-
Medical journals
- Career
Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
Authors: Z. Straňák 1,2; T. Brožová 1; J. Širc 1,2; P. Korček 1,2
Authors‘ workplace: Ústav pro péči o matku a dítě, Praha 1; 3. lékařská fakulta Univerzity Karlovy, Praha 2
Published in: Čes-slov Neonat 2022; 28 (1): 12-17.
Category: Reviews
Overview
Perzistující plicní hypertenze u novorozenců (PPHN) je charakterizována přetrvávajícím zvýšením plicní vaskulární rezistence a snížením průtoku krve plícemi, které vedou k těžké hypoxii a závažným komplikacím (neurologické postižení, syndrom multiorgánové dysfunkce, úmrtí). Funkční echokardiografie zpřesnila diagnostiku PPHN, umožnila monitorování stavu oběhu a odpověď na terapii. Cílem souborného referátu je prezentovat teoretický základ PPHN (základní principy regulace plicní vaskulární rezistence), klinické projevy, aktuální možnosti diagnostiky (zvláště echokardiografické parametry) a léčby (včetně nových vazoaktivních substancí).
Klíčová slova:
diagnostika – oxid dusnatý – perzistující plicní hypertenze u novorozenců – plicní vazodilatace – plicní perfuze
ÚVOD
Perzistující plicní hypertenze u novorozenců (persistent pulmonary hypertension of the newborn, PPHN) je charakterizována zvýšenou plicní vaskulární rezistencí (pulmonary vascular resistance, PVR), sníženým průtokem krve plicním řečištěm a pravo-levými zkraty přes foramen ovale (FO) a duktus arteriosus (DA). PPHN se nejčastěji manifestuje krátce po porodu hypoxemií a respirační insuficiencí [13, 16].
Incidence PPHN se udává 2/1000 s vyšší frekvencí u donošených a mírně nedonošených novorozenců. I přes pokroky v diagnostice a léčbě zůstává mortalita relativně vysoká (4–33 %). Rizikovými faktory vzniku PPHN jsou: intrauterinní expozice inhibitorům zpětného vychytávání serotoninu (SSRI antidepresiva) a nesteroidním antiflogistikům, porod per sectionem caesaream, diabetes a nadváha u matky, gestační stáří (nejvyšší incidence u donošených nebo mírně nedonošených novorozenců) [8, 16, 17].
DIAGNOSTIKA PPHN
Diagnostická kritéria jsou klinická, laboratorní a echokardiografická. Rentgenologické vyšetření může potvrdit plicní patologii asociovanou s PPHN (tab. 1). Kritéria PPHN a diagnostické metody jsou uvedeny v tabulce 2.
Table 1. Etiologie perzistující plicní hypertenze u novorozenců (PPHN) 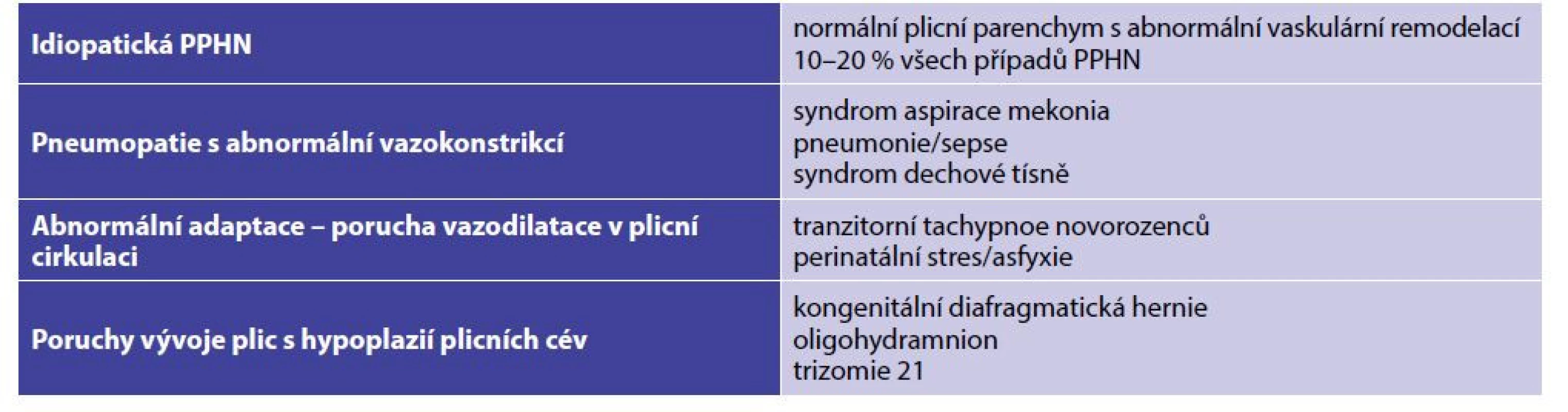
Table 2. Možnosti diagnostiky PPHN [6, 15, 16] ![Možnosti diagnostiky PPHN [6, 15, 16]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f16847ca3cc5de22e0bafcce7b424523.jpg)
ARDS – acute respiratory distress syndrome/akutní syndrom respirační tísně, CDH – congenital diaphragmatic syndrome/kongenitální diafragmatická hernie, DA – ductus arteriosus/Botallova dučej, FO – foramen ovale, MAS – meconium aspiration syndrome/syndrom aspirace mekonia, TTN – transient tachypnoea of newborn/tranzitorní tachypnoe novorozence Novorozenci s PPHN vykazují v prvních hodinách života cyanózu bez přítomnosti strukturální srdeční vady. Hypoxemie má těžký charakter a často velmi rychle progreduje.
Funkce pravé komory (right ventricle, RV) je velmi citlivá na odpor způsobený zvýšením PVR a zvýšení afterloadu je doprovázeno snížením ejekční frakce. Schopnost RV odpovědět na zvýšený afterload zvýšením její kontraktility k udržení ejekční frakce je limitována tenkostí volné stěny RV. K zajištění toku z RV musí být zvýšen preload, ale objemové přetížení pravé komory může mít negativní konsekvence – zvýšení stresu stěny komory a myokardiální konzumpce kyslíku. V okamžiku, kdy spotřeba kyslíku RV překročí množství kyslíku dodávaného koronárním řečištěm, kontraktilita myokardu se sníží. Neadekvátní koronární perfuze může také způsobit ischemické poškození trikuspidální chlopně a trikuspidální insuficienci.
Snížený výdej pravé komory se sníženým průtokem krve plícemi vede ke snížení preloadu levé komory (left ventricle, LV). Hypoxické změny a snížený preload LV potencují vznik dysfunkce LV, snížení srdečního výdeje a tkáňovou hypoperfuzi (schéma 1) [1, 6, 7, 16].
Schéma 1. Hemodynamické změny u PPHN [15] ![Schéma 1. Hemodynamické změny u PPHN [15]](https://pl-master.mdcdn.cz/media/image_pdf/54e4833b1f8b4ecfd3b0ac0e166dd8a6.jpg?version=1655305852)
LV – levá komora, RV – pravá komora, RVO – výdej pravé komory PATOFYZIOLOGIE PPHN
Plicní arterioly u novorozence mají unikátní schopnost rychlé a přehnané vazokonstrikce (i při minimálním patologickém podnětu!). Vazokonstrikce malých plicních arterií se objeví rychle po nástupu alveolární hypoxie. Snížení arteriálního PaO2 je signifikantně méně účinné. Acidóza a hyperkapnie hypoxickou plicní vazokonstrikci zesilují, zatímco hypokapnie a alkalóza tuto vazokonstrikci oslabují. Rozhodující patofyziologickou úlohu v udržování cévního napětí mají biochemické mediátory.
Existuje řada velmi potentních vazoaktivních látek, které jsou schopny regulovat a modulovat klidovou rezistenci v plicních cévách. Výsledná PVR je de facto rovnováhou mezi vazokonstrikčními a vazodilatačními podněty různorodých vazoaktivních látek.
Zásadní význam v regulaci PVR zprostředkovává endotel. Experimentální i klinické studie prokázaly, že cévní endotel není pouze anatomická bariéra, ale komplexní orgán, který odpovídá na fyzikální a chemické podněty produkcí různých faktorů, které zásadně ovlivňují a regulují cévní tonus (schéma 2) [11, 14].
Schéma 2. Fyziologie, patofyziologie PVR a terapeutické modality (čísla v kruhu) 
AA – kyselina arachidonová, AC – adenylátcykláza, AMP – adenosinmonofosfát, cAMP – cyklický adenosinmonofosfát, cGMP – cyklický guanosinmonofosfát, COX – cyklooxygenáza, eNOS – endoteliální syntáza oxidu dusnatého, EP – receptor PGE1, ET-1 – endotelin 1, GMP – guanosinmonofosfát, IL-1β, IL-6, IL-8 – interleukiny, 1β, 6 a 8, IP – receptor PGI2, mETA, mETB – endotelinové receptory A a B hladké svaloviny, NO – oxid dusnatý, PDE3 – fosfodiesteráza 3, PDE5 – fosfodiesteráza 5, PGE1 – prostaglandin E1, PGI2 – prostacyklin, PGSs – prostaglandin syntázy, ROS – reaktivní formy kyslíku, sGC – solubilní guanylát cykláza, TNF-α – tumor necrosis factor α, TP – receptor TXA2, TXA2 – tromboxan A2, VEGF – vaskulární endotelový růstový faktor, VEGFR – receptor VEGF
Terapeutické modality: ① iNO; ② sildenafil; ③ epoprostenol; ④ alprostadil; ⑤ milrinon; ⑥ bosentan; ⑦ hydrokortison.Oxid dusnatý
Endoteliální buňky produkují oxid dusnatý (nitric oxide, NO), který má zásadní roli ve zprostředkování vazodilatace. Uvolnění endogenního NO cestou přeměny L-argininu na L-citrulin, která je katalyzována enzymem NO-syntázou, bylo prokázáno při odpovědi na různé podněty. Oxid dusnatý je následně uvolněn z endoteliálních buněk, difunduje rychle do buněk hladkého svalu plicních cév a aktivuje rozpustnou guanylátcyklázu – enzym, který katalyzuje produkci cyklického guanosin - -monofosfátu (cGMP). cGMP následně zahájí kaskádu dějů, které vedou k relaxaci hladkého svalu. Cyklický GMP je inhibován a redukován fosfodiesterázou 5 (PDE5). Produkce endogenního NO přispívá k fyziologickému snížení postnatální PVR a má podíl na udržování normálního postnatálního nízkého vaskulárního tonu (viz schéma 2). Těžká hypoxemie může přímo bránit uvolňování oxidu dusnatého a potencovat zvýšení PVR při PPHN. Skutečnost, že produkce endogenního NO může být během postnatální adaptace alterována, poskytuje teoretický základ pro využití inhalace NO při léčbě PPHN (tab. 3) [1, 6, 15].
Table 3. Doporučené postupy při inhalaci oxidu dusnatého (INO) [1, 6] ![Doporučené postupy při inhalaci oxidu dusnatého (INO) [1, 6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/23f3f1c2c32e39a3ed301037c913b1eb.jpg)
Prostaglandiny
Prostaglandiny vznikají z kyseliny arachidonové (AA) působením enzymů cyklooxygenáza + prostaglandin syntáza a jsou důležitými mediátory v regulaci PVR. Prostaglandiny aktivují adenylcyklázu a zvyšují intracelulární koncentraci cAMP v buňkách hladké svaloviny. Výsledným efektem zvýšené koncentrace cAMP je vazodilatace (viz schéma 2). Cyklický AMP je inhibován a redukován fosfodiesterázou 3 (PDE3). Inhibitory fosfodiesterázy 3 (milrinone) logicky brání odbourávání cAMP a zvyšují vazodilatační efekt prostaglandinů. Prostacyklin (PGI2) je nejpotentnějším vazodilatačním prostaglandinem, který se uplatňuje po narození a působí komplementárně k působení NO (NO-cGMP systém) [9, 10].
Endotelin a endotelinové receptory
Endotelin 1 (ET-1) je mediátorem vazokontrikce a/ nebo vazodilatace, který produkují endotelové buňky. ET-1 se váže na endotelinové receptory (mETA a mETB) buněk hladké svaloviny. Duální role ET-1 je důležitá pro udržování adekvátní PVR in utero. Blokáda mETA-receptoru (bosentan) vede k vazodilataci. Působení ET-1 přes mETB-receptor je ve vzájemné interakci s NO-cGMP s výsledným vazodilatačním efektem (viz schéma 2). ET-1 je také důležitým mediátorem remodelace cévní stěny (problematika remodelace cévní stěny není předmětem sdělení). Inhibice endotelinových receptorů je jednou ze zásadních terapeutických modalit (tab. 4) [12].
Table 4. Současné možnosti léčby PPHN (farmakoterapie dostupná v ČR) [1, 15] ![Současné možnosti léčby PPHN (farmakoterapie dostupná v ČR) [1, 15]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/473a783d779b40141e9f434f762f0705.jpg)
ECMO – extracorporeal membrane oxygenetion/mimotělní membránová oxygenace, ET – endothelin/endotelin, INO – inhaled nitric oxide/inhalace oxidu dusnatého, PDE – fosfodiesteráza, OI – oxygenační index, RCT – randomized controlled trial/randomizovaná kontrolovaná studie Reaktivní formy kyslíku
Reaktivní formy kyslíku (ROS) mají signifikantní roli v patofyziologii PVR. ROS mají vazokonstrikční efekt a jsou uvolňovány z endotelových buněk při zánětu a/nebo vznikají přímo v buňkách hladké svaloviny při hyperoxii (viz schéma 2). Inhibice zánětové odpovědi (steroidy) je další terapeutickou možností (tab. 4) [13, 15].
SOUČASNÉ MOŽNOSTI TERAPIE PPHN
Inhalace oxidu dusnatého (INO)
Metaanalýza randomizovaných a kontrolovaných studií prokázala příznivý efekt INO na snížení počtu pacientů indikovaných k mimotělní membránové oxygenaci (extracorporeal membrane oxygenation, ECMO). INO zlepšuje oxygenaci a snižuje oxygenační index u 50–60 % dětí s PPHN. Nejhorší výsledky jsou dosahovány u pacientů s kongenitální diafragmatickou hernií. Účinnost INO je závislá na parenchymovém plicním poškození, typu PPHN a způsobu umělé plicní ventilace [1, 3]. Problematika INO je prezentována v tabulce 3.
Klinické faktory potencionálně ovlivňující odpověď na INO:
• alveolokapilární dysplazie
• myokardiální dysfunkce (sepse, asfyxie)
• remodelace cévní stěny (hypoplazie plic)
• vzácné srdeční a cévní vady
• areaktivita plicního řečiště
• paradoxní reakce u ložiskových pneumopatií
• terapeutický protokol
• způsob aplikace NO
Toxicita oxidu dusnatého
Oxid dusnatý má řadu velmi různorodých biologických aktivit, které mají protektivní charakter, ale v některých případech mohou působit kontraproduktivně. NO reaguje rychle s Fe(II) v hemoglobinu za vzniku methemoglobinu, který obsahuje Fe(III). Methemoglobin není schopen lehce uvolnit O2 a způsobuje posun disociační křivky kyslíku doleva s následným snížením účinné kapacity krve pro přenos O2, která vede ke zhoršení hypoxie. Methemoglobinreduktáza, která je normálně přítomná v krvi, přeměňuje methemoglobin zpět na hemoglobin. Závažná methemoglobinemie se vyskytuje pouze v případě, kdy podíl tvorby methemoglobinu je vyšší než jeho odbourávání. V současné době je doporučováno udržovat hladinu methemoglobinu pod 2 % [2, 6].
V případě, kdy se NO slučuje se superoxidovými radikály, vzniká peroxynitrit. Peroxynitrit (OONO-) může poškozovat surfaktantové proteiny, způsobit dysfunkci surfaktantu a poškození buněk. Reakce mezi NO a O2, při které vzniká NO2, je rychlá při vysokých koncentracích NO, ale pomalá při běžně doporučovaných dávkách inhalovaného NO. NO2 je toxin prostředí, který může způsobit plicní edém, krvácení a obliterující bronchiolitidu. V klinickém použití NO se neobjevují významné hladiny NO2. Vyšším koncentracím NO2 bylo do značné míry zabráněno použitím systémů, které minimalizují vystavení NO kyslíku předtím, než je aplikován k pacientovi. Kontrola koncentrace NO a NO2 ve vdechované směsi plynu v inspirační části ventilačního okruhu by měla být prováděna rutinně, zvláště když jsou vyměňovány prázdné rezervoáry. Hladiny NO v prostředí by měly být udržovány pod 25 ppm a hladiny NO2 pod 5 ppm [2].
V experimentu na zvířatech i na dospělých dobrovolnících vystavených NO v dávkách 30–300 ppm bylo pozorováno prodloužení času krvácení a je známo, že endogenní NO inhibuje adhezi destiček k cévnímu endotelu. Prodloužení času krvácení nebylo pozorováno u donošených dětí léčených inhalací NO. Tento účinek může být závažný u nedonošeného dítěte s rizikem vzniku intraventrikulárního krvácení [6].
Současné požadavky na systémy pro aplikaci INO:
• deklarovaná čistota podávaného plynu
• zajištění přepravy, bezpečného skladování (větraná místnost, pokojová teplota) a transportu prázdných láhví dodavateli
• přístroj pro aplikaci NO dodává do dýchacího okruhu trvale konstantní množství kysličníku dusnatého
• kontinuální monitorování hodnoty NO a NO2 v dýchacím okruhu a v okolním prostředí
• při překročení dovolených hodnot automatické přerušení podávání NO a hlášení alarmu
• možnost archivace a/nebo kontroly naměřených hodnot
• limit pro expozici prostředí (25 ppm pro NO a 5 ppm pro NO2) [2]
Inhalace NO je terapií volby u donošených a mírně nedonošených novorozenců s PPHN. Dávka 20 ppm je bezpečná a účinná u 50–60 % novorozenců. U nerespondentních pacientů je nutné hledat příčinu neadekvátní odpovědi na INO a další terapeutické postupy [3, 4].
Terapeutický postup u novorozenců nerespondentních na INO (zdroj: ÚPMD Podolí):
• optimalizace ventilační podpory (konvenční, nekonvenční umělá plicní ventilace – HFOV)
• oběhová podpora při dysfunkci pravé komory, nízkém srdečním výdeji a hypotenzi (iniciálně kombinace noradrenalin/ dobutamin)
• inhibitory fosfodiesterázy (milrinon, sildenafil) • inhibitory proinflamatorních mediátorů (hydrokortizon)
• preduktální SpO2 95–98%, normokapnie • analgosedace, v indikovaných případech myorelaxace
• v případě refrakterní hypoxie je indikováno ECMO
Aktuální a dostupné terapeutické modality jsou uvedeny v tabulce 4.
ZÁVĚR
Perzistující plicní hypertenze zůstává nadále jednou z nejzávažnějších komplikací u donošených a mírně nedonošených novorozenců. Inhalace oxidu dusnatého a mimotělní membránová oxygenace jsou zlatým standardem léčby. V současné době dochází k rozšíření terapeutických možností u novorozenců nerespondentních na INO. Účinnost nových terapeutických postupů však musí být potvrzena validními klinickými studiemi.
Konflikt zájmu: žádný.
Došlo do redakce: 6. 3. 2022
Adresa pro korespondenci:
prof. MUDr. Zbyněk Straňák, CSc., MBA
Novorozenecké oddělení
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4
e-mail: zbynek.stranak@upmd.eu
Sources
1. Bendapudi P, Rao GG, Greenough A. Diagnosis and management of persistent pulmonary hypertension of the newborn. Paediatr Respir Rev 2015; 16 : 157–161. doi: 10.1016/j.prrv.2015.02.001.
2. Cosa N, Costa E Jr. Inhaled pulmonary vasodilators for persistent pulmonary hypertension of the newborn: Safety issues relating to drug administration and delivery devices. Med Devices 2016; 12(9): 45–51. doi: 10.2147/MDER.S99601.
3. Dillard J, Pavlek LR, Korada S, Chen B. Worsened short-term clinical outcomes in a cohort of patients with iNO-unresponsive PPHN: A case for improving iNO responsiveness. J Perinatol 2022; 42(1): 37–44. doi: 10.1038/s41372-021-01228-x.
4. Foglia EE, te Pas AB. Effective ventilation: The most critical intervention for successful delivery room resuscitation. Semin Fetal Neonatal Med 2018; 23 : 340–346. doi: 10.1016/j.siny.2018.04.001
5. Fortas F, Di Nardo M, Yousef N, et al. Life-threatening PPHN refractory to nitric oxide: Proposal for a rational therapeutic algorithm. Eur J Pediatr 2021; 180(8): 2379–2387. doi: 10.1007/ s00431-021-04138-4.
6. Gomella TL, et al. Gomella’s Neonatology 8th Edition 2021, Persistent pulmonary hypertension of the newborn.
7. Hooper SB, Te Pas AB, Lang J, van Vonderen JJ, et al. Cardiovascular transition at birth: A physiological sequence. Pediatr Res 2015; 77 : 608–614. doi: 10.1038/pr.2015.21
8. Huybrechts KF, Bateman BT, Palmsten K, et al. Antidepressant use late in pregnancy and risk of persistent pulmonary hypertension of the newborn. JAMA 2015; 313 : 2142–2151. doi: 10.1001/ jama.2015.5605
9. James AT, Bee C, Corcoran JD, McNamara PJ, et al. Treatment of premature infants with pulmonary hypertension and right ventricular dysfunction with milrinone: A case series. J Perinatol 2015; 35 : 268–273. doi: 10.1038/jp.2014.208
10. Lakshminrusimha S, Mathew B, Leach CL. Pharmacologic strategies in neonatal pulmonary hypertension other than nitric oxide. Semin Perinatol 2016; 40 : 160–173. doi: 10.1053/j.semperi. 2015.12.004
11. Lang JAR, Pearson JT, Binder-Heschl C, et al. Increase in pulmonary blood flow at birth: Role of oxygen and lung aeration. J Physiol 2016; 594 : 1389–1398. doi: 10.1113/JP270926
12. Maneenil G, Thatrimontrichai A, Janjindamai W, Dissaneevate S. Effect of bosentan therapy in persistent pulmonary hypertension of the newborn. Pediatr Neonatol 2018; 59 : 58–64. doi: 10.1016/j.pedneo.2017.02.003
13. Nair J, Lakshminrusimha S. Update on PPHN: Mechanisms and treatment. Semin Perinatol 2014; 38(2): 78–91. doi: 10.1053/j. semperi.2013.11.004.
14. Rosenzweig EB, Abman SH, Adatia I, et al. Paediatric pulmonary arterial hypertension: Updates on definition, classification, diagnostics and management. Eur Respir J 2019; 53 : 1801–1916. doi: 10.1183/13993003.01916-2018
15. Sharma M, Callan E, Konduri GG. Pulmonary vasodilator therapy in persistent pulmonary hypertension of the newborn. Clin Perinatol 2022; 49(1): 103–125. doi: 10.1016/j.clp.2021.11.010.
16. Steurer MA, Jelliffe-Pawlowski LL, Baer RJ, et al. Persistent pulmonary hypertension of the newborn in late preterm and term infants in California. Pediatrics 2017; 139: e20161165. doi: 10.1542/peds.2016-1165
17. Van Marter LJ, Hernandez-Diaz S, Werler MM, et al. Nonsteroidal antiinflammatory drugs in latepregnancy and persistentpulmonary hypertension of the newborn. Pediatrics 2013; 131 : 79–87. doi: 10.1542/peds.2012-0496
Labels
Neonatology Neonatal Nurse
Article was published inCzech and Slovak Neonatology

2022 Issue 1-
All articles in this issue
- Editorial
- Současné možnosti měření perfuze u novorozenců
- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Postavení funkční echokardiografie v diagnostice akutní oběhové deteriorace u novorozenců
- Farmakoterapie oběhového selhání novorozenců
- Relativní adrenální insuficience a vazopresor-rezistentní hypotenze u kriticky nemocných novorozenců
- Near-infrared spektroskopie v posuzování hemodynamických změn u novorozenců
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Hypertrofie myokardu u novorozence
- Okluze retinální arterie u extrémně nezralého novorozence s Escherichia coli meningitidou
- Czech and Slovak Neonatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Hypertrofie myokardu u novorozence
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Farmakoterapie oběhového selhání novorozenců
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

