-
Medical journals
- Career
Near-infrared spektroskopie v posuzování hemodynamických změn u novorozenců
Authors: P. Korček 1,2; Z. Straňák 1,2
Authors‘ workplace: Ústav pro péči o matku a dítě, Praha 1; 3. lékařská fakulta Univerzity Karlovy, Praha 2
Published in: Čes-slov Neonat 2022; 28 (1): 42-48.
Category: Reviews
Overview
V současné době je kladen důraz na neinvazivní monitorování orgánových dysfunkcí u kriticky nemocných novorozenců. Bed-side monitoring pomocí spektroskopie (near-infrared spectroscopy, NIRS) nám může poskytnout cenné informace o hemodynamických poruchách, které jsou významně spojeny s neurologickými morbiditami a zvýšenou mortalitou u těchto pacientů. NIRS hodnotí cerebrální perfuzi a oxygenaci a ve spojení s jinými zobrazovacími metodami (funkční echokardiografie), klinickým vyšetřením (srdeční akce, krevní tlak, diuréza, kapilární návrat) a biochemickými parametry (acidobazická rovnováha, hodnota laktátu) může poskytnout celistvější představu o tkáňové perfuzi. Na základě těchto vyšetření můžeme optimalizovat terapii a snížit mortalitu a závažné neurologické morbidity, které zásadním způsobem determinují následný život dítěte.
Klíčová slova:
near-infrared spektroskopie – cerebrální hemodynamika – autoregulace – tkáňová oxygenace – neonatální morbidita a mortalita
ÚVOD
Metoda blízké infračervené spektroskopie (near-infrared spectroscopy, NIRS) pracuje s blízkou infračervenou oblastí z elektromagnetického spektra (750–2500 nm) a její použití v neonatologii se datuje od osmdesátých let 20. století [1]. Pro moderní neonatologii má metoda NIRS řadu výhod – kontinuální měření, je neinvazivní, nebolestivá a portabilní [2]. Z biofyzikálního hlediska penetruje blízké infračervené spektrum většinu biologických tkání. Když předpokládáme neměnnost tkání, jako jsou svaly, kosti a kůže, pak jediným měnícím se parametrem je regionální krevní průtok a oxygenace [3]. V souvislosti s tím je důležité zmínit, že v krvi existují dva významné chromofory, které jsou schopné absorbovat elektromagnetické spektrum – oxygenovaný (oxyHb) a deoxygenovaný (dHb) hemoglobin. Obě molekuly disponují rozdílnou absorpcí blízkého infračerveného spektra v závislosti na použité vlnové délce (obr. 1). Lambertův-Beerův zákon (matematické vyjádření závislosti absorpce elektromagnetického záření na vlastnostech materiálu, skrze který záření prochází) a moderní algoritmy nám umožňují kalkulaci oxyHb a dHb ve zkoumané oblasti s následnou možností procentuálně vyjádřit tkáňovou oxygenaci (tissue/regional oxygenation, rSO2).
(oxyHb / [oxyHb + dHb]; rozmezí 0–100 %)
Image 1. Absorpční spektrum hemoglobinu v závislosti na vlnové délce elektromagnetického záření OxyHb – oxygenovaný hemoglobin, dHb – deoxygenovaný hemoglobin 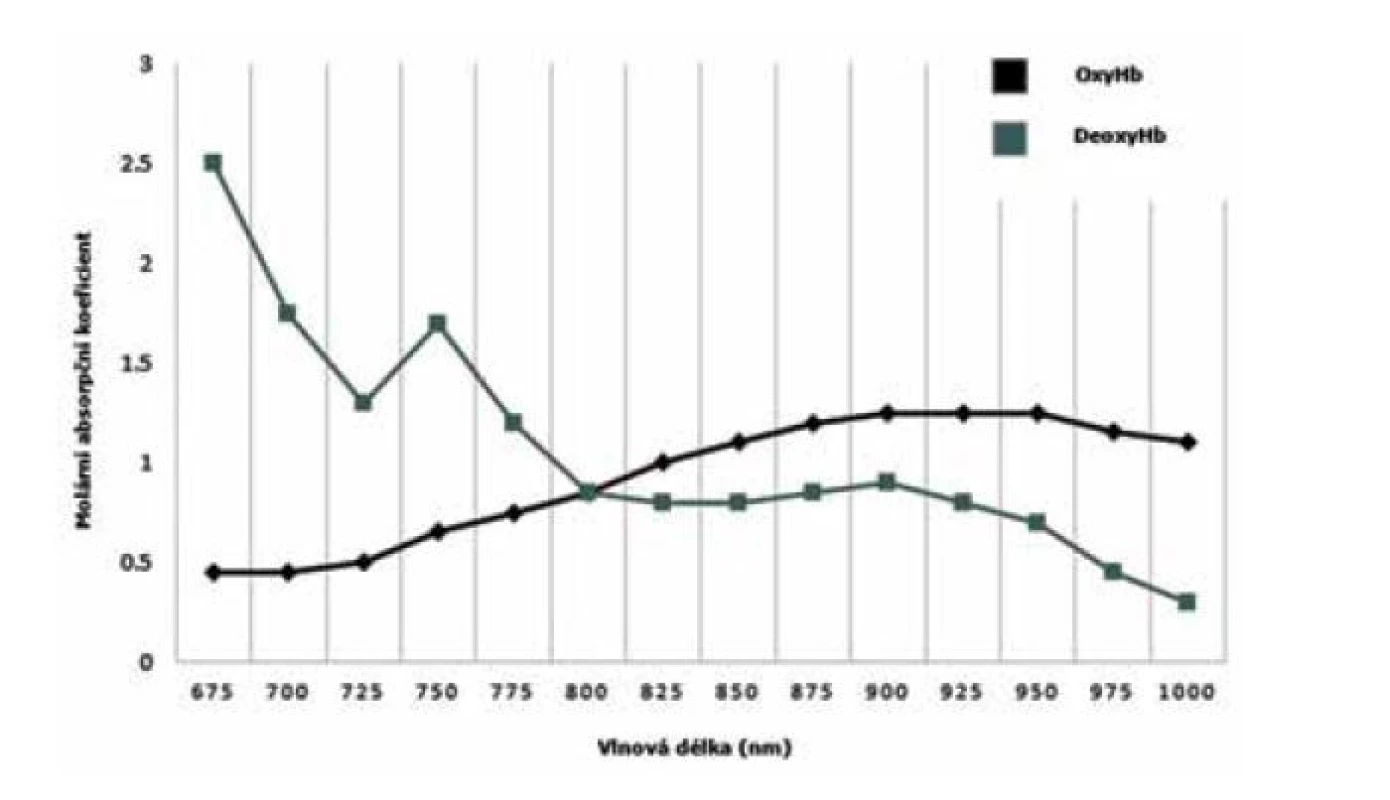
Jelikož NIRS měří veškerou krev ve zkoumané oblasti a 70–80 % krve je venózní, spektroskopie vyjadřuje především venózní oxygenaci [4]. NIRS lze použít v různých oblastech (renální, splanchnická, končetiny), nicméně dominantním klinickým použitím v neonatologii je evaluace cerebrální tkáňové oxygenace a zhodnocení regionální rovnováhy mezi dodávkou a spotřebou kyslíku [2].
CEREBRÁLNÍ PERFUZE A OXYGENACE
Dodávka kyslíku do mozkové tkáně závisí na cerebrální perfuzi (cerebral blood flow, CBF), saturaci krve kyslíkem (SpO2) a koncentraci hemoglobinu (Hb) [5]. CBF je determinovaná srdečním výdejem (cardiac output = heart rate x stroke volume) a cerebrální vaskulární rezistencí. Vzhledem k důležitosti a dynamičnosti centrálního nervového systému (CNS) je cerebrální vazoregulace řízená systémovými a lokálními faktory, které zajišťují adekvátní průtok krve [6]. Primární regulace CBF je lokální (autoregulace) a zahrnuje metabolické, humorální a myogenní faktory (obr. 2).
Image 2. Regulační mechanismy průtoku krve mozkem 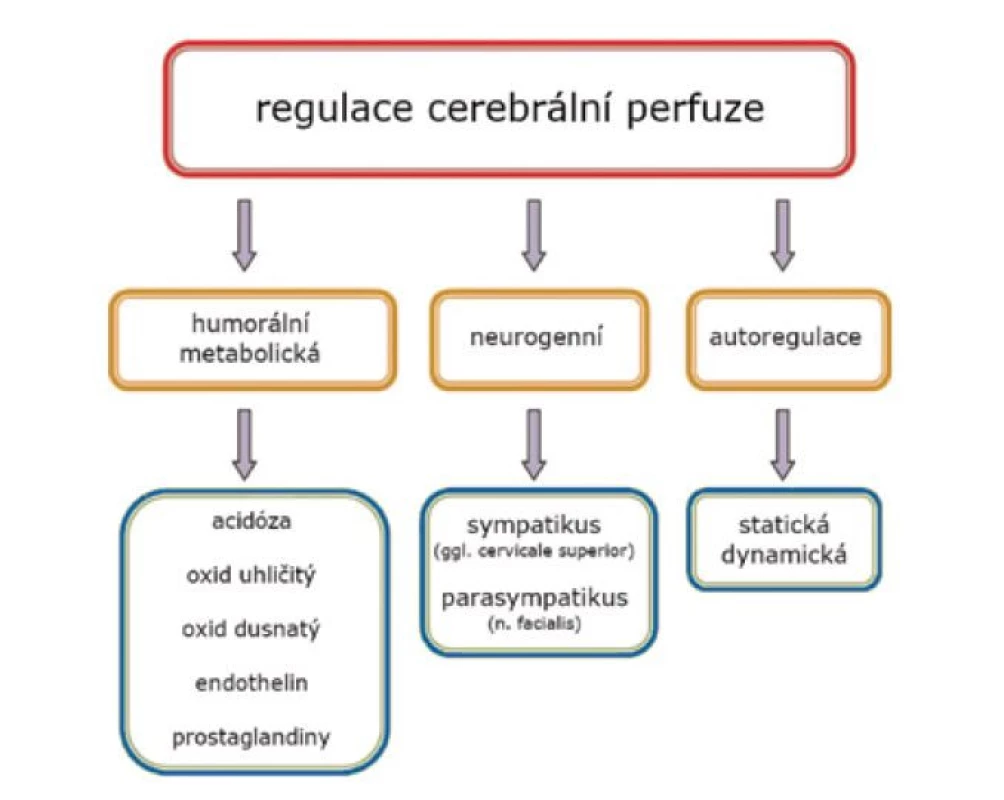
Zásadní roli má metabolická kontrola perfuze – hyperkapnie, acidóza a hypoxie indukuje cerebrální vazodilataci, naopak hyperoxie a hypokapnie způsobí cerebrální vazokonstrikci (některé studie dokumentují vliv signifikantní a protrahované hypokapnie na rozvoj periventrikulární leukomalácie z důvodu hypoperfuze) [7].
Humorální faktory zahrnují vazoaktivní látky produkované endotelem, například prostaglandiny a oxid dusnatý (vazodilatace) nebo endotelin (vazokonstrikce) [8]. Za předpokladu, že neexistují signifikantní rozdíly mezi metabolickým obratem (spotřeba kyslíku), SpO2 a koncentrací hemoglobinu, rSO2 reflektuje deviaci v průtoku krve mozkem [9].
Pro udržení stabilní rovnováhy mezi dodávkou a spotřebou kyslíku (metabolic rate of oxygen) je častější reakcí zvýšení CBF než zvýšená extrakce kyslíku mozkovou tkání. Přesto je důležité zmínit možnost výpočtu frakční tkáňové extrakce kyslíku mozkem (fractional cerebral tissue oxygen extraction, FcTOE) při znalosti SpO2:
FcTOE = ([SpO2 – rSO2] / SpO2 ; rozmezí 0–1).
FcTOE (relativní množství kyslíku spotřebovávaného mozkovou tkání) je inverzní k CBF (pokles cerebrální perfuze způsobí zvýšenou extrakci kyslíku mozkovou tkání) a poukazuje na rovnováhu mezi dodávkou a spotřebou kyslíku [10]. V prvních dnech života je vysoká hodnota FcTOE významně asociovaná se závažným neurologickým postižením u nezralých novorozenců [11]. FcTOE nám může pomoci rozlišit hypoxii hypoxickou (nedostatek kyslíku při normální perfuzi) a ischemickou (nedostatek kyslíku způsobený hypoperfuzí) [12].
TYPY CEREBRÁLNÍ HYPOXIE
Hypoxická hypoxie je způsobená snížením pO2 (parciální tlak kyslíku) a je to nejčastější typ cerebrální hypoxie. CNS reaguje na snížený obsah kyslíku v krvi navýšením CBF a FcTOE k udržení optimální cerebrální oxygenace. U nezralých novorozenců jsou tyto mechanismy nedostatečné a přispívají k vyšší incidenci neurologického postižení v této populaci [13].
Anemická hypoxie je způsobená sníženou koncentrací hemoglobinu nebo omezenou schopností hemoglobinu vázat O2. Mechanismus adaptace na zhoršené podmínky je podobný jako u hypoxické hypoxie, CNS reaguje navýšením CBF a FcTOE, nicméně tento typ hypoxie je relativně vzácný [14].
Ischemická hypoxie představuje signifikantní pokles CBF, který nedokáže udržet adekvátní mozkovou perfuzi a oxygenaci. U novorozenců na jednotce intenzivní péče se všechny 3 typy hypoxického inzultu mohou kombinovat a dramaticky navýšit riziko poškození CNS s odpovídajícím nepříznivým dlouhodobým vývojem [15].
CEREBRÁLNÍ AUTOREGULACE
Autoregulace mozkové perfuze je schopnost udržet konstantní a adekvátní průtok krve mozkem při změnách systémového krevního tlaku (obr. 3). Autoregulace je funkcí CBF (regulace viz výše) a mozkového perfuzního tlaku (cerebral perfusion pressure, CPP), který je výsledkem rozdílu středního arteriálního (mean arterial blood pressure, MABP) a intrakraniálního tlaku (intracranial pressure, ICP) [16, 17].
AUTOREGULACE = CBF ↔ CPP (MABP – ICP)
Image 3. Autoregulace cerebrální perfuze 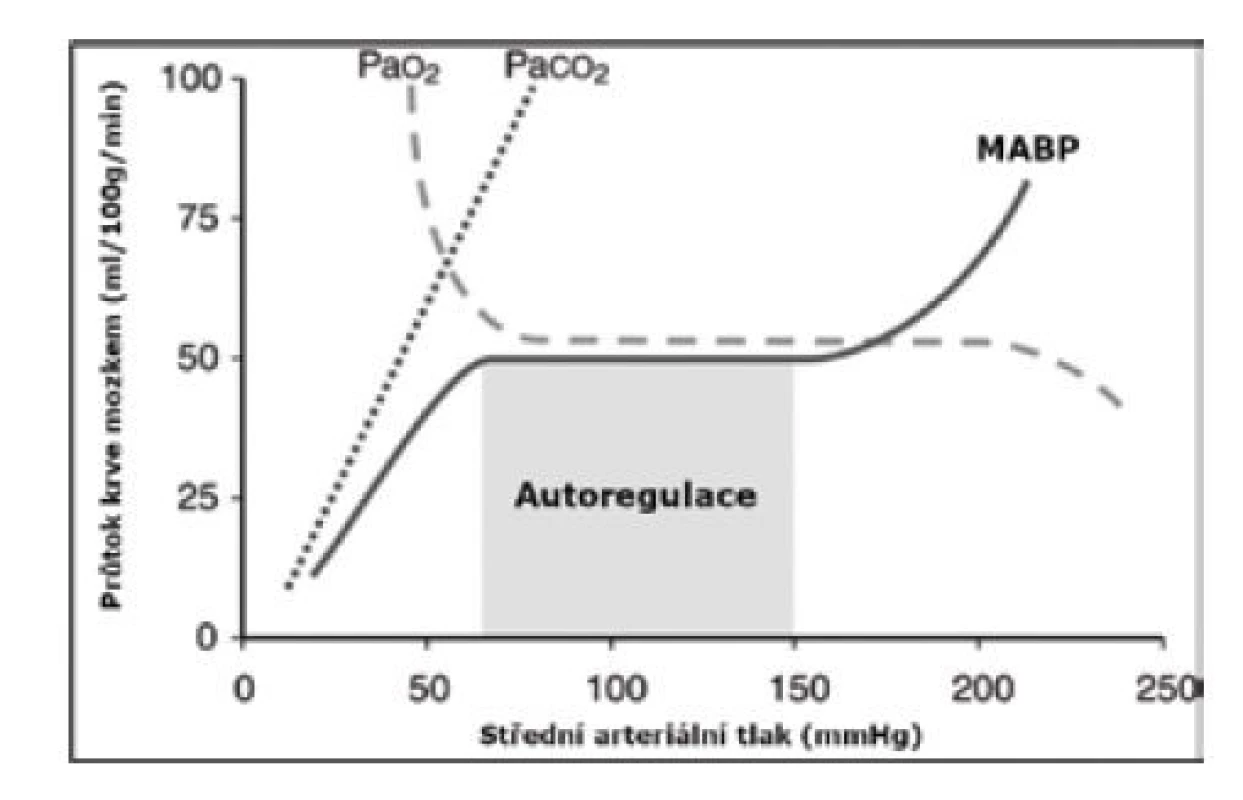
MABP – mean arterial blood pressure (střední arteriální tlak krve) Extrémně nezralí novorozenci jsou schopni i při kolísavém nebo hraničním MABP udržet stabilní vnitřní prostředí (normální hodnota laktátu) a mít uspokojivý klinický nález (prokrvení, diuréza, srdeční akce, kapilární návrat < 3 sekundy) [18]. Tato „permisivní hypotenze“ (MABP < gestační týden novorozence a nevyžadující terapii) navíc nemá negativní vliv na cerebrální perfuzi a nebyl prokázán negativní dopad na dlouhodobý psychomotorický vývoj [19].
Z výše uvedeného vyplývá, že běžně měřené hodnoty, jako je krevní tlak, srdeční akce a/nebo SpO2, nám neposkytují úplnou představu o tkáňové hemodynamice [20]. NIRS může poskytnout cenné údaje o skutečné mozkové tkáňové perfuzi, zvláště v kombinaci s pulzní oxymetrií (výpočet FcTOE) a jinými bed-side zobrazovacími metodami, jako je například funkční echokardiografie (měření srdečního výdeje, kontraktility myokardu, průtoku v horní duté žíle) [21].
NORMATIVNÍ HODNOTY
V prvních 72 hodinách života se hodnota rSO2 pohybuje většinou v rozmezí 55–85 %, a to i u novorozenců pod 32. gestační týden [22]. Z observačních studií dále vyplývá, že hodnota rO2 po porodu graduálně narůstá a dosahuje vrcholové hodnoty kolem 36. hodiny života, po které následuje fáze „plateau“ se stabilními hodnotami rSO2 [22]. Podobné hodnoty vývoje cerebrální oxygenace v prvních 72 hodinách dokládá studie zaměřená na monochoriální a bichoriální dvojčata (obr. 4) [23].
Image 4. Postnatální vývoj cerebrální oxygenace u dětí s/bez fetální patologie 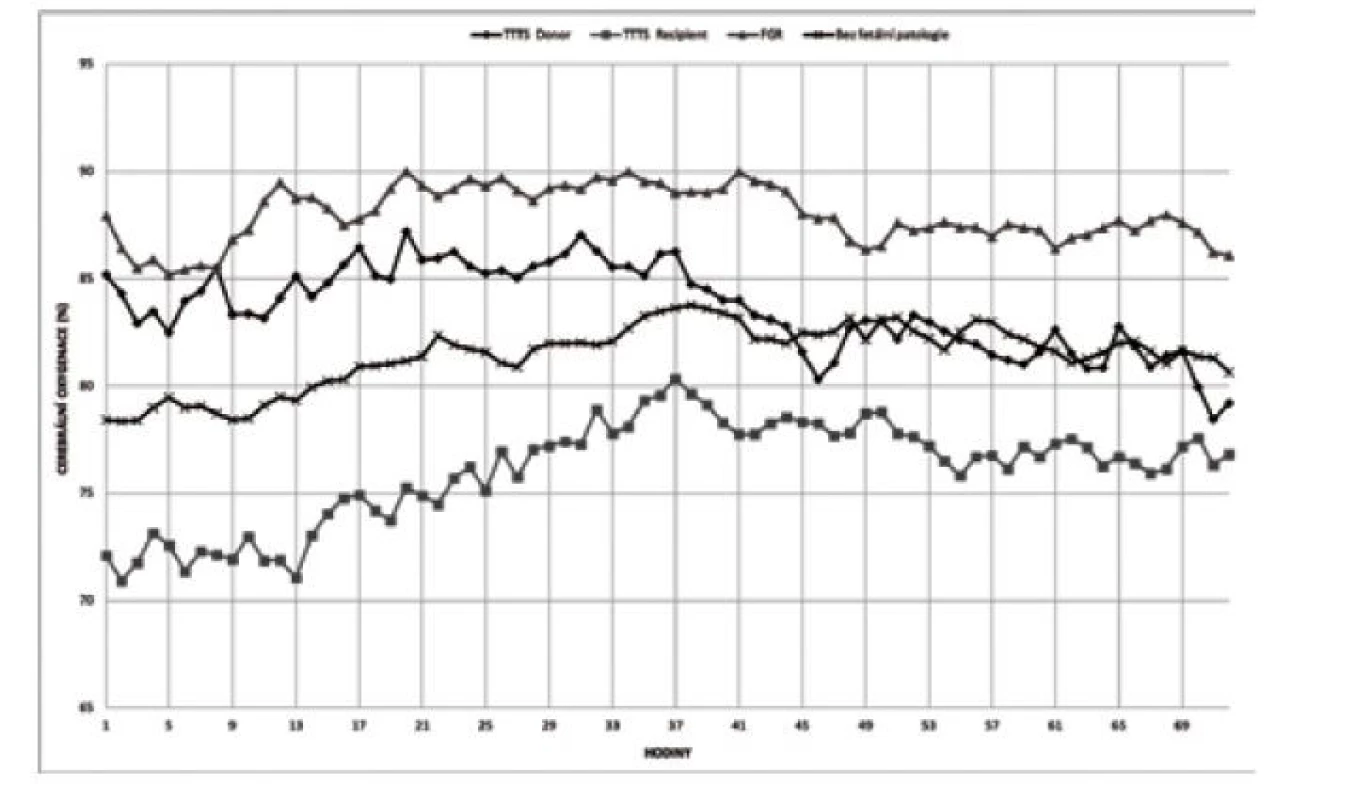
TTTS – twin to twin transfuzní syndrom (feto-fetální syndrom), FGR – fetal growth restriction (fetální růstová restrikce) Z animálních studií na selatech vyplývá, že hodnota rSO2 55 % ještě nemusí vést k disrupci metabolismu a zvýšené produkci laktátu. Nicméně již několik desítek minut pod touto kritickou hranicí může způsobit subcelulární poškození a apoptózu neuronů [24]. Podobné výsledky v tomto ohledu přinesla metaanalýza vývoje rSO2 v prvních 15 minutách po porodu u zralých a nezralých novorozenců, kde u dětí se sníženou iniciální cerebrální oxygenací (kritická hodnota rSO2 kolem 55 %) bylo v pozdějším období diagnostikováno peri-/ intraventrikulární krvácení (PIVH) (obr. 5) [2]. Vzhledem k uvedeným faktům proto není překvapující, že právě tato hodnota (rSO2 55 %) byla stanovena v rámci studie SafeBoosC-III (viz níže) jako směrodatná pro eventuální intervence.
Image 5. Vývoj cerebrální oxygenace v prvních 15 minutách života u dětí s/bez peri-/ intraventrikulárního krvácení 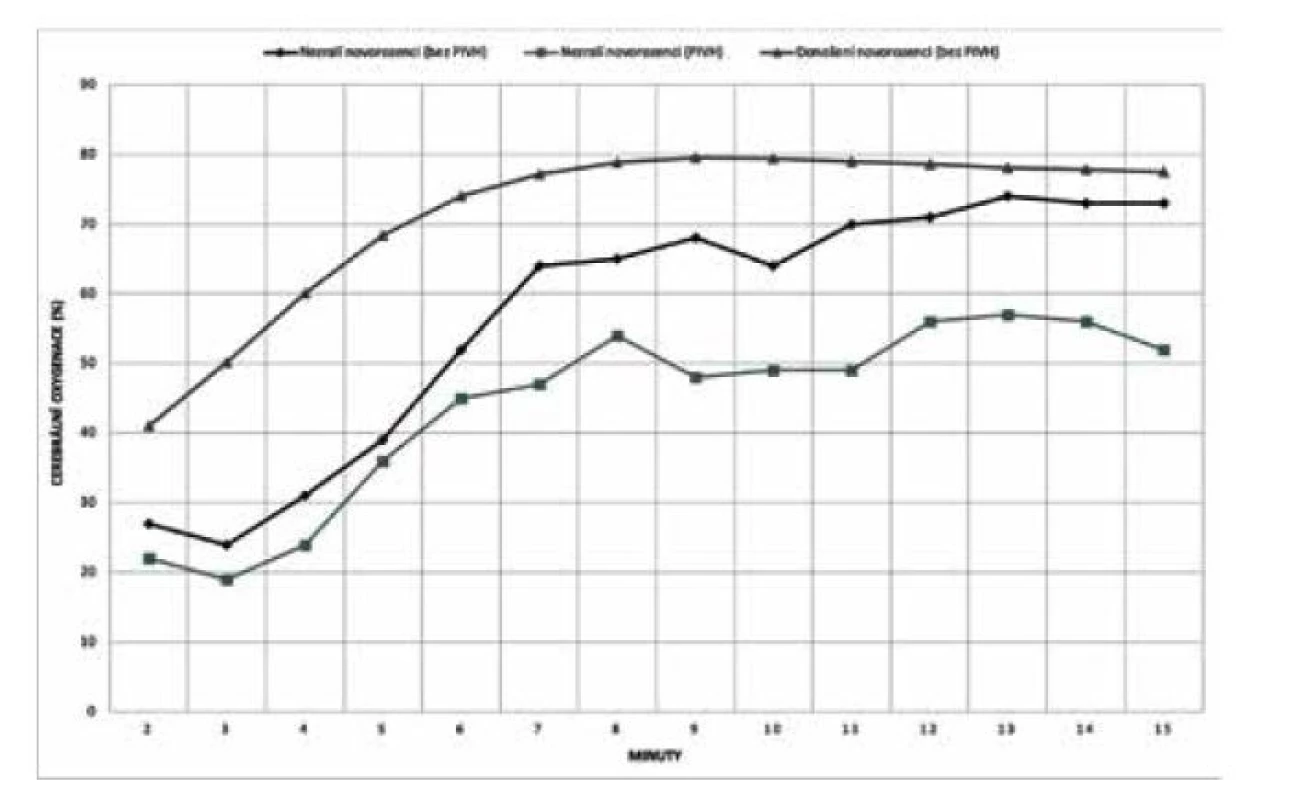
PIVH – peri-/intraventricular hemorrhage VLIV CEREBRÁLNÍ MALPERFUZE NA VZNIK LÉZÍ CNS
Centrální nervový systém u novorozenců (zvláště nezralých) vykazuje zvýšenou vulnerabilitu k perinatálnímu hypoxicko-ischemickému poškození, a to z několika důvodů – nezralá vaskulatura v germinální matrix a periventrikulární bílé hmotě, relativně nízký bazální CBF (20 ml/100 g/min) a zvýšená FcTOE [25]. U nezralých novorozenců musíme navíc kalkulovat s ventilační a kardiovaskulární nestabilitou (myokardiální a autonomní dysfunkce, hypotenze vyžadující volumoterapie nebo inotropní podporu, syndrom dechové tísně, relativní adrenální insuficience), které mají negativní dopad na udržení cerebrální autoregulace [16]. Výsledkem je inverzní vztah mezi incidencí PIVH a periventrikulární leukomalácie (PVL) a gestačním týdnem novorozence [26].
Dysfunkční autoregulace u kriticky nemocných novorozenců je asociována se zvýšenou mortalitou a rizikem neurologického poškození vlivem různých patofyziologických mechanismů – hypoperfuze, hypoxicko - ischemický inzult, hyperperfuze (edém mozku, hyperoxie, peroxidace) a reperfuzní poškození [17, 27]. Především oxidační stres (volné kyslíkové radikály, suboptimální antioxidační mechanismy u nezralých novorozenců) významně poškozuje nezralou, periventrikulární bílou hmotu [28]. Hyperoxie pozastaví maturaci preoligodendrocytů a způsobí poruchu myelinizace axonů s redukcí neuronální konektivity a objemu mozkové tkáně (white matter injury, WMI) [29].
Reperfuzní poškození je pravděpodobně nejčastějším mechanismem vzniku neurologického postižení [26]. Novorozenci, u kterých se později vyvine PIVH/ PVL, mají iniciálně nižší srdeční výdej a průtok krve mozkem – při postupné kardiovaskulární normalizaci může nastat relativní cerebrální hyperperfuze s oxidačním stresem [26]. Uvedená patofyziologie zřejmě vysvětluje negativní vliv intervencí (volumoterapie, inotropní/ ventilační podpora) na incidenci těchto závažných neurologických morbidit [19].
NIRS A CIRKULACE
Cerebrální oxygenace poměrně dobře koreluje s průtokem v horní duté žíle (superior vena cava, SVC) a levostranným srdečním výdejem (left ventricular output, LVO) u nezralých novorozenců v prvních dnech života [28]. SVC průtok < 40 ml/kg/min a rSO2 ≤ 40 % jsou nezávislé rizikové faktory pro zvýšenou mortalitu u novorozenců < 30. gestačním týdnem [11].
Role hemodynamicky významné perzistující Botallovy dučeje (persistent/patent ductus arteriosus, PDA) na rSO2 je kontroverzní. Některé studie prokázaly inverzní vztah mezi průměrem PDA nebo koncentrací markeru myokardiální dysfunkce NT-proBNP (N-terminal-pro brain natriuretic peptide) na cerebrální oxygenaci (čím větší průměr duktu nebo vyšší koncentrace NT-proBNP, tím nižší rSO2) [30]. Naopak jiné studie tuto korelaci nepotvrdily [31].
Patofyziologický mechanismus vlivu cirkulační nestability na cerebrální oxygenaci přinesla observační studie u nezralých monochoriálních a bichoriálních dvojčat [23], zejména porovnání výsledků měření rSO2 u donora a recipienta v případě rozvoje feto-fetální transfuze komplikující monochoriální dvojčetnou graviditu. U recipientů (hypervolemický plod/novorozenec) byla pozorována signifikantně nižší rSO2, pravděpodobně na podkladě hypertrofie myokardu a snížené myokardiální compliance s výslednou obstrukcí výtokových traktů (viz obr. 4) [32]. Přispívajícími negativními faktory mohou být cerebrální vazokonstrikce (endothelin ETA-receptory) a polycytemie (hyperviskozita) [33].
U donorů (hypovolemický plod/novorozenec) je rSO2 významně vyšší, a to na podkladě absolutní hypovolemie, která způsobí renální hypoperfuzi a aktivaci osy renin-angiotenzin-aldosteron (zvýšená periferní vaskulární rezistence, hypertrofie hladkého svalstva) [34]. Častým nálezem u této populace dětí je i anemie, která může způsobit hyperdynamickou cirkulaci a zvýšení CBF se zvýšenou rSO2 [35].
V případě primární placentární insuficience (bez patologických placentárních anastomóz) a chronické fetální hypoxie se vyvine adaptivní hemodynamická redistribuce k zajištění dostatečné perfuze vitálních orgánů, např. mozku – „brain sparing“ effect [36]. Animální modely demonstrují anatomicky mohutnější kapiláry v CNS jako reakci na hypoxické prostředí a efekt zvýšeného CBF a rSO2 perzistuje i v postnatálním období [37].
SAFEBOOSC STUDIE
Snaha o klinickou implementaci metody NIRS u vulnerabilních novorozenců se transformovala do série studií SafeBoosC (Safeguarding the Brain of our smallest Children).
Analýza SafeBoosC-II prokázala snížení hypoxické a hyperoxické zátěže (burden of hypoxia/hyperoxia) u nezralých novorozenců při použití spektroskopie v prvních 72 hodinách života [38]. Následná Safe - BoosC-III studie se zaměřila na vliv terapie na podkladě evaluace cerebrální oxygenace u extrémně nezralých novorozenců (< 28. gestační týden) v prvních 72 hodinách života a následný rozvoj neurologického postižení (PIVH, PVL, atrofie mozku) ve 36. gestačnímu týdnu a/nebo opožděného psychomotorického vývoje. Diagnosticko - terapeutický protokol studie je na obrázku 6 [39]. První výsledky studie SafeBoosC-III budou k dispozici ve druhé polovině roku 2022.
Image 6. SafeBoosC-III – diagnosticko-terapeutické možnosti v případě snížené cerebrální oxygenace 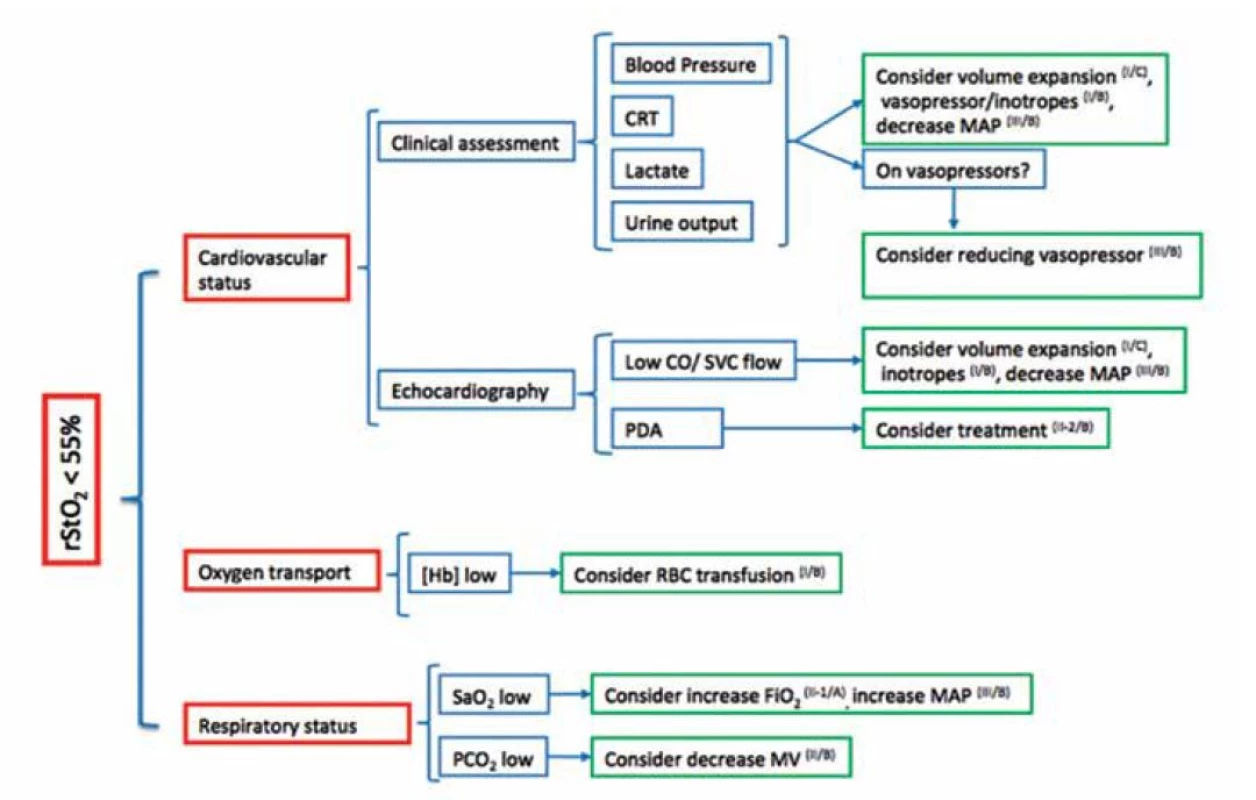
CRT – capillary refill time/kapilární návrat, MAP – mean airway pressure/střední tlak v dýchacích cestách, CO – cardiac output/srdeční výdej, SVC – superior vena cava/horní dutá žíla, PDA – patent ductus arteriosus/perzistující Botallova dučej, Hb – hemoglobin, RBC – red blood cell/červené krvinky, MV – minute ventilation/minutová ventilace, rStO2 – cerebral oxygenation/cerebrální oxygenace NEŽÁDOUCÍ ÚČINKY NIRS
Často zmiňovaným nedostatkem metody NIRS je lokální hypertermický účinek záření a možná tvorba hematomů způsobených stálým tlakem na kůži [2]. Oba nežádoucí účinky lze minimalizovat pravidelnou změnou polohy NIRS čidel a optimální ošetřovatelskou péčí [1]. Nicméně tyto nálezy jsou vzácné a nepůsobí větší problémy v implementaci metody do širší praxe. Relativní nevýhodou NIRS může být obtížná interpretace výsledků, zvláště v případě izolované analýzy rSO2, protože rozmezí bývá poměrně široké (NIRS ukazuje především venózní oxygenaci) a závisí na použitém algoritmu a přístroji.
ZÁVĚR
Metoda NIRS je momentálně preferovanou metodou měření tkáňové oxygenace u kriticky nemocných novorozenců s vysokým rizikem vzniku závažných komplikací centrální nervové soustavy. V kombinaci s klinicko-biochemickým vyšetřením a neinvazivními bed-side metodami (pulzní oxymetrie, funkční echokardiografie) může NIRS poskytnout klinicky relevantní údaje o cerebrální perfuzi u novorozenců velmi nízké porodní hmotnosti v prvních 72 hodinách života (předběžné sdělení ze studie SafeBoosC-III, definitivní výsledky budou publikovány ve druhé polovině roku 2022). Standardně se metoda NIRS používá perioperačně v dětské kardiochirurgii. U novorozenců s hypoxicko-ischemickou encefalopatií dochází k postupnému zavádění metody do klinické praxe.
Konflikt zájmu: žádný.
Došlo do redakce: 26. 2. 2022
Adresa pro korespondenci:
MUDr. Peter Korček, Ph.D.
Ústav pro péči o matku a dítě
Podolské nábřeží 157/36
147 00 Praha 4
e-mail: peter.korcek@upmd.eu
Sources
1. Kenosi M, Naulaers G, Ryan CA, Dempsey EM. Current research suggests that the future looks brighter for cerebral oxygenation monitoring in preterm infants. Acta Paediatr 2015; 104 : 225–231.
2. Korček P, Straňák Z, Širc J, Naulaers G. The role of near-infrared spectroscopy monitoring in preterm infants. J Perinatol 2017; 37 : 1070–1077.
3. da Costa CS, Greisen G, Austin T. Is near-infrared spectroscopy clinically useful in the preterm infant? Arch Dis Child Fetal Neonatal Ed 2015; 100 : 558–561.
4. Sood BG, McLaughlin K, Cortez J. Near-infrared spectroscopy: Applications in neonates. Semin Fetal Neonatal Med 2015; 20 : 164–172.
5. Liem KD, Greisen G. Monitoring of cerebral haemodynamics in newborn infants. Early Hum Dev 2010; 86 : 155–158.
6. Greisen G. Cerebral blood flow in preterm infants during the first week of life. Acta Paediatr Scand 1986; 75 : 43–51.
7. Okumura A, Hayakawa F, Kato T, Itomi K, Maruyama K, Ishihara N, et al. Hypocarbia in preterm infants with periventricular leukomalacia: The relation between hypocarbia and mechanical ventilation. Pediatrics 2001; 107 : 469–475.
8. Weindling AM, Kissack CM. Blood pressure and tissue oxygenation in the newborn baby at risk of brain damage. Biol Neonate 2001; 79 : 241–245.
9. Binder-Heschl C, Urlesberger B, Koestenberger M, Schwaberger B, Schmölzer GM, Pichler G. Cerebral tissue oxygen saturation is associated with N-terminal probrain natriuretic peptide in preterm infants on their first day of life. Acta Paediatr 2015; 104 : 32–37.
10. Verhagen EA, Hummel LA, Bos AF, Kooi EM. Near-infrared spectroscopy to detect absence of cerebrovascular autoregulation in preterm infants. Clin Neurophysiol 2014; 125 : 147–152.
11. Cerbo RM, Scudeller L, Maragliano R, Cabano R, Pozzi M, Tinelli C, et al. Cerebral oxygenation, superior vena cava flow, severe intraventricular hemorrhage and mortality in 60 very low birth weight infants. Neonatology 2015; 108 : 246–252.
12. Balegar KK, Stark MJ, Briggs N, Andersen CC. Early cerebral oxygen extraction and the risk of death or sonographic brain injury in very preterm infants. J Pediatr 2014; 164 : 475–480.
13. Gleason CA, Hamm C, Jones MD Jr. Effect of acute hypoxemia on brain blood flow and oxygen metabolism in immature fetal sheep. Am J Physiol 1990; 258: H1064–H1069.
14. Wardle SP, Yoxall CW, Weindling AM. Determinants of cerebral fractional oxygen extraction using near infrared spectroscopy in preterm neonates. J Cereb Blood Flow Metab 2000; 20 : 272–279.
15. Victor S, Appleton RE, Beirne M, Marson AG, Weindling AM. Effect of carbon dioxide on background cerebral electrical activity and fractional oxygen extraction in very low birth weight infants just after birth. Pediatr Res 2005; 58 : 579–585.
16. Vutskits L. Cerebral blood flow in the neonate. Paediatr Anaesth 2014; 24 : 22–29.
17. Verhagen EA, Van Braeckel KN, van der Veere CN, Groen H, Dijk PH, Hulzebos CV, et al. Cerebral oxygenation is associated with neurodevelopmental outcome of preterm children at age 2 to 3 years. Dev Med Child Neurol 2015; 57 : 449–455.
18. Tyszczuk L, Meek J, Elwell C, Wyatt JS. Cerebral blood flow is independent of mean arterial blood pressure in preterm infants undergoing intensive care. Pediatrics 1998; 102 : 337–341.
19. Dempsey EM, Barrington KJ, Marlow N, O’Donnell CP, Miletin J, Naulaers G, et al. Management of hypotension in preterm infants (The HIP Trial): A randomised controlled trial of hypotension management in extremely low gestational age newborns. Neonatology 2014; 105 : 275–281.
20. Alderliesten T, Lemmers PM, van Haastert IC, de Vries LS, Bonestroo HJ, Baerts W, et al. Hypotension in preterm neonates: Low blood pressure alone does not affect neurodevelopmental outcome. J Pediatr 2014; 164 : 986–991.
21. Miletin J, Dempsey EM. Low superior vena cava flow on day 1 and adverse outcome in the very low birthweight infant. Arch Dis Child Fetal Neonatal Ed 2008; 93: F368–F371.
22. Alderliesten T, Dix L, Baerts W, Caicedo A, van Huffel S, Naulaers G, et al. Reference values of regional cerebral oxygen saturation during the first 3 days of life in preterm neonates. Pediatr Res 2016; 79 : 55–64.
23. Korček P, Širc J, Straňák Z. Cerebral oxygenation reflects fetal development in preterm monochorionic and dichorionic twins. Early Hum Dev 2020; 144 : 105025.
24. Greisen G, Andresen B, Plomgaard AM, Hyttel-Sørensen S. Cerebral oximetry in preterm infants: an agenda for research with a clear clinical goal. Neurophotonics 2016; 3 : 031407.
25. Baik N, Urlesberger B, Schwaberger B, Schmölzer GM, Avian A, Pichler G. Cerebral haemorrhage in preterm neonates: Does cerebral regional oxygen saturation during the immediate transition matter? Arch Dis Child Fetal Neonatal Ed 2015; 100 : 422–427.
26. Noori S, Seri I. Hemodynamic antecedents of peri/intraventricular hemorrhage in very preterm neonates. Semin Fetal Neonatal Med 2015; 20 : 232–237.
27. da Costa CS, Czosnyka M, Smielewski P, Mitra S, Stevenson GN, Austin T. Monitoring of cerebrovascular reactivity for determination of optimal blood pressure in preterm infants. J Pediatr 2015; 167 : 86–91.
28. Noori S, McCoy M, Anderson MP, Ramji F, Seri I. Changes in cardiac function and cerebral blood flow in relation to peri/intraventricular hemorrhage in extremely preterm infants. J Pediatr 2014; 164 : 264–270.
29. Polglase GR, Miller SL, Barton SK, Baburamani AA, Wong FY, Aridas JD, et al. Initiation of resuscitation with high tidal volumes causes cerebral hemodynamic disturbance, brain inflammation and injury in preterm lambs. PLoS One 2012; 7: e39535.
30. Dix L, Molenschot M, Breur J, de Vries W, Vijlbrief D, Groenendaal F, et al. Cerebral oxygenation and echocardiographic parameters in preterm neonates with a patent ductus arteriosus: An observational study. Arch Dis Child Fetal Neonatal Ed 2016; 101: F520–F526.
31. van der Laan ME, Roofthooft MT, Fries MW, Berger RM, Schat TE, van Zoonen AG, et al. A hemodynamically significant patent ductus arteriosus does not affect cerebral or renal tissue oxygenation in preterm infants. Neonatology 2016; 110 : 141–147.
32. Mahieu-Caputo D, Meulemans A, Martinovic J, Gubler MC, Delezoide AL, Muller F, et al. Paradoxic activation of the renin - angiotensin system in twin-twin transfusion syndrome: An explanation for cardiovascular disturbances in the recipient. Pediatr Res 2005; 58 : 685–688.
33. Stirnemann JJ, Mougeot M, Proulx F, Nasr B, Essaoui M, Fouron JC, et al. Profiling fetal cardiac function in twin to twin transfusion syndrome. Ultrasound Obstet Gynecol 2010; 35 : 19–27.
34. Mercanti I, Boivin A, Wo B, Vlieghe V, Le Ray C, Audibert F, et al. Blood pressures in newborns with twin-twin transfusion syndrome. J Perinatol 2011; 31 : 417–424.
35. Bolch C, Fahey M, Reddihough D, Williams K, Reid S, Guzys A, et al. Twin-to-twin transfusion syndrome neurodevelopmental follow-up study (neurodevelopmental outcomes for children whose twin-to-twin transfusion syndrome was treated with placental laser photocoagulation). BMC Pediatr 2018; 18 : 256.
36. Miller SL, Huppi PS, Mallard C. The consequences of fetal growth restriction on brain structure and neurodevelopmental outcome. J Physiol 2016; 594 : 807–823.
37. Hernandez‐Andrade E, Serralde JA, Cruz‐Martinez R. Can anomalies of fetal brain circulation be useful in the management of growth restricted fetuses? Prenat Diagn 2012; 32 : 103–112.
38. Plomgaard AM, van Oeveren W, Petersen TH, Alderliesten T, Austin T, van Bel F, et al. The SafeBoosC II randomized trial: Treatment guided by near-infrared spectroscopy reduces cerebral hypoxia without changing early biomarkers of brain injury. Pediatr Res 2016; 79 : 528–535.
39. Hansen ML, Pellicer A, Gluud C, et al. Cerebral near-infrared spectroscopy monitoring versus treatment as usual for extremely preterm infants: A protocol for the SafeBoosC randomised clinical phase III trial. Trials 2019; 20 : 811.
Labels
Neonatology Neonatal Nurse
Article was published inCzech and Slovak Neonatology

2022 Issue 1-
All articles in this issue
- Editorial
- Současné možnosti měření perfuze u novorozenců
- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Postavení funkční echokardiografie v diagnostice akutní oběhové deteriorace u novorozenců
- Farmakoterapie oběhového selhání novorozenců
- Relativní adrenální insuficience a vazopresor-rezistentní hypotenze u kriticky nemocných novorozenců
- Near-infrared spektroskopie v posuzování hemodynamických změn u novorozenců
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Hypertrofie myokardu u novorozence
- Okluze retinální arterie u extrémně nezralého novorozence s Escherichia coli meningitidou
- Czech and Slovak Neonatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Hypertrofie myokardu u novorozence
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Farmakoterapie oběhového selhání novorozenců
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

