-
Medical journals
- Career
Klinická aplikace principů časového faktoru v radioterapii při kompenzaci přerušení ozařovací série
Authors: Z. Pechačová 1; R. Lohynská 1,2
Authors‘ workplace: Ústav radiační onkologie 1. LF UK a FN Bulovka, Praha 1; Onkologická klinika 1. LF UK a FTN, Praha 2
Published in: Klin Onkol 2021; 34(6): 455-462
Category: Review
doi: https://doi.org/10.48095/ccko2021455Overview
Východiska: Časový faktor hraje v radioterapii klíčovou roli. Celková doba trvání radioterapie patří mezi významné prediktivní faktory efektu radioterapie a je spojena s lepší lokální kontrolou i vlivem na přežití pacientů. Důležitou roli má též délka období od stanovení diagnózy k radikální radioterapii či od operace k zahájení radioterapie nebo využití alternativních frakcionačních schémat zkracujících celkovou dobu léčby. Zásadním a dobře proveditelným způsobem aplikace časového faktoru v radioterapii zůstává zejména zamezení prodloužení ozařovací série. Cíl: K přerušení radioterapie většinou dochází z technických důvodů, kvůli faktorům na straně pacienta nebo z personálních důvodů pracoviště. Standardní postupy pro kompenzaci pauzy v léčbě jsou součástí léčebných standardů radioterapeutických pracovišť. Rozvaha o závažnosti možných dopadů přerušení radioterapie a o nutnosti kompenzovat pauzu v léčbě probíhá na podkladě typu a rozsahu onemocnění, léčebného záměru a celkového stavu pacienta. Pacienti jsou zařazeni do tří kategorií dle uvedených parametrů a z nich plynoucího rizika snížení efektu radioterapie z důvodu přerušení léčby. Kompenzaci pauzy v radioterapii provádíme pomocí výpočtu ekvivalentní dávky k normofrakcionaci (EQD2), přičemž je preferován způsob kompenzace umožňující dodržení plánované celkové doby radioterapie bez prodloužení. Vždy je nutné zvažovat přínos pro zachování lokální kontroly nádoru a rizika navýšení akutní nebo zejména pozdní toxicity. V současné epidemiologické situaci často dochází k přerušení radioterapie kvůli onemocnění COVID-19 a následně je z důvodu delších pauz v léčbě často nutné u jednoho pacienta kombinovat více způsobů kompenzace přerušení radioterapie.
Klíčová slova:
radioterapie – účinnost léčby – časový faktor – radiobiologie – pandemie COVID-19
Úvod
Radioterapie (RT) patří mezi základní modality onkologické léčby a uplatňuje se v kurativních, neoadjuvantních, adjuvantních nebo paliativních indikacích dle léčebných protokolů. Obecně lze úspěšnost radikální onkologické léčby hodnotit řadou statistických parametrů: procentem lokoregionální kontroly, přežití bez nemoci a celkovým přežitím pacientů. Pravděpodobnost vyléčení závisí na řadě faktorů jednak na straně nádoru (stadium onemocnění, histologický typ, stupeň diferenciace nádorových buněk, lymfangioinvaze, molekulární charakteristiky), dále ze strany pacienta (věk, komorbidity, výkonnostní stav, životní styl) a také na faktorech vlastní léčby – v radioterapii se jedná o techniku radioterapie, frakcionační schéma, celkovou dávku záření, celkovou dobu léčby či současnou aplikaci chemoterapie [1].
Časový faktor hraje v radioterapii klíčovou roli, což je dobře potvrzeno zejména u spinocelulárních karcinomů, u nichž je také často radioterapie primární léčebnou metodou (karcinomy hlavy a krku, karcinomy jícnu, nádory hrdla děložního, anální karcinomy a další) [2]. Celková doba trvání radioterapie patří mezi významné prediktivní faktory efektu radioterapie a je spojena s lepší lokální kontrolou i vlivem na přežití pacientů [2,3]. Hlavním důvodem je rychlá repopulace nádorových buněk během přerušení léčby; každý den prodloužení radioterapie spinocelulárních nádorů hlavy a krku znamená 1–5 % ztrátu lokální kontroly onemocnění [4]. Menší význam má časové období od stanovení diagnózy do zahájení radikální léčby – faktory ovlivňující délku tohoto intervalu jsou poměrně komplexní a často hůře ovlivnitelné. Ke zkrácení doby od diagnózy k radikální radioterapii či od operace k zahájení radioterapie již napomohlo zavedení multidisciplinárních týmů, nicméně limity v personální kapacitě zdravotnických pracovišť vč. samotných radioterapeutických oddělení mohou přesto často znamenat i několikatýdenní čekací interval do zahájení radioterapie. Léčebnou výhodu s využitím časového faktoru lze získat využitím alternativních frakcionačních schémat vedoucích ke zkrácení celkové doby ozařování – zdravé tkáně, které reparují poškození rychleji a s menší četnostní chyb (oproti nádorovým), tak získají přednostní výhodu dostatečného času k reparaci poškození [5]. Tímto způsobem můžeme dosáhnout vyšší úspěšnosti léčby, byť často za cenu vyšší akutní toxicity.
Zásadním způsobem aplikace časového faktoru v radioterapii představuje zejména zamezení prodloužení ozařovací série a způsoby kompenzace přerušení ozařovací série jsou dnes běžnou součástí standardních léčebných protokolů na radioterapeutických pracovištích. V současné epidemiologické situaci dochází z důvodu široce rozšířeného onemocnění COVID-19 k mnohem častějším prodloužením ozařovací série, což představuje velkou výzvu i pro radioterapeutická pracoviště – je nutná častá korekce ozařovacích schémat ke kompenzaci přerušení, která již nejsou pouze ve dnech, ale nyní typicky v řádu několika týdnů. Jsou k dispozici praktická doporučení pro řešení specifických situací v radioterapii v době pandemie COVID-19 [6–8], avšak pro kompenzaci takto dlouhých přerušení je již nutno využít kombinace různých kompenzačních mechanizmů. Všestranné dopady pandemie v onkologii zůstávají předmětem výzkumu.
Cílem předkládaného sdělení je shrnutí základních radiobiologických principů časového faktoru v radioterapii, přehled nejčastějších způsobů kompenzace přerušení radioterapie a jejich klinické aplikace s přihlédnutím k epidemiologické situaci v rámci pandemie COVID-19.
Základní radiobiologické principy časového faktoru v radioterapii
Rychlost růstu nádoru lze hodnotit dobou, během níž dojde ke zdvojení objemu tumoru (zdvojovací doba). Zdvojovací doba je ovlivněna délkou buněčného cyklu (Tc), růstovou frakcí (growth fraction – GF) a ztrátami buněk (cell loss factor – CLF) [1,5]. Nádory rostou rychle, je-li krátký buněčný cyklus, vysoká růstová frakce a nízké ztráty buněk. Průměrná zdvojovací doba je cca 2 měsíce a mezi různými druhy nádorů se liší. Potenciální zdvojovací doba (Tpot) je definována jako doba, za niž by se tumor zdvojnásobil, kdyby nedocházelo k žádné ztrátě buněk, a u ORL nádorů je průměrně 5 (1,8–5,9) dnů. Pomalý růst některých nádorů může být tedy výsledkem vysokých ztrát, což je typické právě pro spinocelulární nádory hlavy a krku, u nichž jsou ztráty buněk (např. do trávicího traktu) přes 90 % a výsledná zdvojovací doba (Td) je průměrně 45 dní. Nejkratší potenciální zdvojovací dobu vykazují nediferencované plicní nádory (2,5 dne) se ztrátami buněk až 97 % a Td 90 dní. Oproti tomu nádory prostaty mají průměrnou Tpot 28 dní, ztráty 97 % a Td 1 100 dní. Základní růstové charakteristiky nádoru tak vypovídají o jeho klinickém chování, neboť každé dělení buňky s sebou nese riziko dalších mutací; ty přispívají k získání nových vlastností nádorových buněk, a tak je umožněna rychlejší progrese nádorového onemocnění [1].
Biologické faktory, které ovlivňují odpověď normálních i nádorových tkání k frakcionované radioterapii, jsou definovány jako „5 R“ radioterapie [5]: reparace buněk ze subletálního poškození (neletální poškození je buď opraveno, nebo se akumuluje, až je pro buňku letální), redistribuce buněk mezi fázemi buněčného cyklu, akcelerovaná repopulace buněk, reoxygenace nádoru díky zlepšenému prokrvení a vyššímu zásobení kyslíkem a posledním „R“ je vnitřní radiosenzitivita buňky. V odpovědi buňky na ozáření se účastní výše uvedené faktory komplexně – reparace a repopulace činí tkáně rezistentnějšími k dalším frakcím záření a redistribuce a reoxygenace je naopak činí radiosenzitivnějšími. Přežívání buněk po ozáření lze popsat více teoriemi; v běžné klinické praxi je v současnosti nejpoužívanější lineárně kvadratický (LQ) model, který zohledňuje odlišnou citlivost na výši jednotlivé dávky v rozvoji akutní a pozdní toxicity po ozáření a představuje tak účinný nástroj pro kvantifikaci biologických účinků ionizujícího záření [5,9]. Radiosenzitivita tkáně je v LQ modelu vyjádřena poměrem a/b, který vyjadřuje příspěvek jednozásahového a mnohozásahového mechanizmu k usmrcení buněk zářením – nižší hodnoty jsou typické pro tzv. pozdně reagující tkáně (citlivé na vyšší jednotlivou dávku, více závislé na změně frakcionačního režimu), vyšší hodnoty pro tzv. časně reagující tkáně (citlivé i na nízkou dávku záření, méně závislé na změně frakcionačního režimu). Hodnoty poměru a/b pro časté karcinomy a zdravé tkáně jsou uvedeny v tab. 1. Z LQ modelu je odvozen výpočet pro biologický ekvivalent dávky a pro ekvivalentní dávku k normofakcionaci EQD2, která se užívá pro výpočet dávky při kompenzaci přerušení ozařovací série. V radiobiologických experimentech a studiích vedla akcelerace série radioterapie ke zvýšení biologického účinku. Hodnota dávky, které odpovídá vyšší účinek, přepočítaná na den byla nazvána Dprolif, u ORL nádorů odpovídá 0,7 Gy/den a hodnoty u dalších nádorů jsou uvedeny v tab. 2. Každé urychlení ozařovacího režimu přináší zvýšení protinádorového účinku, ale je nutné mít na paměti i vyšší vliv na zdravé tkáně (akutní reakce).
Table 1. Biologické parametry nádorů a rizikových orgánů k přepočtu biologické ekvivalentní dávky [5]. ![Biologické parametry nádorů a rizikových orgánů k přepočtu biologické ekvivalentní dávky [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e62e738d5dad5d9711bc6acad6031c41.png)
Table 2. Dávka, kterou je vhodné přidat za každý den prodloužení radioterapie (vč. přidaného víkendu) u primární kurativní radioterapie nebo adjuvantní radioterapie pro R+ výkon [2,5]. ![Dávka, kterou je vhodné přidat
za každý den prodloužení radioterapie
(vč. přidaného víkendu)
u primární kurativní radioterapie
nebo adjuvantní radioterapie pro R+
výkon [2,5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6b7daee2cfaf66b9ff98e934569ee5a9.png)
Frakcionační schémata v radioterapii. Radioterapie aplikovaná jednou denně v dávce 1,8–2,0 Gy po 5 dní v týdnu se nazývá normofrakcionace (konvenční frakcionace) [9]. Hypofrakcionace je užití jednotlivých dávek > 2 Gy na frakci a snížení celkového počtu frakcí a zkrácení ozařovací série – příkladem je adjuvantní ozáření prsu dávkou 42,56 Gy v 16 frakcích po 2,66 Gy během 3,5 týdne (akcelerovaná hypofrakcionace). Nižší celková dávka díky zkrácení ozařovací doby vede ke stejným léčebným výsledkům. Hypofrakcionace se příznivě uplatňuje u nádorů s menší citlivostí na frakcionaci (nízký poměr a/b), může zhoršovat pozdní reakce zdravých tkání ve srovnání s normofrakcionací, ale také zhoršovat výsledky léčby nádorů s vyšším poměrem a/b (jako jsou spinocelulární nádory hlavy a krku). Nejčastěji se používá v paliativní radioterapii [9,10]. Zkrácení ozařovací série při stejném počtu frakcí může být dosaženo např. při ozařování o víkendových dnech (akcelerovaná frakcionace). Hyperfrakcionace znamená užití vyššího počtu frakcí denně o nižší jednotlivé dávce, většinou se jedná o dvě frakce denně po 1,15 Gy. Časový odstup frakcí by měl být min. 6, lépe 8 hodin. Celková doba ozařovací série je nejčastěji nezměněna a aplikovaná fyzikální dávka je o 10–20 % vyšší než u konvenčních režimů. Cílem je zvýšení lokální kontroly nádoru při zachování nebo snížení rizika pozdních reakcí (rozdílná schopnost reparace ze subletálního poškození mezi nádorem a fibroblasty normální tkáně), ale časné reakce sliznic bývají u hyperfrakcionace také zvýšené. Hyperfrakcionace je výhodná v léčbě nádorů s vysokým a/b poměrem (např. spinocelulární nádory hlavy a krku).
Přerušení ozařovací série
Prodloužení celkové doby ozařovací série bývá poměrně časté a nastává z více důvodů:
a. technické příčiny – přerušení provozu přístroje (lineární urychlovač, léčebný rentgen) z důvodu plánované (servis, státní svátky) nebo neplánované (porucha přístroje) odstávky;
b. faktory na straně pacienta – zvýšená toxicita léčby, komorbidity, interkurentní nemoci, nařízená karanténa nebo izolace z důvodu COVID-19, obtíže s dopravou;
c. personální důvody na straně pracoviště – personální nouze, karanténa nebo izolace zaměstnanců z důvodu COVID-19, stávka zaměstnanců.
Kategorizace pacientů dle rizikovosti přerušení radioterapie
Rozvaha o závažnosti možných dopadů přerušení radioterapie a o nutnosti kompenzovat pauzu v léčbě probíhá na podkladě základní diagnózy, histologického typu, rozsahu onemocnění, léčebného záměru (kurativní/paliativní) a celkového stavu pacienta i dle preferencí a časových možností pacienta. Přínos užitého způsobu kompenzace musí převážit nad rizikem navýšení akutní nebo pozdní toxicity. V případě plánovaného přerušení radioterapie je vhodné zvážit možnosti kompenzace předem a nahrazovat chybějící frakce v časové blízkosti k období pauzy. Např. u státních svátků je možné kompenzaci víkendovým provozem naplánovat na celý rok dopředu. V indikovaných případech je možné v rámci kompenzace zvážit zmenšení cílového objemu (např. kompenzace dávky pouze na lůžko tumoru po R1 resekci, nikoli na oblast elektivně ozařovaných uzlinových oblastí). V praxi se ustálilo zařazení pacientů do tří kategorií [11,12] dle uvedených parametrů a z nich plynoucího rizika snížení efektu radioterapie z důvodu přerušení léčby.
Kategorie I
Lokoregionální kontrola nádoru při radikální léčbě s kurativním záměrem významně závisí na celkové délce ozařovací série, každý den prodloužení léčby představuje riziko ztráty lokální kontroly cca o 1 %. Je vhodné kompenzovat pauzu při přerušení delším než 2 dny. Cílem je, aby alespoň 95 % pacientů mělo léčbu s prodloužením maximálně 2 dny. Jedná se zejména o tyto diagnózy: spinocelulární nádory (spinocellular carcinoma – SCC) hlavy a krku, SCC čípku děložního, meduloblastom a PNET, plicní tumory nemalobuněčné (non-small cell lung cancer – NSCLC) i malobuněčné, SCC i adenokarcinomy jícnu, SCC kůže, vaginy, vulvy nebo anu a další tumory s krátkým zdvojovacím časem (glioblastomy, lymfomy, předoperační radioterapie adenokarcinomů rekta, dětští pacienti s radikální léčbou).
Kategorie II
Pacienti léčení kurativně pro ostatní nádorová onemocnění, u nichž je časový faktor v radioterapii méně významný – je vhodné kompenzovat při > 5 dnech prodloužení léčby. Jedná se o tyto diagnózy: karcinomy prsu (pooperační normofrakcionovaná RT nesmí být prodloužena o > 5 dnů, hypofrakcionovaná adjuvantní radioterapie by neměla být prodloužena o > 2 dny), nádory endometria, nádory měkkých tkání a skeletu, nádory mozku, karcinom močového měchýře z přechodního epitelu, karcinom prostaty, pooperační adjuvantní RT diagnóz kategorie I.
Kategorie III
Pacienti indikovaní k paliativní radioterapii nebo nenádorové radioterapii – časový faktor je v těchto případech méně významný a u vybraných pacientů s dlouhodobou prognózou je možné kompenzovat pauzu > 7 dnů.
Rozvaha o kompenzaci pauzy v radioterapii
Kompenzaci pauzy v radioterapii provádíme pomocí výpočtu ekvivalentní dávky k normofrakcionaci EQD2 [5].
EQD2 = ekvivalentní dávka v Gy vztažená k normofrakcionaci po 2 Gy
D = celková dávka (Gy)
d = jednotlivá dávka (Gy)
Je preferován způsob kompenzace, který umožní zachování plánované celkové doby radioterapie bez prodloužení. V případě, že to není možné a je akceptováno prodloužení celkového času RT, je nutné za každý den přerušení vč. přidaného víkendu přidat navíc dávku Dprolif dle tab. 2. Vždy je nutné zvažovat přínos pro zachování lokální kontroly nádoru a rizika navýšení akutní nebo zejména pozdní toxicity. Pro přepočet je možné využít webové nebo mobilní aplikace (EQD2 calculator).
Způsoby provedení kompenzace přerušení ozařovací série
Dle všech uvedených parametrů a s ohledem na preference i možnosti pacienta a radioterapeutického pracoviště volíme konkrétní způsob kompenzace přerušení léčby (schéma 1) [1,2,5].
Schéma 1. Schéma možností kompenzace přerušení radioterapie. 
1. zachování celkové doby radioterapie i dávky na frakci:
a. přesun pacienta v léčbě na jinou ozařovnu (při poruše či servisu ozařovače), čímž nedojde k přerušení a prodloužení léčby;
b. provedení ozáření o víkendu, čímž nedojde k prodloužení léčby a není třeba přepočtů při úpravě režimu;
c. hyperfrakcionace – ozáření 2x denně s intervalem > 6 hodin, ideálně 8 hodin.
- Není vhodné pro nádory CNS (z dů - vodu delší reparace tkání CNS, u míchy > 24 hodin);
- je nutné pečlivé načasování s případnou konkomitantní chemoterapií (CHMT) – není vhodné podání CHMT souběžně s dvojitou frakcí RT;
- neproveditelné při přerušení RT ke konci série;
- je vhodné podání dávky v krátkém časovém odstupu od přerušení léčby;
- nevýhodou tohoto postupu je možný nárůst akutní toxicity léčby;
- s ohledem na stav pacienta únosné maximálně 4x (4 dny se dvěma frakcemi denně), maximálně 3x v průběhu 2 týdnů;
2. zachování celkové doby radioterapie a zvýšení jednotlivé dávky na frakci (výpočet dle LQ modelu), stejná ekvivalentní dávka (EQD2) – snaha o dodržení celkového času radioterapie – maximální zkrácení doby kompenzace dávky:
a) přepočet dávky pro všechny zbývající dny RT dle izoefektu na tumor (stejná lokální kontrola (LC), vyšší pozdní toxicita), nebo na zdravé tkáně (nižší LC, stejná pozdní toxicita);
b) přepočet dávky pro stejný počet dnů, po které byla RT přerušena, dle izoefektu na tumor (stejná LC, vyšší pozdní toxicita), nebo na zdravé tkáně (nižší LC, stejná pozdní toxicita);
je nutné pečlivé načasování s případnou konkomitantní chemoterapií – není vhodné podání CHMT ve dnech aplikované vyšší dávky na frakci;
3. zvýšení celkové dávky RT – přidání extra frakcí radioterapie – pokud lze akceptovat prodloužení celkové doby radioterapie:
- za každý den přerušení vč. přidaného víkendu je nutno dle typu nádoru přidat navíc dávku Dprolif dle tab. 2;
4. nekompenzovat vůbec u pacientů s projevy nespolupráce a u paliativního záměru.
Možnosti praktické realizace uvedených způsobů kompenzace přerušení radioterapie jsou ilustrovány na hypotetickém příkladu a několika reálných kazuistikách.
Modelový příklad
Pacient léčený s kurativním záměrem pro NSCLC, v plánu 33 frakcí à 2 Gy, přerušení na 5 dnů po 18. frakci, zbývá ozářit 15 frakcí. Pro výpočet EQD2 stanovíme poměr a/b = 3 pro pozdně reagující tkáně, a/b = 10 pro tumor. Možnosti kompenzace v tomto případě:
- Zachování plánovaného celkového času RT, přepočet dávky pro zbývající dny RT. Pro dodržení celkové délky RT by bylo třeba podat ekvivalent zbývající dávky v 10 frakcích. To dle vzorce pro výpočet EQD2 činí: 10 × 2,65 Gy (nižší LC, srovnatelné riziko pozdní toxicity), nebo 10 × 2,8 Gy (srovnatelná LC, vyšší riziko pozdní toxicity). Preference ekvivalence režimu (tumor vs. akutní reakce vs. pozdní reakce) je na ošetřujícím lékaři.
- Kombinovaný přístup více základních způsobů kompenzace najednou: zachování počtu frakcí, akceptace prodloužení RT, přepočet dávky pro zbývající dny RT s vyšší celkovou dávkou kompenzující přerušení. Za každý den přerušení vč. víkendu musíme dodat navíc Dprolif = 0,45 Gy, tj. 7 × 0,45 Gy, což činí 3,15 Gy, zbývá 30 Gy (15 × 2 Gy), tedy celkem je nutno dodat ekvivalent 33,15 Gy. Vypočteme dávku, kterou chceme dodat v 15 frakcích, aby EQD2 dosahovala hodnoty blízké 33,15 Gy, což činí 15 × 2,15 Gy (nižší LC, srovnatelné riziko pozdní toxicity) nebo 15 × 2,2 Gy (srovnatelná LC, vyšší pozdní toxicita), rozdíl dopadů na LC a pozdní toxicitu je v tomto případě velmi malý.
- Zachování plánovaného celkového času RT, užití hyperfrakcionace. Po 4–5 dnů aplikovat dvě frakce denně s odstupem min. 6 hodin podle pravidel uvedených v bodě 1c. Nevýhodou tohoto postupu je mírný nárůst akutní toxicity léčby.
- Zachování plánovaného celkového času RT, přepočet dávky pro stejný počet dnů, po které byla RT přerušena. RT byla přerušena na 5 dnů, na dalších 5 dnů proveden přepočet dávky k dodání ekvivalentu 20 Gy, což činí 5 × 3,2 Gy (nižší LC, srovnatelné riziko pozdní toxicity), resp. 5 × 3,55 Gy (srovnatelná LC, vyšší pozdní toxicita). Zbývajících pět frakcí by byl pacient ozářen plánovaně à 2 Gy.
- Přidání extra frakcí RT. Jde o nejméně vhodný způsob, který by vedl k dalšímu prodloužení léčby (nižší LC, vyšší pozdní toxicita). Za každý den přerušení vč. víkendu je nutné dodat navíc Dprolif = 0,45 Gy, tj. 7 × 0,45 Gy, což činí 3,15 Gy, plánovaně zbývá 30 Gy (15 × 2 Gy), tedy celkem je nutno dodat ekvivalent 33,15 Gy. Budou přidány dvě frakce RT à 2 Gy identicky.
Kazuistiky
Přerušení radioterapie z různých příčin bývá poměrně časté a způsoby kompenzace přerušení mají být součástí místních radiologických standardů radioterapeutických pracovišť. V současné epidemiologické situaci s rozšířením onemocnění COVID-19 se setkáváme častěji s přerušením léčby na 1–2 týdny nebo při komplikovaném průběhu COVID-19 i na delší dobu. Z důvodu delších pauz v léčbě je často vhodné kombinovat více způsobů kompenzace u jednoho pacienta. Pro ilustraci jsou uvedeny krátké kazuistiky pacientů, kteří prodělali COVID-19 v průběhu radioterapie a byla u nich aplikována kompenzace přerušení léčby.
Kazuistika 1
Pacientka NZ, věk 54 let, lokálně pokročilý karcinom prsu po neoadjuvantní chemoterapii, ablaci prsu s exenterací axilly, nyní na systémové terapii inhibitorem aromatázy, zahájila pooperační radioterapii na oblast hrudní stěny a spádových lymfatik. Po 14. frakci následovalo přerušení na 10 ozařovacích dnů, navíc se blížily dva státní svátky. Zbývající radioterapie tedy byla kontrahována se záměrem kompenzovat přerušení léčby a ukončit léčbu před státními svátky, aby se zabránilo dalšímu prodloužení léčby, byly zohledněny komorbidity pacientky i organizační hlediska (nemožnost aplikace dvou frakcí denně z důvodu vzdáleného bydliště). V adjuvantní RT bylo akceptováno prodloužení 5 dní jako přijatelné v kategorii II a zbývající dny prodloužení byla mírně zvýšena dávka pro kompenzaci prodloužení dalších 5 dnů. Místo zbývajících 11 frakcí à 2 Gy byla pacientka ozářena v devíti frakcích po 2,5 Gy do celkové dávky 50,5 Gy, EQD2 v součtu činila 52,5 Gy při poměru a/b = 3,5 Gy pro karcinom prsu (obr. 1). Pacientka dokončila léčbu bez výraznějších komplikací.
Image 1. Výpočet kompenzace přerušení ozařovací série v kazuistice 1. 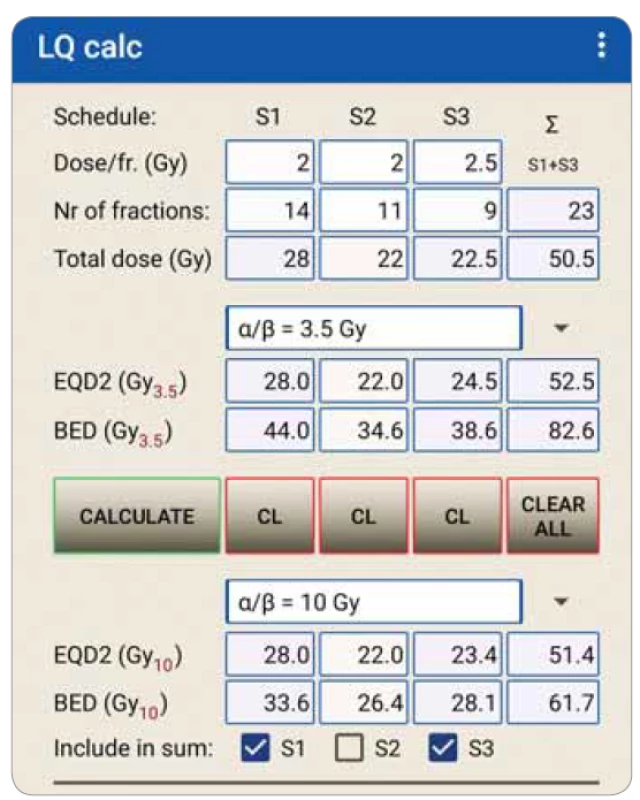
Σ – součet parametrů proběhlého ozařování (S1+S3), BED – biologický ekvivalent dávky, EQD2 – ekvivalentní dávka vztažená k normofrakcionaci, S1 – ozáření aplikované před přerušením léčby, S2 – neprovedené zbývající frakce, S3 – přepočet zbývajícího ozařování.
Výpočet je zobrazen v mobilní aplikaci LQ calc (Westermark).Kazuistika 2
Pacientka BS, věk 45 let, lokálně pokročilý karcinom prsu po neoadjuvantní chemoterapii, po mastektomii s exenterací axilly, pokračuje v hormonální léčbě, zahájila adjuvantní radioterapii na oblast hrudní stěny a spádových lymfatik. Po 10. frakci následovalo přerušení na 11 dnů. Kompenzace radioterapie byla naplánována ve formě kombinace dvou postupů: přidání jedné frakce radioterapie a provedení hyperfrakcionace (aplikace dvou frakcí denně v odstupu cca 7 hodin) celkem třikrát. Bylo tedy aplikováno 16 frakcí během 13 ozařovacích dnů, akutní toxicita se projevila v obvyklé míře – kožní reakce G1 dle kritérií Společnosti pro radiační terapii v onkologii (RTOG), bez dalších komplikací.
Kazuistika 3
Pacient ST, věk 78 let, lokálně pokročilý karcinom tonzily s metastázami do lymfatických uzlin, indikován k definitivní samostatné radioterapii metodou objemově modulované radioterapie kyvem se simultánním integrovaným boostem (VMAT-SIB) ve 33 frakcích (jednotlivá dávka na tumor a postižené uzliny 2,12 Gy, na ostatní oblasti jednotlivá dávka 1,8 Gy nebo 1,64 Gy dle místního radiologického standardu). Po 22. frakci došlo k přerušení radioterapie, které trvalo 4 týdny z důvodu komplikovaného průběhu COVID-19. Kontrolní CT vyšetření zobrazilo nález stabilizovaného onemocnění. Vzhledem k dlouhému přerušení ozařování nebylo reálně možné provést přesnou kompenzaci přerušení léčby. Na oblast tumoru bylo v první fázi dosaženo EQD2 = 47,0 Gy. Bylo rozhodnuto o dokončení ozařování v 10 frakcích – na tumor a postižené uzliny byla aplikována jednotlivá dávka 2,5 Gy, na ostatní uzlinové oblasti 2,0 Gy, což představuje EQD2 pro tumor 25,7 Gy a pro pozdní toxicitu 27,5 Gy, v celkovém součtu EQD2 činila 72,6 Gy pro tumor a 75,3 Gy pro pozdní toxicitu (obr. 2). Pacient dokončil léčbu bez komplikací, s odstupem 10 měsíců trvá nález kompletní remise onemocnění s minimální pozdní toxicitou léčby (suchost v ústech G1, polykání bez omezení).
Výpočet kompenzace přerušení ozařovací série v kazuistice 3. 
Σ – součet parametrů proběhlého ozařování, BED – biologický ekvivalent dávky, EQD2 – ekvivalentní dávka vztažená k normofrakcionaci, S1 – ozáření aplikované před přerušením léčby, S2 – ozáření aplikované po pauze.
Výpočet je zobrazen v mobilní aplikaci LQ calc (Westermark).Závěr
Časový faktor hraje v radioterapii klíčovou roli, přičemž celková doba trvání radioterapie patří mezi významné prediktivní faktory efektu radioterapie a je spojena s lepší lokální kontrolou i s vlivem na přežití pacientů. Důležitou roli má též délka období od stanovení diag - nózy k radikální radioterapii či od operace k zahájení radioterapie (faktory ovlivňující délku tohoto intervalu jsou ale komplexní a hůře ovlivnitelné), léčebnou výhodu lze také získat využitím alternativních frakcionačních schémat vedoucích ke zkrácení celkové doby ozařování. Zásadním způsobem aplikace časového faktoru v radioterapii zůstává zejména zamezení prodloužení ozařovací série – jedná se o nejdostupnější způsob zlepšení výsledků léčby zářením s minimálními finančními náklady. V současné epidemiologické situaci dochází z důvodu široce rozšířeného onemocnění COVID-19 k mnohem častějším prodloužením ozařovací série z důvodu karantény nebo izolace pro COVID--19, která již nejsou pouze ve dnech, ale nyní typicky v řádu několika týdnů. Pro kompenzaci takto dlouhých přerušení je často nutné využít kombinace různých kompenzačních mechanizmů. Standardní postupy pro kompenzaci pauzy v léčbě jsou dnes součástí léčebných standardů radioterapeutických pracovišť.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Zdeňka Pechačová
Ústav radiační onkologie
1. LF UK a FN Bulovka
Budínova 67/2
180 81 Praha 8
e-mail: zdenka.pechacova@bulovka.cz
Obdrženo/Submitted: 23. 3. 2021
Přijato/Accepted: 15. 4. 2021
Sources
1. Lohynská R, Jirkovská M, Krátká Z. Časový faktor v radikální radioterapii nádorů hlavy a krku. Postgraduální medicína 2020; 2 : 115–120.
2. Lohynská R. Časový faktor v radikální radioterapii nádorů hlavy a krku. Praha: 2. lékařská fakulta Univerzity Karlovy 2007.
3. Overgaard J, Hansen HS, Specht L et al. Five compared with six fractions per week of conventional radiotherapy of squamous-cell carcinoma of head and neck: DAHANCA 6,7 randomized controlled trial. Lancet 2003; 362 (9388): 933–939. doi: 10.1016/s0140-6736 (03) 14 361-9.
4. Gonzalez Ferreira JA, Jaen Olasolo J, Azinovic I et al. Effect of radiotherapy delay in overall treatment time on local control and survival in head and neck cancer: review of the literature. Rep Pract Oncol Radiother 2015; 20 (5): 328–339. doi: 10.1016/j.rpor.2015.05.010.
5. Joiner MC, van der Kogel A. Basic clinical radiobiology. 5th ed. CRC Press/Taylor & Francis Group 2019.
6. Lancia A, Bonzano E, Bottero M et al. Radiotherapy in the era of COVID-19. Expert Rev Anticancer Ther 2020; 20 (8): 625–627. doi: 10.1080/14737140.2020.1785 290.
7. Guckenberger M, Belka C, Bezjak A et al. Practice recommendations for lung cancer radiotherapy during the COVID-19 pandemic: an ESTRO-ASTRO consensus statement. Radiother Oncol 2020; 146 : 223–229. doi: 10.1016/j.radonc.2020.04.001.
8. Thomson DJ, Palma D, Guckenberger M et al. Practice recommendations for risk-adapted head and neck cancer radiotherapy during the COVID-19 pandemic: an ASTRO-ESTRO consensus statement. Int J Radiat Oncol Biol Phys 2020; 107 (4): 618–627. doi: 10.1016/j.radonc.2020.04.019.
9. Šlampa P, Petera J. Radiační onkologie. 1. vyd. Praha: Galén Karolinum 2007.
10. Pechačová Z, Končeková J, Lohynská R et al. Paliativní radioterapie v managementu symptomů pokročilého onkologického onemocnění. Onkologie 2020; 14 (6): 271–277.
11. The Royal College of Radiologist. The timely delivery of radical radiotherapy: guidelines for the management of unscheduled treatment interruptions. 4th ed. London 2019.
12. Hendry JH, Bentzen SM, Dale RG et al. A modelled comparison of the effects of using different ways to compensate for missed treatment days in radiotherapy. Clin Oncol 1996; 8 (5): 297–307. doi: 10.1016/s0936-6555 (05) 80715-0.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2021 Issue 6-
All articles in this issue
- Editorial
- Waldenströmova makroglobulinemie
- Erdheimova-Chesterova choroba
- Pozdní endokrinologické komplikace onkologické léčby
- Pokročilá stadia klasického Hodgkinova lymfomu – možnosti první linie léčby
- Klinická aplikace principů časového faktoru v radioterapii při kompenzaci přerušení ozařovací série
- Doporučení pro preventivní a léčebnou péči o kůži pacientů podstupujících radioterapii
- Anotace knihy
- Aktuality z odborného tisku
- Účinnost a bezpečnost entrektinibu při léčbě nádorů s genovou fúzí NTRK
- Polymorfismy rs4673 a rs28714259 v predikci antracyklinem zprostředkované kardiotoxicity u pacientek s karcinomem prsu
- Incidence, mortalita a přežití novotvarů močového měchýře v České republice v letech 1977–2017: analýza časových trendů
- Primární lymfom prsu – kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Waldenströmova makroglobulinemie
- Erdheimova-Chesterova choroba
- Doporučení pro preventivní a léčebnou péči o kůži pacientů podstupujících radioterapii
- Pokročilá stadia klasického Hodgkinova lymfomu – možnosti první linie léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


