-
Medical journals
- Career
Atypický průběh typického karcinoidu plic
Authors: L. Jakubíková
Authors‘ workplace: Klinika nemocí plicních a tuberkulózy, FN Brno
Published in: Klin Onkol 2020; 33(4): 302-308
Category: Case Report
doi: https://doi.org/10.14735/amko2020302Overview
Východiska: Karcinoidy byly v minulosti klasifikovány podle svého embryonálního původu, dnes jsou řazeny a klasifikovány jako neuroendokrinní nádory, které zahrnují nízce maligní typické karcinoidy, středně maligní atypické karcinoidy a skupinu neuroendokrinních karcinomů, kam patří vysoce maligní velkobuněčné neuroendokrinní a malobuněčné karcinomy. Typický karcinoid je dříve užívaný termín pro současné označení neuroendrokinního nádoru stupně I, dobře diferencovaného, patřícího do skupiny vzácných nádorů s dobrou prognózou, s metastázami v méně než 15 %, s pětiletým přežitím ve více než 90 %, vzácně produkujícího serotonin. Ani u tohoto biologicky příznivého nádoru s poměrně nízkým stupněm metastazování nelze podcenit další dispenzarizaci.
Případ: V následujícím sdělení je shrnuta klasifikace neuroendokrinních nádorů, jejich diagnostika a léčba, a v druhé části je pak uveden konkrétní případ pacienta se vznikem vícečetných metastáz původně typického plicního karcinoidu (stanovení histologie v době operace v roce 2012, v době používání této starší verze klasifikace pro neuroendokrinní tumory) s popisem jeho další léčby.
Závěr: U dobře diferencovaných neuroendokrinních nádorů je nezanedbatelné riziko metastazování i přes jejich radikální odstranění, proto je nutná a zcela namístě jejich dispenzarizace.
Klíčová slova:
neuroendokrinní plicní nádory – oktreotid – everolimus
Úvod
Neuroendokrinní plicní nádory (neuroendocrine neoplasm – NEN) představují heterogenní skupinu vzácných nádorů, které se nacházejí v plicích. Podílí se asi 25 % na neuroendokrinních nádorech všech lokalizací. Embryonální původ mají z předního střeva. Incidence plicních NEN se pohybuje okolo 1,35 případů na 100 000 obyvatel. Jsou na druhém místě ve výskytu hned po neuroendokrinních nádorech v lokalizaci gastrointestinálního traktu (GIT). Neuroendokrinní nádory se mohou vyskytovat kdekoli v plicní tkáni. Pohlaví je zastoupeno rovnoměrně, ale ve věku nad 50 let jsou dvakrát častěji zastoupeny ženy. Jsou popisovány dva vrcholy věkového výskytu – mezi 15. a 25. rokem a mezi 65. a 75. rokem. Průměrný věk je 47 let. Atypické karcinoidy (středně diferencovaný neuroendokrinní nádor) se vyskytují u nemocných signifikantně starších. NEN stupně I a II (tedy typický a atypický karcinoid) jsou nejčastěji lokalizovány v hlavních a lobárních bronších, přibližně třetina je lokalizována na periferii (častěji u atypického karcinoidu). Podle toho, zda jsou schopny vyvolávat klinicky manifestní endokrinní projevy, je dělíme na funkčně aktivní a neaktivní [1].
Klasifikace neuroendokrinních nádorů
Neuroendokrinní nádory plic jsou v 90 % funkčně (hormonálně) neaktivní, na rozdíl od GIT lokalizace. Jsou rozděleny na čtyři skupiny, od dobře a středně diferencovaných neuroendokrinních nádorů (typický karcinoid, atypický karcinoid) až po velmi agresivní nízce diferencované karcinomy (velkobuněčný neuroendokrinní karcinom – large-cell neuroendocrine carcinoma – LCNEC) a malobuněčný karcinom (small-cell carcinoma – SCLC). Jednotlivé typy NEN se mezi sebou liší lokalizací, biologickým chováním, klinickým obrazem, způsobem diagnostiky a léčebnými přístupy. Typický karcinoid a malobuněčný plicní karcinom jsou dva krajní póly ve škále NEN plic. Tvoří zcela odlišné, jasně vymezené a nezaměnitelné jednotky s velmi dobrou prognózou a pětiletým přežíváním více než 90 % na jedné straně u typického karcinoidu a s velmi špatnou prognózou a mizivým procentem pětiletého přežití kolem 2 % na straně druhé u malobuněčného karcinomu. Mezi ostatními skupinami již tak ostré hranice nejsou, zejména co se týká biologického chování, odpovědi na protinádorovou léčbu a prognózy. Existuje „šedá zóna“ v přesné diagnostice a predikci biologického chování asi nejvíce mezi atypickým karcinomem a velkobuněčným neuroendokrinním nádorem, mezi velkobuněčným neuroendokrinním nádorem a malobuněčným karcinomem a v některých případech i mezi typickým a atypickým karcinoidem. Složitost dané problematiky je patrná i v tom, že ač je typický karcinoid nádorem s nízkým maligním potenciálem a velmi příznivou prognózou, v době diagnózy jsou až v 9 % přítomny metastázy v regionálních uzlinách a ve 4 % jsou dokonce přítomny vzdálené metastázy nebo dochází k jejich pozdějšímu vzniku. U atypického karcinoidu je uváděno postižení regionálních uzlin až v 36 % případů a vzdálené metastázy bývají přítomny až u 26 % nemocných. U velkobuněčného neuroendokrinního a malobuněčného karcinomu je postižení regionálních lymfatických uzlin uváděno v 60–80 % a vzdálené metastázy minimálně ve 40 % případů [1–3].
Diagnostika neuroendokrinních nádorů
Diagnostika se opírá o patomorfologickou charakteristiku, imunohistochemické vyšetření a průkaz neuroendokrinní diferenciace. Mikroskopicky prokazujeme přítomnost neurosekrečních granul. Imunohistochemicky prokázaná pozitivita TTF-1 (thyroid transcription factor 1) potvrzuje primární původ v plicích. Chromogranin, synaptofyzin, CD56 a neurospecifická enoláza patří ke specifickým neuroendokrinním markerům, které lze vyšetřovat ve tkáních a kromě CD56 i v séru. V současnosti je třídění plicních NEN definováno na podkladě histologické klasifikace založené na mikroskopickém obrazu, počtu mitóz, přítomnosti a typu nekróz. Vyšetřením plicního resekátu je tedy nádor klasifikován a zařazen do jedné ze skupin s poměrně uspokojivou přesností [3,4]. Typický karcinoid dle současně platné WHO klasifikace patří mezi neuroendokrinní nádory (neuroendokrinní tumor – NET) stupně I. Tyto nádory jsou dobře diferencovány, v mikroskopickém obraze mají organoidní vzhled a vytváří trabekulární rozetovité formace, nejsou v nich přítomny nekrózy a počet mitóz /2 mm2 je < 2. Starší klasifikace atypického karcinoidu dnes patří do skupiny neuroendokrinního nádoru stupně II, jedná se o středně diferencované nádory s fokální přítomností nekróz [5]. V mikroskopickém obraze je popisován méně organoidní vzhled než u stupně I, je přítomna pleiomorfie a atypie jádra, počet mitóz se pohybuje od 3 do 10 /2 mm2. Velkobuněčný neuroendokrinní karcinom je dnes řazen do skupiny neuroendokrinních karcinomů (již ne nádor, ale karcinom) stupně III. Tyto karcinomy se vyznačují nízkou diferenciací, v mikroskopickém obrazu chybí organoidní uspořádání, je přítomna výrazná pleiomorfie buněk a vysoký poměr jádro/cytoplazma, počet mitóz v NET III je > 10/2 mm2 jak pro velkobuněčný neuroendokrinní, tak pro malobuněčný karcinom, který je rovněž řazen do stejné skupiny neuroendokrinních karcinomů stupně III, a jediné, co ho odlišuje od velkobuněčného neuroendokrinního karcinomu, je nízký poměr jádro/cytoplazma. Nepřesnost v diagnostice, a tím v odhadu biologického chování a prognózy může nastat, pokud je k vyšetření používán materiál cytologický nebo z malých histologických vzorků z mikroexcizí při bronchoskopickém vyšetření. Proliferační index Ki-67, udávající podíl proliferujících nádorových buněk, je používán jako standard u digestivních NEN k jejich lepší diferenciaci. U NEN plic se proto také doporučuje jeho přidání jako dalšího parametru k lepší predikci biologického chování nádoru a stratifikaci prognostických skupin. Jeden z navrhnutých klasifikačních systémů zahrnujících i proliferační index Ki-67 se dále opírá o počet mitóz a přítomnost nekróz. Pro NET I musí být splněny dva ze tří parametrů: mitózy do 2/2 mm2, nepřítomnost nekróz a Ki-67 < 4. Pro NET II následující parametry: počet mitóz 2–47, nekrózy ≤ 10 % a Ki-67 4–25. Pro NET III (velkobuněčný neuroendokrinní a malobuněčný karcinom) je počet mitóz > 47, nekrózy > 10 % a Ki-67 ≥ 25. Na rozdíl od karcinomu plic se u neuroendokrinního plicního nádoru kromě morfologických metod ke stanovení rozsahu onemocnění používají i tzv. molekulární nebo funkční metody. Kombinace jednotlivých metod pak zvyšuje specifitu a senzitivitu vyšetření [6]. Histologické vyšetření získáváme pomocí bronchoskopie a zejména operace. Klinický obraz plicního neuroendokrinního nádoru zahrnují recidivující bronchopneumonie, kašel a hemoptýzy. V případě sekrece vazoaktivních peptidů (serotonin, bradykinin, tachykinin, histamin, substance P, prostaglandin, kalikrein atd.) jsou za klinický obraz odpovědné tyto substance, ale v případě plicních karcinoidů je jejich produkce poměrně vzácná. Skiagram hrudníku může zobrazovat perifernější, ostře ohraničené okrouhlé zastínění u NEN I a II, podobně CT. Dvě třetiny, zejména NEN I, rostou intrabronchiálně na úrovni hlavních a lobárních bronchů a přibližně třetina, zejména NEN II, je lokalizována periferněji v plicním parenchymu. Pokročilé karcinomy NEN stupně III jsou většinou lokalizovány centrálně s invazivním růstem a infiltrací do mediastina a jeho struktur [7].
Terapie neuroendokrinních nádorů
Dobře a středně diferencované NEN exprimují na buněčném povrchu somatostatinové receptory (SSTR), především typu 2 a 5. Toho se standardně využívá k hybridnímu vyšetření s využitím analogů SSTR (nejčastěji oktreotidu) v kombinaci s fotonovou emisní výpočetní tomografií (single-photon emission computed tomography – SPECT) a nízkodávkovanou výpočetní tomografií („low-dose“ CT). Potvrzení pozitivity SSTR je prediktorem některých léčebných postupů (analogy SSTR nebo peptidová radionuklidová receptorová terapie). V souvislosti s personalizovanou léčbou se diskutuje teranostika v nukleární medicíně, což je spojení diagnostiky a následné léčby NEN pomocí otevřených zářičů. Původně neradioaktivní peptid (analog oktreotidu, oktreotátu) je navázán na chelát a diagnostický nuklid galium (Ga). Pokud je oktreotid ochotně vychytáván nádorovými buňkami, je vysoce pravděpodobné, že u tohoto nádoru bude účinná radionuklidová peptidová receptorová terapie. Jako radionuklid je možné použít lutecium nebo ytrium, které působí jako otevřený beta-zářič, a pomocí chalátu jeho navázání na peptid, který má přímou afinitu k somatostatinovému receptoru [8]. Tato terapie by měla být indikována u pokročilých inoperabilních NEN stupně I a II s vysokou expresí SSTR, nízkou proliferační aktivitou (Ki-67 < 20 %) anebo nezvladatelnými symptomy z hormonální hypersekrece. V naší zemi není v současnosti tato metoda k dispozici, ale ve výjimečných případech lze tuto léčbu podstoupit na etablovaných pracovištích v zahraničí (Německo, Nizozemsko) po schválení úhrady pojišťovnou nebo s úhradou samotného pacienta. Jedná se ale o paliativní metodu, která zmírní symptomy nemoci, prodlouží přežívání, ale nevede k dlouhodobému vyléčení [9,10]. U dobře a středně diferencovaných neuroendokrinních nádorů je indikováno chirurgické řešení v případě operability. Je nutno zdůraznit, že i u dobře diferencovaných nádorů je indikován stejný rozsah plicní resekce s hilovou a mediastinální lymfadenektomií jako u nemalobuněčných plicních karcinomů. Lokalizace typického karcinoidu bývá často ve velkých dýchacích cestách a vynutí si někdy komplikovanější chirurgické zákroky, vč. resekce bronchů, bronchoplastik apod. [11]. U dobře a středně diferencovaných NEN plic je u přísně intraluminálně rostoucích nádorů indikována endobronchiální léčba a další sledování vč. pravidelných bronchoskopií. V některých případech se nedaří radikální resekce nádoru, ale pokud mechanicky nebo funkčně způsobuje symptomy, je nutná i jeho částečná resekce s ponecháním rezidua nádoru. Totéž platí o jaterních metastázách NEN, kdy jejich resekce nebo termoablace může výrazně zmírnit symptomy onemocnění a prodloužit přežívání [12]. Adjuvantní léčba u radikálně odstraněných nádorů stupně I a II není rutinně doporučována, navrhuje se pouze sledování. U nízce diferencovaných NEN III (SCLC a LCNEC) je ale situace opačná, u tohoto typu není chirurgická léčba rutinně prováděna, jen pokud je nádor výjimečně zachycen v nízkém klinickém stadiu a jedná se často o operace diagnostické a diagnosticko-kurativní. U tohoto typu NEN III ale vždy musí následovat adjuvantní chemoterapie a ozařování i přes nízké pooperační stadium. V pokročilém stadiu jsou tyto nádory NEN III léčeny systémovou chemoterapií a ozařováním. Zatímco u LCNEC je doporučena kombinace platinového derivátu s cytostatikem třetí generace jako u NSCLC, u SCLC je dosahováno zatím nejlepšího léčebného efektu kombinací platinového derivátu s etoposidem [13]. Léčba somatostatinovými analogy má symptomatický efekt tím, že blokáda SSTR zmírňuje symptomy vyvolané sekrecí hormonů a především serotoninu. U somatostatinových analog byl prokázán i jejich protinádorový efekt, takže by měla být tato léčba zvažována u pokročilých progredujících NEN plic stupně I a II s pozitivním oktreoscanem a karcinoidním syndromem. Pokročilé neuroendokrinní nádory stupně I a II pro svou chemorezistenci a radiorezistenci nejsou primárně vhodné k systémové chemoterapii nebo ke klasické radioterapii. V posledních letech bylo dosaženo úspěchu v léčbě v případě pokročilosti těchto nádorů využitím cílené biologické léčby [14]. Jedná se o m-TOR (mammalian target of rapamycin) inhibitor – everolimus, který byl zkoušen v klinické studii fáze III – RADIANT-4. V této randomizované, placebem kontrolované studii bylo prokázáno statisticky významné prodloužení doby do progrese u nemocných s pokročilým nefunkčním gastroenteropankreatickým a plicním NEN stupně I a II. Primárním cílem studie byla doba do progrese (time to progression – TTP). Medián TTP byl podle nezávislého radiologického hodnocení 11,01 měsíce (95% CI; 9,2–13,3) u pacientů, kteří dostávali everolimus, ve srovnání s 3,9 měsíce (95% CI, 3,6–7,4) u pacientů, kteří dostávali placebo (HR 0,48, 95%CI; 0,35–0,67). Everolimus zlepšil medián TTP o 5,6 měsíce a byl spojen s 50% snížením rizika progrese nebo úmrtí onemocnění. Podle hodnocení zkoušejícího byl medián TTP 13,8 měsíce (95% CI; 9,3–22,2) u pacientů, kteří dostávali everolimus, ve srovnání s 3,5 měsíce (95% CI, 1,9–5,6) u pacientů, kteří dostávali placebo (HR 0,23, 95% CI; 0,13–0,41). U více pacientů, kteří dostávali everolimus (57,9 %), došlo ke zmenšení nádoru ve srovnání s těmi, kteří dostávali placebo (13,0 %). V České republice je tento lék registrován, ale úhrada pro pokročilé nefunkční neuroendokrinní nádory plic stupně I a II nebyla dosud stanovena, je nutno žádat pojišťovnu.
Případ pacienta s typickým karcinoidem (NET stupně I)
Na našem pracovišti začal být v červenci roku 2010 vyšetřován pro dechové potíže 59letý muž, kuřák, dosud anamnesticky sledovaný jen pro poruchou glukózové tolerance. Pacient byl odeslán k plicnímu vyšetření pro rok se zhoršující námahovou dušnost, dráždivý kašel a intermitentní hemoptýzy. Na zadopředním i levém bočním skiagramu hrudníku nebyla zjištěna patologie, pro udávanou hemoptýzu byla indikována bronchoskopie, při které byl zjištěn pružný, mírně undulující červený nádorový útvar v hlavním bronchu vlevo, na mediální stěně, 3 cm pod hlavní karinou. Následovalo CT vyšetření hrudníku (obr. 1, 2), kde byl vlevo v průběhu hlavního bronchu patrný široký přisedlý polyp 12 mm vysoký, redukující průsvit levého hlavního bronchu na 10–20 %. Při CT vyšetření byla provedena i 3D rekonstrukce virtuální bronchoskopie (obr. 3, 4), pomocí které můžeme sledovat postupné řezy zobrazení v jednotlivých etážích bronchiálního větvení, tak jak mohou být patrny i při klasické bronchoskopii. Histologická klasifikace odebraného materiálu z bronchoskopie provedené v červenci 2010 byla vyhodnocena jako typický karcinoid. Byl doplněn oktreotidový scan, při kterém bylo provedeno planární vyšetření a SPECT krku, hrudníku, břicha a pánve za 3 a 24 a 48 hod po aplikaci. Druhý den vyšetření bylo patrno menší nevýrazné ložisko v levém hlavním bronchu za jeho odstupem, ostatní sledované oblasti byly bez abnormální distribuce radiofarmaka. Vzhledem k endobronchiálnímu nálezu a symptomům bylo nejprve provedeno laserové ošetření nádoru. Velká část nádoru byla snesena mechanicky + laser (byla použita špice rigidního instumentária, kleště, laser minim. 6×, energie 40 W). V říjnu 2010 následovala u pacienta operace cestou thorakotomie, během operace byl příčně naříznut levý hlavní bronchus v místě očekávaného tumoru, peroperačně ale nebyly zjištěny známky nádoru, proto bylo pomocí bronchoskopu označeno místo vymezující rozsah resekce. Následně bylo resekováno 25 mm části levého hlavního bronchu, po mobilizaci okrajů byla provedena anastomóza a současně provedena mediastinální lymfadenektomie. Makroskopicky byl získán resekát bronchu délky 27 mm a průměru 15 mm. V centru resekátu byl zastižen ovoidní tumor, opouzdřený, velikosti 10 × 8 × 11 mm. Tumor infiltroval stěnu bronchu, z části prominoval do lumen. Mikroskopicky byl potvrzen typický karcinoid, všechny odebrané lymfatické uzliny (celkem 15) byly bez postižení nádorem, patologem byl histopatologický nález hodnocen jako pT1pN0, ale dle původní lokality karcinoidu 3 cm distálně od bifurkační kariny v levém hlavním bronchu byla správná klasifikace pT2 i přes malý rozměr nádoru vzhledem k jeho centrální lokalitě. Pacient byl nadále sledován. V lednu 2013 byla zjištěna elevace chromograninu A na hodnotu 196 µg/l (norma ≤ 50 µg/l), po dobu předchozího sledování byla tato hodnota vždy v normálním rozmezí. Následně byl proveden oktreotidový scan, CT vyšetření hrudníku a horní části břicha a bronchoskopie, nebyla zjištěna patologie, pacient byl nadále sledován. Vyšetření byla opakována s odstupem 3 měsíců pro trvale zvýšenou hodnotu nádorového markeru (chromogranin A 233 µg/l). Při dalším CT vyšetření hrudníku vč. břicha se v retroperitoneu zobrazila expanzivní léze parakaválně v úrovni vtoku renálních žil velikosti 55 × 35 × 62 mm, centrálně bylo přítomno nízké sycení, celý útvar komprimoval vena cava inferior (obr. 5). Oktreotidový scan koreloval s CT nálezem, jinde aktivita zjištěna nebyla. V říjnu 2013 byla provedena exstirpace tohoto patologického infiltrátu z retroperitonea, makroskopicky se jednalo o expanzi 50 × 50 × 62 mm, histologicky se jednalo dle aktuální klasifikace o neuroendokrinní tumor stupně II (v klinickém korelátu byla patologem připuštěna možná metastáza původního typického karcinoidu). Na CT před operací byly popisovány četnější uzliny podél cév retroperitonea a v mezenteriu obvyklého CT obrazu do velikosti 12 × 6 mm, jejich negativita byla potvrzena histologicky. Pacient byl nadále sledován bez systémové léčby. Hladina chromograninu se po odstranění ložiska z dutiny břišní zcela normalizovala. Pacient byl bez potíží až do listopadu 2018, kdy u něj začaly bolesti břicha pod mečíkem a došlo opět k významnému nárůstu hladiny chromograninu na 841,9 µg/l (v té době bylo nové referenční rozmezí s normou 0–85 µg/l). Při CT vyšetření hrudníku a břicha byla zjištěna progrese zvětšení lymfatických uzlin – v okolí kovových klipů byly patrny zvětšené kulovité uzliny s nekrotickým středem, obklopující pravou ledvinnou žílu, místy splývající, v rozsahu cca 41 × 43 mm, v tomto terénu byla patrná jedna nápadně se sytící kulovitá léze 13 mm, zde byl nález radiologicky hodnocen jako možná recidiva neuroendokrinního tumoru. Nově byla popsána i ložiska obou nadledvin a suspektní cirkulární rozšíření stěny bulbu duodena, byly patrny drobné hypodenzity jater do 5 mm a byla zjištěna osteolytická léze pravého pediklu třetího hrudního obratle, suspektně i levého pediklu dvanáctého hrudního a prvního bederního obratle. Při planárním oktreotidovém scanu vč. SPECT krku, hrudníku, břicha a pánve za 4 a 24 hod po aplikaci byla diagnostikována vícečetná ložiska patologicky zvýšené aktivity ve skeletu – v pravostranných výběžcích třetího krčního obratle, v těle sedmého hrudního obratle, v pravostranném pediklu třetího bederního obratle, ve ventrální části lopaty kosti kyčelní vlevo, v diafýze pravého femuru, dále byla zjištěna patologicky zvýšená aktivita v uzlině velikosti 22 × 11 mm uložené mezi aortou a vena cava inferior v úrovni těla druhého bederního obratle. Nálezy byly hodnoceny jako metastatické postižení skeletu, lymfatických uzlin retroperitonea i možné jaterní metastázy (dle CT velikostně pod rozlišovací schopnost scintigrafického vyšetření) při generalizaci neuroendokrinního nádoru, s výraznou elevací chromograninu. U nemocného byla zahájena terapie somatostatinovými analogy (SSA) – sandostatinem – a současně pravidelná aplikace denosumabu pro metastatické postižení skeletu a v březnu 2019 byla provedena paliativní zevní radioterapie na oblast postižení krční a hrudní páteře. V současné době je pacient nadále na aktivní léčbě SSA a denosumabem. Při této léčbě dochází k poklesu hladiny chromograninu na 260, nález v dutině břišní se výrazněji nemění, neprogreduje. Pacient je nadále v dobrém klinickém stavu.
Image 1. Transverzální CT hrudníku. 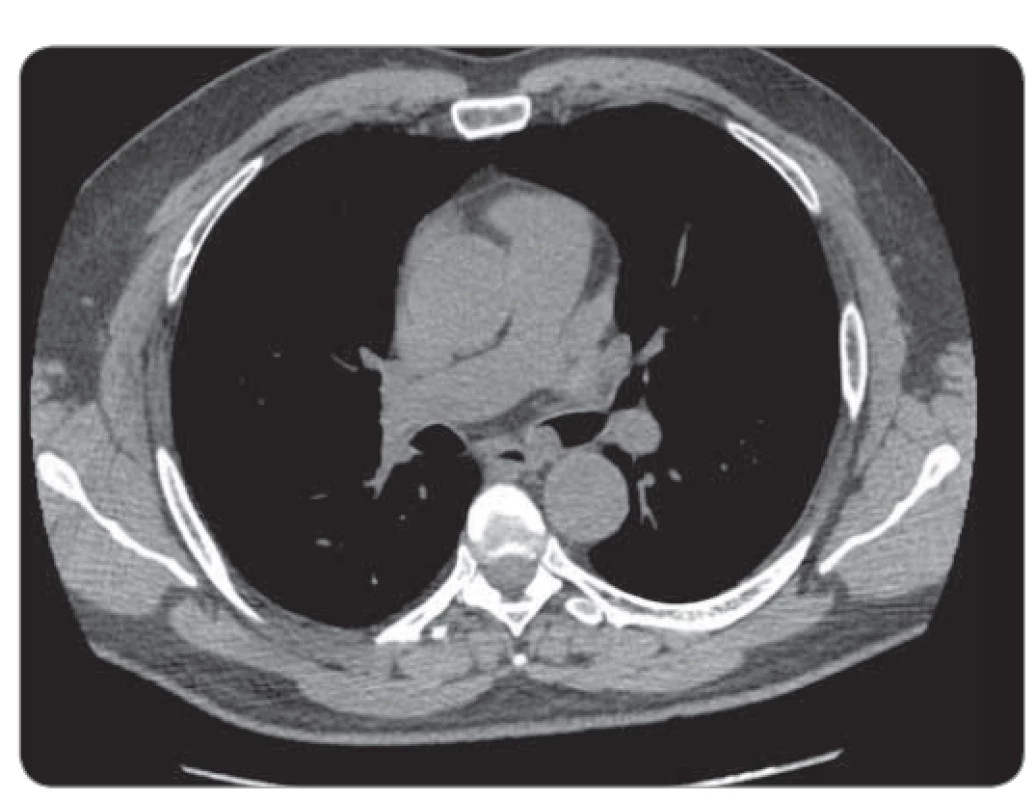
V místě levého bronchu je patrná patologická ostře ohraničená hmota. Image 2. Detail patologie na CT – karcinoid vyrůstající v levém hlavním bronchu. 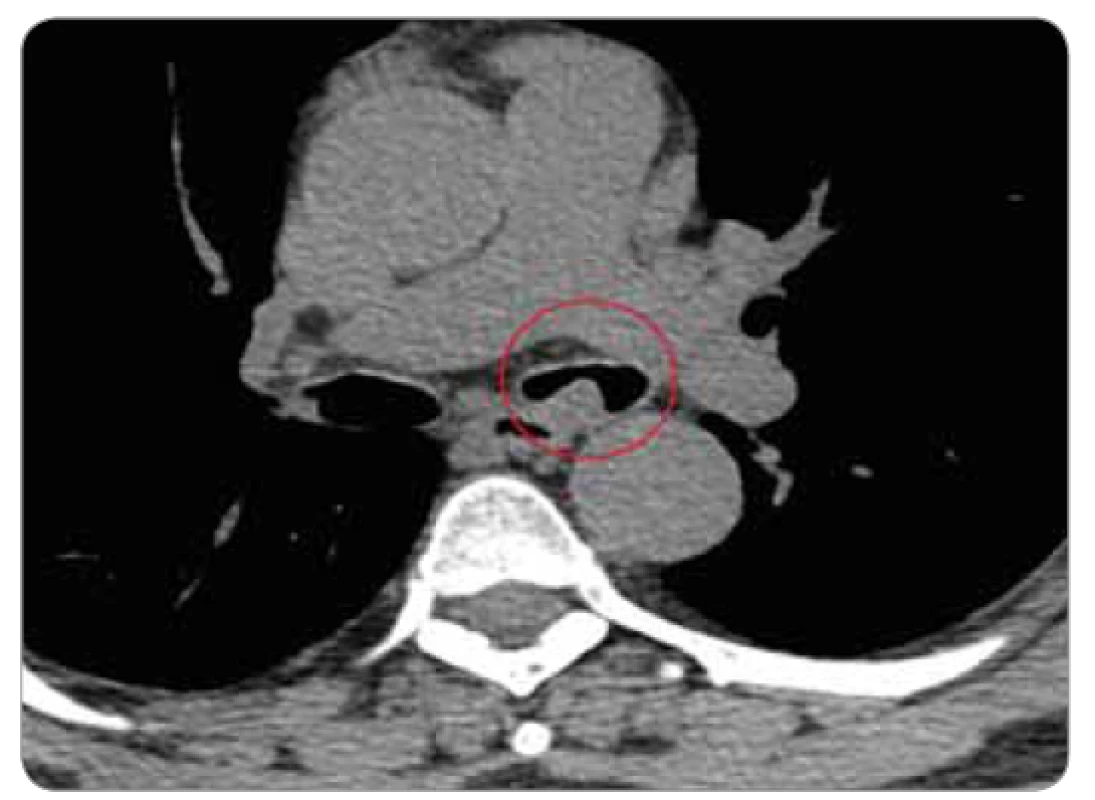
Image 3. 3D-rekonstrukce CT virtuální bronchoskopie. 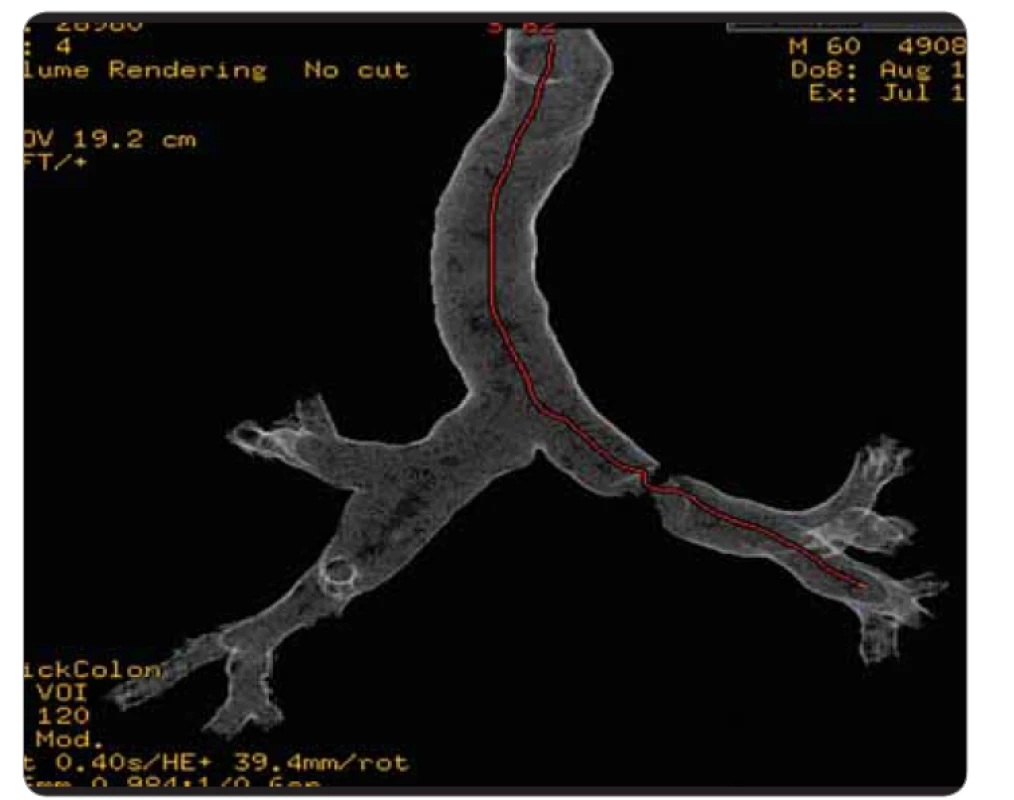
Image 4. Pohled na hlavní bifurkační karinu a do obou hlavních bronchů. Vlevo je patrná obturace patologickou tkání. 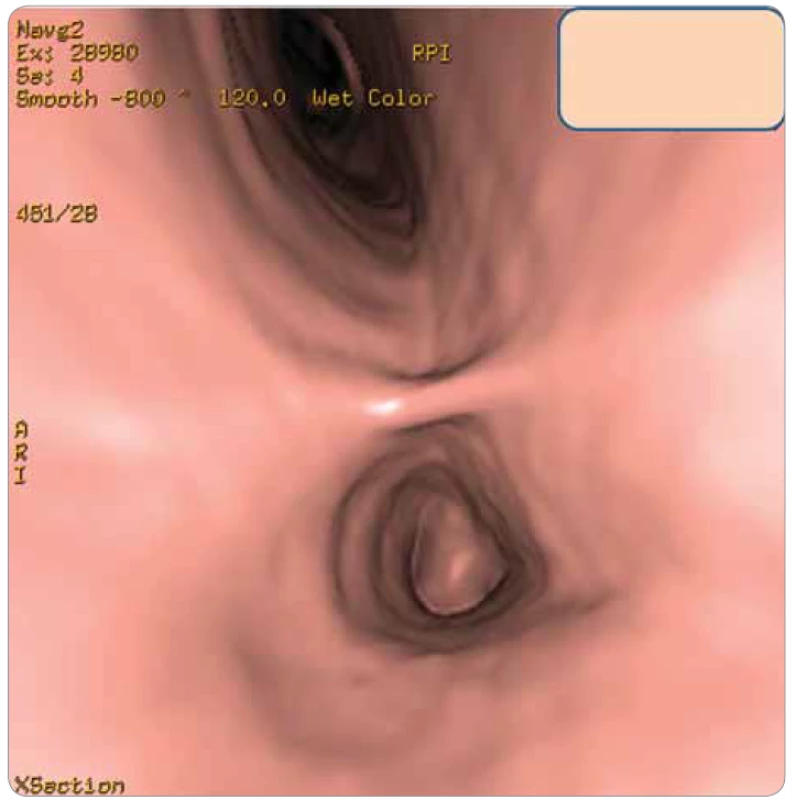
Image 5. CT břicha. 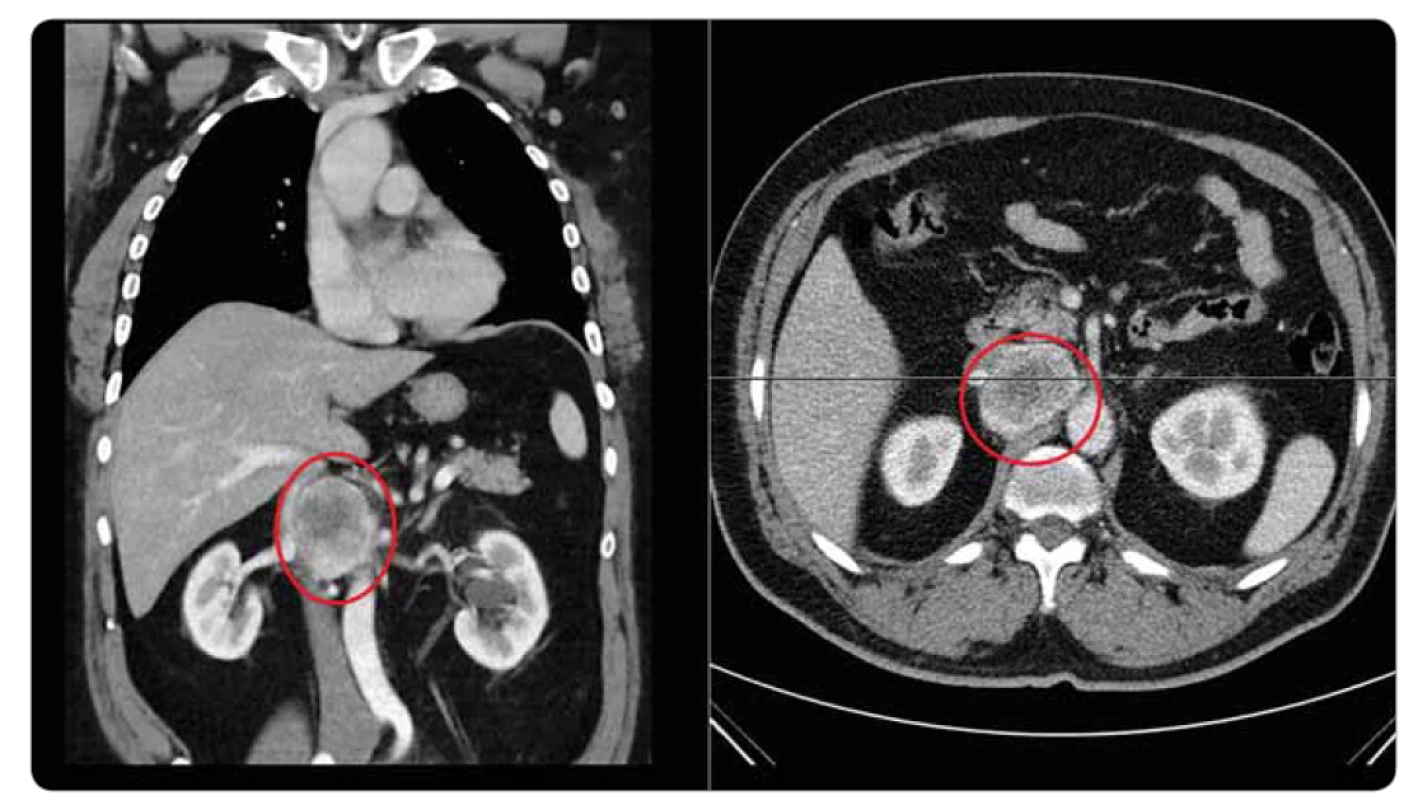
Expanzivní léze parakaválně v úrovni vtoku renálních žil vel. 5 × 50 × 62 mm, komprimující vena cava inferior. Diskuze k případu
Nemocný byl v době diagnózy v odpovídající věkové kategorii nad 50 let s nejčastější incidencí neuroendokrinních nádorů, měl poměrně typickou anamnézu kašle a opakovaných hemoptýz bez jednoznačného RTG korelátu, příčinu potíží rychle objektivizovalo bronchoskopické vyšetření. U plicních neuroendokrinních nádorů má bronchoskopické vyšetření zcela nezastupitelnou roli vzhledem k časté lokalizaci NEN na úrovni lobárních a hlavních bronchů, což byl i případ našeho pacienta. U dobře diferencovaného NEN rostoucího jen endobronchiálně může být jako definitivní léčebná možnost využita bronchoskopická intervence se snesením tumoru a dalším sledováním [12]. U našeho pacienta mohl být endobronchiální nález ještě opakovaně ošetřován laserem, ale toto řešení se nejevilo jako zcela dostačující a hrozilo riziko tepelného poškození bronchiální stěny a vznik pneumomediastina. Byla indikována radikální resekce pro nejednoznačný nález rozsahu postižení stěny hlavního bronchu, ačkoli dle CT byla mimobronchiální invaze vyloučena. Během operace při naříznutí hlavní stěny bronchu operatérem nebylo jednoznačně makroskopicky možné určit postiženou oblast bronchu, proto byl na operační sál povolán broncholog a ten byl schopen sterilním bronchoskopem přesně označit postiženou část lumen hlavního bronchu. Následovala resekce části hlavního bronchu a anastomóza obou okrajů hlavního bronchu – bronchoplastika. Další sledování nemocného bylo pomocí bronchoskopických kontrol, odběrů chromograninu a zobrazovacích metod po dobu téměř 3 let bez pozoruhodností. Kvůli laboratornímu zvýšení chromograninu bylo pátráno po možné recidivě a ta byla po opakovaném vyšetření zjištěna mimo hrudník v oblasti retroperitonea v blízkosti vena cava inferior. Byla provedena resekce tumoru histologicky odpovídající NET stupně II, původně tumor resekovaný z hrudníku koreloval s typickým karcinoidem, tedy NET stupně I dle aktuální klasifikace. Je možné usuzovat, že došlo k určité transformaci tohoto typu NET u pacienta a zvýšení maligního potenciálu metastázy původního neuroendokrinního nádoru stupně I na stupeň II. V obou případech byl k dispozici dostatek tkáně k histologickému vyšetření. Pacient přežívá 9. rokem od doby diagnózy, s první recidivou po 3 letech a další již inoperabilní recidivou po dalších 5 letech od zjištění první metastázy. Onkologickou systémovou léčbu podstupuje až od ledna 2019 s dosud trvajícím dobrým efektem. V případě progrese je plánováno požádání o zvýšenou úhradu na everolimus.
Závěr
Neuroendokrinní nádory představují značně heterogenní skupinu s různou prognózou, výrazně se horšící se stupněm diferenciace. Typický karcinoid je sice nádorem s nízkým maligním potenciálem a poměrně příznivou prognózou, ale až v 9 % jsou v době diagnózy přítomny metastázy v regionálních uzlinách, ve 4 % jsou dokonce přítomny vzdálené metastázy nebo dochází k jejich pozdějšímu vzniku. To snižuje přežívání nemocných s typickým karcinoidem z 90 na 27 % [15–17]. U dobře diferencovaných neuroendokrinních nádorů je nezanedbatelné riziko metastazování i přes jejich radikální odstranění, proto je nutná a zcela namístě jejich dispenzarizace.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Lenka Jakubíková
Klinika nemocí plicních
a tuberkulózy
FN Brno
Jihlavská 20
625 00 Brno
e-mail: babilen@seznam.cz
Obdrženo/Submitted: 26. 11. 2019
Přijato/Accepted: 11. 1. 2020
Sources
1. Sedláčková E, Bajčiová V et al. Neuroendokrinní nádory, 1. vydání. Praha: Maxdorf 2016 : 180–199.
2. Pelosi G, Sinzogni A, Harari S. Classification of pulmonary neuroendocrine tumors: new insights. [online]. Available from: https: //www.ncbi.nlm.nih.gov/pmc/articles/PMC5653522/.
3. Travis W, Brambilla E, Burke A et al. WHO classification of tumours of the lung, pleura, thymus and heart. 4th Ed. Lyon: IARC Press 2015.
4. Travis WD, Brambilla E, Nicholson AG et al. The 2015 World Health Organization classification of lung tumors: Impact of genetic, clinical and radiologic advances since the 2004 classification. J Thorac Oncol 2015; 10 (9): 1243–1260. doi: 10.1097/JTO.0000000000000630.
5. Caplin ME, Baudin E, Ferolla P et al. Pulmonary neuroendocrine (carcinoid) tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann Oncol 2015; 26 (8): 1604–1620. doi: 10.1093/annonc/mdv041.
6. Hendifar AE, Marchevsky AM, Tuli R. Neuroendocrine tumor sof the lung: Current challenges and advances in the diagnosis and management of well-differential disease. J Thorac Oncol 2017; 12 (3): 425–436. doi: 10.1016/j.jtho.2016.11.2222.
7. Tomíšková M, Jakubíková L, Kadlec B. Neuroendokrinní plicní nádory. [online]. Dostupné z: https: //onkologickarevue.cz/cs/neuroendokrinni-plicni-nadory.
8. Tomíšková M, Venclíček O, Skřičková J. Karcinoid plic. In: Základy moderní pneumoonkologie. 2. rozš. vyd. Praha: Maxdorf 2017 : 393–403.
9. Sedláčková E, Bajčiová V et al. Neuroendokrinní nádory. 1. vyd. Praha: Maxdorf 2016 : 156–163.
10. Papamichail DG, Exadaktylou PE, Chatzipavlidou VD. Neuroendocrine tumors: Peptide receptors radionuclide therapy (PRRT). Hell J Nucl Med 2016; 19 (7): 75–82.
11. HoražďovskýP, Hytych V, Hromádka P. Chirurgická léčba neuroendokrinních nádorů plic. In: Neuroendokrinní nádory plic a mediastina. Praha: Maxdorf 2014 : 93–115.
12. Venclíček O, Tomíšková M, Skřičková J. Karcinoid plic. In: Základy moderní pneumoonkologie. Praha: Maxdorf 2012 : 336–345a.
13. Kadlec B, Skřičková J. Léčba malobuněčného karcinomu plic. In: Základy moderní pneumoonkologie. Praha: Maxdorf 2012 : 203–211.
14. Fazio N, Buzzoni R, Dekke Fave G et al. Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4) lung subgroups analysis. Cancer Sci 2018; 109 (1): 174–181. doi: 10.1111/cas.13427.
15. den Bakker MA, Thunnissen FB. Neuroendocrine tumours-challenges in the diagnosis and classification of pulmonary neuroendocrine tumours. J Clin Pathol 2013; 66 (10): 862–869. doi: 10.1136/jclinpath-2012-201310.
16. Travis WD. Advances in neuroendocrine lung tumors. Ann Oncol 2010; 21 (Suppl 7): vii65 – vii71. doi: 10.1093/annonc/mdq380.
17. Kunz PL. Carcinoid and neuroendocrine tumors: building on success. J Clin Oncol 2015; 33 (16): 1855–1863. doi: 10.1200/JCO.2014.60.2532.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 4-
All articles in this issue
- Integrovaná diagnostika difúzních gliomů
- Úloha CDK12 v rozvoji nádorů
- Zhubné nádory krčka maternice v gravidite
- Role exozomů u nádorových onemocnění
- Nemoc těžkých řetězců imunoglobulinu gama
- Hematologická toxicita u IMRT/VMAT v kurativní léčbě análního karcinomu
- Atypický průběh typického karcinoidu plic
- Karcinom děložního hrdla v graviditě
- Akademická studie XR-TEMinDREC – kombinace konkomitantní neoadjuvantní chemoradioterapie následované lokální excizí operačním rektoskopem a akcelerovanou dispenzarizací u pacientů s mírně pokročilými stadii nízce sedícího adenokarcinomu konečníku a její průběh v MOÚ
- Efektivita blokády pektorálneho nervu typu II oproti torakálnej paravertebrálnej blokáde v analgézii po operácii tumoru prsníka
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zhubné nádory krčka maternice v gravidite
- Integrovaná diagnostika difúzních gliomů
- Atypický průběh typického karcinoidu plic
- Nemoc těžkých řetězců imunoglobulinu gama
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

