Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
:
Mikuš Kuracinová Kristína; Janega Pavol; Janegová Andrea; Čierna Zuzana
:
Ústav patologickej anatómie, LF UK a UN, Bratislava
:
Klin Onkol 2018; 31(3): 167-177
:
Reviews
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko2018167
Východiská:
Nádory vychádzajúce z neuroendokrinných buniek sú definované ako epitelové neoplázie s predominantne neuroendokrinnou diferenciáciou. Ide o samostatnú skupinu nádorov s charakteristickou histologickou stavbou a funkčnými vlastnosťami vyskytujúcimi sa na rôznych miestach v organizme, najmä v oblasti gastrointestinálneho systému (67 %) a pľúc (25 %). Aj keď ide obyčajne o pomaly rastúce nádory s indolentným priebehom, takmer všetky z nich majú malígny potenciál. Väčšina z nich má schopnosť tvoriť aktívne hormonálne látky. Spektrum klinických príznakov je rôznorodé, mnohé sú typické pre konkrétnu lokalitu neuroendokrinného nádoru. Aj keď tieto nádory poznáme > 130 rokov, koncept týkajúci sa klasifikácie stále nie je jednotný.
Cieľ:
Prehľadová práca poskytuje v úvodnej časti ucelený pohľad na neuroendokrinný systém človeka a nádory z neho vychádzajúce od ich objavenia až po v súčasnosti platnú terminológiu a klasifikácie. V druhej časti je pozornosť upriamená na nádory z endokrinných buniek gastrointestinálneho traktu, na ich klinickú symptomatológiu, makroskopický a mikroskopický obraz s dôrazom na ich klasifikáciu, diagnostické kritériá pri určovaní gradingu a TNM (tumour, node, metastasis) stagingu nádorov a na špecifiká v jednotlivých lokalitách zažívacieho traktu.
Záver:
Nádory z neuroendokrinných buniek predstavujú zriedkavé ochorenia, ktoré sa môžu klinicky prejaviť typickým obrazom karcinoidného syndrómu. Väčšia časť nádorov je však asymptomatických, čo spolu s ich obyčajne malými rozmermi a lokalitou v oblastiach čreva ťažko dostupných endoskopickému vyšetreniu často vedie k diagnostike v pokročilom štádiu ochorenia. Základom úspešnej diagnostiky a liečby nádorov vychádzajúcich z neuroendokrinných buniek je myslieť na ne v rámci diferenciálne-diagnostického postupu s exaktnou histopatologickou klasifikáciou, gradingom a stagingom podľa presne stanovených kritérií a najnovších klasifikácií a odporúčaní. V literatúre aj v odbornej verejnosti sa často používajú pojmy karcinoid, neuroendokrinný nádor, neuroendokrinní tumor či neuroendokrinný karcinóm synonymicky, no z hľadiska názvoslovia a klasifikácie je potrebné si osvojiť správnu terminológiu.
Kľúčové slová:
gastrointestinálne neuroendokrinné neoplázie – neuroendokrinné nádory – neuroendokrinné karcinómy – klasifikácia – NET – NEC
Úvod
Neuroendokrinný systém človeka je tvorený bunkami so spoločnými vlastnosťami buniek nervového aj endokrinného systému s dôležitou regulačnou úlohou, so schopnosťou vylučovať peptidové hormóny [1,2]. Neuroendokrinné bunky sa vyskytujú difúzne v mnohých orgánoch a tkanivách a sú súčasťou tzv. difúzneho neuroendokrinného systému (diffuse neuroendocrine system – DNES), v minulosti označovaného APUD systém (amine precursor uptake and decarboxylation) [3]. Napriek neustále pokračujúcemu výskumu zostávajú tieto bunky v mnohých ohľadoch záhadné a oprávnene aj v súčasnosti vzbudzujú pozornosť histopatológov. Ide o bunky s nejasným embryonálnym pôvodom, nespochybniteľným neural-like fenotypom a schopnosťou vylučovať na základe rôznych stimulov peptidové hormóny do krvi s dopadom na celý organizmus, prípadne je ich hormonálna aktivita limitovaná na okolie bunky [2]. Názov buniek vychádza z pôvodnej predstavy, že pochádzajú embryologicky z neurálnej lišty. Táto domnienka bola už koncom minulého storočia spochybnená a v súčasnosti sa predpokladá, že bunky majú endodermálny pôvod [2]. Z praktického hľadiska používajú všetky klasifikácie pri opise týchto buniek termín „neuroendokrinný“ vzhľadom na ich fenotyp a funkčné vlastnosti.
Nádory vychádzajúce z neuroendokrinných buniek sa môžu vyskytovať vo všetkých lokalitách, kde sú fyziologicky tieto bunky prítomné. Okrem typických lokalít (gastrointestinálny trakt (GIT), bronchopulmonálny systém) boli opísané aj v jazyku [4], v močovo-pohlavnom systéme vrátane obličiek [5], prostaty [6,7], ovárií [8,9], prsníka [10,11] a maternice [12,13]. Vo všeobecnosti ide o pomaly rastúce tumory s malígnym potenciálom, so špecifickými biologickými a klinickými charakteristikami, a práve pre ich rôznorodosť je ich správna diagnostika náročná a často zdĺhavá [14].
Reálna incidencia nádorov z neuroendokrinných buniek nie je známa, väčšina z nich pravdepodobne uniká diagnóze počas života pacienta [15]. Podrobne sa incidencii venujú Leoncini et al v jednotlivých štátoch Európy na základe analýzy publikovaných štúdií a v USA na základe databázy SEER (Surveillance, Epidemiology, and End Results) [16]. Celosvetovo sa incidencia dobre aj nízko diferencovaných nádorov z neuroendokrinných buniek zvyšuje vo väčšine anatomických miest [16].
Od histórie po súčasnosť
Od objavenia neuroendokrinných nádorov (neuroendocrine tumors – NETs) až po ich zjednotenie a klasifikáciu prešlo viac ako 130 rokov. Keď Paul Langerhans objavil v roku 1869 pankreatické ostrovčeky, bol pravdepodobne prvý, kto popísal normálne endokrinné bunky [17]. V roku 1870 si nemecký fyziológ Rudolf Heidenhain ako prvý všimol a opísal prítomnosť gastrointestinálnych buniek v sliznici čreva, ktoré boli svojou štruktúrou a správaním odlišné od oxyntických a enterických buniek. Podobné bunky popísal v roku 1897 aj ruský histológ a anatóm Nikolai Kultschitzky [17]. Je zrejmé, že podobné nálezy boli opisované rôznymi patológmi od roku 1867, avšak neboli uznané za samostatnú jednotku [17]. V roku 1907 Carmelo Ciaccio zaviedol pojem enterochromafinné pri popisovaní týchto buniek [18]. V tom istom roku Siegfried Oberndorfer ako prvý použil termín „karcinoid“. Zavedením názvu karcinoid sa snažil odlíšiť tieto zdanlivo benígne lézie od malígnych adenokarcinómov [18]. V roku 1914 chirurg Antonin Gosset a patológ Pierre Masson použili techniku impregnácie striebrom na preukázanie vlastností buniek karcinoidov a predpokladali, že môžu vznikať z enterochromafinných buniek (Kultschitzkeho buniek) intestinálnej sliznice [17]. Hoci si Oberndorfer spočiatku myslel, že sa jedná o benígne lézie, o dve dekády neskôr zmenil svoj názor na ich biologické správanie na základe nálezu metastatických ložísk. Jeho nový objav odpublikovaný v tureckom jazyku unikal väčšej pozornosti takmer celé storočie [17]. V roku 1924 Seale Harris ako prvý opísal inzulinóm a endogénny hyperinzulinizmus a o pár rokov neskôr jeho kolegovia popísali glukagónový syndróm. Robert Zollinger a Edwin Ellison popísali po prvýkrát gastrinóm v roku 1955 [17]. Postupne boli objavované a popisované ďalšie neuroendokrinné syndrómy. V roku 2013 Jens Rehfeld et al popísali syndróm zo zvýšeného vylučovania cholecystokinínu [19].
V roku 1963 sa začala používať schéma rozdelenia nádorov vychádzajúcich z neuroendokrinných buniek podľa rôznych úsekov embryonálneho čreva na nádory predného (foregut – pľúca, žalúdok, duodénum, pankreas, žlčník), stredného (midgut – jejunum, ileum, apendix, pravá časť hrubého čreva) a zadného (hindgut – ľavá časť hrubého čreva, rektum) čreva, ktorá poukazovala na vzťah morfológie a topografie ich výskytu [20]. V roku 1995 taliansky patológ Carlo Capella et al publikovali ďalšiu klasifikáciu, v ktorej navrhovali zmenu názvu karcinoidný tumor na NET, zahrňujúci všetky nádory vychádzajúce z neuroendokrinných buniek [21]. V súčasnosti sú platné WHO (World Health Organization) klasifikácie pre gastrointestinálne NETs z roku 2010 [22], pre NETs pľúc z roku 2015 [23] a najnovšia pre NETs pankreasu z roku 2017 [24].
Terminológia a klasifikácia
Terminológia nádorov vychádzajúcich z neuroendokrinných buniek sa niekoľkokrát menila a ani v súčasnosti nie je jednotná pre celú skupinu nádorov. Názvoslovie a klasifikácia týchto nádorov sa odlišuje v závislosti od ich anatomickej lokality [25–27].
Európska spoločnosť neuroendokrinných nádorov (European Neuroendocrine Tumor Society – ENETS) vydala v roku 2016 zatiaľ posledné odporúčania pre diagnostiku, liečbu a menežment pacientov s gastrointestinálnymi NETs [28]. Pre klasifikáciu a stanovenie gradingu odporúčajú opierať sa o WHO klasifikáciu 2010, ktorá prijala gradingový systém zavedený spoločnosťou ENETS.
WHO klasifikácia gastroenteropankreatických nádorov z roku 2010 (tab. 1) používa pre celú skupinu nádorov názov neuroendokrinné neoplázie (gastroenteropancreatic neuroendocrine neoplasms – GEP-NENs) [22] a zahŕňa nádory pažeráka, žalúdka, tenkého a hrubého čreva vrátane ampulárnej oblasti a apendixu, nádory rekta, pankreasu, žlčníka a extrahepatálnych žlčových ciest. Táto klasifikácia priniesla striktnejšie pravidlá na rozdelenie NENs na základe morfológie a proliferačnej aktivity na NETs a neuroendokrinné karcinómy (neuroendocrine carcinomas – NECs). Spomínaná WHO klasifikácia síce pripúšťa, že termín „neuroendokrinná neoplázia“ sa môže používať synonymicky s názvom NET, no keďže NETs predstavujú konkrétnu podskupinu nádorov, budeme pre lepšiu prehľadnosť tento názov používať len v súvislosti s nimi. Okrem čistých NENs rozoznáva WHO klasifikácia aj zmiešané adenoneuroendokrinné karcinómy (mixed adenoneuroendocrine carcinoma – MANEC), v ktorých každá komponenta tvorí > 30 % tumoru. Opísané sú aj dlaždicovobunkové karcinómy koexistujúce s NEC [29]. V tab. 1 je porovnanie rôznych WHO klasifikácií NENs gastrointestinálneho systému.
![Porovnanie WHO klasifi kácií gastrointestinálnych neuroendokrinných neoplázií [22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/cc8e808e3c8b5d74197aa9d511fed185.jpeg)
WHO klasifikácia 2010 predkladá 3-stupňový grading NENs GIT vrátane pankreasu navrhnutý spoločnosťou ENETS na konferenciách v Ríme v rokoch 2005 [30] a 2006 [31]. Grading vychádza z morfologických kritérií a proliferačnej aktivity nádorových buniek stanovenej počtom mitóz a proliferačným indexom Ki-67 (tab. 2). V prípade, ak by došlo k rozporu medzi danými ukazovateľmi, stanovuje sa vyšší grading [32].
![Grading gastrointestinálnych neuroendokrinných neoplázií [22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/4572e1c65f09e5820a84dee4b49ad7fb.jpeg)
* Mitózy sa počítajú v mitoticky najaktívnejších oblastich, pri zväčšení 40x,v 10 HPF (high power fields) = 2 mm2, pričom je potrebné pozorne zhodnotiť minimálne 50 HPF podľa AJCC alebo 40 HPF podľa UICC.
** Proliferačný index Ki-67 udáva percento pozitívnych buniek z 500–2000 buniek v proliferačne najaktívnejších oblastiach (tzv. hot spots) [33].
Výsledky viacerých štúdií poukázali, že spomínaný grading v prípade pankreatických NENs (PanNENs) nekoreluje úplne s odpoveďou na liečbu a prežívaním pacientov, najmä v skupine nízko diferencovaných pankreatických NEC (PanNECs). Na základe týchto štúdií bola aktualizovaná klasifikácia PanNENs, ktorá je súčasťou novej WHO klasifikácie nádorov endokrinných orgánov z roku 2017 [24]. Najdôležitejšou zmenou je rozdelenie PanNECs G3 na dve skupiny. Prvú skupinu predstavuje nová kategória nádorov PanNETs G3, ktoré si zachovávajú dobre diferencovaný histologický vzor so zvýšenou mitotickou aktivitou a Ki-67 > 20 %. Druhú skupinu tvoria nádory zodpovedajúce morfológiou a proliferačnou aktivitou PanNECs podľa WHO klasifikácie 2010. Pri odlíšení týchto dvoch skupín nádorov je možné využiť imunohistochemické vyšetrenie, pre skupinu nádorov PanNETs G3 je typická strata expresie markerov DAXX a ATRX, pre nádory PanNECs strata expresie Rb a abnormálna expresia p53 [33]. Ďalšia zmena sa týka hranice Ki-67 medzi PanNETs G1 a G2, ktorá bola vo WHO klasifikácii 2010 ≤ 2 %, v klasifikácii 2017 sa hranica posunula na Ki-67 < 3 %, aby boli zahrnuté aj hodnoty medzi 2 a 3 %, aj keď pôvodne sa uvažovalo o posunutí hranice až na 5 %. Tretia zmena nastala v premenovaní skupiny zmiešaných adenoneuroendokrinných nádorov. Keďže ne-neuroendokrinná zložka môže byť iná ako adenokarcinóm, zaviedol sa pojem “zmiešaná neuroendokrinná – ne-neuroendokrinná neoplázia“, (mixed neuroendocrine – non-neuroendocrine neoplasm – MiNEN) [24].
ENETS navrhla prvý TNM stagingový systém pre NETs, ktorý bol prijatý na konferencii v Ríme v roku 2005 pre nádory žalúdka, duodéna a pankreasu [30] a v roku 2006 pre nádory ilea, apendixu, hrubého čreva a rekta [31]. Spomínaný systém bol čiastočne akceptovaný 7. vydaním TNM klasifikácie malígnych nádorov UICC (Union for International Cancer Control) a AJCC (American Joint Committee on Cancer). V súčasnosti je platné už 8. vydanie TNM klasifikácie UICC aj AJCC [34,35] so samostatnými kapitolami venovanými NETs G1 a G2 žalúdka, duodéna a ampulárnej oblasti, jejuna, ilea, apendixu, hrubého čreva, rekta a pankreasu. NEC G3 sa klasifikujú podľa kritérií TNM systému pre karcinómy príslušného orgánu. Oproti 7. vydaniu TNM klasifikácie nastali niektoré zmeny, pričom 8. vydanie AJCC a UICC akceptovalo TNM klasifikáciu navrhnutú spoločnosťou ENETS pre väčšinu orgánov, rozdiely sú len v T štádiách nádorov žalúdka a apendixu. Porovnanie T klasifikácií AJCC/UICC a ENETS je uvedené v tab. 3 so zvýraznením rozdielov medzi nimi. Na záver histopatologickej správy je potrebné uviesť použitú TNM klasifikáciu a vysvetliť, na základe ktorých faktorov bolo určené T štádium (veľkosť nádoru, rozsah invázie), aby bolo možné sa zorientovať medzi rôznymi klasifikáciami [1]. ENETS odporúča pre určenie stagingu vychádzať buď z TNM klasifikácie UICC/AJCC alebo ENETS, za najlepšie považuje použitie oboch klasifikácií [36].
![Porovnanie T štádií TNM klasifikácie pre NETs G1 a G2 žalúdka a apendixu podľa AJCC/UICC [34,35] a ENETS [30,31].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3d1f57bb6b7a67fc3c5dcfa76eb58c67.jpeg)
Všeobecná histopatologická a imunohistochemická charakteristika NENs
NENs sú často malé nádory žltej, žltohnedej až šedej farby, prekryté intaktnou alebo ulcerovanou sliznicou. V GIT vznikajú hlboko v sliznici, pomaly prerastajú všetky vrstvy sliznice, čoho dôsledkom je vznik malých tuhých uzlíkov prominujúcich do lúmenu orgánu. Žlté zafarbenie je spôsobené ukladaním cholesterolu a iných tukov. Po infiltrácii submukózy, lamina muscularis propria a serózy môžu nádory prerastať do okolitého tkaniva (napr. mezentéria). V prípade agresívnych tumorov sú časté metastázy do okolitých lymfatických uzlín a vzdialené metastázy hlavne do pečene a dutiny brušnej [37].
Histologicky sú NETs G1 (obr. 1, 2) charakterizované polygonálnymi bunkami s malým kompaktným, uniformným jadrom s jemne zrnitým chromatínom charakteru „salt and pepper“, obyčajne nenápadným jadierkom a s malým až stredným množstvom eozinofilnej cytoplazmy. Mitózy takmer chýbajú (< 2/10 HPF (high-power field)), zriedka sa vyskytuje angioinvázia, nekrózy nebývajú prítomné. Elektrónovo-mikroskopicky sú pozorovateľné denzné granuly, ktoré obsahujú aktívne amíny a/alebo neuropeptidy.
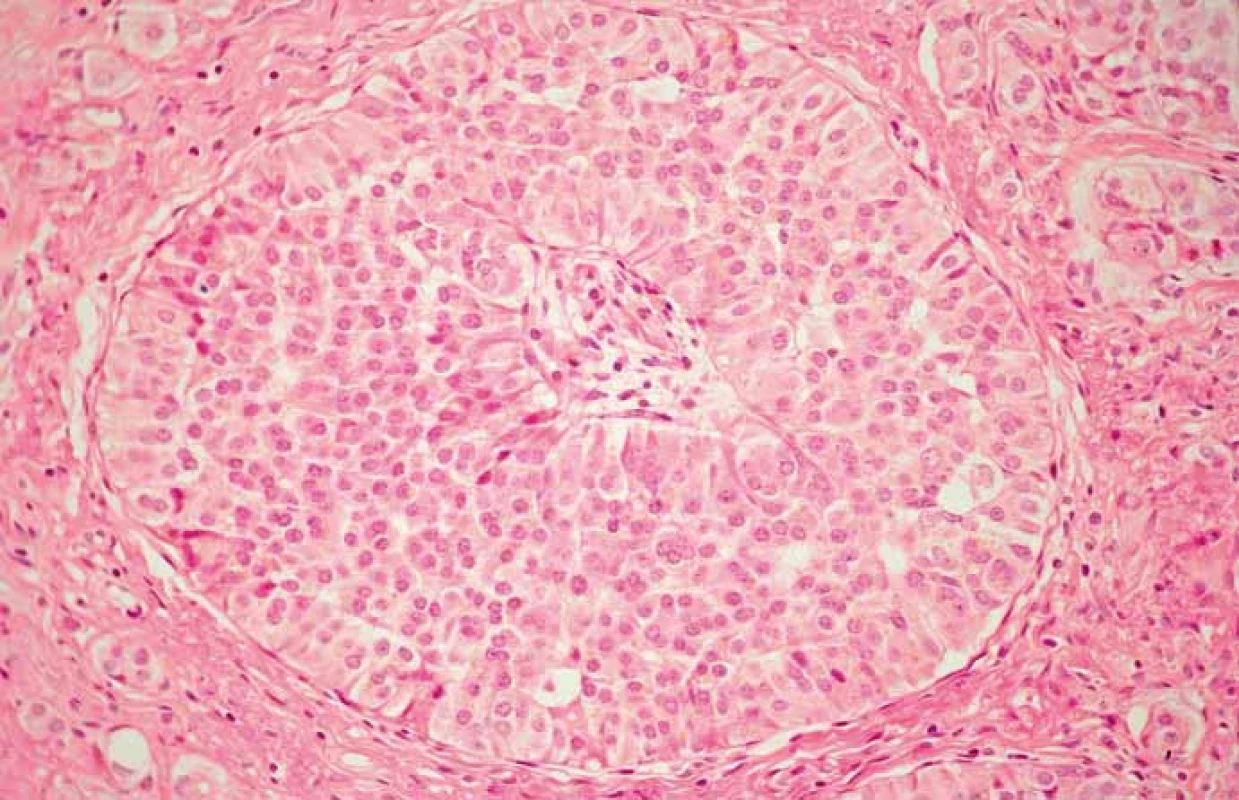
NETs G2 (obr. 3, 4) sú tvorené okrúhlymi až vretenovitými bunkami buď s veľkými vezikulárnymi jadrami a prominentnými eozinofilnými jadierkami alebo s menšími hyperchrómnymi jadrami s nepravidelným hrudkovitým chromatínom a malými jadierkami. Mitózy sú početnejšie (2–20/10 HPF), môžu byť aj atypické a ojedinele sa vyskytujú nekrózy.

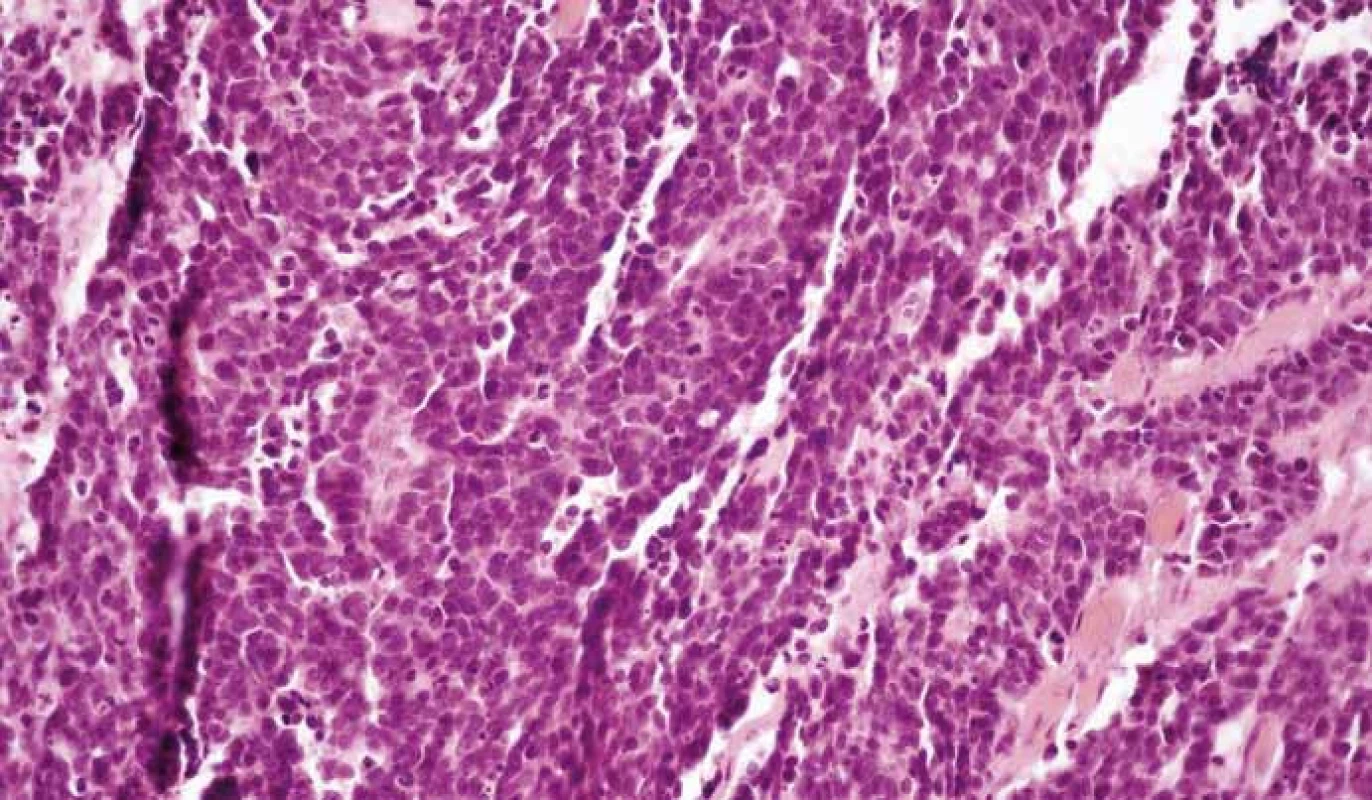
NECs (obr. 5, 6) sú vysoko malígne, nízko diferencované G3 nádory pozostávajúce z anaplastických okrúhlych, polyhedrických až vretenovitých buniek. Mitózy su početné (> 20/10 HPF), nekrózy sú rozsiahle a často multifokálne. Na základe veľkosti buniek a jadrových charakteristík sa NECs delia na malobunkový a veľkobunkový podtyp. Malobunkové karcinómy pozostávajú z malých okrúhlych, ovoidných alebo vretenovitých buniek s malým množstvom cytoplazmy. Jadrá obsahujú jemne zrnitý chromatín, bez viditeľných jadierok alebo len s nenápadnými jadierkami. Veľkobunkové NECs sú všeobecne tvorené strednými až veľkými bunkami s nepravidelným atypickým jadrom a prominentnými jadierkami. Jadrovo-cytoplazmový pomer je menší ako v prípade malobunkových karcinómov [29,38,39].
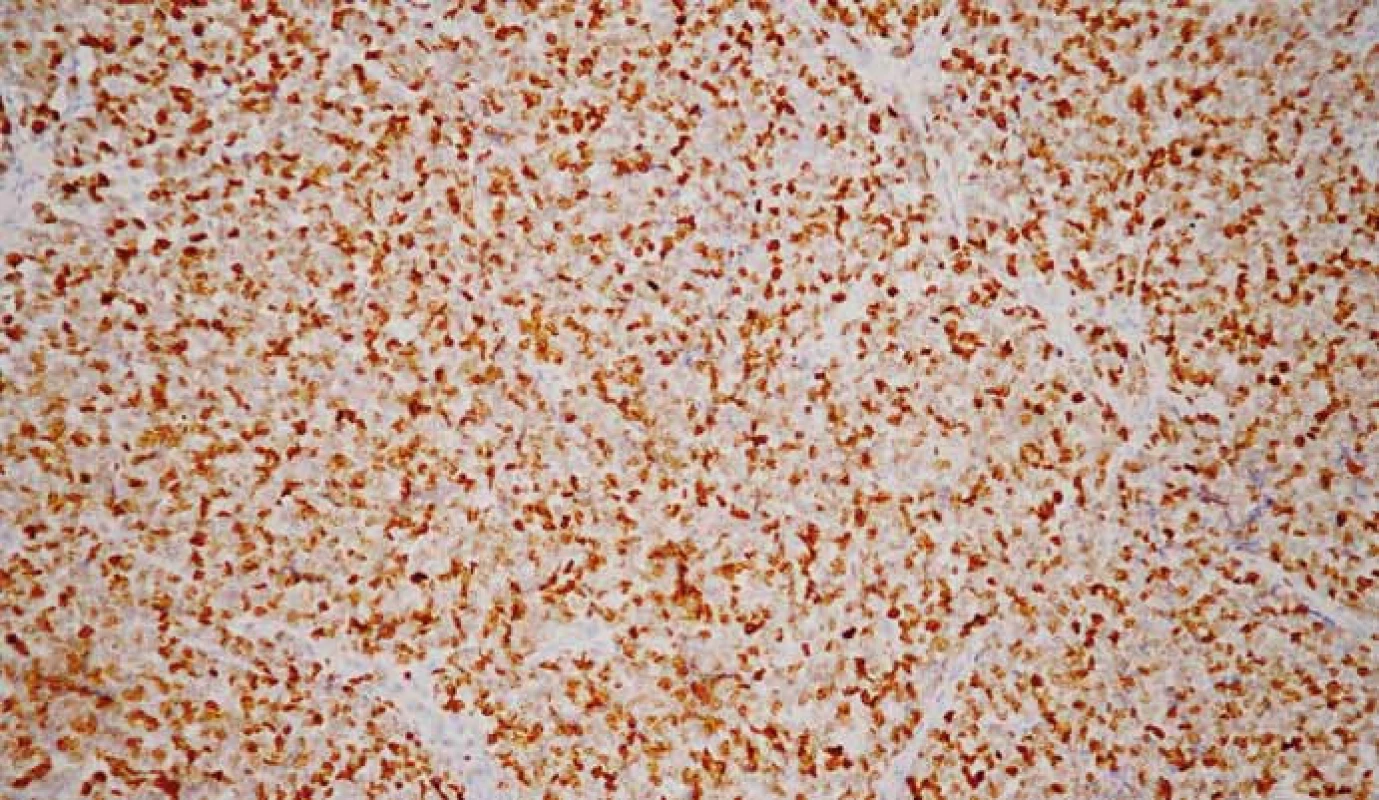
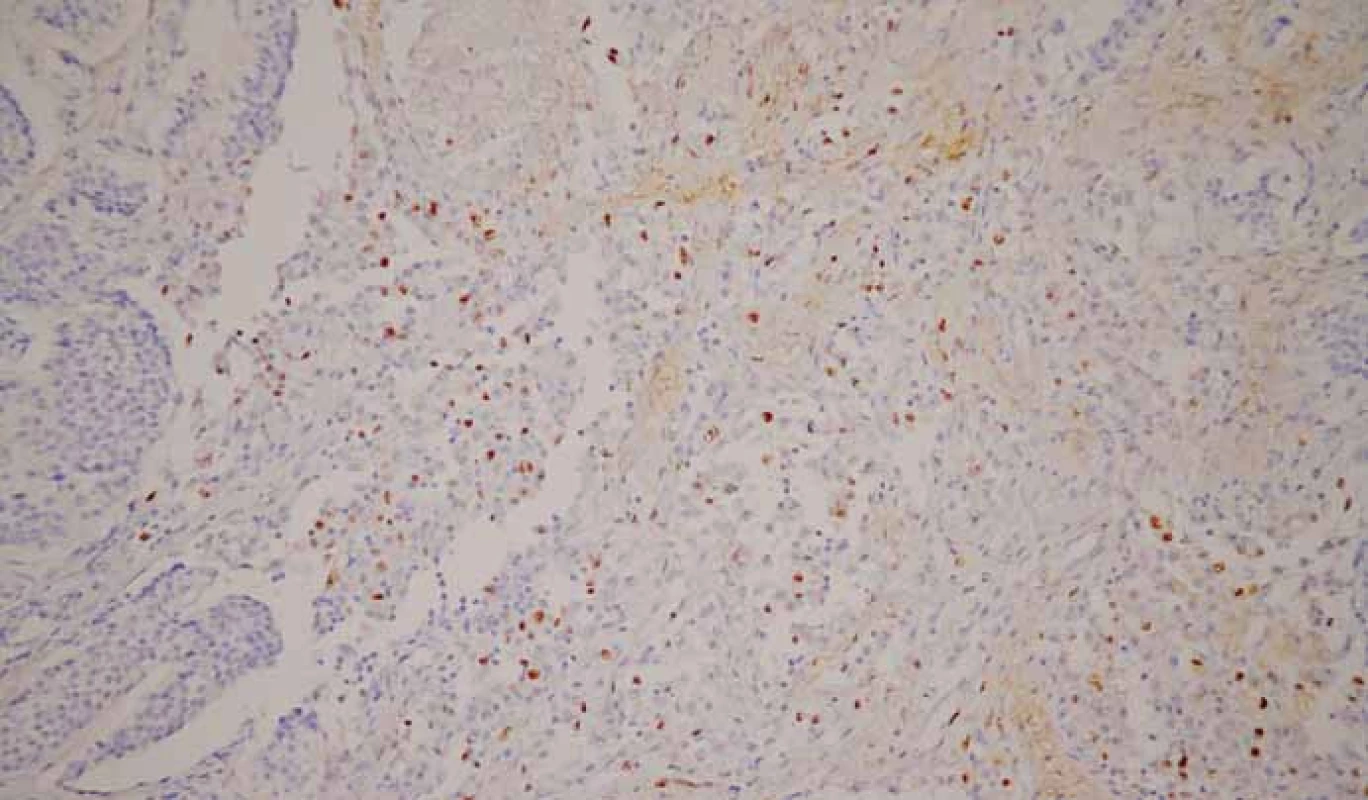
Pre nádory vychádzajúce z neuroendokrinných buniek je charakteristická imunohistochemická pozitivita markerov typických pre neuroendokrinnú diferenciáciu, ako sú chromogranín A (obr. 7), synaptofyzín (obr. 8), CD56 (neural cell adhesion molecule – NCAM1), neurón-špecifická enoláza (neuron-specific enolase – NSE) a PGP9.5 (protein gene product 9.5) [40]. Okrem toho sú tieto nádory schopné produkovať rôzne proteíny v závislosti od typu buniek a ich lokality, napr. serotonín, gastrín, somatostatín, pankreatický polypeptid, ghrelín. Expresiu spomínaných proteínov môžeme taktiež dokázať imunohistochemickými metódami.
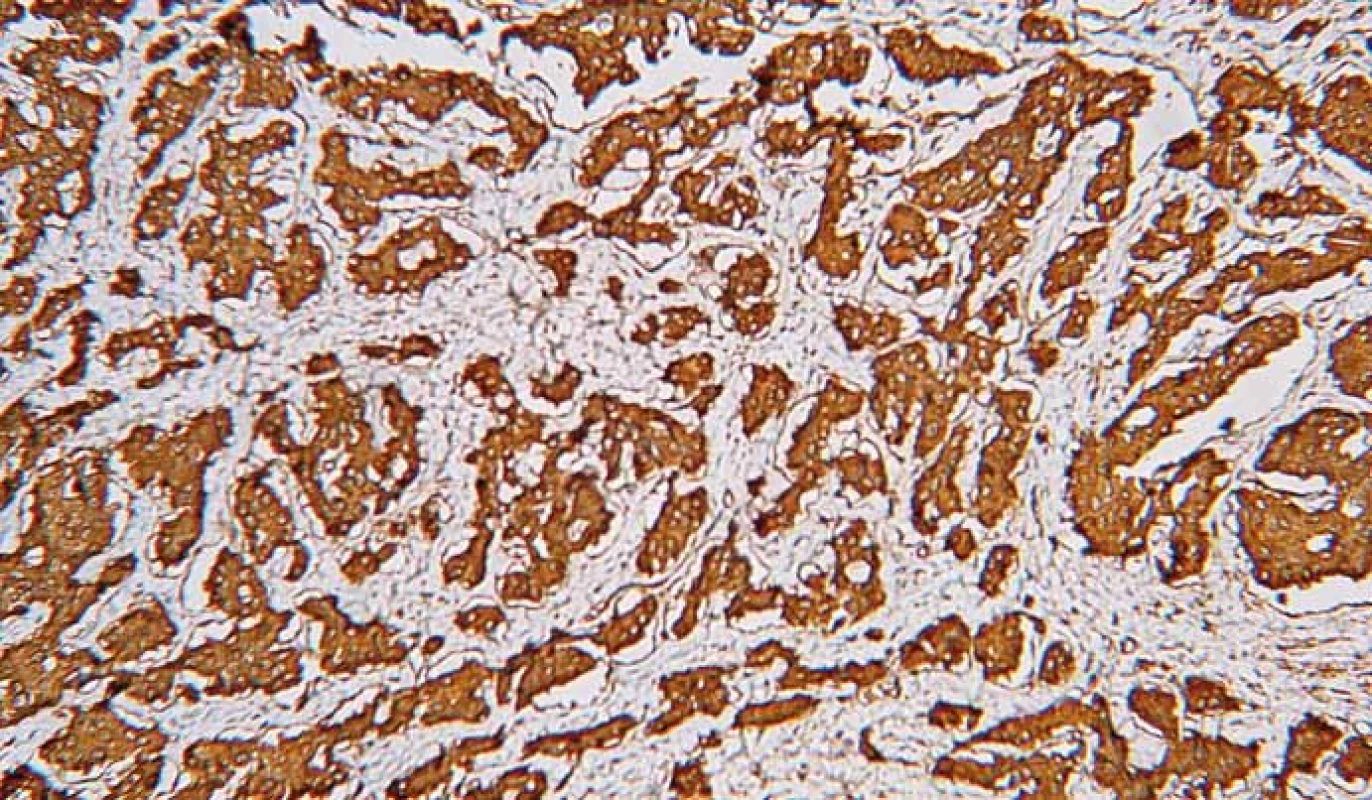
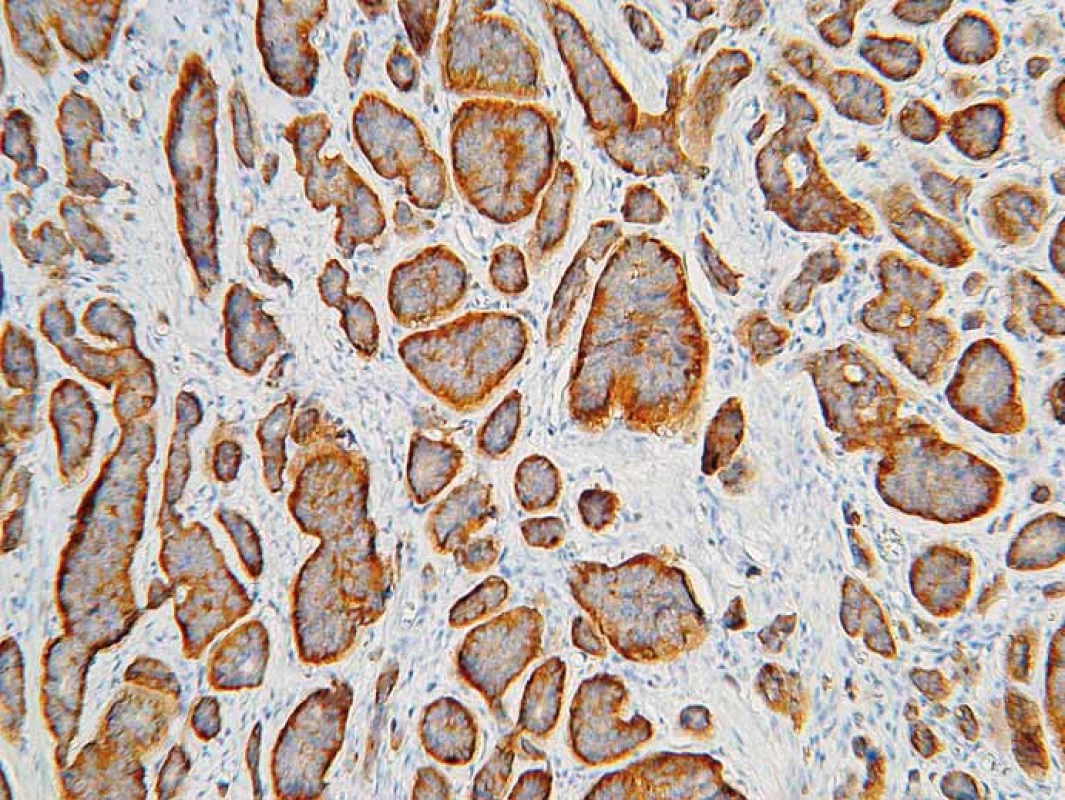
Klinická manifestácia NENs
Typickým prejavom zvýšeného vylučovania peptidových hormónov z nádorov z neuroendokrinných buniek je skupina príznakov nazývaných karcinoidný syndróm. Za normálnych okolností dokáže pečeň pomerne rýchlo zmetabolizovať peptidové hormóny vylúčené týmito nádormi, čo však neplatí v prípade ich metastatického rozsevu do pečene. Prejavuje sa u 8–35 % pacientov a je často asociovaný s prítomnosťou NET G1 (karcinoidu) v tenkom čreve [41]. Karcinoidný syndróm vzniká účinkom serotonínu a iných vazoaktívnych látok, ktoré vstupujú do systémovej cirkulácie a ovplyvňujú pečeňový metabolizmus [42,43].
Karcinoidný syndróm zahŕňa rôzne príznaky. Opakujúce sa bolesti brucha sa najčastejšie objavujú pri karcinoidoch tenkého čreva. Kožné prejavy sú pomerne včasný a častý príznak (94 %). Typicky sa prejaví v oblasti hlavy a krku, je sprevádzaný nepríjemným pocitom tepla, svrbením, opuchom a erytémom hornej časti tela, zvýšeným slinením a slzením. Hnačka a malabsorbcia sa prejavujú až v 84 %. Stolice sú objemné, penivé alebo je prítomná steatorrhea. Tento stav môže a nemusí byť spojený s bolesťou brucha, návalmi a kŕčmi. Až v 60 % môže dôjsť k srdcovej chybe na trikuspidálnej chlopni, fibróze endokardu, pulmonálnej stenóze. Piskoty alebo asthma-like syndrome sa objavujú v 25 % v dôsledku bronchiálnej konstrikcie, čo neskôr môže vyústiť až do chronického kašľa a dyspnoe [44]. Funkčné PanNETs majú svoj vlastný špecifický klinický obraz (tab. 4) [1]. Klinický obraz NETs bez príznakov karcinoidného syndrómu je pomerne nešpecifický. Stanovenie vhodného diagnostického a terapeutického postupu si vyžaduje medziodborovú spoluprácu onkológov, endokrinológov, rádiológov, chirurgov a patológov.
![Príznaky najčastejších neuroendokrinných nádorov pankreasu [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a40ecdbaefc7fdfc381a596248a9fe48.jpeg)
NENs jednotlivých častí GIT
GEP-NENs predstavujú geneticky rôznorodú skupinu nádorov produkujúcich peptidové a ne-peptidové hormóny koordinujúce funkciu čriev. Tieto nádory môžu byť klinicky symptomatické, „funkčné“ alebo tiché, „nefunkčné“ [45]. V GIT existuje najmenej 13 typov neuroendokrinných buniek produkujúcich bioaktívne peptidy alebo amíny [42]. Tvorba jednotlivých hormónov je často závislá od lokalizácie primárneho nádoru (tab. 5).
![Produkcia hormónov v závislosti od lokalizácie nádoru [47].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/977d0e65caec32fa57026bf606fd3c3d.jpeg)
Dáta z prieskumov hovoria o stúpajúcej incidencii NETs, čo môže byť aj dôsledkom zlepšenia a spresnenia diagnostických metód [46]. Najčastejšie NETs G1 (karcinoidy) v mužskej populácii nachádzame v tenkom čreve, v oblasti terminálneho ilea, u žien v apendixe [47]. Kým vo všeobecnosti majú dobre diferencované NETs skôr indolentný priebeh, nízko diferencované NECs sú charakteristické svojou agresivitou a skorým metastázovaním.
NENs pažeráka
NENs pažeráka sú pomerne vzácne a zriedkavé nádory, s incidenciou 0,05–7,6 % zo všetkých malignít pažeráka [48]. Tieto nádory rastú prevažne v dolnej tretine pažeráka, často sú asociované s Baretovým ezofágom [49]. Väčšina NENs pažeráka sú NECs G3 alebo zmiešané adenoneuroendokrinné karcinómy [22]. Celkovo sa považujú za nádory s agresívnym správaním a zlou prognózou.
NENs žalúdka
Žalúdočné NENs boli v minulosti považované za nádory s pomerne nízkym výskytom, predstavovali < 2 % zo všetkých gastrointestinálnych NENs a < 1 % zo všetkých nádorov žalúdka. V dôsledku zvýšeného počtu gastroskopických vyšetrení stúpa záchyt týchto nádorov, posledné analýzy hovoria o vzostupe ich výskytu na >10 % [50,51].
Väčšinu NENs žalúdka tvoria NETs – dobre diferencované, nefunkčné nádory z buniek podobných enterochromafinným (enterochromaffin like cells – ECL), vznikajúce predovšetkým v oblasti tela a fundu žalúdka. Podľa WHO aj ENETS rozlišujeme tri typy gastrických NENs, ich rozpoznanie je dôležité pre určenie správneho diagnostického postupu a liečby (tab. 6) [22,52,53].
![Klasifikácia gastrických NENs podľa ENETS [52].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0a9800198e66fe75c4278a39a2b9a856.jpeg)
Typy 1 a 2 vznikajú ako dôsledok vplyvu zvýšenej gastrinémie na enterochromafinné bunky v mukóze tela a fundu žalúdka [54]. Žalúdočné NENs 1. a 2. typu sú väčšinou mnohopočetné tumory, menšie ako 1–1,5 cm a sú obmedzené na mukózu, menej submukózu, bez prieniku do lamina muscularis propria. Typ 1 predstavuje najčastejšiu gastrickú NEN, tvorí až 80 % zo všetkých žalúdočných NENs [33,55]. Ide často o malé multifokálne lézie asociované s autoimunitnou chronickou atrofickou gastritídou a hypergastrinémiou [45,56]. Typ 2 žalúdočná NEN predstavuje približne 5 % zo všetkých žalúdočných NENs [55]. Typicky sa prejavuje zväčšením žalúdka so zhrubnutou stenou v dôsledku hypertroficko-hypersekretorickej gastropatie a početných slizničných a podslizničných lézií. Tento typ je asociovaný s mnohopočetnou NENs typu 1 (MEN1) a Zollinger-Ellisonovým syndrómom (ZES), ktoré vznikajú v dôsledku autozomálne dominantnej mutácie MEN1 génu na chromozóme 11q13. Nádory produkujúce gastrín (gastrinómy) typicky prítomné u pacientov s MEN1-ZES vedú k hypergastrinémii s následným vývojom hyperplázie ECL buniek, dysplázie a NEN 2. typu [54,56]. Tento typ sa zriedka vyskytuje u pacientov so sporadickým ZES [57].
Nádory 3. typu predstavujú sporadické NENs, ktoré vznikajú pri fyziologických hladinách gastrínu v mukóze žalúdka bez signifikantnej patológie a tvoria okolo 13 % zo všetkých žalúdočných NENs. Sú agresívnejšie ako NENs 1. a 2. typu, často ide o väčšie, hlboko invadujúce, metastazujúce, G3 nádory [52].
Niektorí autori uvádzajú aj 4. typ NENs [55]. Makroskopicky ide o mnohopočetné malé lézie, histologický obraz odhalí hypertrofiu a hyperpláziu parietálnych buniek.
NEC žalúdka patrí medzi raritné nádory [55]. Predstavuje nízko diferencovaný, vysoko malígny nádor, ktorý väčšinou v čase diagnózy invaduje hlboko do steny žalúdka a infiltruje lymfatické a krvné cievy [58].
NENs tenkého čreva
NENs tenkého čreva je možné rozdeliť na základe miesta výskytu na dve skupiny, nádory hornej časti tenkého čreva (duodénum a proximálne jejunum) a nádory dolnej časti tenkého čreva (distálne jejunum, ileum a Meckelov divertikel).
Duodénum a proximálne jejunum
Jedná sa o pomerne zriedkavé nádory, rádovo tvoria 5,7–7,9 % zo všetkých NETs [33]. V duodéne sa v rámci NENs najčastejšie vyskytujú NETs. Bolo opísaných päť typov duodenálnych NENs na základe hormonálnej látky, ktorú zvýšene produkujú. Gastrín-produkujúce NENs sa vyskytujú sporadicky alebo ako súčasť MEN1-ZES, môžu byť nefunkčné alebo funkčné (gastrinómy). Svojím výskytom patria medzi najčastejšie NENs, tvoria 62 % zo všetkých NENs duodéna a proximálneho jejuna [56,58]. Somatostatín-produkujúci nádor predstavuje druhý typ duodenálnych NENs vyskytujúci sa prevažne v ampulárnej/periampulárnej časti duodéna, často asociovaný s von Recklinghausenovou chorobou (neurofibromatóza typ 1) [59]. Medzi ďalšie patrí gangliocytický paraganglióm [47], nefunkčný NET s obsahom serotonín-a kalcitonín-pozitívnych buniek [58] a NEC [59].
Distálne jejunum a ileum
V oblasti distálneho jejuna a ilea sa vyskytujú len NETs (karcinoidy), NECs neboli v týchto oblastiach popísané. Väčšina nádorov sa nachádza v terminálnom ileu a najčastejšie ide o serotonín-produkujúce NETs z enterochromafinných buniek, ktoré na základe proliferačnej aktivity spadajú do kategórie G1. V ileu sa vyskytuje až 49,9 % intestinálnych NETs [33]. Približne 8 % ileálnych NETs je asociovaných s karcinoidným syndrómom [22].
Apendix
NET apendixu patrí medzi najčastejšie apendikálne tumory [60] náhodne nájdené pri apendektómii, až 90 % je menších ako 1 cm [58]. Zo všetkých nádorov apendixu NETs predstavujú až 85 % [35]. Najčastejšie ide o serotonín-produkujúce nádory vychádzajúce z enterochromafinných buniek. Apendikálne NETs < 2 cm metastázujú pomerne zriedkavo, avšak s veľkosťou nádoru rastie aj výskyt metastáz [51,60].
NENs hrubého čreva a rekta
NENs sa najčastejšie vyskytujú v rekte, menej v céku, colon sigmoideum, rektosigmoideum a colon ascendens. Ide prevažne o NETs, ktoré podľa proliferačnej aktivity spadajú do skupiny G1. NECs sú zriedkavé, no v porovnaní s inými časťami GIT sa v kolorekte vyskytujú častejšie [22].
Hrubé črevo
NENs hrubého čreva sú veľmi zriedkavé. Klinicky sa prezentujú poruchami vyprázdňovania, gastrointestinálnym krvácaním, bolesťami brucha, stratou hmotnosti. Asymptomatické lézie, ktoré sa nájdu počas skríningovej kolonoskopie, sú spravidla neodlíšiteľné od iných lézií hrubého čreva.
Rektum
Tieto nádory sú často asymptomatické, malé lézie nájdené náhodne pri endoskopickom vyšetrení. V lokalizovanej forme je v čase diagnózy 75–85 % nádorov [61]. Nádory submukózy < 1 cm predstavujú až 80 % rektálnych NETs [47].
NENs pankreasu
PanNENs sú pomerne zriedkavé nádory predstavujúce 1–3 % zo všetkých malignít pankreasu [33, 62–64]. WHO klasifikácia a grading PanNENs sa líši od ostatných gastrointestinálnych NENs (tab. 7). Poväčšine sa jedná o dobre diferencované NETs (40–91 %) [64].
![Porovnanie WHO klasifi kácii neuroendokrinných neoplázií pankreasu [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c417cfdaa4cf7eb420525faefd2527e4.jpeg)
NETs sa môžu klinicky prejaviť hormonálnym syndrómom v dôsledku hypersekrécie hormónov buď vlastných endokrinnému pankreasu alebo iných. Hovoríme o „funkčných, syndrómových NETs“ (inzulinóm, gastrinóm, glukagonóm). NETs, ktorých bunky exprimujú špecifický hormón, no neprejavujú sa klinicky, nazývame „nefunkčné, nesyndrómové NETs“ a v diagnostickom závere píšeme, z akých buniek vychádzajú, napr. z α-buniek/glukagón-produkujúci NET, z β-buniek/inzulín-produkujúci NET, z G-buniek/gastrín produkujúci NET.
V minulosti tvorili funkčné PanNETs 60–80 %, no v súčasnosti sa ukazuje prevaha nefunkčných PanNETs (> 60 %) [24]. PanNETs sú väčšinou sporadické nádory, no môžu sa vyskytovať aj ako súčasť vrodených syndrómov, najčastejšie u pacientov s MEN1 syndrómom (gastrinóm, inzulinóm) a von Hippel Lindau (VHL) syndrómom (väčšinou nefunkčné nádory) [65].
Záver
GEP-NENs sú zriedkavé nádory, ktoré sa môžu prejaviť typickými príznakmi karcinoidného syndrómu. V takom prípade je diagnostika s využitím biochemických, zobrazovacích a bioptických metód poväčšine nenáročná. Karcinoidný syndróm sa však prejaví len v 8–35 % prípadov. U ostatných pacientov sú príznaky nešpecifické, alebo sú nádory asymptomatické, často nájdené náhodne v chirurgickom resekáte odstránenom z inej indikácie. Vzhľadom na bezpríznakovosť časti nádorov, často ich malé rozmery a lokalitu v oblastiach čreva ťažko dostupných endoskopickému vyšetreniu sú GEP-NENs mnoho ráz objavené v pokročilom štádiu, v štádiu infiltrácie do okolitých štruktúr, v štádiu lymfogénneho a hematogénneho rozsevu. Základom úspešnej diagnostiky a liečby je myslieť na ne v rámci diferenciálne-diagnostického postupu. Vďaka v súčasnosti dostupným vysoko senzitívnym diagnostickým zobrazovacím metódam je možné zachytiť ochorenie vo včasnom štádiu, kedy je terapia najefektívnejšia. Nemenej dôležitá z hľadiska diagnostiky a liečby je exaktná histopatologická klasifikácia s určením gradingu a stagingu podľa presne stanovených kritérií v súlade s najnovšími klasifikačnými schémami a odporúčaniami s ohľadom na lokalitu nádoru.
V literatúre aj v odbornej verejnosti sa často používajú pojmy karcinoid, NET či NEC synonymicky, no z hľadiska názvoslovia a klasifikácie je potrebné si osvojiť správnu terminológiu. Ako NENs označujeme celú skupinu nádorov z neuroendokrinných buniek GIT, ide teda o všeobecnejšie pomenovanie. NET označujú dobre diferencované nádory s gradingom G1 (karcinoidy) a G2. NEC charakterizujú nízko diferencované nádory G3. Len správna a jednotná terminológia a klasifikácia nádorov z neuroendokrinných buniek umožní bezproblémovú komunikáciu medzi špecialistami z jednotlivých odborov a zabezpečí správne zvolenú liečbu a menežment pacientov s týmto zriedkavým, no spoločensky významným ochorením.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zuzana Čierna, PhD.
Ústav patologickej anatómie LF UK a UN
Sasinkova 4 811 08 Bratislava
e-mail: ciernaz@gmail.com
Submitted: 21. 3. 2018
Accepted: 16. 4. 2018
Sources
1. Ramage JK, Ahmed A, Ardill J et al. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours (NETs). Gut 2012; 61 (1): 6–32. doi: 10.1136/gutjnl-2011-300831.
2. Rosai J. The origin of neuroendocrine tumors and the neural crest saga. Mod Pathol 2011; 24 (Suppl 2): S53–S57. doi: 10.1038/modpathol.2010.166.
3. Matějka VM, Fiala O, Tupý R et al. Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika. Klin Onkol 2013; 26 (5): 358–361. doi: 10.14735/amko2013358.
4. Esmati E, Babaei M, Matini A et al. Neuroendocrine carcinoma of the tongue. J Cancer Res Ther 2015; 11 (3): 659. doi: 10.4103/0973-1482.139395.
5. Dvorackova J, Macak J, Brzula P et al. Primary neuroendocrine carcinoma of the kidney. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 157 (3): 257–260. doi: 10.5507/bp.2012.053.
6. Li Z, Chen CJ, Wang JK et al. Neuroendocrine differentiation of prostate cancer. Asian J Androl 2013; 15 (3): 328–332. doi: 10.1038/aja.2013.7.
7. Moratalla Charcos LM, Pastor Navarro T, Cortes Vizcaino V et al. Large-cell neuroendocrine carcinoma of prostate. Arch Esp Urol 2013; 66 (4): 368–371.
8. Lindboe CF. Large cell neuroendocrine carcinoma of the ovary. APMIS. 2007; 115 (2): 169–176. doi: 10.1111/j.1600-0463.2007.apm_570.x.
9. Aslam MF, Choi C, Khulpateea N. Neuroendocrine tumour of the ovary. J Obstet Gynaecol 2009; 29 (5): 449–451. doi: 10.1080/01443610902946903.
10. Hanna MY, Leung E, Rogers C et al. Primary large-cell neuroendocrine tumor of the breast. Breast J 2013; 19 (2): 204–206. doi: 10.1111/tbj.12081.
11. Rehman A. Primary neuroendocrine carcinoma of the breast. J Coll Physicians Surg Pak 2013; 23 (4): 282–284. doi: 04.2013/JCPSP.282284.
12. Ueda G, Yamasaki M. Neuroendocrine carcinoma of the uterus. Curr Top Pathol 1992; 85: 309–335.
13. Schmidt D. Neuroendocrine tumors of the uterus. Verh Dtsch Ges Pathol 1997; 81: 260–265.
14. Tan EH, Tan CH. Imaging of gastroenteropancreatic neuroendocrine tumors. World J Clin Oncol 2011; 2 (4): 28–43. doi: 10.5306/wjco.v2.i1.28.
15. Vítek P, Strenkova J, Sedláčkova E et al. Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat. Klin Onkol 2013; 26 (4): 271–280. doi: 10.14735/amko2013271.
16. Leoncini E, Boffetta P, Shafir M et al. Increased incidence trend of low-grade and high-grade neuroendocrine neoplasms. Endocrine 2017; 58 (2): 368–379. doi: 10.1007/s12020-017-1273-x.
17. de Herder WW, Rehfeld JF, Kidd M et al. A short history of neuroendocrine tumours and their peptide hormones. Best Pract Res Clin Endocrinol Metab 2016; 30 (1): 3–17. doi: 10.1016/j.beem.2015.10.004.
18. Modlin IM, Shapiro MD, Kidd M et al. Siegfried oberndorfer and the evolution of carcinoid disease. Arch Surg 2007; 142 (2): 187–197. doi: 10.1001/archsurg.142.2.187.
19. Rehfeld JF, Federspiel B, Bardram L. A neuroendocrine tumor syndrome from cholecystokinin secretion. N Engl J Med 2013; 368 (12): 1165–1166. doi: 10.1056/NEJMc1215137.
20. Williams ED, Sandler M. The classification of carcinoid tumours. Lancet 1963; 1 (7275): 238–239.
21. Capella C, Heitz PU, Hofler H et al. Revised classification of neuroendocrine tumours of the lung, pancreas and gut. Virchows Arch 1995; 425 (6): 547–560.
22. Bosman FT CF, Hruban RH, Theise ND. WHO Classification of tumours of the digestive system. Fourth edition. WHO 2010: 417.
23. Travis WD, Brambilla E, Nicholson AG et al. The 2015 World Health Organization classification of lung tumors: Impact of genetic, clinical and radiologic advances since the 2004 classification. J Thorac Oncol 2015; 10 (9): 1243–1260. doi: 10.1097/JTO.0000000000000630.
24. Lloyd RV, Osamura RY, Klöppel G et al. WHO classification of tumours of endocrine organs. Fourth edition. WHO 2017: 355.
25. Klimstra DS, Modlin IR, Coppola D et al. The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems. Pancreas 2010; 39 (6): 707–712. doi: 10.1097/MPA.0b013e3181ec 124e.
26. Rindi G, Arnold R, Bosman FT et al. Nomenclature and classification of neuroendocrine neoplasms of the digestive system. 4th edition. In: Classification of tumour of the digestive system. Lyon: IARC Press 2010.
27. Travis WD. The concept of pulmonary neuroendocrine tumours. In: Travis WD, Brambilla E, Muller-Hermelink (eds). Pathology and genetics of tumours of the lung, pleura, thymus and heart. Lyon: IARC Press; 2004.
28. Enets.org. [online]. Available from: https: //www.enets.org/current_guidelines.html.
29. Hirabayashi K, Zamboni G, Nishi T et al. Histopathology of gastrointestinal neuroendocrine neoplasms. Frontiers in oncology 2013; 3: 2. doi: 10.3389/fonc.2013.00002.
30. Rindi G, Kloppel G, Alhman H et al. TNM staging of foregut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2006; 449 (4): 395–401. doi: 10.1007/s00428-006-0250-1.
31. Rindi G, Kloppel G, Couvelard A et al. TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2007; 451 (4): 757–762. doi: 10.1007/s00428-007-0452-1.
32. Yang Z, Tang LH, Klimstra DS. Effect of tumor heterogeneity on the assessment of Ki67 labeling index in well-differentiated neuroendocrine tumors metastatic to the liver: implications for prognostic stratification. Am J Surg Pathol 2011; 35 (6): 853–860. doi: 10.1097/ PAS.0b013e31821a0696.
33. Kim JY, Hong SM, Ro JY. Recent updates on grading and classification of neuroendocrine tumors. Annals of diagnostic pathology 2017; 29: 11–16. doi: 10.1016/j.anndiagpath.2017.04.005.
34. Brierley JD, Gospodarowicz MK, Wittekind C (eds). TNM Classification of malignant tumours. Hoboken: Wiley Blackwell 2017: 253.
35. Amin MB, Edge S, Greene F (eds). AJCC Cancer Staging Manual. New York: Springer 2017: 1032.
36. Pape UF, Niederle B, Costa F et al. ENETS consensus guidelines for neuroendocrine neoplasms of the appendix (excluding goblet cell carcinomas). Neuroendocrinology 2016; 103 (2): 144–152. doi: 10.1159/000443165.
37. Riihimaki M, Hemminki A, Sundquist K et al. The epidemiology of metastases in neuroendocrine tumors. Int J Cancer 2016; 139 (12): 2679–2686. doi: 10.1002/ijc.30400.
38. Elizabeth A. Montgomery MD LVM. Biopsy interpretation of the gastrointestinal tract mucosa: volume 2: neoplastic. Philadephia: Lippincott Williams & Wilkins 2012: 352.
39. Kumar V, Abbas A, Fausto N (eds). Robins and cotran pathologic basis of disease. Eighth edition. Philadephia: Elsevier 2010: 1464.
40. Ramage JK, Davies AH, Ardill J et al. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours. Gut 2005 54 (Suppl 4): 1–16. doi: 10.1136/gut.2004.053314.
41. Rorstad O. Prognostic indicators for carcinoid neuroendocrine tumors of the gastrointestinal tract. J Surg Oncol 2005; 89 (3): 151–160. doi: 10.1002/jso.20179.
42. Jes A. Circulating markers for endocrine tumours of the gastrointestinal tract. Ann Clin Biochem 2008; 45 (5): 451. doi: 10.1258/acb.2008.200825.
43. Modlin IM, Oberg K, Chung DC et al. Gastroenteropancreatic neuroendocrine tumours. Lancet Oncol 2008; 9 (1): 61–72. doi: 10.1016/S1470-2045 (07) 70410-2.
44. Uskul BT, Turker H, Dincer IS et al. A primary tracheal carcinoid tumor masquerading as chronic obstructive pulmonary disease. South Med J 2008; 101 (5): 546–549. doi: 10.1097/SMJ.0b013e31816bf624.
45. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128 (6): 1717–1751.
46. Oberg KE. Gastrointestinal neuroendocrine tumors. Ann Oncol 2010; 21 (Suppl 7): 72–80. doi: 10.1093/annonc/mdq290.
47. Salyers WJ, Vega KJ, Munoz JC et al. Neuroendocrine tumors of the gastrointestinal tract: Case reports and literature review. World J Gastrointest Oncol 2014; 6 (8): 301–310. doi: 10.4251/wjgo.v6.i8.301.
48. Egashira A, Morita M, Kumagai R et al. Neuroendocrine carcinoma of the esophagus: Clinicopathological and immunohistochemical features of 14 cases. PloS One 2017; 12 (3): e0173501. doi: 10.1371/journal.pone.0173501.
49. Deng HY, Ni PZ, Wang YC et al. Neuroendocrine carcinoma of the esophagus: clinical characteristics and prognostic evaluation of 49 cases with surgical resection. Journal of thoracic disease 2016; 8 (6): 1250–1256. doi: 10.21037/jtd.2016.04.21.
50. Jung M, Kim JW, Jang JY et al. Recurrent gastric neuroendocrine tumors treated with total gastrectomy. World J Gastroenterol 2015; 21 (46): 13195–13200. doi: 10.3748/wjg.v21.i46.13195.
51. Kulke MH, Shah MH, Benson AB et al. Neuroendocrine tumors, version 1.2015. J Natl Compr Canc Netw 2015; 13 (1): 78–108.
52. Delle Fave G, O‘Toole D, Sundin A et al. ENETS Consensus guidelines update for gastroduodenal nNeuroendocrine neoplasms. Neuroendocrinology 2016; 103 (2): 119–124. doi: 10.1159/000443168.
53. Scherubl H, Cadiot G, Jensen RT et al. Neuroendocrine tumors of the stomach (gastric carcinoids) are on the rise: small tumors, small problems? Endoscopy 2010; 42 (8): 664–671. doi: 10.1055/s-0030-1255564.
54. von Rosenvinge EC, Wank SA, Lim RM. Gastric masses in multiple endocrine neoplasia type I-associated Zollinger-Ellison syndrome. Gastroenterology 2009; 137 (4): 1222–1537. doi: 10.1053/j.gastro.2009.03.050.
55. Dias AR, Azevedo BC, Alban LBV et al. Gastric Neuroendocrine Tumor: Review and Update. Arq Bras Cir Dig 2017; 30 (2): 150–154. doi: 10.1590/0102-6720201700020016.
56. Kloppel G, Perren A, Heitz PU. The gastroenteropancreatic neuroendocrine cell system and its tumors: the WHO classification. Ann N Y Acad Sci 2004; 1014: 13–27.
57. Delle Fave G, Capurso G, Milione M et al. Endocrine tumours of the stomach. Best Pract Res Clin Gastroenterol 2005; 19 (5): 659–673. doi: 10.1016/j.bpg.2005.05.002.
58. Modlin IM, Oberg K, Chung DC et al. Gastroenteropancreatic neuroendocrine tumours. Lancet Oncol 2008; 9 (1): 61–72. doi: 10.1016/S1470-2045 (07) 70410-2.
59. Makhlouf HR, Burke AP, Sobin LH. Carcinoid tumors of the ampulla of Vater: a comparison with duodenal carcinoid tumors. Cancer 1999; 85 (6): 1241–1249.
60. Pasieka JL. Carcinoid tumors. Surg Clin North Am 2009; 89 (5): 1123–1137. doi: 10.1016/j.suc.2009.06. 008.
61. Louthan O. Neuroendokrinní nádory rekta. Klin Onkol 2009; 22 (5): 195–201.
62. Batcher E, Madaj P, Gianoukakis AG. Pancreatic neuroendocrine tumors. Endocr Res 2011; 36 (1): 35–43. doi: 10.3109/07435800.2010.525085.
63. Krampitz GW, Norton JA. Pancreatic neuroendocrine tumors. Curr Probl Surg 2013; 50 (11): 509–545. doi: 10.1067/j.cpsurg.2013.08.001.
64. Klimstra DS, Beltran H, Lilenbaum R et al. The spectrum of neuroendocrine tumors: histologic classification, unique features and areas of overlap. Am Soc Clin Oncol Educ Book 2015: 92–103. doi: 10.14694/EdBook_AM.2015.35.92.
65. Falconi M, Eriksson B, Kaltsas G et al. ENETS consensus guidelines update for the management of patients with functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors. Neuroendocrinology 2016; 103 (2): 153–171. doi: 10.1159/000443171.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2018 Issue 3
Most read in this issue
- Potential of the Flavonoid Quercetin to Prevent and Treat Cancer – Current Status of Research
- Histopathology of Neuroendocrine Neoplasms of the Gastrointestinal System
- Resection of Abdominal, Pelvic and Retroperitoneal Tumors
- Detection of FLT3 Mutations in Patients from Eastern Slovakia
