-
Medical journals
- Career
Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
Authors: A. Metelková 1; A. Skálová 2,3; J. Fínek 1
Authors‘ workplace: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Šiklův ústav patologie, LF UK a FN Plzeň 2; Bioptická laboratoř s. r. o., Plzeň 3
Published in: Klin Onkol 2017; 30(3): 202-209
Category: Original Articles
doi: https://doi.org/10.14735/amko2017202Overview
Východiska:
Karcinom prsu je celosvětově nejčastější ženskou malignitou. Pro ženy premenopauzální, obzvláště ve velmi nízkém věku do 35 let, přináší toto onemocnění velké riziko – mívá agresivnější chování a horší prognózu.Soubor pacientů a metody:
Skupinu pacientek v naší retrospektivní studii tvořilo 356 žen do 35 let věku, kterým byl v letech 2006–2015 diagnostikován invazivní karcinom prsu. Z této základní kohorty jsme vybrali 92 nemocných, které byly léčeny na Onkologické a radioterapeutické klinice FN Plzeň. Kontrolní skupinu tvořilo 100 postmenopauzálních žen nad 65 let v době stanovení diagnózy invazivního karcinomu prsu. Srovnali jsme prognostické a prediktivní indikátory, léčbu a průběh onemocnění v obou skupinách.Výsledky:
U mladých pacientek byla častěji přítomna overexprese proteinu HER2/neu, nádory měly častěji triple negativní imunoprofil a bazaloidní fenotyp, byly hůře diferencované. Naopak prognosticky příznivější typy karcinomu nebyly v této skupině tak časté. Co se týče průběhu onemocnění, i zde výsledky hovoří v neprospěch pacientek nízkého věku – méně pacientek dosáhlo remise onemocnění, více bylo zaznamenáno případů generalizace nemoci i počtu úmrtí.Závěr:
Incidence invazivního karcinomu prsu u mladých žen je nízká, představuje kolem 2 % ze všech případů, tato skupina nemocných je však prognosticky velmi významná. Karcinomy v takto mladém věku bývají agresivnější a častěji bývají zastoupeny prognosticky nepříznivější typy karcinomu, jako triple negativní nebo bazaloidní. Výsledky naší retrospektivní studie tento předpoklad potvrzují. Karcinomy prsu u mladých žen navíc bývají častěji způsobeny genetickou predispozicí (vrozené mutace v genech BRCA1 a BRCA2 a v dalších).Klíčová slova:
karcinom prsu – mladé ženy – triple negativní karcinom prsu – BRCA mutace – bazaloidní – tumor supresorové genyVýchodiska
Karcinom prsu představuje nejčastější malignitu u žen ve většině vyspělých zemí světa. Incidence onemocnění je v ČR stále na vzestupu, za posledních 25 let vzrostla téměř dvojnásobně. Karcinom prsu je chronické onemocnění s dlouhodobým mnohaletým průběhem. Nejnovější epidemiologická data Národního onkologického registru (NOR) potvrzují, že zhoubný novotvar prsu je v ČR nejčastějším maligním onemocněním žen a jeho incidence trvale výrazně roste [1]. Poslední data z NOR jsou z roku 2014, kdy bylo hlášeno 7 008 nově diagnostikovaných nádorů prsu, ve stejném roce na toto onemocnění zemřelo 1 940 pacientů. Více než 80 % pacientek onemocní v 5.–7. deceniu. Vrchol incidence karcinomu prsu se pohybuje kolem 65. roku života, karcinom prsu u žen mladších než 35 let představuje přibližně 2 % nově diagnostikovaných případů. Na řadě onkologických pracovišť je pozorován spolu se zvyšujícím se počtem nemocných s karcinomem prsu i četnější záchyt onemocnění ve skupině mladých žen (ve věku 35 let a méně). Zda se incidence zhoubných nádorů prsu v populaci mladých žen v ČR skutečně zvyšuje, nebylo dosud doloženo s jistotou [1]. Spíše se zdá, že nárůst počtu nově diagnostikovaných karcinomů prsu se týká pouze věkových skupin žen nad 50 let a u žen mladších 35 let je incidence relativně stabilní [2].
Z hlediska epidemiologie nejde v ČR o problém, ale karcinom prsu u mladých žen představuje specifickou a prognosticky závažnou podskupinu nádorových onemocnění, vyžadující nadstandardní postupy v diagnosticko-léčebné praxi. I když je prevalence karcinomu prsu u mladých žen nízká, mladý věk je nepříznivým prognostickým faktorem [3–7]. Incidence karcinomu prsu u mladých žen je sice relativně nízká, ale důsledky této nemoci jsou v této věkové kategorii významné. Průběh onemocnění je podstatně rychlejší a závažnější než u starších žen. Karcinomy prsu u mladých žen jsou většinou agresivní a prognosticky nepříznivé s časným rozvojem vzdálených metastáz do mozku a do plic, kratší celkovou dobou přežití a přežitím bez příznaků nemoci [7–8]. U mladých žen se častěji vyskytují hereditární karcinomy (BRCA mutace) [9], karcinomy jsou méně diferencované, častěji grade 3, a mají častěji bazaloidní [10] nebo triple negativní profil (ER/PR negativní a HER2/neu negativní) [11]. U mladých žen je také významně vyšší podíl HER2/neu pozitivních karcinomů prsu (17–25 %) oproti celkové frekvenci ve všech věkových kategoriích (kolem 10 %) [12]. Také je vyšší podíl pacientek s primo-diagnózou v pozdějších stadiích (III a IV) než u žen starších. Zaznamenány jsou též častější recidivy [13]. Zčásti může být nepříznivá prognóza způsobena pozdním odhalením karcinomu, kdy se nádorové onemocnění u mladých žen nepředpokládá, ale obecně nejsou důvody této věkové závislosti přesně ve všech aspektech vysvětlené a vycházejí zcela zřejmě z biologické povahy nádorů.
Soubor pacientek a metody
Retrospektivní studie vychází ze souboru celkem 16 294 pacientek, u kterých byl v letech 2006–2015 primárně diagnostikován karcinom prsu (C50). Histologická diagnóza vč. vyšetření prediktivních markerů byla stanovena v Bioptické laboratoři v Plzni a v Šiklově ústavu patologie, LF UK a FN Plzeň. Celkem u 356 pacientek (2,2 %) byla v uvedeném období stanovena diagnóza karcinomu prsu ve věku nižším než 35 let. Počty pacientek v jednotlivých letech 10letého období sledování jsou v detailu uvedeny v tab. 1. Náš vlastní soubor zahrnuje celkem 92 pacientek s diagnózou C50 ve věku 35 let a méně, které onemocněly ve sledovaném období 2006–2015 a byly nebo jsou léčeny na Onkologické a radioterapeutické klinice LF UK a FN Plzeň (ORAK). Jako kontrolní soubor slouží sestava náhodně vybraných postmenopauzálních pacientek léčených na ORAK, u nichž byla ve stejném časovém období let 2006–2015 stanovena diagnóza C50 ve věku 65 let a vyšším. Kontrolní soubor sloužil ke srovnání zastoupení jednotlivých molekulárních typů karcinomu, přítomnosti prognostických a prediktivních faktorů, srovnání léčby a následného průběhu onemocnění. Srovnáním se souborem postmenopauzálních pacientek můžeme sledovat odlišnosti v charakteristice a průběhu karcinomu prsu, který se manifestuje před nástupem menopauzy.
Table 1. Počty žen s karcinomem prsu (C50) diagnostikovaným v období 1. 1. 2006 až 31. 12. 2015 v Bioptické laboratoři a Šiklově ústavu patologie, LF UK a FN Plzeň. 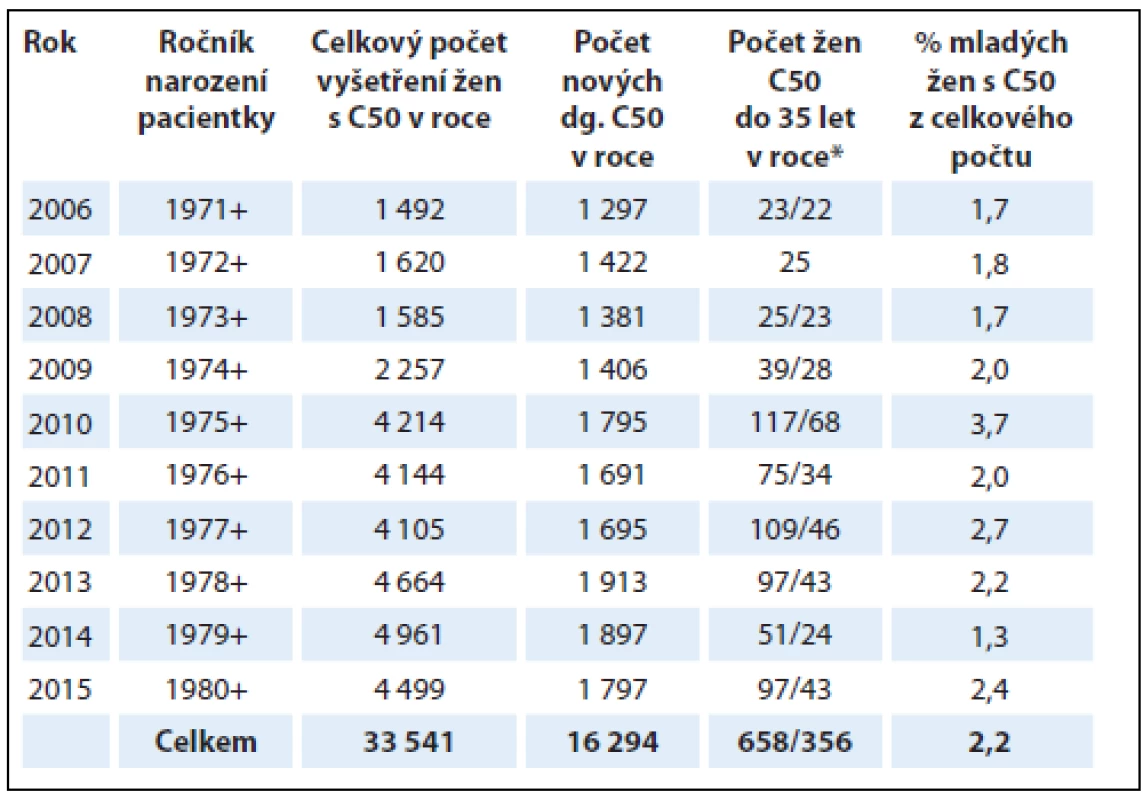
*Celkový počet vyšetření u mladých žen s C50/nově diagnostikované případy C50 u mladých žen. Imunohistochemické vyšetření hormonálních receptorů, exprese HER2/neu a proliferační aktivity
Pro imunohistochemické vyšetření byly použity parafinové řezy ve formalinu fixované a rutinně zpracované tkáně, 4 µm silné, natažené na silanizovaná skla (3-aminopropyltriethoxy-silane, Sigma, St. Louis, MO). Řezy byly rutinním způsobem odparafinovány v xylolu a rehydratovány sestupnou řadou etanolu (od 100 do 70 %). Oživení antigenity tkáně (antigen retrieval) bylo provedeno zahříváním řezů v 0,01 mol/l roztoku citrátového pufru (pH 6,0) v mikrovlnné troubě Micromed TTmega po dobu 40 min. Endogenní peroxidázu blokovalo ponoření řezů v 3% roztoku peroxidu vodíku v absolutním metanolu po dobu 5 min. Řezy byly následně inkubovány s primární protilátkou v autostaineru LabVision po dobu 60 min (tab. 2). K zviditelnění proběhlé imunohistochemické reakce byl použit supersenzitivní vizualizační komplex streptavidin-biotin-peroxidáza (Novocastra, Newcastle upon Tyne, UK) a 3-3’-diaminobenzidine (Sigma) jako chromogen. Nakonec byly řezy lehce dobarveny Mayerovým hematoxylinem. Pro každé vyšetření jsme použili příslušné pozitivní a negativní kontroly.
Table 2. Detaily imunohistochemické analýzy vybraných prognostických a prediktivních markerů karcinomu prsu. 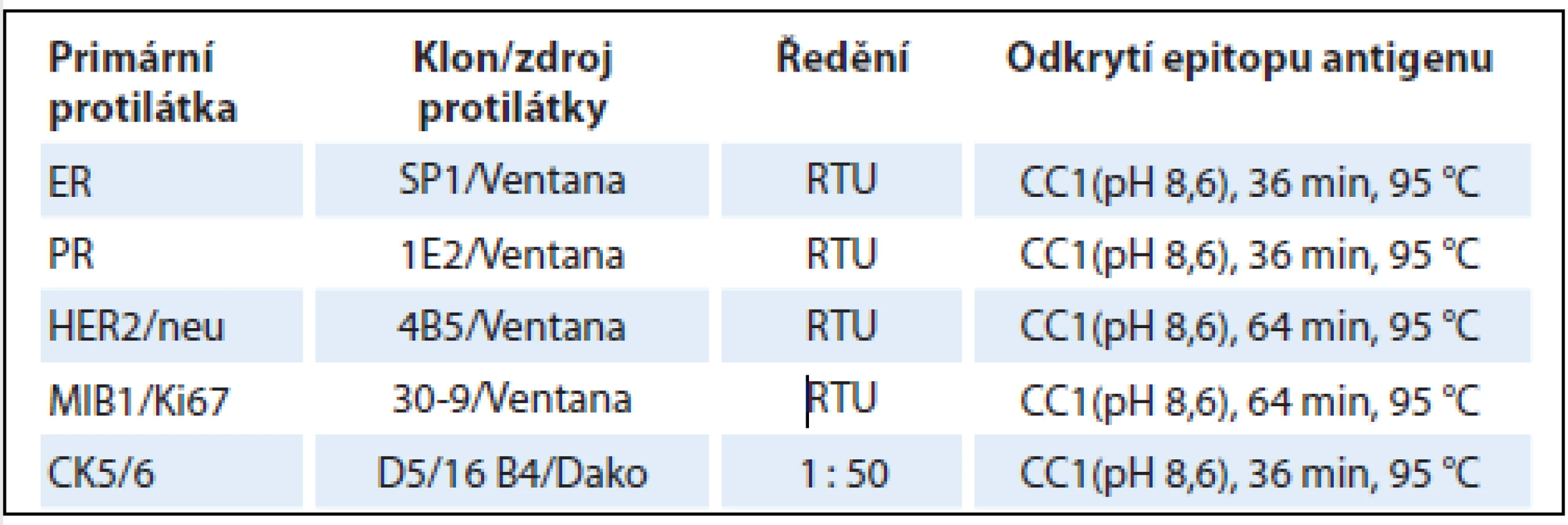
ER – estrogenní receptor, PR – progesteronový receptor, RTU – ready to use, CC1 – cell conditioning 1, MIB1/Ki67 – index proliferační aktivity, CD5/6 – cytokeratin 5/6 Interpretace imunohistochemických výsledků
Preparáty byly hodnoceny podle dříve publikovaných standardních kritérií doporučených k detekci exprese HER2/neu [14–16]. Negativní případy (skóre 0) vykazovaly částečnou slabou membránovou pozitivitu v méně než 10 % buněk nebo byly zcela bez prokazatelné reakce v membránách. Negativní případy (skóre 1+) prokazovaly částečnou slabou pozitivní membránovou reakci ve více než 10 % buněk. Slabá nadměrná exprese (skóre 2+) byla diagnostikována v případech se slabou až středně silnou pozitivní membránovou reakcí ve více než 10 % buněk, přičemž pozitivní reakce byla patrná v celé buněčné membráně. Silná pozitivní úplná membránová reakce ve více než 10 % buněk byla hodnocena jako silná nadměrná exprese (skóre 3+) (obr. 1).
Image 1. Silná pozitivní úplná membránová reakce ve více než 10 % buněk byla hodnocena jako silná nadměrná exprese HER2/neu (skóre 3+). 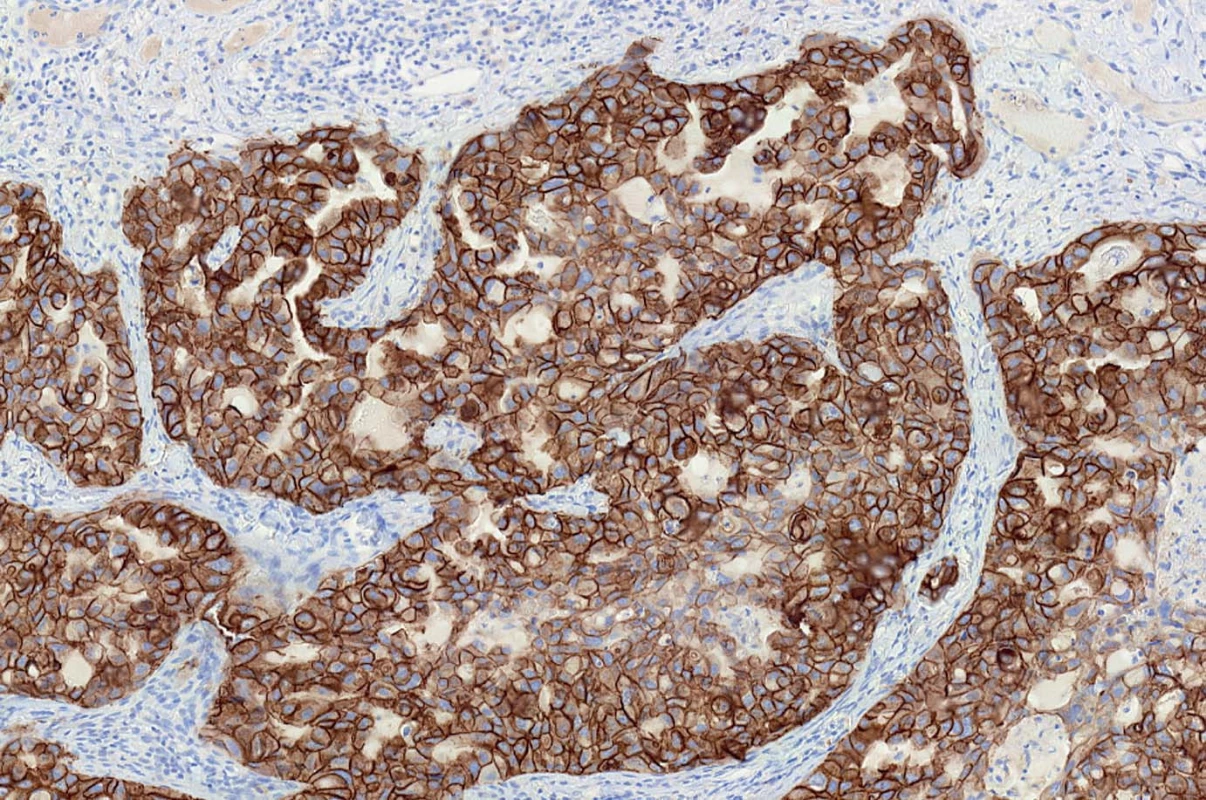
Index proliferační aktivity nádorové populace odpovídá procentu jader karcinomových buněk pozitivních s MIB1 protilátkou. MIB1 pozitivní jádra byla počítána v mikroskopu Olympus BX50 vybaveném speciálním objektivem (zvětšení 40×) s vestavěnou mřížkou za pomoci hematologického mechanického kvantifikátoru vždy ve 20 náhodně vybraných histologických polích tak, aby celkový počet hodnocených jader byl nejméně 1 000 (obr. 2).
Image 2. Index proliferační aktivity nádorové populace odpovídá procentu jader karcinomových buněk pozitivních s MIB1 protilátkou. 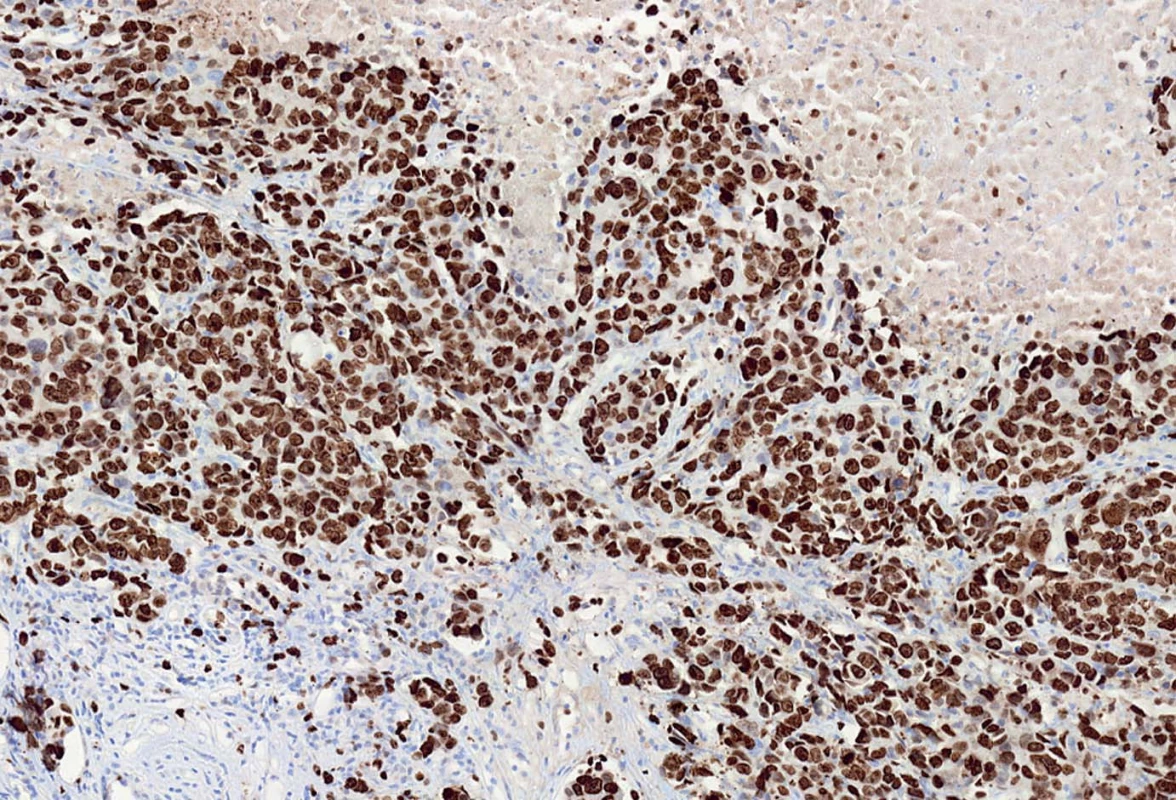
Imunohistochemické vyšetření a hodnocení výsledků ER/PR vychází z doporučených postupů [17,18]. Pozitivním výsledkem je jaderná exprese ve více než 1 % nádorových buněk (obr. 3).
Image 3. Pozitivní exprese estrogenních receptorů v karcinomu prsu. 
In situ hybridizační metody na průkaz HER2/neu antigenu
U všech karcinomů s pozitivní imunohistochemickou expresí HER2/neu (skóre 2+ a 3+) byl výsledek doplněn a ověřen před léčbou vyšetřením amplifikace genu HER2/neu metodou fluorescenční in situ hybridizace. Při absenci hormonálních receptorů v buňkách karcinomu prsu pro možnost diskordantního fenotypu byla amplifikace genu HER2/neu studována in situ hybridizační metodou i v případech imunohistochemicky negativních (skóre 0 a 1+) [19]. Výsledky těchto vyšetření jsou souhrnně uvedeny v tab. 3.
Výsledky
Ve sledovaném 10letém období mezi roky 2006 a 2015 bylo v Bioptické laboratoři, s. r. o., v Plzni celkem nově diagnostikováno 16 294 karcinomů prsu. Celkem 356 nových případů karcinomu prsu ve skupině mladých žen (do 35 let věku vč.) reprezentuje 2,2 % z celkového počtu za sledované období. V souboru 92 mladých žen (věk v době stanovení diagnózy 35 let a méně) s diagnózou C50, které byly a jsou léčeny na ORAK, celkem 51 pacientek onemocnělo karcinomem, který nevykazoval žádné známky exprese estrogenních (ER) ani progesteronových (PR) hormonálních receptorů (55 %). U 32 pacientek jsme prokázali imuno-overexpresi HER2/neu proteinu a amplifikaci HER2/neu genu, což představuje 35 % v uvedeném souboru. Triple negativní imunoprofil (absence obou hormonálních receptorů, ER/PR i HER2/neu) jsme zaznamenali u 30 nemocných (33 %). Bazaloidní fenotyp byl imunohistochemicky prokázán v 18 případech a rysy medulárního karcinomu zmíněny 10×. Ve stejném časovém období bylo na ORAK léčeno 100 pacientek s karcinomem prsu, které byly v době diagnózy starší 65 let. V kontrolní skupině žen starších 65 let v době diagnózy vykazovalo pozitivní hormonální status (ER+/PR+) 81 pacientek/100 (81 %). Nadměrná exprese a/nebo amplifikace HER2/neu byla prokázána pouze u 18 starších žen, což představuje 18 %. Triple negativní fenotyp se našel v kontrolní skupině pouze u 8 %. Výsledky imunohistochemického vyšetření a in situ hybridizačních metod k průkazu výše uvedených prognostických a prediktivních markerů u mladých žen a v kontrolní skupině jsou v přehledu uvedeny v tab. 3. Vysoká proliferační aktivita s MIB1 indexem vyšším než 30 % byla stanovena u 60 % mladých žen v porovnání s 18 % žen v kontrolní skupině. Naproti tomu dobře a středně diferencované karcinomy (grade 1 a 2) se ukázaly daleko častější v kontrolní skupině (90 %) než ve skupině žen mladších 35 let (53 %) (tab. 3).
Table 3. Výsledky imunohistochemického vyšetření a FISH/SISH HER2/neu u mladých žen a v kontrolní skupině žen starších 65 let. 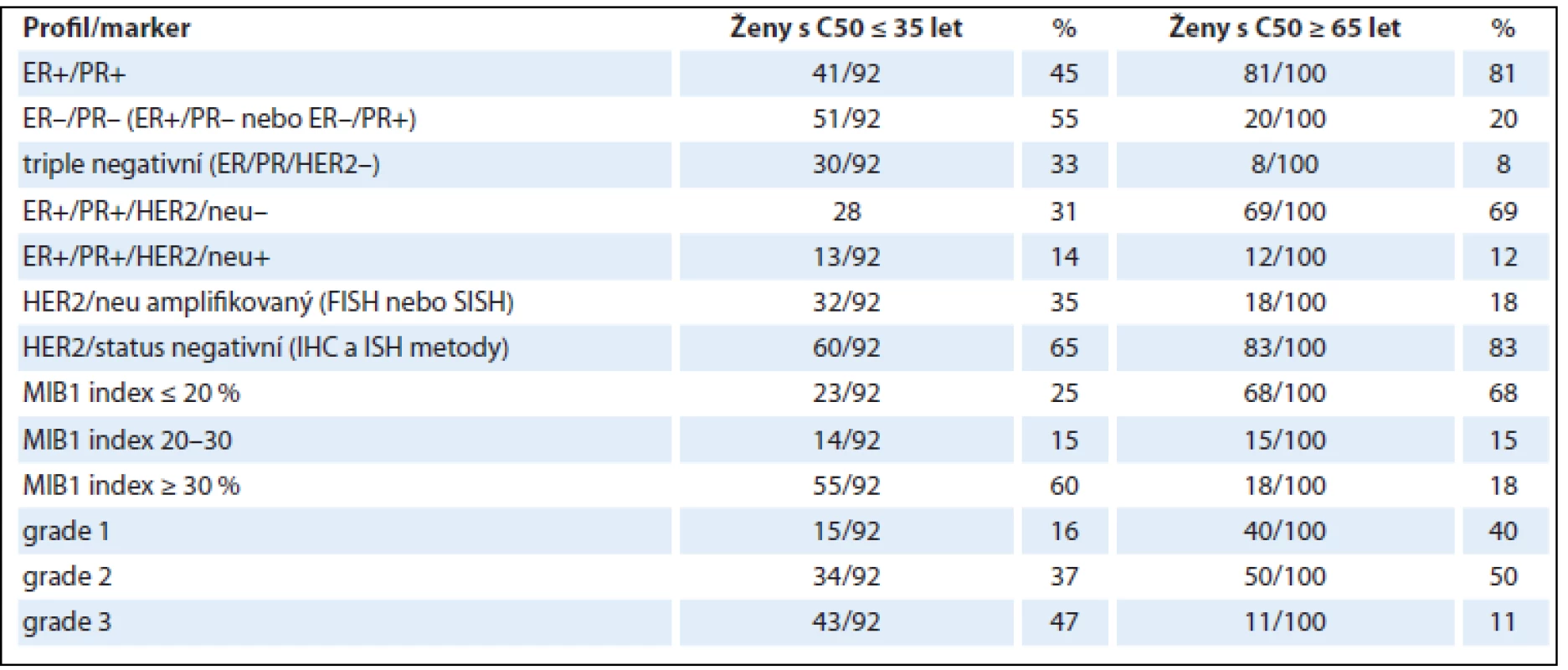
FISH – fluorescenční in situ hybridizace, SISH – silver in situ hybridizace, IHC – imunohistochemické, ER – estrogenní receptor, PR – progesteronový receptor Imunohistochemická analýza ER/PR, index proliferační aktivity (MIB1 index), a HER2/neu status (imunohistochemicky a in situ hybridizačními metodami) byly využity ke stanovení zástupného molekulárního profilu karcinomů prsu ve skupině žen ≤ 35 let a ≥ 65 let [20,21]. Výsledky v korelaci s klinickým průběhem jsou uvedeny v tab. 4. Luminální typ A charakterizuje pozitivní exprese ER/PR, nízká proliferační aktivita s MIB1 indexem ≤ 20 %, grade 1, a HER2/neu negativita (obr. 4). Luminální typ B je stanoven, pokud je karcinom ER pozitivní, PR pozitivní nebo negativní, proliferační aktivita je středně vysoká s MIB1 indexem ≥ 20 %, grade 2 nebo 3, a je HER2 negativní. HER2/neu pozitivní profil charakterizuje overexprese a amplifikace genu HER2/neu bez ohledu na prezenci či absenci hormonálních receptorů (obr. 5). Karcinom má triple negativní profil, pokud v nádorových buňkách chybí oba hormonální receptory i HER2/neu protein/gen. Zatímco prognosticky nejpříznivější luminální A profil byl nalezen u 62 % pacientek kontrolní skupiny, ve skupině mladých žen to bylo pouze 16 případů (17 %). Naproti tomu zastoupení prognosticky méně příznivých profilů bylo opačné, s větším procentem HER2/neu pozitivních a triple negativních karcinomů u mladých žen než v kontrolní skupině (tab. 5).
Image 4. Grade 1 duktální karcinom (A). Luminální typ A charakterizuje pozitivní exprese ER/PR, nízká proliferační aktivita s MIB1 indexem ≤ 20 % (B), grade 1, a HER2/neu negativita. 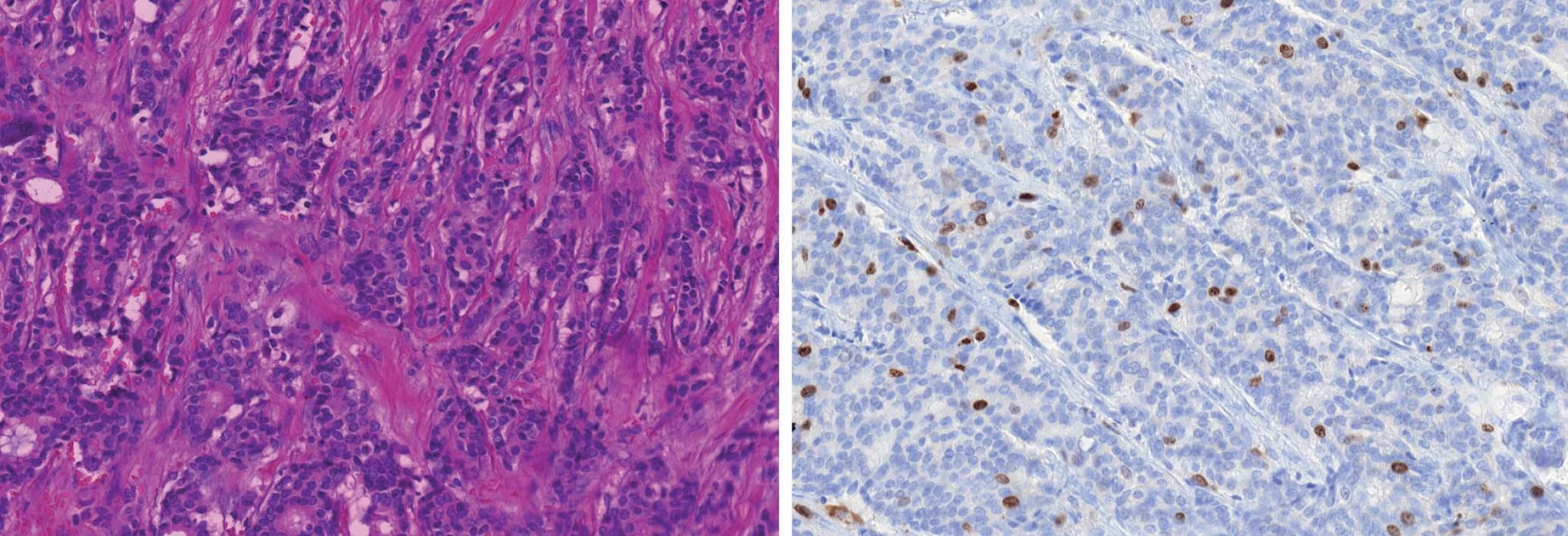
Image 5. Grade 3 duktální karcinom (A). HER2/neu pozitivní profil charakterizuje overexprese a amplifikace genu HER2/neu bez ohledu na prezenci či absenci hormonálních receptorů (B). 
Table 4. Stav mízních uzlin v době diagnózy (N) a průběhu onemocnění mladých žen ≤ 35 let a v kontrolní skupině žen ≥ 65 let. 
Table 5. Molekulární profil karcinomů u mladých žen ≤ 35 let a v kontrolní skupině žen ≥ 65 let. 
V našem souboru pacientek s manifestací karcinomu prsu před 35. rokem života bylo u 50 z nich (54 %) provedeno genetické vyšetření, většinou byla vyšetřena mutace v genech BRCA1 nebo BRCA2. Genetická zátěž v podobě mutace genu BRCA1 byla prokázána u 14 pacientek (28 %) a mutace genu BRCA2 celkem u 2 pacientek (4 %), 34 nemocných mělo výsledek vyšetření negativní. Ženy kontrolní skupiny nebyly testovány. Pozitivní rodinná anamnéza, tedy diagnostikovaný karcinom prsu u pokrevních příbuzných I. a II. stupně (prarodiče, rodiče a sourozenci), byla zaznamenána u 37 z 92 mladých pacientek (40 %).
Průměrný věk mladých pacientek do 35 let činí 31,7 roku (v kontrolní skupině 70,6 roku) a medián 33 let (v kontrolním souboru 69 let). Negativní nález v lymfatických uzlinách (N0) v době diagnózy byl sledován častěji u žen z kontrolní skupiny (54 %), zatímco u mladých pacientek pouze u 45,6 % (tab. 4). Léčba pacientek obou sledovaných skupin probíhala na ORAK. Proto u nich bylo možno dohledat a sledovat průběh léčby a samotného onemocnění. Ve skupině žen do 35 let byla vstupně diagnostikována čtyři (4,3 %) pokročilá onemocnění s průkazem vzdálených metastáz (M1), v kontrolní skupině byly prokázány vzdálené metastázy onemocnění v době diagnózy celkem v 6 % případů. Ve skupině mladých pacientek s časným karcinomem prsu léčených adjuvantní či neoadjuvantní léčbou dle indikačních kritérií bylo dosaženo kompletní remise bez rozvoje recidivy onemocnění, celkem u 60 z 88 z nich (68 %). V kontrolní skupině postmenopauzálních žen dosáhlo remise onemocnění 82 z 94 primárně lokalizovaných onemocnění, tedy celých 87,2 %.
V obou skupinách adjuvantně léčených žen jsme sledovali dobu do recidivy/relapsu onemocnění. U 28 mladých žen (31,8 %) došlo v průběhu sledování k recidivě či relapsu onemocnění a průměrná doba do progrese činila 28,1 měsíce. V souboru starších žen byla podobná událost zaznamenána pouze u 12 z nich (12,8 %), průměrná doba do progrese tedy činila 38,3 měsíce.
Mortalita byla také vyšší u mladých pacientek. Pokročilý karcinom prsu byl příčinou úmrtí u 15 mladých pacientek (16,3 %) a 12 žen starších než 65 let (12 %) – dalších pět úmrtí v této skupině bylo jednoznačně způsobeno z jiných příčin (2× srdeční selhání, pokročilý ovariální karcinom, komplikace diabetu, maligní mezoteliom).
Při hodnocení rozdílu v molekulárním profilu nádorů mladých nemocných a nemocných v kontrolním souboru zaujme na první pohled rozdíl v relativním počtu prognosticky nejpříznivějších nádorů luminal A, který činí 17 vs. 62 % v neprospěch mladých nemocných, stejně tak poměr zastoupení triple negativních nádorů 33 vs. 8 % ve prospěch nádorů mladých žen. Pouhá tato čtyři relativní čísla jsou schopna významně osvětlit rozdílnou prognózu onemocnění mezi těmito dvěma věkovými skupinami žen a demonstrovat závažnost onemocnění karcinomem prsu u žen do 35 let věku.
Na základě studia genových expresních profilů nádorových buněk karcinomu prsu, dle kritérií publikovaných dříve [22–23], byly identifikovány čtyři základní skupiny karcinomu prsu, a to karcinomy luminálního typu A, s ER/PR expresí a negativním HER2/neu; luminálního typu B, s vyšší proliferační aktivitou, a/nebo s negativním PR; dále HER2/neu pozitivní karcinomy; a karcinom triple negativní s absencí ER/PR a HER2/neu. U mladých žen je vyšší podíl prognosticky nepříznivých histologických forem karcinomu, např. triple negativního karcinomu než u starších žen – v naší sestavě ve shodě s literárními údaji byl triple negativní karcinom prsu zastižen u 33 % žen ≤ 35 let vs. 8 % u žen starších 65 let. Karcinom s overexpresí a amplifikací HER2/neu se v našem souboru vyskytl u 35 % mladých žen, u pacientek starších 65 let jen u 18 %.
U mladých žen je naopak výrazně nižší podíl low-grade karcinomů s pomalejší progresí. Karcinom grade 1 byl zachycen u 16 % mladých žen v porovnání se 40 % pacientek kontrolní skupiny. Naproti tomu karcinom grade 3 byl prokázán u 47 % našeho souboru žen mladších 35 let ve srovnání s 11% zastoupením u žen z kontrolní skupiny. Není pochyb o tom, že hormonálně dependentní karcinomy (ER+/PR+) se hojně vyskytují v obou porovnávaných věkových kategoriích, ale v naší skupině mladých žen představoval tento typ karcinomu 45 % případů, zatímco u žen starších 65 let byl podíl téměř dvojnásobný (tab. 3). V jedné recentní srovnávací studii se objevil názor, že estrogen pozitivní karcinomy u mladých žen představují biologicky odlišný typ karcinomu než u žen starých [24]. Naše zkušenost úplně tento názor nepodporuje, hormonálně dependentní karcinomy (ER+/PR+) se současnou expresí HER2/neu se vyskytovaly u mladých (14 %) a starých žen (12 %) téměř identicky (tab. 3).
Nádory prsu u mladých žen vznikají častěji v důsledku vrozené mutace v tumor-supresorových genech, především BRCA1
Velkou část skupiny mladých žen s karcinomem prsu představují ženy s předpokladem vyššího rizika genetické zátěže při vzniku onemocnění [25]. Genetická predispozice je způsobena především zárodečnými mutacemi v genech BRCA1 a BRCA2, které zvyšují riziko karcinomu prsu až 10násobně. Je známo, že karcinomy prsu podmíněné mutacemi genů BRCA1 a BRCA2 jsou častěji grade 3 s vysokou proliferační aktivitou a vzácně vykazují overexpresi HER2/neu onkoproteinu, resp. amplifikaci HER2/neu genu. BRCA1 karcinomy mohou mít mutace v TP53 genu [26].
Karcinomy mladých žen mají častěji bazaloidní imunoprofil
Karcinomy s fenotypem bazálních buněk mají typicky high-grade morfologii a vykazují agresivní klinický [27] průběh. Důležitou vlastností těchto karcinomů je současná negativita receptorů pro estrogeny a progesteron společně s absencí exprese proteinu HER2/neu, označovaná jako triple negativita. Bazaloidní karcinom byl jako jednotka nejdřív definován genovým expresním profilem [22–23], později byly popsány hlavní morfologické a imunohistochemické charakteristiky [28]. Jde o high-grade karcinom s četnými mitózami, ložisky geografických nekróz a vysokou proliferační aktivitou. Bazaloidní karcinom představuje morfologické spektrum, jehož charakteristickým rysem jsou solidní bohatě celulární ložiska bez žlázové diferenciace, doprovázená hojným lymfoidním infiltrátem ve stromatu (dříve označovaný jako atypický medulární karcinom). V imunoprofilu bazaloidního karcinomu dominuje exprese vysokomolekulárních cytokeratinů bazálních buněk, především cytokeratinů CK14 a CK5/6. Nádorové buňky exprimují i další markery bazaloidních/myoepiteliálních buněk, především p63 protein, vimentin a EGFR (epidermal growth factor receptor). Proliferační aktivita je zpravidla vysoká a velmi často chybí exprese ER/PR a HER2/neu.
Karcinomy mladých žen jsou častěji triple negativní nebo HER2 pozitivní
Triple negativní imunoprofil se nachází přibližně u 10–17 % karcinomů prsu. Je to heterogenní skupina, kterou charakterizuje absence hormonálních receptorů a HER2/neu overexprese, spektrum histomorfologických typů a variabilita prognózy [29]. U mladých žen mají triple negativní karcinomy téměř vždy podobu tzv. atypického medulárního nebo bazaloidního karcinomu a high-grade morfologii, spojenou s vysokou proliferační aktivitou a nepříznivým klinickým průběhem. U mladých žen je také častěji ve srovnání se staršími pacientkami zastoupen molekulární typ HER2/neu pozitivní spojený s high-grade morfologií, který je rovněž prognosticky nepříznivý.
Závěr
Ve skupině mladých žen jsou signifikantně častěji zastoupené high-grade invazivní duktální karcinomy (G3 dle Nottinghamské klasifikace), vyšší je podíl karcinomů s bazaloidním a triple negativním imunoprofilem. Karcinomy prsu u mladých žen jsou většinou agresivní a prognosticky nepříznivé nádory s časným rozvojem vzdálených metastáz, vč. mozku a plic. Častěji než u starších žen se setkáváme s hereditárními karcinomy s BRCA1 a BRCA2 mutacemi. Přestože je incidence karcinomu prsu mladých žen relativně nízká (2 %), jde o prognosticky nesmírně závažnou podskupinu nádorových onemocnění, vyžadující specifické postupy v diagnostice i léčbě.
Poznámka
Všechny nemocné podepsaly informovaný souhlas s účastí ve studii. Projekt byl schválen etickou komisí LF UK a FN Plzeň.
Studie byla zčásti podpořena grantem Univerzity Karlovy pro Specifický studentský výzkum č. projektu SVV-2016-260 282.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Alena Metelková
Onkologická a radioterapeutická klinika LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: metelkovaa@fnplzen.cz
Obdrženo: 10. 1. 2017
Přijato: 15. 3. 2017
Sources
1. Svod.cz [internetová stránka]. Databáze Národního onkologického registru. [cited 2017 Dec 20]. Dostupný z: http: //www.svod.cz.
2. Nová J, Palácová M, Forejtová L et al. Zhoubná nádorová onemocnění prsu u mladých žen v České republice 1989–2004. Klin Onkol 2008; 21 (1): 35–36.
3. Chung M, Chang HR, Bland KI et al. Younger women with breast carcinoma have a poorer prognosis than older women. Cancer 1996; 77 (1): 97–103.
4. Dubsky PF, Gnant MF, Taucher S et al. Young age as an independent adverse prognostic factor in premmenopausal patients with breast cancer. Clin Breast Cancer 2002; 3 (1): 65–72.
5. Shannon C, Smith IE. Breast cancer in adolescent and young women. Eur J Cancer 2003; 39 (18): 2632–2642.
6. De La Rochefordiere A, Asselain B, Campana F et al. Age as prognostic factor in premenopausal breast carcinoma. Lancet 1993; 341 (8852): 1039–1043.
7. Fowble BL, Schultz DJ, Overmoyer B et al. The influence of young age on outcome in early stage breast cancer. Int J Radiation Oncol Biol Phys 1994; 30 (1): 23–33.
8. Anders CK, Hsu DS, Broadwater G et al. Young age at diagnosis correlates with worse prognosis and defines a subset of breast cancers with shared patterns of gene expression. J Clin Oncol 2008; 26 (20): 3324–3330. doi: 10.1200/JCO.2007.14.2471.
9. El Saghir NS, Seoud M, Khalil MK et al. Effects of young age at presentation on survival in breast cancer. BMC Cancer 2006; 6 : 194.
10. Golshan M, Miron A, Nixon AJ et al. The prevalence of germeline BRCA1 and BRCA2 mutations in young women with breast cancer undergoing breast-conservation therapy. Am J Surg 2006; 192 (1): 58–62.
11. Lakhani SR, Reis-Filho JS, Fulford L et al. Prediction of BRCA1 status in patients with breast cancer using estrogen receptor and basal phenotype. Clin Cancer Res 2005; 11 (14): 5175–5180.
12. Bori R, Cserni G. Basal phenotype in breast carcinoma occurring in women aged 35 or younger. Pathol Oncol Res 2009; 15 (1): 41–45.
13. Fínek J, Holubec L Jr., Topolcan O et al. The importance of prognostic factors in premenopausal women with breast cancer. Anticancer Res 2007; 27 (4A): 1893–1896.
14. Wolff AC, Hammond ME, Hicks DG et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. J Clin Oncol 2013; 31 (31): 3997–4013. doi: 10.1200/JCO.2013.50. 9984.
15. Shah MV, Wiktor AE, Meyeer RG et al. Change in Pattern of HER2 Fluorescent in Situ Hybridization (FISH) Results in Breast Cancers Submitted for FISH Testing: Experience of a Reference Laboratory Using US Food and Drug Administration Criteria and American Society of Clinical Oncology and College of American Pathologists Guidelines. J Clin Oncol 2016. pii: JCO618983. In press.
16. Wolff AC, Hammond EH, Hicks DG et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer. American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. Arch Pathol Lab Med 2014; 138 (2): 241–256. doi: 10.5858/arpa.2013-09 53-SA.
17. Hammond ME, Hayes DF, Dowsett M et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. J Clin Oncol 2010; 28 (16): 2784–2795. doi: 10.1200/JCO.2009.25. 6529.
18. Hammond ME, Hayes DF, Dowsett M et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Arch Pathol Lab Med 2010; 134: E1–E16.
19. Kinkor Z, Grossman P, Skálová A. Molekulární testování HER2 u karcinomu prsu jako kritérium výběru nemocných k léčbě Herceptinem – jsme optimální? Breast Cancer News 2014; 4 (2): 10–13.
20. Nielsen TO, Hsu DD, Jensen K et al. Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma. Clin Cancer Research 2004; 10 (16): 5367–5374.
21. Di Palma S, Simpson RH, Marchio C et al. Salivar duct carcinomas can be classified into luminal androgen receptor-positive, HER2 and basal-like phenotypes. Histopathology 2012; 61 (4): 629–643. doi: 10.1111/j.13652559.2012.04252.x.
22. Perrou CM, Sorie T, Elsen MB et al. Molecular portraits of human breast tumours. Nature 2000; 406 (6797): 747–752.
23. Sotiriou C, Neo SY, McShane LM et al. Breast cancer classification and prognosis based on gene expression profiles from a population-based study. Proc Natl Acad Sci U S A 2003; 100 (18): 10393–10398.
24. Bacchi LM, Corpa M, Santos PP et al. Estrogen receptor-positive breast carcinomas in younger women are different of those of older women: a pathological and immunohistochemical study. Breast 2010; 19 (2): 137–141. doi: 10.1016/j.breast.2010.01.002.
25. Johnson RH, Hu P, Fan C et al. Gene expression in „young adult type“ breast cancer: a retrospective analysis. Oncotarget 2015; 6 (15): 13688–13702.
26. Da Silva L, Lakhani SR. Pathology of hereditary breast cancer. Mod Pathol 2010; 23 (Suppl 2): S46–S51. doi: 10.1038/modpathol.2010.37.
27. Ho-Yen C, Bowen RL, Jones JL. Characterization of basal-like breast cancer: an update. Diagnostic Histopathol 2012; 18 : 104–111.
28. Rakha EA, Putti TC, Abd El-Rahim DM et al. Morphological and immunophenotypic analysis of breast carcinomas with basal and myoepithelial differentitation. J Pathol 2006; 208 (4): 495–506.
29. Reis-Filho JS, Tutt ANJ. Triple negative tumours: a critical review. Histopathology 2008; 52 (1): 108–118. doi: 10.1111/j.1365-2559.2007.02889.x.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue 3-
All articles in this issue
- Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislosti
- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Nové léky v terapii akutní myeloidní leukemie u starších pacientů
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
- Izolovaná perfuze horní končetiny s TNF-α – dvojitá kanylace žilního systému
- Mnohopočetný výskyt bazocelulárneho karcinómu – retrospektívna analýza 899 pacientov s biopticky verifikovanými léziami na jednom pracovisku
- Dlouhodobá kompletní odpověď metastázy kolorektálního karcinomu po biochemoterapii
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

