-
Medical journals
- Career
Izolovaná perfuze horní končetiny s TNF-α – dvojitá kanylace žilního systému
Authors: M. Špaček 1; P. Mitáš 1; M. Vočka 2; L. Lacina 3; G. Hodková 1; R. Špunda 1; O. Kodet 3; I. Krajsová 3; L. Petruželka 2; J. Trnka 4,5; J. Kubinyi 4; Z. Matějovský 6; L. Lambert 7; J. Lindner 1
Authors‘ workplace: II. chirurgická klinika kardiovaskulární chirurgie 1. LF UK a VFN v Praze 1; Onkologická klinika 1. LF UK a VFN v Praze 2; Dermatovenerologická klinika 1. LF UK a VFN v Praze 3; Ústav nukleární medicíny, 1. LF UK a VFN v Praze 4; Oddělení radiační ochrany, VFN v Praze 5; Ortopedická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 6; Radiodiagnostická klinika 1. LF UK a VFN v Praze 7
Published in: Klin Onkol 2017; 30(3): 213-219
Category: Case Report
doi: https://doi.org/10.14735/amko2017213Overview
Východiska:
Izolovaná perfuze končetin s použitím TNF-α a melfalanu (TM-ILP), v kombinaci s následnou kompletní resekcí tumoru, je efektivní metoda léčby u nemocných s neresekovatelným sarkomem měkkých tkání končetin, spojená se záchranou končetiny ve více než 80 % případů. Metoda ILP je indikována též u nemocných s maligním melanomem končetin, s četnými in-tranzitními metastázami. Autoři prezentují technickou variantu kanylace pro mimotělní oběh u vybraných pacientů s postižením horní končetiny.Soubor pacientů:
Z celkového počtu 55 ILP provedených na našem pracovišti od roku 2009 bylo devět výkonů na horní končetině (v obdobném poměru v indikaci sarkom měkkých tkání (n = 4) i maligní melanom (n = 4 + 1× reoperace)). Standardní technika kanylace brachiální žíly u malého kompartmentu horní končetiny vzhledem k nižším průtokům v systému a relativně velké ploše vzhledem k hmotnosti přináší obtíže s nedostatečným a déle trvajícím ohřátím perfundovaného kompartmentu horní končetiny. Jednoduchá technika „Y“ kanylace žilního systému cestou hluboké brachiální žíly a současně povrchního systému cestou v. basilica přináší až o 20 % vyšší minutový průtok v systému mimotělního oběhu, rychlejší ohřátí horní končetiny a stabilní teplotní prostředí po celou dobu ILP horní končetiny, což je základní podmínkou úspěchu léčby.Závěr:
Uvedená technika se vzhledem ke svým přednostem stala na našem pracovišti standardní při ILP horní končetiny.Klíčová slova:
izolovaná perfuze končetiny – maligní melanom – sarkom měkkých tkání – horní končetina – mimotělní oběhÚvod
Izolovaná perfuze končetiny (isolated limb perfusion – ILP) využívá terapeutických účinků hypertermie v ohraničeném kompartmentu končetiny spolu s působením mnohonásobně vyšší koncentrace cytostatika, než by bylo možné dosáhnout v rámci systémové chemoterapie. Metodu uvedli do klinické praxe Creech a Krementz v roce 1956 u pacientů s neresekovatelným sarkomem měkkých tkání nebo melanomem lokalizovaným na končetině [1]. V průběhu 50leté historie metody bylo testováno podání řady látek pomocí ILP [2–4]. Zlatým standardem se stala hypertermická perfuze končetiny s použitím melfalanu (Alkeran, Aspen Pharma, Irsko), od druhé poloviny 90. let 20. století též v kombinaci s tasonerminem (tumor nekrotizující faktor – TNF-α1a, Beromun®, Boehringer Ingelheim, Německo) [5,6]. Účinnost této kombinace byla prokázána u senzitivních sarkomů měkkých tkání končetin a u pacientů s tzv. bulky disease postižením končetiny maligním melanomem [7,8]. Přípravek Beromun je produkován rekombinantní technologií prostřednictvím bakterií E. Coli a patří do skupiny imunostimulancií.
Charakteristika a působení TNF-α
TNF-α je pleiotropní cytokin. Molekulu poprvé izoloval v roce 1975 Carswell a pro svou schopnost indukovat nekrózu buněk sarkomu byl působek nazván tumor nekrotizující faktor. Strukturně je TNF-α homotrimerický protein, aminokyselinový řetězec je složen ze 157 reziduí. Prekurzorová molekula (27 kDa) je vázána na buněčnou membránu a následně po odštěpení vzniká definitivní molekula (17 kDa), která může být secernována. Přechod z inaktivní proformy na aktivní formu zajišťuje enzym konvertující TNF-α (TACE). Aktivovaná molekula se dále váže na specifické receptory TNFR-p55 (TNFR-1, CD120a) a TNFR-p75 (TNFR-2, CD120b). TNFR-1 sice vykazuje nižší aviditu vazby TNF-α, je ale přítomen na všech somatických buňkách, a proto je mu připisována většina biologických účinků TNF-α. TNFR-2 váže TNF-α silněji, ale je exprimován jen na buňkách imunitního systému a endotelu. Aktivovat receptor je schopna i membránově vázaná solubilní molekula. Transmembránový receptor je za normálních okolností sekvestrován v Golgiho aparátu uvnitř buňky, v případě stimulace je pak externalizován na povrch cytoplazmatické membrány buňky.
Superrodina TNF účinně reguluje řadu signálních buněčných drah [9]. Jako klíčový se jeví především nukleární faktor B (NF-κB), mechanizmus působení však není doposud přesně popsán. Funkce TNF-α a příbuzných cytokinů jsou neobyčejně široké, ovlivňují většinu tkání lidského organizmu. V některých případech je nápadná divergence funkcí v závislosti na situaci organizmu. Prolongovaná stimulace TNF-α vede k celkové kachexii organizmu, proto je historicky užíváno synonymum kachexin. TNF-α může stimulovat proliferaci polymorfonukleárů během zánětlivé odpovědi, stejně tak ale za jistých okolností může přispívat k indukci jejich apoptózy. Při stimulaci buňky tímto cytokinem dochází k odpoutání konstitutivně vázaného inhibitoru SODD (silencer of death domain) a následné interakci mezi TNFR-1 a TRADD (TNFR1-associated death domain protein) [10]. Další kroky kaskády vedou k aktivaci kaspázy-8 a k apoptóze buňky. Produkce TNF-α je schopno více typů buněk. Za jeho významný zdroj v lidském těle jsou považovány zejména makrofágy, ale i lymfocyty a NK buňky. TNF-α vznikající po stimulaci makrofágů lipopolysacharidem sehrává významnou úlohu např. při septické reakci na bakteriální patogeny. Role TNF je prokázána v celé řadě dalších patologických pochodů.
Tasonermin působí na cílovou tkáň jak přímým, tak i nepřímým mechanizmem. Přípravek má výrazný účinek na proliferaci aktivovaných B a T lymfocytů vč. cytotoxických T lymfocytů, které se účastní likvidace nádorových buněk a vedou k aktivaci granulocytů a zesílení fagocytární odpovědi [5]. Lék moduluje produkci dalších cytokinů s protinádorovým účinkem [4]. Tasonermin dále modifikuje expresi sekretorických proteinů a buněčných epitopů, což společně s indukcí zánětlivé odpovědi vede k prokoagulačnímu stavu a vzniku mikrovaskulárních trombóz specificky v nádorové tkáni. Lék podstatně zvyšuje vychytávání melfalanu selektivně v nádorové tkáni a umožňuje tak maximalizovat jeho selektivní účinek. Synergie kombinace tasonerminu s melfalanem při hypertermii zvyšuje účinnost léčby ILP, zatímco samotné použití TNF-α efektivitu léčby nezvyšuje [7].
Technika provedení ILP
Technické provedení hypertermické ILP obecně spočívá v preparaci cév dané lokality a následné kanylaci pro zajištění lokálního mimotělního oběhu. Volba místa kanylace závisí na lokalizaci a cévním zásobení nádoru a event. metastáz. Na horní končetině nejčastěji kanylujeme brachiální, event. axilární cévy z krátké, kosmeticky příznivé kožní incize. Současně preparujeme v. basilica, která se průsvitem často vyrovná hluboké brachiální žíle a dle našich zkušeností umožnuje zvýšení minutového průtoku až o 20 % (obr. 1). Při ILP dolních končetin se s problémem nedostatečného průtoku a stability teploty při správné poloze žilní kanyly ve v. femoralis nesetkáváme.
Image 1. Schéma kanylace pro mimotělní oběh při ILP horní končetiny. 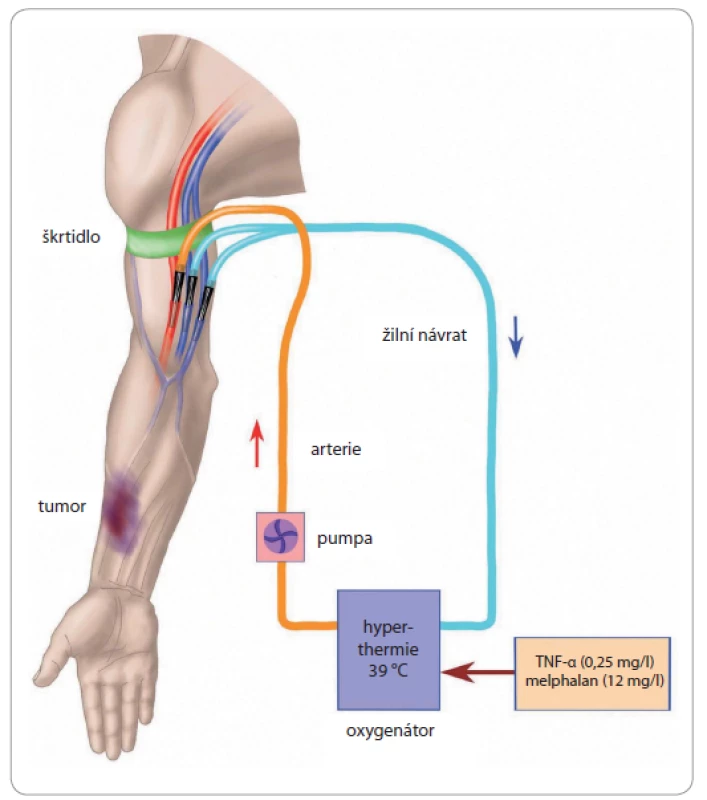
Tepenná linka cestou arteria brachialis, žilní návrat zajištěn kanylací vena basilica a vena brachialis. Centrálně škrtidlo, spolu s centrálním uzávěrem velkých cév, minimalizuje únik perfuzátu do systémového oběhu během výkonu. Kanylace zvolených tepen a žil se provádí z příčné tomie cévy asi v rozsahu poloviny jejich obvodu. Centrálně jsou hlavní cévy při plné heparinizaci dočasně uzavřeny svorkami. Součástí přístroje pro mimotělní oběh je oxygenátor zajištující výměnu plynů, aby se minimalizovalo riziko hypoxie končetiny po dobu její perfuze. Izolace kolaterál se provádí naložením a utažením dvou Esmarchových škrtidel nebo pneumatického turniketu proximálně od perfundované oblasti. Pokud není tumorem postižena vlastní ruka nebo chodidlo, měly by být chráněny bandáží podle Esmarcha (expulzní bandáž) z důvodu ochrany Vater-Paciniho tělísek. I tuto bandáž nakládáme až po celkové heparinizaci pacienta z důvodu prevence trombóz v cévním řečišti ruky, resp. chodidla.
Výměník tepla zajištuje potřebné ohřátí roztoku tak, aby cílová teplota tkání dosahovala 39 °C. Monitorování cílové teploty je průběžně zajišťováno senzory svalového a podkožního teploměru. Lokální hypertermii napomáhá uložení končetiny do sterilní vodní podložky. Standardní doba ohřevu končetiny je kolem 30 min.
Po dosažení cílové teploty tkání (38–39 °C) je do perfuzátu přidán tasonermin. Perfuzát cirkuluje v kompartmentu končetiny po dobu 10 min a de facto slouží ke zvýšení citlivosti cílové tkáně k cytostatickým účinkům melfalanu. Dávkování tasonerminu je standardizováno. Ve starších léčebných schématech byla při perfuzi dolní končetiny aplikována dávka 3–4 mg (high-dose TNF), při perfuzi horní končetiny dávka 3 mg. Novější schémata snižovala dávku tasonerminu na 2 mg (low-dose TNF), nedoporučuje se však podávat dávku nižší než 0,25 mg/l perfundovaného objemu končetiny. Vyšší dávka je spojena s vyšší četností kompletní odpovědi.
Následně je mírně zvýšena teplota perfuzátu (39–40 °C), přidán roztok cytostatika (melfalan) v množství, které závisí na objemu končetiny. Standardně podáváme 12 mg/l objemu horní končetiny (resp. 10 mg/l objemu dolní končetiny). Objem končetin je možno stanovit několika metodami, nejběžněji výpočtem objemu válcových segmentů. Poločas rozpadu cytostatika je krátký, proto se jeho příprava zahajuje současně se zahájením perfuze. Hlavním faktorem určujícím eliminační poločas u pacientů je spontánní degradace spíše než metabolizace. Doba perfuze s cytostatikem je 90 min, a to za dodržení dosažené teploty. Na závěr jsou do arteriální linky přidány 2 l izotonického roztoku k vymytí perfuzátu. Ten je likvidován dle zásad práce s biologickým materiálem a cytostatiky. Po dekanylaci provedeme příčnou suturu arteriotomie a venotomií, event. s jejich rekonstrukcí.
Bezpečnost ILP
Základní podmínkou bezpečnosti ILP při použití tasonerminu je peroperační monitorování úniku perfuzátu z končetiny do systémového oběhu. Krev systémového oběhu, stejně jako perfuzát (oběh v kompartmentu končetiny a systému hadic mimotělního oběhu), jsou označeny vypočteným množstvím radiofarmaka na bázi albuminu značeného 99mTc, avšak v řádově rozdílné koncentraci. Pomocí scintilační sondy (s krystalem na bázi jodidu sodného s příměsí thalia) směrované nad prekordium se sleduje aktivita v systémovém oběhu, která by měla být v ideálním případě konstantní (obr. 2) [11]. Případný únik perfuzátu je charakterizován nárůstem aktivity v prekordiu. Je běžné, že během perfuze dochází k mírnému průniku tekutiny z oběhu izolovaného kompartmentu končetiny do oběhu systémového (např. krevním oběhem dlouhých kostí). Na základě hodnoty rostoucího systémového pozadí lze snadno výpočtem odhadnout aktuální únik i očekávaný celkový únik na konci perfuze. Za předpokladu, že se do kolaterálního oběhu aplikovalo 10× více aktivity a že objem izolovaného kompartmentu končetiny je mnohem menší než objem systémového oběhu, je maximální dovolený nárůst systémového pozadí roven přesně 2,0, což odpovídá maximálně tolerovanému 10% úniku perfuzátu do systémového oběhu. Reálně je však hodnota úniku během operace menší, ve většině případů mezi 1 a 3 %. Celý řetězec monitoringu je zatížen řadou náhodných i systematických chyb a je třeba uvažovat interval spolehlivosti úniku min. ± 1 procentní bod v okolí odhadované hodnoty. Dále je třeba vést v patrnosti, že tímto postupem se de facto monitoruje pouze koncentrace radiofarmaka s předpokladem, že radiofarmakum z kolaterálního oběhu se distribuuje stejně jako účinná látka. Radiační zátěž personálu je vzhledem k malému množství 99mTc značeného radiofarmaka a nízké frekvenci zákroku prakticky zanedbatelná. Radiační zátěž pacienta je rovněž zanedbatelná.
Image 2. Scintilační kamera (A) a typický průběh monitorovací křivky (B). 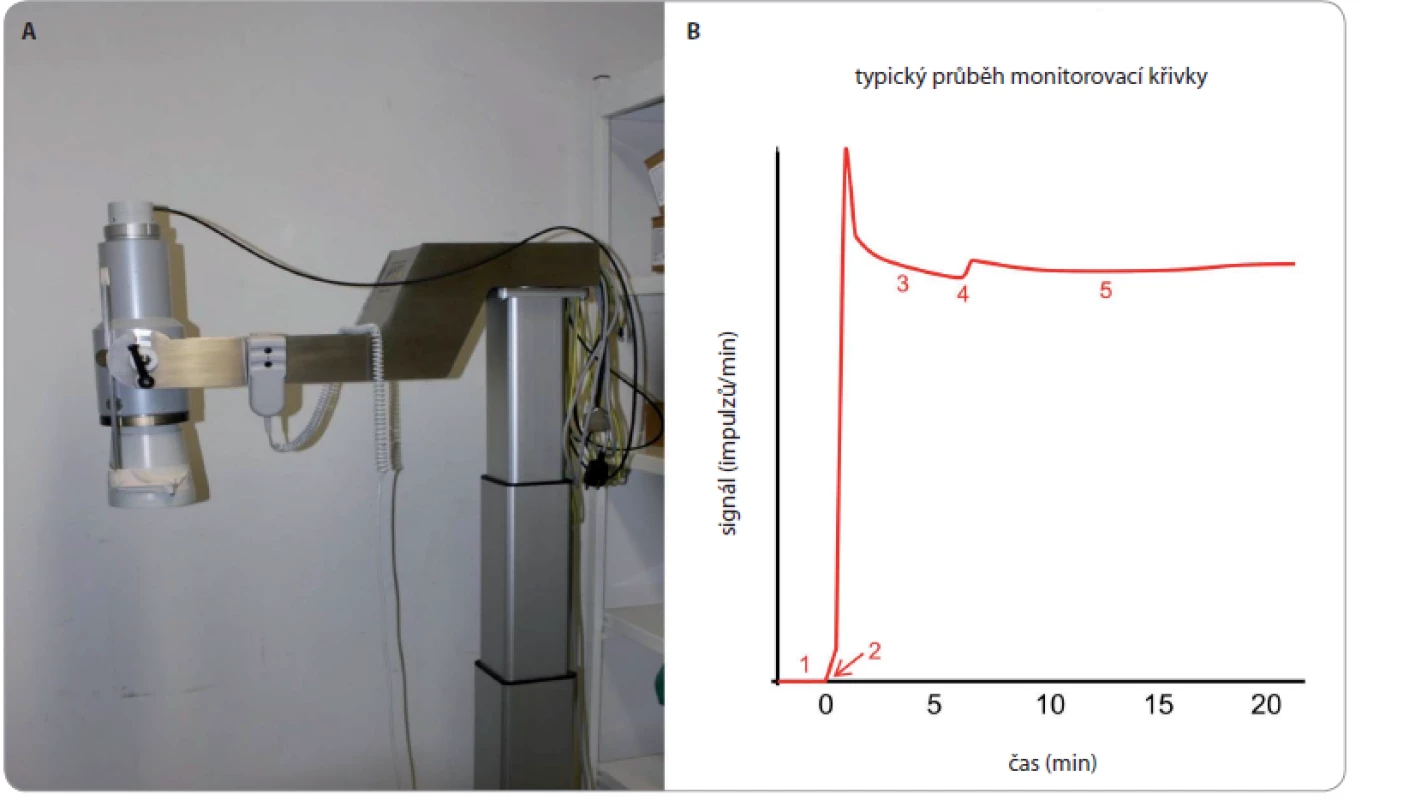
1 – měření pozadí, 2 – aplikace radiofarmaka do systémového oběhu, 3 – homogenizace aktivity v krvi se stabilizací signálu, 4 – aplikace radiofarmaka do perfuzního oběhu s mírným skokovým zvýšením signálu, 5 – perfuze končetiny při konstantním signálu Ilustrační kazuistiky
Z celkového počtu 55 ILP uskutečněných na našem pracovišti od roku 2009 bylo na horní končetině provedeno devět výkonů. Pacienti se sarkomem měkkých tkání (n = 4) tvoří prakticky stejný počet jako pacienti s maligním melanomem horní končetiny (n = 4 + 1× reoperace). Pro ilustraci uvádíme případy tří pacientů.
Kazuistika I
U 66leté pacientky s recidivujícím pleomorfním nediferencovaným sarkomem na předloktí pravé horní končetiny po opakovaných resekčních výkonech v průběhu posledních 5 let, která byla indikována k amputaci horní končetiny, jsme provedli ILP jako alternativní výkon požadovaný pacientkou. Před operací byla velikost recidivy tumoru 4 × 8 cm (viz MRI nález). Jednalo se o plošný tumor, terén předloktí modifikován několika resekčními výkony, které byly provedeny od roku 2011, vč. plastiky defektu na předloktí. Lokání nález a MRI vyšetření shodně ukázaly úplnou regresi nálezu 3 měsíce po výkonu (obr. 3), následně je nemocná tč. sledována 6 měsíců po operaci v dobrém stavu.
Image 3. U 66leté pacientky s recidivujícím pleomorfním nediferencovaným sarkomem na předloktí pravé horní končetiny, která byla původně indikována k amputaci horní končetiny, jsme provedli ILP. 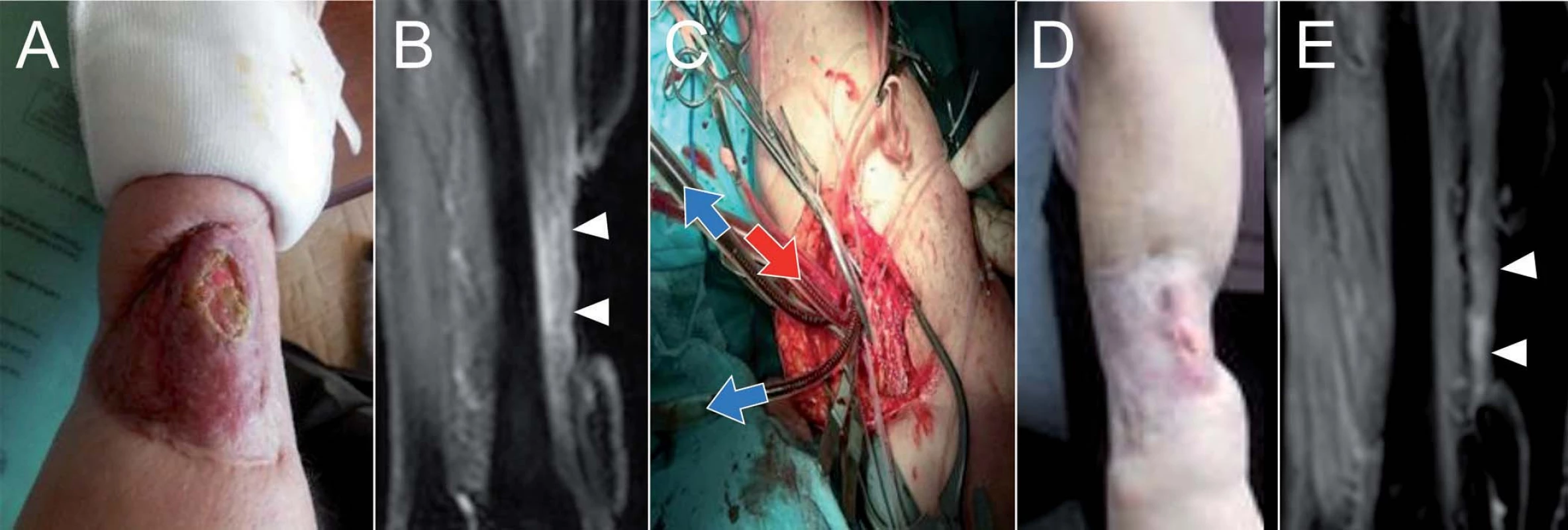
Předoperační fotografie (A) a MRI vyšetření (B), peroperační fotografie (C) se zobrazením dvou žilních kanyl (modré šipky) a jedné tepenné kanyly (červená šipka), fotografie (D) a MRI vyšetření (E) 3 měsíce po výkonu ukazující regresi nálezu. Kazuistika II
Druhá pacientka s diagnózou pleomorfního nediferencovaného sarkomu (G III, pT1b M0 N0) předloktí levé horní končetiny, která odmítla amputaci, byla indikována k paliativní ILP (obr. 4). Po 2 měsících od výkonu došlo k částečné regresi a byla provedena lokální resekce reziduálního nádoru.
Image 4. Pacientka s diagnózou pleomorfního nediferencovaného sarkomu (G III, pT1b M0 N0) předloktí levé horní končetiny, která odmítla amputaci, podstoupila paliativní ILP. 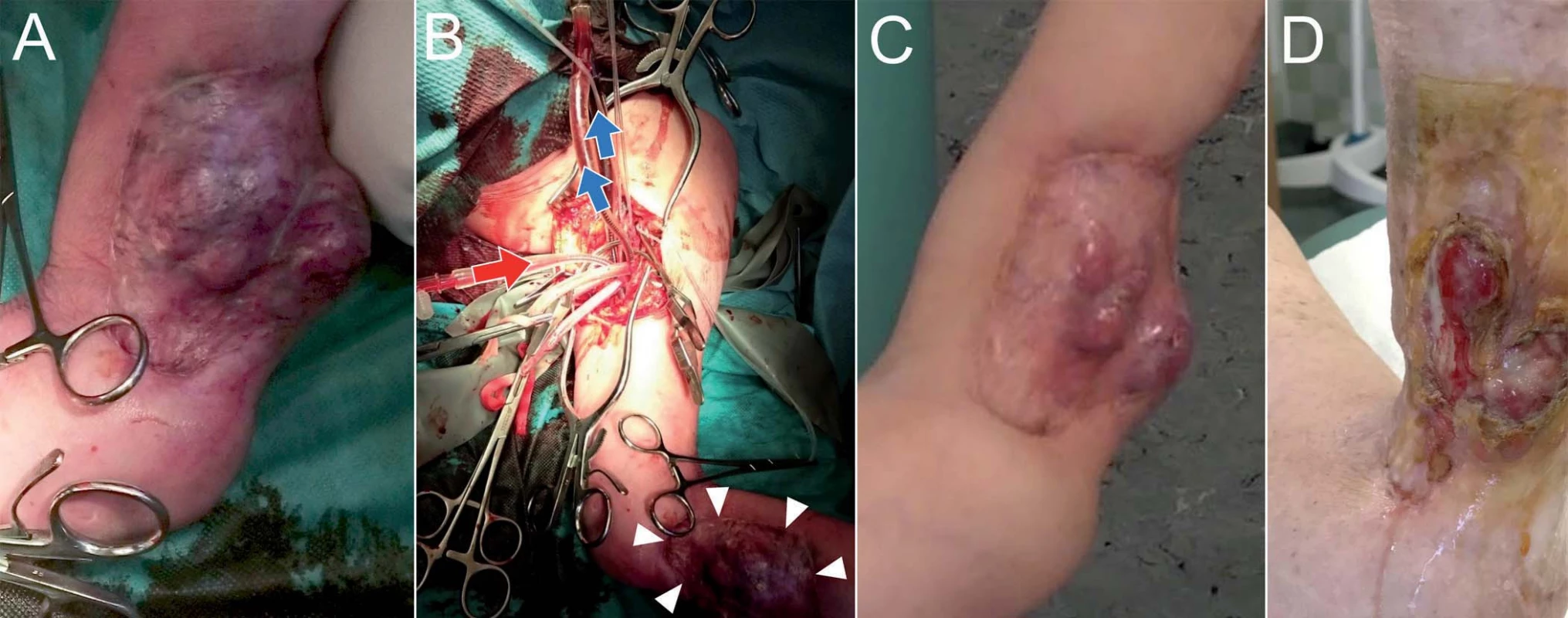
Po 2 měsících od výkonu došlo k částečné regresi a byla provedena lokální resekce reziduálního nádoru. Peroperační fotografie (A), fotografie 2 měsíce po výkonu ukazující regresi nádoru (B), fotografie lokálního nálezu po resekci reziduálního nádoru (C). Kazuistika III
U 89letého pacienta s asi roční anamnézou mokvavého nehojícího se ložiska v oblasti distálního článku palce pravé horní končetiny byl diagnostikován akrolentiginózní maligní melanom. Po amputaci palce byl tumor definitivně hodnocen jako Breslow 3,4 mm, Clark IV, s ulcerací, bez známek regrese. V pravé axile byla zastižena jedna sentinelová uzlina, která byla hodnocena jako pozitivní, ostatních sedm uzlin nebylo nádorem infiltrováno, proto s ohledem na věk pacienta nebylo přikročeno k radikální exenteraci. Po 6 měsících od amputace byl zaznamenán výsev mnohočetných intranzitních kožních metastáz (obr. 5). Molekulárně biologickými metodami nebyla prokázána v nádoru mutace BRAF v kodonu 600 a 601, u pacienta tedy byla zvažována systémová chemoterapie. Vzhledem k věku, komorbiditám a současně i v souhlasu s přáním pacienta byla provedena ILP. Po provedeném výkonu došlo k rychlému oploštění mnohočetných intranzitních metastáz, paradoxně došlo ale i k jejich barevnému zvýraznění. Histologicky ve vyšetřené následné excizi z těchto černých makul však byl zastižen pouze nepříznačný obraz regresivní změny, slučitelný s klinicky zvažovanou regresí melanocytární léze, jejíž reziduální struktury však nebyly zastiženy ani s použitím imunohistochemického vyšetření. V průběhu následujících 18 měsíců u většiny regredovaných ložisek přetrvával tento zcela plošný makulózní charakter, pouze v ojedinělém případě byla patrná růstová aktivita. Tato sporadická aktivní zóna byla excidována, histologicky byl nález slučitelný s metastázou melanomu do kůže. Ani při opakovaných PET/CT vyšetřeních však nebyla prokázána generalizace onemocnění. V tomto případě byla dosažena jednorázovým výkonem ILP u pacienta ve vysokém věku velmi dobrá kontrola onemocnění bez potřeby následné další onkologické léčby. Bylo současně dosaženo maximálního udržení kvality života pacienta, uchování kompetence a současně byla minimalizována i nutnost hospitalizační péče.
Image 5. Pacient, 89 let, s lokálně pokročilým melanomem palce pravé ruky. 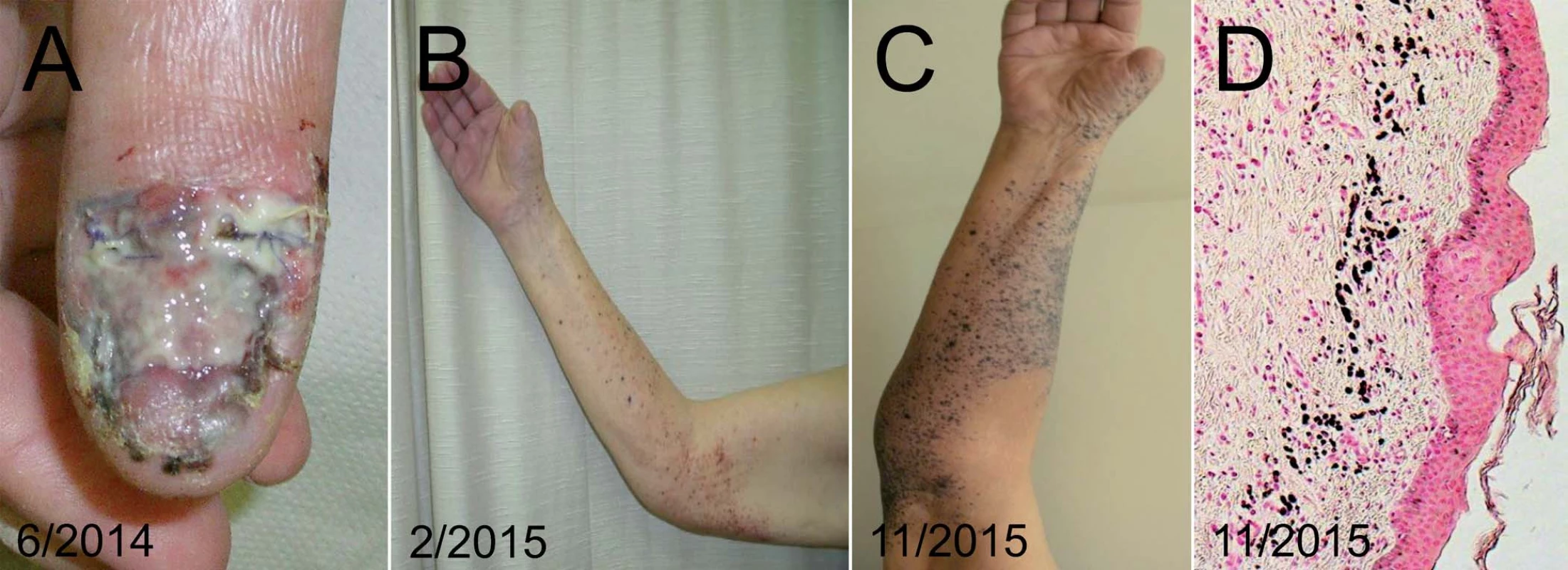
Pacient podstoupil amputaci palce – primární nádor (A), foto po zhojení pahýlu (B), s nálezem výsevu četných in-tranzitních metastáz na horní končetině. Stav po provedení ILP pravé horní končetiny, klinický obraz regrese s makulozními reziduálními pigmentacemi (C). V bioptickém preparátu (D) je patrný histologický obraz regrese s početnými melanofágy, ale bez zastižení nádorových struktur. Kazuistika IV
Pacient, 25 let, s roční anamnézou progredující rezistence na volární straně levého distálního předloktí se bál amputace, a proto navštívil lékaře až poté, co nemohl používat myš při práci grafika. Histologicky byl ověřen vřetenobuněčný rhabdomyosarkom G3. Pro odmítnutí ablativního výkonu byla na onko-týmu zvážena, vzhledem k příznivé histologické diagnóze, možnost kombinované terapie s využitím ILP. Pacient absolvoval čtyři třídenní cykly HD ifosfamid + doxorubicin + etoposid v intervalech 3 týdnů. Následně byl referován k provedení ILP s TNF-α na levé horní končetině. Poté byl podán ještě 5. cyklus stejné chemoterapie, po kterém následovala, v důsledku výrazného zmenšení nádoru, široká, ale v oblasti interoseální membrány jen intralezionální totální exstirpace nádoru, který histologicky vykazoval 10% vitalitu a na několika místech dosahoval až k hranici resekce. Z tohoto důvodu následovala ještě adjuvantní radioterapie 60 Gy (obr. 6). V současné době je pacient 8 měsíců od zahájení léčby bez známek onemocnění, jen s minimálním omezením supinace, volární a dorzální flexe, pracuje a opět hraje na kytaru. Tato kazuistika je příkladem alternativní indikace ILP v rámci komplexní onkologické péče, kdy pacient jednoznačně odmítá ablativní výkon a má příznivou chemo-a radiosenzitivní histologickou diagnózu, u které lze předpokládat příznivou odpověď na chemoterapii potencovanou ILP. Přes všechny tyto faktory však byla u uvedeného pacienta dosažena jen 90% a nikoli 100% histologická odpověď. Z tohoto důvodu by bylo chybné se domnívat, že kombinace jen chemoterapie s ILP, bez chirurgické a radiační léčby, bude dostatečnou pro dosažení dlouhodobé či trvalé lokální remise sarkomů měkkých tkání.
Image 6. Pacient, 25 let, s rhabdomyosarkomem na distálním předloktí (A). 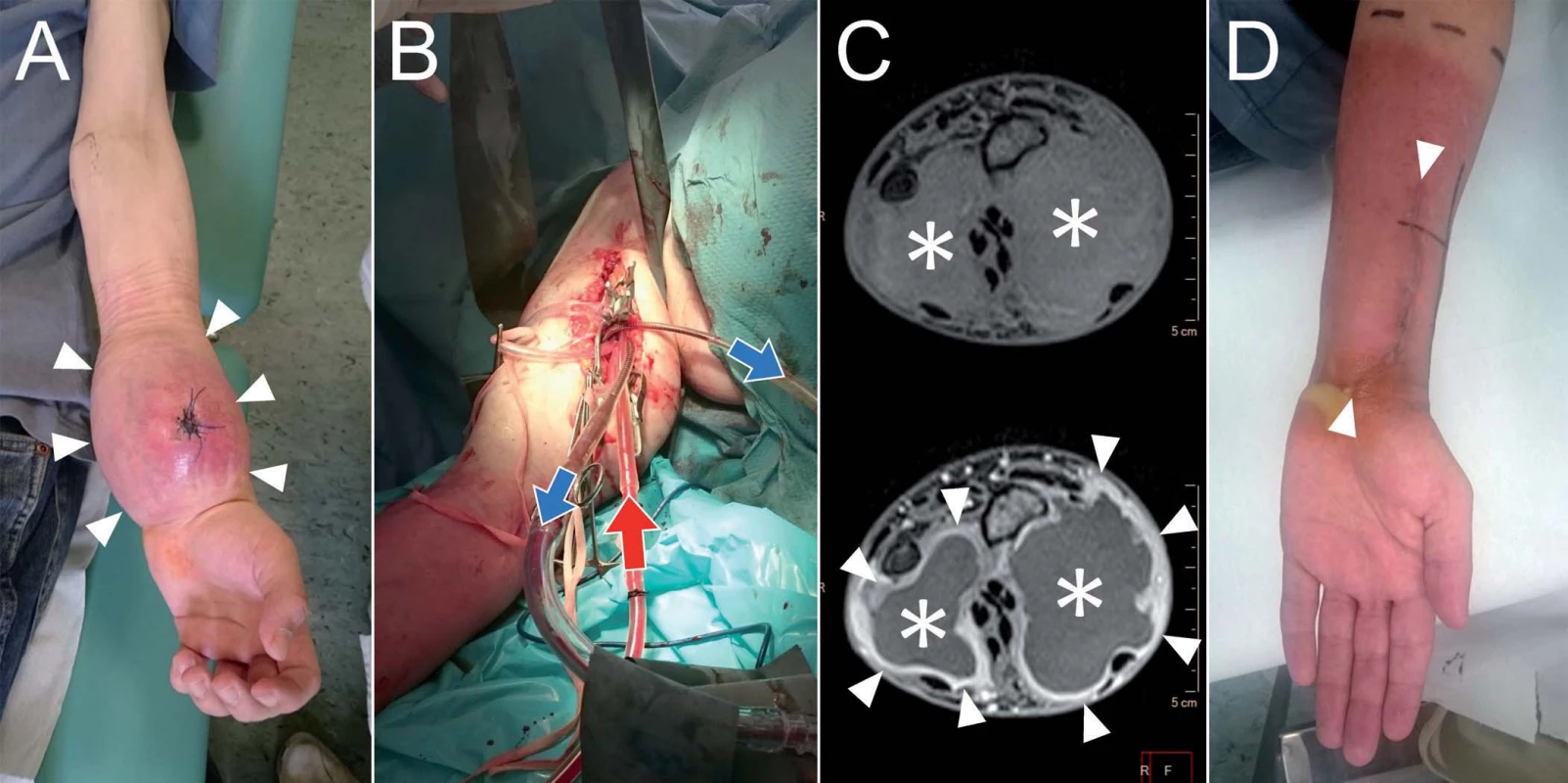
Pacient podstoupil ILP (B, peroperační foto). Na kontrolním MRI vyšetření (C, nativní a postkontrastní T1 vážené obrazy) 5 týdnů je patrná kolikvace centrální části nádoru (*) a sycení jeho pouzdra (šipky). Následně provedena extirpace reziduálního nádoru a zahájena radioterapie (D). Závěr
Hypertermická ILP s použitím kombinace tasonerminu (TNF-1α) a melfalanu rozšiřuje terapeutické možnosti u lokálně neresekovatelných nebo obtížně resekovatelných sarkomů měkkých tkání končetin u pacientů, kteří by jinak podstoupili amputaci končetiny. V ČR je indikace k léčbě stanovena v rámci doporučení Modré knihy České onkologické společnosti ČLS JEP. Všeobecně přijímaná je indikace k této léčbě u vybraných pacientů s maligním melanomem, s četnými intranzitními metastázami, které jsou omezené na končetinu. Pracoviště Všeobecné fakultní nemocnice, podílející se na léčbě nemocných pacientů, byla certifikována pro použití TNF-α v rámci ILP končetin v roce 2011. Zatím chybí standardní úhradový mechanizmus. Hypertermická ILP by měla být prováděna ve specializovaných centrech s funkčním mezioborovým týmem.
Vzhledem k relativně malé hmotnosti horní končetiny a jejímu většímu povrchu dochází k výraznějším tepelným ztrátám jak ze samotné končetiny, tak i z přívodných a odvodných hadic systému pro mimotělní oběh. Technika současné kanylace povrchního i hlubokého žilního systému horní končetiny zlepšuje drenáž, přináší vyšší minutový průtok přístrojem pro mimotělní oběh, který umožnuje při standardním teplotním gradientu ve výměníku tepla rychlejší ohřátí končetiny (resp. perfuzátu v kompartmentu) a spolehlivě udržet stabilní teplotní prostředí s předpokládaným zlepšením synergického působení teploty, TNF-α a lokálně vysoké koncentrace melfalanu k dosažení maximálního léčebného účinku.
Poděkování
Autoři děkují Mgr. Janu Kacvinskému z Anatomického ústavu 1. LF UK v Praze za zhotovení grafického schématu principu metody. Děkujeme též za poskytnutí MRI dokumentace Radiodiagnostické klinice Nemocnice Na Bulovce v Praze a pracovišti Dr. Magnet, s. r. o., Bratislava, SK.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Miroslav Špaček, Ph.D.
II. chirurgická klinika kardiovaskulární chirurgie 1. LF UK a VFN
U Nemocnice 2
120 00 Praha
e-mail: mirekspacek@seznam.cz
Obdrženo: 8. 1. 2017
Přijato: 15. 1. 2017
Sources
1. Creech O, Krementz ET, Ryan RF et al. Chemotherapy of cancer: regional perfusion utilizing an extracorporeal circuit. Ann Surg 1958; 148 (4): 616–632.
2. Koops HS, Garbe C, Hohenberger P. Is isolated limb perfusion of metastatic malignant melanoma of the extremity worthwhile? Eur J Cancer 1996; 32A (10): 1633–1640.
3. Krementz ET, Carter RD, Sutherland CM et al. Regional chemotherapy for melanoma. A 35-year experience. Ann Surg 1994; 220 (4): 520–535.
4. Fraker DL, Alexander HR, Ross M et al. A phase III trial of isolated limb perfusion for extremity melanoma comparing melphalan alone versus melphalan plus tumor necrosis factor (TNF) plus interferon-gamma (IFN). Philadelphia: Lippincott Williams & Wilkins 2002 : 8.
5. Eggermont AM, Schraffordt Koops H, Klausner JM et al. Isolated limb perfusion with tumor necrosis factor and melphalan for limb salvage in 186 patients with locally advanced soft tissue extremity sarcomas. The cumulative multicenter European experience. Ann Surg 1996; 224 (6): 756–765.
6. Špaček M, Petruželka L, Lacina L et al. Tasonermin jako součást izolované perfuze končetin. [online]. Farmakoterapie 2011; 5. Dostupné z: http: //www.prolekare.cz/farmakoterapie-clanek/tasonermin-jako-soucast-izolovane-perfuze-koncetin-36816.
7. Taeger G, Grabellus F, Podleska LE et al. Effectiveness of regional chemotherapy with TNF-alpha/melphalan in advanced soft tissue sarcoma of the extremities. Int J Hyperthermia 2008; 24 (3): 193–203. doi: 10.1080/02656730701868387.
8. Moreno-Ramirez D, de la Cruz-Merino L, Ferrandiz L et al. Isolated limb perfusion for malignant melanoma: systematic review on effectiveness and safety. Oncologist 2010; 15 (4): 416–427. doi: 10.1634/theoncologist.2009-0325.
9. Dranoff G. Cytokines in cancer pathogenesis and cancer therapy. Nat Rev Cancer 2004; 4 (1): 11–22.
10. Wu Y, Zhou BP. TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion. Br J Cancer 2010; 102 (4): 639–644. doi: 10.1038/sj.bjc.6605 530.
11. Trnka J, Špaček M, Šírová V et al. Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu. Klin Onkol 2016; 29 (5): 375–379. doi: 10.14735/amko2016 375.
12. Kroon HM, Moncrieff M, Kam PC et al. Outcomes following isolated limb infusion for melanoma. A 14-year experience. Ann Surg Oncol 2008; 15 (11): 3003–3013. doi: 10.1245/s10434-008-9954-6.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue 3-
All articles in this issue
- Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislosti
- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Nové léky v terapii akutní myeloidní leukemie u starších pacientů
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
- Izolovaná perfuze horní končetiny s TNF-α – dvojitá kanylace žilního systému
- Mnohopočetný výskyt bazocelulárneho karcinómu – retrospektívna analýza 899 pacientov s biopticky verifikovanými léziami na jednom pracovisku
- Dlouhodobá kompletní odpověď metastázy kolorektálního karcinomu po biochemoterapii
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

