-
Medical journals
- Career
Sledování cirkulujících hladin estradiolu u pacientek s karcinomem prsu léčených inhibitory aromatázy – přínos v klinické praxi
: K. Petrakova 1,2; M. Krásenská 1; D. Valík 3,4; M. Holánek 1; M. Palacova 1; R. Demlová 4,5
: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Lékařská fakulta MU, Brno 2; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 3; RECAMO, Masarykův onkologický ústav, Brno 4; Oddělení klinických hodnocení, Masarykův onkologický ústav, Brno 5
: Klin Onkol 2016; 29(Supplementum 3): 50-57
: Review
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20163S50Inhibitory aromatázy v adjuvantním podání zlepšily léčebné výsledky u postmenopauzálních pacientek s časným karcinomem prsu. Neměly by však být používané u premenopauzálních pacientek. Menopauzální stav je jedním z nejdůležitějších kritérií pro výběr adjuvantní hormonální léčby. Mezi menopauzálním stavem a funkcí ovarií nemusí být přímý vztah, i pacientky s amenoreou můžou mít premenopauzální hladiny estradiolu. Složitější je situace u pacientek užívajících tamoxifen, který může zvyšovat hladiny estradiolu i u pacientek s amenoreou. Při změně adjuvantní hormonální léčby je proto u těchto pacientek nutné změřit hladiny estradiolu. Další skupinou pacientek, u kterých je třeba opatrnosti při indikaci inhibitorů aromatázy, jsou premenopauzální pacientky, u kterých byl menopauzální stav navozen chemoterapií. K obnovení ovariálních funkcí po podání chemoterapie může dojít po různě dlouhé době. V průměru to je 12 měsíců (4−59) a ne vždy musí být doprovázeno obnovením menstruace. Před nasazením inhibitorů aromatázy je proto důležité změřit hladiny estradiolu nejlépe opakovaně v odstupu 3−4 měsíců. U žen mladších 40 let je vysoká pravděpodobnost obnovení ovariálních funkcí, a proto by neměly být léčené inhibitory aromatázy samotnými. Z tohoto důvodu je sledování cirkulujících hladin estradiolu před léčbou inhibitory aromatázy hlavně u žen mezi 40. a 50. rokem života důležité.
Klíčová slova:
karcinom prsu – premenopauza – postmenopauza – perimenopauza – estradiol – inhibitory aromatázyÚvod
Karcinom prsu je nejčastější malignitou žen na celém světě. Incidence stoupá, zvláště ve vyspělých zemích západní Evropy a USA, a zvyšuje se s věkem – nejčastěji postihuje ženy ve věku 50–75 let. V roce 2011 bylo hlášeno v ČR 67,4 případu na 100 000 osob. Při stoupající incidenci v ČR mortalita stagnuje a za poslední roky dokonce klesá (v roce 2011 bylo hlášeno 15,39 úmrtí na 100 000 osob). Na tomto faktu se v nemalé míře podílí i účinnější léčba.
Předmětem zkoumání mnohých prací je otázka nalezení vztahu mezi cirkulujícími hladinami estrogenů a rizikem vzniku karcinomu prsu. Některé práce prokázaly tento vztah u postmenopauzálních žen. Ženy s vyšší hladinou cirkulujících estrogenů mají vyšší riziko vzniku karcinomu prsu. Cirkulující estrogeny jsou tvořeny z největší části estronem, estradiolem a estron sulfátem [1]. U premenopauzálních žen jsou estrogeny produkovány hlavně v granulózových buňkách ovarií, méně potom v jiných tkáních jako např. v mezenchymálních buňkách podkožního tuku, buňkách prsní žlázy a kostech [2]. U postmenopauzálních žen je produkce estrogenů v ovariích z velké části ukončena a hlavním zdrojem estrogenů se stane androstendion, který je produkovaný přibližně ze dvou třetin v kůře nadledvin a z jedné třetiny v ovariích. Androstendion se potom působením enzymu aromatázy mění zejména v tukové tkáni na estradiol [3].
Plazmatické a tkáňové hladiny estrogenů nemusí vždy korelovat. Hladina estradiolu měřená přímo v lyzátu nádoru je přibližně 20krát vyšší než plazmatická hladina estradiolu. Jedním z důvodů může být různá aktivita enzymu aromatázy v různých tkáních, ale příčinou mohou být i další faktory – lokální, např. vlastnosti intersticia, nebo celkové, např. hyperthyreoidizmus [4]. Dlouho se vedly diskuze o tom, zda je pro vznik nádoru důležitá pouze hladina estrogenů v nádoru, resp. v jeho stromatu, nebo se na něm podílí i plazmatická hladina estrogenů. Poslední práce však prokázaly význam nejenom hladin v nádoru, ale i plazmatických hladin estrogenů při vzniku karcinomu prsu [5]. Některé práce předpokládají, že by cirkulující hladina estradiolu mohla být měřítkem hormonální senzitivity karcinomu prsu a mohla by se využívat k individualizaci léčby pacientek [6].
Medián věku českých pacientek s karcinomem prsu v době stanovení diagnózy je 61 let. Přibližně 20 % pacientek v ČR je v době diagnózy mladší než 50 let a 15 % je ve věku 40–50 let [7]. Věk menopauzy u žen v Evropě je kolem 51 let. Velká část žen léčených pro karcinom prsu je tedy ve věku premenopauzálním nebo perimenopauzálním. Přibližně 75 % pacientek má karcinom prsu s pozitivními estrogenovými receptory (ER). Velmi důležitou součástí adjuvantní léčby těchto pacientek je hormonální léčba, která pro ně může být často přínosnější než chemoterapie. Důležité však je, aby byla indikována správně, což souvisí se správným určením menopauzálního stavu pacientek.
Řada klinických studií u postmenopauzálních žen prokázala větší účinnost adjuvantní hormonální léčby, jejíž součástí je inhibitor aromatázy, ve srovnání s tamoxifenem samotným. Výsledky těchto studií zohledňují i všechna mezinárodní doporučení. Součástí adjuvantní hormonální léčby postmenopauzálních pacientek by měl být inhibitor aromatázy buď jako iniciální léčba, nebo sekvenční léčba po 2–3 letech předchozí léčby tamoxifenem, hlavně u pacientek s vyšším rizikem relapsu onemocnění [8].
Standardem adjuvantní hormonální léčby u premenopauzálních pacientek je tamoxifen s nebo bez ovariální suprese, jíž lze dosáhnout podáváním LHRH (hormon uvolňující luteinizační hormon) agonistů nebo ovarektomií. Velká část premenopauzálních pacientek s pozitivními ER je však nejdříve léčena adjuvantní chemoterapií, která může následně ovlivnit činnost ovarií, a tím snížit i hladiny cirkulujících estrogenů.
Tamoxifen a inhibitory aromatázy mají rozdílný mechanizmus účinku. Tamoxifen je účinný nezávisle na věku pacientky, menopauzálním stavu nebo předchozím podání chemoterapie [9]. Působí přímo na nádorové buňky tím, že se váže kompetitivně s estradiolem na ER v jádře nádorových buněk. Má několikanásobně vyšší afinitu k těmto receptorům než estradiol, a proto estradiol z vazby vytěsňuje. Kromě toho má vliv na řídící hormonální osu hypotalamus – hypofýza–ovaria. U postmenopauzálních pacientek může proto docházet při léčbě tamoxifenem k poklesu hladin luteinizačního hormonu (LH) a folikulostimulačního hormonu (FSH), nemá však obvykle vliv na hladinu estradiolu [10].
Inhibitory aromatázy snižují hladinu estrogenů inhibicí nebo inaktivací enzymu aromatázy v periferní tkáni a v nádoru. U žen s reziduální ovariální funkcí může pokles estrogenů cestou inhibice aromatázy způsobit zvýšení hladin gonadotropinů cestou zpětné vazby, což může mít za následek zvýšenou produkci estrogenů v ovariích a zvýšenou stimulaci nádorových buněk [11]. Inhibitory aromatázy byly původně využívány právě k navození ovulace u premenopauzálních pacientek. V této indikaci můžou být dokonce účinnější než selektivní modulátor ER, clomiphen citrát, který se k tomuto účelu obvykle užívá. Kombinace LHRH agonistů a inhibitorů aromatázy je dodnes používána ke stimulaci ovulace před in vitro fertilizací [12].
Určení menopauzálního stavu pacientek
Jedním z hlavních rozhodovacích kritérií při výběru adjuvantní hormonální léčby je menopauzální stav pacientky. Neexistuje přitom jednoznačná definice menopauzálního stavu. NCCN definuje menopauzu u pacientek mladších 60 let jako amenoreu v trvání více než 12 měsíců za předpokladu, že pacientka není léčená chemoterapií, tamoxifenem nebo ovariální supresí a pacientka má postmenopauzální hladinu estradiolu a FSH. V literatuře se můžeme setkat s různými definicemi menopauzálního stavu. Dokladují to klinické studie, které zkoumaly přínos inhibitorů aromatázy v adjuvantní léčbě pacientek s karcinomem prsu, které měly různé definice menopauzálního stavu jako kritérium pro zařazení pacientky do studie. Nejpřísnější kritéria pro definici menopauzálního stavu, který je při hodnocení účinnosti inhibitorů aromatázy důležitý, byla ve studii BIG-1-98 [13]. Se stejným problémem se můžeme setkat i v současně probíhajících klinických studiích, které menopauzální stav definují různě anebo určení menopauzálního stavu ponechávají na lékaři samotném.
U většiny žen dochází k navození menopauzy mezi 40. a 50. rokem života, u malé části (3–5 %) je to již před 40. rokem života. Biochemicky lze tento stav definovat jako vzestup cirkulujících hladin FSH a pokles hladin estradiolu. K těmto změnám však nedochází skokem, ale postupně. Nejdříve se zvedá hladina FSH, a to někdy již 10 let před menopauzou ženy a až následně klesá hladina estradiolu. Období postupného poklesu hladin estradiolu lze označit za perimenopauzu neboli přechod. Délka perimenopauzy je u žen různě dlouhá. Pracovní skupina pro problematiku reproduktivního stárnutí označila FSH za nejlepší marker určení menopauzálního stavu žen [14].
Při indikaci adjuvantní léčby inhibitory aromatázy by si měl být onkolog jist, že je pacientka menopauzální, tedy že má pacientka nízkou hladinu plazmatického estradiolu. Jinak by byla léčba inhibitory aromatázy nejenom neúčinná, ale dokonce kontraindikována. Proto je před nasazením inhibitorů aromatázy u perimenopauzálních pacientek vhodné provést odběr ke stanovení plazmatické hladiny FSH a estradiolu nejlépe opakovaně v odstupu 2–3 měsíců. Plazmatické hladiny estradiolu a FSH totiž mohou v případě zachování reziduálních ovariálních funkcí kolísat. Situaci může komplikovat i předchozí dlouhodobá hormonální antikoncepce (HAK), kterou velká část žen ve věku mezi 45. a 50. rokem života užívá.
Příklad z klinické praxe
U 48leté pacientky byl v červnu 2012 diagnostikován levostranný karcinom prsu cT1 N0 M0. V době diagnózy pacientka již 30. rokem užívala HAK a nemenstruovala. Pacientka podstoupila parciální mastektomii a vyšetření sentinelové uzliny. Histologické vyšetření potvrdilo invazivní duktální karcinom, pT1c N0 (0/2) M0, G1, ER 100 %, PgR 100 %, Ki-67 6 %, L0 V0, HER2 amplifikace. Vzhledem k příznivému fenotypu nádoru, vysoké pozitivitě hormonálních receptorů a jeho velikosti jsme se u pacientky klonili k adjuvantní léčbě bez chemoterapie, tedy pouze adjuvantní hormonální léčbě a adjuvantnímu podání trastuzumabu. Tuto možnost nabízela klinická studie III. fáze Safe HER, do které jsme pacientku zařadili. Po měsíci léčby začala mít pacientka výrazné potíže s projevy CNS symptomatologie – závratě, nejistota při chůzi, diplopie, neschopnost delší chůze. S podezřením na metastatické postižení CNS byla došetřena magnetickou rezonancí, podezření však nebylo potvrzeno. Potíže ustoupily po vysazení tamoxifenu. U pacientky byla indikována změna hormonální léčby na inhibitory aromatázy, a proto byly odebrány hladiny FHS a estradiolu. Nebyla však nalezena shoda – hladina FSH byla evidentně postmenopauzální (61,6 IU/l), zatímco hladina estradiolu výrazně premenopauzální (1 983 pmol/l). Za měsíc jsme provedli kontrolní odběr, kdy obě hodnoty indikovaly postmenopauzální stav pacientky (FSH 78 IU/l a estradiol 38 pmol/l) (tab. 1). Pacientka zahájila léčbu inhibitory aromatázy. Pro potvrzení menopauzy jsme hladinu hormonů kontrolovali za další měsíc, v říjnu 2012, kdy byla naměřena hodnota FSH 26 IU/l a hodnota estradiolu 1 959 pmol/l, a v listopadu 2012 FSH 2,2 IU/l a estradiol 3 777 pmol/l. Léčba inhibitory aromatázy byla u pacientky vysazena a pro podezření z extraovariální produkce estradiolu byla pacientka došetřena pomocí CT. Diseminace onemocnění ani duplicitní malignita však nebyly potvrzeny. Vzhledem k premenopauzálním hodnotám FSH a estradiolu byla u pacientky indikována kombinace LHRH analoga a inhibitorů aromatázy.
1. Hladiny FSH a estradiolu v čase. 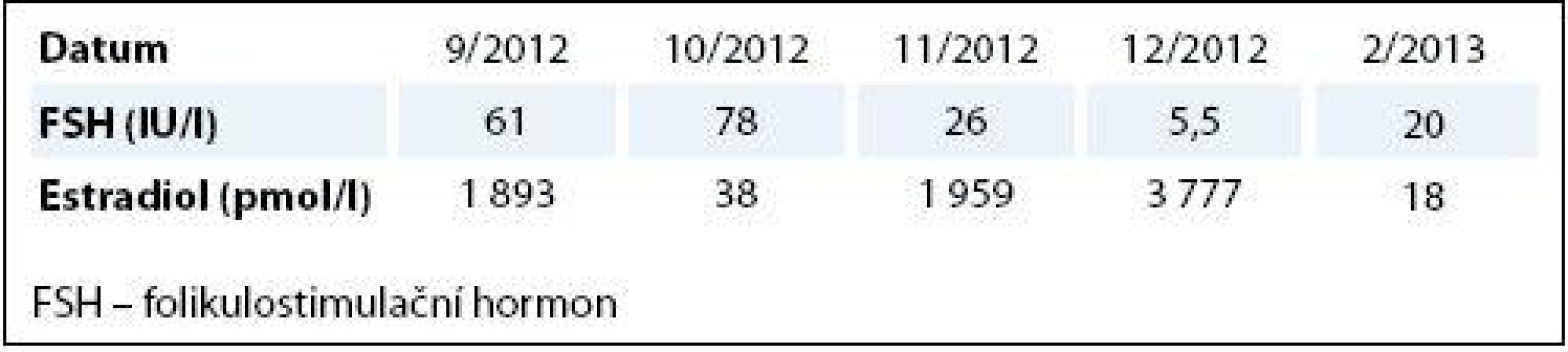
FSH – folikulostimulační hormon Extrémně kolísavé hodnoty FSH a estradiolu u pacientky lze vysvětlit předchozím dlouhodobým užíváním HAK, co způsobilo dlouhodobý útlum osy hypotalamus–hypofýza–ovaria.
Metody měření hladin estradiolu a FSH
V běžné klinické praxi se plazmatické hladiny hormonů měří pomocí metod na principu imunoanalýzy certifikovaných pro in vitro diagnostiku, které jsou však méně citlivé pro sledování nízkých hladin estrogenů. Dle metod používaných v Masarykově onkologickém ústavu (Roche FSH a Estradiol III) by hladina FSH u postmenopauzálních pacientek měla být vyšší než 25,8 IU/ml a hladina estradiolu by neměla být vyšší než 183 pmol/l [15]. Některé zdroje udávají hladinu FSH u postmenopauzálních žen vyšší než 40 IU/ml, což je v souladu s požadavky některých klinických studií [16].
Užívané analytické metody stanovení hladiny estradiolu byly historicky vyvinuty jako technika měření hormonálních hladin premenopauzálních žen pro potřeby vyšetření v reprodukční medicíně, kde se fyziologické hodnoty estradiolu pohybují zhruba mezi 100 a 1 000 pmol/l a výše. Výhodou těchto technik – prakticky vždy imunoesejí – je jejich relativní jednoduchost, robustnost, rychlost provedení testu, přijatelná cena a malý objem vzorku krve (resp. séra nebo plazmy), z něhož je vyšetření možné provést. Určitá limitace správnosti výsledku je v tomto případě akceptovatelná a nemá žádný zásadní dopad na klinické rozhodování, kdy navíc často posuzujeme změnu a trend hodnot v čase. Tato limitace správnosti stanovení může mít řadu důvodů analytické a neanalytické povahy, v praxi je většinou dána interferencemi látek steroidní povahy v analyzovaném klinickém vzorku (typicky fulvestrant). V případě měření hladin estradiolu u postmenopauzálních žen a zejména potom žen s karcinomem prsu léčených inhibitory aromatázy je však jejich užití problematické a v určitých situacích může ne zcela přesný výsledek nebo jeho chybná interpretace vést k nesprávnému rozhodnutí o léčbě konkrétní pacientky (graf 1). Většina běžně užívaných imunoanalytických neextrakčních technik neměří hodnotu estradiolu nižší než 30 pmol/l. Na našem pracovišti je používána metoda, jejíž mez stanovitelnosti je 18,4 pmol/l (www.mou.cz). Ze studií, kde byly hladiny estradiolu u žen léčených inhibitory aromatázy měřeny vysoce senzitivními metodami (dnes obvykle LC/MS s extrakcí a zahuštěním vzorku) víme, že by měly být nižší než 10 pmol/l, avšak neumíme dobře vyhodnotit, zda je pacientka účinně léčena, pokud jsou během léčby její naměřené hodnoty estradiolu např. 30 pmol/l či 50 pmol/l. Neumíme rozpoznat, zda je to výsledek možných interakcí během měření (limitace některých metod je dobře popsána zejména při léčbě steroidním inhibitorem aromatázy exemestanem), nebo známka neúčinné léčby. Někteří autoři se dokonce domnívají, že pracoviště, které nemá dostupnou vysoce senzitivní techniku měření, by nemělo vůbec ženy inhibitorem aromatázy léčit [17]. Přehled metod měření hladin estradiolu, jejich výhod a limitací uvádí tab. 2. Nepřímé imunoeseje využívají preanalytickou purifikaci analytu – v případě stanovení estradiolu je estradiol separován od svého nosiče (sex hormone binding protein nebo albumin – SHBG) a od konjugovaných, ve vodě rozpustných estrogenů (např. estron-sulfát), které mohou zkříženě reagovat s anti-estradiol protilátkami užitými v metodě. Velmi vhodnou je tato metoda v kombinaci s chromatografií pro stanovení estradiolu v případě léčby steroidním inhibitorem aromatázy exemestanem. Bioeseje, jako např. HeLa cell DNA esej, jsou vysoce senzitivní techniky s detekčními limity estradiolu od 1,0 do 7,3 pmol/l. Jsou založeny na interakci ligand-protein, avšak namísto protilátky (antiséra) je použit fyziologický ligand, ER [18], nejsou však obvykle certifikovány pro in vitro diagnostiku.
1. Průběh hladin estradiolu a folikuly stimulujícího hormonu (FSH) u postmenopauzální pacientky s karcinomem prsu. 
Léčena adjuvantní chemoterapií na bázi antracyklinů a taxánů a adjuvantní hormonoterapií – v úvodu tamoxifen, pro jeho intoleranci výměna na letrozol, pro projevy oční alergie následně podáván exemestan. Je patrné ovlivnění hladiny FSH tamoxifenem. Zvýšení hladiny estradiolu při léčbě exemestanem může být způsobeno interferencí exemestanu a jeho metabolitů s estradiol antisérem. Měřeno metodou Cobas E601 firmy Roche. 2. Přehled metod měření estradiolu. 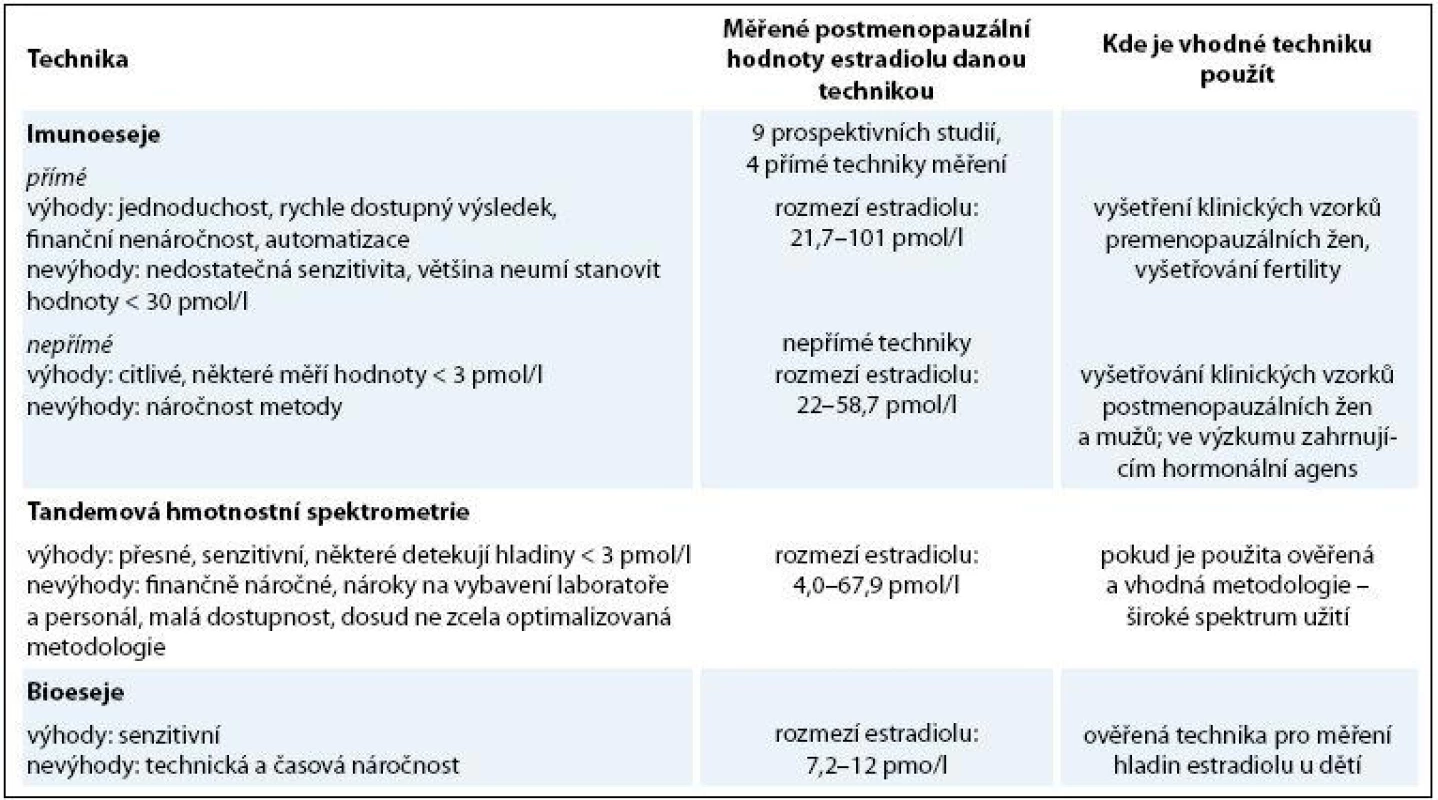
Volně upraveno dle [18]. Chemoterapií indukovaná amenorea
U velkého procenta premenopauzálních pacientek může dojít v důsledku podání adjuvantní chemoterapie ke snížení ovariálních funkcí, které mohou u části pacientek vést k trvalému navození chemoterapií indukované menopauzy (chemotherapy-induced amenorrhea – CIA) [19]. Četnost vzniku CIA je závislá na věku pacientky, délce chemoterapie a složení chemoterapie. Nejvyšší procento CIA způsobují hlavně alkylační látky (tab. 3).
3. Incidence amenorea po různých chemoterapeutických režimech [17]. ![Incidence amenorea po různých chemoterapeutických režimech [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ee22760b39b4e22cb7479c85832daf5c.jpg)
AC – doxorubicin a cyklofosfamid, CMF – cyklofosfamid, metotrexát a 5-fluorouracil, CAF/FEC – cyklofosfamid, doxorubicin, 5-fluorouracil/5-fluorouracil, epirubicin a cyklofosfamid Důvodem CIA je primární ovariální selhání po podané chemoterapii. Dochází ke snížení počtu sekundárních folikulů až k úplnému chybění folikulů s ovariální fibrózou, histologicky často identické se změnami u postmenopauzálních žen. Biochemicky se projevuje nízkou hladinou estradiolu a vysokou hladinou FSH a LH. U mladších žen může být CIA dočasná a k obnovení ovariálních funkcí dochází v 22–56 %, u starších v 0–11 %. K obnovení ovariálních funkcí po podání chemoterapie může dojít po různě dlouhé době. V průměru to je 12 měsíců (4–59) a ne vždy musí být doprovázeno obnovením menstruace. K obnovení ovariálních funkcí po chemoterapii může dojít výjimečně i v případech, když se naměřené plazmatické hladiny FSH a estradiolu pohybují v rozmezí určeném pro postmenopauzální stav [11,20].
Při zahájení léčby inhibitory aromatázy je potřeba myslet na to, že u pacientek premenopauzálních s ovariální produkcí estrogenů je léčba inhibitory aromatázy neúčinná, ba dokonce kontraindikovaná. Pokles estrogenů při léčbě inhibitory aromatázy by mohl cestou zpětné vazby zvýšit hladinu gonadotropinů a následně ještě zvýšit produkci estrogenů ve funkčních ovariích, a tím stimulovat růst nádorových buněk. Hladina estradiolu by při účinné léčbě inhibitory aromatázy měla být optimálně ≤ 5 pmol/l. Nízké plazmatické hladiny estradiolu je však problematické změřit pomocí metod obvykle používaných v biochemických laboratořích.
V důsledku poklesu plazmatických hladin estrogenů při léčbě inhibitory aromatázy mají pacientky často projevy atrofické vaginitidy (18,5 % ve studii ATAC) a dyspareunii (17,3 % ve studii ATAC) [21]. Tyto problémy bývají u žen léčených inhibitory aromatázy často řešeny vaginální aplikací estrogenů. Vstřebávání lokálních estrogenů je však interindividuálně variabilní. U pacientek, u nichž dochází ke zvýšenému vstřebávání cestou vaginální sliznice, může dojít ke vzestupu plazmatických hladin estradiolu a tím zrušení léčebného účinku inhibitorů aromatázy. Optimálním postupem by bylo měření hladin estradiolu před a po aplikaci lokálních estrogenů (graf 2). Tento postup je však v klinické praxi nereálný. Lokální léčbu estrogeny u pacientek léčených inhibitory aromatázy je proto potřeba důkladně zvážit a spíše se jí vyhnout [22,23].
2. Sérové hladiny estradiolu u žen se souběžným podáním inhibitorů aromatázy a estradiolu vaginálně(Vagifem). 
Podle [23]. Smith et al sledovali celkem 45 pa - cientek ve věku 39–52 let s CIA, které byly léčené inhibitory aromatázy. Pouze 73 % pacientek mělo postmenopauzální hodnoty plazmatických hladin hormonů a léčba inhibitory aromatázy u nich byla účinná. Podávání inhibitorů aromatázy u pacientek s CIA může dokonce způsobit rychlejší obnovení ovariálních funkcí. Jedna pacientka v sledovaném souboru během léčby dokonce otěhotněla bez předchozího obnovení menstruace [11].
Cuzick et al ve své metaanalýze klinických studií, které hodnotily úlohu LHRH analogů v adjuvantní léčbě premenopauzálních pacientek, potvrdili jejich přínos u pacientek mladších 40 let [24]. U pacientek s CIA musíme pamatovat na to, že ovariální funkce nemusí korelovat s menstruací. Pokud u pacientek s CIA indikujeme kombinaci tamoxifenu a LHRH analogů s úmyslem využít snížení ovariálních funkcí předchozí chemoterapií a s plánem nasadit LHRH analoga až po jejich obnovení, musíme pravidelně (nejlépe jednou za 3–4 měsíce) kontrolovat plazmatické hladiny hormonů jako markeru obnovení ovariálních funkcí. Podle našich zkušeností může často docházet při obnovování ovariálních funkcí nejdříve ke vzestupu estradiolu při jednoznačně postmenopauzálních hodnotách FSH, které mohou klesnout do hodnot premenopauzálních až v rozmezí několik měsíců.
Je potřeba se zmínit i o vhodnosti kontroly suprese hladin estradiolu u premenopauzálních pacientek, kterým jsou LHRH analoga podávaná s cílem snížení hladin estradiolu. U malého procenta pacientek, hlavně u pacientek s vyšším body mass indexem, může být efekt ovariální suprese při této léčbě nedostatečný, a tudíž je v léčbě zbytečné pokračovat [25].
Vliv tamoxifenu na plazmatické hladiny hormonů
Adjuvantní hormonální léčba se u pacientek s pozitivními hormonálními receptory nasazuje bezprostředně po skončení adjuvantní chemoterapie. Pacientky premenopauzální před zahájením léčby chemoterapií mohou mít v té době CIA, tedy nebudou menstruovat. Jedním z vedlejších účinků léčby tamoxifenem může být amenorea, která nemusí souviset s plazmatickou hladinou FSH a estradiolu. Při léčbě tamoxifenem tedy nelze usuzovat na menopauzální stav podle přítomnosti nebo nepřítomnosti menstruace u pacientky. Pokud tedy chceme u pacientek léčených tamoxifenem s amenoreou přejít na léčbu inhibitory aromatázy, a to hlavně u pacientek mladších 50 let, je nutné potvrdit menopauzální stav změřením plazmatických hladin FSH a estradiolu.
Tamoxifen však může mít vliv i na plazmatické hladiny hormonů premenopauzálních i postmenopauzálních pacientek. U premenopauzálních pacientek může dojít k vzestupu estradiolu bez vlivu na hladinu FSH a LH. U postmenopauzálních pacientek však může dojít ke snížení hladin estradiolu o 12 %, FSH až o 45,5 % a LH o 48 % [26]. Určení menopauzálního stavu pacientek s CIA s následnou léčbou tamoxifenem může být proto velice obtížné. Pokud však u pacientky plánujeme změnu adjuvantní hormonální léčby z tamoxifenu na inhibitory aromatázy, je určení menopauzálního stavu zásadní. V tab. 4 uvádíme naměřené plazmatické hladiny estradiolu a FSH u našich pacientek s amenoreou při léčbě tamoxifenem při změně léčby na inhibitory aromatázy. Podle naměřených hodnot nebylo možné jednoznačně určit menopauzální stav pacientky. Vzhledem k tomu, že se nelze spolehnout na hladiny FSH, které mohou být výrazně ovlivněny tamoxifenem, doporučujeme orientovat se podle cirkulujících hladin estradiolu, které je však potřeba stanovit opakovaným odběrem, tj. spíše posuzovat trend než jednotlivou změřenou hladinu.
4. Pacientky léčené tamoxifenem s amenoreou. 
FSH – folikulostimulační hormon Diskuze
Adjuvantní léčba tamoxifenem redukuje riziko rekurence karcinomu prsu v 15 letech sledování o 12 %. Metaanalýza klinických studií, jež srovnávaly adjuvantní léčbu inhibitory aromatázy s tamoxifenem u postmenopauzálních pacientek, prokázala další zlepšení léčebných výsledků ve smyslu snížení rizika rekurence onemocnění a nesignifikantně i snížení úmrtí [27]. S ohledem na uvedené výsledky studií se inhibitory aromatázy staly součástí všech mezinárodních doporučení pro léčbu pacientek s karcinomem prsu a jsou onkology indikovány u většiny postmenopauzálních pacientek s pozitivními ER. Přibližně 20 % pacientek v ČR je v době diagnózy mladší než 50 let [7]. Vzhledem k tomu, že jsou inhibitory aromatázy neúčinné, a dokonce kontraindikované v případě reziduálních ovariálních funkcí, je potřeba velké opatrnosti při nasazení inhibitorů aromatázy právě u této skupiny pacientek. Předchozí podání chemoterapie a následná CIA může komplikovat zhodnocení menopauzálního stavu. Podle absence menstruace nemůžeme usuzovat na postmenopauzu. Monitorace hladin FSH a estradiolu u skupiny žen mladších 50 let je potřebná i během léčby inhibitory aromatázy, kdy k obnovení ovariálních funkcí může dojít až po 59 měsících [11]. Pokud tato monitorace není možná, je lepší pacientku léčit tamoxifenem, než ji vystavit riziku někdy až několikaleté neúčinné léčby inhibitory aromatázy. Pacientky mladší 40 let by neměly být léčené inhibitory aromatázy samotnými vůbec.
U některých pacientek s amenoreou nám však nepomůže ani měření hladin FSH a estradiolu. U pacientek naší kliniky jsme opakovaně naměřili jasně postmenopauzální hodnoty hladin FSH, který je doporučovaný jako nejspolehlivější marker pro stanovení menopauzálního stavu, a současně vysoké premenopauzální hladiny estradiolu, při kterých nemůže být léčba inhibitory aromatázy účinná. Tento nesoulad jsme pozorovali nejčastěji u pacientek, které před stanovením užívaly dlouhodobě HAK, nebo u pacientek, které byly v té době léčené tamoxifenem. Vhodné je odběr opakovat s časovým odstupem (tři měsíce), abychom mohli posoudit event. trend naměřených hodnot.
Na základě těchto rozporuplných skutečností se v roce 2011 sešla skupina expertů pod vedením O. Ortmanna, která vytvořila následující doporučení pro určení menopauzálního stavu pacientek s návrhem léčebných opatření [28].
Ženy bez předchozí léčby v perimenopauze
U žen, u kterých nelze doložit menopauzální stav, je léčba inhibitory aromatázy kontraindikována. Ženy by měly být léčené tamoxifenem. Doporučuje se sledování cirkulujících hladin FSH a estradiolu každých 3–6 měsíců, v případě nástupu menopauzy lze změnit léčbu za inhibitory aromatázy.
Ženy s amenoreou po předchozí léčbě chemoterapií
Délka útlumu ovariálních funkcí po chemoterapii může mít různě dlouhé trvání. Pravděpodobnost obnovení ovariálních funkcí je tím menší, čím je žena blíž věku přirozené menopauzy 51 let. U žen mladších 40 let je vysoká pravděpodobnost obnovení ovariálních funkcí, a proto by neměly být léčené inhibitory aromatázy samotnými. Před zahájením léčby inhibitory aromatázy by měly být změřeny cirkulující hladiny FSH a estradiolu. Pokud jsou hladiny v opakovaném odběru konzistentní s postmenopauzálním stavem, může být léčba inhibitory aromatázy zahájena. Vhodné je sledovat hladiny FSH a estradiolu i během léčby (za tři měsíce, za šest měsíců a potom pravidelně každých šest měsíců během léčby). Pokud není možné sledovat hladiny FSH a estradiolu, neměly by být ženy léčeny inhibitorem aromatázy samotným.
Ženy s nástupem amenorey během léčby tamoxifenem
Ženy s amenoreou při léčbě tamoxifenem, u kterých je plánována další léčba inhibitory aromatázy, by měly mít změřené plazmatické hladiny FSH a estradiolu. Hladiny by měly být změřeny před zahájením léčby inhibitory aromatázy a potom v průběhu léčby (každých 3–6 měsíců).
Závěr
Nesprávně indikovaná léčba inhibitory aromatázy může být pro pacientku spíše škodlivá než prospěšná. Podle některých prací dochází až u třetiny pacientek během léčby inhibitory aromatázy k obnovení ovariálních funkcí, a tedy neúčinné léčbě. Proto je potřeba věnovat větší pozornost určení menopauzálního stavu hlavně u žen po předchozí léčbě tamoxifenem nebo chemoterapií. Na na - šem pracovišti pravidelně měříme hladiny FSH a estradiolu u pacientek mezi 40. a 50. rokem života, u kterých zahajujeme léčbu inhibitory aromatázy. Jak jsme již uvedli, hladina FSH může být ovlivněna léčbou tamoxifenem a je méně spolehlivá pro určení menopauzálního stavu než hladina estradiolu. V současnosti používané imunoanalytické laboratorní metody užívané pro stanovení FSH jsou pro tento účel vyhovující, pokud jde o metody pro stanovení estradiolu, je vhodné se zaměřit na metody s výrobcem deklarovanou mezí stanovitelnosti alespoň 20 pmol/l. V klinické praxi je pak třeba se orientovat dle časového trendu cirkulujících hodnot FSH, resp. estradiolu.
Práce byla podpořena projektem MŠMT – NPU I – LO1413 pro RECAMO.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Katarína Petráková, Ph.D.
Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: petrakova@mou.cz
Obdrženo: 18. 2. 2016
Přijato: 29. 6. 2016
Sources
1. Van Bogaert LJ, Van Craynest MP, Abarca-Quinones J. Direct influence of the three natural estrogens on human mammary gland in vitro. Horm Metab Res 1982; 14 (11): 598–601.
2. Miller WR. Aromatase and its inhibitors: new biology and clinical perspectives. Endocr Relat Cancer 1999; 6 (2): 127–130.
3. Vermulen A. The hormonal activity of the postmenopausal ovary. J Clin Endocrinol Metabol 1976; 42 (2): 247–253.
4. Southern A, Louis OJ, Gordon GG et al. The conversion of androgens to estrogens in hyperthyroidism. J Clin Endocrinol Metab 1974; 38 (2): 207–214.
5. Lonning PE, Haynes PB, Straume HA et al. Exploring breast cancer estrogen disposition: the basis for endocrine manipulation. Clin Cancer Res 2011; 17 (15): 4948–4958. doi: 10.1158/1078-0432.CCR-11-0043.
6. Dunbier KA, Anderson H, Ghazoui Z et al. Relationship between plasma estradiol levels and estrogen-responsive gene expression in estrogen receptor-positive breast cancer in postmenopausal women. J Clin Oncol 2010; 28 (7): 1161–1167. doi: 10.1200/JCO.2009.23. 9616.
7. Svod.cz [internetová stránka]. Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika; c2006. Dostupné z: www.svod.cz.
8. Goldhirsch A, Winer EP, Coates AS et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol 2013; 24 (9): 2206–2223. doi: 10.1093/annonc/mdt303.
9. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), Davies C, Godwin J et al. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet 2011; 378 (9793): 771–784. doi: 10.1016/S0140-6736 (11) 60993-8.
10. Groom GV, Griffiths K. Effect of the anti-oestrogen tamoxifen on plasma levels of luteinizing hormone, follicle-stimulating hormone, prolactin, oestradiol and progesterone in normal pre-menopausal women. J Endocrinol 1976; 70 (3): 421–428.
11. Smith IE, Dowsett M, Zap YS et al. Adjuvant aromatase inhibitors for early breast cancer after chemotherapy-induced amenorrhoea: caution and suggested guidelines. J Clin Oncol 2006; 24 (16): 2444–2447.
12. Mitwally M, Casper RF. Use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate. Fert Steril 2001; 75 (2): 305–309.
13. Thurliman B, Keshaviah A, Coates AS et al. A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. N Engl J Med 2005; 353 (26): 2747–2757.
14. Burger HG, Hale GE, Robertson DM et al. A review of hormonal changes during the menopausal transition: focus on findings from the Melbourne Women‘s Midlife Health Project. Hum Reprod Update 2007; 13 (6): 559–565.
15. Moú.cz [homepage on the Internet]. Oddělení laboratorní medicíny. Dostupné z: https: //www.mou.cz/oddeleni-laboratorni-mediciny-olm/d115#chapter=1.
16. Henrich JB, Hughes JP, Kaufman SC et al. Limitations of follicle-stimulating hormone in assessing menopause status: findings from the National Health and Nutrition Examination Survey (NHANES 1999–2000). Menopause 2006; 13 (2): 171–177.
17. Smith IE, Dowsett M, Yap YS et al. Adjuvant aromatase inhibitors for early breast cancer after chemotherapy-induced amenorrhoea: caution and suggested guidelines. J Clin Oncol 2006; 24 (16): 2444–2447.
18. Folferd EJ, Lonning PE, Dowsett M. Interpreting plasma estrogen levels in breast cancer: caution needed. J Clin Oncol 2014; 32 (14): 1396–1400. doi: 10.1200/JCO.2013.53.9411.
19. Ganz PA, Land SR, Geyer CE et al. Menstrual history and quality-of-life outcomes in women with node-positive breast cancer treated with adjuvant therapy on the NSABP B-30 trial. J Clin Oncol 2011; 29 (9): 1110–1116. doi: 10.1200/JCO.2010.29.7689.
20. Bines J, Oleske DM, Cobleigh MA. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. J Clin Oncol 1996; 14 (5): 1718–1729.
21. Forbes JF, Cuzick J, Buzdar A et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 100-month analysis of the ATAC trial. Lancet Oncol 2008; 9 (1): 45–53.
22. Trinkaus M, Chin S, Wolfman W et al. Should urogenital atrophy in breast cancer survivors be treated with topical estrogens? Oncologist 2008; 13 (3): 222–231. doi: 10.1634/theoncologist.2007-0234.
23. Kendall A, Dowsett M, Folkerd E et al. Caution: vaginal estradiol appears to be contraindicated in postmenopausal women on adjuvant aromatase inhibitors. Ann Oncol 2006; 17 (4): 584–587.
24. LHRH-agonists in Early Breast Cancer Overview group, Cuzik J, Ambroisine L et al. Use of luteinising-hormone-releasing hormone agonists as adjuvant treatment in premenopausal patients with hormone-receptor-positive breast cancer: a meta-analysis of individual patient data from randomised adjuvant trials. Lancet 2007; 369 (9574): 1711–1723.
25. Bellet M, Gray KP, Francis PA et al. Twelve-month estrogen levels in premenopausal women with hormone receptor-positive breast cancer receiving adjuvant triptorelin plus exemestane or tamoxifen in the Suppression of Ovarian Function Trial (SOFT): the SOFT-EST substudy. J Clin Oncol 2016; 34 (14): 1584–1593. doi: 10.1200/JCO.2015.61.2259.
26. Lonning PE, Johanssen DC, Lien EA et al. Influence of tamoxifen on sex hormones, gonadotrophins and sex hormone binding globulin in postmenopausal breast cancer patients. J Steroid Biochem Mol Biol 1995; 52 (5): 491–496.
27. Dowsett M, Cuzick J, Ingle J et al. Meta-analysis of breast cancer outcomes in adjuvant trials of aromatase inhibitors versus tamoxifen. J Clin Oncol 2010; 28 (3): 509–518. doi: 10.1200/JCO.2009.23.1274.
28. Ortmann O, Pagani O, Jones A et al. Which factors should be taken into account in perimenopausal women with early breast cancer who may become eligible for an aromatase inhibitor? Recommendations of an expert panel. Cancer Treat Rev 2011; 37 (2) : 97–104. doi: 10.1016/j.ctrv.2010.05.005.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue Supplementum 3-
All articles in this issue
- Editorial
- Breast Cancer – Specifics of Gynecological Care and Counseling
- Pregnancy-associated Breast Cancer
- Pregnancy after Treatment of Breast Cancer
- Ovarian Ablation in Breast Cancer Patients and the Possibility of Influencing Treatment Side Effects
- Treatment with Aromatase Inhibitors in Postmenopausal Women with Breast Cancer and the Possibility of Influencing Side Effects
- Circulating Levels of Estradiol in Breast Cancer Patients Treated with Aromatase Inhibitors and Their Clinical Implications
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Treatment with Aromatase Inhibitors in Postmenopausal Women with Breast Cancer and the Possibility of Influencing Side Effects
- Breast Cancer – Specifics of Gynecological Care and Counseling
- Circulating Levels of Estradiol in Breast Cancer Patients Treated with Aromatase Inhibitors and Their Clinical Implications
- Pregnancy after Treatment of Breast Cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

