-
Medical journals
- Career
Pacientka s primárním intraventrikulárním gliosarkomem s dlouhodobým přežíváním – kazuistika
: O. Kalita 1; M. Zlevorová 2; M. Megová 3; M. Vaverka 1; R. Trojanec 3; L. Tučková 4
: Neurochirurgická klinika LF UP a FN Olomouc 1; Onkologická klinika LF UP a FN Olomouc 2; Laboratoř experimentální medicíny, Ústav molekulární a translační medicíny, LF UP a FN Olomouc 3; Laboratoř molekulární patologie, Oddělení patologie, LF UP a FN Olomouc 4
: Klin Onkol 2016; 29(6): 454-459
: Case Report
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2016454Východiska:
Gliosarkom je vzácný maligní nádor CNS s velmi špatnou prognózou. Gliosarkom je variantou glioblastomu multiforme charakterizovaný přítomností jak gliální, tak mezenchymální komponenty. Léčebná strategie u gliosarkomů není dosud jednoznačně stanovena.Pozorování:
Naše kazuistika prezentuje 23letou pacientku, která byla vyšetřována pro narůstající bolesti hlavy, nauzeu, zvracení a diskrétní motorické oslabení levé paže. MRI mozku odhalilo nádor vyplňující přední část pravé postranní komory s extenzí do pravého čelního laloku. Byla provedena exstirpace nádoru. Histologický nález odhalil gliosarkom. Následně absolvovala konkomitantní chemoradioterapii s temozolomidem ve Stuppově režimu. Po čtvrtém cyklu pokračovací chemoterapie temozolomid solo byla osm měsíců od diagnózy na MRI nalezena progrese rezidua nádoru. Pacientka podstoupila druhou operaci a poté absolvovala 10 cyklů 2. linie chemoterapie v režimu ICE (ifosfamid, karboplatina, etoposid). Pacientka zvládla onkologickou léčbu s minimální toxicitou a na kontrolních MRI došlo prakticky k vymizení reziduálního nádoru. Na kontrolním MRI, 28 měsíců od diagnózy, došlo opětovně k progresi rezidua nádoru. Třetí operace nádoru byla provedena 29 měsíců od diagnózy. Histologický nález opět potvrdil gliosarkom. Časné pooperační MRI ukázalo subtotální resekci opět s reziduem nádoru v elokventních oblastech a nově i suspektní implantační metastázu v páteřním kanále ve výši C2. Z neurologického pohledu byla pacientka plně soběstačná, pozůstává jen velmi lehký motorický deficit na levé paži. Nyní, 31 měsíců od diagnózy, je pacientka ve stabilizovaném stavu, plně soběstačná.Závěr:
Naše kazuistika ukazuje dlouhodobé přežívání u pacientky s gliosarkomem, který měl všechny nepříznivé klinicko-patologické znaky. Je obecně akceptováno, že maximální resekce následovaná pooperační radioterapií je minimální doporučenou léčbou. Naše pacientka podstoupila chemoradioterapii s temozolomidem ve Stuppově režimu. Recidiva osm měsíců od diagnózy byla řešena opakovanou operací následovanou intenzivní kombinovanou chemoterapií, která od prvního relapsu po dobu 20 měsíců udržela onemocnění v remisi. Absence jednoznačných pravidel pro chemoterapii dává možnost použití i méně obvyklých režimů.Klíčová slova:
gliosarkom – operace – chemoterapie – radioterapie – přežíváníÚvod
Gliosarkom je vzácný maligní nádor CNS, WHO klasifikace stupně IV, s velmi špatnou prognózou [1]. Gliosarkom tvoří 1–8 % všech glioblastoma multiforme (GBM) a méně než 0,5 % všech intrakraniálních nádorů [2,3]. Typicky se vyskytuje mezi 50 a 70 lety, s mediánem věku nad 60 let a významnou mužskou prevalencí [4–6]. Gliosarkom je variantou GBM charakterizovaný přítomností jak gliální (WHO stupeň 4), tak mezenchymální (sarkomatózní) komponenty [1,7]. Sarkomatózní komponenta je tvořena vřetenobuněčným sarkomem, ale může jít i o fibrosarkom, angiosarkom, měkkotkáňový sarkom nebo rhabdomyosarkom [8]. Při histologickém vyšetření na přítomnost retikulinu a GFAP pomáhá definovat gliomatózní a mezenchymální elementy. Sarkomatózní areály jsou bohaté na retikulin a naopak gliální komponenta je chudá na retikulin, ale bohatá na GFAP pozitivní elementy. Vimentin je pozitivní v obou komponentách, a proto jej není možné použít k jejich odlišení. Na základě současného genetického výzkumu se přepokládá monoklonální původ obou složek [9].
Léčebná strategie u gliosarkomů je nejasná a většinou zahrnuje maximální možnou resekci následovanou radioterapií. Chemoterapie je obvykle podávána taktéž, ale její typ, dávkování a počet cyklů není dosud stanoven.
Průběh onemocnění
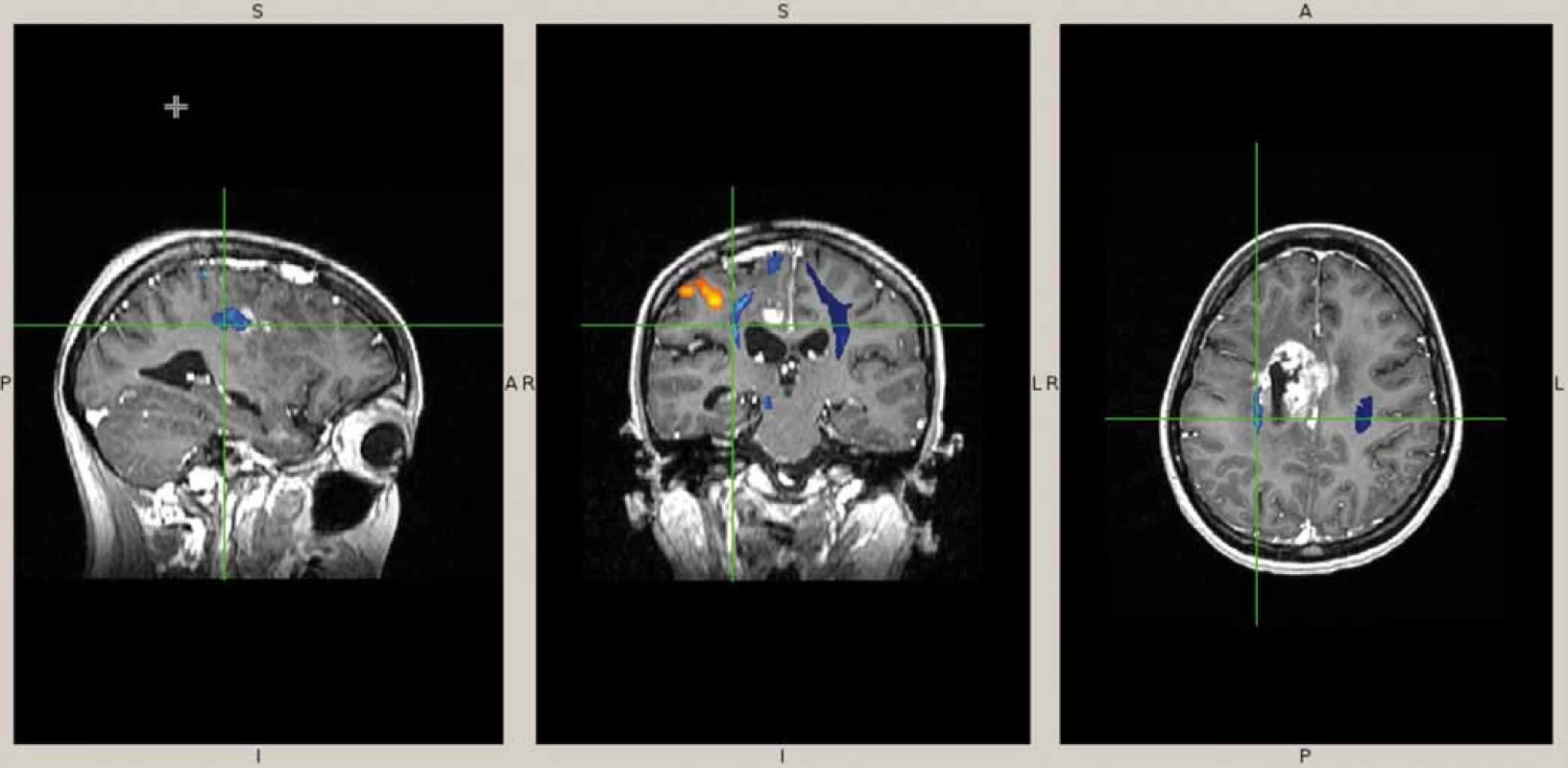
Naše kazuistika prezentuje 23letou pacientku, která byla vyšetřována pro narůstající bolesti hlavy, nauzeu, zvracení a diskrétní motorické oslabení levé paže. Na MRI mozku (obr. 1) byl nalezen objemný, částečně cystický nehomogenně se sytící nádor s neostrými okraji, vyplňující přední část pravé postranní komory s extenzí do pravého čelního laloku. V září 2013 byla provedena exstirpace nádoru. Časné pooperační MRI ukázalo subtotální resekci s reziduem nádoru v elokventních oblastech. Z neurologického pohledu byla pacientka bez trvalého neurologického deficitu. Histologické vyšetření odhalilo gliosarkom WHO stupně IV, přičemž sarkomatózní komponenta byla lokalizována především okolo tlustostěnných cév. Imunohistochemicky nádorové buňky exprimovaly difuzní pozitivitu GFAP, pozitivita p53 se pohybovala v rozmezí 10–70 %, negativní bylo EGFR, p16 a IDH-1; Ki-67 dosáhlo 10 %. Nemocná byla dispenzarizována pravidelnými MRI a klinickými kontrolami. Pacientka absolvovala v období od října do prosince 2013 konkomitantní chemoradioterapii (30 × 2 Gy/temozolomid 75 mg (m2 den 1–42)). Od ledna 2014 zahájila solo chemoterapii temozolomidem (350 mg den 1–5 à 4 týdny) a po 4. cyklu, osm měsíců od diagnózy, byla na MRI nalezena progrese rezidua nádoru (obr. 2). V červnu 2014 pacientka podstoupila druhou operaci. Časné pooperační MRI ukázalo subtotální resekci s reziduem nádoru v elokventních oblastech. Nález odpovídal předoperačnímu funkčnímu MRI (obr. 3), kdy nádor byl v těsném kontaktu s kortikospinální drahou. Pacientka byla nadále bez trvalého neurologického deficitu. Histologický nález potvrdil gliosarkom. Imunohistochemicky nádorové buňky exprimovaly difuzně GFAP v cca 90 %, p53 v 5–20 %, p16 v 1–5 %; Ki-67 dosáhlo 5 %; negativní bylo vyšetření IDH a EGFR. Od července 2014 do září 2015 bylo pacientce podáno 10 cyklů 2. linie chemoterapie v režimu ICE (ifosfamid, karboplatina, etoposid). Pacientka zvládla onkologickou léčbu s minimální toxicitou a na kontrolních MRI reziduální nádor prakticky vymizel. Na kontrolním MRI, 28 měsíců od diagnózy, došlo opětovně k progresi rezidua nádoru. V klinickém obraze se objevily epileptické ataky, znovu se objevilo motorické oslabení levé paže. V prosinci 2015 byla provedena opakovaná resekce nádoru. Časné pooperační MRI ukázalo subtotální resekci, opět s reziduem nádoru v elokventních oblastech. Navíc byla nově objevena suspektní implantační metastáza v páteřním kanále ve výši C2 (obr. 4). Z neurologického pohledu byla pacientka plně soběstačná, pozůstává jen velmi lehký motorický deficit levé paže. Histologický nález opět potvrdil gliosarkom. Imunohistochemicky nádorové buňky vykazovaly difuzní pozitivitu GFAP, p53 v 60 %, p16 v 1 %. Negativní bylo vyšetření AE1/3, EMA, TTF-1, IDH-1 a EGFR; Ki-67 dosahovala 40 %.
1. T1 vážený MRI obraz intraventrikulárního gliosarkomu. 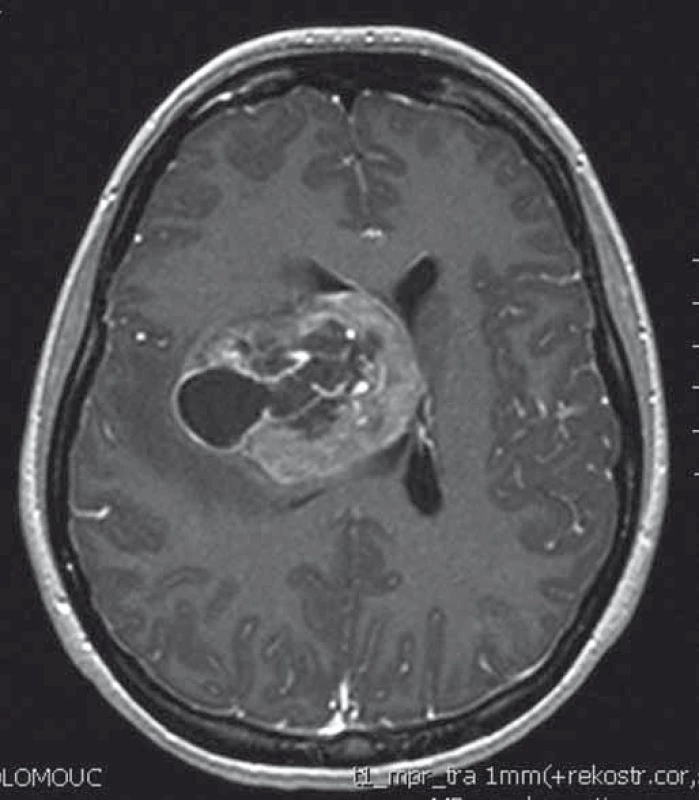
2. T1 vážený MRI obraz recidivy intraventrikulárního sarkomu. 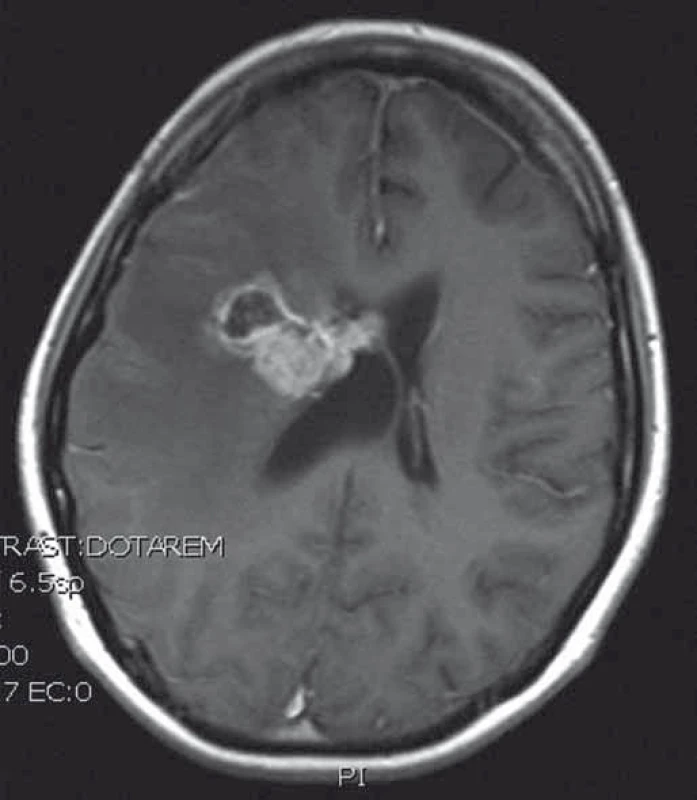
4. Časné pooperační T1 vážené MRI s radikální resekcí v místě původního nádoru, šipka ukazuje implantační metastázu v páteřním kanále. 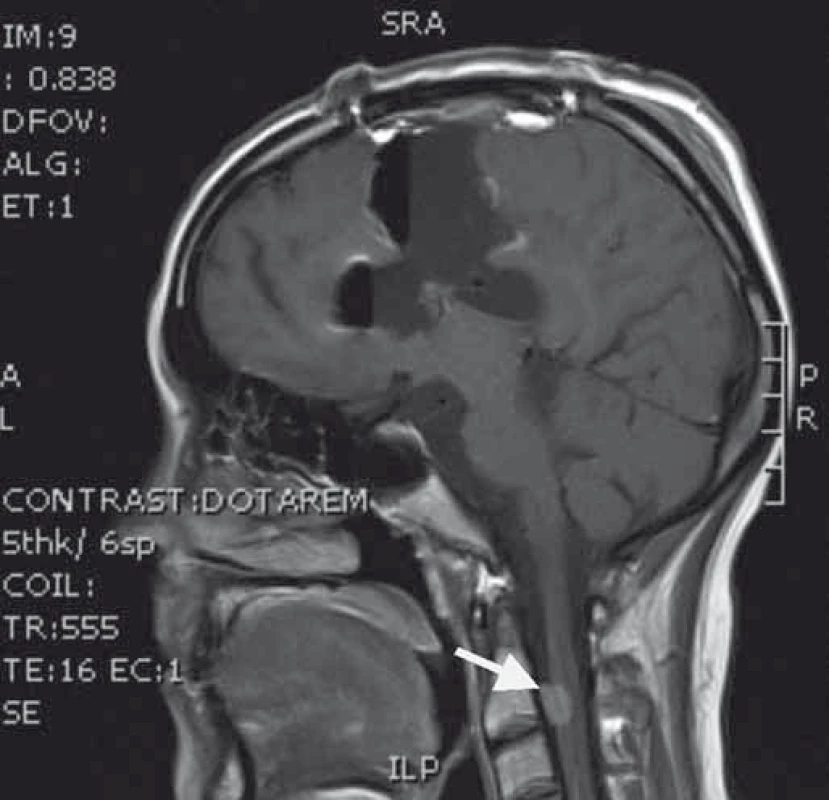
U všech vzorků byl pomocí fluorescenční in situ hybridizace vyšetřen status genů EGFR, TP53, RB1, MDM2, chromozomálních oblastí 1p36, 9p21, 19q13, chromozomu 7 a 10 s použitím fluorescenčně značených DNA sond (IntellMed, Česká republika) a již dříve popsané metodiky [9]. Gen EGFR byl hodnocen jako amplifikovaný v případě, že poměr EGFR/CEP7 byl > 2. Další markery byly hodnoceny jako „navýšení“, resp. „ztráta“ v případě průměrného počtu kopií > 2,3, resp. < 1,9 nebo v případě „navýšení“, resp. „ztráty“ u více než 20 % jader ve vzorku nádorové tkáně. Vyšetření metylace promotoru MGMT bylo provedeno pomocí metylačně specifické real-time PCR po předchozí bisulfidační konverzi DNA [11]. Pro vyšetření mutací genu IDH1 R132H a R132C byla použita CADMA (competitive amplification of differecially melting amplicons) PCR dle principu, který popsal ve své práci Kristensen et al [12].
Nyní, 31 měsíců od diagnózy, je pacientka ve stabilizovaném stavu, plně soběstačná. Vzhledem k uvedené diseminaci nádoru je v současnosti uvažováno o některé z 3. linie paliativní chemoterapie.
Diskuze
Gliosarkomy jsou primárně lokalizované v mozkových hemisférách a jen řídce se vyskytují intraventrikulárně [1,7]. Celkové přežívání (overall survival – OS) pacientů s gliosarkomem se dle literatury pohybuje mezi 4 a 18,5 měsíce [6,7,13,14]. Jen velmi vzácně přesahuje 40 měsíců. Neléčení pacienti s gliosarkomy mají OS okolo čtyř měsíců. Nejdelší zaznamenaný případ přežívání pacienta byl 22 let [15]. Přežívání intraventrikulárně lokalizovaných gliosarkomů se pohybuje v rozmezí mezi 10 dny a 8 měsíci, s mediánem okolo 3 měsíců [7]. V novějších pracích lze nalézt i ojedinělý případ pacienta s takto uloženým nádorem s OS přesahujícím 130 měsíců, a to bez rekurence či metastazování [16].
Gliosarkomy sdílejí obdobné genetické, klinické a prognostické znaky s GBM, proto je obvyklé, že jsou léčeny stejným způsobem jako GBM. Nicméně existují i rozdílné klinicko-patologické znaky. Především gliosarkomy lokalizované v periferii mozkových laloků mají větší sklon k durální adhezi. Také je u gliosarkomů zaznamenán větší výskyt intra - i extrakraniálních metastáz (11 %) a tendence k horšímu přežívání ve srovnání s glioblastomy [4]. Sarkomatózní komponenta má větší tendenci k diseminaci a často tvoří jedinou komponentu v metastázách [13]. Nejčastěji gliosarkomy metastazují do plic a jater, méně i do sleziny, nadledvinek, ledvin, ústní sliznice, kůže, kostí a lymfatických uzlin [14,17,18]. Existuje i diseminace v rámci CNS, přičemž intraventrikulární gliosarkomy se mohou šířit likvorovými cestami.
Gliosarkomy se na MRI zobrazují jako heterogenní expanze, postkontrastně se sytící, dobře ohraničené nebo s nejasnou hranicí a s výrazným peritumorózním edémem. Někdy je přítomna i cystická komponenta s nepravidelným, různě utvářeným postkontrastním sycením [14]. Na podkladě radiologického obrazu lze gliosarkomy rozdělit do dvou variant [19,20]. První jsou nádory podobné GBM, které jsou charakterizovány nejasnými okraji a nehomogenním postkontrastním sycením. Druhou variantou jsou nádory podobné meningeomům, které mají homogenní sycení a jasné radiologické okraje. Taktéž i peroperačně bývá nalézán u této varianty tužší, dobře ohraničený nádor umožňující radikální exstirpaci. Tyto nádory mají i lepší OS (medián OS 8 měsíců, resp. 71 ± 6 týdnů) ve srovnání s gliosarkomy, které se radiologicky i peroperačně podobají GBM (medián 2 měsíce, resp. 63 ± 6 týdnů) [19,20].
Dle provedených genetických analýz mají gliosarkomy vyšší frekvenci mutace TP53 a nižší frekvenci EGFR amplifikace (0–8 %) než primární GBM [9]. Na druhé straně mají vyšší frekvenci PTEN mutace a p16 delece, ale nižší frekvenci TP53 mutace než sekundární GBM [17]. Tedy z pohledu frekvencí genetických alterací jsou gliosarkomy na půl cesty mezi primárními a sekundárními GBM, přičemž mutace TP53 je přítomna jak v gliální, tak v sarkomatózní komponentě [19]. Ze studií zabývajících se metylací promotoru MGMT u gliosarkomů vyplynuly značně rozporuplné výsledky. První práce [21,22] nalézaly MGMT metylaci poměrně často (31,25 a 58,3 %), zatímco pozdější práce [23] odhalily jen nízký výskyt metylace MGMT u gliosarkomů (11,5 %). Co se týče vlivu vztahu mezi metylací MGMT a přežíváním, jedna práce [22] potvrdila, že OS pacientů s gliosarkomy koreluje se stavem metylace MGMT, zatím druhé práce [21] ukázaly, že s OS nesouvisejí. Prognostický či prediktivní vliv mutace IDH u gliosarkomů nebyl zatím zkoumán.
Gliosarkomy jsou dnes léčeny stejným způsobem jako GBM, tzn. maximální resekcí následovanou pooperační chemoradioterapií. Jako faktory ovlivňující OS jsou uváděny věk, předoperační Karnofského skóre, radiologický a již zmíněný peroperační nález (konzistence, ohraničení), rozsah resekce a zmíněná adjuvantní chemoradioterapie [19,20].
Existuje množství studií ukazujících, že radikalita resekce u GBM má vliv na prodloužení OS [24,25]. Z důvodu absence takových dat je tendence extrapolovat výsledky z GBM i na pacienty s gliosarkomy. Přesto existují retrospektivní práce s menším počtem pacientů, které ukázaly až půlroční rozdíl v OS ve prospěch radikálnějších operací. Jedna z prvních studií ukázala, že i pouhá resekce bez další terapie oproti biopsii s následnou chemoterapií má lepší výsledky [4]. Gliosarkomy se často nacházejí na periferii mozkových laloků, a tím umožňují lepší bezpečnou radikalitu resekce [19,20]. Také nádory mající sarkomatózní část větší než 50 % mají tendenci k lepšímu OS oproti těm, kde sarkomatózní komponenta je menší než 25 %. Delší OS bylo zdůvodněno průměrnou vyšší radikalitou resekce u gliosarkomu s dominantní mezenchymální částí, kdy nádory bývají tužší a dobře ohraničené od mozkové tkáně [20].
Efekt radioterapie a chemoterapie u gliosarkomů není zcela jasný. Jedna ze starších studií ukázala zlepšení OS u pacientů, kteří podstoupili pooperační radioterapii v porovnání s těmi, kteří měli pouhou observaci po resekci (10,6 vs. 6,25 měsíce) [26]. Použité radioterapeutické dávky se pohybovaly mezi 45 a 81 Gy [7]. Existujícím kontroverzím ohledně role chemoterapie u gliosarkomů odpovídá i velké množství používaných cytostatik, jako jsou dakarbazin, prokarbazin, mitomycin C, temozolomide, irinotecan, vinkristine, cisplatina, karboplatina, doxorubicin, etoposid a další [4]. Již jedna z prvních prací ukázala lehké zlepšení přežívání u pacientů s chemoradioterapií oproti skupině s pouhou radioterapií (36 vs. 33 týdnů) [27]. Protože se chemoterapie s temozolomidem stala standardem péče u GBM, stala se i dominantním typem léčby u gliosarkomů. Přesto účinnost temozolomidu u gliosarkomů nebyla dosud potvrzena a v první studii efekt této chemoterapie dokonce nebyl nalezen [28]. V další studii byl již ve skupině s temozolomidem dosažen medián OS okolo 18,5 měsíce, což podpořilo jeho zahrnutí do standardní terapie [21]. Jedna z posledních prací ukázala, že adjuvantní chemoradioterapie s temozolomidem vedla k vzestupu 2letého OS na 20 % oproti 10,2 % u skupiny léčené jiným režimem [29]. Stále však zbývá potvrdit, jestli je temozolomid stejně efektivní i u mezenchymální složky nádorů. Pochybnosti vyplývají ze skutečnosti, že navzdory obecnému monoklonálnímu původu gliosarkomy i GBM obsahují rozdílné genetické aberace, což vede ke sporu, zdali je možné plně extrapolovat strategii léčby u GBM na pacienty s gliosarkomy [7,30].
Závěr
Námi prezentovaná kazuistika ukazuje dlouhodobé celkové přežívání u pacientky s gliosarkomem, který měl všechny nepříznivé znaky: 1. intraventrikulární lokalizace nádoru, 2. nehomogenní sycení nádoru na vstupním MRI, 3. peroperační absence jasných hranic nádoru, 4. nižší obsah sarkomatózní porce, 5. cytogenetický profil blížící se GBM (tab. 1), vč. jeho změny vyvolané selekčním tlakem aplikované léčby.
1. Modře jsou označeny „navýšení“, šedě „ztráty“ v počtu kopií genů či chromozomálních úseků dle pravidel popsaných v metodice. 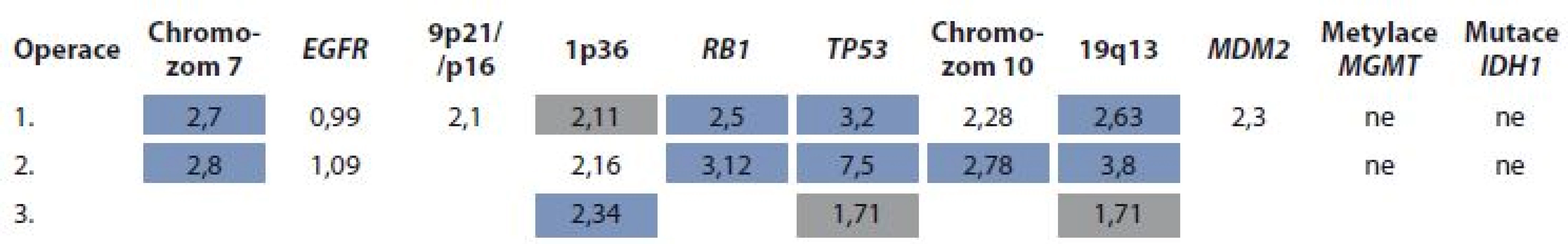
Je obecně akceptováno, že maximální resekce následovaná adjuvantní radioterapií je minimální doporučenou léčbou, kterou by pacienti s gliosarkomem měli obdržet. V našem případě byla snaha dosáhnout radikální operace omezena lokalizací nádoru a jeho vztahem k elokventním oblastem mozku. Následná chemoradioterapie s využitím temozolomidu v Stuppově režimu oddálila recidivu onemocnění o osm měsíců. Uložení nádoru umožnilo opakovanou operaci, po které byla zvažována další chemoterapie. Vzhledem k typu nádoru, věku a dobrému klinickému stavu bylo přikročeno k intenzivní kombinované chemoterapii, která od prvního relapsu po dobu 20 měsíců udržela onemocnění v remisi.
Absence jednoznačných pravidel pro chemoterapii dává možnost použití i méně obvyklých režimů či využití off-label chemoterapie [31,32]. Z důvodu raritnosti onemocnění stále chybí větší prospektivní studie zaměřená na gliosarkomy. Strategická doporučení týkající se role chemoterapie vycházejí často z konfliktních závěrů malých retrospektivních studií. Jsou práce, které tvrdí, že pacienti s gliosarkomy mají právo na specifickou léčbu odlišnou od konvenční GBM terapie. Nicméně se zdá, že léčba gliosarkomů bude kopírovat terapii u GBM až do doby, než se objeví účinná cílená léčba nebo nové chemoterapeutikum.
Tato práce byla z části podpořena grantem IGA MZ ČR č. NT13581-4/2012(86-91).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ondřej Kalita, Ph.D., MBA
Neurochirurgická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: ondrej.kalita@fnol.cz
Obdrženo: 26. 3. 2016
Přijato: 27. 4. 2016
Sources
1. Louis DN, Ohgaki H, Wiestler OD et al. Gliosarcoma. In: WHO classification of tumours of the central nervous system. 4th ed. Lyon: IARC 2007 : 48–49.
2. Lutterbach J, Guttenberger R, Pagenstecher A. Gliosarcoma: a clinical study. Radiother Oncol 2001; 61 (1): 57–64.
3. Zhang BY, Chen H, Geng DY et al. Computed tomography and magnetic resonance features of gliosarcoma: a study of 54 cases. J Comput Assist Tomogr 2011; 35 (6): 667–673. doi: 10.1097/RCT.0b013e3182331128.
4. Kozak KR, Mahadevan A, Moody JS. Adult gliosarcoma: epidemiology, natural history, and factors associated with outcome. Neuro Oncol 2009; 11 (2): 183–191. doi: 10.1215/15228517-2008-076.
5. Lee D, Kang SY, Suh YL et al. Clinicopathologic and genomic features of gliosarcomas. J Neurooncol 2012; 107 (3): 643–650. doi: 10.1007/s11060-011-0790-3.
6. Romero-Rojas AE, Diaz-Perez JA, Ariza-Serrano LM et al. Primary gliosarcoma of the brain: radiologic and histopathologic features. Neuroradiol J 2013; 26 (6): 639–648.
7. Han SJ, Yang I, Tihan T et al Primary gliosarcoma: key clinical and pathologic distinctions from glioblastoma with implications as a unique oncologic entity. J Neurooncol 2010; 96 (3): 313–320. doi: 10.1007/s11060-009-9973-6.
8. Švajdler M, Rychlý B, Gajdoš M et al. Gliosarkóm s komponentou pripomínajúcou alveolárny rabdomyosarkóm: popis prípadu s doposial nepopísanou sarkómovou zložkou. Cesk Patol 2012; 48 (4): 210–214.
9. Reis RM, Könü-Lebleblicioglu D, Lopes JM et al. Genetic profile of gliosarcomas. Am J Pathol 2000; 156 (2): 425–432.
10. Bouchalova K, Trojanec R, Kolar Z et al. Analysis of ERBB2 and TOP2A gene status using fluorescence in situ hybridization versus immunohistochemistry in localized breast cancer. Neoplasma 2006; 53 (5): 393–401.
11. Weisenberger DJ, Campan M, Long TI et al. Analysis of repetitive element DNA methylation by MethyLight. Nucleic Acids Research 2005; 33 (21): 6823–6826.
12. Kristensen LS, Andersen GB, Hager H et al. Competitive amplification of differentially melting amplicons (CADMA) enables sensitive and direct detection of all mutation types by high-resolution melting analysis. Hum Mutat 2012; 33 (1): 264–271. doi: 10.1002/humu.21598.
13. Biswas A, Kumar N, Kumar P et al. Primary gliosarcoma – clinical experience from a regional cancer centre in north India. Br J Neurosurg 2011; 25 (6): 723–729. doi: 10.3109/02688697.2011.570881.
14. Damodaran O, van Heerden J, Nowak AK et al. Clinical management and survival outcomes of gliosarcomas in the era of multimodality therapy. J Clin Neurosci 2014; 21 (3): 478–481. doi: 10.1016/j.jocn.2013.07.042.
15. Winkler PA, Büttner A, Tomezzoli A et al. Histologically repeatedly confirmed gliosarcoma with long survival: review of the literature and report of a case. Acta Neurochir (Wien) 2000; 142 (1): 91–95.
16. Huo Z, Yang D, Shen J et al. Primary gliosarcoma with long-survival: report of two cases and review of literature. Int J Clin Exp Pathol 2014; 7 (9): 6323–6333.
17. Baldawa S, Kasegaonkar P, Vani S et al Primary intraventricular gliosarcoma. Clin Neuropathol 2013; 32 (6): 525–528. doi: 10.5414/NP300607.
18. Moiyadi A, Sridhar E, Jalali R. Intraventricular gliosarcoma: unusual location of an uncommon tumor. J Neurooncol 2010; 96 (2): 291–294. doi: 10.1007/s11060-009-9952-y.
19. Singh G, Das KK, Sharma P et al. Cerebral gliosarcoma: analysis of 16 patients and review of literature. Asian J Neurosurg 2015; 10 (3): 195–202. doi: 10.4103/1793-5482.161173.
20. Salvati M, Caroli E, Raco A et al. Gliosarcomas: analysis of 11 cases do two subtypes exist? J Neurooncol 2005; 74 (1): 59–63.
21. Singh G, Mallick S, Sharma V et al. A study of clinico-pathological parameters and O6-methylguanine DNA methyltransferase (MGMT) promoter methylation status in the prognostication of gliosarcoma. Neuropathology 2012; 32 (5): 534–542. doi: 10.1111/j.1440 - 1789.2012.01297.x.
22. Kang SH, Park KJ, Kim CY et al. O6-methylguanine DNA methyltransferase status determined by promoter methylation and immunohistochemistry in gliosarcoma and their clinical implications. J Neuroonco 2011; 101 (3): 477–486. doi: 10.1007/s11060-010-0267-9.
23. Lee D, Kang SY, Suh YL et al. Clinicopathologic and genomic features of gliosarcomas. J Neurooncol 2012; 107 (3): 643–650. doi: 10.1007/s11060-011 - 0790-3.
24. Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008; 62 (4): 753–764. doi: 10.1227/01.neu.0000318159.21731.cf.
25. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996.
26. Perry JR, Ang LC, Bilbao JM et al. Clinicopathologic features of primary and postirradiation cerebral gliosarcoma. Cancer 1995; 75 (12): 2910–2918.
27. Morantz RA, Feigen I, Ransohoff J. Clinical and pathological study of 24 cases of gliosarcoma. J Neurosurg 1976; 45 (4): 398–408.
28. Han SJ, Yang I, Ahn BJ et al. Clinical characteristics and outcomes for a modern series of primary gliosarcoma patients. Cancer 2010; 116 (5): 1358–1366. doi: 10.1002/cncr.24857.
29. Walker GV, Gilbert MR, Prabhu SS et al. Temozolomide use in adult patients with gliosarcoma: an evolving clinical practice. J Neurooncol 2013; 112 (1): 83–89. doi: 10.1007/s11060-012-1029-7.
30. Forshew T, Lewis P, Waldman A et al. Three different brain tumours evolving from a common origin. Oncogenesis 2013; 2: e41. doi: 10.1038/oncsis.2013.1.
31. Stančoková T. Liečba dětských nádorov mozgu. Onkologia (Bratisl.) 2007; 2 (3): 176–180.
32. Pavelka Z, Zitterbart K. Nádory centrálního nervového systému u dětí. Neurol pro praxi 2011; 12 (1): 52–58.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 6-
All articles in this issue
- Molecular Genetic Testing for Acute Myeloid Leukemia
- Molecular Pathogenesis of Colorectal Cancer
- Involvement of PIWI-interacting RNAs in Cancerogenesis via the Regulation of Gene Expression
- Clinical and Functional Importance of Selected CASP8 and CASP9 Polymorphisms in Breast Carcinoma
- A Patient with Primary Intraventricular Gliosarcoma and Long-term Survival – a Case Report
- Intervention Exercise Program for Cancer Patients with Breast Cancer
- Quality of Life, Anxiety and Depression in Patients with Differentiated Thyroid Cancer under Short Term Hypothyroidism Induced by Levothyroxine Withdrawal
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Molecular Genetic Testing for Acute Myeloid Leukemia
- Molecular Pathogenesis of Colorectal Cancer
- A Patient with Primary Intraventricular Gliosarcoma and Long-term Survival – a Case Report
- Quality of Life, Anxiety and Depression in Patients with Differentiated Thyroid Cancer under Short Term Hypothyroidism Induced by Levothyroxine Withdrawal
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career