-
Medical journals
- Career
Vícenásobné nádorové onemocnění plic – kazuistika a přehled literatury
: Z. Chovanec; I. Čapov; A. Peštál; M. Benej; M. Páral
: I. chirurgická klinika LF MU a FN u sv. Anny v Brně
: Klin Onkol 2016; 29(4): 287-290
: Case Report
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2016287Východisko:
Vícenásobné nádorové onemocnění plic je poměrně vzácnou nozologickou jednotkou, cílem této kazuistiky je její připomenutí a poukázání na úskalí její diagnostiky a následné terapie.Případ:
Pacientka, 62 let, po ablaci pravého prsu s disekcí axily v roce 1993 pro invazivní duktální adenokarcinom byla indikována k operační terapii pro nemalobuněčný plicní nádor středního laloku pravé plíce, diagnostikovaném při screeningovém vyšetření. Perioperačně bylo odstraněno další ložisko v dolním laloku téže plíce, které bylo následně také hodnoceno jako primární plicní karcinom, tedy synchronní plicní nádor.Závěr:
Jedná se o vzácnou nozologickou jednotku, při které je nádorové onemocnění plic prezentováno více než jedním primárním plicním ložiskem. Dělí se na synchronní nebo metachronní variantu. Synchronní forma je charakterizována záchytem ložisek v době primární diagnózy, naproti tomu u metachronního výskytu je druhý, primární plicní nádor diagnostikován s časovým odstupem. Incidence se zvyšuje díky dřívější diagnostice, úspěšnější léčbě nádorového onemocnění v raném stadiu s prodloužením přežívání pacientů, a tedy i prodloužením intervalu pro možnost vzniku dalšího primárního plicního tumoru. Jedním z hlavních rizikových faktorů je kouření. Diagnostika je obtížnější s nutností vyloučení metastatického onemocnění. Základní informaci o povaze ložisek získáváme z histologického došetření. U pacientů s více než jedním plicním ložiskem by měl být proveden velmi pečlivě staging, zejména v případě zvažované kurativní resekce, s vyloučením extrapulmonálních metastáz pomocí MRI mozku a celotělového PET/ CT došetření.Klíčová slova:
karcinom plic – vícenásobné nádorové onemocnění – synchronní – metachronní – diagnostika – terapiePřípad
U 8 % pacientů s již prodělaným nádorovým onemocněním je diagnostikováno nové nádorové onemocnění, podobný trend je i u nádorového onemocnění plic [1].
Pacientka, 62 let, po ablaci pravého prsu s disekcí axily v roce 1993 pro invazivní duktální adenokarcinom pT2 Nlb M0 a následné chemoradioterapii (CMF + radioterapie na oblast jizvy 46 Gy a uzliny 42 Gy) byla indikována k došetření pro suspektní infiltraci středního laloku pravé plíce dle kontrolního PET/CT došetření (obr. 1). Jednalo se o pacientku postiženou 30 let nikotinizmem, kouřící 15 cigaret denně, tč. medikující pouze Sortis.
1. PET/CT ložisko ve středním laloku. 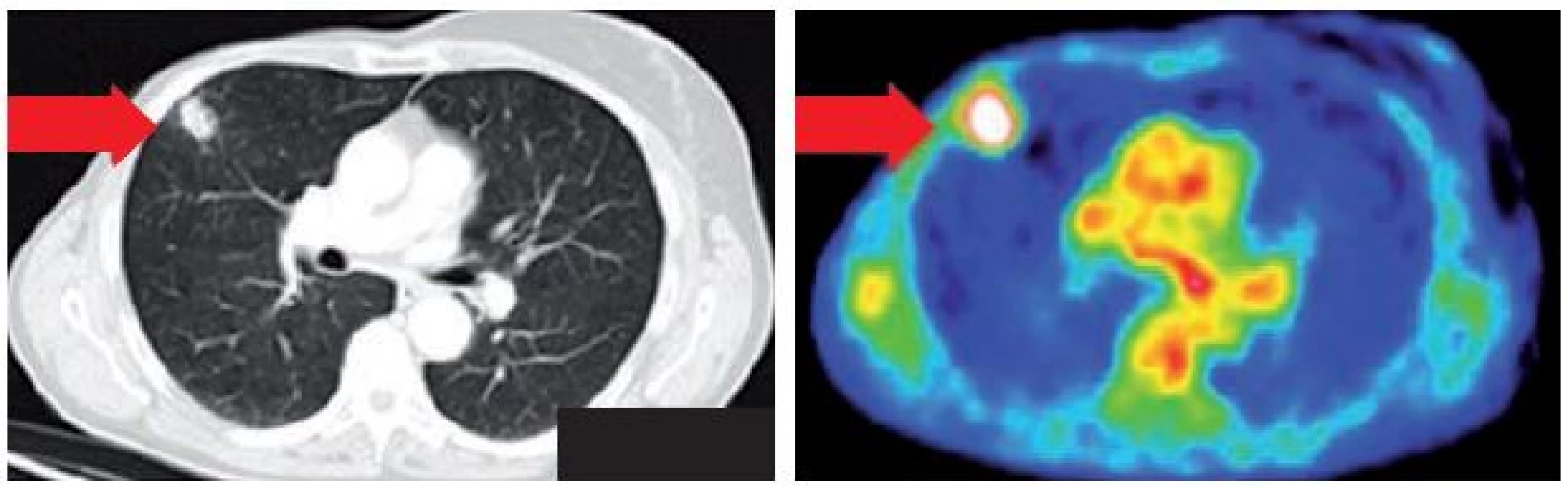
Dle provedeného kontrolního celotělového PET/CT z listopadu 2014 a jeho srovnáním z října 2013 bylo popsáno cípaté ložisko v pátém segmentu pravé plíce velikosti 25 mm s progresí o 1 mm a současně ložisko v osmém segmentu vpravo o velikostí 10 mm s progresí o 2 mm. Levá plíce byla bez patologických denzit a mediastinum bez lymfadenopatie nad 10 mm. Byla provedena CT navigovaná punkční biopsie ložiska z pátého segmentu s histologickou verifikací adenokarcinomu primárního plicního origa.
Pacientka byla předvedena na pneumoonkologicko-hrudní komisi I. chirurgické kliniky FN u sv. Anny v Brně se závěrem doporučujícím operační revizi cestou pravostranné torakotomie.
Před operací bylo provedeno standardně funkční plicní došetření, předoperační interní vyšetření a anesteziologické došetření se závěry – bez ventilační poruchy, interně schopna zákroku v celkové anestezii a schopna operace ASA II.
Perioperačním nálezem byl infiltrát vtahující viscerální pleuru ve středním laloku a drobné infiltrativní ložisko periferně v oblasti dolního laloku ve shodě s PET/CT došetřením (obr. 2). Byla provedena nekomplikovaná střední lobektomie a klínovité snesení infiltrátu dolního laloku s perioperačním cryotomovým vyšetřením. Dle hodnocení patologa se jednalo o možnou metastázu adenokarcinomu, nicméně morfologie také nevylučovala možnost primárního plicního tumoru.
2. PET/CT ložisko v dolním laloku. 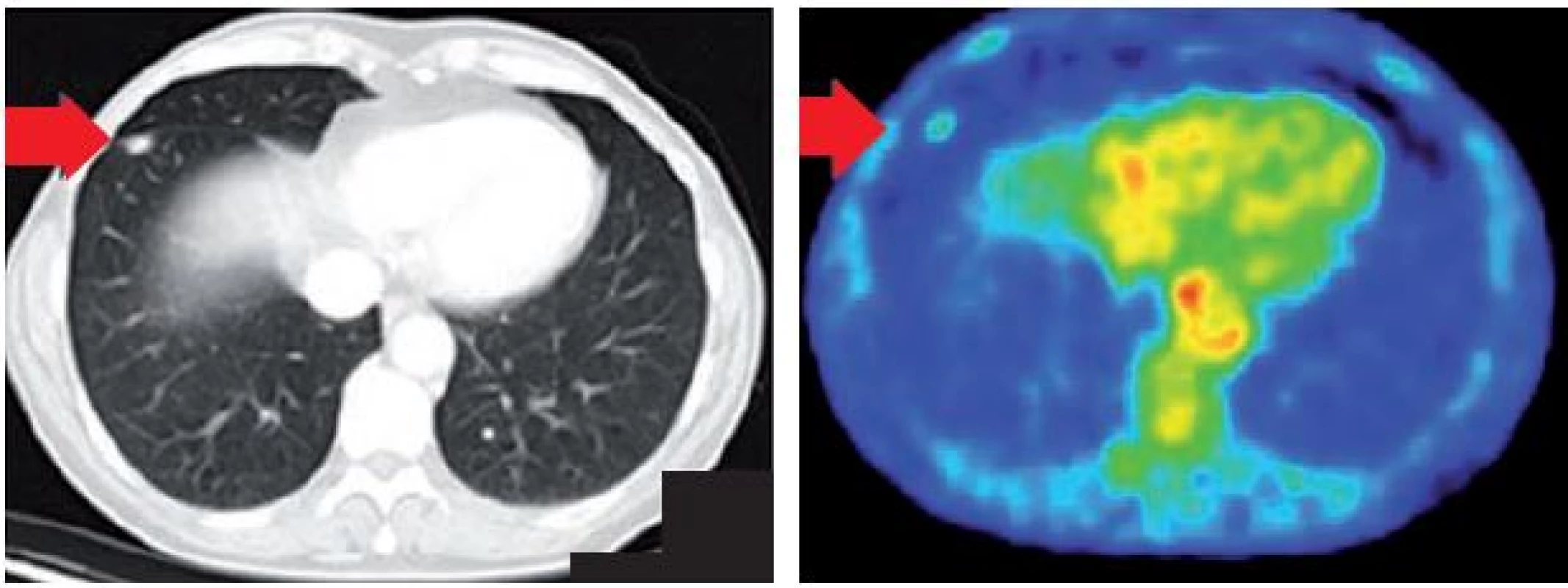
Následně byla dokončena klasicky mediastinální lymfadenektomie ze stanic 11, 10, 7, 8, 2, 4 a operace ukončena s rozvahou vyčkání definitivní histologie. Do úvahy připadaly diagnostické možnosti, a to metastáza karcinomu prsu, metastáza plicního ložiska a ve velmi raritním případě druhý synchronní primární plicní tumor.
Pacientka byla hospitalizována šest dnů, hrudní drenáž byla extrahována pátý pooperační den s následným propuštěním do domácí péče. Kontrolní klinické vyšetření bylo provedeno 12 dnů po propuštění. Rána byla zhojena per primam, poslechově oboustranně alveolární dýchání a kontrolní RTG plic byl v normě. Pacientka udávala pouze poruchu citlivosti v oblasti operační rány s lehkou bolestivostí bez dechové limitace.
Histologie
Infiltrace ve středním laloku byla histologicky hodnocena jako bělavé nádorové ložisko velikosti 16 × 12 × 25 mm. Parenchym byl tvořen více než z 90 % dominující acinární stavbou, dále drobnými úseky solidního a mikropapilárního růstu. V centrální části uzlu bylo hojné desmoplastické stroma. V nádorových buňkách byla exprese cytokeratinu CK7 s nukleární koexpresí TTF-1 při negativitě CK20. Celkem zpracováno 16 lymfatických uzlin bez metastatické nádorové infiltrace.
Uzavřeno jako středně diferencovaný acinárně dominantní plicní adenokarcinom středního laloku pravé plíce bez metastatické infiltrace regionálních lymfatických uzlin (0/ 27), resekční linie byla hodnocena in sano. MKN: C342, pTNM: pT1b pN0 MX.
Infiltrace z dolního laloku byla hodnocena jako lobulární ložisko velikosti 8 mm subpleurálně uloženo, bez extenze na serózu. V rozsahu uzlu byla dominující papilární stavba tvořící asi 70 % neoplastického parenchymu, alternující s úseky acinárního (25 %) a mikropapilárního (5 %) růstu. V centrální části uzlu bylo hojnější desmoplastické stroma s depozity antrakotického pigmentu. V nádorových buňkách byla exprese cytokeratinu CK7 s nukleární koexpresí TTF-1, při negativitě CK20, ER, PrR a tyreoglobulinu.
Uzavřeno jako středně diferencovaný papilárně dominantní plicní adenokarcinom bez metastatické infiltrace regionálních lymfatických uzlin – MKN: C343, pTNM: pT1a pN0 MX.
Jednalo se tedy o vzácnou nozologickou jednotku, a to o synchronní vícenásobný primární plicní karcinom (multiple primary lung cancer – MPLC).
Synchronní MPLC
U synchronního výskytu jsou ložiska zachycena v době primární diagnózy. Abychom mohli hodnotit dvě a více plicních ložisek jako synchronní MPLC, musí být splněna následující kritéria:
- Obě ložiska musí být současně maligní se separátním růstem a současným vyloučením metastázy jiného mimoplicního nádorového onemocnění.
- Druhé ložisko nesmí být prezentováno jako metastáza primárního nádorového ložiska. Kritéria potvrzující tuto diagnostiku jsou – odlišná histologie nebo původ z jiného carcinoma in situ.
U stejné histologie ložisek je prezentována jiná anatomická struktura, bez postižení mediastinálních uzlin, tedy negativita N2, N3 a nepřítomnost systémových metastáz [2,3].
Metachronní MPLC
Pacienti jednou léčení pro primární nádorové plicní onemocnění mají vyšší pravděpodobnost vzniku dalšího primárního (v tomto případě sekundárního) plicního ložiska. K potvrzení diagnózy musí být splněna následující kritéria:
- Druhé ložisko musí být maligní s vyloučením metastáz jiného mimoplicního nádorového onemocnění.
- Tumor je považován za metachronní v případě odlišné histologie oproti primárnímu ložisku, popřípadě má-li stejnou histologii, tak by měl být interval od základního onemocnění delší čtyř nebo více let (Martini a Melamed udávají časový interval ≥ 2 roky [4]), se současným vyloučením jiných systémových metastáz [5].
Kratší interval než dva roky mezi dvěma primárními ložisky má horší prognózu, přestože je terapie obdobná jako v případě jiného metastazujícího onemocnění.
Dle TNM klasifikace 7. vydání American Joint Committee on Cancer
- Histologicky identické, oddělitelné léze ve stejném laloku jsou považovány za jeden primární tumor a jsou klasifikovány jako T3, a nejedná se tedy o MPLC.
- Druhé ložisko stejné histologie lokalizované v jiném laloku ipsilaterálně, které bylo klasifikováno jako metastáza M1, je dnes klasifikováno jako T4 onemocnění. Proto některé případy původně klasifikované jako stadium IV nebo MPLC jsou nyní hodnoceny jako T4 onemocnění [6].
V případě multifokálního nádorového onemocnění je častěji popisován lokální růst oproti vzdálené diseminaci vyjádřené metastatickým postižením [7].
Multifokální onemocnění má charakteristický obraz na CT s ložisky různého stadia růstu od mléčného skla přes částečně až kompletně solidní uzly. Může se jednat o pomalu rostoucí ložiska, ale i ložiska s velmi agresivním růstem, proto není v některých případech možné všechna ložiska resekovat a každému případu je třeba věnovat zvláštní pozornost.
Terapie
Chirurgická terapie je indikována u pacientů s nemalobuněčným karcinomem plic (non-small cell lung cancer – NSCLC) stadia I a II, doporučována je anatomická resekce, pokud jsou tohoto operačního rozsahu pacienti schopni [8]. V poslední době se objevují články, které segmentální resekci u stadia I kladou na úroveň lobektomie co do přežití a radikality.
Mezi základní principy chirurgické léčby patří kompletní odstranění nádoru během operace bez porušení jeho celistvosti, odstranění pulmonálních a mediastinálních uzlin a peroperační vyšetření okraje resekovaného bronchu [9].
Pacienti s neresekabilními synchronními ložisky jsou indikováni k stereoradioterapii. V případě resekce jen jednoho ložiska je druhé rovněž indikováno k stereoradioterapii.
Ve stadiu I NSCLC má stereoradioterapie lepší výsledky (lokální regrese, délka přežívání) nežli konvenční radioterapie nebo radiofrekvenční ablace. Výsledky jsou srovnatelné s chirurgickou terapií, pokud bereme v úvahu i komorbidity [10–12].
Pro adjuvantní chemoterapii po resekovaných MPLC není dodnes stanoveno jednoznačné doporučení. Cisplatina jako základ adjuvantní terapie je určena pro pacienty ve stadiu II a III, jež podstoupili potenciální kurativní zákrok. Toto doporučení je odvozeno od klinického stadia III NSCLC, kdy adjuvantní terapie prodlužuje přežití ve srovnání s observací. Doporučení pro stadium I není standardizováno. Pacienti ve stadiu IA nemají z adjuvantní terapie prospěch, zatímco ve stadiu IB a tumorů větších než 4 cm je adjuvantní terapie prospěšná.
U pacientů se synchronním MPLC má nejvýznamnější prognostický význam stadium nejvíce postiženého ložiska [13].
Nejistá situace nastává v případě diagnostiky dvou synchronních nádorů ve stadiu I. Pacienti ve stadiu I s MPLC mají horší prognózu než pacienti s jedním primárním tumorem. Absolutní prospěch adjuvantní terapie v podobě cisplatiny ale nebyl prokázán. Musí být brána v úvahu velikost tumoru, komorbidita pacienta a jeho celkový stav.
Dispenzarizace
U pacientů po prodělané kompletní plicní resekci doporučuje National Comprehensive Cancer Network CT vyšetření a kontrolu lékařem každých 6 – 12 měsíců během prvních dvou let [14]. Poté CT bez kontrastu 1krát ročně. Dle doporučení z Chirurgické onkologie jsou kontroly onkologem nebo pneumoonkologem v prvních dvou letech v tříměsíčních intervalech, dalších třech letech v šestiměsíčních intervalech a následně 1krát ročně. Žádné dispenzární schéma ale neprokázalo, že by zvýšilo šanci na kurabilitu recidiv, které jsou ve většině případů zjištěny na podkladě symptomů [9].
Pacienti s MPLC mají vyšší riziko rekurence onemocnění, nicméně prozatím není validována prospěšnost častějšího provádění CT k brzkému záchytu nového ložiska.
Významným ověřeným prognostickým faktorem je pouze omezení, popř. ukončení kouření [15].
Doporučení
MPLC je relativně vzácnou jednotkou. Nicméně její incidence se zvyšuje v důsledku dřívější diagnostiky a úspěšnější léčby nádorového onemocnění v raném stadiu s prodloužením přežívání pacientů, a tedy i prodloužením doby možného vzniku nového primárního plicního nádoru.
Rozlišení mezi metastázou a synchronním ložiskem primárního plicního karcinomu je velmi obtížné a někdy až nemožné. Jedná-li se o synchronní ložiska NSCLC stejné histologie (která často nebývají zcela morfologicky homogenní), může být toto rozhodnutí obtížné i pro zkušeného patologa [16]. Nicméně MPLC můžeme nově odlišit od plicní metastázy pomocí DNA fingerprintingu. Tato metoda ale není rutinně používána [17].
Výskyt synchronních nádorů představuje méně než 1 % nových případů plicního karcinomu, přesto pozorujeme vzestup incidence adenokarcinomu se stejnou histologií obou ložisek.
Solitární léze v kontralaterální plíci může být ve většině případů považována za synchronní primární plicní tumor [18].
Terapie musí být stanovena multioborovou komisí složenou z radiologa, patologa, onkologa a hrudního chirurga. Všichni pacienti s MPLC by měli být, pokud možno, kurativně léčeni. Vybraná skupina pacientů má dlouhodobé přežití.
Základem kurativní terapie je chirurgická resekce, je-li jí pacient schopen. Je preferována anatomická resekce, a to lobektomie nebo segmentektomie.
Pokud není možno provést operaci, je indikována lokální stereotaktická radioterapie.
Adjuvantní terapie je indikována ve stadiu II a III, a to dle doporučení získaných na základě léčby resekovaných NSCLC téhož stadia.
Pacienti se synchronním MPLC mají nižší přežívání a horší prognózu než pacienti s metachronním MPLC [17].
Je důležité poznamenat, že recidiva onemocnění představuje selhání léčby, zatímco vývoj nového primárního nádoru ukazuje na trvalou expozici etiologicky rizikových faktorů [1].
Závěr
U výše uvedené pacientky byly oba karcinomy v klinickém stadiu IA, ložisko resekováno ze středního laloku bylo hodnoceno jako T1b (zde byla provedena lobektomie), ložisko v dolním laloku bylo hodnoceno jako T1a a sneseno atypicky s námi uvažovaným dostatečným lemem, všech 16 exstirpovaných uzlin bylo nádoru prosto. Dle doporučení je indikována kompletující lobektomie, popřípadě vzhledem k velikosti ložiska 8mm segmentektomie.
V našem případě jsme reoperaci neprovedli, a to ze dvou důvodů. Atypicky snesené ložisko bylo s dostatečným resekčním lemem, navíc pacientka nebyla kladně nakloněna k další chirurgické intervenci.
Doporučena byla dispenzarizace bez adjuvantní terapie, jelikož nemá v tomto stadiu onemocnění přesvědčivý léčebný efekt. Dále byla naplánována brzká PET/CT kontrola s tříměsíčním odstupem od operace, i když dle prozatímních studií nezvyšuje brzký screening pravděpodobnost včasného zachycení recidivy onemocnění oproti klasicky prováděnému screeningu při jednom primárním plicním tumoru stejného stadia, přestože častěji recidivuje. Pacientce bylo doporučeno přestat kouřit, tento faktor má prozatím jako jediný prokazatelně prospěšný efekt.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zdeněk Chovanec, Ph.D.
I. chirurgická klinika LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: zdenek.chovanec@fnusa.cz
Obdrženo: 22. 2. 2016
Přijato: 20. 4. 2016
Sources
1. Xue X, Liu Y, Pan L et al. Diagnosis of multiple primary lung cancer. A systemic review. J Int Med Res 2013; 41(6): 1779 – 1787. doi: 10.1177/0300060513504707.
2. Kozower BD, Larner JM, Detterbeck FC et al. Special treatment issues in non-small cell lung cancer: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143 (Suppl 5): e369S – e399S. doi: 10.1378/ chest.12-2362.
3. National Comprehensive Cancer Network [online]. NCCN Guidlines Version 1.2014 Non-Small Cell Lung Cancer. Available from: http://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
4. Martini N, Melamed MR. Multiple primary lung cancers. J Thorac Cardiovasc Surg 1975; 70(4): 606 – 612.
5. Shen KR, Meyers BF, Larner JM et al. Special treatment issues in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132 (Suppl 3): 290S – 305S.
6. Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th Edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol 2010; 17(6): 1471 – 1474. doi: 10.1245/ s10434-010-0985-4.
7. Barsky SH, Cameron R, Osann KE et al. Rising incidence of bronchioloalveolar lung carcinoma and its unique clinicopathologic features. Cancer 1994; 73(4): 1163 – 1170.
8. Finley DJ, Yoshizawa A, Travis W et al. Predictors of outcomes after surgical treatment of synchronous primary lung cancers. J Thorac Oncol 2010; 5(2): 197 – 205. doi: 10.1097/ JTO.0b013e3181c814c5.
9. Krška Z, Hoskovec D, Petruželka L et al. Chirurgická onkologie. Praha: Grada publishing 2014 : 352.
10. Haasbeek CJ, Palma D, Visser O et al. Early-stage lung cancer in elderly patients: a population-based study of changes in treatment patterns and survival in the Netherlands. Ann Oncol 2012; 23(10): 2743 – 2747.
11. Shirvani SM, Jiang J, Chang JY et al. Comparative effectiveness of 5 treatment strategies for early-stage non-small cell lung cancer in the elderly. Int J Radiat Oncol Biol Phys 2012; 84(5): 1060 – 1070. doi: 10.1016/ j.ijrobp.2012.07.2354.
12. Dupuy DE. Treatment of medically inoperable non-small-cell lung cancer with stereotactic body radiation therapy versus image-guided tumor ablation: can interventional radiology compete? J Vasc Interv Radiol 2013; 24(8): 1139 – 1145. doi: 10.1016/ j.jvir.2013.04.021.
13. van Rens MT, de la Rivière AB, Elbers HR et al. Prognostic assessment of 2,361 patients who underwent pulmonary resection for non-small cell lung cancer, stage I, II, and IIIA. Chest 2000; 117(2): 374 – 379.
14. Nccn.org [homepage on the Internet]. National Comprehensive Cancer Network. [cited 2013 March 21]. Available from: https://subscriptions.nccn.org/gl_login.aspx?ReturnURL=http://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf -accessed 3/ 21/ 2013.
15. Read WL, Page NC, Tierney RM et al. The epidemiology of bronchioloalveolar carcinoma over the past two decades: analysis of the SEER database. Lung Cancer 2004; 45(2): 137 – 142.
16. Čapov I et al. Chirurgie orgánových metastáz. Praha: Galén 2008 : 60.
17. Stinchcombe TE, Carr S, Loo BW Jr et al. Multiple primary lung cancers [online]. Available from: http:/ / www.uptodate.com/ contents/ multiple-primary-lung-cancers.
18. Peters S, Adjei AA, Gridelli C et al. Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7): vii56 – vii64. doi: 10.1093/ annonc/ mds226.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 4-
All articles in this issue
- Antiproliferative Effect of Somatostatin Analogs – Data Analyses and Clinical Applications in the Context of the CLARINET Study
- Two Approaches to Cancer Development
- Impact of Treatments to Improve Cognitive Function and Quality of Life on Cancer Patients with Carcinoma of the Testes
- The Influence of Palliative Chemotherapy on the Quality of Life of Patients with Gastric Cancer
- Multiple Primary Lung Cancer – a Case Report and Literature Review
- Staging and Treatment Response Evaluation in Malignant Lymphomas – Czech Lymphoma Study Group Recommendations According to Criteria Revised in 2014 (Lugano Classification)
- Radiotherapy Indications in Patients with Hematological Malignancies During the Five Years Course of Modernized Center of Oncology and Radiotherapy Clinic in Pilsen
- Sentinel Lymph Node in Melanoma – a Study Conducted in the South of Brazil
- Primary Mucoepidermoid Carcinoma of the Lacrimal Sac – a Case Report and Literature Review
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The Influence of Palliative Chemotherapy on the Quality of Life of Patients with Gastric Cancer
- Two Approaches to Cancer Development
- Impact of Treatments to Improve Cognitive Function and Quality of Life on Cancer Patients with Carcinoma of the Testes
- Primary Mucoepidermoid Carcinoma of the Lacrimal Sac – a Case Report and Literature Review
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

