-
Medical journals
- Career
Shoda a neshoda klinické a patologické TNM klasifikace u karcinomu orofaryngu – vliv na prognózu a výsledky léčby
Authors: P. Kordač 1; D. Kalfeřt 1,2; K. Smatanová 1; J. Laco 3; M. Vošmik 4; P. Čelakovský 1; Viktor Chrobok 1
Authors‘ workplace: Klinika otorinolaryngologie a chirurgie hlavy a krku LF UK a FN Hradec Králové 1; ORL, foniatrie, sluchová protetika s. r. o., Plzeň 2; Fingerlandův ústav patologie, LF UK a FN Hradec Králové 3; Klinika onkologie a radioterapie LF UK a FN Hradec Králové 4
Published in: Klin Onkol 2016; 29(2): 122-126
Category: Original Articles
doi: https://doi.org/10.14735/amko2016122Overview
Východisko:
Cílem studie bylo určit, v jakém procentu případů dochází k neshodě mezi mezi klinickou (c) a patologickou (p) TNM klasifikací u karcinomu orofaryngu a zdali neshoda mezi c a p klasifikací ovlivňuje frekvenci recidiv a prognózu základního onemocnění.Soubor a metodika:
Retrospektivní soubor 51 primárně chirurgicky léčených pacientů s karcinomem orofaryngu. Klinická TNM klasifikace byla stanovena na základě klinického a zobrazovacího vyšetření (sonografie, CT či MRI krku), patologickou klasifikaci stanovil patolog na základě histopatologického vyšetření vlastního tumoru a odstraněných lymfatických uzlin. Shoda a neshoda TNM byly statisticky hodnoceny ve vztahu k recidivě tumoru a celkovému specifickému a nespecifickému přežití pacientů. Mezi další statisticky hodnocené potenciální prognostické faktory patřily věk pacienta, rozsah primárního tumoru, histologická pozitivita odstraněných lymfatických uzlin a histologická pozitivita okrajů.Výsledky:
Neshoda mezi cTNM a pTNM klasifikací byla prokázána u 27 pacientů. U neshody T bylo prokázáno statisticky významně kratší přežití bez známek nádoru (p = 0,034) i přesto, že neshoda T statisticky významně neovlivnila frekvenci recidiv. Ostatní sledované faktory neměly významnější vliv na frekvenci recidivy či přežití bez známek nádoru. K úmrtí v souvislosti s primárním tumorem došlo v průběhu sledování u šesti nemocných (11,8 %). U neshody T bylo prokázáno kratší specifické přežití na hranici statistické významnosti (p = 0,069). Ostatní sledované faktory neměly významnější vliv na specifické úmrtí.Závěr:
Neshoda mezi klinickou a patologickou TNM klasifikací byla prokázána u 52,9 % nemocných s karcinomem orofaryngu. Neshoda cTNM a pTNM klasifikace v oblasti primárního nádoru (kategorie T) se jeví jako potenciální prognostický faktor. Zlepšení výsledků léčby onkologických pacientů je proto do jisté míry závislé na možnostech a přesnosti předoperační diagnostiky.Klíčová slova:
TNM staging – klinická TNM klasifikace – patologická TNM klasifikace – karcinom orofaryngu – prognózaÚvod
TNM klasifikace je i v současnosti považována za nejvýznamnější systém určující rozsah primárního tumoru i regionálních a vzdálených metastáz. Správné určení TNM klasifikace má zásadní význam při volbě terapie a stadium nádorové nemoci je u většiny maligních tumorů také rozhodujícím prognostickým faktorem.
Klinická klasifikace (cTNM) je stanovována na základě fyzikálního vyšetření, endoskopie a zobrazovacích metod. Pro určení patologické klasifikace (pTNM) je určující detailní histopatologické vyšetření odstraněné tkáně chirurgem [1 – 3]. Jak ukazuje řada soudobých prací, ani nejdokonalejší zobrazovací vyšetření není schopné přesně verifikovat rozsah primárního tumoru, ani prokázat, zdali jsou regionální lymfatické uzliny postiženy metastázami [4]. Často tak vzniká neshoda mezi cTNM a pTNM klasifikací.
Cílem naší studie bylo určit, v jakém procentu dochází k neshodě mezi cTNM a pTNM klasifikací u karcinomu orofaryngu a zdali neshoda mezi cTNM a pTNM klasifikací ovlivňuje frekvenci recidiv a prognózu základního onemocnění.
Soubor a metodika
Do retrospektivního souboru byli zařazeni všichni pacienti s dlaždicobuněčným karcinomem orofaryngu, kteří v rámci primární terapie podstoupili operaci na Klinice otorinolaryngologie a chirurgie hlavy a krku FN v Hradci Králové v období 1. 1. 2001 – 31. 12. 2010. Jednalo se o 51 nemocných (40 mužů a 11 žen) ve věku 41 – 80 let (medián 58 let). TNM klasifikace byla stanovena dle aktuálně platného vydání. V období sledování souboru (2001 – 2010) bylo postupně v platnosti 5. a 6. vydání TNM klasifikace [1,2]. Rozvrstvení souboru dle jednotlivých TNM stadií ukazuje tab. 1.
Table 1. Stadia dle pTNM klasifikace. 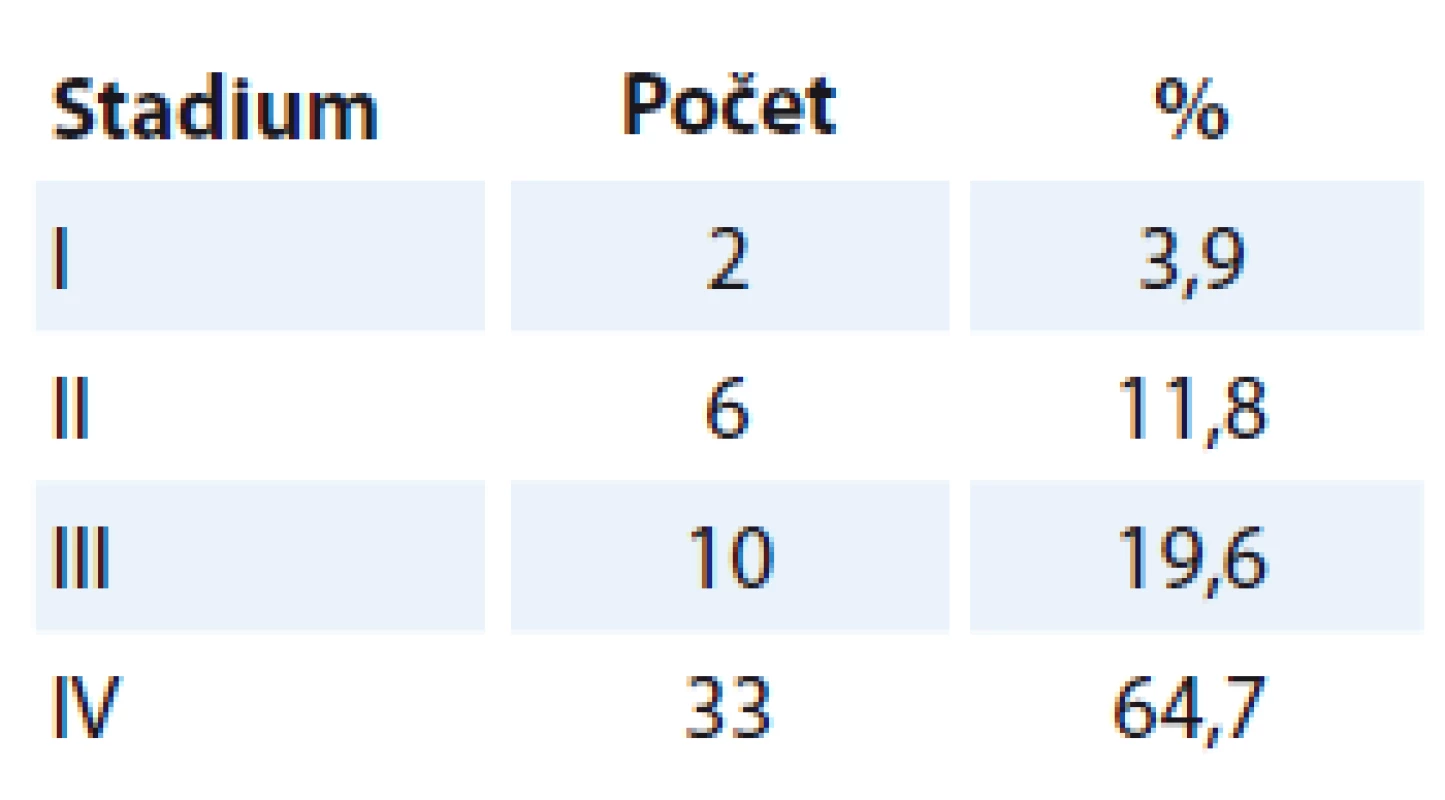
V rámci chirurgického výkonu na primárním nádoru byl současně proveden u 94,1 % nemocných i výkon na krčních uzlinách. Pooperační radioterapii a případně radiochemoterapii podstoupilo 42 (82,4 %), resp. 8 (15,7 %) pacientů.
Klinická TNM klasifikace byla stanovena na základě klinického a zobrazovacího vyšetření (sonografie, počítačové tomografie (CT) či magnetické rezonance (MRI) hlavy a krku), pTNM stanovil patolog na základě histopatologického vyšetření vlastního tumoru, odstraněných lymfatických uzlin. Shoda a neshoda TNM byly statisticky hodnoceny ve vztahu k recidivě tumoru, celkovému specifickému a nespecifickému přežití pacientů. Mezi další statisticky hodnocené potenciální prognostické faktory patřily věk pacienta, rozsah primárního tumoru, histologická pozitivita odstraněných lymfatických uzlin a histologická pozitivita okrajů.
Ke statistickému zpracování výsledků byl použit statistický program IBM SSPS, verze 22.0. Pro popis souboru byly zvoleny metody deskriptivní statistiky, Fisherův přesný test a Pearsonův chí-kvadrát test. K hodnocení přežití bez známek nádoru (disease free survival – DFS), celkového přežití (overall survival – OS) a specifického přežití (disease specific survival – DSS) byla použita Kaplan-Meierova metoda a ve vztahu k různým faktorům Long rank test (Mantel-Coxova metoda). Pro hodnocení statistické významnosti byla zvolena hodnota p ≤ 0,05.
Výsledky
Neshoda TNM klasifikace
Neshoda c - či pTNM klasifikace byla prokázána u 27 pacientů, což představuje 52,9 % souboru. U 11 nemocných se jednalo o neshodu v oblasti primárního tumoru (T), u 11 pacientů o neshodu v oblasti krčních metastáz (N) a u pěti nemocných byla prokázána neshoda v oblasti T i N.
Recidiva karcinomu orofaryngu
Recidiva či perzistence karcinomu byla v průběhu sledování zjištěna u osmi nemocných (15,7 %), přičemž u tří pacientů z této skupiny (37,5 %) byla prokázána do jednoho roku od primární diagnostiky a do tří let u sedmi nemocných (87,5 %). Doba sledování pacientů byla v rozmezí 2 – 142 měsíců.
Neshoda v kategorii N a T významněji neovlivnila frekvenci recidiv nádoru (p = 0,240, resp. p = 0,090) i přesto, že neshoda kategorie T byla spojena s mírně častější frekvencí recidiv karcinomu. U obou kategorií byla frekvence recidiv bez závislosti na snížení či zvýšení p oproti c (p = 1,000) (tab. 2). DFS bylo u nemocných s neshodou T statisticky významně kratší (p = 0,034) (graf 1). U pacientů s neshodou N bylo DFS také kratší, ale bez statistické významnosti (p = 0,216).
Table 2. Recidiva (perzistence) v závislosti na shodě či neshodě T. 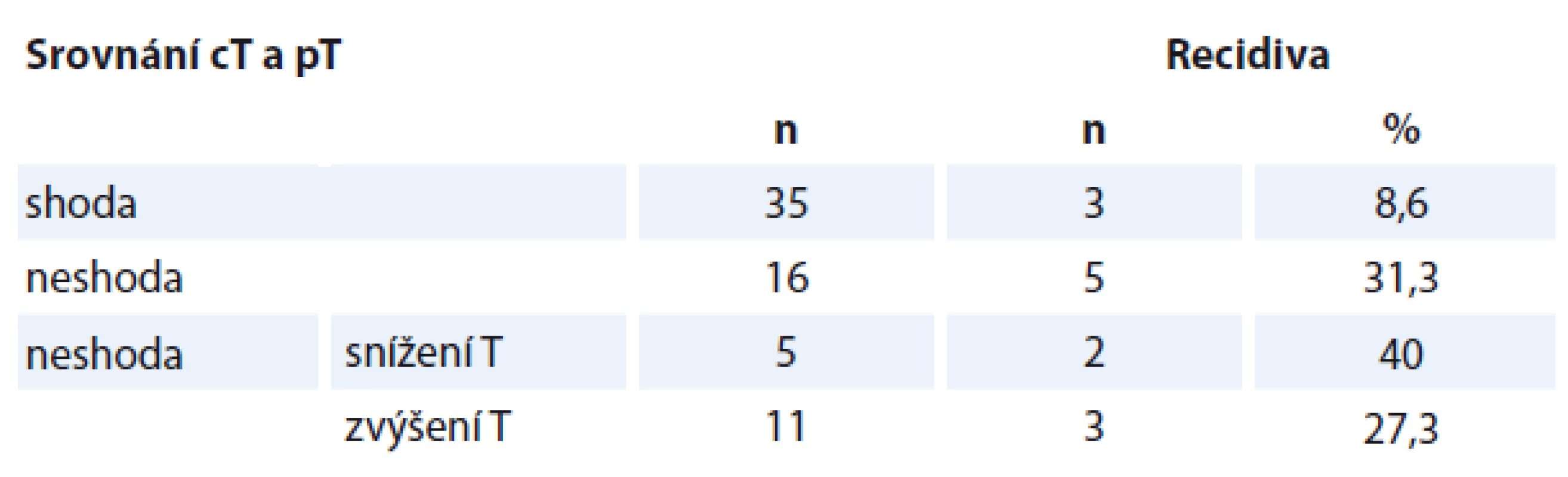
Graph 1. DFS (přežití bez známek tumoru) u shody a neshody T. 
Pravděpodobnost recidivy neovlivnil rozsah primárního tumoru, přítomnost krčních metastáz a ani prokázaný pozitivní resekční okraj (tab. 3).
Table 3. Recidiva v závislosti na různých parametrech. 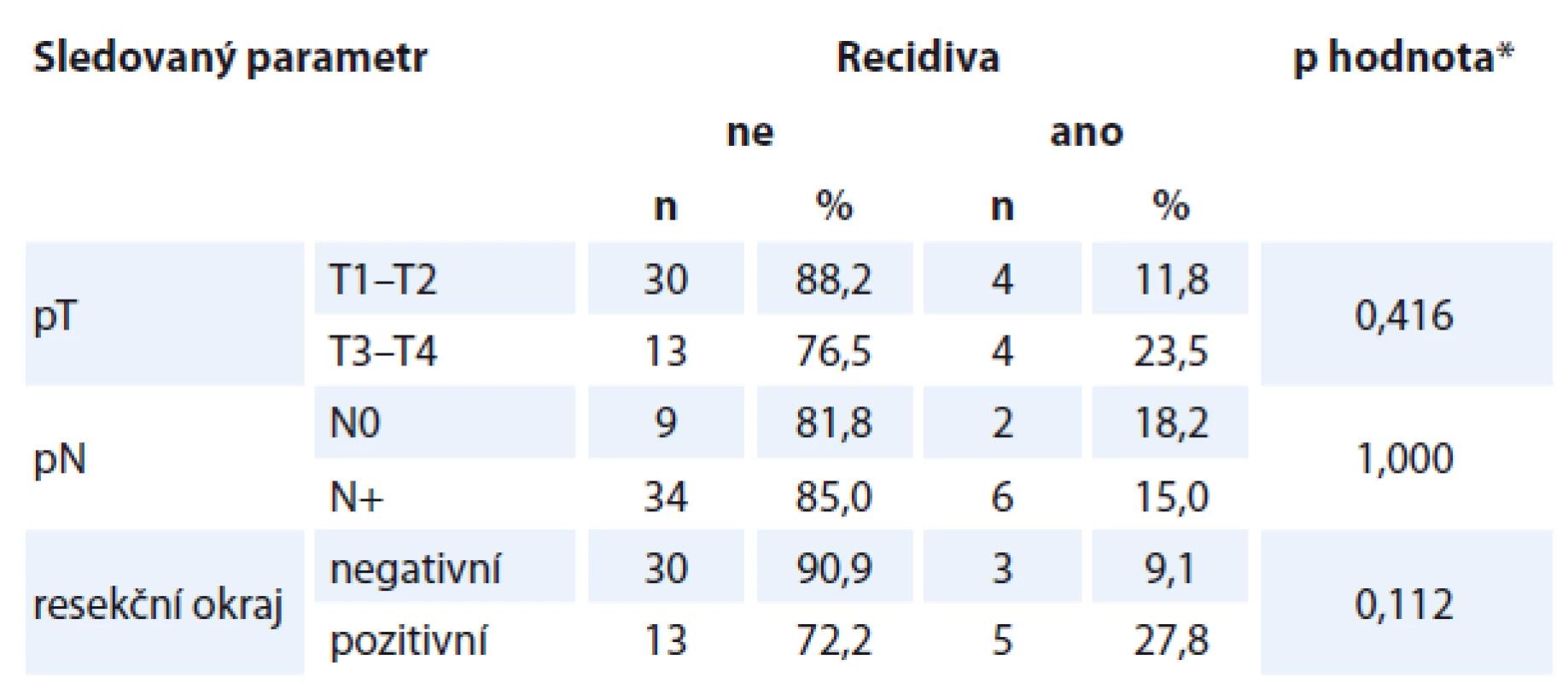
*Fischerův přesný test Úmrtí
K úmrtí v souvislosti s primárním tumorem (specifická mortalita) došlo v průběhu sledování u šesti nemocných (11,8 %). Specifická mortalita byla srovnatelná jak u pacientů s neshodou v oblasti T, tak i N či při současné neshodě v T a N. U neshody T bylo prokázáno kratší DSS na hranici statistické významnosti (p = 0,069) (graf 2). Neshoda N však DSS významněji neovlivnila (p = 0,325).
Graph 2. DSS (specifické přežití) u shody a neshody T. 
Z dalších faktorů zvyšovaly pravděpodobnost úmrtí v souvislosti s karcinomem větší rozsah primárního tumoru, přítomnost krčních metastáz a pooperační radioterapie. Specifická mortalita nebyla ovlivněna rozsahem primárního tumoru, přítomností krčních metastáz či pozitivitou resekčních okrajů (tab. 4).
Table 4. Specifická mortalita v závislosti na různých parametrech. 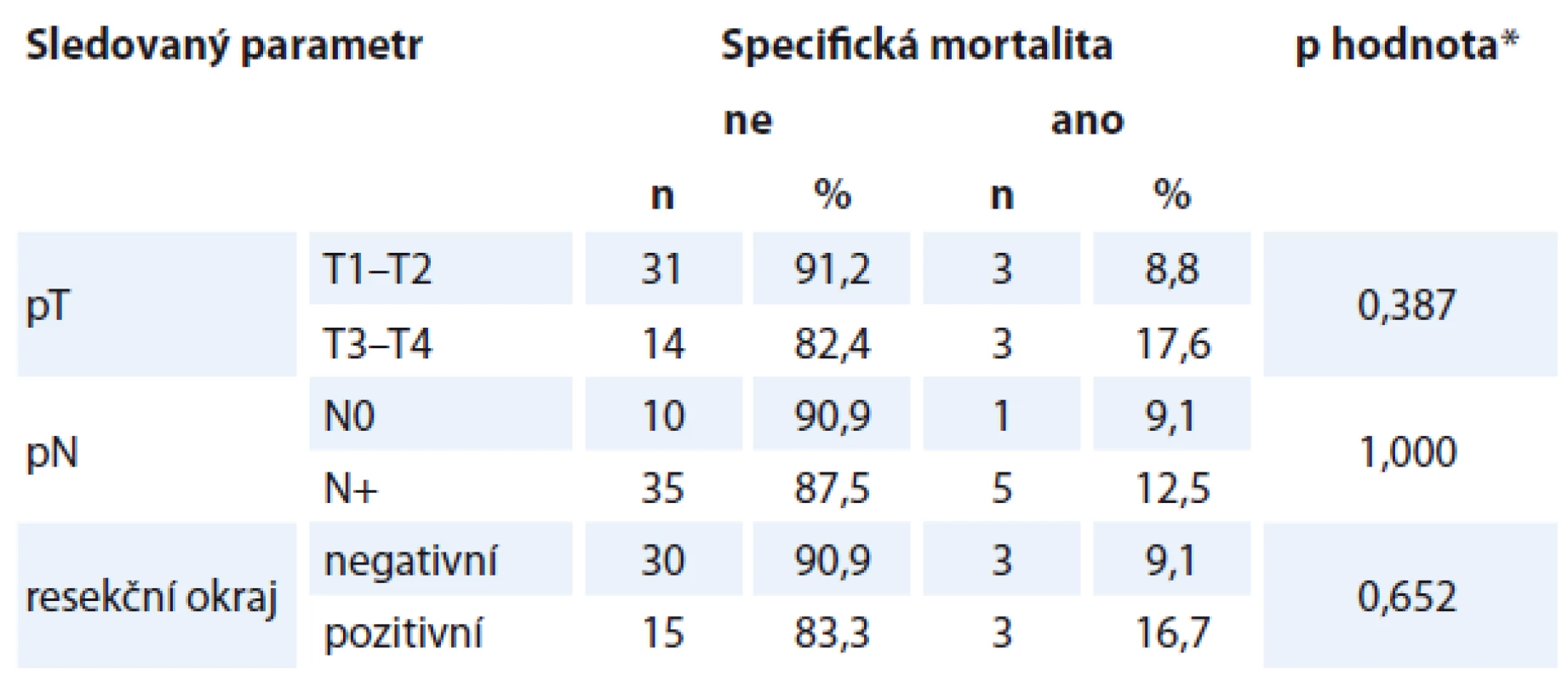
*Fischerův přesný test Diskuze
Sledovaný soubor byl klasifikován v době platnosti 5. a 6. vydání TNM klasifikace [1,2]. V současnosti je platné 7. vydání klasifikace zhoubných novotvarů, jehož česká verze byla vydána v roce 2011 [3]. V rámci jednotlivých vydání TNM klasifikace byla provedena částečná úprava kritérií pro klasifikaci rozsahu primárního tumoru (T), kdy v 6. vydání TNM byla upřesněna klasifikace T4, která byla dle vztahu nádorů k okolním anatomickým strukturám rozdělena na podskupiny T4a a T4b [2]. V současně platné TNM klasifikaci (7. vydání) byly zařazeny pod klasifikaci T3 i nádory šířící se na lingvální plochu epiglotis [3]. Určení rozsahu nádorového onemocnění pomáhá při plánování léčby, poskytuje údaje o prognóze a usnadňuje výměnu informací mezi centry, čímž přispívá k výzkumu zhoubných nádorů a současně umožňuje kontrolu a dohled nad nádorovými onemocněními. Nicméně přesnost klinického určení rozsahu nádoru je dána spolehlivostí jednotlivých diagnostických metod a současně je zatížena také chybou subjektivního hodnocení při zařazení konkrétního nádoru do příslušné TNM kategorie.
V současnosti není dostupná recentní práce, která by se zabývala touto problematikou se zaměřením na karcinom orofaryngu. Existuje však řada prací, které se zabývaly hodnocením přesnosti předoperačního klinického vyšetření, endoskopie a zobrazovacích vyšetření u karcinomu hrtanu [5,6]. Zbären et al dochází k závěru, že klinické a endoskopické vyšetření má pouze nízkou spolehlivost (57,5 %) vzhledem k možné infiltraci paraglotického prostoru, prelaryngeálního prostoru, invazi tumoru do laryngeálních chrupavek či extralaryngeálnímu šíření nádoru [6]. Současné použití CT či MRI zvyšuje spolehlivost vyšetření na 80, resp. 87,5 %. MRI dosahuje vyšší senzitivity než CT vyšetření, avšak na úkor nižší specificity [6]. Někteří autoři proto doporučují současné použití CT a MRI, přičemž kombinací těchto metod je u glotického karcinomu hrtanu dosahováno senzitivity 88 % a specificity 84 % [7 – 9]. Časté selhání CT při hodnocení přední komisury potvrzují u laryngeálních nádorů také Foucher et al [10]. V jejich souboru bylo 24,6 % nádorů na základě histologického vyšetření reklasifikováno na pT4a [10]. Větší přesnosti při určení celkového objemu tumoru oproti CT a MRI může být dosaženo pozitronovou emisní tomografií (PET), nevýhodou je však vyšší cena [11].
Ještě problematičtější než hodnocení primárního ložiska nádoru bývá průkaz metastáz v krčních uzlinách. Výsledky neovlivňuje pouze spolehlivost předoperačních diagnostických metod, ale také metodika histopatologického vyšetření. Výsledky budou zásadně rozdílné v závislosti na tom, kolik řezů každou lymfatickou uzlinou bude provedeno a zdali bude použito pouze standardní barvení, nebo bude aplikováno imunohistochemické, případně genetické vyšetření. Vyšetření lymfatických uzlin sériovými řezy a použití imunohistochemie je nutné především pro záchyt drobných okultních metastáz či mikrometastáz. Pro předoperační diagnostiku makrometastáz je zobrazovací vyšetření poměrně spolehlivé. Ultrazvukové vyšetření může být zatíženo subjektivní chybou vyšetřujícího, nicméně v rukou zkušeného lékaře dosahuje vysoké senzitivity (91 %) i specificity (97 %). O něco nižší přesnosti dosahuje při záchytu krčních metastáz CT vyšetření (senzitivita 83 %, specificita 93 %) [12].
Mikrometastázy však nebývají běžně dostupnými zobrazovacími metodami detekovatelné. Záchyt mikrometastáz u klinicky N0 nemocných se pohybuje ve velice širokém rozmezí od 2 do 58 % [13 – 17], což svědčí pro skutečnost, že metodika vyšetření je často nejednotná a procento zachycených mikrometastáz je závislé na zkušenostech vyšetřujícího histopatologa a také na rozsahu a lokalitě primárního nádoru.
Dostupné práce zabývající se porovnáním cTNM a pTNM klasifikace se zaměřují především na přesnost určení rozsahu nádoru při použití běžných diagnostických metod a standardním histologickém zpracování odstraněného nádoru i lymfatických uzlin. Koch et al porovnávali cTNM a pTNM klasifikaci u velkého soboru 501 nemocných s dlaždicobuněčným karcinomem hlavy a krku [18]. Neshodu mezi cTNM a pTNM prokázali v některém parametru u necelých 50 % pacientů v souboru [18]. Dle autorů má klinická i patologická klasifikace jako prognostický faktor obdobný význam [18]. V práci však chybí hodnocení specifických lokalit tumoru, navíc autor nehodnotí výsledky léčby ve vztahu ke shodě či neshodě cTNM a pTNM klasifikace. Nakolik nepřesné určení cTNM klasifikace ovlivňuje frekvenci recidiv onemocnění a celkovou prognózu pacienta není dle literárních údajů doposud přesně známo. V naší práci jsme prokázali neshodu mezi cTNM a pTNM klasifikací u 52,9 % souboru karcinomů orofaryngu, přičemž neshoda T či N byla diagnostikována ve stejné frekvenci. Neshoda kategorie N neměla významnější vliv na frekvenci recidiv ani na specifické přežití a přežití bez známek nádoru. Neshoda kategorie T také nebyla spojena s častějšími recidivami nádoru, ale i přesto negativně ovlivňovala specifické přežití pacientů a přežití bez známek nádoru. Ve sledovaném souboru byl prokázán statisticky významný vztah neshody T s histologicky pozitivními okraji (p = 0,011). Tento fakt vede k závěru, že případná přesnější znalost rozsahu onemocnění předoperačně (shoda cTNM a pTNM) by mohla pomoci lépe zvolit rozsah operačního výkonu. Naproti tomu by přesnější znalost rozsahu onemocnění (shoda cTNM a pTNM) ve sledovaném souboru neovlivnila léčebný postup stran pooperační radio - či chemoradioterapie. Neshoda cTNM a pTNM klasifikace v oblasti primárního nádoru (kategorie T) se tudíž jeví jako potenciální prognostický faktor a průkaz této neshody by měl být zvažován v rámci rozhodování o další pooperační onkologické léčbě.
Z dalších sledovaných faktorů neměl žádný z nich významný negativní vliv na frekvenci recidiv, DFS či na specifické přežití.
Závěr
Neshoda mezi cTNM a pTNM klasifikací byla prokázána u 52,9 % nemocných s karcinomem orofaryngu. Zatímco neshoda N neovlivňuje výrazněji prognózu onemocnění, tak neshoda T negativně ovlivňuje specifické přežití pacientů a přežití bez známek nádoru. Zlepšení výsledků léčby onkologických pacientů je proto do jisté míry závislé na možnostech a přesnosti předoperační diagnostiky.
Tato práce byla podpořena projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace č. 00179906 a grantem PRVOUK P37/11.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 18. 9. 2015
Přijato: 1. 11. 2015
MUDr. David Kalfeřt, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: david.kalfert@email.cz
Sources
1. Sobin LH, Wittekind CH (eds). TNM klasifikace zhoubných novotvarů. 5. vyd. 1997, česká verze 2000. Praha: Ústav zdravotnických informací a statistiky České republiky 2000.
2. Sobin LH, Wittekind CH (eds). TNM klasifikace zhoubných novotvarů. 6. vyd. 2000, česká verze 2004. Praha: Ústav zdravotnických informací a statistiky České republiky 2004.
3. Sobin LH, Gospodarowicz MK, Wittekind CH (eds). TNM klasifikace zhoubných novotvarů. 7. vyd. 2009, česká verze 2011. Praha: Ústav zdravotnických informací a statistiky České republiky 2011.
4. Harréus U. Surgical errors and risks – the head and neck cancer patient. GMS Curr Top Otorhinolaryngol Head Neck Surg 2013; 12: Doc04. doi: 10.3205/cto000096.
5. Zbären P, Becker M, Läng H. Pretherapeutic staging of laryngeal carcinoma. Clinical findings, computed tomography, and magnetic resonance imaging compared with histopathology. Cancer 1996; 77(7): 1263 – 1273.
6. Zbären P, Becker M, Läng H. Staging of laryngeal cancer: endoscopy, computed tomography and magnetic resonance versus histopathology. Eur Arch Otorhinolaryngol 1997; 254 (Suppl 1): S117 – S122.
7. Kim JW, Yoon SY, Park IS et al. Correlation between radiological images and pathological results in supraglottic cancer. J Laryngol Otol 2008; 122(11): 1224 – 1229. doi: 10.1017/S0022215108001746.
8. Kuno H, Onaya H, Fujii S et al. Primary staging of laryngeal and hypopharyngeal cancer: CT, MR imaging and dual-energy CT. Eur J Radiol 2014; 83(1): e23 – e35. doi: 10.1016/j.ejrad.2013.10.022.
9. Lim JY, Park IS, Park SW et al. Potential pitfalls and therapeutic implications of pretherapeutic radiologic staging in glottic cancers. Acta Otolaryngol 2011; 131(8): 869 – 875. doi: 10.3109/00016489.2011.562538.
10. Foucher M, Barnoud R, Buiret G et al. Pre - and posttherapeutic staging of laryngeal carcinoma involving anterior commissure: review of 127 cases. ISRN Otolaryngol 2012; 2012 : 363148. doi: 10.5402/2012/ 363148.
11. Daisne JF, Duprez T, Weynand B et al. Tumor volume in pharyngolaryngeal squamous cell carcinoma: comparison at CT, MR imaging, and FDG PET and validation with surgical specimen. Radiology 2004; 233(1): 93 – 100.
12. Ashraf M, Biswas J, Jha J et al. Clinical utility and prospective comparison of ultrasonography and computed tomography imaging in staging of neck metastases in head and neck squamous cell cancer in an Indian setup. Int J Clin Oncol 2011; 16(6): 686 – 693. doi: 10.1007/s10147-011-0250-2.
13. De Waal PJ, Fagan JJ, Isaacs S. Pre - and intra-operative staging of the neck in a developing world practice. J Laryngol Otol 2003; 117(12): 976 – 978.
14. Ferlito A, Shaha AR, Rinaldo A. The incidence of lymph node micrometastases in patients pathologically staged N0 in cancer of oral cavity and oropharynx. Oral Oncol 2002; 38(1): 3 – 5.
15. Hamakawa H, Fukuzumi M, Bao Y et al. Keratin mRNA for detecting micrometastasis in cervical lymph nodes of oral cancer. Cancer Lett 2000; 160(1): 115 – 123.
16. Mnejja M, Hammami B, Bougacha L et al. Occult lymph node metastasis in laryngeal squamous cell carcinoma: therapeutic and prognostic impact. Eur Ann Otorhinolaryngol Head Neck Dis 2010; 127(5): 173 – 176. doi: 10.1016/j.anorl.2010.07.011.
17. Rhee D, Wenig BM, Smith RV. The significance of immunohistochemically demonstrated nodal micrometastases in patients with squamous cell carcinoma of the head and neck. Laryngoscope 2002; 112(11): 1970 – 1974.
18. Koch WM, Ridge JA, Forastiere A et al. Comparison of clinical and pathological staging in head and neck squamous cell carcinoma: results from Intergroup Study ECOG 4393/ RTOG 9614. Arch Otolaryngol Head Neck Surg 2009; 135(9): 851 – 858. doi: 10.1001/archoto.2009.123.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 2-
All articles in this issue
- Shoda a neshoda klinické a patologické TNM klasifikace u karcinomu orofaryngu – vliv na prognózu a výsledky léčby
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Novinky v adjuvantní terapii neseminomů stadia I
- Comment – Active Surveillance vs. Adjuvant Therapy in Clinical Stage I Non-seminomatous Germ Cell Testicular Cancer
- Kvalita života měřená jako změna v čase u českých žen s karcinomem prsu
- Papilárny karcinóm štítnej žľazy u dvojročného dieťaťa
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

