-
Medical journals
- Career
Význam standardizace v hodnocení populačního přežití onkologických pacientů v ČR – metodický koncept a výsledky analýzy dat Národního onkologického registru
Authors: M. Uher 1; T. Pavlík 1; O. Májek 1; J. Mužík 1; T. Büchler 2; J. Abrahámová 2; R. Vyzula 3; J. Fínek 4; J. Vorlíček 3; L. Dušek 1
Authors‘ workplace: Institut biostatistiky a analýz, MU, Brno2 Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha3 Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno4 Onkologické a radioterapeutické oddělení, FN Plzeň 1
Published in: Klin Onkol 2014; 27(2): 127-135
Category: Original Articles
Overview
Východiska:
Hodnocení 5letého celkového a relativního přežití je standardem populačních analýz v onkologii. Odhad přežití z populačních dat však není zárukou standardizovaných referenčních hodnot použitelných pro srovnání různých populací, což platí zejména v případě, kdy se srovnávané populace pacientů výrazně liší věkovou strukturou a zastoupením klinických stadií. Tato práce prezentuje relevantní statistickou metodiku pro standardizaci populačních odhadů přežití onkologických pacientů v ČR.Soubor pacientů a metody:
Na datech Národního onkologického registru jsme hodnotili 5leté celkové a relativní přežití pro období 2001 – 2005 a 2006 – 2010. Pro demonstraci významu standardizace jsme porovnali nestandardizované odhady, věkově standardizované odhady a odhady standardizované na věk a zastoupení klinických stadií.Výsledky:
Forma standardizace populačních odhadů 5letého celkového i relativního přežití onkologických pacientů ovlivňuje výsledné hodnoty jak v rámci jednoho časového období, tak při srovnání více časových období, resp. více populací pacientů. Výsledky studie dále dokládají prokazatelné zlepšení v 5letém relativním přežití mezi obdobími 2001 – 2005 a 2006 – 2010 u 19 z 20 hodnocených diagnóz. Mezi diagnózami se statisticky významným zlepšením jsou všechny nejčastěji se vyskytující diagnózy včetně zhoubného novotvaru prostaty, plic, tlustého střeva a konečníku, prsu, ledviny, dělohy a melanomu kůže.Závěr:
Není‑li využití standardizace na věk a stadium onemocnění omezeno malým počtem pacientů v jednotlivých kategoriích dle věku a klinického stadia, lze tuto metodu považovat za vhodný metodický postup pro hodnocení populačního přežití onkologických pacientů v ČR.Klíčová slova:
onkologie – analýza přežití – relativní přežití – staging nádorů – adjustovaný odhadÚvod
Výpočet 5letého celkového a relativního přežití je standardem analýzy výstupů a kvality onkologické péče. Zatímco v hodnocení klinických studií je používáno převážně celkové přežití odrážející celkovou mortalitu u zařazených pacientů bez ohledu na konkrétní příčinu úmrtí, v populačním hodnocení je počítáno zejména relativní přežití. To definujeme jako poměr celkového přežití (overall survival – OS) a tzv. očekávaného přežití, které vyjadřuje mortalitu v obecné populaci odpovídající sledované skupině pacientů obdobím diagnózy, věkem a pohlavím. Cílem výpočtu relativního přežití je odfiltrování vlivu mortality spojené s jinými onemocněními, než jsou sledované zhoubné novotvary (ZN). Relativní přežití je populační mírou mortality odpovídající přímo či nepřímo onkologickému onemocnění, přičemž příčina úmrtí nemusí být nutně specifikována. Samotný výpočet relativního přežití však ještě není zárukou standardizovaných referenčních hodnot přežití použitelných pro srovnání různých populací. Toto platí zejména v případě, když se srovnávané populace onkologických pacientů výrazně liší věkovou strukturou a zastoupením klinických stadií [1]. V případě, že se struktura srovnávaných populací pacientů liší, je nutné hodnoty přežití podle věku a klinického stadia standardizovat.
Standardizace odhadů přežití je aktuálním úkolem, jehož výsledky se promítají do hodnocení léčebné péče na všech myslitelných úrovních. Na nutnost standardizace narazíme při srovnání výsledků péče různých zdravotnických zařízení, regionů a samozřejmě také v mezinárodních projektech. V mezinárodním hodnocení onkologické péče mají v současnosti nejvýznamnější pozici projekty EUROCARE [2,3] a CONCORD [4]. Obě studie spojují data populačních onkologických registrů vybraných evropských i mimoevropských zemí. Dosud publikované výsledky z obou studií vyzněly pro ČR spíše negativně; české hodnoty přežití jsou zde nižší, než je souhrnná hodnota pro spojená evropská data [2 – 4]. V této souvislosti je ale nutné zdůraznit, že tyto mezinárodní projekty zahrnují do analýz všechny pacienty bez informace o prodělané protinádorové terapii a hlavně bez údajů o klinickém stadiu primárního nádoru [5]. Výsledky tak přinášejí celkový epidemiologický obraz o dané populaci, avšak skutečný informační přínos pro hodnocení výsledků péče je omezený, neboť např. klinické stadium často determinuje přežití pacientů významněji než samotná diagnóza. Prezentace výstupů přežití bez ohledu na klinické stadium nádorového onemocnění je největší slabinou srovnávacích projektů. Příčinou je neúplnost dat o diagnóze nádorového onemocnění v onkologických registrech řady států. Druhou slabinou mezinárodních srovnání je neaktuálnost, neboť spojení heterogenních dat mnoha států neumožňuje dostatečně aktuální výsledky.
Česká republika má díky vynikající kvalitě Národního onkologického registru jedinečnou příležitost kvalitně dokumentovat přežití dosahované u onkologických pacientů a posoudit i jeho vývoj v čase [6]. Cílem této práce je prezentovat relevantní statistickou metodiku pro standardizaci populačních odhadů přežití onkologických pacientů v ČR a dokumentovat její výsledky na datech Národního onkologického registru (NOR) v analýze časových period 2001 – 2005 a 2006 – 2010.
Soubor pacientů a metody
Prezentované hodnocení je založeno na datech NOR, validovaných k datu 31. 12. 2010. Celkové i relativní přežití bylo hodnoceno na skupině všech onkologických pacientů diagnostikovaných od roku 1995 (vyjma dětských pacientů pod 15 let a pacientů s nulovou dobou přežití, tj. diagnostikovaných při pitvě/na základě DCO) pomocí analýzy časových period 2001 – 2005 a 2006 – 2010 [7]. Analýza zahrnuje pouze první solidní zhoubné nádory (ZN) u pacienta v dané lokalizaci, což znamená, že pacienta s více primárními nádory hodnotíme v rámci více diagnóz. Výsledky tak shrnují hodnocení 519 347 zhoubných novotvarů u 493 201 pacientů, přičemž při analýze přežití časové periody 2001 – 2005 bylo do výpočtu zahrnuto 299 184 novotvarů u 287 598 pacientů a při hodnocení přežití časové periody 2006 – 2010 se jednalo o 400 807 novotvarů u 380 479 pacientů. Z uvedených počtů je zřejmé, že skupiny pacientů se v obou časových obdobích částečně překrývají.
Relativní přežití (relative survival rate – RSR) je definováno jako poměr celkového přežití (OS) a tzv. očekávaného přežití (P*) [8]:
OS(t)
RSR(t) = —— — ,
P*(t)kde RSR(t) značí relativní přežití v čase t, OS(t) je celkové přežití v čase t a P*(t) je očekávané přežití v čase t. Věkově standardizovaný odhad relativního přežití lze jednoduše vypočítat jako vážený průměr dílčích odhadů pro jednotlivé vybrané věkové kategorie:
∑iwiRSR(t)i
RSR(t)věk = ————— — ,
∑iwikde RSR(t)věk je věkově standardizovaný odhad relativního přežití, RSR(t)i je relativní přežití i-té věkové kategorie a wi značí váhu i - té věkové kategorie v rámci dané diagnózy v referenčním časovém období. Odhad relativního přežití standardizovaný na věk a stadium je také dán váženým průměrem dílčích odhadů:
∑i∑jwijRSR(t)ij
RSR(t)věk, stadium = ————— — ,
∑i∑jwijkde RSR(t)věk, stadium je odhad relativního přežití (relative survival – RS) standardizovaný na věk a stadium onemocnění, RSR(t)ij je relativní přežití i- té věkové kategorie a j - tého stadia a wij značí váhu i - té věkové kategorie a j- tého stadia v rámci dané diagnózy v referenčním časovém období.
Pro věkovou standardizaci lze zvolit libovolnou, ale zároveň smysluplnou kategorizaci pacientů, v naší analýze jsme zvolili následujících pět věkových kategorií dle mezinárodního standardu: 15 – 44 let, 45 – 54 let, 55 – 64 let, 65 – 74 let a 75 a více let [9]. Při standardizaci na věk a klinické stadium onemocnění zároveň byly kategorie pro stadia určeny dle 4., 5. a 6. verze TNM klasifikačního sytému jako stadium I, II, II, IV a stadium neurčeno. U ZN jater, žlučníku a žlučových cest, slinivky břišní, štítné žlázy a u melanomu kůže byla kategorizace na klinická stadia nahrazena rozdělením dle ENCR doporučení [10] na lokalizované (jakékoli T, N0, M0), regionálně rozšířené (jakékoli T, N+, M0) a metastatické onemocnění (jakékoli T, jakékoli N, M1), a to z důvodu významných změn v klasifikaci klinických stadií v čase.
Celkové přežití onkologických pacientů v NOR jsme odhadli metodou úmrtnostních tabulek s jednoletými intervaly, přičemž sledovanou událostí bylo úmrtí z jakékoli příčiny [11]. K odhadu očekávaného přežití byla použita metoda dle Hakulinena [12]. Při výpočtu očekávaného přežití byly využity populační mortalitní tabulky Českého statistického úřadu (ČSÚ) stratifikované dle pohlaví, věku a kalendářního roku [13]. Hodnocení statistické významnosti změn v 5letém přežití mezi periodami 2001 – 2005 a 2006 – 2010 jsme provedli pomocí testu pro srovnání bodových odhadů přežití v daném časovém bodě s využitím logaritmické transformace funkce přežití [14]. Statistická významnost rozdílu v relativní četnosti záznamů se známým klinickým stadiem mezi srovnávanými periodami byla hodnocena s použitím Pearsonova chí ‑ kvadrát testu, stejně jako v případě testování rozdílů v zastoupení klinických stadií jednotlivých diagnóz. Všechny výpočty byly provedeny s využitím software Stata 10.0.
Výsledky
Zastoupení stadií/ agregovaných TNM kategorií v rámci jednotlivých diagnóz v periodách 2001 – 2005 a 2006 – 2010 je uvedeno v tab. 1 A, B. Podíl záznamů se známým klinickým stadiem uvedeným v databázi NOR v periodě 2006 – 2010 vzrostl oproti období 2001 až 2005 u 18 z 20 hodnocených diagnostických skupin (z toho u 15 diagnóz se jedná o nárůst statisticky významný). Jedinou diagnózou s výrazným poklesem v úplnosti informace o klinickém stadiu je ZN dělohy, což je však výsledek, který jednoznačně souvisí se změnami v TNM klasifikaci (viz Diskuze).
Tab. 1 A. Zastoupení klinických stadií prvních malignit v dané lokalizaci u pacientů hodnocených v periodě 2001–2005 a 2006–2010. 
Tab. 1 B. Zastoupení kategorií dle ENCR u prvních ZN jater, žlučníku a žlučových cest, slinivky břišní, štítné žlázy a u melanomu kůže v dané lokalizaci u pacientů hodnocených v periodě 2001–2005 a 2006–2010. 
Mezi diagnózami novotvarů jsou patrné významné rozdíly v zastoupení klinických stadií. Zatímco v případě melanomu kůže, ZN dělohy, varlete a močového měchýře výrazně převládají prognosticky příznivá stadia, u ZN dutiny ústní, hltanu a jícnu, jater, žlučníku a žlučových cest, slinivky a navíc i plic se jedná převážně o pokročilá stadia onemocnění. Statisticky významná změna v zastoupení klinických stadií mezi periodou 2001 – 2005 a 2006 – 2010 je patrná u 14 z 20 hodnocených diagnóz (ZN žaludku, tlustého střeva a konečníku, jater, žlučníku a žlučových cest, slinivky, plic, prsu, hrdla děložního, vaječníku, prostaty, ledvin, močového měchýře, štítné žlázy a melanom kůže), přičemž ve většině případů se jedná o nárůst zastoupení časných stadií. Výjimkou je pouze ZN plic, kde lze v období 2006 – 2010 pozorovat zvýšené zastoupení stadia IV.
Odhady 5letého celkového (OS) a relativního (RSR) přežití pro časové periody 2001 – 2005 a 2006 – 2010 shrnují tab. 2 a 3. Pro jednotlivé diagnostické skupiny jsou vždy uvedeny hodnoty přežití jako hrubý nestandardizovaný odhad (OS, RSR), věkově standardizovaný odhad (OSvěk, RSRvěk) a odhad přežití standardizovaný na věk a stadium onemocnění (OSvěk, stadium, RSRvěk, stadium). Výsledné odhady dokládají, že metodika výpočtu má vliv na výsledný odhad celkového i relativního přežití. U 10 diagnóz z 20 se hodnota 5letého relativního přežití standardizovaného na věk i stadium nemoci v recentní periodě 2006 – 2010 liší od nestandardizovaného odhadu o více než 1 % (tab. 3), přičemž pouze u dvou diagnóz se jedná o nárůst hodnoty přežití po standardizaci, a to u ZN dutiny ústní a hltanu (RSR = 43,6 %; RSRvěk, stadium = 45,2 %; Δ = +1,6 %) a plic (RSR = 10,7 %; RSRvěk, stadium= 11,9 %; Δ = +1,2 %). U osmi diagnóz naopak dochází po standardizaci ke snížení odhadu přežití o více než 1 %, jedná se o ZN prostaty (RSR = 86,4 %; RSRvěk, stadium = 81,5 %; Δ = – 4,9 %), ledviny (RSR = 64,9 %; RSRvěk, stadium = 61,2 %; Δ = – 3,7 %), močového měchýře (RSR = 68,8 %; RSRvěk, stadium = 65,3 %; Δ = – 3,5 %), prsu (RSR = 84,1 %; RSRvěk, stadium = 80,8 %; Δ = – 3,3 %), štítné žlázy (RSR = 94,6 %; RSRvěk, stadium = 91,6 %; Δ = – 3,0 %), hrdladěložního (RSR = 69,6 %; RSRvěk, stadium= 67,3 %; Δ = – 2,3 %), tlustého střeva a konečníku (RSR = 53,6 %; RSRvěk, stadium = 52,0 %; Δ = – 1,6 %) a melanom kůže (RSR= 84,8 %; RSRvěk, stadium = 83,4 %; Δ = – 1,4 %).
Table 1. Hodnoty 5letého celkového přežití (OS) dle diagnózy a rozdíl mezi časovou periodou 2001–2005 a 2006–2010 s využitím nestandardizovaného odhadu, standardizace dle věkových skupin a standardizace dle věkových skupin v rámci klinických stadií. 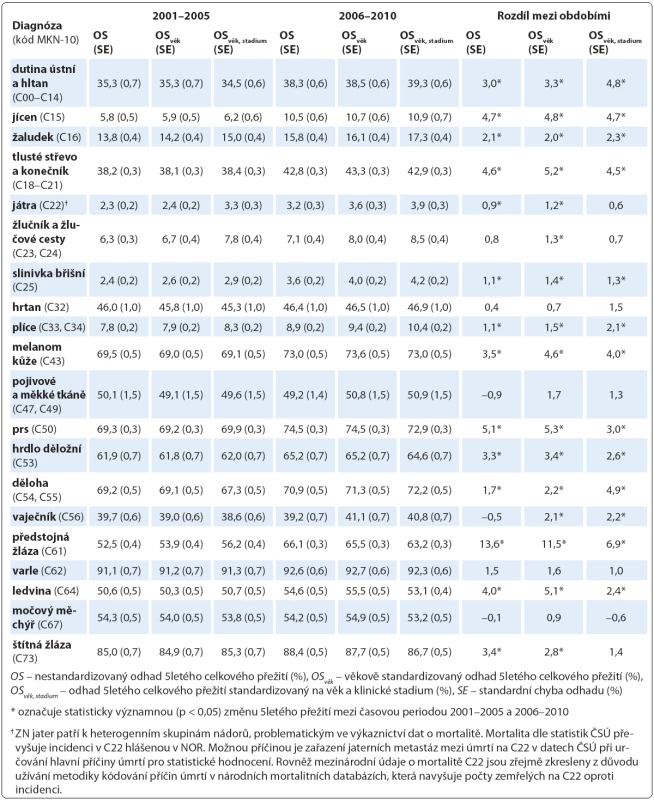
Table 2. Hodnoty 5letého relativního přežití (RSR) dle diagnózy a rozdíl mezi časovou periodou 2001–2005 a 2006–2010 s využitím nestandardizovaného odhadu, standardizace dle věkových skupin a standardizace dle věkových skupin v rámci klinických stadií. 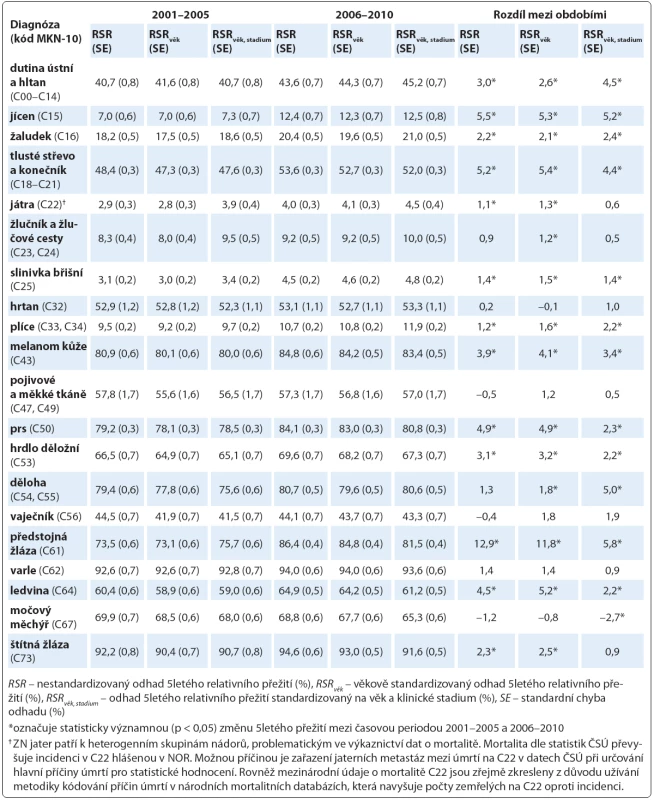
V celkovém pohledu se hodnoty 5letého relativního přežití onkologických pacientů standardizované na věk a stadium onemocnění v období 2006 – 2010 pohybují od 4,5 % a 4,8 % v případě ZN jater a slinivky břišní až do 91,6 % a 93,6 % u ZN štítné žlázy a varlete. Výsledné hodnoty relativního přežití zřetelně vyčleňují diagnostické skupiny s obecně lepší prognózou, jako jsou melanom kůže (5leté relativní přežití v období 2006 – 2010 83,4 %), ZN prsu (80,8 %), dělohy (80,6 %), prostaty (81,5 %) a již výše zmíněné ZN varlete a štítné žlázy. Na druhou stranu onkologické diagnózy s nízkou pravděpodobností 5letého relativního přežití zahrnují vedle ZN jater a slinivky břišní také zhoubný novotvar jícnu (12,5 %), žlučníku a žlučových cest (10,0 %) a ZN plic (11,9 %).
Při porovnání časových změn v nestandardizovaných odhadech, věkově standardizovaných odhadech a odhadech standardizovaných na věk a zastoupení klinických stadií lze v zásadě pozorovat tři různé výsledky: 1. standardizace nemá vliv na hodnotu přežití, 2. standardizace vede ke zvýšení rozdílu v 5letém přežití a 3. standardizace vede ke snížení rozdílu v 5letém přežití. Co se týče první možnosti, pak u čtyř diagnóz (ZN hrtanu, pojivových a měkkých tkání, vaječníku a varlete) není při hodnocení změny v 5letém relativním přežití mezi obdobími 2001 – 2005 a 2006 – 2010 patrná statisticky významná změna. Dále v případě ZN jícnu, žaludku a slinivky břišní je zřejmé statisticky významné zlepšení v recentním období oproti 2001 – 2005, nicméně jak metodikou bez standardizace, tak oběma způsoby standardizování odhadů dostáváme velmi podobné hodnoty zlepšení: ZN jícnu (ΔRSR = +5,5 %; ΔRSRvěk = +5,3 %, ΔRSRvěk, stadium = +5,2 %), žaludku (ΔRSR = +2,2 %; ΔRSRvěk = +2,1 %, ΔRSRvěk, stadium = +2,4 %), slinivky (ΔRSR = +1,4 %; ΔRSRvěk = +1,5 %, ΔRSRvěk, stadium = +1,4 %). V případě výše zmíněných diagnostických skupin tedy použití odhadu standardizovaného na věk a stadium nemoci poskytuje výsledky pro srovnání dvou časových period podobné jako v případě použití pouze věkové standardizace, což koresponduje se skutečností, že se jedná o diagnózy, u kterých není mezi obdobími patrný výrazný rozdíl v zastoupení stadií.
Pouze u tří hodnocených diagnóz (ZN dutiny ústní a hltanu, plic a dělohy) došlo po standardizaci na věk a stadium k posunu rozdílu mezi periodami ve smyslu zvýšení oproti pouze věkové standardizaci či nestandardizovanému odhadu. V případě ZN dutiny ústní a hltanu (ΔRSR = +3,0 %; ΔRSRvěk = +2,6 %, ΔRSRvěk, stadium = +4,5 %) a karcinomu plic (ΔRSR = +1,2 %; ΔRSRvěk = +1,6 %, ΔRSRvěk, stadium = +2,2 %) je toto pochopitelné, neboť u těchto diagnóz pozorujeme vyšší zastoupení pokročilých stadií v recentní periodě. Tento fakt vede v období 2006 – 2010 k podhodnocení odhadů nestandardizovaných na klinické stadium. Jak již bylo uvedeno výše, hodnocení změny přežití u ZN dělohy (ΔRSR = +1,3 %; ΔRSRvěk = +1,8 %, ΔRSRvěk, stadium = +5,0 %) je výrazně ovlivněno administrativními pravidly v hlášení záznamů do databáze NOR nesouvisejícími s epidemiologií tohoto onemocnění.
U 10 z 20 hodnocených diagnóz se standardizace na věk a klinické stadium projevila snížením rozdílu mezi srovnávanými periodami. Důvodem tohoto vlivu je vyšší zastoupení prognosticky příznivých klinických stadií v období 2006 – 2010. V případě čtyř diagnostických skupin došlo dokonce ke změně ve statistické významnosti, přičemž po standardizaci na stadium již pozorovaná změna mezi periodami není statisticky významná. Jedná se o ZN štítné žlázy (ΔRSR = +2,3 %; ΔRSRvěk = +2,5 %, ΔRSRvěk, stadium = +0,9 %), jater (ΔRSR = +1,1 %; ΔRSRvěk = +1,3 %, ΔRSRvěk, stadium = +0,6 %) a žlučníku a žlučových cest (ΔRSR = +0,9 %; ΔRSRvěk = +1,2 %, ΔRSRvěk, stadium = +0,5 %). V případě ZN močového měchýře se naopak původně nevýznamný rozdíl změnil ve statisticky významné snížení 5letého relativního přežití po standardizaci: ΔRSR = – 1,2 %; ΔRSRvěk = – 0,8 %, ΔRSRvěk, stadium = – 2,7 %. U šesti diagnóz je při použití všech tří postupů patrné statisticky významné zlepšení 5letého relativního přežití v recentním časovém období, nicméně velikost tohoto efektu je při použití standardizace na věk a stadium oproti ostatním metodám nižší. K nejvýraznějšímu posunu došlo v případě ZN prostaty (ΔRSR = +12,9 %; ΔRSRvěk = +11,8 %, ΔRSRvěk, stadium = +5,8 %), dále pak u karcinomu ledviny (ΔRSR = +4,5 %; ΔRSRvěk = +5,2 %, ΔRSRvěk, stadium = +2,2 %), prsu (ΔRSR= +4,9 %; ΔRSRvěk = +4,9 %, ΔRSRvěk, stadium = +2,3 %), tlustého střeva a konečníku (ΔRSR = +5,2 %; ΔRSRvěk = +5,4 %, ΔRSRvěk, stadium = +4,4 %), hrdla děložního (ΔRSR = +3,1 %; ΔRSRvěk = +3,2 %, ΔRSRvěk, stadium = +2,2 %) a melanomu kůže (ΔRSR= +3,9 %; ΔRSRvěk = +4,1 %, ΔRSRvěk, stadium = +3,4 %).
Diskuze
Věk pacienta, jeho výkonnostní stav (performance status) a klinické stadium onemocnění patří mezi hlavní prognostické faktory přežití v onkologii, které je nutno při zpracování dat a srovnávání výsledků s dalšími studiemi plně respektovat. Zanedbání jejich vlivu může vést ke zkresleným odhadům přežití a k srovnávání nesrovnatelného [15]. Tento článek prezentuje statistickou metodiku pro standardizaci populačního přežití v onkologii a na datech NOR ČR dokumentuje její význam a přínos. S pomocí těchto metod navíc naše studie prezentuje referenční a dosud nepublikované hodnoty 5letého celkového a relativního přežití onkologických pacientů v ČR pro období 2001 – 2005 a 2006 – 2010.
Význam použití metodiky standardizace 5letého přežití na věk pacientů a zastoupení klinických stadií lze demonstrovat na příkladu karcinomu prostaty. Při porovnání hodnot nestandardizovaného 5letého relativního přežití mezi periodami 2001 – 2005 a 2006 – 2010 je výsledkem zlepšení o +12,9 %. Při použití pouze věkové standardizace, která představuje běžně užívaný postup při hodnocení populačního přežití, se rozdíl mezi periodami příliš nezmění a jeho hodnota se pohybuje stále vysoko, na +11,8 % (srovnávaná období mají totiž podobnou věkovou skladbu pacientů s karcinomem prostaty). Nicméně z výsledků je zřejmé, že zastoupení klinických stadií mezi oběma periodami není shodné, neboť v recentní periodě 2006 – 2010 je výrazně vyšší zastoupení prognosticky příznivých stadií I a II. Porovnáním nestandardizovaného přežití anebo pouze věkově standardizovaného přežití dostáváme tedy výsledky, které jsou tímto faktem zkresleny. Korektním postupem standardizace na věk pacientů i na zastoupení klinických stadií je výsledný rozdíl odhadů 5letého relativního přežití mezi periodami 2001 – 2005 a 2006 – 2010 roven +5,8 %. Tento rozdíl je výrazně nižší než u předchozích dvou postupů, neboť reflektuje skutečnost, že v recentní periodě je menší zastoupení pacientů s horší prognózou než v periodě 2001 – 2005. Stejný efekt lze pozorovat i u dalších četných diagnóz (ZN tlustého střeva a konečníku, prsu, ledviny a melanomu kůže). Pro získání výsledků nezkreslených faktory ovlivňujícími zastoupení klinických stadií (např. rozvoj diagnostiky, screening apod.) je tak standardizace na věk a stadium nemoci vhodným metodickým postupem.
Neznalost zastoupení klinických stadií je také hlavním faktorem, který znesnadňuje srovnání hodnot 5letého relativního a celkového přežití v mezinárodním měřítku. Kromě již zmíněných studií EUROCARE i CONCORD lze tento fakt dokumentovat na studii autorů Brenner et al [16], kteří publikovali hodnoty 5letého relativního přežití onkologických pacientů v USA v období 1998 – 2003. Pro srovnání opět použijme karcinom prostaty. Zatímco v naší studii je věkově standardizované 5leté relativní přežití pacientů s karcinomem prostaty v období 2001 – 2005 rovno 73,1 %, v americké studii je tato hodnota pro rok 2003 rovna 99,8 %. Hlavní rozdíl je v tom, že v roce 2003 bylo v americké databázi Surveillance, Epidemiology, and End Results (SEER) hlášeno 4,1 % pacientů s karcinomem prostaty ve stadiu IV, zatímco v databázi NOR v období 2001 – 2005 to bylo 22,3 % (tab. 1 A). Přitom srovnání dostupných odhadů 5letého relativního přežití specifických pro stadium IV (31,7 % pro pacienty v USA v roce 2003 a 30,2 % pro české pacienty v období 2003 – 2005 [17]) nenaznačuje žádný rozdíl v přežití u metastatického onemocnění prostaty mezi oběma populacemi.
Srovnáme‑li výsledky naší studie s výsledky studie EUROCARE ‑ 4 za období 2000 – 2002 [3], vidíme, že hodnoty 5letého relativního přežití pro periodu 2001 – 2005 i 2006 – 2010 v naší analýze jsou vyšší než odhady uvedené pro ČR ve studii EUROCARE ‑ 4 za období 2000 – 2002. Odhady 5letého relativního přežití v ČR v recentním období dosahují hodnot průměrného 5letého relativního přežití pro celou populaci evropských onkologických pacientů (pro jednotlivé diagnózy se jedná o vážený průměr hodnot 47 evropských registrů zapojených do studie EUROCARE), což dokumentuje fakt, že rozdíly v přežití onkologických pacientů v jednotlivých státech Evropy se v posledním desetiletí snižují [18]. Výjimkou jsou pouze karcinom těla děložního a ledviny, kde však ČR dosahovala srovnatelného přežití s ostatními evropskými státy již v období 2000 – 2002. Toto zlepšení, které souvisí i s pozitivním posunem v zastoupení primárně diagnostikovaných méně pokročilých klinických stadií, odráží pozitivní trend v epidemiologii a léčbě onkologických onemocnění v ČR a dokládá soustavné zlepšování kvality protinádorové péče v ČR v uplynulých dvou desetiletích [17].
Naše studie má výhody a samozřejmě i omezení. Hlavní výhodou je její reprezentativnost vzhledem k populaci českých onkologických pacientů. Na rozdíl od studií EUROCARE ‑ 4 a CONCORD [2 – 4], kde je ČR administrativní chybou zastoupena pouze daty za západočeský region, zde prezentujeme výsledky vypočtené na základě kompletních a plně reprezentativních dat NOR a zároveň respektujeme klinicky relevantní údaje o stadiu nádoru [1]. S klinickým stadiem onemocnění však souvisí i potenciální úskalí této studie, neboť použití standardizace na stadium nádoru implikuje nutnost definování odpovídajících si klinických stadií mezi srovnávanými populacemi pacientů, čehož nelze vždy dosáhnout (např. z důvodu změn v klasifikaci stadií). V takových případech je potřeba odvozovat jiné kategorizace reprezentující pokročilost a rozsah onemocnění, které ovšem nemusí mít stejnou informační hodnotu jako TNM klasifikace [10].
Dalším faktorem ovlivňujícím vhodnost použití standardizace na stadia mohou být výrazné změny v zastoupení záznamů se známým klinickým stadiem, neboť v případě zásadně odlišné struktury pacientů zahrnutých do kategorie s neznámým klinickým stadiem nelze ani pomocí standardizace na stadia dosáhnout srovnatelných výsledků. Příkladem takového problému jsou data o ZN dělohy, kde jako u jediné diagnózy pozorujeme významný pokles zastoupení záznamů se známým stadiem onemocnění v čase (v periodě 2001 – 2005 : 82,6 %; v periodě 2006 – 2010 : 69,8 %). Tento fakt jednoznačně souvisí se změnami v TNM klasifikaci. Podle pravidel TNM klasifikace do 6. vydání se dělení do stadií vztahuje pouze na anatomické lokalizace krček děložní (C54.0) a tělo děložní (C54.3, případně C54.8 – 9). Z tohoto důvodu došlo od roku 2005, kdy byly do registračního software databáze NOR zavedeny striktní kontroly dodržování klasifikačních pravidel, k poklesu podílu určených stadií, zejména u lokalizace C54.1 (endometrium – sliznice). Od 7. vydání TNM klasifikace jsou již stadia zavedena i pro lokalizaci C54.1. O nápravě vysokého podílu neuvedených stadií v období 2005 – 2010 bylo navíc rozhodnuto radou NOR, chybějící údaje jsou do databáze NOR průběžně doplňovány.
Další nevýhodou uvedené statistické metodiky je její omezená aplikovatelnost v případech méně četných diagnóz, kde jednotlivé kategorie definované věkovými skupinami a klinickými stadii nemají dostatečnou četnost. Malá četnost a nestandardní provádění cenzury mohou vést k nulovým odhadům specifického přežití pro jednotlivé podskupiny pacientů, které mohou následně zkreslit výsledné odhady 5letého celkového a relativního přežití.
Závěrem zmiňme, že standardizaci na klinické stadium je možné samozřejmě obejít prezentací odhadů přežití odděleně pro jednotlivá stadia onemocnění. Tento postup jistě přináší využitelnější informaci pro hodnocení výsledků diagnostiky a léčby pro různě pokročilé formy onemocnění. Nicméně při publikaci souhrnných výsledků napříč všemi stadii onemocnění nebo při interpretaci odhadů přežití publikovaných bez separace klinických stadií minimalizuje správně provedená standardizace riziko zkreslení.
Závěr
Forma standardizace populačních odhadů 5letého celkového i relativního přežití onkologických pacientů ovlivňuje výsledné hodnoty jak v rámci jednoho časového období, tak při srovnání více časových období, resp. více populací pacientů. Naše studie ukázala, že u 10 onkologických diagnóz z 20 se hodnota 5letého relativního přežití standardizovaného na věk i stadium nemoci v recentní periodě 2006 – 2010 liší od nestandardizovaného odhadu nebo odhadu standardizovaného pouze na věk o více než 1 %, s maximem – 4,9 % u karcinomu prostaty. Při srovnání časových období 2001 – 2005 a 2006 – 2010 se standardizace na věk a klinické stadium projevila snížením rozdílu v 5letém relativním přežití mezi srovnávanými periodami také u 10 z 20 hodnocených diagnóz. U čtyř diagnóz došlo ke změně ve statistické významnosti rozdílu, přičemž po adekvátní standardizaci na klinické stadium již pozorovaná změna mezi obdobími není statisticky významná. Není‑li využití standardizace na věk a stadium onemocnění omezeno malým počtem pacientů v jednotlivých kategoriích věk-stadium, lze tuto metodu považovat za vhodný metodický postup pro hodnocení populačního přežití onkologických pacientů v ČR.
Prezentované výsledky studie dále dokládají prokazatelné zlepšení v 5letém relativním přežití mezi obdobími 2001 – 2005 a 2006 – 2010 u 19 z 20 hodnocených diagnóz. Mezi diagnózami se statisticky významným zlepšením jsou všechny nejčastěji se vyskytující diagnózy včetně ZN prostaty, plic, tlustého střeva a konečníku, prsu, ledviny, dělohy a melanomu kůže.
Práce byla podpořena prostředky z projektu OPVK č. CZ 1.07/2.3.00/35.0005 s názvem „Věda a vědci pro vzdělanost moderní společnosti“.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. RNDr. Ladislav Dušek, Ph.D.
Institut biostatistiky a analýz MU
Kamenice 126/3
625 00 Brno
e-mail: dusek@iba.muni.cz
Obdrženo: 16. 10. 2013
Přijato: 9. 12. 2013
Sources
1. Clerc L, Jooste V, Lejeune C et al. Cost of care of colorectal cancers according to health care patterns and stage at diagnosis in France. Eur J Health Econ 2008; 9(4): 361 – 367.
2. Berrino F, De Angelis R, Sant M et al. Survival for eight major cancers and all cancers combined for European adults diagnosed in 1995 – 99: results of the EUROCARE ‑ 4 study. Lancet Oncol 2007; 8(9): 773 – 783.
3. Verdecchia A, Francisci S, Brenner H et al. Recent cancer survival in Europe: a 2000 – 02 period analysis of EUROCARE ‑ 4 data. Lancet Oncol 2007; 8(9): 784 – 796.
4. Coleman MP, Quaresma M, Berrino F et al. Cancer survival in five continents: a worldwide population‑based study (CONCORD). Lancet Oncol 2008; 9(8): 730 – 756.
5. Dušek L, Pavlík T, Mužík J et al. Populační standardy relativního přežití onkologických pacientů v ČR kalkulované z dat NOR – reakce na výsledky publikované ve studii EUROCARE 4. Klin Onkol 2007; 20(6): 399 – 404.
6. Dušek L, Pavlík T, Koptíková J et al. Národní onkologický registr ČR jako zdroj referenčních standardů pro hodnocení výsledků léčebné péče. Klin Onkol 2007; 20 (Suppl 1):77 – 95.
7. Brenner H, Soderman B, Hakulinen T. Use of period analysis for providing more up ‑ to ‑ date estimates of long‑term survival rates: empirical evaluation among 370.000 cancer patients in Finland. Int J Epidemiol 2002; 31(2): 456 – 462.
8. Ederer F, Axtell LM, Cutler SJ. The relative survival rate: a statistical methodology. Natl Cancer Inst Monogr 1961; 6 : 101 – 121.
9. Corazziari I, Quinn M, Capocaccia R. Standard cancer patient population for age standardising survival ratios. Eur J Cancer 2004; 40(15): 2307 – 2316.
10. Berrino F, Brown C, Moller T et al (eds). ENCR Recommendation. Condensed TNM for coding the extent of disease. Lyon: European Network of Cancer Registries 2002.
11. Marubini E, Valsecchi MG (eds). Analysing survival data from clinical trials and observational studies. New York: John Wiley & Sons 2004.
12. Hakulinen T. Cancer survival corrected for heterogeneity in patient withdrawal. Biometrics 1982; 38(4): 933 – 942.
13. Mortality.org [homepage on the internet]. The Human Mortality Database. University of California, Berkeley (USA), and Max Planck Institute for Demographic Research (Germany). Available from: www.mortality.org; www.humanmortality.de.
14. Klein JP, Logan B, Harhoff M et al. Analyzing survival curves at a fixed point in time. Stat Med 2007; 26(24): 4505 – 4519.
15. Brenner H, Arndt V. Further enhanced monitoring of cancer patient survival by stage ‑ adjusted period analysis. Cancer Epidemiol Biomarkers Prev 2005; 14(8):1917 – 1921.
16. Brenner H, Gondos A, Arndt V. Recent major progress in long‑term cancer patient survival disclosed by modeled period analysis. J Clin Oncol 2007; 25(22): 3274 – 3280.
17. Dusek L et al (eds). Czech Cancer Care in Numbers 2008 – 2009. Praha: Grada Publishing 2009.
18. Verdecchia A, Guzzinati S, Francisci S et al. Survival trends in European cancer patients diagnosed from 1988 to 1999. Eur J Cancer 2009; 45(6): 1042 – 1066.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 2-
All articles in this issue
- Zajímavé případy z nutriční péče v onkologii
- Role mikroRNA v molekulární patologii karcinomu jícnu a jejich potenciální využití v klinické onkologii
- Lobulární karcinom prsu u muže – kazuistika a přehled literatury
- Aplikace poznatků psychoneuroimunologie v kontextu komplexní onkologické léčby karcinomu prsu
- Léčba anakinrou u Schnitzler‑ syndromu – výsledky první retrospektivní multicentrické studie šesti pacientů z České republiky
- Význam standardizace v hodnocení populačního přežití onkologických pacientů v ČR – metodický koncept a výsledky analýzy dat Národního onkologického registru
- Další postupný ústup od axilární disekce u časného karcinomu prsu
- Mamografický screening u brazilských žen z hlediska socio‑ ekonomické stratifikace
- Adenokarcinóm rete testis – zriedkavý prípad testikulárnej malignity
- Renálny onkocytóm s histologickými črtami invázie – kazuistika
- Massive Cutaneous Metastasis of a Renal Cell Carcinoma
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aplikace poznatků psychoneuroimunologie v kontextu komplexní onkologické léčby karcinomu prsu
- Renálny onkocytóm s histologickými črtami invázie – kazuistika
- Další postupný ústup od axilární disekce u časného karcinomu prsu
- Lobulární karcinom prsu u muže – kazuistika a přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

