-
Medical journals
- Career
Neskoré následky u pacientov liečených alogénnou transplantáciou kmeňových krvotvorných buniek
Authors: Ľ. Roziaková 1,2; E. Bojtárová 2; M. Mistrík 2; B. Mladosievičová 1
Authors‘ workplace: Ústav patologickej fyziológie, LF UK Bratislava, Slovenská republika 1; Klinika hematológie a transfuziológie, LF UK, SZU a UN Bratislava, Slovenská republika 2
Published in: Klin Onkol 2011; 24(6): 453-459
Category: Original Articles
Overview
Východiská:
Alogénna transplantácia kmeňových krvotvorných buniek (TKB) sa stala liečebnou modalitou pre mnohé malígne a nemalígne ochorenia. Počet dlhodobo prežívajúcich pacientov po tejto liečebnej modalite sa zvyšuje. Dlhodobá kvalita života u pacientov po TKB predstavuje multidisciplinárny problém. Cieľom práce bolo zistiť prevalenciu vybraných neskorých následkov u dlhodobo prežívajúcich pacientov po TKB.Pacienti a metódy:
Vyšetrili sme 45 pacientov vo veku 12–63 rokov, ktorí boli aspoň 2 roky od alogénnej TKB pre hematologickú diagnózu. Dvanásť (26,7 %) pacientov dostalo celotelové ožiarenie v rámci prípravného režimu. Medián sledovania bol 6 rokov (rozsah, 2–18 rokov).Výsledky:
Zistené toxické komplikácie mali subklinický až životohrozujúci charakter. Prevalencia aspoň jedného neskorého následku bola 88,9 %. Z endokrinných a metabolických komplikácií sme zistili abnormality štítnej žľazy u 12 (26,7 %) pacientov, skeletálne komplikácie u 13 (28,8 %) a metabolický syndróm u 13 (28,8 %). Očné komplikácie sme diagnostikovali u 20 (44,4 %), kardiovaskulárne abnormality u 15 (33,3 %), pľúcnu dysfunkciu u 6 (13,3 %) a sekundárne malignity u 3 (6,67 %) prežívajúcich pacientov. Počet komplikácií u pacienta narastal s časom od TKB. Chronická reakcia štepu proti hostiteľovi bola signifikantným rizikovým faktorom pri rozvoji očných, pľúcnych a skeletálnych komplikácií.Záver:
Potvrdený zvýšený výskyt neskorých toxických komplikácií u pacientov prežívajúcich viac ako 2 roky po transplantácii kmeňových krvotvorných buniek môže byť ďalším stimulom pre prospektívne štúdie a pre intervencie potrebné pre ich prevenciu.Kľúčové slová:
neskorá toxicita – transplantácia kmeňových krvotvorných buniek – dlhodobé sledovanieÚvod
Alogénna transplantácia kmeňových krvotvorných buniek (TKB) sa stala perspektívnou liečebnou modalitou pre mnohé malígne a nemalígne ochorenia. Pokrok v liečbe a podpornej starostlivosti vyústil nielen k zlepšenému celkovému prežívaniu, ale aj k zvyšujúcemu sa počtu prežívajúcich pacientov po TKB [1]. Očakáva sa, že v roku 2020 bude celosvetovo viac ako pol milióna dlhodobo prežívajúcich pacientov po tejto liečebnej modalite [2]. Snahou a cieľom súčasnej hematológie je nielen vyliečenie pacientov zo závažného hematologického ochorenia, ale aj poskytnutie kvalitného života po jeho vyliečení. Transplantácie kmeňových krvotvorných buniek môžu zapríčiniť poškodenia rôznych orgánov a tkanív – od minimálnych potenciálne progredujúcich subklinických zmien až po život ohrozujúce stavy [3].
Mnohé štúdie potvrdili zvýšený výskyt neskorej toxicity u pacientov po TKB oproti ich HLA identickým súrodencom [4,5]. Medzi neskoré následky po TKB patria endokrinné [6,7], očné [8], respiračné [9], kostné [10,11] neurologické komplikácie [12], kardiotoxicita [13,14], sekundárne malignity a ďalšie [15,16]. Po použití nových liečebných transplantačných modalít (transplantácia pupočníkovej krvi, redukované prípravné režimy a haploidentické transplantácie zbavené T-buniek) sa môžu objaviť autoimunitné syndrómy [17].
Riziko neskorej toxicity je ovplyvnené typom ochorenia, predchádzajúcou liečbou, komorbiditami, vekom pacienta, prípravným režimom, akútnou a chronickou reakciou štepu proti hostiteľovi (GvHD) a jej liečbou [18]. V tejto práci analyzujeme vybrané neskoré komplikácie, ich kumulatívnu incidenciu a rizikové faktory u pacientov, ktorí sú aspoň 2 roky od TKB.
Pacienti a metódy
Pacienti
Súbor tvorilo 45 dospelých pacientov (24 mužov a 21 žien), ktorí boli aspoň 2 roky od TKB a boli vyšetrení na Transplantačnej ambulancii Kliniky hematológie a transfuziológie LF UK, SZU a UN Bratislava od 1. augusta 2010 do 28. februára 2011. Medián veku v čase diagnózy bol 33 rokov (rozsah 12–59 rokov) a medián od transplantácie bol 6 rokov (rozsah 2–18 rokov). Najčastejšou indikáciou na transplantáciu bola akútna myeloblastová leukémia (AML, n = 12), akútna lymfoblastová leukémia (ALL, n = 8) a chronická myeloidná leukémia (CML, n = 11), medzi ďalšie diagnózy patrila paroxyzmálna nočná hemoglobínúria (PNH, n = 4), osteomyelofibróza (OMF, n = 2), ťažká aplastická anémia (SAA, n = 7) a myelodysplastický syndróm (MDS, n = 1). Dvadsať pacientov bolo pred TKB liečených antracyklínom (ANT) s mediánom kumulatívnej dávky prepočítanej na doxorubicín 250 mg/m2 (125–450), 8 pacientov dostalo rádioterapiu (RAT) na kranium a kraniospinálnu oblasť v celkovej dávke (TD) 24 Gy a 3 pacienti RAT na mediastinum v celkovej dávke 24 Gy. Charakteristiky pacientov sú uvedené v tab. 1.
Table 1. Charakteristika súboru pacientov. 
Zdrojom kmeňových krvotvorných buniek bola kostná dreň (KD) u 18 pacientov a periférne kmeňové krvotvorné bunky (PKB) u 27 pacientov. Darcom krvotvorných buniek bol HLA--zhodný súrodenec, iba v 5 prípadoch išlo o zhodného nepríbuzného darcu. U 12 pacientov prípravný režim (PR) pozostával z celotelového ožiarenia (TBI) v TD 12 Gy rozdelených do 6 frakcií v kombinácii s cyklofosfamidom (CY) 120 mg/kg počas 2 dní. Zvyšných 33 pacientov dostávalo v rámci PR kombinovanú chemoterapiu (CY, busulfan, fludarabín, VP-16), alebo v kombinácii s antitymocytovým globulínom. V rámci profylaxie reakcie štepu proti hostiteľovi (GvHD) dostávali pacienti cyklosporín A s metotrexátom. Chronická GvHD sa objavila u 13 pacientov a liečba pozostávala z prolongovanej imunosupresívnej terapie (cyklosporín A, mykofenolát mofetil) s alebo bez kortikosteroidu.
Práca bola schválená Etickou komisiou Univerzitnej nemocnice v Bratislave v júni 2009. Každý pacient bol poučený a podpísal informovaný súhlas.
Metódy
Vyhodnotenie funkcie štítnej žľazy
Funkcie štítnej žľazy sme hodnotili na základe biochemického vyšetrenia hormónov štítnej žľazy (fT4) a tyreostimulačného hormónu (TSH). Referenčné hodnoty TSH boli medzi 0,5 a 5,0 mIU/l a fT4 medzi 12 a 20 pmol/l.
Dysfunkcia štítnej žľazy (ŠŽ) bola definovaná ako:
- primárny hypotyreoidizmus: zvýšená hodnota TSH s normálnou hodnotou fT4 (subklinický hypotyreoidizmus) alebo so zníženou hodnotou fT4 (manifestný hypotyreoidizmus);
- centrálny hypotyreoidizmus: znížená hodnota fT4 s normálnou alebo zníženou hodnotou TSH.
Metabolický syndróm
Biochemicky sme vyšetrili hodnotu glukózy nalačno a lipidový profil pacienta, realizovali sme vyšetrenie tlaku krvi (TK) a body mass index (BMI) sme vypočítali ako hmotnosť v kilogramoch delenú výškou v metroch na druhú. V diagnostike metabolického syndrómu (MS) sme vychádzali z odporúčaní publikovaných v Slovenskej republike, pričom museli byť prítomné aspoň 3 komponenty MS z uvedených:
- hmotnosť/obezita (BMI nad 25 kg/m2);
- hypertriacylglycerolémia: nad 1,7 mmol/l;
- znížené hladiny HDL-cholesterolu: pod 1,0 mmol/l (muži), pod 1,3 mmol/l (ženy);
- zvýšené hodnoty TK: nad 130/85 mmHg;
- glykémia nalačno nad 5,6 mmol/l (hraničná glykémia nalačno alebo DM 2).
Vyhodnotenie kardiálnej funkcie
Pacientom sme vyšetrili markery kardiálneho poškodenia, N-terminálny fragment mozgového nátriuretického peptidu (NT-proBNP) a kardiálny troponín T (cTnT) a zrealizovali echokardiografické vyšetrenie. Normálne hodnoty cTnT boli < 0,014 μg/l a hodnoty NT-proBNP < 100 pg/ml u mužov a < 150 pg/ml u žien. Echokardiografické vyšetrenie realizoval jeden kardiológ a vyhodnocovali sme parametre systolickej a diastolickej funkcie a prítomnosť perikardiálneho výpotku. Systolická dysfunkcia bola definovaná ako ejekčná frakcia (EF) < 55 %. Diastolická dysfunkcia hodnotená prostredníctvom dopplerovskej echokardiografie bola definovaná ako E/A inverzia a deceleračný čas (DT) nad 220 ms. Perikardiálny výpotok do 100 ml bol považovaný za fyziologický.
Vyhodnotenie pľúcnej funkcie
U pacientov bolo realizované spirometrické vyšetrenie s vyhodnotením objemu úsilného výdychu za jednu sekundu (FEV1) a vitálnej kapacity pľúc (FVC).
- normálna pľúcna funkcia: FVC a FEV1 > 80 %;
- reštrikčná ventilačná porucha: FEV1 > 80 %, FVC < 80 %;
- obštrukčná ventilačná porucha: FEV1 < 80 %, FVC > 80 %.
Poškodenie kostného systému
U pacientov bolo realizované denzitometrické vyšetrenie. Osteopénia bola definovaná ako T skóre medzi –1 a –2,5, osteoporóza ako T skóre pod –2,5.
Očné vyšetrenie
Realizovali sme komplexné oftalmologické vyšetrenie zahrňujúce vyšetrenie štrbinovou lampou, vyšetrenie zrakovej ostrosti a očného pozadia, Schirmerov test a zmeranie vnútroočného tlaku. Katarakta bola definovaná ako prítomnosť subkapsulových opacít. Schirmerov test bol pozitívny, ak po 5 min bola línia nasiaknutia papierika slzami < 10 mm.
Štatistické analýzy
Základné charakteristiky súboru pacientov, ako vek v čase diagnózy, vek v čase TKB, čas od TKB a kumulatívna dávka antracyklínu, boli vyjadrené ako medián a rozsah. Premenné hodnoty (echokardiografické parametre) boli vyjadrené ako priemer ± smerodajná odchýlka (SD). Hodnoty NT-proBNP a cTnT boli vyjadrené ako medián a medzikvartilové rozpätie. Pre porovnávanie kategorických premenných sme použili chi-kvadrát test. Asociácie medzi premennými boli vyhodnocované prostredníctvom Spearmannovho korelačného koeficientu. Na určenie rizikového faktora sme použili Fisherov exaktný test a na kumulatívnu incidenciu pre jednotlivé neskoré následky analýzu kumulatívnej incidencie. Za signifikantný rozdiel sme považovali pravdepodobnosť nulovej hypotézy menšiu ako 5 % (P < 0,05).
Výsledky
Počet pacientov bez komplikácie po transplantácii v našom súbore bol nízky. Len 5 pacientov (11,1 %) bolo bez akýchkoľvek následkov. Výskyt neskorej toxicity sa zvyšoval s časom od TKB. Medián doby od TKB u pacientov s 1 neskorým následkom bol 6 rokov (rozsah 2–18), kým u pacientov so 4 následkami bol medián 8 rokov (rozsah 3–14). Obr. 1 a 2 znázorňujú počty pacientov v závislosti od počtu komplikácií po TKB. Kumulatívna incidencia pre jednotlivé následky je uvedená v tab. 2.
Image 1. Frekvencia počtu neskorých komplikácií. 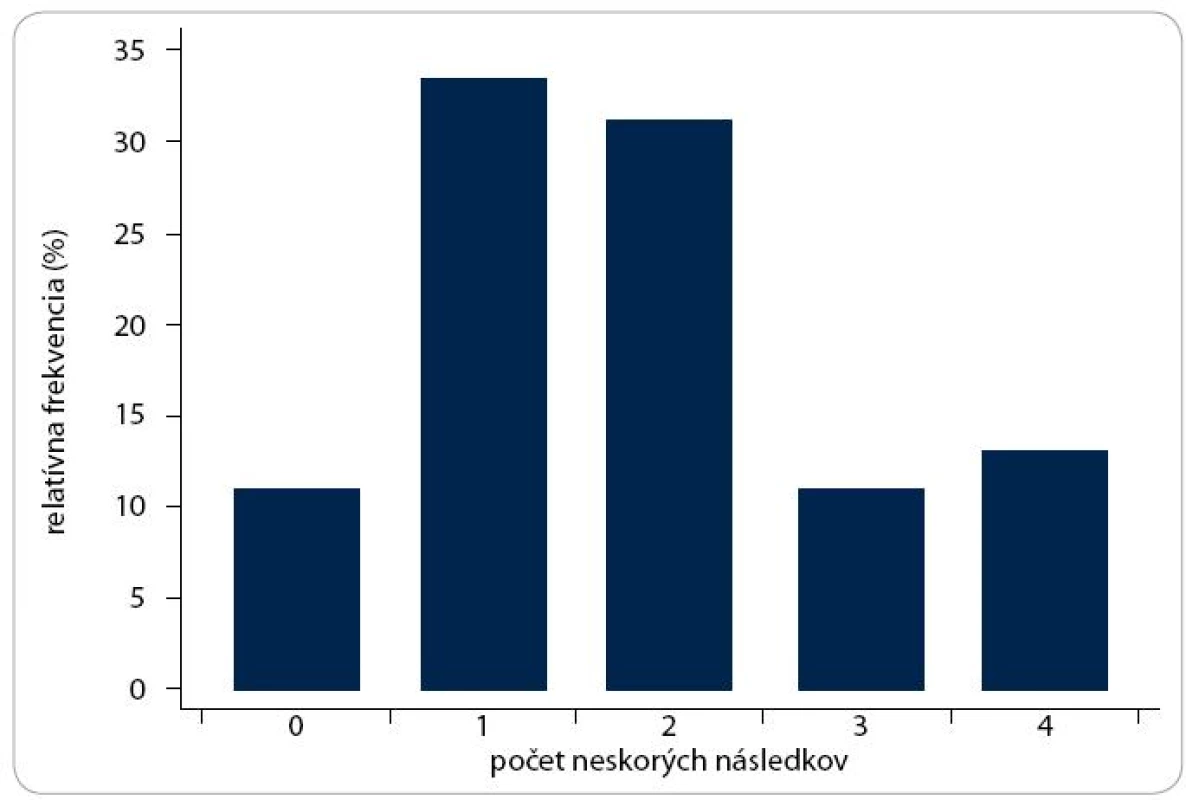
Image 2. Prehľad počtu pacientov s jednotlivými neskorými následkami po TKB. 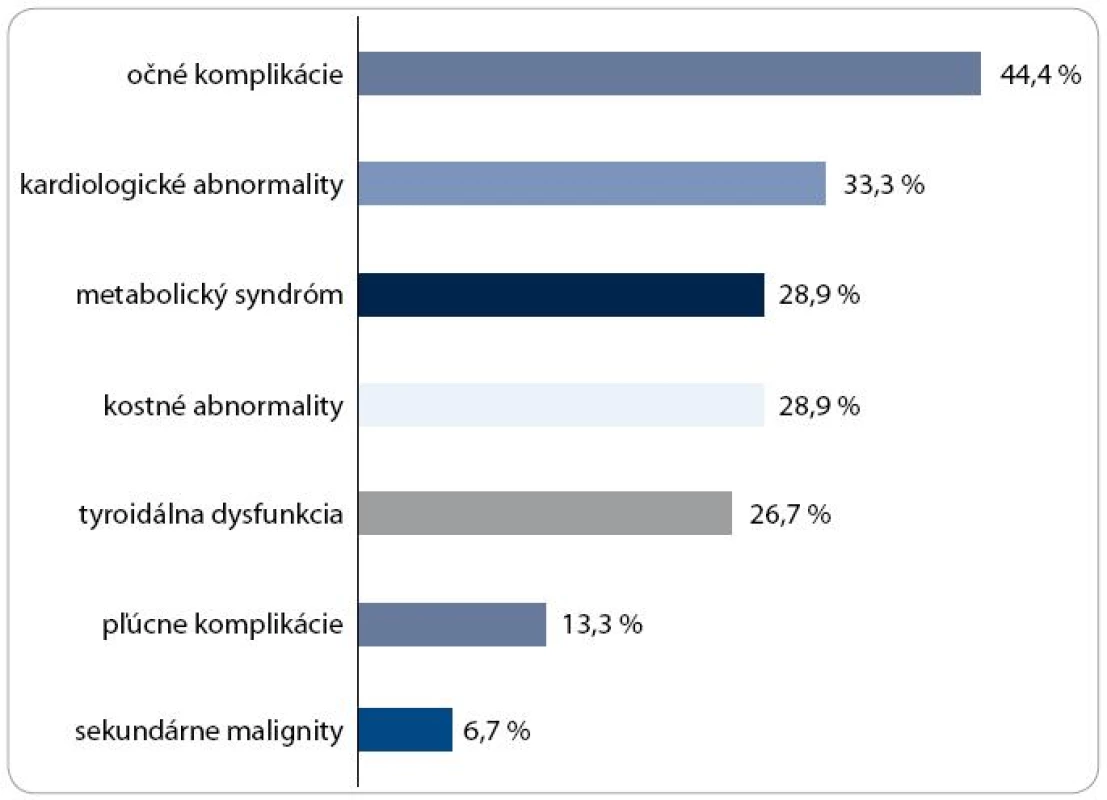
Table 2. Kumulatívna incidencia (KI) jednotlivých neskorých následkov. 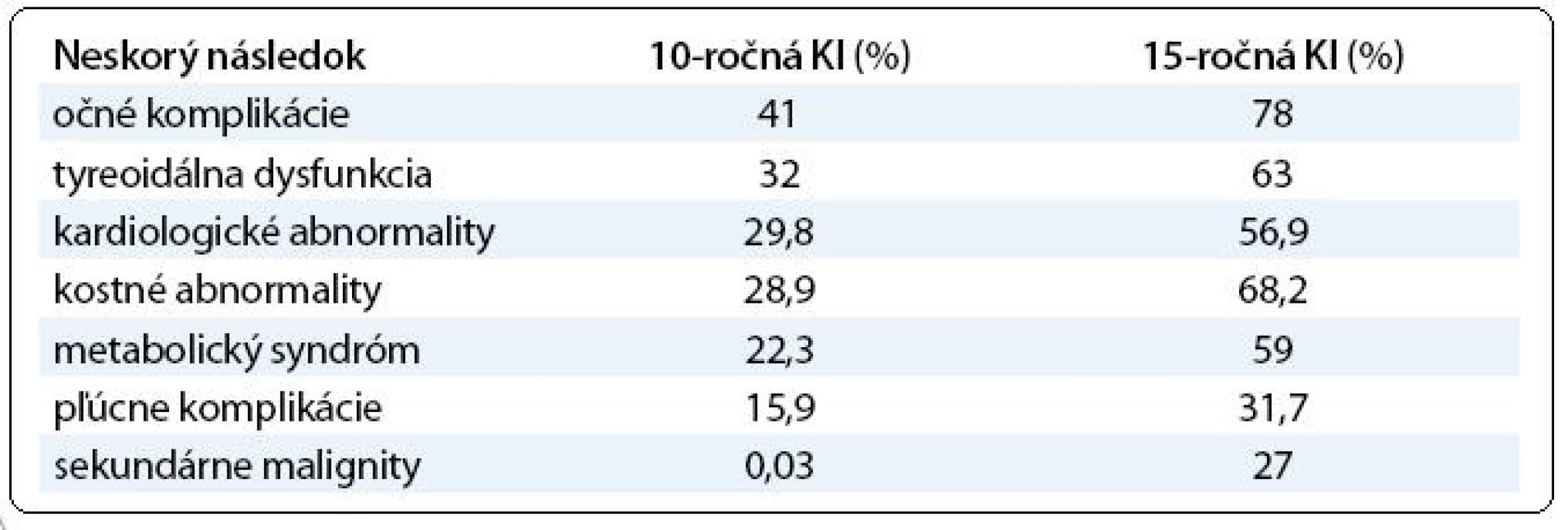
Dysfunkcia štítnej žľazy
Abnormality štítnej žľazy boli zaznamenané u 12 (26,7 %) pacientov. Hypotyreoidizmus bol zistený u 11 pacientov, z toho 7 pacientov malo centrálny a 4 pacienti primárny manifestný hypotyreoidizmus. U jedného pacienta bola zistená autoimunitná tyreopatia. Dvaja pacienti boli liečení substitučnou liečbou. 10-ročná kumulatívna incidencia tyreopatií v našom súbore bola 32 %. Analýza rizikových faktorov (TBI, chronická GvHD, vek, kortikoterapia) nepreukázala signifikantný rizikový faktor a nezistili sme ani štatisticky významný rozdiel medzi poruchou štítnej žľazy v závislosti od pohlavia alebo použitého prípravného režimu.
Metabolický syndróm
Metabolický syndróm (MS) sme zistili u 13 (28,8 %) pacientov. Z jednotlivých parametrov MS sa najčastejšie vyskytovala artériová hypertenzia (u 10 pacientov) a hypertriglycerolémia (10 pacientov), ďalej obezita u 9 pacientov, znížený HDL cholesterol u 6 pacientov a hyperglykémia u 8 pacientov. Poruchu glukózovej tolerancie (PGT) malo 5 pacientov, diabetes mellitus typ I (1 pacient) a typ II (2 pacienti). 10-ročná kumulatívna incidencia rozvoja MS v našom súbore bola 22,3 %. Významným rizikovým faktorom bol vyšší vek – viac ako 40 rokov (P = 0,03). Úloha TBI ako rizikového faktora bola na hranici štatistickej významnosti (P = 0,05) a chronická GvHD, ako aj kortikoterapia neboli významným rizikovým faktorom.
Kardiologické abnormality
Echokardiografické abnormality sme zaznamenali u 15 (33,3 %) pacientov a sú uvedené v tab. 3. Priemerná ejekčná frakcia (EF) bola 60,4 ± 5,5 %, medián NT-proBNP bol 58,28 (44,25–100,7) pg/ml a medián cTnT bol 0,005 (0,003–0,009) μg/l. Hodnoty NT-proBNP boli abnormálne u 6 (13,3 %) pacientov a abnormálne hodnoty cTnT boli zaznamenané u 4 (8,89 %) pacientov. Nezistili sme štatisticky významnú koreláciu medzi echokardiografickým vyšetrením a plazmatickou koncentráciou NT-proBNP (ρ = –0,27; P = 0,06) ani medzi echokardiografickým vyšetrením a plazmatickou koncentráciou cTnT (ρ = 0,11; P = 0,47). 10-ročná kumulatívna incidencia kardiologických abnormalít v našom súbore bola 29,8 %. Podávanie antracyklínov ani TBI v rámci prípravného režimu neboli v rozvoji echokardiografických abnormalít štatisticky významné.
Table 3. Echokardiografické abnormality. 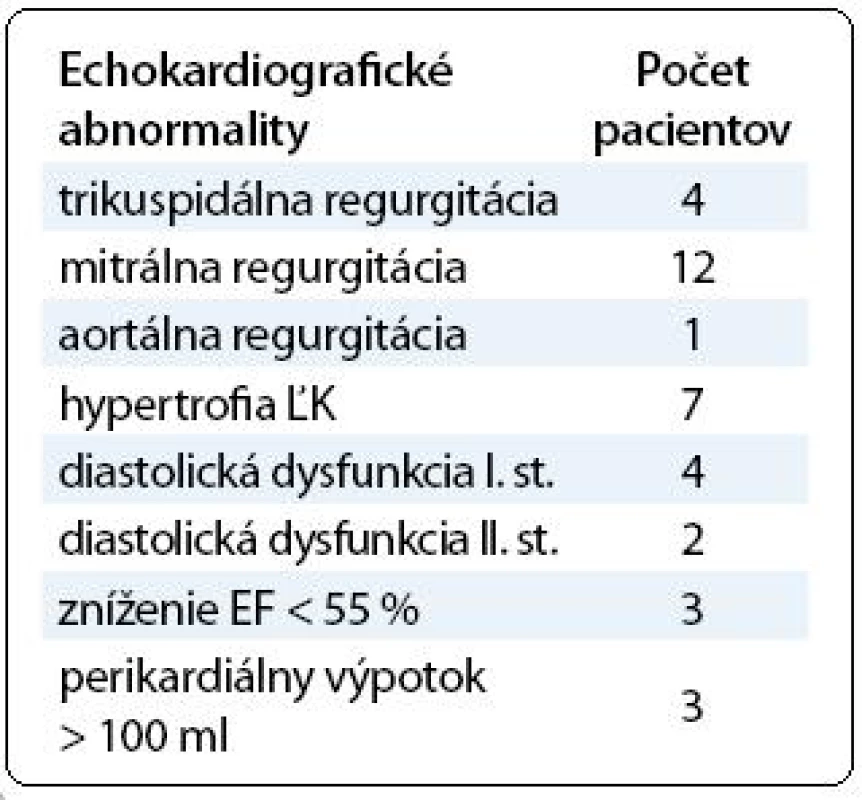
Pľúcne komplikácie
U 6 (13,3 %) pacientov sme zistili pľúcne komplikácie, z toho u 3 sme zistili obštrukčnú ventilačnú poruchu, u 2 pacientov reštrikčnú ventilačnú poruchu a 1 pacient mal obliterujúcu bronchiolitídu. 10-ročná kumulatívna incidencia bola 15,9 %. Signifikantným rizikovým faktorom bola chronická GvHD (P = 0,03) a vyšší vek nad 38 rokov (P = 0,03). TBI ani busulfan v prípravnom režime nebol v našom súbore štatisticky významný rizikový faktor.
Poškodenie kostného systému
Trinásť (28,8 %) pacientov malo skeletálne abnormality. U 2 pacientov sme zistili redukciu kostnej denzity na úrovni osteopénie, u 9 pacientov na úrovni osteoporózy a 3 pacienti mali avaskulárnu nekrózu kostí. 10-ročná kumulatívna incidencia skeletálnych abnormalít bola 28,9 %. Štatisticky významným rizikovým faktorom bola chronická GvHD (P = 0,02) a vyšší vek nad 40 rokov bol na hranici významnosti (P = 0,05). Kortikoterapia ani TBI neboli významným rizikovým faktorom.
Očné komplikácie
U 20 (44,4 %) pacientov sme pozorovali očné komplikácie. Katarakta bola diagnostikovaná u 3 pacientov, zvyšných 17 pacientov malo syndróm suchej keratokonjuktivitídy (syndróm suchého oka, suchá keratokonjuktivitída, korneálne ulcerácie). 10-ročná kumulatívna incidencia bola 41 % (obr. 3). Významným rizikovým faktorom v rozvoji očných komplikácií bola chronická GvHD (P = 0,03), liečba kortikoidmi (P = 0,03) a mladší vek pod 27 rokov (P = 0,007). Použitie TBI alebo busulfanu v rámci prípravného režimu nebolo štatisticky významné.
Image 3. Kumulatívna incidencia očných komplikácií po TKB. 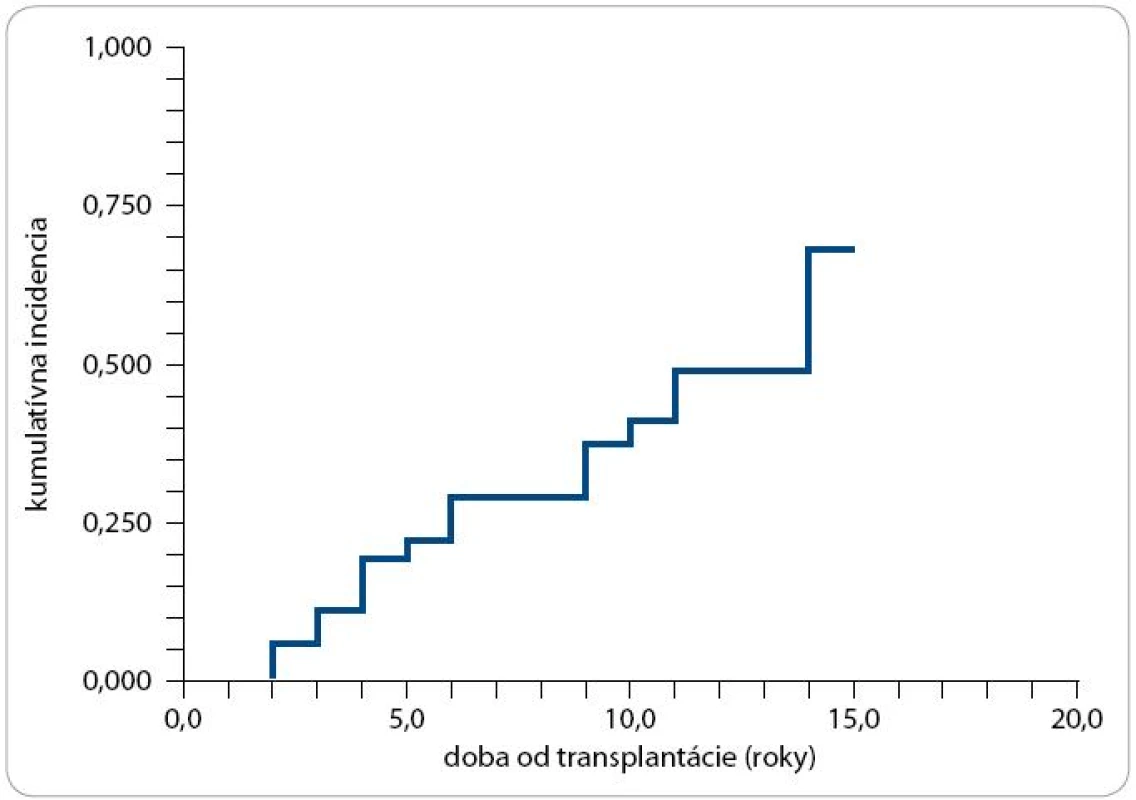
Sekundárne malignity
U 3 (6,67 %) pacientov boli diagnostikované sekundárne malignity, a to nemalobunkový karcinóm pľúc s odstupom 14 rokov od TKB, mukoepidermoidný karcinóm glanduly parotis po 14 rokoch od TKB a bazocelulárny karcinóm nosovej dutiny s odstupom 3 rokov od TKB.
10-ročná kumulatívna incidencia sekundárnych malignít bola len 0,03 %, avšak s prudkým vzostupom po 15 rokoch na 27 %. Všetci 3 pacienti dostávali cyklofosfamid s busulfanom v rámci prípravného režimu pred TKB.
Diskusia
Náš súbor tvorili všetci pacienti, ktorí boli vyšetrení na Transplantačnej ambulancii Kliniky hematológie a transfuziológie LF UK Bratislava od 1. augusta 2010 do 28. februára 2011. V našom súbore sme zistili vysoký výskyt neskorých následkov po TKB – 88,9 % dlhodobo prežívajúcich pacientov malo aspoň jeden chronický následok, viac ako polovica pacientov mala 2 alebo viac následkov a takmer štvrtina prežívajúcich mala 3 alebo viac následkov. Prevalencia aspoň jedného neskorého následku publikovaná u pacientov po alogénnej a autológnej TKB v rámci Bone Marrow Survivor Study (BMTSS) bola 66,4 %, viac ako polovica mala 2 alebo viac následkov a viac ako tretina mala 3 a viac následkov [19]. Vyššia prevalencia aspoň 1 následku v našom súbore by mohla byť vysvetlená tým, že náš súbor pacientov tvorili iba pacienti po alogénnej, a nie autológnej TKB, v rámci ktorej sa nepodáva imunosupresívna terapia a nevzniká chronická GvHD, ktoré by mohli byť ďalšími potenciálnymi rizikovými faktormi vzniku neskorých následkov.
Zvýšený počet neskorých následkov sme zaznamenali s predlžujúcim sa časom od TKB. Pacienti len s 1 neskorým následkom mali kratší medián doby od TKB ako pacienti so 4 komplikáciami. Podobné výsledky publikovali vo svojej práci aj Ferry et al [20].
Dysfunkcia štítnej žľazy patrí medzi najčastejšie endokrinné komplikácie po TKB. Prevalencia tejto komplikácie býva v rozmedzí 7,6–52 % [21,22]. V našom súbore sme zistili nižšiu prevalenciu ako autori Bailey et al, ale vyššiu ako autori Mourad et al. K najčastejším poruchám funkcií štítnej žľazy v našom súbore patril primárny a centrálny hypotyreoidizmus. Výskyt primárneho hypotyreoidizmu bol podobný ako v práci autorov Niedzelska et al (10,8 % vs 8,8 % v našom súbore) [23].
Medzi neskoré očné následky po TKB patria komplikácie predného segmentu oka (syndróm suchej keratokonjuktivitídy a katarakta) a komplikácie zadného segmentu oka (ischemická mikrovaskulárna retinopatia). U našich pacientov sme zistili len komplikácie predného segmentu oka. Oproti práci autorov Fahnehjelm et al [24] sme zaznamenali nižšiu prevalenciu katarakty (58 % vs 6,7 % v našom súbore), čo je možné vysvetliť nízkym počtom pacientom s TBI ako hlavného rizikového faktora rozvoja tohto následku [24]. Naproti tomu vyšší výskyt syndrómu suchej keratokonjunktivitídy (37,8 %) v našom súbore mohol súvisieť s chronickou GvHD.
Pacienti po TKB mávajú aj zvýšené riziko metabolického syndrómu. Autori Annaloro et al (2008) v súbore dlhodobo prežívajúcich pacientov po TKB zistili 31 % prevalenciu metabolického syndrómu [25]. Nedávna štúdia u pacientov po alogénnej TKB odhalila vysoký počet kardiovaskulárnych rizikových faktorov [26]. Medzi najčastejšie komponenty metabolického syndrómu patrí artériová hypertenzia a dyslipidémia. Závery z prác o neskorých kardiovaskulárnych a iných komplikáciách po TKB však naznačujú, že agresívnejší manažment týchto modifikovateľných abnormalít je opodstatnený [26,27].
Chronická GvHD hrá dôležitú úlohu pri vzniku neskorých následkov, hlavne očných, pľúcnych a kostných [28–31]. V našom súbore sme potvrdili signifikantnú úlohu chronickej GvHD v rozvoji očných, pľúcnych aj kostných komplikácií. Ožiarenie na kranium a kraniospinálnu oblasť môže hrať úlohu v rozvoji niektorých ďalších neskorých následkov – hlavne neurokognitívnych a endokrinologických [32]. Význam TBI ako rizikového faktora neskorých následkov nebol v našej práci potvrdený, čo môže byť vysvetlené aj nízkym počtom pacientov s TBI v rámci prípravného režimu (26,7 %). TBI ako rizikový faktor metabolického syndrómu bol na hranici štatistickej významnosti. Vyšší vek v našom súbore hral dôležitú v rozvoji očných, pľúcnych komplikácií a v rozvoji metabolického syndrómu.
Potvrdený zvýšený výskyt neskorých toxických komplikácií u pacientov s odstupom viac ako 2 roky po transplantácii kmeňových krvotvorných buniek môže byť ďalším stimulom pre prospektívne štúdie a pre intervencie potrebné pre ich prevenciu.
Keďže existuje možnosť ovplyvnenia kvality života po TKB – prevenciou, včasnou diagnostikou a terapiou následkov, mala by byť týmto pacientom venovaná celoživotná starostlivosť. Pacienti po TKB majú poznať faktory, ktoré zvyšujú riziko neskorých následkov. Výchova sa má zamerať na správne stravovanie, fyzickú aktivitu a odstránenie rizikových spôsobov životosprávy (najmä alkoholu a nikotínu). Po skončení liečby by mal pacienta najmenej raz do roka vyšetriť lekár, ktorý je oboznámený s jeho kompletnou dokumentáciou [3].
Práca bola čiastočne financovaná z grantu MZ SR 2007/42-UK-18.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Ľubica Roziaková, PhD.
Ústav patologickej fyziológie
LF UK Bratislava
Sasinkova 4
811 08 Bratislava
Slovenská republika
e-mail: lubica.roziakova@gmail.com
Obdrženo: 24. 3. 2011
Přijato: 26. 9. 2011
Sources
1. Gratwohl A, Baldomero H, Aljurf M et al. Hematopoietic stem cell transplantation: a global perspective. JAMA 2010; 303(16): 1617–1624.
2. Savani BN, Griffith ML, Jagasia S et al. How I treat late effects in adults after allogeneic stem cell transplantation. Blood 2011; 117(11): 3002–3009.
3. Mladosievičová B, Kaiserová E, Foltinová A et al. Dlhodobé nežiaduce účinky terapie u pacientov vyliečených z detskej malignity. Klin Onkol 2007; 20(1): 18–22.
4. Rovó A, Daikeler T, Halter J et al. Late altered organ function in very long-term survivors after allogeneic hematopoietic stem cell transplantation: a paired comparison with their HLA-identical sibling donor. Haematologica 2011; 96(1): 150–155.
5. Baker KS, Ness KK, Weisdorf D et al. Late effects in survivors of acute leukemia treated with hematopoietic cell transplantation: a report from the Bone Marrow Transplant Survivor Study. Leukemia 2010; 24(12): 2039–2047.
6. Roziaková Ľ, Mladosievičová B. Endocrine late effects after hematopoietic stem cell transplantation. Oncol Res 2010; 18(11–12): 607–615.
7. Jung MH, Cho KS, Lee JW et al. Endocrine complications after hematopoietic stem cell transplantation during childhood and adolescence. J Korean Med Sci 2009; 24(6): 1071–1077.
8. Tabbara KF, Al-Ghamdi A, Al-Mohareb F et al. Ocular findings after allogeneic hematopoietic stem cell transplantation. Ophthalmology 2009; 116(9): 1624–1629.
9. Gower WA, Collaco JM, Mogayzel PJ Jr. Lung function and late pulmonary complications among survivors of hematopoietic stem cell transplantation during childhood. Paediatr Respir Rev 2010; 11(2): 115–122.
10. Petropoulou AD, Porcher R, Herr AL et al. Prospective assessment of bone turnover and clinical bone diseases after allogeneic hematopoietic stem-cell transplantation. Transplantation 2010; 89(11): 1354–1361.
11. Kodama M, Komura H, Shimizu S et al. Efficacy of hormone therapy for osteoporosis in adolescent girls after hematopoietic stem cell transplantation: a longitudinal study. Fertil Steril 2011; 95(2): 731–735.
12. Saiz A, Graus F. Neurologic complications of hematopoietic cell transplantation. Semin Neurol 2010; 30(3): 287–295.
13. Baker KS, Armenian S, Bhatia S. Long-term consequences of hematopoietic stem cell transplantation: current state of the science. Biol Blood Marrow Transplant 2010; 16(1 Suppl): S90–S96.
14. Tichelli A, Passweg J, Wójcik D et al. Late cardiovascular events after allogeneic hematopoietic stem cell transplantation: a retrospective multicenter study of the Late Effects Working Party of the European Group for Blood and Marrow Transplantation. Haematologica 2008; 93(8): 1203–1210.
15. Rizzo JD, Curtis RE, Socié G et al. Solid cancers after allogeneic hematopoietic cell transplantation. Blood 2009; 113(5): 1175–1183.
16. Majhail NS, Brazauskas R, Rizzo JD et al. Secondary solid cancers after allogeneic hematopoietic cell transplantation using busulfan-cyclophosphamide conditioning. Blood 2011; 117(1): 316–322.
17. Faraci M, Békássy AN, De Fazio V et al. EBMT Paediatric and Late Effects Working Parties. Non-endocrine late complications in children after allogeneic haematopoietic SCT. Bone Marrow Transplant 2008; 41 (Suppl 2): S49–S57.
18. Gratwohl A, Stern M, Brand R et al. Risk score for outcome after allogeneic hematopoietic stem cell transplantation: a retrospective analysis. Cancer 2009; 115(20): 4715–4726.
19. Sun CL, Francisco L, Kawashima T et al. Prevalence and predictors of chronic health conditions after hematopoietic cell transplantation: a report from the Bone Marrow Transplant Survivor Study. Blood 2010; 116(17): 3129–3139.
20. Ferry C, Gemayel G, Rocha V et al. Long-term outcomes after allogeneic stem cell transplantation for children with hematological malignancies. Bone Marrow Transplant 2007; 40(3): 219–224.
21. Bailey HK, Kappy MS, Giller RH et al. Time-course and risk factors of hypothyroidism following allogeneic hematopoietic stem cell transplantation (HSCT) in children conditioned with fractionated total body irradiation. Pediatr Blood Cancer 2008; 51(3): 405–409.
22. Abou-Mourad YR, Lau BC, Barnett MJ et al. Long-term outcome after allo-SCT: close follow-up on a large cohort treated with myeloablative regimens. Bone Marrow Transplant 2010; 45(2): 295–302.
23. Niedzielska E, Wójcik D, Barg E et al. Evaluation of selected endocrine complications in patients treated with auto - and allo-haematopoietic stem cell transplantation. Med Wieku Rozwoj 2008; 12(3): 761–766.
24. Fahnehjelm KT, Törnquist AL, Olsson M et al. Visual outcome and cataract development after allogeneic stem-cell transplantation in children. Acta Ophthalmol Scand 2007; 85(7): 724–733.
25. Annaloro C, Usardi P, Airaghi L et al. Prevalence of metabolic syndrome in long-term survivors of hematopoietic stem cell transplantation. Bone Marrow Transplant 2008; 41(9): 797–804.
26. Majhail NS, Flowers ME, Ness KK et al. High prevalence of metabolic syndrome after allogeneic hematopoietic cell transplantation. Bone Marrow Transplant 2009; 43(1): 49–54.
27. Tichelli A, Bucher C, Rovó A et al. Premature cardiovascular disease after allogeneic hematopoietic stem-cell transplantation. Blood 2007; 110(9): 3463–3471.
28. Carpenter PA. Late effects of chronic graft-versus-host disease. Best Pract Res Clin Haematol 2008; 21(2): 309–331.
29. Fraser CJ, Bhatia S, Ness K et al. Impact of chronic graft-versus-host disease on the health status of hematopoietic cell transplantation survivors: a report from the Bone Marrow Transplant Survivor Study. Blood 2006; 108(8): 2867–2873.
30. Tichelli A, Rovó A, Gratwohl A. Late pulmonary, cardiovascular, and renal complications after hematopoietic stem cell transplantation and recommended screening practices. Hematology Am Soc Hematol Educ Program 2008 : 125–33.
31. Patriarca F, Poletti V, Costabel U et al. Clinical presentation, outcome and risk factors of late-onset non-infectious pulmonary complications after allogeneic stem cell transplantation. Curr Stem Cell Res Ther 2009; 4(2): 161–167.
32. Jabbour E, Thomas D, Cortes J et al. Central nervous system prophylaxis in adults with acute lymphoblastic leukemia: current and emerging therapies. Cancer 2010; 116(10): 2290–2300.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2011 Issue 6-
All articles in this issue
- Plazminogen aktivátor systém a jeho klinický význam u pacientů s nádorovým onemocněním
- Castlemanova choroba
- Naše päťročné výsledky in vitro testovania chemorezistencie u onkologických pacientov
- Neskoré následky u pacientov liečených alogénnou transplantáciou kmeňových krvotvorných buniek
- Použití chemoterapie v kombinaci s cílenou biologickou léčbou u diseminovaného kolorektálního karcinomu: kazuistika dlouhodobé a výrazné klinické odpovědi
- Lékový registr – trabectedin
- Pozitronová emisní tomografie v diagnostice a sledování pacientů s neseminomovými germinálními nádory
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
- Aktuálne charakteristiky deskriptívnej epidemiológie nádorov žalúdka v Slovenskej republike v kontexte medzinárodného porovnania
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- HER2 pozitivní T1N0M0 tumor: Čas pro změnu?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Castlemanova choroba
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- Lékový registr – trabectedin
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

