Zinek – molekulární mechanizmy u karcinomu prostaty
:
J. Gumulec 1; M. Masařík 1; S. Křížková 4; P. Babula 2; R. Hrabec 3; A. Rovný 3; M. Masaříková 4; R. Kizek 4
:
Ústav patologické fyziologie, Lékařská fakulta, Masarykova univerzita, Brno
1; Ústav přírodních léčiv, Farmaceutická fakulta, Veterinární a farmaceutická univerzita, Brno
2; Urologické oddělení, Fakultní nemocnice u sv. Anny, Brno
3; Ústav chemie a biochemie, Agronomická fakulta, Mendelova univerzita, Brno
4
:
Klin Onkol 2011; 24(4): 249-255
:
Reviews
V řadě rozvinutých zemí jsou nádory prostaty nejčastějším nádorovým onemocněním mužů. Vzhledem k vysoké incidenci a mortalitě tohoto onemocnění je žádoucí časná diagnostika, rozpoznání vysoce agresivních forem od klinicky němých a pochopení patogeneze onemocnění s typickými metabolickými odlišnostmi (jsou-li nějaké) se záměrem vyvinout specificky cílenou terapii. Prostatické buňky a karcinom prostaty jsou výjimečné svým vztahem k zinečnatým iontům. Významnou charakteristikou prostatické tkáně je schopnost tyto ionty akumulovat; intracelulární koncentrace dosahuje až desetinásobné koncentrace v porovnání s jinými typy buněk a tkání. Zinečnaté ionty ovlivňují řadu buněčných procesů včetně proliferace, diferenciace a apoptózy. Lze tedy očekávat, že právě zinečnaté ionty se významnou měrou mohou podílet na vzniku onemocnění, na jeho propagaci či na schopnosti metastazovat. Hladina intracelulárního zinku je regulována zinek vázajícími proteiny, zejména metalothioneinem, a zinkovými přenašeči. Poruchy regulace hladiny zinečnatých iontů byly zjištěny v případě karcinomu prostaty; mohou se podílet na patogenezi. Díky zvýšené hladině metalothioneinu v krevním séru způsobené jeho zvýšenou produkcí v prostatické tkáni může být metalothionein využit jako významný nádorový marker.
Klíčová slova:
prostata – nádory – zinek – metalothionein – glutathion – apoptóza
Úvod
V řadě rozvinutých zemí jsou nádory prostaty nejčastějším nádorovým onemocněním mužů. Po karcinomu plic jsou tyto nádory druhou nejčastější s nádorem spojenou příčinou smrti [1]. Výskyt těchto nádorů je významně spjat s vyšším věkem pacientů, objevují se převážně u mužů nad 50 let. Jsou to obvykle bezpříznakové, pomalu rostoucí nádory a jsou často prokázány až při pitvě. Ve více než v 90% se jedná o adenokarcinomy. Zbylých 10% tvoří malobuněčné, dlaždicobuněčné a přechodné karcinomy [1]. Nejčastěji se vyskytující adenokarcinomy metastazují do lymfatického systému a do kostí. Z diagnostických metod se využívá zejména fyzikální vyšetření per rectum, stanovení prostatického specifického antigenu (PSA) v séru, biopsie a dalších markerů [2]. Jsou-li hladiny PSA v rozmezí 2,6–4,0 ng/ml anebo je-li přítomen vzestup hladiny vyšší než 0,5 ng/ml/rok, je indikována biopsie [3]. Na tento nádorový marker existuje ve světě řada protichůdných názorů. Jeho zastánci tvrdí, že pouze včasně diagnostikovaný, v prostatě lokalizovaný karcinom umožňuje vyléčení, odpůrci namítají, že významné množství pacientů s PSA pozitivním výsledkem je buď zcela zdravých (a sérovou hladinu PSA má zvýšenou z jiného důvodu), nebo karcinom, který zůstává klinicky němý, nečiní pacientům ani po delší době potíže a je často diagnostikován až při sekci zemřelých na jinou příčinu. Falešně pozitivní výsledky indikují pacienty na další nákladná vyšetření, a zatěžují je tak nemalým stresem [3]. To se týká zejména tzv. šedé zóny, tj. hladiny PSA v rozmezí 4–10 ng/ml. V tomto rozpětí je identifikováno nejvíce, až 75 % falešně negativních karcinomů [4]. Tento fakt vedl k zavedení zpřesňujícího ukazatele, a to stanovení poměru volného PSA (fPSA) k celkovému – tzv. fPSA/PSA ratio. Je-li tento poměr menší než 0,2, je indikována biopsie. Ačkoli stanovení poměru fPSA/PSA přineslo do diagnostiky karcinomu prostaty určitá zpřesnění, stále se vyskytuje významný podíl falešně pozitivních, falešně negativních či klinicky latentních nádorů.
Vzhledem k vysoké incidenci a mortalitě tohoto onemocnění je žádoucí diagnostikovat ho co nejdříve, rozpoznat vysoce agresivní formy od klinicky němých a pochopit patogenezi onemocnění s typickými metabolickými odlišnostmi (jsou-li nějaké) se záměrem vyvinout specificky cílenou terapii. Prostatické buňky a karcinom prostaty jsou výjimečné svým vztahem k zinečnatým iontům. Významnou charakteristikou prostatické tkáně je schopnost tyto ionty akumulovat; intracelulární koncentrace dosahuje až desetinásobné koncentrace oproti řadě jiných běžných buněk [5]. Tyto ionty ovlivňují řadu buněčných procesů včetně proliferace, diferenciace a apoptózy. U karcinomu prostaty dochází k alteraci mechanizmů udržujících vysokou intracelulární hladinu zinku a z toho vyplývající ztrátě schopnosti zinečnaté ionty akumulovat. Vzhledem k tomu, že zinečnaté ionty zasahují do zmíněných významných procesů, je očekávatelné, že právě zinečnaté ionty se významnou měrou mohou podílet na vzniku onemocnění, na jeho propagaci či na schopnosti metastazovat.
Zinek – výskyt a jeho fyziologická funkce
Zinek je významným esenciálním prvkem nutným pro růst a vývoj všech živých organizmů. Až 10 % lidského genomu kóduje proteiny schopné vázat tento prvek [6]. Zinečnaté ionty jsou součástí řady enzymů, figurují v řadě signálních drah a jsou nezbytné pro udržování struktury cytoskeletu [7,8]. Zinek-dependentní enzymy jsou zastoupeny ve všech třídách enzymů, tedy u oxidoreduktáz, transferáz, hydroláz, lyáz, izomeráz a ligáz [9,10]. Zinek se na tyto enzymy váže na tzv. „zinc-finger“ domény, zinkové prsty, sekvence bohaté na histidin a cystein obsahující repetice His2Cys2. Každá tato repetice váže jeden zinečnatý ion, zinkové prsty tak slouží k udržování terciární a kvartérní struktury těchto bílkovin [11]. Mimo tuto strukturální funkci zasahuje zinek také jako signální sloučenina do řady kaskád [8]: Bylo zjištěno, že volná intracelulární frakce zinku má proměnlivou hladinu, která může být zvýšena např. vlivem volných radikálů či oxidu dusnatého [12,13]. Tyto látky způsobí uvolnění zinku z jeho buněčných zásobáren nebo ze zinek vázajících sloučenin [13]. Takovýmito zásobárnami může být endoplazmatické retikulum, Golgiho aparát nebo zinkozomy, jednomembránové vezikulární útvary vzniklé dilatací a odštěpením od endoplazmatického retikula nebo Golgiho aparátu [13]. Volné zinečnaté ionty mohou poté vstupovat do řady signálních a regulačních kaskád – mohou např. inhibovat funkci protein tyrozin fosfatáz (PTP), a tak následně aktivovat řadu kináz, které jsou zodpovědné za regulaci buněčného cyklu či za buněčnou diferenciaci [14]. Takovými kinázami jsou zejména mitogen-aktivované proteinové kinázy (MAPK) účastnící se regulace mitózy, genové exprese, buněčné diferenciace, přežívání buněk či apoptózy [13] (obr. 1).
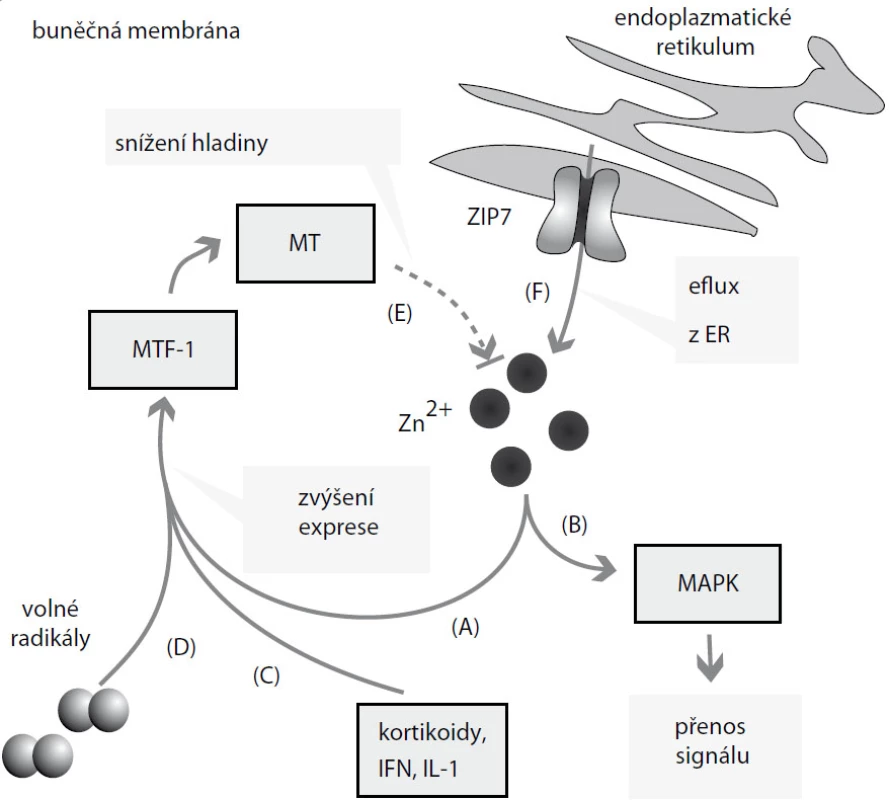
Je tedy možné říci, že zinečnaté ionty zasahují významnou měrou do široké řady buněčných procesů, mnohdy klíčových pro přežívání buněk. Není proto překvapující, že odchylky v metabolizmu tohoto iontu, ať již způsobené jeho nedostatečným příjmem, či poruchou molekulárních mechanizmů zajišťujících hospodaření se zinkem, způsobují řadu onemocnění. Časným projevem nedostatku zinečnatých iontů je ztráta chuti k jídlu [7]. Při dlouhodobějším nedostatku zinku dochází k dalším patofyziologickým projevům, jejichž míra projevu je závislá na míře nedostatku zinečnatých iontů [7]. Mezi nejvíce zastoupené příznaky patří zpomalení růstu dětí, narušení funkcí imunitního systému, objevují se dermatitidy, prodlužuje se doba hojení ran, dochází k nefyziologickému vývoji plodu, zpomaluje se sexuální vývoj a objevují se neurologické příznaky jako třes [7,15].
Protože volné zinečnaté ionty nemohou volně procházet buněčnými membránami, musí existovat transportní mechanizmy pro transport zinku. Za ten zodpovídají transmembránové proteiny, lokalizované na buněčné membráně a na membráně organel, tzv. zinkové přenašeče. Ty jsou zodpovědné za jejich transport do cytoplazmy (jedná se tedy o import zinku z extracelulárního prostředí, resp. z organel do cytoplazmy) a z cytoplazmy (tedy export z cytoplazmy do extracelulárního prostředí a do organel). Import zabezpečuje rodina přenašečů „Zrt-Irt-like protein“, ZIP, export zajišťují přenašeče „Zinc transporters“, ZnT. Jakmile se volné zinečnaté ionty dostanou prostřednictvím zinkových přenašečů do cytoplazmy, jsou ihned navázány na zinek vázající proteiny, zejména na metalothioneiny, v menší míře na další nízkomolekulární látky – aminokyseliny (cystein, histidin, prolin) a organické kyseliny (citrát, oxalát) [16]. Zde funguje jako labilní rezervní forma zinku pro cytoplazmu [17,18]. Část zinku je transportována do organel, zejména do endoplazmatického retikula a Golgiho aparátu, které slouží jako labilní reaktivní pool těchto iontů [19]. Klíčovým regulátorem hladiny zinku je kov regulační transkripční faktor 1 (metal regulatory transcription factor 1, MTF-1). MTF-1 ovlivňuje transkripci řady genů účastnících se regulace hladiny zinku. Má vliv zejména na expresi metalothioneinů a zinkových transportérů zodpovědných za eflux zinku z buněk [15] (obr. 1). Tento autoregulační mechanizmus slouží k udržování stálých koncentrací hladiny zinku v buňkách. Mimoto má MTF-1 účinky nesouvisející s metabolizmem zinku – účastní se molekulárních mechanizmů souvisejících s regulací oxidativního stresu a odstraňuje toxicitu i jiných těžkých kovů [15].
Vliv zinku na zdravou prostatickou tkáň
Sekretorické buňky laterálních laloků prostatické tkáně jsou ve vztahu k zinku jedinečné. Dochází v nich k akumulaci těchto iontů až v desetinásobně větším množství oproti jiným buňkám [20]. Jak již bylo řečeno, zinek se chová jako signální látka. V prostatické tkáni, kde je jeho koncentrace zvýšena, se jeho signální chování uplatňuje o to více, a dochází tak k ovlivnění řady metabolických drah zcela jedinečných pro prostatické buňky. Je ovlivněn metabolizmus organických kyselin, energetické hospodaření buněk a odolnost buněk vůči apoptóze (obr. 2).
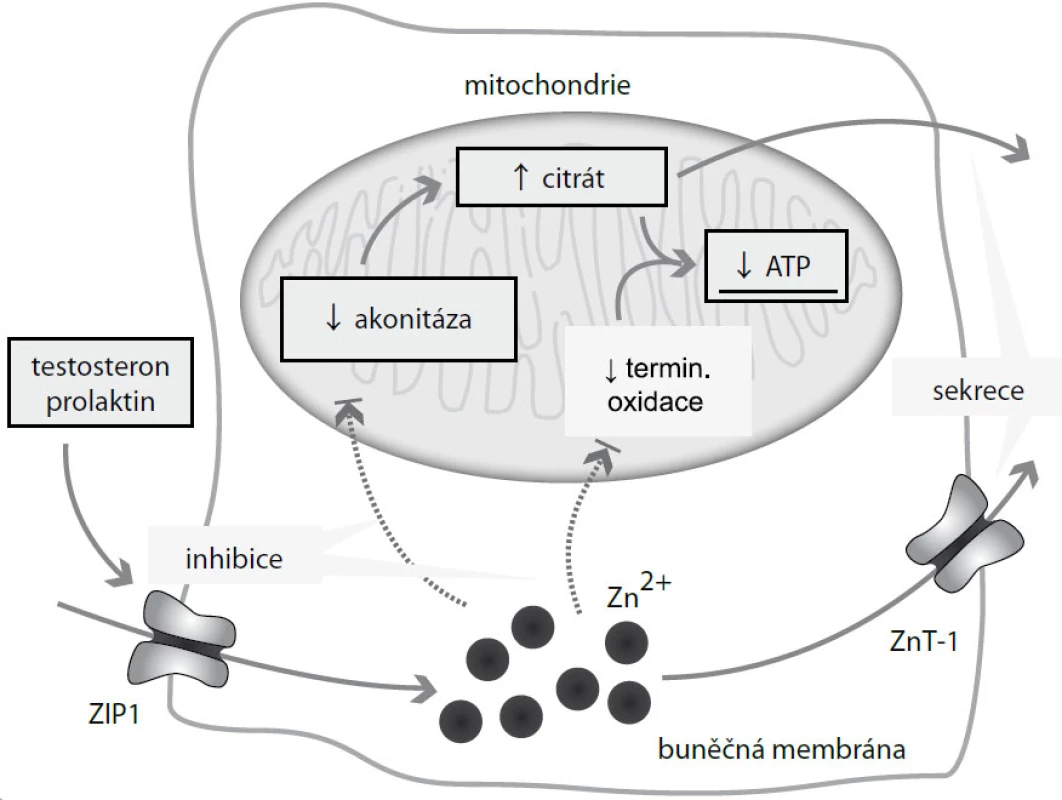
U většiny „běžných“ buněk dochází k utilizaci citrátu v Krebsově cyklu v mitochondriích za vzniku významného množství energie [21]. Oproti tomu v buňkách prostaty dochází k akumulaci citrátu a jeho následnému transportu do seminální tekutiny; citrát je nezbytný pro optimální energetický metabolizmus spermií [22]. Aby mohl být citrát akumulován prostatickými buňkami, musí být zabráněno jeho vstupu do Krebsova cyklu. Musí být zablokována akonitáza, mitochondriální enzym katalyzující oxidaci citrátu na izocitrát [18]. Omezení aktivity tohoto enzymu je dáno působením zinku, resp. jeho vysoké hladiny, na tento enzym [23]. Naopak prolaktin a testosteron způsobují zvýšení jeho exprese [24]. Touto drahou přichází prostata o podstatnou část energie – oproti kompletní oxidaci glukózy o 65 % ATP [18]. Prostatické buňky jsou tedy energeticky „nevýhodné“.
Zinek zasahuje do regulace energetického metabolizmu i na další úrovni – má inhibiční vliv na terminální oxidaci. Prostatické buňky tím udržuje na nízké hladině respirace [25]. Spolu s inhibičním efektem zinku na akonitázu přicházejí prostatické buňky o další množství energie. Zinek významnou měrou zasahuje do regulace apoptózy v prostatických buňkách. Jeho vysoká hladina má inhibiční vliv na proliferaci a s tím spojenou indukci apoptózy (obr. 3) [26]. Zinek zvyšuje expresi X proteinu asociovaného s Bcl2 (BAX) a indukuje formaci BAX pórů na vnější mitochondriální membráně [18,27]. Vzniklé BAX póry umožní eflux cytochromu C z mitochondrií do cytoplazmy. Cytochrom C aktivuje kaskádu kaspáz, která vede k apoptóze. Tato kaskáda je zřejmě typická pouze pro buňky prostaty. V jiných buňkách nedochází k zinkem indukované apoptóze cestou BAX – cytochrom C [18]. Nicméně podobná kaskáda byla popsána také u mitochondrií neuronálních buněk [28].
![Zinečnatými ionty indukovaná apoptóza u buněk prostaty. Zinečnaté ionty zvyšují expresi X proteinu asociovaného s Bcl2 (BAX) a usnadňují tvorbu BAX pórů na vnější mitochondriální membráně. Vzniklé BAX póry umožní eflux cytochromu C do cytoplazmy. Cytochrom C aktivuje kaskádu kaspáz, která vede k apoptóze. Podle [27].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1f7e5ea8ead9fab604944fb859371298.jpeg)
Role zinku u karcinomu prostaty
Bylo zjištěno, že u pacientů s karcinomem prostaty jsou v buňkách laterálního laloku tohoto orgánu hladiny zinku signifikantně nižší oproti normálním hodnotám [8]. Maligně změněné prostatické buňky jsou totiž charakteristické nevratnou ztrátou schopnosti akumulovat zinek [24]. Je známo, že laterální laloky jsou také hlavním místem iniciace maligního procesu. Jak již bylo zmíněno, zinek má významné regulační funkce v buňkách, jež se týkají proliferace, diferenciace a apoptózy. Pravděpodobně nerovnováha těchto procesů stojí často za procesy kancerogeneze. Dá se proto předpokládat, že se právě zinek může podílet na patogenezi karcinomu prostaty, možná i významnou měrou. Metabolizmus zinku je alterován také u benigně hyperplastické prostatické tkáně; je popsána zvýšená schopnost akumulace zinku. Benigní hyperplazie je ovšem proces lokalizovaný do centrálních částí tohoto orgánu [8].
Je-li schopnost akumulace zinku podmíněna funkcí zinkových transportérů, musí být u buněk karcinomu prostaty buď snížený vstup zinku do buněk (tedy defekt ZIP přenašečů), nebo zvýšené vylučování zinku z buněk (tedy zvýšená aktivita ZnT přenašečů). Co se týče změn v transportu zinku do buněk, je popsáno zejména snížení exprese transportéru ZIP1, v menší míře také transportérů ZIP2 a ZIP3 a zvýšení exprese transportéru ZIP7 [13]. Defekt transportéru ZIP1 je v popředí, jedná se o hlavní importér zinku do buněk (prostatických i ostatních). Vedle toho přenašeče ZIP2 a ZIP3 zodpovídají za redistribuci zinku mezi prostatickými buňkami, na akumulaci se podílejí významně menší měrou [29]. Důležitost transportéru ZIP1 je podpořena také zjištěním, že jeho zvýšená exprese snižuje schopnost karcinomu metastazovat [30]. ZIP1 tedy může být považován za tumor supresorový gen. Je známo, že snížená exprese ZIP1 není zapříčiněna delecí genu nebo fatálními mutacemi, ale down-regulací. Za tu je, dle nedávných zjištění, zodpovědný transkripční faktor „ras responsive element binding protein-1“ (RREB-1) [31]. RREB-1 je transkripční faktor obsahující „zinkové prsty“ s aktivačním i inhibičním potenciálem, určeným dle promotoru, na nějž se váže [32]. RREB-1 je transkripčním faktorem následně aktivovaným kaskádou RAS-RAF-MEK-ERK [33]. Pozoruhodné je, že právě tato kaskáda je up-regulována u karcinomu prostaty [34]. Nicméně RREB-1 není zřejmě jediným transkripčním faktorem, který je zodpovědný za snížení exprese ZIP1; v promotoru tohoto zinkového transportéru se nacházejí i další oblasti schopné zapříčinit sníženou expresi ZIP1 [31].
Vedle snížené exprese těchto transportérů, nacházejících se na buněčné membráně, je popsáno zvýšení exprese přenašeče ZIP7. Tento přenašeč je umístněn na membráně endoplazmatického retikula [13,35]. Tato organela může plnit funkci zásobárny intracelulárního zinku [13]. Přenašeč ZIP7 pak může zodpovídat za přesun zinku z této zásobárny do cytoplazmy – tedy za zvyšování intracelulární koncentrace volného zinku. Protože má zinek funkci signální molekuly, může zvýšení jeho hladiny zapříčinit aktivaci tyrozin kináz a následně mitogen aktivovaných proteinových kináz a z toho vyplývající zvýšení genové exprese. ZIP7 tedy může hrát významnou, možná klíčovou roli v spouštění těchto biologicky významných kaskád, a může se tak podílet na patogenezi řady patologických stavů včetně karcinomů [13]. Zvýšení exprese tohoto přenašeče bylo mimo karcinom prostaty prokázáno u high-risk karcinomu prsu. Touto cestou mohou být spouštěny proliferační či antiapoptické kaskády, zodpovědné za špatnou prognózu tohoto karcinomu [13].
Za snížením schopnosti akumulace zinku může stát i jeho zvýšené vylučování z buněk. Za transport zinku z cytoplazmy je zodpovědná rodina přenašečů ZnT. Transportér ZnT-1 je jediným zástupcem této rodiny umístěným na plazmatické membráně buněk, ostatní přenašeče jsou na membránách organel [36]. Změna exprese ZnT-1 ale nebyla u maligních buněk prostaty zjištěna. Změněná exprese byla popsána u přenašeče ZnT-4, ten se ale vyskytuje na membráně vezikul, nemůže být proto zodpovědný za pokles intracelulární hladiny zinku. Z uvedeného vyplývá, že snížená hladina zinku v buňkách karcinomu prostaty je s největší pravděpodobností způsobena zejména defektem přenašeče ZIP1. Je však vhodné hovořit spíše o nerovnováze v transportu zinku než o snížené schopnosti vstupu zinku do buněk. Role přenašečů ZIP7 či ZnT-4, jejichž hladina je oproti zdravé tkáni změněna, není zcela vyjasněna a je nutné další bádání, které povede ke komplexnějšímu pohledu na tuto problematiku. Nabízí se spekulace, že obnovení exprese přenašeče ZIP1 do fyziologických hladin, potažmo obnovení fyziologických hladin v prostatických buňkách, by mohlo být v budoucnu využito jako možná terapeutická cesta. Takový stav je možné způsobit buď zrušením, nebo změnou podmínek, které způsobily snížení exprese tohoto přenašeče, nebo, dále v budoucnu, cílenou genetickou manipulací způsobující zvýšení exprese zmíněného přenašeče.
Snížení intracelulární koncentrace zinečnatých iontů v buňkách karcinomu prostaty má za následek změnu energetického metabolizmu těchto buněk. Zatímco buňky zdravé citrát akumulující prostatické tkáně jsou vlivem vyšších koncentrací zinku (a jeho inhibičního efektu na mitochondriální akonitázu) energeticky „znevýhodněny“, buňky karcinomu fungují energeticky efektivněji. Citrát tak není akumulován, může vstoupit do Krebsova cyklu, a podílet se tak na generování energie [37]. Nabízí se spekulace, že obnovení inhibičního vlivu na mitochondriální akonitázu jiným inhibitorem může mít tumor supresorové účinky [20]. Takovým inhibitorem může být např. fluoroacetát (který se metabolizuje na fluorocitrát). Tato látka ale není pro prostatické buňky specifická a působí toxicky na většinu savčích buněk [20]. Nalezení specifického a zároveň netoxického inhibitoru akonitázy může být využito jako nového, velmi cíleného terapeutického postupu. Kromě změny hladiny zinečnatých iontů je v buňkách karcinomové prostatické tkáně popsána – oproti zdravé prostatické tkáni – také změna hladiny jiných prvků. Banas et al popisují významné zvýšení hladiny manganu a mědi, zejména v buňkách karcinomu o Gleason grade 2, a významné zvýšení hladiny železa, jehož hladina stoupá v závislosti na Gleason grade (trojnásobná u Gleason score 2 a 3 a až šestinásobná u Gleason grade 4) [38]. Ionty železa se pravděpodobně taktéž podílejí na patogenezi karcinomu prostaty [39]. Sapota et al zmiňují snížení hladiny hořčíku a vápníku a zvýšení hladiny selenu a mědi v buňkách karcinomu [40]. Zvýšená hladina selenu je popsána také v dalších studiích a je dávána do souvislosti s jeho protektivní, zejména antioxidativní funkcí [41]. Dysregulace tkáňové hladiny iontů se projevuje změnou sérových hladin daných prvků anebo je jejich důsledkem. V séru pacientů s karcinomem prostaty je oproti kontrolní skupině popsáno statisticky významné snížení koncentrací zinku, mědi a železa [42]. Předpokládá se, že zinečnaté ionty jsou v séru navázány na albumin a alfa-2-makroglobulin. V práci Kanoha et al je popsáno zvýšení hladiny transportního proteinu alfa-2-makroglobulinu u pacientů s kostními metastázami karcinomu, což staví tento sérový protein do pozice možného markeru metastazujícího karcinomu prostaty [43]. Celková deregulace hladin zmíněných prvků se může odrazit na změně jejich hladiny ve vlasech. Dle Guoa et al se ve vlasech pacientů s karcinomem prostaty vyskytuje rozdílné množství hořčíku, fosforu, draslíku, vápníku, chromu, manganu, zinku a selenu a signifikantně zvýšené množství železa a mědi [44]. Nejen zinečnaté ionty, ale i další přechodné kovy a jiné prvky zasahují do rozvoje onemocnění či jsou zvýšeny v důsledku jejich antitumorózního působení, popř. je změna jejich hladiny důsledkem komplexního narušení rovnováhy u karcinomem změněného organizmu. Komplexní pochopení a objasnění této problematiky je zcela žádoucí, má přínos diagnostický a pravděpodobně taktéž terapeutický.
Vztah zinek – metalothionein
Metalothioneiny jsou skupinou intracelulárních proteinů s neobvykle velkým obsahem cysteinových aminokyselin. Ty jim (díky thiolovým vazbám mezi cysteiny) propůjčují schopnost vázat řadu kovů [45]. Metalothioneiny proto hrají klíčovou roli v transportu těžkých kovů (tedy také zinku), jejich detoxikaci a v ochraně buněk před oxidativním stresem [46] (obr. 4). Těžké kovy se navážou na metalothionein, a jsou tak transportovány do ledvin, kde jsou vylučovány. Antioxidační působení tohoto proteinu je podmíněno přítomností cysteinových aminokyselin v jeho řetězci, které obsahují volnou thiolovou skupinu – SH. Metalothionein se tak může „párovat“ s glutathionem (GSH), a snižovat tak hladinu volných radikálů i těžkých kovů [47]. Metalothionein se tak ve zvýšené míře objevuje v situacích s vyšším rizikem tvorby těchto volných radikálů: buněčná proliferace, embryonální vývoj [47]. Funkce tohoto proteinu zasahují také do regulace apoptózy – zvýšené hladiny metalothioneinu mají antiapoptické působení (obr. 4). Metalothionein reguluje hladinu, aktivitu a buněčnou lokalizaci transkripčního faktoru NF-κB. NF-κB zajišťuje ochranu buněk před apoptózou aktivací antiapoptických genů a protoonkogenů Bcl-2, c-myc a TRAF-1 [47].
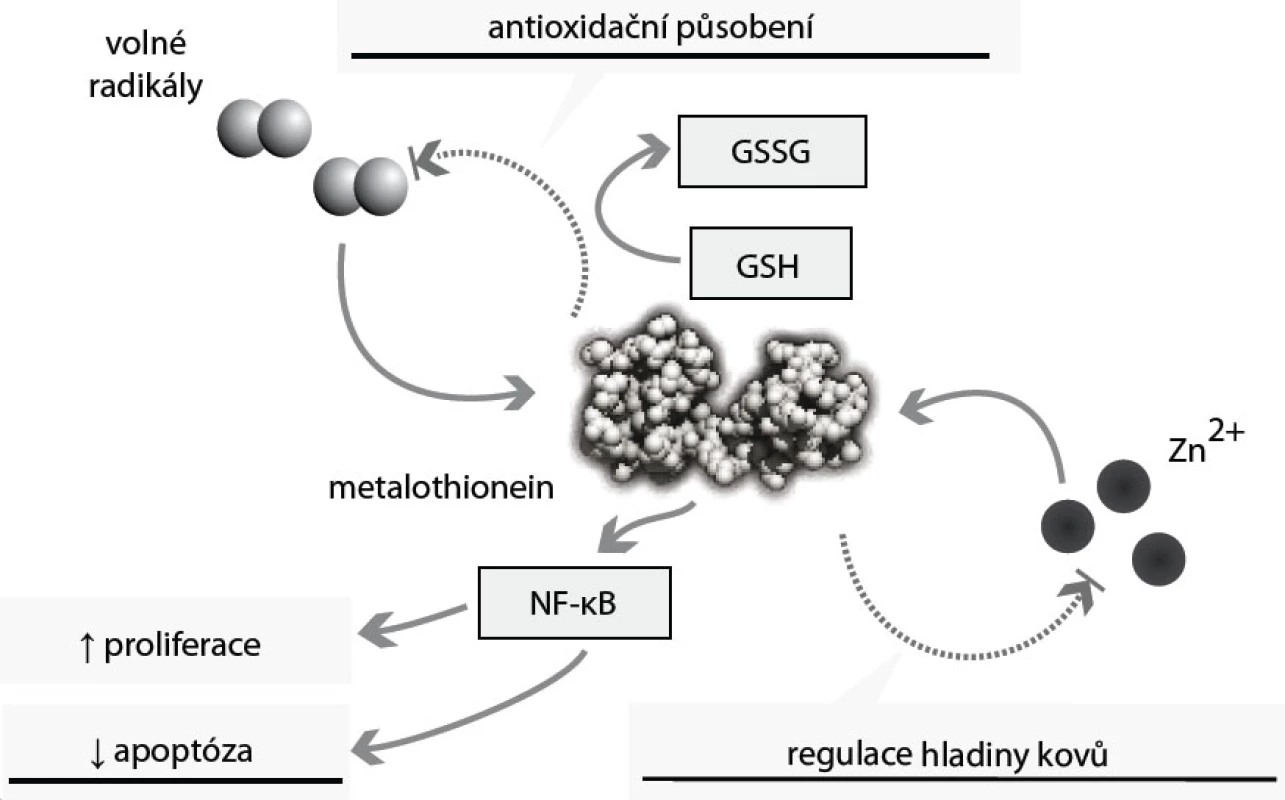
Řada studií z posledních let poukazuje na zvýšené sérové hladiny metalothioneinu u malignit prsu, plic, urogenitálního a trávicího systému, u melanomu a u některých lymfomů [46]. U karcinomu prostaty jsou sérové hladiny tohoto proteinu třikrát vyšší oproti hladinám ve zdravé populaci [47]. Dle našich výsledků je dosahováno statisticky významného (p < 0,01) zvýšení sérové hladiny metalothioneinu; u pacientů s biopticky ověřeným adenokarcinomem o různém stupni diferenciace (T1c–4) je dosahováno průměrných hodnot 2,1 µM oproti souboru kontrol, u nichž dosahuje průměrná sérová hladina 0,6 µM [48–54]. Hladina sérového metalothioneinu není dle našich výsledků ovlivněna (korelační koeficient r < 0,2 a p > 0,05) přítomností komorbidit hypertenzní nemoci, hyperlipoproteinemie ani ischemické choroby srdeční.
I když není příčina ani mechanizmus zvýšení sérové hladiny metalothioneinu stále zcela jasná, usuzuje se, že právě zvýšená hladina tohoto proteinu je zodpovědná za ochranu nádorových buněk před apoptózou, za zvýšenou proliferaci a schopnost metastazovat [46]. Vztah metalothionein – zinek je dán schopností MT vázat zinečnaté ionty, ale také je transportovat, a to zejména do jádra, kde mohou být uvolněny a kde mohou zasáhnout do regulace buněčných procesů včetně buněčné proliferace a diferenciace právě přes zinkové prsty celé řady regulačních proteinů.
Závěr
Snížená hladina intracelulárního zinku v prostatických buňkách je významnou charakteristikou karcinomu prostaty. Velkou měrou se na tomto stavu podílí poškození přenašeče ZIP1, který může být považován za tumor supresorový gen. Za snížení exprese tohoto přenašeče je pravděpodobně zodpovědný transkripční faktor RREB-1, nicméně očekává se, že na snížení exprese transportéru ZIP1 se mohou podílet i další signální látky [31]. Stav je s největší pravděpodobností reverzibilní [20]. Objasnění všech příčin „epigenetického silencingu“ tohoto genu může ukázat nové léčebné cesty karcinomu prostaty. Ať je mechanizmus vedoucí ke snížení intracelulární hladiny zmiňovaného kovu jakýkoli, vede tento stav k řadě metabolických změn. Mnohé z těchto změn se podílejí na zhoršování prognózy karcinomu. Dá se proto očekávat, že obnovení vysokých hladin zinku v buňkách karcinomu vede k obnovení zinkem způsobených metabolických odlišností typických pro prostatu. Toho může být využito k zástavě progrese/přerušení průběhu karcinomu.
Transport zinku je alterován také na úrovni jeho „pufračního“ systému – metalothioneinů. Vzhledem k tomu, že zinek indukuje expresi metalothioneinu, se dá očekávat, že hladiny metalothioneinu budou sníženy souhlasně se snížením hladiny intracelulárního zinku v buňkách karcinomu. Nicméně významnou charakteristikou malignit prsu, plic, urogenitálního a trávicího systému, u melanomu a u některých lymfomů je zvýšení sérových hladin metalothioneinu. Není zcela jasné, proč tomu tak je a jakým mechanizmem se tento stav spouští. V buňkách karcinomu prostaty zřejmě dochází ke komplexní dysbalanci metabolizmu zinku a s ní související dysbalanci metalothioneinů. Podobně jako u hladiny zinku platí, že kdyby se normalizovaly hladiny metalothioneinů, lze očekávat, vzhledem k jejich regulaci apoptózy, protinádorový efekt. Toho by mohlo být využito v terapii. Je však žádoucí další bádání, které osvětlí mechanizmus tohoto děje a souvislost se změnou intracelulární hladiny zinku v buňkách karcinomu prostaty, popř. u jiných nádorů. Zvýšení sérové hladiny metalothioneinů může být využito také diagnosticky, bude-li potvrzen v řadě současně probíhajících studií fakt, že elevace jeho hladin je pro toto onemocnění dostatečně senzitivní a specifická [55]. Je proto nutné identifikovat všechny stavy vedoucí k elevaci sérové hladiny metalothioneinů a popsat její dynamiku.
Seznam zkratek:
MT – metalothionein
PSA – prostatický specifický antigen
MTF-1 – metal regulatory transcription factor 1
PTP – protein tyrozin fosfatáza
MAPK – mitogen aktivované proteinové kinázy
ZIP – Zrt-Irt like protein
ZnT – Zinc transporter
RREB-1 – ras responsive element binding protein-1
ER – endoplazmatické retikulum
BAX – BCL2-associated X protein
GSH – glutathion
NF-κB – nuclear factor „kappa-light-chain-enhancer“ of activated B-cells
Bcl-2 – B-cell lymphoma 2
TRAF-1 – TNF receptor associated factor 1
Ac-Coa – acetyl koenzym A
IL – interleukin
IFN – interferon
Článek byl podpořen granty GAČR 301/09/P436 Analýza metalothioneinu u karcinomu prostaty na úrovni DNA, RNA a proteinu, IGA MZ ČR č. 10200-3 Nádorové markery, jejich stanovení a korelace s karcinomem prostaty a projektem 9/2010/FaF Farmaceutický význam zinku a metalothioneinu v buněčné signalizaci.
The paper was supported by the following grants: Czech Science Foundation (GAČR) 301/09/P436 “An analysis of metallothionein in prostate cancer at a level oaf DNA, RNA and protein”, the Ministry of Health of the Czech Republic’s Internal Grant Agency grant No. 10200-3 “Tumour markers, their determination and correlation with prostate cancer” and project No. 9/2010/FaF “Pharmaceutical significance of zink and metallothionein in cell signalling”.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. Ing. René Kizek, Ph.D.
Ústav chemie a biochemie
Agronomická fakulta
Mendelova univerzita v Brně
Zemědělská 1
613 00 Brno
e-mail: kizek@sci.muni.cz
Obdrženo/Submitted: 24. 10. 2010
Přijato/Accepted: 15. 12. 2010
Sources
1. Wit RD, Sternberg CN. Cancers of the Genitourinary Tract. In: Cavalli F, Hansen HH, Kaye SB (eds). Textbook of medical oncology, Informa Healthcare. London: Dunitz 2009.
2. Kuroda N, Katto K, Tamura M et al. Immunohistochemical application of D2-40 as basal cell marker in evaluating atypical small acinar proliferation of initial routine prostatic needle biopsy materials. Med Mol Morphol 2010; 43(3): 165–169.
3. Študent V, Grepl M, Král M et al. Má vyšetření PSA stále význam při vyhledávání karcinomu prostaty? Urol pro Praxi 2006; 5(5): 214–218.
4. Jamaspishvili T, Kral M, Khomeriki I et al. Urine markers in monitoring for prostate cancer. Prostate Cancer Prostatic Dis 2010; 13(1): 12–19.
5. Habib FK. Evaluation of androgen metabolism studies in human prostate cancer – correlation with zinc levels. Prev Med 1980; 9(5): 650–656.
6. Andreini C, Banci L, Bertini I et al. Counting the zinc--proteins encoded in the human genome. J Proteome Res 2006; 5(1): 196–201.
7. Oteiza P, Mackenzie G. Zinc, oxidant-triggered cell signaling, and human health. Mol Aspects Med 2005; 26(4–5): 245–255.
8. Kambe T, Yamaguchi-Iwai Y, Sasaki R et al. Overview of mammalian zinc transporters. Cell Mol Life Sci 2004; 61(1): 49–68.
9. Colvin RA, Holmes WR, Fontaine CP et al. Cytosolic zinc buffering and muffling: their role in intracellular zinc homeostasis. Metallomics 2010; 2(5): 306–317.
10. Vallee B, Auld D. Short and long spacer sequences and other structural features of zinc binding sites in zinc enzymes. FEBS Lett 1989; 257(1): 138–140.
11. Maret W, Li Y. Coordination dynamics of zinc in proteins. Chem Rev 2009; 109(10): 4682–4707.
12. Hirano T, Murakami M, Fukada T et al. Roles of zinc and zinc signaling in immunity: zinc as an intracellular signaling molecule. Adv Immunol 2008; 97: 149–176.
13. Hogstrand C, Kille P, Nicholson RI et al. Zinc transporters and cancer: a potential role for ZIP7 as a hub for tyrosine kinase activation. Trends Mol Med 2009; 15(3): 101–111.
14. Yamasaki S, Sakata-Sogawa K, Hasegawa A et al. Zinc is a novel intracellular second messenger. J Cell Biol 2007; 177(4): 637–645.
15. Laity JH, Andrews GK. Understanding the mechanisms of zinc-sensing by metal-response element binding transcription factor-1 (MTF-1). Arch Biochem Biophys 2007; 463(2): 201–210.
16. Costello L, Liu Y, Zou J et al. Evidence for a zinc uptake transporter in human prostate cancer cells which is regulated by prolactin and testosterone. J Biol Chem 1999; 274(25): 17499–17504.
17. Coyle P, Philcox JC, Carey LC et al. Metallothionein: the multipurpose protein. Cell Mol Life Sci 2002; 59(4): 627–647.
18. Franklin RB, Milon B, Feng P et al. Zinc and zinc transporter in normal prostate function and the pathogenesis of prostate cancer. Front Biosci 2005; 10: 2230–2239.
19. Vallee BL, Falchuk KH. The biochemical basis of zinc physiology. Physiol Rev 1993; 73(1): 79–118.
20. Costello L, Franklin R. The clinical relevance of the metabolism of prostate cancer; zinc and tumor suppression: connecting the dots. Mol Cancer 2006; 5(1): 17.
21. Mycielska M, Patel A, Rizaner N et al. Citrate transport and metabolism in mammalian cells: prostate epithelial cells and prostate cancer. Bioessays 2009; 31(1): 10–20.
22. Medrano A, Fernández-Novell J, Ramió L et al. Utilization of citrate and lactate through a lactate dehydrogenase and ATP-regulated pathway in boar spermatozoa. Mol Reprod Dev 2006; 73(3): 369–378.
23. Costello L, Liu Y, Franklin R et al. Zinc inhibition of mitochondrial aconitase and its importance in citrate metabolism of prostate epithelial cells. J Biol Chem 1997; 272(46): 28875–28881.
24. Costello LC, Franklin RB. The intermediary metabolism of the prostate: a key to understanding the pathogenesis and progression of prostate malignancy. Oncology 2000; 59(4): 269–282.
25. Müntzing J, Varkarakis M, Saroff J et al. Comparison and significance of respiration and glycolysis of prostatic tissue from various species. J Med Primatol 1975; 4(4): 245–251.
26. Feng P, Liang JY, Li TL et al. Zinc induces mitochondria apoptogenesis in prostate cells. Mol Urol 2000; 4(1): 31–36.
27. Feng P, Li T, Guan Z et al. The involvement of Bax in zinc-induced mitochondrial apoptogenesis in malignant prostate cells. Mol Cancer 2008; 7(1): 25.
28. Jiang D, Sullivan P, Sensi S et al. Zn(2+) induces permeability transition pore opening and release of pro-apoptotic peptides from neuronal mitochondria. J Biol Chem 2001; 276(50): 47524–47529.
29. Franklin R, Ma J, Zou J et al. Human ZIP1 is a major zinc uptake transporter for the accumulation of zinc in prostate cells. J Inorg Biochem 2003; 96(2–3): 435–442.
30. Golovine K, Makhov P, Uzzo R et al. Overexpression of the zinc uptake transporter hZIP1 inhibits nuclear factor-kappaB and reduces the malignant potential of prostate cancer cells in vitro and in vivo. Clin Cancer Res 2008; 14(17): 5376–5384.
31. Milon B C, Agyapong A, Bautista R et al. Ras responsive element binding protein-1 (RREB-1) down-regulates hZIP1 expression in prostate cancer cells. Prostate 2010; 70(3): 288–296.
32. Ray SK, Nishitani J, Petry MW et al. Novel transcriptional potentiation of BETA2/NeuroD on the secretin gene promoter by the DNA-binding protein Finb/RREB-1. Mol Cell Biol 2003; 23(1): 259–271.
33. Thiagalingam A, De Bustros A, Borges M et al. RREB-1, a novel zinc finger protein, is involved in the differentiation response to Ras in human medullary thyroid carcinomas. Mol Cell Biol 1996; 16(10): 5335–5345.
34. Gioeli D. Signal transduction in prostate cancer progression. Clin Sci 2005; 108(4): 293–308.
35. Taylor KM, Morgan HE, Smart K et al. The emerging role of the LIV-1 subfamily of zinc transporters in breast cancer. Mol Med 2007; 13(7–8): 396–406.
36. Hasumi M, Suzuki K, Matsui H et al. Regulation of metallothionein and zinc transporter expression in human prostate cancer cells and tissues. Cancer Lett 2003; 200(2): 187–195.
37. Modica-Napolitano JS, Singh KK. Mitochondrial dysfunction in cancer. Mitochondrion 2004; 4(5–6): 755–762.
38. Banas A, Kwiatek WM, Banas K et al. Correlation of concentrations of selected trace elements with Gleason grade of prostate tissues. J Biol Inorg Chem 2010; 15(7): 1147–1155.
39. Tappel A. Heme of consumed red meat can act as a catalyst of oxidative damage and could initiate colon, breast and prostate cancers, heart disease and other diseases. Med Hypotheses 2007; 68(3): 562–564.
40. Sapota A, Darago A, Taczalski J et al. Disturbed homeostasis of zinc and other essential elements in the prostate gland dependent on the character of pathological lesions. Biometals 2009; 22(6): 1041–1049.
41. Zachara BA, Szewczyk-Golec K, Wolski Z et al. Selenium level in benign and cancerous prostate. Biol Trace Elem Res 2005; 103(3): 199–206.
42. Kiziler AR, Aydemir B, Guzel S et al. May the level and ratio changes of trace elements be utilized in identification of disease progression and grade in prostatic cancer? J Trace Elem Electrolytes Health Dis 2010; 27(2): 65–72.
43. Kanoh W, Ohtani N, Mashiko T et al. Levels of alpha(2) macroglobulin can predict bone metastases in prostrate cancer. Anticancer Res 2001; 21(1B): 551–556.
44. Guo JK, Deng WH, Zhang LC et al. Prediction of prostate cancer using hair trace element concentration and support vector machine method. Biol Trace Elem Res 2007; 116(3): 257–271.
45. Kizek R, Vacek J, Trnkova L et al. Využití katalytických reakcí na rtuťové elektrodě pro elektrochemické stanovení metalothioneinů. Chem Listy 2004; 98(4).
46. Eckschlager T, Adam V, Hrabeta J et al. Metallothioneins and cancer. Curr Protein Pept Sci 2009; 10(4): 360–375.
47. Krizkova S, Fabrik I, Adam V et al. Metallothionein – a promising tool for cancer diagnostics. Bratisl Lek Listy 2009; 110(2): 93–97.
48. Masarik M, Gumulec J, Kuchtickova S et al. Determination of novel tumor markers in prostate carcinoma. FEBS J 2010; 277(1): 188–188.
49. Gumulec J, Cernei NV, Zitka O et al. Zinc, Metallothionein and Prostate Tumour Cells – Is There Any Relation? 10th International Nutrition & Diagnostics Conference. Prague 2010.
50. Fabrik I, Adam V, Krizkova S et al. Level of heat-stable thiols in patients with a malignant tumor. Klin Onkol 2007; 20(6): 384–389.
51. Gumulec J, Masarik M, Hrabec R et al. Zinc and its relation to prostate tumous. Prakt Lek 2010; 90(8): 455–459.
52. Kizek R, Vacek J, Adam V et al. Metallothionein – Cisplatine and anticancer therapy. Klin Biochem Metab 2004; 12(2): 72–78.
53. Petrlova J, Blastik O, Prusa R et al. Determination of metallothionein content in patients with breast cancer, colon cancer, and malignant melanoma. Klin Onkol 2006; 19(2): 138–142.
54. Zelena J, Potesil D, Vacek J et al. Metallothionein as a prognostic marker of tumor disease. Klin Onkol 2004; 17(6): 190–195.
55. Masarik M, Gumulec J, Kuchtickova S et al. Detection of metallothionein and alphamethylacyl CoA racemase as potential new markers for prostate carcinoma. Int J Mol Med 2009; 24 (Suppl 1): S48.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2011 Issue 4
Most read in this issue
- Oropharyngeal Mucositis – Pain Management
- Schnitzler Syndrome: Diagnostics and Treatment
- Molecular Mechanisms of Zinc in Prostate Cancer
- The Role of Procalcitonin in the Differencial Diagnosis of Fever in Patiens with Multiple Myeloma
