-
Medical journals
- Career
Adjuvantní terapie u karcinomu rekta
Authors: P. Lovas; Z. Lovasová
Authors‘ workplace: Klinika radiační onkologie LF MU, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2011; 24(2): 94-100
Category: Reviews
Overview
Východiska:
Léčba karcinomu rekta v posledních letech zaznamenala několik zásadních změn. Byla zavedena totální mesorektální excize, zlepšila se technologie radioterapie, objevila se nová cytostatika. Došlo ke zlepšení předoperační diagnostiky. Přesto není léčebný postup především v neoadjuvantní léčbě celosvětově jednotný.Materiál a metody:
Komparativní analýza amerických a evropských doporučených postupů s review publikovaných prací.Závěr:
Mezi pracovišti existují podstatné rozdíly v aplikaci dávkování léčby ionizujícím zářením v neoadjuvanci. Krátký kurz radioterapie je vhodný k předoperační aplikaci u pacientů s primárně radikálně operabilním karcinomem rekta. Jde o bezpečný způsob léčby, který pacienty s rektálním karcinomem ve stadiu III nezatěžuje prolongovanou onkologickou léčbou a chemoterapií.Klíčová slova:
karcinom rekta – adjuvantní radioterapie – neoadjuvantní radioterapie – adjuvantní chemoterapie – neoadjuvantní chemoterapie – totální mesorektální exscizeÚvod
Adenokarcinom rekta je svou rostoucí incidencí kolem 22 případů a mortalitou asi 12 případů na 100 000 obyvatel jednou z nejčastějších a nejzávažnějších malignit dospělého věku. Incidence začíná narůstat ve čtvrtém decenniu s maximem mezi 65. a 75. rokem života. Nádor se častěji vyskytuje v mužské populaci [1].
Histopatologicky není rozdíl mezi adenokarcinomem tračníku a konečníku. Tlusté střevo má však ve svém průběhu variabilní vztah k peritoneu, různou mobilitu a odlišnou lymfatickou drenáž. Vzhledem k rozdílné anatomii, odlišnostem lymfatik a jinému terapeutickému přístupu lze identifikovat dva klinické obrazy karcinomu tlustého střeva, a to karcinom colon a karcinom rekta [2]. Tomu odpovídá i členění jednotek v rámci mezinárodní klasifikace nemocí vydávané WHO.
Pobřišnice je přirozenou bariérou pro šíření nádorové nemoci tlustého střeva. Transversum a sigmoideum jsou intraperitoneální části orgánu, kompletně pokryté peritoneem (serózou) a mají jasně definovatelné mesenterium. Ascendentní a descendentní colon mají minimální mesenterium a dorsolaterálně obvykle zasahují do retroperitonea. Horní část rekta začíná pod peritoneální řasou a je pokryta pobřišnicí vpředu a laterálně. Dolní polovina až dvě třetiny rekta jsou tedy umístěny extraperitoneálně, pod řasou [3] (obr. 1).
Image 1. Idealizovaný náčrt vztahu tlustého střeva a peritonea. Podle [2]. ![Idealizovaný náčrt vztahu tlustého střeva a peritonea. Podle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6c63c4f3c208d4b5fbdc3c94c1ce8ce9.jpg)
Přístup k léčbě karcinomu rekta se za poslední dekády dramaticky změnil. Vychází ze znalosti anatomie a přirozeného chování nemoci, včetně typického způsobu lokálních relapsů a vzoru metastazování. U části nemocných kombinujeme chirurgickou léčbu, ozáření a systémovou léčbu – terapie je tedy multimodální, s cílem dosáhnout vysoké úrovně lokální kontroly malignity. Pro dosažení kurativního cíle léčby je zásadní provedení radikální operace (tj. R0 resekce). Zásadním přínosem v chirurgii rekta bylo zavedení a rozšíření koncepce „totální mesorektální excize“, což významně zlepšilo prognózu nemocných s karcinomem rekta [4,5,34].
Kontrola nemoci v pánvi je zásadní pro dosažení kurativního cíle léčby. V 60. letech minulého století, před zavedením TME (totální mesorektální excize), v dobách nedokonalé diagnostiky byla dokonce standardem tzv. second look operation, tj. reoperace asymptomatických pacientů za 6–12 měsíců po primární resekci s cílem odhalit lokální relaps nemoci v době, kdy je ještě radikálně operovatelný. Tento postup byl opuštěn zavedením radioterapie do léčebného schématu.
Stadium nemoci a její přirozené chování
Téměř všechny nádory kolorekta vznikají ve sliznici a ve více než 90 % jde o adenokarcinomy [2,6]. Jiné histologické typy, jako spinocelulární karcinom, karcinoid, leiomyosarkom či lymfom, nejsou předmětem tohoto sdělení.
Prognóza nemoci je určena histologickými charakteristikami, extenzí nádoru přes stěnu rekta a do okolí (rozsahem, pokročilostí nádoru) [6]. Adenokarcinom, který vznikne ve sliznici (T1), roste polypoidně, ulcerativně nebo infiltrativně. Dojde-li k penetraci do submukózy za hranici muscularis propria (T2), kde se již nacházejí lymfatické cévy, zvyšuje se pravděpodobnost metastáz do lymfatik. Proroste-li nádor svalovinu střeva a dosáhne perirektálního tuku (T3), je riziko šíření lymfatickými cévami do uzlin velmi vysoké (> 10 %) a tyto bývají často postiženy (N1–2). Další přímé šíření do jiných orgánů, struktur či přímo do viscerálního peritonea (T4) se spojuje téměř pravidelně s distantním metastazováním lymfatickou cestou a často i s hematogenní diseminací. Vzdálené metastázy bývají nalezeny hlavně v játrech, příležitostně v plicích. Metastázy v plicích, kostech a mozku jsou málo časté a jsou známkou značné pokročilosti nemoci. Perforace peritonea (transcoelomové šíření) přivodí karcinomatózu v dutině břišní a ascites.
Jiné viscerální metastázy než jaterní nacházíme u pacientů, kteří přežívají delší dobu díky systémové léčbě. Jde hlavně o nemocné, u kterých bylo dosaženo lokální kontroly nádoru v pánvi a kteří prodělali lokální léčbu jaterních metastáz.
Strategie léčby
Z hlediska léčebné strategie a potřeby adjuvantní léčby je vhodné rozdělit pacienty podle pokročilosti stadia onemocnění a možnosti primárního radikálního chirurgického řešení. Většina zachycených karcinomů rekta je v lokálně pokročilém stadiu [1].
Časný karcinom rekta, tj. stadia T1–2 N0 (Dukes A): Dostačující je monoterapie jednou modalitou. Preferována je chirurgická léčba. Pacienti, kteří jsou nevhodní k operaci, mohou být léčeni zářením. V literatuře lze najít i údaje o indikaci intrakavitární brachyterapie se zdrojem 192Ir a intraluminální aplikaci RTG záření (kontaktní RTG terapie).
Lokálně pokročilý rektální tumor, tj. T3–4, N+ nálezy: Vzhledem k riziku lokálního relapsu je ozáření indikováno podle soudobého standardu vždy [7,8].
Resekovatelný tumor – předoperační (chemo)radioterapie (současný trend) nebo pooperační konkomitantní chemoradioterapie.
Neresekovatelný tumor – předoperační chemoradioterapie nebo paliativní (chemo)radioterapie.
Resekovatelný/neresekovatelný metastatický rektální karcinom: Lokální léčba je určena rozsahem metastáz a očekávaným přežitím pacienta. Chirurgická léčba a/nebo ozáření může/nemusí být indikována multidisciplinárním týmem. V současné době se díky pokroku v systémové léčbě pohybuje medián přežívání pacientů s metastatickým kolorektálním karcinomem kolem dvou let, asi polovina pacientů tedy žije déle. I u této skupiny nemocných je nutné zajistit kontrolu primárního nádoru, který při lokální progresi velmi negativně ovlivňuje kvalitu života pacienta.
Lokální recidiva nádoru: Řešením je operace a/nebo reiradiace zevní radioterapií nebo intraoperační radioterapií.
Principy kombinace ozáření a chirurgické léčby
Chirurgie a radioterapie jsou lokálně-regionálními metodami léčby maligního onemocnění. V případě, že jsou tyto modality úspěšné, natrvalo eradikují nádorové buňky primárního tumoru a metastázy regionálních lymfatických uzlin. Lokální kontrola (radikální resekce) zhoubného nádoru rekta je základním předpokladem pro jeho vyléčení.
Selhání lokální kontroly onemocnění neznamená jen nemožnost dosažení kurativního záměru léčby. Může vést i k neřešitelným problémům v pánvi, jako jsou např. píštěle, krvácení, bolest a zápach. Tyto komplikace výrazně zhoršují kvalitu života pacienta a při malém rozsahu vzdálených metastáz mohou být i příčinou smrti. Výhody agresivní léčby rakoviny rekta v oblasti pánve jsou tedy evidentní.
Již méně jednoznačný je efekt chirurgie a ozáření na rozvoj následných (metachronních) vzdálených metastáz. Nelze ho přesně hodnotit pro naši neschopnost identifikovat přítomnost mikrometastáz v době primární léčby. Je jasné, že lokální léčba může být kurativní jedině před rozvojem vzdálených mikrometastáz, protože odstraňuje jejich zdroj. Vyšetření na minimální reziduální nemoc není zatím standardním postupem. Význam průkazu jednotlivých izolovaných nádorových buněk kolorektálního karcinomu v krvi nebo kostní dřeni ultrastagingem s pomocí RT PCR (Reverse Transcription Polymerase Chain Reaction) je zatím nejasný.
Rakovina rekta se chová typicky sekvenčně, tj. lokální a regionální nemoc ve většině případů předchází vzdálenou diseminaci (na rozdíl od adenokarcinomů např. horní části zažívacího traktu či prsu).
Jedním z rysů karcinomu rekta je invazivní růst. Ten se může objevit v jakémkoliv směru, ale nejčastěji v oblastech nejmenšího odporu, tj. v tuku, pak podél svalů a nervových obalů a směrem po periostu. Důležité je pochopit, že infiltrativní růst je nejdříve jevem mikroskopickým (obr. 2). Se vzrůstající vzdáleností od primárního nádoru klesá koncentrace maligních buněk. Čím je karcinom rekta větší, tím větší je koncentrace klonogenních buněk v okolí co do počtu a vzdálenosti. V centru nádoru bývá nekróza a koncentrace nádorových buněk kolem 1012/mm3, v klinicky evidentní makroskopické periferii nádoru asi 109/mm3 maligních buněk. V místech, kde tumor již není makroskopicky patrný, je však zpravidla ještě rozsáhlá infiltrace klonogenními buňkami. Přibližně 106 buněk tvoří asi 1 mm3 tkáně. Jde již o koncentrace, které z technických důvodů nemusí být zachyceny ani při mikroskopickém vyšetření [9,10]. Tento „invazivní růstový vzor“ zhoubný nádor opakuje i v oblastech extrakapsulárního šíření při uzlinových metastázách a při hematogenním rozsevu.
Image 2. Schematická ilustrace subklinické nemoci kolem primárního tumoru. A) Chirurgicky neřešený primární tumor s přilehlou oblastí mikroskopické (subklinické) nemoci, denzita klesá se vzdáleností od tumoru. Přerušovanou čárou vyznačena oblast chirurgické resekce. B) Stav po resekci se signifi kantním zbytkem subklinické nemoci. Denzita nádorové nemoci je často tak malá, že ani pečlivé mikroskopické vyšetření neodhalí nádorové buňky (pro nedostatečnou senzitivitu histopatologického vyšetření) – subklinická nemoc [37]. C) Distribuce metastatických fokusů kolem primárního nádoru v závislosti na proporčním počtu případů u karcinomu prsu. Diagram z klasické práce Hollanda, Velinga et al ukazuje, že podstatné procento pacientek s karcinomem prsu má mikroskopickou nemoc kolem primárního tumoru až do vzdálenosti 6–8 cm [38]. ![Schematická ilustrace subklinické nemoci kolem primárního tumoru. A) Chirurgicky neřešený primární tumor s přilehlou oblastí mikroskopické (subklinické) nemoci, denzita klesá se vzdáleností od tumoru. Přerušovanou čárou vyznačena oblast chirurgické resekce. B) Stav po resekci se signifi kantním zbytkem subklinické nemoci. Denzita nádorové nemoci je často tak malá, že ani pečlivé mikroskopické vyšetření neodhalí nádorové buňky (pro nedostatečnou senzitivitu histopatologického vyšetření) – subklinická nemoc [37]. C) Distribuce metastatických fokusů kolem primárního nádoru v závislosti na proporčním počtu případů u karcinomu prsu. Diagram z klasické práce Hollanda, Velinga et al ukazuje, že podstatné procento pacientek s karcinomem prsu má mikroskopickou nemoc kolem primárního tumoru až do vzdálenosti 6–8 cm [38].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f73786906e70be4aa2dc7f891b2774cf.jpg)
Nedetekovatelnou nádorovou nemoc označujeme pojmem subklinická (obr. 2). Znalost, že v daném stadiu nemoci po primární léčbě perzistuje subklinická nemoc, je dána pozorováním vzniku relapsů v typických lokalitách. U lokálně pokročilého karcinomu rekta po primární operaci je to v případě pánevního relapsu hlavně presakrálně, v mesorektálních a dolních mesenterických uzlinách.
Chirurgická léčba je omezena svou povahou (jde o léčbu makroskopickou) a agresivitou (rozsah odstranitelné tkáně je limitovaný). Z toho vyplývá, že chceme-li dosáhnout kurativního cíle (nulového počtu nádorových klonogenních buněk), je potřeba kombinace léčebných modalit, tak aby došlo k eradikaci subklinické nemoci. Taková léčba s kurativním záměrem se pak konvenčně označuje jako neoadjuvantní (jiná modalita léčby zařazena před operací) nebo adjuvantní (další léčebná modalita aplikována po operaci). U lokálně pokročilého karcinomu rekta má tento postup nezastupitelné místo v podobě ozáření s chemoterapií nebo bez chemoterapie.
Radioterapie karcinomu rekta
Při léčbě zářením je podstatné, aby jeho dávka v nádorové tkáni byla co nejvyšší při nejmenším možném ozáření zdravých tkání. Lze toho dosáhnout různými způsoby. Nejčastěji je aplikována zevní radioterapie – neinvazivní ozáření několika svazky záření z různých stran, které se sčítají v nádorovém ložisku. Jinou možností je přímé zavedení radioaktivního zdroje do tkáně (invazivně) – brachyterapie. Intraoperační radioterapie (IORT) se provádí ve spolupráci s chirurgem, který mechanicky odsune zdravé tkáně z ozařované oblasti. Do operačního pole se vsune tubus, kterým se ozáří nádor za maximálního šetření okolních orgánů (střevních kliček).
Je důležité si uvědomit, že pro léčebný efekt není důležitý jen způsob dodání dávky záření, ale hlavně homogenita a výše aplikované dávky a její rozložení v čase a v anatomickém prostoru.
Ionizující záření je schopno předat energii hmotě buňky prostřednictvím kaskády jevů fyzikálních, chemických a nakonec biologických. Poškozena je jedinečná molekula DNA. Biologický efekt (smrt nádorové buňky) nenastane zpravidla okamžitě. Buňka s poškozenou DNA dále přežívá, dokud ve svém životním cyklu nedospěje k mitóze, ve které (v důsledku poškození DNA) hyne apoptózou. Z toho vyplývá, že k dosažení zmenšení primárního nádoru rekta (downstagingu, downsizingu) po neoadjuvantní (chemo)radioterapii je potřeba čekat několik týdnů od jejího ukončení (zvláště u velkých nádorů).
Jak již bylo uvedeno, u časného karcinomu rekta může být za určitých podmínek použito endoluminální radioterapie jako samostatné modality. Jde o malé exofytické, polypovité tumory bez negativních prognostických faktorů (tj. ne high grade, bez lymfovaskulární invaze, T1–2). Jinou možností je aplikace brachyterapie s použitím 192Ir. Intrakavitární léčba karcinomu rekta byla publikována hlavně francouzskými autory. Uvedenou intraluminální „kontaktní léčbou“ bylo dosaženo pětiletého přežití 65–85 % s počtem lokálních relapsů 10–15 % [11,12]. Tento postup není doložen dostatečným množstvím randomizovaných studií a je nutno ho považovat za nestandardní. V indikaci časného karcinomu se preferuje radikální chirurgická léčba, která je metodou volby. Lokální rektoskopická excize je vhodná tam, kde je radikální výkon nemožný. (Americká doporučení v této indikaci zvažují transrektální endoskopickou excizi. Takový postup je extrémně závislý na kvalitě histopatologického vyšetření a zkušenosti chirurga [8].)
U lokálně pokročilých nádorů rekta již tumor prorůstá střevní stěnu nebo evidentně postihuje pánevní lymfatické uzliny bez známek vzdálených metastáz (tj. nemoc se šíří mimo orgán, ve kterém vznikla). Radioterapie má v léčbě této nemoci pevně stanovené místo, podložené mnoha randomizovanými studiemi. Lze je rozdělit na studie se zařazenou léčbou zářením jako modalitou:
- pooperační,
- předoperační versus chirurgie samotná,
- předoperační versus pooperační,
- předoperační ozáření versus předoperační radiochemoterapie,
- studie zaměřené na efekt šetření sfinkteru.
Na základě série výzkumů provedených koncem 80. let (GITSG 1985, NCCTG 85-47-51, NSABP R-01) [13,14] byla pooperační chemoradioterapie stanovena NCI konferencí jako standard v multimodální léčbě pT3, 4 a/nebo pN1, 2 tumorů [15]. Bylo prokázáno zlepšení lokální kontroly a z některých dat vyplynulo nejednoznačně i prodloužení přežití.
Předoperační a pooperační aplikace záření s chemoterapií nebo bez chemoterapie byla studována ve čtyřech randomizovaných studiích (CAO/ARO/AIO-94 2004, UK MRC CR07 2009, USA RTOG 94-01/Intergroup 0417 a USA NSABP R-03) [16–18]. Předoperační skupiny pacientů měly zlepšenu lokální kontrolu, zlepšilo se přežití bez známek nemoci (DFS). Došlo k signifikantnímu zvýšení počtu sfinkter šetřících operací, byla zaznamenána menší incidence akutní a pozdní toxicity v porovnání s pooperační aplikací radiochemoterapie. Proto v současnosti pacienti s nálezem cT3–cT4 cN+ karcinomu rekta mají být indikováni k předoperační radiochemoterapii.
Z mnoha uvedených studií a z dalších randomizovaných sérií (francouzské Lyon R09-01 1999, R96-02 2004) [19] vyplynulo, že ozářením je možno zvýšit procento operací zachovávajících svěrač. Je-li toto primárním cílem léčby, pak je obecně výhodnější delší časová aplikace záření (5–6 týdnů), vyšší aplikovaná dávka má lepší efekt. Je potřeba delšího odstupu mezi operací a ozářením. Byl studován i nechirurgický přístup k léčbě bez zařazení operace do léčebného schématu (radikální radiochemoterapie samostatně).
Ohledně optimálního dávkování záření jsou k dispozici kontroverzní údaje. Není možné jednoznačně porovnat efekt na lokální kontrolu a přežití u krátkého kurzu ozáření (5 × 5 Gy) s konvenčním dlouhým kurzem radioterapie (45–54 Gy) v předoperační indikaci, protože do studií s krátkým kurzem radioterapie byli selektováni pacienti s lepší prognózou.
Z podskupinových analýz však vyplývá, že krátký kurz ozáření není dostatečně efektivní u pacientů s předpokládaným pozitivním radiálním chirurgickým okrajem a nízce sedícím tumorem [20–22].
Význam kombinace chemoterapie a radioterapie u karcinomu rekta
Bylo provedeno několik srovnávacích studií na efekt ozáření samotného versus jeho kombinace s chemoterapií (francouzská studie FFCD-9203 2006, Glimeliusova metaanalýza v roce 2008, Ceelenova metaanalýza v roce 2009) [20,24].
Ve studovaných skupinách cT3–cT4 pacientů chemoterapie snížila procento lokálních recidiv a zvýšila počet pT0 pacientů definitivně histopatologicky hodnocených po operaci. Byla však dokumentována vyšší toxicita léčby a nebyl jednoznačně prokázán benefit pro celkové přežití [22].
Zatím chybí jednoznačné, vědecky podložené údaje pro aplikaci adjuvantní chemoterapie po předoperační (chemo)radioterapii. Na základě publikovaného se však zdá, že tato indikace má jistý efekt. Adjuvantní chemoterapie po neoadjuvantní (chemo)radioterapii je dle publikovaných doporučení indikována [7,8,22–24,35,36].
Standardem v kombinované léčbě je stále chemoterapie s 5-fluorouracilem (5-FU) v bolusovém či kontinuálním podání. Kapecitabin jako prodrug (látka metabolizující se na fluorouracil) má výhodu perorální aplikace. Dlouhodobá zralá data na podání kapecitabinu ve srovnání s 5-FU nejsou zatím publikována [25]. Slibné v léčbě lokálně pokročilé nemoci jsou výsledky studií fáze II, ve kterých byla v konkomitanci podána kombinace 5-FU s irinotecanem nebo oxaliplatinou [26].
Plánování léčby zářením u karcinomu rekta
Pro pochopení problematiky bude dále stručně definován cílový objem u karcinomu rekta. Cílový objem (to, co „má být ozářeno“) je pro radiačního onkologa oblast klinické a předpokládané subklinické nemoci, která má obdržet předepsanou léčebnou dávku záření. Zdokonalování technologie umožňuje v současnosti přesně definovat tuto oblast v CT řezech s pomocí dalších vyšetření. Jde hlavně o klinické vyšetření radiačním onkologem a zobrazovací metody jako NMR, TRUS, endoskopie.
Stanovení cílového objemu je podstatná část práce onkologa, která určuje výsledek celé léčby. Nedostatečné ozáření např. rizikových skupin lymfatických uzlin může později způsobit jak systémový, tak i lokální relaps nemoci.
Všechny cílové objemy v onkologii byly určeny na základě:
- sledování vzoru relapsů u pacientů různých stadií po léčbě,
- lymfatické drenáže,
- individuální anatomie a patologie.
Historicky první prací zabývající se touto problematikou byla práce Gundersona et al publikovaná v roce 1974 [27]. Na základě pozorovaných recidiv bylo doporučeno první uspořádání adjuvantních polí, která pokrývala zadní část pánve (obr. 3).
Image 3. Způsoby lokální recidivy u pacientů po iniciální operaci před zavedením radioterapie a TME. Naznačena ozařovací pole v dnes již „klasické“ historické práci [29]. ![Způsoby lokální recidivy u pacientů po iniciální operaci před zavedením radioterapie a TME. Naznačena ozařovací pole v dnes již „klasické“ historické práci [29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1e878a0baa920fca4f7a85dd60d2dad2.jpg)
Roels et al [28] provedli metaanalýzu 114 článků zabývajících se touto problematikou. Riziko lokální recidivy striktně závisí na typu provedené operace. Lokální recidivy v oblasti mesorekta a presakrálního prostoru byly popisovány hlavně před zavedením TME. Větší počet lokálních recidiv byl spojen s pozitivním cirkumferenčním resekčním okrajem a s pokročilejším T stadiem. Nejčastější uzlinové relapsy byly identifikovány opět v mesorektu, v oblasti uzlin podél horní rektální arterie (mesenterica inferior) a střední rektální arterie (interní ilika, obturátorové uzliny). K podobným závěrům došli i jiní autoři [29].
NMR u karcinomu rekta dobře zobrazuje oblast primárního nádoru a umožňuje ho odlišit od artefaktů, např. stolice. Uzlinové oblasti, které mají být ozářeny, jsou určeny v CT řezech sledováním průběhu cév a na základě znalosti anatomie lymfatické drenáže rekta. Cílem ozáření je tedy primární nádor rekta s kaudálním lemem 1 cm a orálním lemem 2–5 cm společně s regionálními uzlinami podél interních ilických arterií a jejich větví a oblast mesorekta a presakrálního prostoru. Podle rozsahu postižení a na základě erudice radiačního onkologa se eventuálně zahrnuje do ozářeného objemu pánve i objem urogenitálních struktur, lymfatika inguinální a podél externích ilických svazků. Podrobná definice cílového objemu přesahuje rámec tohoto sdělení [10] (obr. 4).
Image 4. Cílový objem při léčbě zářením u karcinomu rekta. Frontální a sagitální řez pánví (barevně léčebná dávka záření deponovaná hlavně v oblasti mesorekta, podél interních ilik a pokrytí presakrálního prostoru). Klinika radiační onkologie, MOÚ Brno. 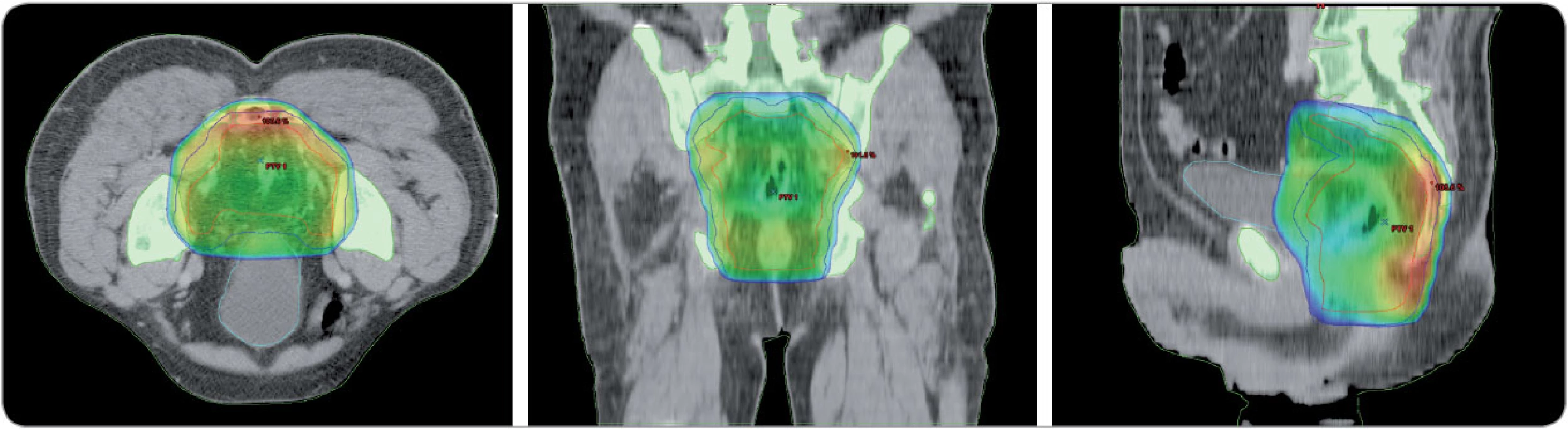
Hlavní nevýhodou neoadjuvantní léčby jako primárního postupu ve srovnání s operací je nepřesná stratifikace nemocných pro neznalost histopatologických kritérií, která mají největší prognostickou hodnotu.
Zavedení neoadjuvantní léčby předpokládá velmi přesnou diagnostiku před léčbou s využitím transrektální ultrasonografie (TRUS) a nukleární magnetické rezonance (NMR). V rukou zkušeného diagnostika jde o efektivní nástroje. I přesto se ale u mnoha nemocných nevyhneme nadhodnocení rozsahu tumoru (T3 místo T2), a tedy jeho nadléčení předoperační (chemo)radioterapií. Velmi problematické je i hodnocení postižení uzlin zobrazovacími metodami, protože velikost je nespolehlivé kritérium.
V případech po TME je důležitým parametrem kromě počtu uzlin a axiálních okrajů především cirkumferenční (radiální) resekční okraj (CRM). Pozitivita CRM je nejsilnějším prognostickým faktorem lokálního relapsu a je měřítkem kvality chirurgie.
Předpoklad proveditelnosti radikální operace má prediktivní hodnotu pro dávkování předoperační léčby zářením. Zkrácený režim 5 × 5,0 Gy aplikovaných v jednom týdnu bez chemoterapie s bezprostřední operací do jednoho týdne od ukončení radioterapie je pohodlná, jednoduchá a netoxická léčba (i ve smyslu pozdních nežádoucích účinků po ozáření). Toto dávkování je vhodné vždy, pokud jde o nádor primárně radikálně operabilní (bez ohledu na N status). Zásadním prediktivním faktorem pro výše zmíněnou indikaci je vyšetření pánve pomocí magnetické rezonance (MR). Vzdálenost nádoru nebo postižených uzlin od mesorektální fascie se označuje jako CRM (Circumferential Radial Margin). Jde o pojem histopatologický i radiodiagnostický. Za pozitivní CRM (tj. R1 operace, nedostatečný laterální okraj resekátu) po chirurgickém výkonu se považuje patologický nález nádoru < 1 mm od chirurgického resekčního okraje, je-li vzorek excidovaného mesorekta histologicky vyšetřen v řezech po 5 mm. Negativní predikcí CRM (tj. předpoklad R0 resekce) dle předoperační MR je vzdálenost nádoru od mesorektální fascie > 5 mm.
V lokálně pokročilejších případech u primárně radikálně neresekovatelné nemoci (T3–4 a pozitivní predikce CRM dle MR, T4 s prorůstáním do neresekovatelných orgánů) je efektivnější předoperační radiochemoterapie, zpravidla 40–50 Gy; 1,8–2,0 Gy na frakci, 5krát týdně s konkomitantní chemoterapií na bázi fluoropyrimidinů s následnou operací s odstupem 6–8 týdnů od neoadjuvantní léčby.
Krátký předoperační režim je ve srovnání s americkým přístupem preferujícím dlouhý kurz radioterapie s konkomitantní chemoterapií v Evropě dobře etablován [7,8, 20, 22,30].
Toxicita léčby
Hlavními nežádoucími účinky zhoršujícími kvalitu života je nutnost založení stomie a poškození sfinkteru, dále postižení střeva, urogenitálního traktu a zhoršení sexuálních funkcí.
Existují údaje, že vynechání sfinkteru z ozářeného objemu má za následek jeho lepší funkci po multimodální léčbě. Urogenitální dysfunkce a porucha sexuálních funkcí (suchost poševní sliznice, porucha ejakulace) jsou částečně způsobeny následkem ozáření, ale hlavně vznikají poškozením hypogastrických nervů při operaci.
Lze dohledat dostatek údajů prokazujících poškození funkce střeva předoperační nebo pooperační radioterapií. Častým akutním nežádoucím účinkem chemoradioterapie je průjem a zvýšená frekvence stolic (tenké střevo) a akutní proktitida (tlusté střevo). Jsou obvykle přechodného rázu a odezní do několika týdnů po ukončení léčby.
Samotný fluorouracil a jeho deriváty mají nezanedbatelný toxický efekt na sliznici střeva, který potencuje nežádoucí účinky záření. Nejčastější závažné komplikace vznikají z poškození tenkého střeva. Jde o enteritidu, v krajním případě je možný pozdější vznik adhezí a obstrukčních břišních příhod vyžadujících chirurgické řešení. Předoperační (chemo)radioterapie v poloze na břiše ve speciálním zařízení (belly board) je provázena menší incidencí nežádoucích účinků v oblasti tenkého střeva [22,39,40].
Další vývoj
TME a předoperační radioterapie zajišťují lokální kontrolu nemoci s relapsem v pánvi u méně než 10 % léčených pacientů [10]. Je to velmi dobrý výsledek ve srovnání s obdobím před zavedením těchto modalit, kdy více než 75 % pacientů umíralo na komplikace způsobené růstem nádoru při nedostatečné lokální kontrole.
U pacientů T3–4 N+ tedy stále existuje možnost zlepšení [31]. Možný posun do budoucna přinese zpřesnění předoperačního stagingu – široké zavedení MR umožní stratifikovat podskupiny nemocných T3 a–d (T3 se šířením mimo stěny < 5 mm je prognózou blíže k T2, T3 > 5 mm má výrazně horší prognózu) [32]. V rámci detekce uzlinového postižení se jako slibné jeví výsledky ze studií s novými MR kontrastními látkami (USPIO). Radioterapie prodělala v poslední dekádě dramatický technologický rozvoj. Doposud není dořešena indikace dávky u krátkého a dlouhého kurzu ozáření (dle dat ze švédské Uppsaly se zdá, že režim 5 × 5,0 Gy s odloženým chirurgickým řešením je efektivní k dosažení R0 resekce) [33]. Systémová léčba v kombinaci se zářením otevírá rovněž nové možnosti. Jde o nové kombinace (přidání oxaliplatiny k fluorouracilu či capecitabinu). Jinou možností je kombinace preparátů tzv. biologické léčby (inhibitory EGF receptoru) s chemoterapií a zářením. Nejasná je i možnost kombinace předoperační systémové léčby s krátkým kurzem radioterapie.
Závěr
Karcinom rekta je velmi častým onkologickým onemocněním. Diagnóza je vždy histologická s přesným určením rozsahu a pokročilosti nemoci. Léčba je zpravidla multimodální a je postavená na základě specifické anatomie rekta jako části tlustého střeva ve vztahu k okolním orgánům, hlavně peritoneu (přirozená bariéra pro šíření nemoci). Je snaha zachytit co nejčasnější stadium nemoci, které může být vyřešeno lokální a regionální kurativní léčbou ještě před rozvojem vzdálených metastáz. Lokální léčba má ale nezastupitelné místo i u nevyléčitelného onemocnění, protože redukuje výskyt komplikací a zlepšuje kvalitu života pacienta. Onkologickou léčbu je potřebné chápat v konceptu subklinické nemoci. Základem kurativní léčby je úplná eradikace nádorových klonogenních buněk. Toho lze u lokálně pokročilého nádoru dosáhnout jedině kombinací terapeutických modalit. Vždy jde o totální mesorektální excizi před ozářením nebo po ozáření oblasti primárního tumoru, mesorekta a oblastí s vysokým rizikem uzlinového relapsu. Ozáření a chemoterapie našly své místo nejprve v pooperační indikaci. Soudobým trendem je předoperační (chemo)radioterapie, protože jde o postup s nejmenší toxicitou, nejlepší lokální kontrolou a v případě ozáření i prodlužující přežití. U nízce sedících nádorů dává šanci na operaci zachovávající svěrač. Další vývoj doporučení lze očekávat hlavně u nemocných stadia III. Ke „klasickým“ prediktivním faktorům TNM (velikost tumoru, postižení uzlin, vzdálené metastázy) lze dnes již přiřadit CRM. Ten nejenom předpovídá radikalitu operace, ale zároveň je i vhodným prediktivním parametrem pro stanovení agresivity neoadjuvantní léčby [31].
Poděkování
Mé poděkování patří MUDr. Jiřímu Tomáškovi a prof. MUDr. Miloslavu Dudovi, DrSc.
Tato práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005.
This study was supported by the following research programme of the Ministry of Health of the Czech Republic: FUNDIN MZ0MOU2005.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Pavel Lovas
Klinika radiační onkologie LF MUMasarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: pavel.lovas@mou.cz
Obdrženo/Submitted: 28. 8. 2010
Přijato/Accepted: 30. 12. 2010
Sources
1. Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika. 2005. http://www.svod.cz.
2. Mohammed M, Czito BG et al. Rectal cancer. In: Halperin CH, Perez CA, Brady LW et al (eds). Principles and practice of radiation oncology. 5th ed. Philadelphia: Lippincot Williams § Wilkins 2004 : 1366–1367.
3. Gunderson LL, O’Connell MJ. The postoperative chemotherapy/irradiation adjuvant strategy. In: Cohen AF, Winawer SJ, Friedman MA et al (eds). Cancer of the colon, rectum, and anus. New York: McGraw-Hil 1995 : 631–645.
4. Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery the cene to pelvic recurens? Br J Surg 1982; 69(10): 613–616.
5. MacFarlane JK, Ryall RD, Heald RJ. Mesorectal excision for rectal cancer. Lancet 1993; 341(8843): 457–460.
6. Gunderson LL, Sosin H. Areas of failure found at reoperation (second or symptomatic look) following “curative surgery” for adenocarcinoma of the rectum. Clinicopathologic correlation and implications for adjuvant therapy. Cancer 1974; 34(4): 1278–1292.
7. Glimelius B, Påhlman L, Cervantes A. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annl Oncol 2010; 21 (Suppl 5): v82–v86.
8. National Comprehensive Cancer Network, NCCN Clinical Practice Guidelines in Oncology: Rectal cancer V. 2010, USA. http://www.nccn.com.
9. Zagras GK. Principles of combining radiation therapy and surgery. In: Cox JD, Ang KK (eds). Radiation oncology rationale technique, results. 8th ed. St. Louis: Mosby 2003 : 97–107.
10. Holland R, Veling SH, Mravunac M et al. Histologic multifocality of Tis, T1–2 breast carcinomas. Implications for clinical trials of breast-conserving surgery. Cancer 1985; 56(5): 979–990.
11. Gerard JP, Romestaing P, Ardiet JM et al. Sphincter preservation in rectal cancer. Endocavitary radiation therapy. Sem Radiat Oncol 1998; 8(1): 13–23.
12. Coatmeur O, Truc G, Barillot I et al. Treatment of T1–T2 rectal tumors by contact therapy and interstitial brachytherapy. Radiother Oncol 2004; 70(2): 177–182.
13. Smalley SR, Benedetti JK, Williamson SK et al. Phase III trial of fluorouracil-based chemotherapy regimens plus radiotherapy in postoperative adjuvant rectal cancer: GI INT 0144. J Clin Oncol 2006; 24(22): 3542–3547.
14. Fisher B, Wolmark N, Rockette H et al. Adjuvant chemotherapy or post-operative radiation for rectal cancer: 5 year results of NSABP protocol R-01. Am Soc Clin Oncol 1987; 6(A): 359–392.
15. Krook JE, Moertel CG, Gunderson LL. Effective surgical adjuvant therapy for high-risk rectal carcinoma. N Engl J Med 1991; 324(11): 709–715.
16. Roh MS, Colangelo LH, O’Connell MJ et al. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol 2009; 27(31): 5124–5130.
17. Sebag-Montefiore D, Stephens RJ, Steele R et al. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet 2009; 373(9666): 811–820.
18. Sauer R, Fietkau R, Wittekind C et al. Adjuvant versus neoadjuvant radiochemotherapy for locally advanced rectal cancer. A progress report of a phase-III randomized trial (protocol CAO/ARO/AIO-94). Strahlenther Onkol 2001; 177(4): 173–181.
19. Gerard JP, Chapet O, Nemoz C et al. Improved sphincter preservation in low rectal cancer with high-dose preoperative radiotherapy: the Lyon R96-02 randomized trial. J Clin Oncol 2004; 22(12): 2404–2409.
20. Glimelius B, Grönberg H, Järhult J et al. A systematic overview of radiation therapy effects in rectal cancer. Acta Oncol 2003; 42(5–6): 476–492.
21. Rödel C, Hohenberger W, Sauer R. Adjuvant and neoadjuvant therapy of rectal carcinoma. The current status. Strahlenther Onkol 1998; 174(10): 497–504.
22. Valentini V, Beets-Tan R, Borras JM et al. Evidence and research in rectal cancer. Radiother Oncol 2008; 87(3): 449–474.
23. Gérard JP, Conroy T, Bonnetain F et al. Preoperative radiotherapy with or without concurrent Fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203. J Clin Oncol 2006; 24(28): 4620–4625.
24. Collette L, Bosset JF, den Dulk M et al. Patients with curative resection of cT3-4 rectal cancer after preoperative radiotherapy or radiochemotherapy: does anybody benefit from adjuvant fluorouracil-based chemotherapy? A trial of the European Organisation for Research and Treatment of Cancer Radiation Oncology Group. J Clin Oncol 2007; 25(28): 4379–4386.
25. Kim JS, Cho MJ, Song KS et al. Preoperative chemoradiation using oral capecitabine in locally advanced rectal cancer. Int J Radiat Oncol Biol Phys 2002; 54(2): 403–408.
26. Schmoll HJ, Cartwright T, Tabernero J et al. Phase III trial of capecitabine plus oxaliplatin as adjuvant therapy for stage III colon cancer: a planned safety analysis in 1,864 patients. J Clin Oncol 2007; 25(1): 102–109.
27. Gunderson LL, Sosin H. Areas of failure at reoperation (second or symptomatic look) following “curative surgery” for adenocarcinoma of the rectum. Clinicopathologic correlation and implications for adjuvant therapy. Cancer 1974; 34(4): 1278–1292.
28. Roels S, Duthoy W, Haustermans K et al. Definition and delineation of the clinical target volume for rectal cancer. Int J Radiat Oncol Biol Phys 2006; 65(4): 1129–1142.
29. Bagatzounis A, Kölbl O, Müller G et al. The locoregional recurrence of rectal carcinoma. A computed tomographic analysis and a target volume concept for adjuvant radiotherapy. Strahlenther Onkol 1997; 173(2): 68–75.
30. Bujko K, Nowacki MP, Nasierowska-Guttmejer A et al. Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 2006; 93(10): 1215–1223.
31. Gunderson LL, Sergent DJ, Tepper JE et al. Impact of T and N stage and treatment on survival and relapse in adjuvant rectal cancer: a pooled analysis. J Clin Oncol 2004; 22(10): 1785–1796.
32. MERCURY Study Group. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the MERCURY study. Radiology 2007; 2431): 132–139.
33. Bujko K, Kolodziejczyk M. The 5 × 5 Gy with delayed surgery in non-resectable rectal cancer: a new treatment option. Radiother Oncol 2008; 87(3): 311–313.
34. Doleželová H, Ondrová B, Hynková L. Moderní radioterapie v léčbě kolorektálního karcinomu. In: Vyzula R, Žaloudík J et al (eds). Rakovina tlustého střeva a konečníku: vybrané kapitoly. Praha: Maxdorf 2007 : 205–217.
35. Šlampa P, Kocáková I, Šefr R et al. Neoadjuvant treatment for locally advanced rectal adenocarcinoma with concomitant radiotherapy and oral capecitabine. J BUON 2004; 9(1): 33–40.
36. Šlampa P, Tomášek J. Radioterapie nádorů konečníku. Referátový výběr z onkologie 2008; 25(1+2): 32–36.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2011 Issue 2-
All articles in this issue
- Léčba pacientů s relabovaným/refraktérním Hodgkinovým lymfomem
- Metastázujúci choriokarcinóm u 26-ročnej ženy – kazuistika
- Comments on the TNM Classification of Malignant Tumours – 7th Edition
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2011
- Zpřesněme indikaci podávání inhibitorů kinázové aktivity EGFR
- Adjuvantní terapie u karcinomu rekta
- Avastin v léčbě karcinomu prsu
- Prehľad potenciálnych onkomarkerov detekcie skorých fáz rakoviny vaječníkov
- Výsledky multimodální léčby glioblastoma multiforme: Konsekutivní série 86 pacientů diagnostikovaných v letech 2003–2009
- Incidencia a mortalita na karcinóm prostaty vo vybraných krajinách strednej Európy
- Angiomyofibroblastóm krčku maternice: kazuistika
- Překonávají klinické studie fáze 0 stagnující vývoj protinádorových léčiv?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prehľad potenciálnych onkomarkerov detekcie skorých fáz rakoviny vaječníkov
- Metastázujúci choriokarcinóm u 26-ročnej ženy – kazuistika
- Adjuvantní terapie u karcinomu rekta
- Comments on the TNM Classification of Malignant Tumours – 7th Edition
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

