-
Medical journals
- Career
Chronická gastrointestinální toxicita po zevní radioterapii karcinomu prostaty
Authors: J. Šefrová 1; P. Paluska 1; K. Odrážka 2,3,4,5; V. Jirkovský 6
Authors‘ workplace: Klinika onkologie a radioterapie, FN Hradec Králové 2Multiscan s. r. o., Oddělení klinické a radiační onkologie, Pardubická krajská nemocnice, a. s., Pardubice 3Onkologická klinika 1. lékařské fakulty UK a VFN, Praha 4Radioterapeutická a onkologická klini 1
Published in: Klin Onkol 2009; 22(5): 233-241
Category: Original Article
Overview
Východiska:
Chronická gastrointestinální (GI) toxicita je významným faktorem limitujícím eskalaci dávky záření na prostatu. Její incidence se mění v závislosti na dávce a použité technice ozáření, ale spolupodílejí se i faktory další. Přes veškerou snahu je stále nežádoucím účinkem, který může významně zhoršovat kvalitu života pacientů po proběhlé kurativní radioterapii karcinomu prostaty. Cíl: Cílem této práce je blíže popsat chronickou GI toxicitu po zevním ozáření karcinomu prostaty, její příčiny, rozvoj, projevy a incidenci při různých technikách ozáření. Dále pak porovnat časový vývoj od začátků kurativní radioterapie karcinomu prostaty až do dnešní doby. Závěry: Výskyt chronické GI toxicity je dnes díky moderním technikám radioterapie relativně nízký i při použití celkové dávky záření až 80 Gy. Další snižování radiačních komplikací lze očekávat od zavedení obrazem řízené radioterapie (IGRT), která umožňuje přesnější doručení dávky přímo do prostaty, zmenšení bezpečnostního lemu kolem klinického cílového objemu (CTV), a tím i menší zatížení okolních rizikových orgánů.Klíčová slova:
toxicita – radioterapie – proktitida – karcinom prostatyÚvod
Akutní nebo chronické poškození zdravých tkání je významným limitujícím faktorem radioterapie. U karcinomu prostaty bylo v několika randomizovaných studiích prokázáno, že eskalace dávky záření na prostatu vede ke zlepšení lokální kontroly, doby do biochemické progrese [1–5], doby do vzniku metastáz [6], v retrospektivních studiích i k prodloužení celkového přežití [7], a to zejména u pacientů se středním a vysokým rizikem. V dalším zvyšování dávky jsme ale omezováni právě toxicitou léčby.
S rozvojem technických možností jsme od začátků používání radioterapie jako kurativní metody pro léčbu karcinomu prostaty dospěli k významnému zlepšení lokální kontroly. Jak se přitom změnila gastrointestinální toxicita a co o ní víme, se pokouší zmapovat následující přehled.
Definice
Jako chronické označujeme komplikace vyskytující se za 90 a více dní od ukončení radioterapie. Pro ozáření prostaty je typické postižení genitourinární (GU) a gastrointestinální (GI). V oblasti gastrointestinální se pak ve většině případů jedná o postižení rekta – radiační proktitidu. Méně často se při ozáření samotné prostaty setkáme s postižením anu a sigmatu a jen výjimečně s postižením tenkého střeva (narozdíl od ozáření celé pánve).
Patofyziologie chronické GI toxicity
Chronické změny jsou způsobeny zejména progredujícím postižením cév. Vlivem záření dochází k uvolňování růstových a inhibičních faktorů, dysregulaci na buněčné úrovni, apoptotické smrti buněk i změnám genové exprese. Rozvíjí se zánětlivá odpověď s převažující fibrotickou aktivitou. Mikroskopické změny se nachází v mukóze a submukóze, v pojivové tkáni se objevují atypické fibroblasty, přibývá kolagenních vláken, dochází k zeslabení stěny arterií a teleangiektaziím cév [8]. Zvýšená trombogenní aktivita endotelu vede k tvorbě fibrinových trombů v drobných arteriolách, ischemii, případně ulceraci a krvácení. Časem začínají převažovat fibrotické změny, dochází k jizvení, mohou se objevit striktury, píštěle, vzácně obstrukce [9].
Projevy chronické GI toxicity
Projevem chronické radiační proktitidy je nejčastěji enteroragie [10], vzácněji se objevují průjmy, časté stolice, tenesmy, odchod hlenu z konečníku nebo inkontinence stolice.
Endoskopicky můžeme pozorovat okrsky zarudnutí, křehkou sliznici, rozšířené, někdy i krvácející cévy, případně ulcerace (obr. 1).
Image 1. Endoskopický obraz radiační proktitidy. Radiační proktitida, endoskopický obraz u pacienta po radioterapii karcinomu prostaty 78 Gy. U jednotlivých obrázků je uveden popis endoskopického nálezu a subjektivní obtíže pacienta. 13 měsíců po skončení radioterapie ošetřen navíc významně krvácející divertikl sigmatu. a) 7 měsíců po skončení radioterapie: Vícečetná drobná klubka novotvořených cév, které po průchodu endoskopu mírně krvácejí. Subjektivní obtíže – stolice 1– 2krát denně, bez krve, urgence. b) 12 měsíců po skončení radioterapie: Objemnější koagulum, čerstvá krev, setřelá podslizniční cévní kresba, klubka novotvořených cév, místy s čerstvým krvácením. Ošetřeno argonovou plazmakoagulací. Subjektivní obtíže – odchod krve a koagul 2krát do týdne, stolice 2– 3krát denně. Nutnost substituce erymasami. c) 14 měsíců po skončení radioterapie: V rektu koagula čerstvá krev, sliznice s klubíčky novotvořených cév, některé s ronícím krvácením, ulcerace kombinované etiologie (radiační + předchozí ošetření argonovou plazmakoagulací), v okrajích lne koagulum nebo roní krev. Ošetřeno argonovou plazmakoagulací. Subjektivní obtíže – stolice 1– 3krát denně, odchod krve a koagul denně. Nutnost substituce erymasami. d) 15 měsíců po skončení radioterapie: Sliznice s klubíčky novotvořených cév, některé s ronícím krvácením, drobné hojící se ulcerace s jizvami v okolí kombinované etiologie (radiační + předchozí ošetření argonovou plazmakoagulací). Subjektivní obtíže – stolice 1– 3krát denně, odchod tmavší krve 2krát do týdne. Bez nutnosti substituce erymasami. e) 16 měsíců po skončení radioterapie: Hojící se ulcerace po předchozím ošetření argonovou plazmakoagulací s fibrinovou spodinou, největší 12 mm. Mezi ulceracemi normální sliznice s jizvami a drobnými zbytky novotvořených cév. Jedno lnoucí koagulum, po odstranění patrna krvácející céva, ošetřena argonovou plazmakoagulací. Subjektivní obtíže – malé množství krve ve stolici 1– 2krát do týdne. Bez nutnosti substituce erymasami. Obrazová dokumentace byla zapůjčena laskavostí MU Dr. Jirkovského z archivu oddělení gastroenterologie II. interní kliniky Fakultní nemocnice Hradec Králové. 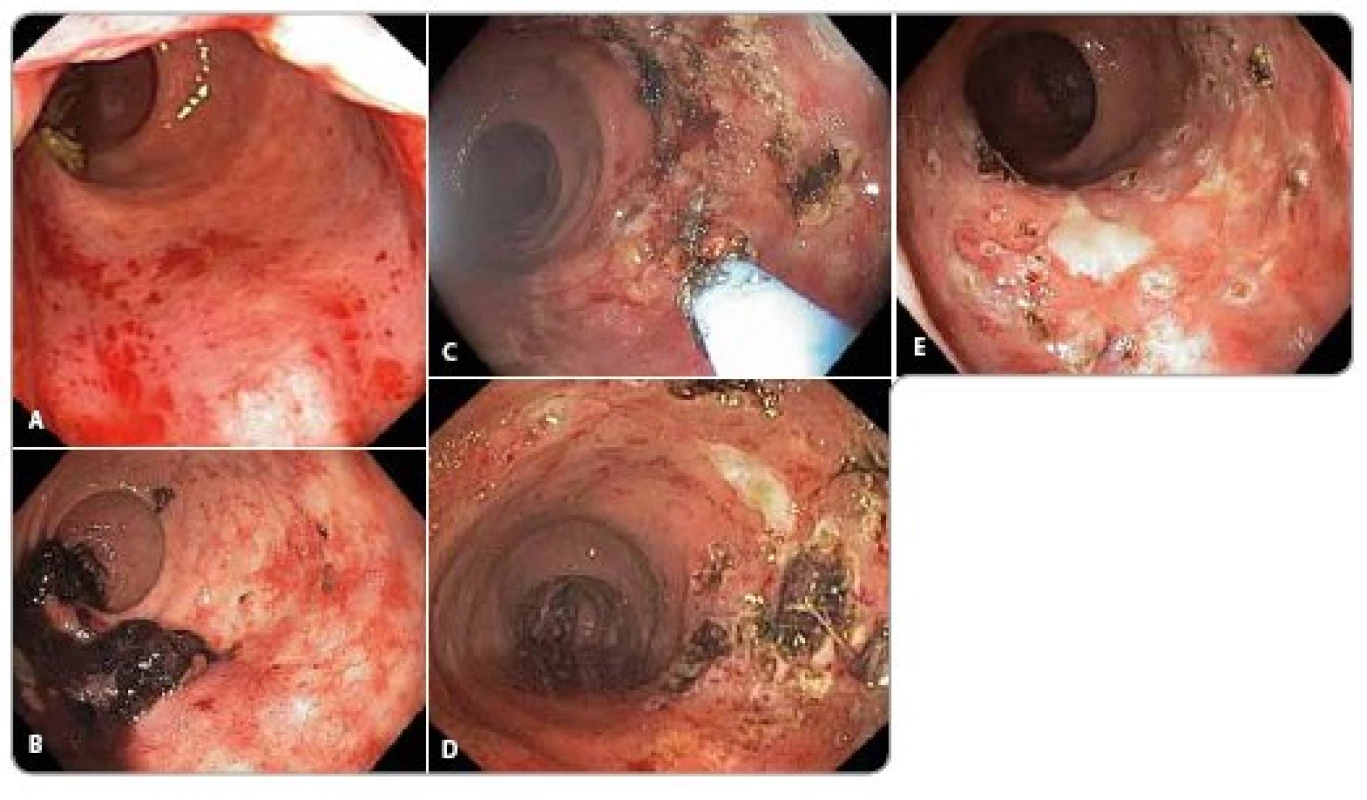
Projevy se objevují nejčastěji v období prvních dvou let po léčbě s mediánem 12 měsíců [10–11]. U dvou třetin pacientů dochází do dvou let od projevů toxicity ke zlepšení až úplnému vymizení obtíží [9,12], některé studie uvádějí přetrvávání příznaků od 6 měsíců do konce života v závislosti na stupni postižení [13–14]. Toxicita druhého stupně odpovídá na medikaci nebo koagulaci v 90%, toxicita třetího stupně v 75% s mediánem trvání obtíží 10 měsíců [14]. U jedné čtvrtiny pacientů ovšem krvácení i přes léčbu pokračuje [14–15].
Hodnocení chronické GI toxicity
Existuje několik stupnic pro hodnocení chronické radiační toxicity. Nejčastěji jsou používána RTOG/EORTC (Radiation Therapy Oncology Group/European Organisation for Research and Treatment of Cancer) Common Toxicity Criteria rozdělující toxicitu do pěti nepříliš konkrétně specifikovaných stupňů [16]. Podrobnější je klasifikace LENT-SOMA (Late Effects Normal Tissue Scale – Subjective, Objective, Management, Analytic) [17], další změny v hodnocení G2 a G3 toxicity přináší její modifikace FC-LENT (Fox Chase Modification of Late Effects Normal Tissue Scale) (tab. 1).
Table 1. Stupnice hodnocení chronické gastrointestinální toxicity. 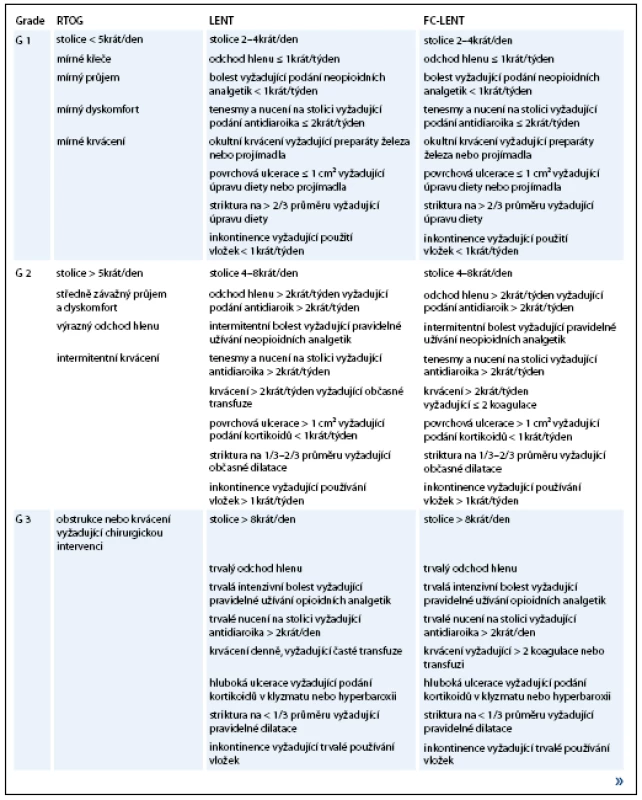
Pokračování tab. 1. 
RTOG – Radiation Therapy Oncology Group, LENT – Late Effects Normal Tissue Scale, FC- LENT – Fox Chase Modification of Late Effects Normal Tissue Scale V publikacích uváděná procenta toxicity se podle použité škály hodnocení mohou lišit až o několik jednotek. Např. ve studii Hanlonové et al [15] se toxicita G3-4 objevuje během 5 let u 0,7% pacientů při hodnocení dle RTOG/EORTC kritérií, u 2% při použití klasifikace LENT a u 6% při použití jimi navržené modifikace FC-LENT.
Pro popis chronických změn může být použita i některá z endoskopických klasifikací, např. Vienna Endoscopy Scoring (tab. 2), stanovená na základě standardního popisu endoskopického nálezu na sliznici rekta [18]. Bývá používána v kombinaci s některým z výše uvedených skórovacích systémů, neboť samostatný endoskopický nález nemusí odpovídat tíži klinických projevů a subjektivním obtížím pacienta. Navíc rektoskopické nebo sigmoideoskopické vyšetření pro pravidelné a dlouhodobé hodnocení toxicity není pro svou invazivitu vhodné.
Table 2. Vienna Rectoscopy Score. 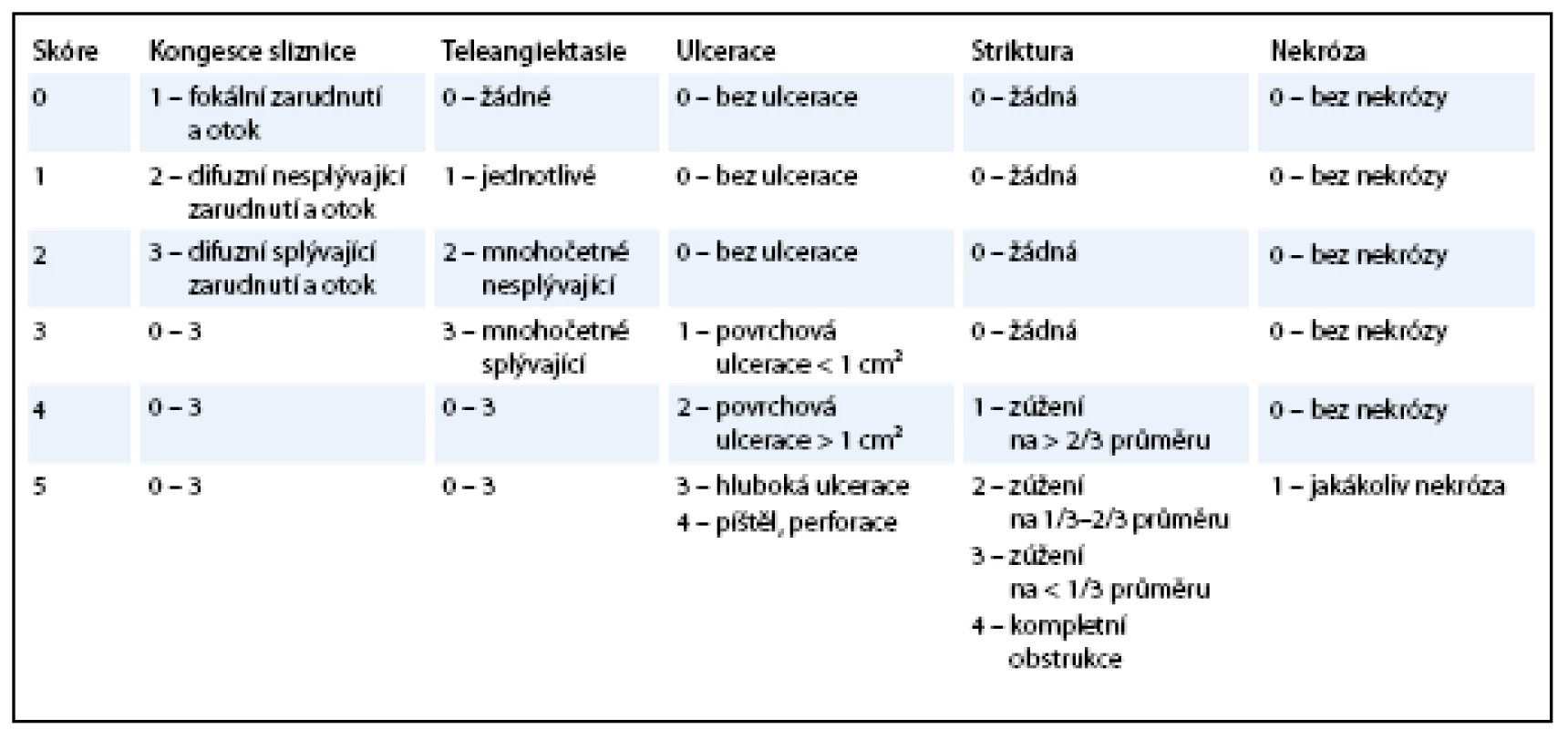
Faktory ovlivňující rozvoj GI toxicity
Faktory vázané na radioterapii
Nejvýznamnějším rizikovým faktorem pro vznik radiačního poškození rekta je aplikovaná dávka záření, respektive absolutní a relativní objem rekta ozářený určitou dávkou, kde významnější roli hrají dávky vyšší. Tento fakt byl potvrzen v mnoha pracích zabývajících se eskalací dávky a různými technikami ozáření.
Vliv jednotlivé dávky byl potvrzen ve studii RTOG 9406, a to hned ve dvou ramenech, kde zvýšení denní dávky o 10% (z 1,8 na 2,0 Gy) vedlo k signifikantnímu vzestupu G2 toxicity (21% při dávce 74 Gy po 2 Gy vs 11% při dávce 79,2 Gy po 1,8 Gy) a mírnému, leč statisticky nevýznamnému zvýšení G3 toxicity [19].
Z hlediska celkové dávky se spolehlivým nástrojem k predikci toxicity ukázal být dávkově objemový histogram (dose volume histogram – DVH), který znázorňuje pokrytí cílového objemu a zatížení vyznačených rizikových orgánů pro každou dávku [10,20–23]. V randomizované studii s eskalací dávky z 68 na 78 Gy [20] byl prokázán významný rozdíl ve výskytu krvácení z rekta a inkontinence stolice. Největší rozdíly DVH pro rektum mezi oběma rameny jsou v dávkách 65–78 Gy, pod 20 Gy jsou křivky shodné, v oblasti 20–65 Gy jsou lehce vyšší dávky v rameni s eskalací na 78 Gy. Jako signifikantní pro výskyt ≥ G2 krvácení z rekta vyšly objemy ozářené do 55, 60 a 65 Gy (V55, V60, V65). Hazard ratio při vzestupu V65 o 1% je 1,052. Ve zmíněné studii byla toxicita ≥ G2 1% u pacientů, kteří měli V65 19% vs 9% u pacientů, kde V65 bylo 43%. Autoři uzavírají, že udržení V65 < 30% vede k rozumné redukci rizika toxicity.
V práci Storeyho et al [21] byl výskyt toxicity 21% pro dávku 78 Gy vs 14% pro dávku 70 Gy. Analýza DVH u pacientů ozářených 78 Gy ukázala korelaci s objemem rekta ozářeného 70 Gy a vyšší dávkou. Pacienti s ≥ 25% rekta ozářeného dávkou ≥ 70 Gy měli riziko komplikací G2 a horších 37%, kdežto pacienti s objemem ozářeným ≥ 70 Gy menším než 25% měli riziko komplikací 13%. Všechny G3 komplikace se objevily u pacientů, kde dávku ≥ 70 Gy obdrželo ≥ 30% objemu rekta. Podobně Boersma et al [22] popisují korelaci DVH s G3 krvácením. Obdobné závěry a doporučení činí ve své práci i Huang et al [10], v jejichž studii se korelace rizika s relativním objemem rekta objevuje pro všechny dávky, absolutní objem rekta hraje roli pouze pro dávky vyšší (70, 75,6 a 78 Gy), riziko komplikací stoupá v závislosti na sledovaných dozimetrických charakteristikách exponenciálně. Autoři pro snížení rizika doporučují dodržovat limity V60 ≤ 40%, V70 ≤ 25%, V75,6 ≤ 15%, V78 ≤ 5%. Pro absolutní objemy pak 75,6 Gy ≤ 4 cm3, 78 Gy ≤ 2 cm3 [10]. O něco přísnější jsou limity vyplývající z práce Fiorina et al [23], kteří jako nejsilnější prediktory pro krvácení z rekta prokázali V40, V70 a předchozí břišní nebo pánevní chirurgický výkon. V limitu pro V60 a V70 se s Huangem et al [10] shodují, pro V75 doporučují udržet objem rekta ozářeného touto dávkou pod 5%.
Pro riziko inkontinence vyžadující používání vložek se jako rizikové ukázalo ozáření stěny análního kanálu [20], kde dávky nad 46 Gy vedou k signifikantnímu zvýšení rizika, zatímco při dávce < 46 Gy je výskyt inkontinence do 10%. Není zde žádná korelace s dávkou na stěnu rekta. Nejsilnějším prediktorem je střední dávka v anu Dmean a anální V65, korelace se ale objevuje pro všechny dozimetrické parametry, proto k minimalizaci rizika je nutné redukovat dávku na nejnižší možnou [20]. Fiorino et al [23] pro riziko inkontinence prokázali vliv V40 a předchozího chirurgického výkonu, doporučují dodržování limitu V40 < 65–70% objemu rekta.
Pro zvýšenou frekvenci stolice (≥ 6krát denně) je signifikantní korelace s objemem ozářeným do dávky 40 Gy a Dmean na anorektum [20] a s předchozím chirurgickým výkonem břišním nebo pánevním [23]. Pro křeče, tenesmy a bolesti G3 nebyla nalezena asociace s DVH [20], opět vyšší riziko se objevuje u pacientů po prodělaném chirurgickém zákroku [23], proto je doporučováno u pacientů po předchozích břišních a pánevních operacích limity pro dávku na rektum dodržovat přísněji, V 70 < 15% [23].
Faktory vázané na pacienta
Ze zkoumaných komorbidit, které by mohly zvyšovat riziko pozdní toxicity, byl v některých studiích prokázán vliv diabetu na vznik G2 toxicity. Ve studii Herolda et al [24] byl rozdíl incidence G2 toxicity u diabetiků a nediabetiků 28% vs 17%. Pro G3 a G4 stupně toxicity nebyl prokázán statisticky významný rozdíl. Jiné práce však vyšší riziko toxicity nepotvrzují [10], sami autoři ale poukazují na to, že populace diabetiků v jejich souboru byla minoritní a nedosahovala počtu potřebného k průkazu významných rozdílů. Riziko GI toxicity signifikantně zvyšuje výskyt hemoroidů před léčbou [10], výskyt GI symptomů před zahájením radioterapie [25], předchozí chirurgické břišní výkony, a to jak pánevní lymfadenektomie pro stanovení stadia, tak i jiné, s tumorem prostaty nesouvisející operace [23,25]. Výskyt radiační proktitidy je též popisován častěji u pacientů s divertikulitidou nebo střevními záněty (Crohnova choroba, colitis ulcerosa), ale počty pacientů s anamnézou těchto chorob jsou příliš malé [26–27]. Jako nezávislý prediktivní faktor se ukazuje i výskyt akutní toxicity. Ve studii Zelefskeho et al [28] je incidence chronické GI toxicity v 10 letech 42% u pacientů, kteří měli projevy akutní toxicity, a 9% u pacientů, kteří akutní projevy neměli. Někteří autoři dokonce v této souvislosti hovoří o chronické toxicitě jako o následku iniciálního poškození tkání [29], ač vysvětlením může být např. i zvýšená reaktivita pacienta k záření, a to jak ve fázi akutní, tak chronické. Přítomnost více rizikových faktorů současně riziko pozdní toxicity násobí [20].
Redukce rizika chronické GI toxicity technikou ozáření
Konvenční vs konformní radioterapie karcinomu prostaty
Konvenční radioterapie byla v kurativní léčbě karcinomu prostaty používána od 70. let 20. století, dostala se ale do pozadí s rozvojem modernějších a bezpečnějších metod. V 80. letech to byla trojrozměrná konformní radioterapie (3D-CRT), jejíž zavedení do praxe bylo možné díky rozšíření počítačové tomografie (CT). V dalším desetiletí se potom rozvíjela radioterapie s modulovanou intenzitou svazku (intensity modulated radiotherapy – IMRT). Obě tyto metody umožňují větší šetření zdravých tkání při doručení stejné nebo dokonce vyšší dávky do cílového objemu (obr. 2 a 3).
Image 2. Dávkově-objemový histogram pro rektum. Porovnání dávkově-objemových histogramů pro rektum při celkové dávce 70 Gy. Znázorněny jsou křivky pro konvenční plán (vpravo), plán konformní (3D-CRT, uprostřed) a plán pro radioterapii s modulovanou intenzitou (IMRT, vlevo). 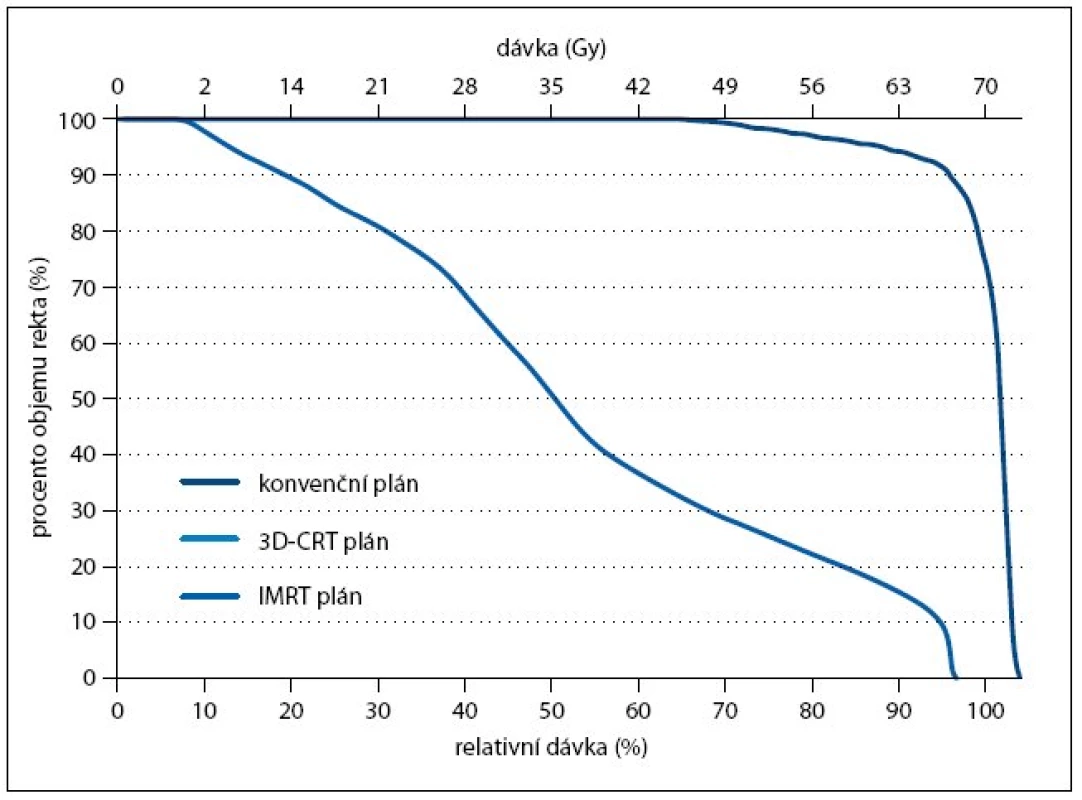
Image 3. Porovnání izodozových plánů pro různé techniky radioterapie. Porovnání izodozových plánů – a) konvenční technika 4 polí (0 °, 90 °, 180 °, 270 °); b) konformní technika (3D- CRT) 4 polí (30 °, 90 °, 270 °, 330 °); c) technika radioterapie s modulovanou intenzitou (IMRT) 5 polí (45 °, 100 °, 180 °, 260 °, 315 °). Všechny plány jsou spočítány pro stejnou celkovou dávku 70 Gy. Hnědě rektum, oranžově prostata (CTV – klinický cílový objem), červeně prostata s lemem 1 cm (PTV – plánovací cílový objem). 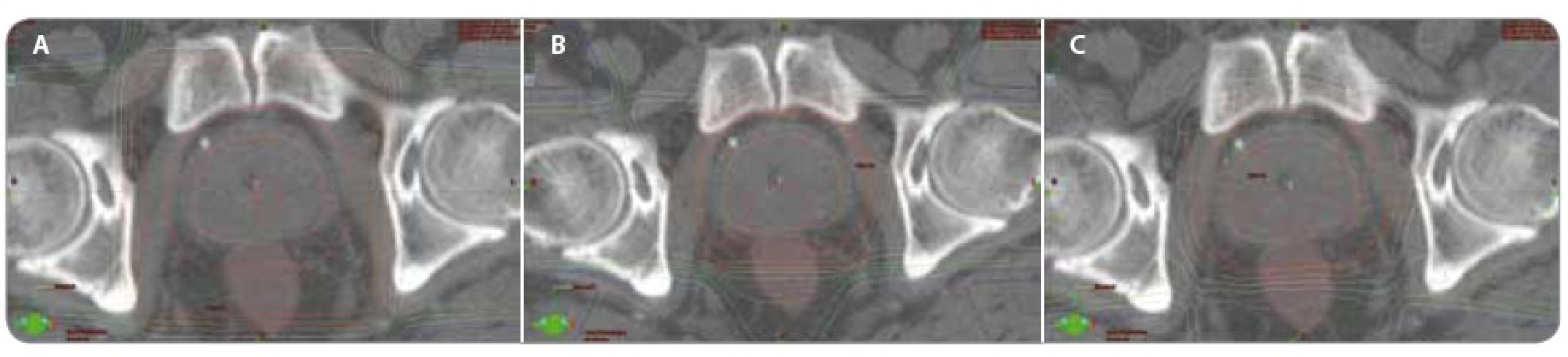
Existuje více prací srovnávajících konvenční a konformní ozáření. Pro ilustraci redukce toxicity je na prvním místě uvedena randomizovaná studie porovnávající toxicitu konvenční a konformní radioterapie při dávce 64 Gy [30]. Mezi oběma rameny nebyly rozdíly v lokální kontrole ani v celkovém přežití, jak lze při stejné dávce předpokládat. V konformních plánech bylo ozářeno o 48% objemu rekta (a 38% objemu močového měchýře) méně než v plánech konvenčních. Toxicita byla hodnocena dle RTOG kritérií. V genitourinární toxicitě ≥ G2 nebyly signifikantní rozdíly. V GI toxicitě bylo nejčastějším projevem krvácení. Gastrointestinální toxicita G1 se objevila u 56% pacientů ozářených konvenční technikou a pouze u 37% ozářených konformně. Nejčastějším projevem bylo krvácení, ≥ G1 se vyskytlo u 51% vs 34%, ≥ G2 u 12% vs 3% pro konvenční vs konformní techniku.
Podobný výskyt toxicity uvádějí i další autoři. Lee et al [31] porovnávali též konvenční a konformní ozáření, přičemž pacienti ozáření konvenční technikou obdrželi dávku 66 Gy, pacienti ozáření 3D-CRT dávku 74 Gy. Toxicita byla hodnocena dle modifikovaných RTOG a LENT kritérií, kde incidence ≥ G2 byla 21% u konvenčních plánů a 1% u 3D-CRT plánů, hodnoceno dle modifikované RTOG/LENT stupnice, 12% vs 1% při hodnocení dle RTOG stupnice.
Rozsáhlý soubor pacientů ozářených konvenční technikou 4 polí, dávkou 50 Gy na pánev s boostem 20 Gy na prostatu přinesla analýza studie EORTC 22 863 určená primárně k vyhodnocení efektu adjuvantní hormonální terapie. GI toxicita se vzhledem k dávce a velikosti polí objevuje u menšího procenta pacientů, než by se dalo očekávat, G2 u 9,5%, G3 u 0,3% pacientů hodnoceno dle RTOG [32].
Obdobné hodnoty pro 3D-CRT 70–74 Gy uvádějí i Huang et al [10], riziko toxicity ≥ G2 25% v 6 letech (G2 21%, G3 6%).
Konvenční radioterapie se ukázala nevhodná pro eskalaci dávky kvůli enormnímu riziku toxicity při dávkách nad 75 Gy. Smit et al [33] ve své práci uvádějí riziko ≥ G2 GI toxicity 22% při dávce na přední stěnu rekta < 70 Gy, 20% při dávce 70–75 Gy, ale 60%, pokud dávka na přední stěnu rekta přesáhla 75 Gy, což je riziko neakceptovatelné.
Konformní vs IMRT radioterapie karcinomu prostaty
Další redukci rizika toxicity přineslo zavedení IMRT do praxe v 90. letech 20. století. Pro porovnání konformní radioterapie a IMRT prostaty neexistuje prospektivní randomizovaná studie, pomineme li data z holandské studie s eskalací dávky na 78 Gy, kde ale porovnání obou metod nebylo primárním cílem. Podskupina ozářená do 78 Gy technikou 3D-CRT se sekvenčním boostem nebo IMRT se simultánním integrovaným boostem (SIB) čítá pouze 78 pacientů, u nichž akutní GI toxicita ≥ G2 byla 61% pro 3D-CRT vs 20% pro IMRT. Pro chronickou toxicitu byl sice výskyt v rameni IMRT nižší (toxicita ≥ G2 21% vs 37%, toxicita G3 0% vs 7%), ale ne statisticky významně [34].
Signifikantních rozdílů dosahují údaje Zelefskeho et al [28], kteří porovnávali data od více než 1 500 pacientů ozářených dávkou 68–81 Gy po 1,8 Gy technikou 3D-CRT nebo IMRT. Toxicita byla hodnocena podle NCI kritérií (National Cancer Institute’s Common Terminology Criteria for Adverse Events, version 3.0). Toxicitu ≥ G2 mělo 6% pacientů, toxicitu G3 1% pacientů. Pravděpodobnost výskytu toxicity ≥ G2 v 10 letech byla 9%, signifikantně méně pro skupinu IMRT oproti 3D-CRT (5% vs 13%). Pro pacienty ozářené dávkou 70,2 Gy to bylo 7%, při dávce 75,6 Gy 18%, při 81 Gy pouze 5%. Pokles v toxicitě při eskalaci dávky na 81 Gy vysvětluje právě použití IMRT u všech pacientů v této podskupině. Riziko G3 toxicity v 10 letech bylo 1%, při použití IMRT < 1%.
Redukce rizika chronické GI toxicity nastavením pacienta při ozáření
Dávka záření, která se dostane na rektum při samotném ozáření, závisí do značné míry na tom, jak dobře je pacient nastaven do plánované polohy. Je jasné, že pokud bude rektum posunuto směrem do ozařovaného objemu, bude dávka vyšší, než jsme předpokládali dle plánovacího CT a než jsme spočítali v námi zvoleném plánu. Existují různé způsoby, jak můžeme tento posun, způsobený chybou v nastavení nebo pohybem vnitřních orgánů, omezit.
Nejjednodušší je korekce nastavení na kostěné struktury, lepší potom korekce nastavení na samotnou prostatu, ať už s použitím kontrastních markerů zavedených do prostaty nebo bez nich. Takovou korekci umožňuje metoda obrazem řízené radioterapie (image-guided radiotherapy – IGRT). Přesné nastavení umožňuje zmenšit bezpečnostní lem nutný k dostatečnému ozáření klinického cílového objemu (clinical target volume – CTV), a tím i objem ozářených okolních zdravých tkání. Jaké lemy je nutno zvolit pro různé typy korekce nastavení, vyhodnocovali Meijer et al [35]. Pokud bylo provedeno nastavení pacienta na značky na kůži bez další korekce, byl by pro dostatečné ozáření CTV u 90% pacientů nutný lem 11mm kolem prostaty a 15mm kolem semenných váčků. Byla li provedena korekce na kostěné struktury, zmenšil se lem na 8 a 13mm. Při korekci na zlatá zrna zavedená do prostaty na 3 a 8mm [35].
Jak vyplývá z výše uvedeného, je nejbezpečnější korekce nastavení na prostatu za použití IGRT, už proto, že orgány v malé pánvi se vůči kostěným strukturám pohybují [36–38]. Největší změny polohy prostaty jsou udávány v předozadním (anterioposteriorní – AP) směru, méně v laterálním (left-right – LF) a kraniokaudálním (superioinferiorní – SI) [36–39]. Ve studii Bylunda et al [36] byl průměrný vektor celkové odchylky 6,7mm. Střední chyba nastavení byla 4,8mm ve směru předozadním, 2,9mm v laterálním a 2,1mm v kraniokaudálním. Ve studii Brittona et al [38] to bylo 3,78cm v AP směru, 1,76cm v RL a 3,14cm v SI směru. V práci Wonga et al [37] mělo odchylku < 3mm, tedy bez nutnosti další korekce, v AP směru 44% pacientů, v LR 65% a v SI 81% pacientů. Pohyblivost semenných váčků je o něco vyšší než pohyblivost samotné prostaty, proto je doporučován větší bezpečnostní lem. V práci Lianga et al [40] za použití IG-IMRT s korekcí na prostatu denně je to 4,5mm na semenné váčky, na prostatu pouze 3mm. Při volbě PTV, případně jeho redukci, je ale nutno brát v úvahu kromě pohybu prostaty mezi frakcemi, který můžeme minimalizovat správnou korekcí, i další faktory, mezi něž patří nepřesnost při konturování CTV, interobserver variabilita (tj. rozdíl kontur zakreslených různými, i když zkušenými radiačními onkology), intraobserver variabilita (tj. rozdíl kontur zakreslených týmž radiačním onkologem s časovým odstupem), nepřesnost provedení fúze při korekci nastavení (fúze na prostatu nebo markery zavedené do prostaty) a konečně pohyb prostaty během ozáření (intrafraction motion – IM). Ten byl již celkem podrobně zdokumentován, odpovídá peristaltice střev a rekta, pohybuje se většinou v řádu několika milimetrů, ale může dosáhnout i více než 1cm. Takovéto velké odchylky se ale objevují výjimečně a mívají velmi krátké trvání, proto není nutno s nimi při stanovování lemu pro PTV počítat [41]. Ve studii Maha et al [41] byla IM < 1mm, Britton et al [38] uvádějí odchylky 0,45mm ve směru LR, 1,08mm v SI a 1,45mm v AP směru, Beltran et al [39] 2,4mm v LR, 3,4mm v SI a 5,2mm v AP směru. Tito autoři ve své práci hodnotili i interobserver variabilitu, která činila ve všech směrech < 0,5mm. Doporučení pro lem kolem CTV zahrnuje součet všech odchylek, v případě práce Beltrana et al [39] (korekce denně na zavedená zlatá zrna) činí doporučené lemy 4,8mm v LR směru, 5,4mm v SI a 5,2mm v AP směru. Z těchto údajů lze soudit, že lem kolem CTV by se při denní korekci na kontrastní markery v prostatě neměl dostat pod 5mm. Je na zvážení každého pracoviště, jaké má technické možnosti redukce chyb v jednotlivých krocích, a tedy jak velký lem kolem CTV by měl být zvolen.
Začínají se objevovat práce porovnávající toxicitu za použití IGRT. Skala et al [42] vyhodnotili toxicitu zpětně za použití dotazníků zaslaných pacientům po skončení ozáření. Návratnost byla 63%, toxicita při dávce 75,6 Gy nebo 79,8 Gy byla G1 25,2%, G2 2,5%, G3 0,7%. Chung et al [43] porovnávali 25 pacientů ozářených na prostatu a pánev ve dvou centrech, v jednom IMRT s lemem 1cm kolem CTV ve všech směrech kromě 0,5cm směrem k rektu, v druhém IG-IMRT s lemem 2–3mm kolem CTV. Dávka na rektum i močový měchýř byla pro IG-IMRT signifikantně nižší, akutní GI toxicita G2 dle RTOG byla 80% vs 13% pro IMRT versus IG-IMRT, zhodnocení chronické toxicity zatím chybí. Obě tyto práce mají bohužel řadu nedostatků – různé dávky záření, malá návratnost dotazníků se zpětným vyhodnocením, kde lze předpokládat větší spolupráci u pacientů, kteří nemají obtíže, malý počet pacientů ve druhé studii, v rameni IMRT pouze 10, kde toxicita u jediného pacienta znamená rozdíl 10%.
Ačkoliv je zřejmé, že využití IGRT umožňuje zmenšit lem kolem CTV, čímž vede k redukci dávky na rizikové orgány, přesvědčivé důkazy o snížení chronické toxicity zatím chybí.
Závěr
Chronická GI toxicita zůstává stále jedním z hlavních problémů zhoršujících kvalitu života pacientů po radikální radioterapii karcinomu prostaty. Její výskyt se podařilo znatelně snížit moderními metodami radioterapie, kdy při dávkách 75–80 Gy dnes standardně používaných je riziko ≥ G2 toxicity 20–25% při použití 3D-CRT a obvykle nižší než 20% při použití IMRT. Při ozáření konvenční technikou by při stejné dávce bylo postiženo minimálně 50% pacientů. Vliv na riziko postižení má i jednotlivá denní dávka záření. Významné rozdíly můžeme pozorovat při použití různých škál hodnocení, z nichž nejpodrobnější, a tím i nejcitlivější, je stupnice FC-LENT, případně ještě doplněná popisem endoskopického obrazu.
Riziko postižení lze predikovat, ale zároveň redukovat pomocí DVH, resp. dodržováním limitů dávky, kterou obdrží určité procento objemu rekta. Z doporučovaných limitů jsou to hlavně objemy V60 ≤ 40%, V70 ≤ 25%, V75 ≤ 5%. Nutno dodat, že u tří čtvrtin pacientů jsou projevy toxicity reverzibilní, reagují na léčbu nebo spontánně mizí během dvou let od svého vzniku.
Slibnou metodou pro snížení toxicity radioterapie obecně se zdá být IGRT, práce potvrzující redukci chronické GI toxicity při radioterapii karcinomu prostaty však zatím chybí.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Jana Šefrová
Klinika onkologie a radioterapie
FN Hradec Králové Sokolská 581
500 05 Hradec Králové
e-mail: sefrova@fnhk.cz
Sources
1. Al-Mamgani A, van Putten WL, Heemsbergen WD et al. Dutch multicenter dose escalation trial of radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72(4): 980–988.
2. Peeters ST, Heemsbergen WD, Koper PC et al. Dose response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol 2006; 24(13): 1990–1996.
3. Zietman AL, DeSilvio ML, Slater JD et. al. Comparison of conventional dose vs high dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA 2005; 294(10): 1233–1239.
4. Dearnaley DP, Sydes MR, Graham JD et al. Escalated dose versus standard dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007; 8(6): 475–487.
5. Zelefsky MJ, Leibel SA, Gaudin PB et al. Dose escalation with three-dimensional conformal radiation therapy affects the outcome in prostate cancer. Int J Radiat Oncol Biol Phys 1998; 41(3): 491–500.
6. Zelefsky MJ, Yamada Y, Fuks Z et al. Long term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases free survival outcomes. Int J Radiat Oncol Biol Phys 2008; 71(4): 1028–1033.
7. Jacob R, Hanlon AL, Horwitz EM et al. The relationship of increasing radiotherapy dose to reduced distant metastases and mortality in men with prostate cancer. Cancer 2004; 100(3): 538–543.
8. Perez CA, Brady LW, Halperin EC et al (eds). Principles and Practice of Radiation Oncology. 4th ed. Philadelphia: Lippincott Williams&Wilkins 2004 : 357–361, 379–383.
9. Garg AK, Mai WY, McGary JE et al. Radiation proctopathy in the treatment of prostate cancer. Int J Radiat Oncol Biol Phys 2006; 66(5): 1294–1305.
10. Huang EH, Pollack A, Levy L et al. Late rectal toxicity: dose volume effects of conformal radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 2002; 54(5): 1314–1321.
11. Pilepich MV, Krall J, George FW et al. Treatment related morbidity in phase III RTOG studies of extended-field irradiation for carcinoma of the prostate. Int J Radiat Oncol Biol Phys 1984; 10(10): 1861–1867.
12. Cho KH, Lee CK, Levitt SH. Proctitis after conventional external radiation therapy for prostate cancer: importance of minimizing posterior rectal dose. Radiology 1995; 195(3): 699–703.
13. Gilinsky NH, Burns DG, Barbezat GO et al. The natural history of radiation induced proctosigmoiditis: an analysis of 88 patients. Q J Med 1983; 52(205): 40–53.
14. Teshima T, Hanks GE, Hanlon AL et al. Rectal bleeding after conformal 3D treatment of prostate cancer: time to occurrence, response to treatment and duration of morbidity. Int J Radiat Oncol Biol Phys 1997; 39(1): 77–83.
15. Hanlon AL, Schultheiss TE, Hunt MA et al. Chronic rectal bleeding after high dose conformal treatment of prostate cancer warrants modification of existing morbidity scales. Int J Radiat Oncol Biol Phys 1997; 38(1): 59–63.
16. Cox JD, Stetz J, Pajak TF et al. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995; 31(5): 1341–1346.
17. Pavy JJ, Denekamp J, Letschert J et al. EORTC Late Effects Working Group. Late Effects toxicity scoring: the SOMA scale. Int J Radiat Oncol Biol Phys 1995; 31(5): 1043–1047.
18. Wachter S, Gerstner N, Goldner G et al. Endoscopic scoring of late rectal mucosal damage after conformal radiotherapy for prostatic carcinoma. Radiother Oncol 2000; 54(1): 11–19.
19. Michalski JM, Winter K, Purdy JA et al. Toxicity after three-dimensional radiotherapy for prostate cancer on RTOG 9406 dose Level V. Int J Radiat Oncol Biol Phys 2005; 62(3): 706–713.
20. Peeters ST, Lebesque JV, Heemsbergen WD et al. Localized volume effects for late rectal and anal toxicity after radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 2006; 64(4): 1151–1161.
21. Storey MR, Pollack A, Zagars G et al. Complications from radiotherapy dose escalation in prostate cancer: preliminary results of a randomized trial. Int J Radiat Oncol Biol Phys 2000; 48(3): 635–642.
22. Boersma LJ, van den Brink M, Bruce AM et al. Estimation of the incidence of late bladder and rectum complications after high dose (70–78 GY) conformal radiotherapy for prostate cancer, using dose volume histograms. Int J Radiat Oncol Biol Phys 1998; 41(1): 83–92.
23. Fiorino C, Fellin G, Rancati T et al. Clinical and dosimetric predictors of late rectal syndrome after 3D-CRT for localized prostate cancer: preliminary results of a multicenter prospective study. Int J Radiat Oncol Biol Phys 2008; 70(4): 1130–1137.
24. Herold DM, Hanlon AL, Hanks GE. Diabetes mellitus: a predictor for late radiation morbidity. Int J Radiat Oncol Biol Phys 1999; 43(3): 475–479.
25. Peeters ST, Heemsbergen WD, van Putten WL et al. Acute and late complications after radiotherapy for prostate cancer: results of a multicenter randomized trial comparing 68 Gy to 78 Gy. Int J Radiat Oncol Biol Phys 2005; 61(4): 1019–1034.
26. Willett CG, Ooi CJ, Zietman AL et al. Acute and late toxicity of patients with inflammatory bowel disease undergoing irradiation for abdominal and pelvic neoplasms. Int J Radiat Oncol Biol Phys 2000; 46(4): 995–998.
27. Song DY, Lawrie WT, Abrams RA et al. Acute and late radiotherapy toxicity in patients with inflammatory bowel disease. Int J Radiat Oncol Biol Phys 2001; 51 : 455–459.
28. Zelefsky MJ, Levin EJ, Hunt M et al. Incidence of late rectal and urinary toxicities after three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70(4): 1124–1129.
29. Heemsbergen WD, Peeters ST, Koper PC et al. Acute and late gastrointestinal toxicity after radiotherapy in prostate cancer patients: consequential late damage. Int J Radiat Oncol Biol Phys 2006; 66(1): 3–10.
30. Dearnaley DP, Khoo VS, Norman AR et al. Comparison of radiation side-effects of conformal and conventional radiotherapy in prostate cancer: a randomised trial. Lancet 1999; 353(9149): 267–272.
31. Lee CM, Lee RJ, Handrahan DL et al. Comparison of late rectal toxicity from conventional versus three-dimensional conformal radiotherapy for prostate cancer: analysis of clinical and dosimetric factors. Urology 2005; 65(1): 114–119.
32. Ataman F, Zurlo A, Artignan X et al. Late toxicity following conventional radiotherapy for prostate cancer: analysis of the EORTC trial 22863. Eur J Cancer 2004; 40(11): 1674–1681.
33. Smit WG, Helle PA, van Putten WL et al. Late radiation damage in prostate cancer patients treated by high dose external radiotherapy in relation to rectal dose. Int J Radiat Oncol Biol Phys 1990; 18(1): 23–29.
34. Al-Mamgani A, Heemsbergen WD, Peeters ST et al. Role of intensity-modulated radiotherapy in reducing toxicity in dose escalation for localized prostate cancer. Int J Radiat Oncol Biol Phys 2009; 73(3): 685–691.
35. Meijer GJ, de Klerk J, Bzdusek K et al. What CTV-to-PTV margins should be applied for prostate irradiation? Four-dimensional quantitative assessment using model based deformable image registration techniques. Int J Radiat Oncol Biol Phys 2008; 72(5): 1416–1425.
36. Bylund KC, Bayouth JE, Smith MC et al. Analysis of interfraction prostate motion using megavoltage cone beam computed tomography. Int J Radiat Oncol Biol Phys 2008; 72(3): 949–956.
37. Wong JR, Gao Z, Uematsu M et al. Interfractional prostate shifts: review of 1 870 computed tomography (CT) scans obtained during image-guided radiotherapy using CT-on-rails for the treatment of prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72(5): 1396–1401.
38. Britton KR, Takai Y, Mitsuya M et al. Evaluation of inter - and intrafraction organ motion during intensity modulated radiation therapy (IMRT) for localized prostate cancer measured by a newly developed on-board image-guided system. Radiat Med 2005; 23(1): 14–24.
39. Beltran C, Herman MG, Davis BJ. Planning target margin calculations for prostate radiotherapy based on intrafraction and interfraction motion using four localization methods. Int J Radiat Oncol Biol Phys 2008; 70(1): 289–295.
40. Liang J, Wu Q, Yan D. The role of seminal vesicle motion in target margin assessment for online image-guided radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 2009; 73(3): 935–943.
41. Mah D, Freedman G, Milestone B et al. Measurement of intrafractional prostate motion using magnetic resonance imaging. Int J Radiat Oncol Biol Phys 2002; 54(2): 568–575.
42. Skala M, Rosewall T, Dawson L et al. Patient-assessed late toxicity rates and principal component analysis after image-guided radiation therapy for prostate cancer. Int J Radiat Oncol Biol Phys 2007; 68(3): 690–698.
43. Chung HT, Xia P, Chan LW et al. Does image-guided radiotherapy improve toxicity profile in whole pelvic treated high risk prostate cancer? Comparison between IG-IMRT and IMRT. Int J Radiat Oncol Biol Phys 2009; 73(1): 53–60.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2009 Issue 5-
All articles in this issue
- Proteomická analýza nádorových buněk
- Studie evaporace vybraných cytostatik a propustnosti ochranných rukavic v rámci výzkumu profesní zátěže zdravotnických pracovníků exponovaných cytotoxickým protinádorovým léčivům (projekt CYTO)
- Profily nízkomolekulárního proteomového spektra získané pomocí hmotnostní spektrometrie SELDI-TOF v sérech pacientů s diseminovaným maligním melanomem: pilotní studie
- Chronická gastrointestinální toxicita po zevní radioterapii karcinomu prostaty
- Úvaha nad vývojem screeningu kolorektálního karcinomu
- Pohled na vývoj onkologie ve 3. tisíciletí
- Neuroendokrinní nádory rekta
- DNA a mikroRNA čipové technologie v diagnostice a predikci u pacientů s renálním karcinomem
- Polymorfizmus –2548 G/A v genu pro leptin u pacientek s endometriálním karcinomem
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neuroendokrinní nádory rekta
- Chronická gastrointestinální toxicita po zevní radioterapii karcinomu prostaty
- Studie evaporace vybraných cytostatik a propustnosti ochranných rukavic v rámci výzkumu profesní zátěže zdravotnických pracovníků exponovaných cytotoxickým protinádorovým léčivům (projekt CYTO)
- Proteomická analýza nádorových buněk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

