-
Medical journals
- Career
Využití PET/CT vyšetření při plánování radioterapie nádorů ORL oblasti
: I. Kolářová 1; J. Vaňásek 1; K. Odrážka 1; L. Petruželka 2; M. Doležel 1; J. Nechvíl 1
: Oddělení radiační a klinické onkologie, Multiscan, s. r. o., Pardubice 2Onkologická klinika 1. LF UK Praha 1
: Klin Onkol 2009; 22(3): 98-103
: Original Articles
Východiska:
Použití konformních ozařovacích technik a IMRT (Intensity Modulated Radiotherapy, radioterapie s modulovanou intenzitou svazku) dovolují zvýšení dávky v cílovém objemu a šetří okolní zdravé tkáně. Ve srovnání s konvenčními postupy však vyžadují přesnější konturování cílových objemů, k čemuž je potřeba využít všechny vhodné diagnostické metody. Základní zobrazovací metodou zůstává CT vyšetření, které dovoluje výpočet dávky záření. Nové možnosti přináší pozitronová emisní tomografie (PET), která doplňuje morfologické zobrazení o funkční pohled. Cílem naší studie je zhodnotit přínos použití fúze PET/CT u nemocných ozařovaných na pracovišti pro tumory hlavy a krku.Soubor pacientů a metody:
Hodnotili jsme soubor 40 pacientů s karcinomy v oblasti hlavy a krku léčených radikální radioterapií. Jedná se o 30 mužů a 10 žen, průměrný věk 56, rozmezí 34–81 let. U 10 pacientů se jednalo o pooperační radioterapii, u 30 pacientů o primární radioterapii. Ozařovali jsme X paprsky 6MeV technikou IMRT metodou integrovaného boostu.Výsledky:
Z celkového počtu 40 pacientů byl u 20 nález na diagnostickém CT a plánovacím PET/CT shodný. V šesti případech (15%) jsme nalezli pomocí PET/CT větší rozsah postižení lymfatických uzlin, naopak menší rozsah uzlinového postižení jsme detekovali ve třech případech (7,5%). V oblasti primárního ložiska došlo ke změně klasifikace u dvou pacientů (5%), v obou případech ke zvětšení objemu. Ve dvou případech s pozitivním histopatologickým nálezem resekčních okrajů byl PET/CT negativní. V našem souboru v 11 případech (27,5%) PET/CT vyšetření změnilo cílový objem a ve třech případech terapeutický záměr.Závěr:
Testovali jsme použití PET/CT vyšetření pro plánování radioterapie. Metodu jsme zavedli jako standardní postup plánování terapie tumorů hlavy a krku.Klíčová slova:
pozitronová emisní tomografie – radioterapie – plánování počítačové – hlava a krk – nádory – IMRTÚvod
Zavedení technik konformní radioterapie a radioterapie s modulovanou intenzitou svazku (IMRT) dovoluje ve srovnání s konvenčním ozařováním efektivně šetřit zdravé tkáně, především oblast příušních žláz, míchy, mandibuly, chiazmatu a mozku. Výsledkem je snížení nežádoucích účinků, především xerostomie, a tím zlepšení kvality života [1–4].
Možnost zvýšit dávku na oblast nádorového postižení pak umožňuje současné zlepšení lokální a regionální kontroly a prodloužení přežití [5–7].
Zvýšení dávky, resp. snížení počtu komplikací, je umožněno díky lepší shodě tvaru cílového a ozářeného objemu, což ve většině případů výrazně snižuje objem ozářených zdravých tkání. Tato skutečnost však vyžaduje, ve srovnání s konvenčními technikami, zvýšenou přesnost zaměření cílového objemu. Ke snížení rizika recidivy tumoru je proto potřebné využívat všechny vhodné diagnostické postupy.
Základní zobrazovací technikou pro plánování radioterapie zůstává počítačová tomografie (CT), která jediná dovoluje výpočet rozložení dávky ionizujícího záření v těle pacienta. Další metodou využívající morfologického zobrazení je magnetická rezonance (MR). Nové možnosti přináší pozitronová emisní tomografie (PET). Ta doplňuje morfologický obraz o funkční pohled zobrazením oblastí se zvýšenou metabolickou aktivitou, resp. se zvýšenou akumulací radiofarmaka.
PET je diagnostická zobrazovací technika založená na použití biologicky aktivních sloučenin značených krátkodobými radionuklidy emitujícími pozitrony jako 11C, 13N, 15O a 18F. Za určitou dobu se radionuklid akumuluje v oblasti těla, pro kterou má molekula biologicky aktivní sloučeniny požadovanou afinitu. Je to např. glukóza značená 11C (poločas 20 min) nebo nejčastěji analog glukózy značený 18F, tj. 2-[18F]fluoro 2-deoxy-D-glukóza (18FDG) s poločasem 1,8 hod.
V současnosti je 18FDG PET využívána především u nemalobuněčných tumorů plic, maligních lymfomů, melanomů, tumorů hlavy a krku, gynekologických karcinomů a kolorektálního karcinomu [8,9]. Další možností využití je karcinom prsu, kde lze monitorovat odpověď na terapii a provádět restaging, případně ještě karcinom štítné žlázy, který neakumuluje 131I. Senzitivita a specificita PET vyšetření v onkologii je velmi vysoká a udává se 84–87% (vyšetření 18 402 nemocných) a specificita 88–93% (vyšetření 14 264 nemocných) [10].
U tumorů hlavy a krku se uvádí senzitivita 90% a specificita 94%, což je ve srovnání s možnostmi CT, kde je senzitivita 82% a specificita 85%, podstatně více. U magnetické rezonance jsou udávány hodnoty senzitivity 80% a specificity 79% [11].
Nové možnosti zlepšení diagnostiky díky PET a získání dokonalejších podkladů pro plánování léčby zářením vedly k jejímu zavedení do plánování radioterapie. Odhaduje se, že v důsledku využití PET vyšetření v plánovacím procesu je změněno 30–40% ozařovacích plánů [12].
V současné době prochází velkým rozvojem hybridní PET/CT systémy, které umožňují tzv. hardwarovou fúzi PET a CT obrazu při zajištění adekvátní geometrické přesnosti a podmínek snímání. O problematice přesnosti a přínosu PET/CT se diskutuje v odborné literatuře, která nabízí širokou paletu výsledků a názorů [12].
Na našem pracovišti jsme se zaměřili na využití PET/CT fúze především při plánování radioterapie tumorů hlavy a krku. Z literárních údajů vyplývá, že při plánování s pomocí této techniky se obvykle významně mění cílový objem. Dalším ziskem je to, že do PET pozitivních oblastí lze aplikovat denní dávku zvýšenou o 10–20% [13].
Pro využití fúze PET/CT při plánování radioterapie je třeba splnit řadu technických podmínek a provést zajištění kvality získání dat, jejich přenosu a dalšího zpracování. Základní požadavky na využití údajů z PET/CT přístroje pro plánování radioterapie jsou kompatibilita dat, verifikace shody parametrů v diagnostickém a plánovacím systému, respektive odstranění neshod mezi systémy (diagnostickým a plánovacím) [14].
Cílem našeho sdělení je zhodnotit přínos použití fúze PET/CT na souboru nemocných ozařovaných na našem pracovišti pro tumory hlavy a krku.
Soubor nemocných a metodika
Hodnotili jsme soubor 40 nemocných léčených v období od 7/2006 do 3/2008. Jedná se o soubor 30 mužů a 10 žen, průměrný věk 56, rozmezí 34–81 let. Histologicky ve 37 případech jde o dlaždicobuněčný karcinom, jeden pacient měl histologický nález adenoidně cystického karcinomu, u jednoho pacienta šlo o lymfoepiteliom, u jednoho pacienta byl zjištěn kulatobuněčný karcinom. U 10 pacientů se jednalo o pooperační radioterapii, u 30 pacientů o primární kurativní radioterapii. Rozdělení souboru podle lokalizací je uvedeno v tab. 1.
1. Rozdělení nemocných podle lokalizace postižení. 
Přístrojové vybavení
Při radioterapii a jejím plánování s použitím fúze PET/CT užíváme TPS Eclipse Varian s modulem pro inverzní plánování Helios, CT simulátor GE HiSpeed NX/I Plus, PET/CT scanner Siemens Biograph duo LSO umístěný v PET centru Nemocnice Na Homolce Praha.
Zajištění shodné polohy pacienta při zaměření i ozáření
Odlišný tvar desky stolu diagnostického přístroje a ozařovače vyžaduje použití vyrovnávací desky, která je zhotovena z vhodného rentgen nekontrastního materiálu. Vzhledem k tomu, že PET/CT vyšetření slouží přímo pro plánování radioterapie, je třeba použít všechny fixační pomůcky, které bude mít pacient i při vlastním ozařování. Proto se jejich primární výběr provádí již s ohledem na omezené rozměry PET/ CT gantry (obr. 1).
1. Fixační pomůcky používané při snímkování pomocí PET/CT a následně při ozařování. 
Laserový poziční systém
Laserový poziční systém je nezbytný pro stanovení referenčního bodu s koordináty [0,0,0] („nulový bod“), od nějž je vypočtena vzdálenost izocentra. Lze využít vnitřní laserový systém přístroje za podmínky přítomnosti laserů ve všech třech rovinách a jejich kalibrace provedené tak, aby izocentrum laserů odpovídalo izocentru CT gantry.
V našem případě nemá izocentrum gantry CT/PET přístroje koordináty 0,0,0 v osách x,y,z, a proto je třeba před simulací pro nastavení pacienta do referenčního (nulového) bodu provést korekci posunem o rozdílovou hodnotu. Ověření přesnosti laserového pozičního systému na fantómu je nezbytnou podmínkou pro využití údajů z PET/CT pro plánování.
Simulace a přenos dat
Při plánování radioterapie používáme standardní postup obvyklý při virtuální simulaci. Zakreslení polohy referenčního nulového bodu na pacienta, resp. na fixační pomůcky, provádíme laserovým pozičním systémem virtuálního simulátoru. Toto zakreslení se využívá při PET/CT vyšetření a je na ně zaměřen laserový poziční systém přístroje. Pro diagnostické účely je u PET/CT používán původní software výrobce, který provádí automatickou fúzi.
Vstupní data pro výpočet obrazu přejímáme z PET/CT skeneru. Na fúzovaných skenech jsou v plánovacím systému zakresleny cílové objemy, rizikové orgány (obr. 2) a nakonec vypracován ozařovací plán (obr. 3).
2. Zakreslení cílových objemů a kritických orgánů v PET/CT snímku. 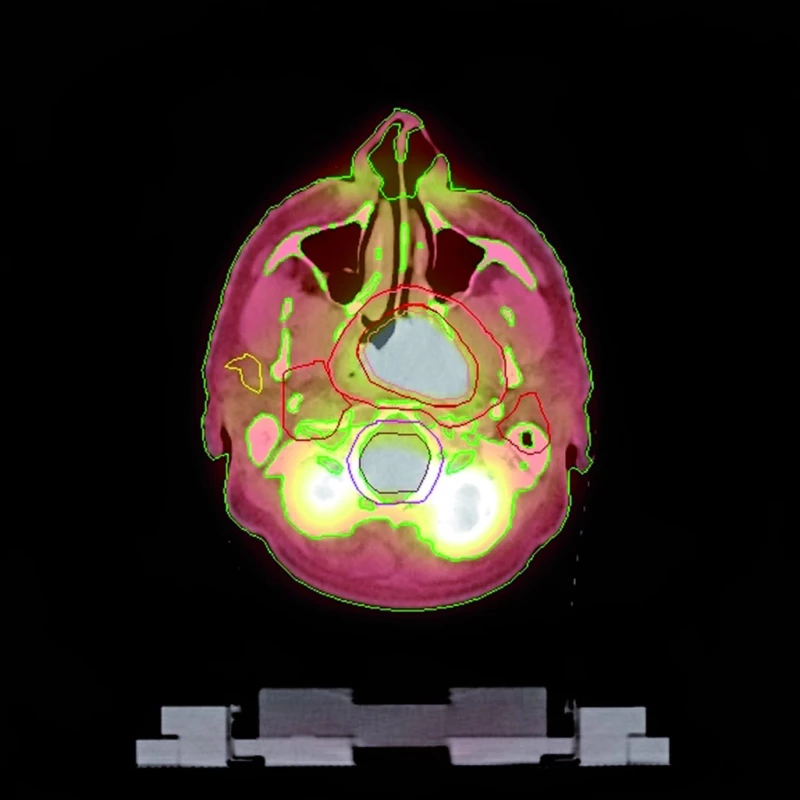
3. Výsledný izodozový plán techniky IMRT ve stejném řezu. 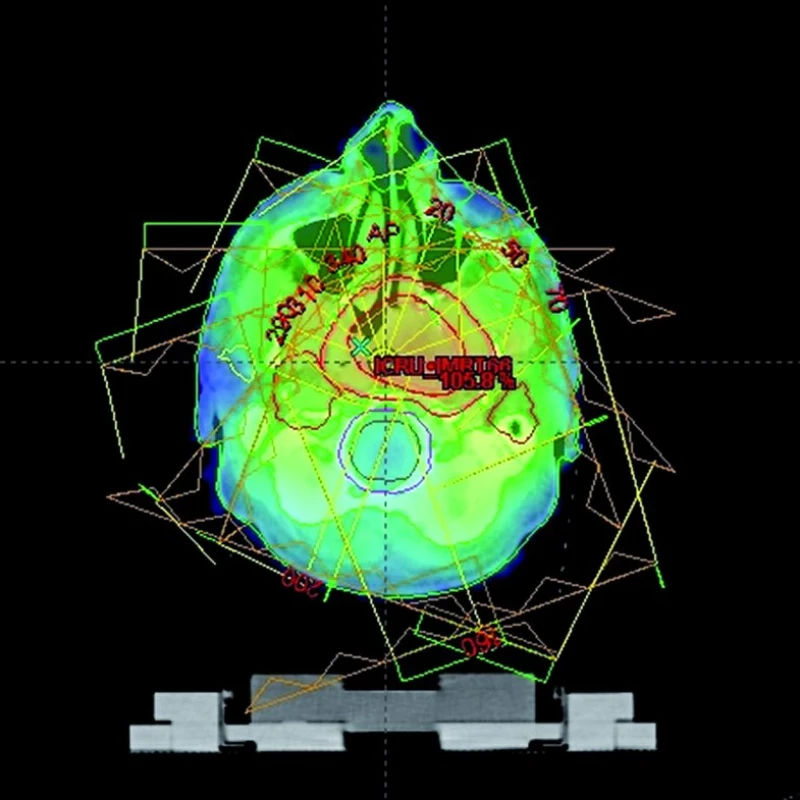
Přenos polohy izocentra z plánu na nemocného (vzdálenosti od tzv. „nulového bodu“) probíhá na CT simulátoru pomocí laserového pozičního systému. Ze snímků provedených na virtuálním simulátoru ověřujeme přesnost polohy izocentra. K další kontrole správnosti zaměření dochází při vlastním ozáření pomocí portálového zobrazovacího systému, resp. IGRT (Image Guided Radiotherapy).
Výsledky
V hodnoceném souboru jsme zjistili změny vyplývající z doplnění konvenčního stagingu o PET/CT vyšetření.
Změna terapeutického záměru: třikrát byly nově zjištěny vzdálené metastázy, což vedlo ke změně léčebného záměru.
Změna cílového objemu: provedení PET/CT v rámci plánování radioterapie mělo v 11 případech (27,5%) vliv na určení rozsahu postižení T a N, a tím současně i na cílový objem. V šesti případech (15%) jsme nalezli pomocí PET/CT větší rozsah postižení lymfatických uzlin, naopak menší rozsah uzlinového postižení jsme detekovali ve třech případech (7,5%). V oblasti primárního ložiska došlo ke změně klasifikace u dvou pacientů (5%), v obou případech ke zvětšení tumoru. Podrobný popis změn je uveden v tab. 2.
2. Změna cílového objemu v oblasti uzlinového postižení a primárního tumoru v důsledku PET/CT nálezu. 
Ve čtyřech případech diagnostikem popsaný pozitivní PET nález neměl korelaci s ostatními vyšetřeními, tj. nepodařilo se jej verifikovat dalšími zobrazovacími metodami ani klinickým vyšetřením, včetně odběru biopsie. U dvou nemocných, kde byly v histopatologickém nálezu popsány pozitivní okraje, byl PET/CT nález negativní. U 20 (50%) pacientů byla zjištěna shoda s konvenčním stagingem i při PET/CT vyšetření.
Diskuze
V našem souboru 40 nemocných jsme zjistili změnu léčebného plánu v důsledku použití PET/CT vyšetření v 14 případech (35%). Nejzávažnější byly tři případy, kdy byly nově objeveny vzdálené metastázy, což vedlo ke změně léčebného záměru z radikální terapie na paliativní. V jednom případě došlo ke změně klasifikace uzlinového postižení z N2c na N1. Naopak přítomnost postižení uzlin jsme nalezli ve třech případech, kdy původní klasifikace byla N0. Větší rozsah uzlinového postižení jsme detekovali ve třech případech. V oblasti primárního tumoru došlo ke změně klasifikace u dvou pacientů, v obou případech ke zvětšení rozsahu. Ve dvou případech byly zvětšené lymfatické uzliny hodnoceny na PET/CT jako negativní, to znamená jako reaktivní lymfadenopatie bez nádorového postižení.
Výsledky studií zaměřených na využití PET/CT při plánování radioterapie tumorů hlavy a krku jsou podobné výsledkům z naší práce. Koshy at al publikovali údaje, z nichž vyplývá změna stadia podle TNM klasifikace v oblasti T a N v 36% a 14%, u cílových objemů pak změnu ve 14% a 11% případů. Závěrem práce je sdělení, že PET/CT fúze může mít signifikantní vliv na staging tumoru a stanovení cílového objemu i dávky pro radioterapii [15].
Role PET a PET/CT při určení léčebného záměru u časných i pokročilých tumorů hlavy a krku byla studována na souboru 36 nemocných a publikována autory z Johns Hopkins University, Baltimore [16]. Léčebný plán se nezměnil u 25 nemocných (69%), změna byla u 11 nemocných (31%). Z těchto 11 bylo u 6 zjištěno vyšší stadium tumoru. U počínajících tumorů ke změně došlo u 4 nemocných z 8, zatímco u pokročilých u 7 z 28. Mezi 18 operovanými pacienty PET/CT určilo rozsah primárního tumoru správně u všech 18, kdežto u lymfatického postižení bylo histopatologicky ověřené shodné stadium jen u 9 z 16.
Heron at al publikovali soubor 21 nemocných s tumory hlavy a krku vyšetřených pomocí hybridního PET/CT přístroje. Hodnotili velikosti cílových objemů stanovené pomocí PET v oblasti primárního tumoru (GTVp), lymfatických uzlin, abnormal nodal region (ABNp) a stejné objemy zakreslené pomocí CT – GTVc a ABNc. Statistická analýza ukázala, že průměrný poměr mezi GTVc/GTVp byl 3,1 (rozmezí 0,3–23,6), zatímco pro ABNc/ABNp byl 0,7 (rozmezí 0–4). Objemy primárních tumorů tedy byly signifikantně větší na CT než na PET (p = 0,002). Zmenšení objemu uzlinové oblasti v důsledku provedení PET vyšetření však nebylo signifikantní (p = 0,5). Autoři uzavírají, že hybridní PET/CT vyšetření přináší přesnější odlišení nepostižených oblastí od nádorem postižených. Významnou skutečností je, že v oblasti cílového objemu stanoveného pomocí CT (GTVc) není často zahrnut celý tumor prokazatelný pomocí PET (GTVp). Použití PET/CT tedy může zlepšit terapeutický efekt léčby tumorů hlavy a krku technikou IMRT [17].
Jak vyplývá z našich výsledků i literárních údajů, použití fúze PET/CT přináší při stanovení cílového objemu pro plánování radioterapie oproti konvenčnímu CT vyšetření řadu výhod. CT na rozdíl od morfologického i funkčního zobrazení pomocí PET/CT většinou nedává přesnou informaci o rozsahu nádorového postižení.
Přesto je třeba si uvědomit, že PET/CT vyšetření není bez rizika špatné interpretace vedoucí k nesprávnému určení cílového objemu. Při vyšetření je nezbytné dodržet určité zásady. Pacient musí být vyšetřen nalačno, abychom předešli falešně negativním výsledkům. Problémy vznikají u diabetiků při vyšších hodnotách glykemie. Pacient musí při vyšetření dobře spolupracovat, protože vyšetření je značně časově náročné. Nezbytně nutná je interpretace nálezu kvalifikovaným diagnostikem, který jediný může odlišit fyziologické variace akumulace glukózy. Zvýšené vychytávání radionuklidu je časté v oblasti slinných žláz, svalů, tuku a lymfatické tkáně [18].
Standardní cílové objemy jsou stále základem plánování radioterapie, protože ani tak senzitivní vyšetření, jakým je PET/CT, nemůže odhalit mikroskopické nádorové postižení. Proto je málo pravděpodobné, že by toto vyšetření dovolilo změnit plánovací cílový objem (PTV) ozařované profylakticky. Přínosem je možnost jeho využití pro přesnější zacílení boostu. Další možností je využití IMRT pro diferencované rozložení dávky v závislosti na rozsahu nádorového postižení [13].
Perspektivně může PET přinést důležité informace o radiobiologických vlastnostech tumoru, jako je přítomnost a lokalizace hypoxických oblastí nebo oblasti se zvýšenou proliferací. Jsou pro tento účel testovány nové biologicky aktivní látky [19,20].
Závěr
Testovali jsme použití PET/CT vyšetření jako metody pro simulaci a využití získaných dat jako základu výpočtu rozložení dávky. Vytvořili jsme postup pro zajištění shodné polohy pacienta při zaměření i ozáření, verifikovali jsme možnost použití laserového pozičního systému, možnosti přenosu dat do plánovacího systému a jejich dalšího zpracování při fúzi obrazu. Postup plánování radioterapie s využitím dat z PET/CT skeneru se ukázal být technicky zvládnutelný, stejně jako následné zaměření izocentra pomocí CT simulátoru.
V řadě případů PET/CT vyšetření zásadním způsobem mění terapeutický záměr nebo cílový objem. Klinický přínos tohoto postupu spočívá v tom, že detekuje postižené oblasti, které nebyly identifikovány pomocí CT, což lze využít pro přesnější zacílení boostu. Tím se zvyšuje pravděpodobnost snížení počtu lokálních recidiv.
Děkujeme pracovišti PET centra Nemocnice Na Homolce, především panu doc. MUDr. O. Bělohlávkovi, CSc., za spolupráci.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Iveta Kolářová
Komplexní onkologické centrum Pardubice
Pardubická krajská nemocnice, a.s.
Radiologické centrum Multiscan, s.r.o.
Kyjevská 44
532 03 Pardubice
e-mail: kolarova@multiscan.cz
Sources
1. Eisbruch A. Clinical aspects of IMRT for head and neck cancer. Med Dosim 2002; 27 : 99–104.
2. Chao KS, Deasy JO, Markman J et al. A prospective of salivary function sparing in patients with head and neck cancers receiving intesity – modulated or three dimensional radiation therapy: Initial results. Int J Radiat Oncol Biol Phys 2001; 49 : 907–916.
3. Lin A, Kim HM, Terrell JE et al. Qualit of life after parotid-sparing IMRT for head-and-neck cancer: A prospective longitudinal study. Int J Radiat Oncol Biol Phys 2003; 57 : 61–70.
4. Odrazka K, Petera J, Zouhar M et al. Clinical results of intensity-modulated radiation therapy (IMRT) for tumors of the head and neck region. Neoplasma 2005; 52 : 85–94.
5. Lee N, Puri DR, Blanco AI et al. Intensity-modulated radiation therapy in head and neck cancers: An update. Head Neck 2005; 29(4): 387–400.
6. Xia P, Fu KK, Wong GW et al. Comparison of treatment plans involving intensity-modulated radiotherapy for nasopharyngeal carcinoma. Int J Radiat Oncol Biol Phys 2000; 48 : 329–337.
7. Lee N, Xia P, Quivey JM et al. Intensity modulated radiotherapy in the treatment of nasopharyngeal carcinoma: an update of the UCSF experience. Int J Radiat Oncol Biol Phys 2002; 53 : 12–22.
8. Horová H, Hynková L, Košťáková Š et al. Využití pozitronové emisní tomografie v radioterapii. Klin Onkol 2004; 17(6): 201–202.
9. Dolezelová H, Slampa P. The impact of positron emission tomography in the radiotherapy treatment planning. Neoplasma 2007; 54(2): 95–100.
10. Gambhir SS, Czernin J, Schwimmer J et al. A tabulated summary of the FDG PET literature. J Nucl Med 2001; 42 : 1S–93S.
11. Adams S, Baum R, Stuckensen T et al. Prospective comparison of 18-FDG PET with conventional imaging modalities (CT, MRI, US) in lymph node staging of head and neck cancer. Eur J Nucl Med 1998; 25 : 1255–1260.
12. Bujenovic S. The role of positron emission tomography in radiation treatment planning. Semin Nucl Med 2004; 34 : 293–299.
13. Solberg T, Agazaryan N, Goss B et al. A feasibility study of 18F-fluorodeoxyglucose positron emission tomography targeting and simultaneous integrated boost for intensity-modulated radiosurgery and radiotherapy. J Neurosurg 2004; Suppl 3 : 381–389.
14. Vaňásek J, Kolářová I, Kudelka K et al. Využití PET/CT vyšetření při plánování radioterapie – technické poznámky. Radiační onkologie 2006; 6 : 27–29.
15. Koshy M, Paulino AC, Howell R et al. F-18 FDG PET-CT fusion in radiotherapy treatment planning for head and neck cancer. Head Neck 2005; 27(6): 494–502.
16. Ha PK, Hdeib A, Goldenberg D et al. The role of positron emission tomography and computed tomography fusion in the management of early stage and advanced stage primary head and neck squamous cell carcinoma. Arch Otolaryngol Head Neck Surg 2006; 132 : 12–16.
17. Heron D, Andrade R, Flickinger J et al. Hybrid PET-CT simulation for radiation treatment planning in head and neck cancers: a brief technical report. Int J Radiat Oncol Biol Phys 2004; 60 : 1419–1424.
18. Nakamoto Y, Tatsumi M, Hammoud D et al. Normal FDG distribution patterns in the head and neck: PET/CT evaluation. Radiology 2005; 234 : 879–885.
19. Lehtiö K, Eskola O, Viljanen T et al. Imaging perfusion and hypoxia with PET to predict radiotherapy response in head-and-neck cancer. Int J Radiat Oncol Biol Phys 2004; 59 : 971–982.
20. Eschmann SM, Paulsen F, Bedeshem C et al. Hypoxia-imaging with (18)F-Misonidazole and PET: changes of kinetics during radiotherapy of head-and-neck cancer. Radiother Oncol 2007; 83(3): 406–410.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2009 Issue 3-
All articles in this issue
- New Radiopharmaceuticals and Positron-emission Tomography Applications at the Masaryk Memorial Cancer Institute in Brno
- Use of PET/CT Examination in Head and Neck Cancer Radiotherapy Planning
- Long term Results of Surgical Treatment of Pulmonary Metastases in Germ Cell Testicular Cancer Patients
- Clostridium Difficile Associated Diarrhoea –Problem of Oncological Patient?
- Lenalidomide in the Treatment of Multiple Myeloma
- Comments on the 4th WHO Classification of Lymphomas
- Evaluation of Aromatase Inhibitors’ Side Effects in Clinical and Experimental Studies
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Evaluation of Aromatase Inhibitors’ Side Effects in Clinical and Experimental Studies
- Use of PET/CT Examination in Head and Neck Cancer Radiotherapy Planning
- Clostridium Difficile Associated Diarrhoea –Problem of Oncological Patient?
- New Radiopharmaceuticals and Positron-emission Tomography Applications at the Masaryk Memorial Cancer Institute in Brno
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

