-
Medical journals
- Career
Klinický význam chromozomálních změn u nádorů kostí a měkkých tkání dětí a mladistvých
: E. Stejskalová 1; M. Jarošová 2; J. Mališ 1; D. Sumerauer 1; H. Urbánková 2; L. Krsková 3; K. Pýcha 4; J. Schovanec 5; J. Balcárková 2; V. Šmelhaus 1; D. Kodetová 3; J. Starý 1
: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha2 Hemato-onkologická klinika FN a LF UP Olomouc3 Ústav patologické anatomie a molekulární medicíny 2. LF UK a FN Motol, Praha4 Klinika dětské chirurgie 2. LF UK a FN Motol, Praha5 Ortopedick 1
: Klin Onkol 2009; 22(2): 58-66
: Original Articles
Východiska:
V práci předkládáme cytogenetické a molekulárně cytogenetické vyšetření u pacientů s nádory kostí a měkkých tkání.Soubor pacientů a metody:
Cytogeneticky a molekulárně cytogeneticky, technikami M-FISH a arrayCGH, jsme vyšetřili soubor 26 pacientů s diagnózou Ewingův sarkom/PNET, 15 pacientů s rabdomyosarkomem, 5 se synovialosarkomem a jednu pacientku s nediferencovaným sarkomem.Výsledky:
U většiny pacientů jsme prokázali nenáhodné chromozomální strukturální a početní změny s významem pro stanovení diagnózy i pro odhad prognózy. U osmi pacientů s ES/PNET byla cytogeneticky prokázána pouze t(11;22)(q24;q12), dalších osm mělo vedle této změny sekundární aberace a šest pouze sekundární aberace. Vyšetřením pacientů s RMS jsme prokázali jednou t(1;13)(p36;q14) a čtyřikrát t(2;13)(q35;q14), typické pro alveolární, prognosticky nepříznivý podtyp, a početní změny charakterizujicí embryonální podtyp u pěti pacientů. U čtyř pacientů se synovialosarkomem byla přítomna diagnostická t(X;18)(p11.2;q11.2), u jednoho jako komplexní translokace t(X;18;21)(p11.2;q11.2;q11.2) v komplexním karyotypu společně s dalšími translokacemi t(2;5)(q24–32;p13–14) a t(12;20)(p11;q13). Vyšetření karyotypu nádorových buněk jsme korelovali s histopatologickým morfologickým vyšetřením a s klinickými údaji o průběhu onemocnění. Získané výsledky jsme porovnali se zahraničními literárními závěry.Závěr:
Cytogenetické a molekulárně cytogenetické vyšetření je přínosné v diferenciální diagnostice nádorů kostí a měkkých tkání, zvláště u podtypů s méně diferencovanou morfologií, a mělo by tvořit integrální součást léčebné péče o pacienty s tímto onemocněním.Klíčová slova:
Ewingův sarkom/PNET – rabdomyosarkom – synovialosarkom – děti a mladiství – cytogenetika – arrayCGH – M-FISH – chromozomyÚvod
Sarkomy měkkých tkání participují podle různých údajů ve spektru nádorů dětí 6–15%. Nejčastějšími z nich jsou rabdomyosarkom (RMS), nediferencovaný sarkom a synovialosarkom. Fibrosarkom, liposarkom a u dospělých vůbec nejčastěji diagnostikovaný zhoubný nádor měkkých tkání – maligní fibrózní histiocytom – jsou u dětí spíše výjimkou [1]. Diferenciální diagnostika může být i dnes, přes možnost využití moderních imunohistochemických technik, obtížná, zvláště u méně diferencovaných podtypů kulatobuněčných či vřetenobuněčných nádorů, díky jejich velmi podobnému histopatologickému obrazu. S výhodou lze v diferenciálně diagnostické rozvaze využít existenci charakteristických cytogenetických translokací, a to t(1;13)(p36;q14) a t(2;13)(q35;q14) u alveolárního, prognosticky nepříznivého RMS, vyskytující se až u 90% pacientů a t(X;18)(p11.2;q11.2) u 90% synovialosarkomů [2,3]. Na molekulární úrovni lze příslušnými technikami prokázat fúzní gen PAX/FKHR u RMS a SYT/SSX u synovialosarkomu [4,5,6].
Nádory ze skupiny Ewingův sarkom/periferní neuroektodermální nádor (ES/PNET) tvoří 4,4% všech nádorů dětského a adolescentního věku. ES/PNET postihuje převážně dlouhé a ploché kosti, avšak jeho mimokostní výskyt není výjimečný. Jedná se o systémové onemocnění, které se rychle šíří hematogenní cestou. Přibližně 25% nemocných má již v době stanovení diagnózy metastázy. Zavedením multimodální léčby, kombinující intenzivní chemoterapii s lokální léčbou (operace a radioterapie), se významně zlepšila prognóza pacientů [1].
Morfologicky patří ES/PNET do skupiny nádorů z malých tmavých buněk. Tyto nádory představují 15% dětských nádorů. V absolutních číslech to znamená ročně 15–20 nově diagnostikovaných nádorů tohoto typu u dětí a mladistvých. Nádory této skupiny mají velmi podobnou histologickou stavbu z malých buněk s chudou cytoplazmou a kulatým bazofilním jádrem. Jejich patologicko anatomická diagnostika je velmi obtížná, zhruba u jedné čtvrtiny pacientů není možné stanovit jednoznačnou diagnózu. Proto je výhodné využít k upřesnění diagnózy některých dnes již známých a specifických chromozomálních změn.
Ewingův sarkom (ES) byl po meningeomu prvním nádorem měkkých tkání s popsanou charakteristickou chromozomální změnou. U pacientů s ES/PNET lze cytogenetickým vyšetřením nádorových buněk nejčastěji prokázat patognomonickou balancovanou translokaci mezi chromozomy 11 a 22, se zlomovými místy v pruzích q24 a q12 – t(11;22)(q24;q12). Translokace se vyskytuje u 85–95% pacientů s tímto onemocněním. V důsledku této translokace se vytváří aktivní chimérický fúzní gen ews-fli1, jehož transkript lze jednoduše prokázat molekulárně genetickou metodou reverzní transkripce-polymerázové řetězové reakce (RT PCR), která je dnes rutinně využívána pro stanovení diagnózy [7].
Translokaci t(11;22) lze prokázat jak u ES, tak u vzácnějšího Askinova malobuněčného nádoru torakopulmonální oblasti a periferních neuroepiteliomů, což dokládá jejich společný neuroektodermální původ. Vedle nejobvyklejší t(11;22) se vyskytují zhruba u 10% nemocných tzv. variantní translokace t(21;22), t(7;22) a t(16;22), které mají rovněž význam pro stanovení správné diagnózy [8]. Na chromozomu 22 je vždy zahrnuta oblast, ve které je lokalizován gen EWS, který fúzuje s geny FLI 1, ERG nebo ETV 1 na chromozomech 11, 21 nebo 7. Změna v oblasti genu EWS je tedy s největší pravděpodobností primární [9].
U řady pacientů s ES/PNET lze prokázat další přídatné (sekundární) chromozomální změny, které jsou v současnosti předmětem intenzivního výzkumu. Názory na jejich klinický význam, především pro odhad prognózy nemocných, nejsou totiž jednotné. Předpokládá se, že některé změny by mohly upozorňovat na onemocnění více rezistentní vůči terapii, s rizikem progrese či lokální recidivy. Mezi sledované sekundární změny patří del(1p),+8,+12 [10,11].
U další sekundární změny, nebalancované translokace der(16)t(1;16), se předpokládá negativní vliv na přežití pacientů s ES/PNET. Ve většině zveřejněných studií se uvádí, že se vyskytuje u pacientů s metastázami nebo s časným relapsem onemocnění [10,12]. Tato změna není vysloveně specifická pro Ewingův sarkom, relativně častá je u Wilmsova nádoru, retinoblastomu, nádorů mléčné žlázy či u mnohočetných myelomů. Byla dále prokázána jako sekundární změna u alveolárního rabdomyosarkomu a extraskeletárního myxoidního chondrosarkomu. Zlomová místa na příslušných chromozomech jsou variabilní [13,14]. S největší pravděpodobností představuje obecně platný specifický cytogenetický marker nádorové progrese [15]. Její odhalení v karyotypu nádorových buněk pacienta může přispět k volbě intenzivnější terapie. Rovněž polyploidie (zmnožení chromozomů sady) a komplexní karyotyp zřejmě představují indikátor negativní prognózy u ES/PNET [10]. V práci Kullendorf et al měli pacienti s nadbytečným 1q chromozomem a s celkovým počtem chromozomů nad 50 infaustní prognózu [15].
Molekulární studie prokázaly ztrátu heterozygozity (LOH) na 11p15.5, společnou pro několik dětských nádorů: RMS, Wilmsův tumor a hepatoblastom. Stejná změna hraje roli v etiologii Beckwith-Wiedemannova syndromu, s nímž se tyto nádory často sdružují, a proto se předpokládá jejich společná genetická vývojová cesta [16].
Cílem naší práce bylo prezentovat výsledky cytogenetického a molekulárně cytogenetického vyšetření u souboru 47 pacientů s diagnostikovanými nádory kostí a měkkých tkání.
Pacienti a metody
Náš soubor tvoří 26 pacientů s ES/PNET, 15 pacientů s RMS, 5 pacientů se synovialosarkomem a jedna pacientka s nediferencovaným sarkomem. U většiny z nich jsme prokázali změny v karyotypu jejich nádorových buněk.
Pacienti byli léčeni dle léčebných protokolů platných v době trvání jejich onemocnění.
Materiál pro cytogenetické vyšetření, odebraný za přísně sterilních podmínek, byl získán při diagnostických operacích a vyšetřen paralelně s histopatologickým vyšetřením. Menší část vzorků pochází z biopsií při relapsu, tedy již po léčbě. Základem úspěšnosti je čerstvá nádorová tkáň s živými nádorovými buňkami. Techniky in vitro kultivace se řídí typem nádoru, pracovní diagnózou, lokalizací odebrané tkáně. Zpracování suspenze nádorových buněk je provedeno dle standardně v literatuře popsaných technik [17,18]. Vyšetření je v případě potřeby a při dostatku materiálu i mitóz doplněno fluorescenčními technikami FISH, M-FISH a arrayCGH. Výsledky všech metod byly hodnoceny podle kritérií ISCN 2005 [19]. Studie byla schválena etickou komisí FN Motol.
Výsledky
U osmi pacientů s ES/PNET byla cytogeneticky prokázána pouze t(11;22)(q24;q12), dalších osm mělo vedle této změny sekundární aberace a dalších šest mělo pouze sekundární změny. Nález nebalancované der(16)t(1;16), trizomie 12 a komplexní karyotyp se zmnožením chromozomální sady byl spojen s velmi nepříznivým průběhem onemocnění, časným relapsem a úmrtím. Trizomie 8 se vyskytla u čtyř pacientů s příznivým průběhem onemocnění a u tří pacientů s metastatickým postižením již při diagnóze a nepříznivým průběhem. U jednoho pacienta byla prokázána místo typické t(11;22) nenáhodná t(4;19)(q35;q?13.1–2). U pacientky s nediferencovaným sarkomem a konstituční aberací 14. chromozomu, s mentálním postižením, byly v karyotypu prokázány dva klony, jeden s typickou trizomií 8 a druhý s dosud nepublikovanou t(2;17)(q?34;q?24). ArrayCGH vyšetření u pacienta s generalizovaným extraskeletárním ES malé pánve, z materiálu z prvního plicního relapsu, významně zpřesnilo cytogenetické změny včetně exaktních zlomových míst u karyotypu s mnohočetnými aberacemi (obr. 2). U dalšího pacienta s recidivujícím ES/PNET kosti křížové, s plicními metastázami, arrayCGH vyšetření rovněž zpřesnilo cytogenetický karyotyp s indikátory negativní prognózy (obr. 1). Výsledky cytogenetického a arrayCGH vyšetření uvádíme v tab. 1 v korelaci s klinickými údaji. ArrayCGH vyšetření bylo možné provést jen při dostatku materiálu.
1. Pacient s ES/ PNET lopaty kosti kyčelní a plicními metastázami, zemřel za 2 roky od stanovení diagnózy. Karyotyp s indikátory negativní prognózy: 48,XY,+8, t(11;22)(q24;q12),– 16,der(16)t(1;16)(q21;q13),+12[6]/polyploidní mitózy. Cytogenetické vyšetření bylo upřesněno arrayCGH: arr cgh 1q21.2q44(RP11– 326G21→ GS–167K11)×3,8(167 BAC)×3,12(166 BAC)×3,16q12.1q24.3 (RP11– 283C7→RP11– 533D19)×1. ![Pacient s ES/ PNET lopaty kosti kyčelní a plicními metastázami, zemřel za 2 roky od stanovení diagnózy. Karyotyp s indikátory negativní prognózy: 48,XY,+8, t(11;22)(q24;q12),– 16,der(16)t(1;16)(q21;q13),+12[6]/polyploidní mitózy. Cytogenetické vyšetření bylo upřesněno arrayCGH: arr cgh 1q21.2q44(RP11– 326G21→ GS–167K11)×3,8(167 BAC)×3,12(166 BAC)×3,16q12.1q24.3 (RP11– 283C7→RP11– 533D19)×1.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b9df698e566d5ec6e626d76d3fa8dea9.jpeg)
2. Pacient s generalizovaným ES malé pánve, cytogenetické a arrayCGH vyšetření provedeno při 1. relapsu, nyní po 2. relapsu do plic, LU mediastina a dutiny břišní. Karyotyp s indikátory negativní prognózy: s mnohočetnými změnami, o modálním počtu 55~100, der(16)t(1;16)(q21;q13)×3. 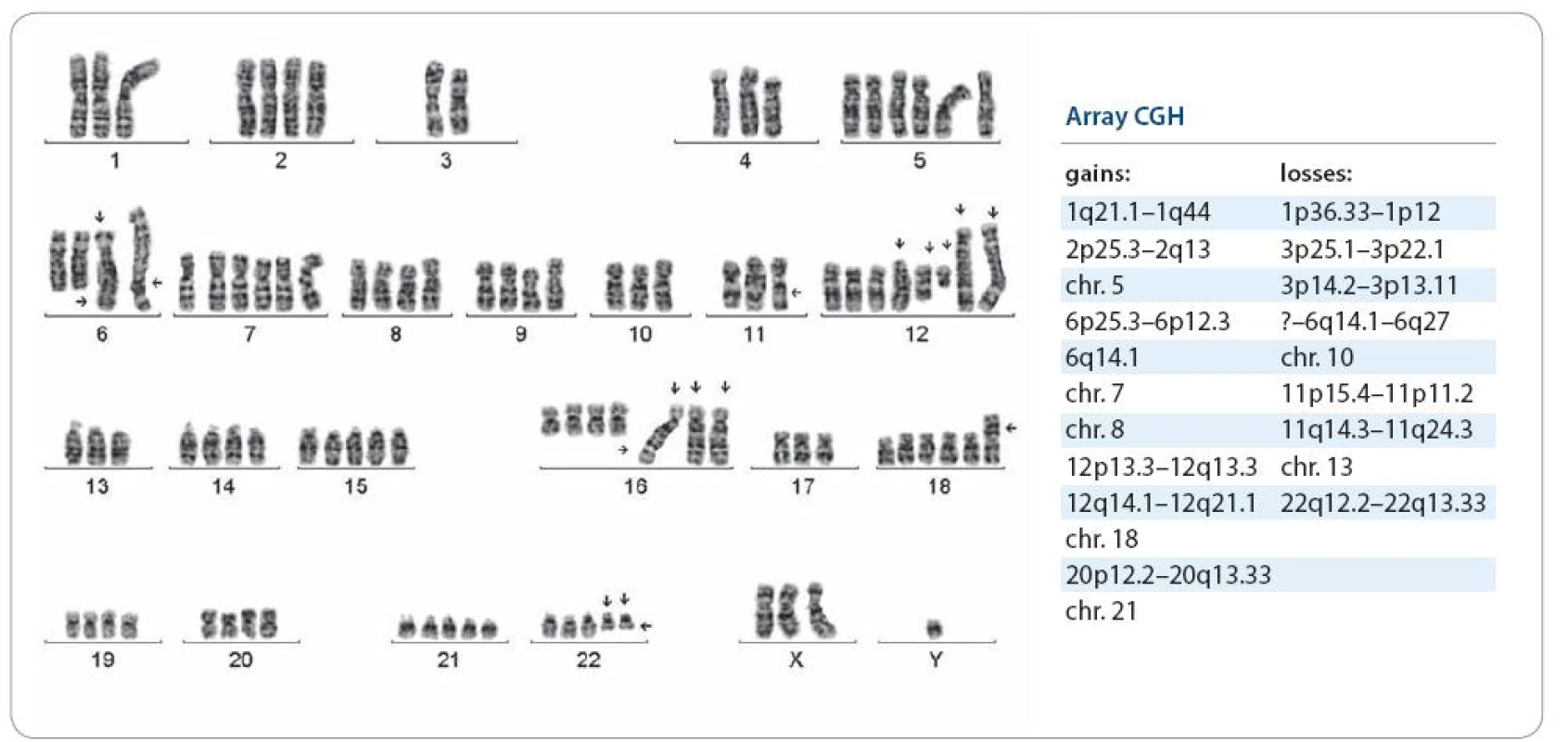
1. Charakteristika studovaných pacientů s ES/PNET. 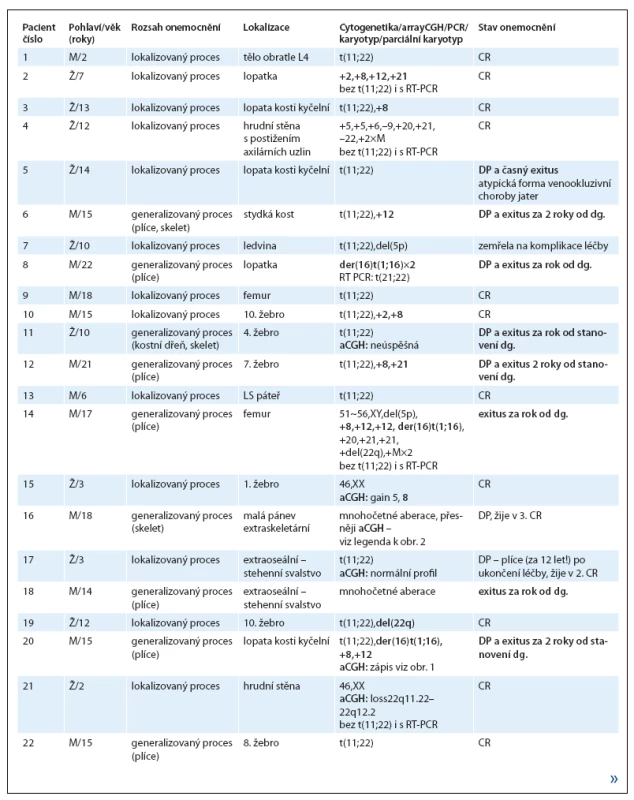
Pokračování tab. 1. 
M – mužské pohlaví, Ž – ženské pohlaví, CR – kompletní remise, DP – progrese onemocnění, dg – diagnóza Vyšetřením pacientů s RMS jsme prokázali jednou t(1;13)(p36;q14) a čtyřikrát t(2;13)(q35;q14), typické pro alveolární, prognosticky nepříznivý podtyp. U dvou pacientek s t(2;13) byl druhý partner translokace, derivovaný chromozom 13, zduplikován. Obě pacientky zemřely na progresi základního onemocnění. U další pacientky s alveolárním RMS byla místo translokace přítomna rovněž typická změna add(17)(q25). Početní změny charakterizující embryonální podtyp, s modálním počtem 51~60 chromozomů, mělo pět pacientů.
3. M-FISH. Pacientka s nediferencovaným sarkomem a konstituční aberací 14. chromozomu, s mentálním postižením. V karyotypu nádorových buněk byly prokázány dva klony, jeden s typickým nadbytečným chromozomem 8 a druhý s dosud nepublikovanou t(2;17)(q?34;q?24). 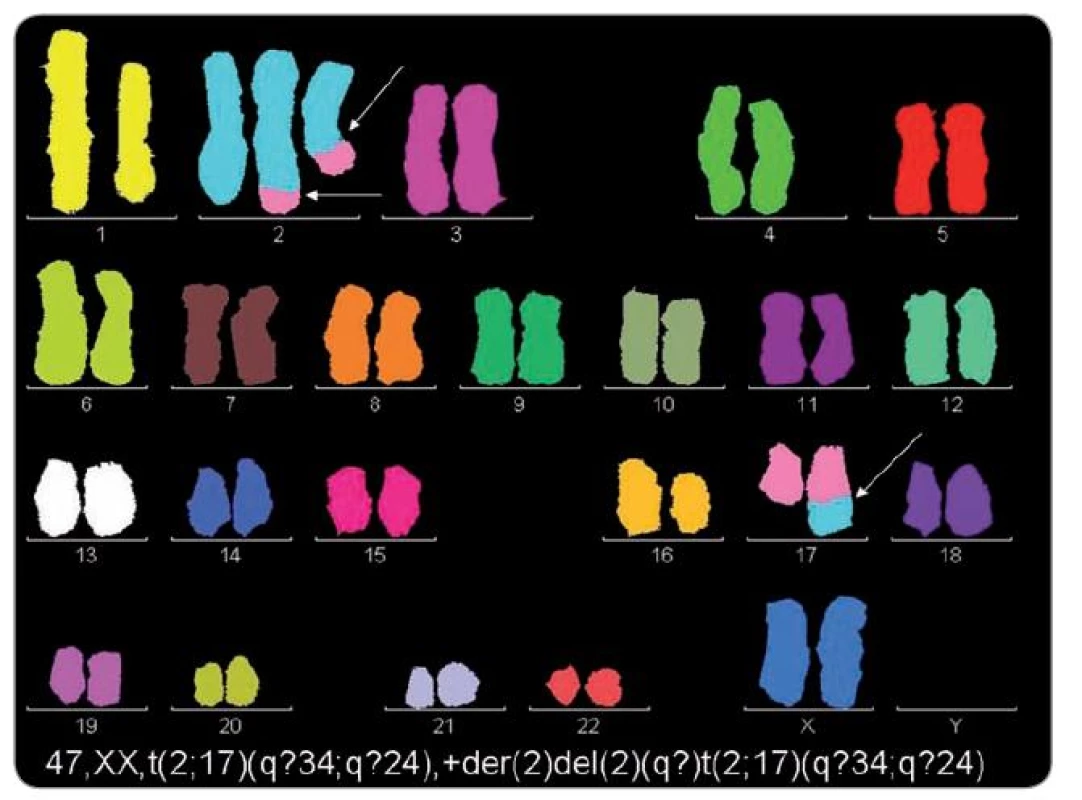
U 4 pacientů se synovialosarkomem byla přítomna diagnostická t(X;18)(p11.2;q11.2), u jednoho jako komplexní translokace t(X;18;21)(p11.2;q11.2;q11.2) v komplexním karyotypu společně s dalšími translokacemi t(2;5)(q24–32;p13–14) a t(12;20)(p11;q13). Komplexní karyotyp i translokace byly potvrzeny M-FISH technikou (obr. 5b). U pátého pacienta byla cytogeneticky odhalena t(11;22)(q24;q12) spolu s t(17;18)(q21.2;q22.3–23). Následně byl nález t(11;22) potvrzen RT PCR technikou.
4. M-FISH. 46,XY,t(4;19)(q35;q?13.1– 2) [7]. Pacient s nediferencovaným embryonálním sarkomem a plicními metastázami zemřel na progresi onemocnění v plicích a kostech 10 měsíců od stanovení diagnózy. Dosud byly v literatuře popsány pouze čtyři primitivní kulatobuněčné sarkomy s t(4;19), která je tím považována za nenáhodnou rekurentní translokaci u primitivních mezenchymálních nádorů. ![M-FISH. 46,XY,t(4;19)(q35;q?13.1– 2) [7]. Pacient s nediferencovaným embryonálním sarkomem a plicními metastázami zemřel na progresi onemocnění v plicích a kostech 10 měsíců od stanovení diagnózy. Dosud byly v literatuře popsány pouze čtyři primitivní kulatobuněčné sarkomy s t(4;19), která je tím považována za nenáhodnou rekurentní translokaci u primitivních mezenchymálních nádorů.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/49994455dfdf17a1b73440ba2f5c9b31.jpeg)
Obr. 5a. Pacient se synovialosarkomem a komplexním karyotypem s t(2;5)(q24– 32;p13– 14),t(12;20 (p11;q13),t(X;18;21 (p11.2;q11.2;q11.2)[20]. Obr. 5b. M-FISH od téhož pacienta. ![Obr. 5a. Pacient se synovialosarkomem a komplexním karyotypem s t(2;5)(q24– 32;p13– 14),t(12;20 (p11;q13),t(X;18;21 (p11.2;q11.2;q11.2)[20]. Obr. 5b. M-FISH od téhož pacienta.](https://pl-master.mdcdn.cz/media/image/8db2ae9412f349bb7ad28543409067f4.jpeg?version=1537790276)
Diskuze
Optimální léčba pacientů s nádory měkkých tkání a kostí úzce souvisí s přesnou diagnostikou. Diferenciální diagnostika, s použitím standardních morfologických vyšetření, může být i dnes obtížná, a to jak pro patologa, tak pro klinického lékaře. Cytogenetickým vyšetřením těchto nádorů byly objeveny nenáhodné a v některých případech specifické, tedy diagnosticky využitelné, chromozomální translokace s odpovídající změnou na molekulární úrovni, většinou v podobě fúzního genu. Molekulární techniky PCR umožňují prokázat fúzní gen i v případě nedostupnosti vitální tkáně pro cytogenetické vyšetření či v případě neúspěšnosti cytogenetiky, proto jsou často využívány pro potvrzení klinické a histopatologické diagnostiky. Když byla počátkem 80. let popsána mezi prvními t(11;22)(q24;q12), vyskytující se až u 95% nádorů ze skupiny Ewingova sarkomu/PNET, byla považována za dostatečně specifickou. Průkaz této translokace či jejích variantních forem některou z dostupných technik umožňoval jednoznačně zařadit nádor a potvrdit diagnózu. Novější výzkumy překvapivě ukázaly značnou promiskuitu EWS genu, který je schopen vstupovat do přestaveb i s dalšími geny, nejen ve skupině nádorů Ewingova sarkomu, ale i u dalších nádorů, jako je myxoidní chondrosarkom, rabdomyosarkom, neuroblastom, a dokonce i u akutní myeloidní leukemie (AML). EWS/FLI 1 fúzní gen exprimují bifenotypické sarkomy, s morfologií typickou jak pro myogenní, tak pro neurální diferenciaci a polyfenotypické sarkomy [20,21]. Předpokládá se, že ačkoli EWS/FLI 1 přestavba je nejspíš transformující událostí, fenotypické vyjádření této transformace může být různorodé v závislosti na faktorech buněčného prostředí. Použití pouze molekulárně diagnostických technik založených na průkazu specifických přestaveb se jeví jako nedostatečně spolehlivé [22]. Samozřejmostí by měla být vzájemná korelace všech dostupných technik s histopatologií a klinikou.
Obr. 6a. 46,XY,t(11;22)(q24;q12),t(17;18)(q21.2;q22.3– 23) [4]. Pacient s monofázickým synovialosarkomem dlaně pravé ruky, bez generalizace a s t(11;22), typickou pro Ewingův sarkom. Translokace (11;22) s fúzí genů EWS/FLI1 byla následně potvrzena RT-PCR technikou. Bez cytogenetického vyšetření by nebyla odhalena. M-FISH ani PCR technikou se nepodařilo prokázat t(X;18) či fúzní gen SYT- SSX, typický pro synovialosarkom. Pacient byl léčen s přihlédnutím k t(11;22) a nyní je v klinické remisi 4 roky od stanovení diagnózy. Obr. 6b. M-FISH od téhož pacienta. ![Obr. 6a. 46,XY,t(11;22)(q24;q12),t(17;18)(q21.2;q22.3– 23) [4]. Pacient s monofázickým synovialosarkomem dlaně pravé ruky, bez generalizace a s t(11;22), typickou pro Ewingův sarkom. Translokace (11;22) s fúzí genů EWS/FLI1 byla následně potvrzena RT-PCR technikou. Bez cytogenetického vyšetření by nebyla odhalena. M-FISH ani PCR technikou se nepodařilo prokázat t(X;18) či fúzní gen SYT- SSX, typický pro synovialosarkom. Pacient byl léčen s přihlédnutím k t(11;22) a nyní je v klinické remisi 4 roky od stanovení diagnózy. Obr. 6b. M-FISH od téhož pacienta.](https://pl-master.mdcdn.cz/media/image/03f5947a74d2e50426f110f9665aeeca.jpeg?version=1537791863)
V našem souboru pacientů je z tohoto hlediska zajímavý pacient, u něhož se, vzhledem k pracovní diagnóze synovialosarkomu, původně po t(11;22) nepátralo. Rutinně prováděné cytogenetické vyšetření odhalilo tuto pro synovialosarkom zcela neobvyklou t(11;22). Byla následně potvrzena i RT PCR technikou, naopak t(X;18), typická pro synovialosarkom, nebyla prokázána ani na molekulární úrovni. Tyto vzájemně se doplňující nálezy pak byly argumentem pro chemoterapeutický postup podávaný obvykle u nádorů skupiny ES/PNET. Dalším zajímavým pacientem je pacient s nediferencovaným, blíže nezařaditelným embryonálním sarkomem, původně vyšetřovaným jako Ewingův nediferencovaný extraoseální sarkom. Translokace t(11;22) nebyla prokázána ani na molekulární úrovni, místo ní je pacient nositelem t(4;19)(q35;q?13.1–2), již dříve popsané u primitivních mezenchymálních nádorů [23] a u agresivního primitivního neuroektodermálního ES/PNET [24].
Obr. 7. Translokace t(2;13)(q35;q14) je diagnostická pro alveolární RMS, vyskytuje se s frekvencí 70– 90 % u tohoto nádoru a je známkou horší prognózy. Zde je druhý partner translokace, derivovaný chromozom 13, zduplikován. 
Vzhledem k nízké četnosti výskytu Ewingova sarkomu jsou studie zaměřené na korelaci sekundárních cytogenetických změn s průběhem onemocnění velmi důležité, neboť jedině na základě větších souborů jasně vyplyne význam těchto změn pro prognózu. Pro sledování některých četnějších změn lze vedle klasické cytogenetiky využít i interfázickou FISH techniku, případně mnohobarevnou FISH techniku, pokud je dostatečné množství mitóz. Posledně jmenovaná technika je užitečná pro odhalení nových kryptických translokací, které nemusí být klasickou cytogenetikou zjistitelné. Naopak zcela nevhodné je vyšetření pouze molekulárními technikami PCR, které jsou založené na záchytu některé z již známých translokací a jejich fúzních produktů. V současnosti se sledují sekundární změny delece (1p), trizomie chromozomů 8 a 12 a nebalancovaná der(16)t(1;16). Původně se předpokládalo, že všechny tyto změny představují marker proliferačního zvýhodnění nádorových buněk, některé novější studie [10] spojují trizomii 8 naopak s příznivějším průběhem onemocnění, což se ukázalo i v našem souboru. Čtyři z našich pacientů s trizomií 8 žijí v kompletní remisi onemocnění. Další tři však zemřeli. Dva z nich měli v karyotypu kromě +8 indikátory negativní prognózy +12 a der(16)t(1;16). Trizomie 12 bývá spojena s komplexně změněným karyotypem a v současnosti se považuje za indikátor negativní prognózy hlavně u pacientů s lokalizovaným onemocněním [12]. Všichni tři pacienti měli metastatické postižení již v době stanovení diagnózy.
Obr. 8a a 8b. U této pacientky s RMS a t(2;13)(q35;q14) lze pozorovat klonální vývoj, u převládajicího klonu je opět druhý partner translokace, derivovaný chromozom 13, zduplikován. 
Závěr
Naše zkušenosti, získané v průběhu deseti let působení v onkocytogenetické laboratoři Kliniky dětské hematologie a onkologie FN Motol, potvrzují závěry vyslovené v zahraniční literatuře o smysluplnosti cytogenetického vyšetření u dětí a mladistvých s nádory kostí a měkkých tkání. Vyšetření by mělo tvořit integrální součást komplexní péče o pacienty s tímto nádorovým onemocněním, neboť může poskytnout informaci s již dnes uznávanou diagnostickou hodnotou. Zároveň pomáhá odhalit další chromozomální změny, jejichž význam pro prognózu se předpokládá a nejspíše bude v nedaleké budoucnosti na větších souborech ověřen. Z tohoto hlediska je přínosná účast v nadnárodních multicentrických studiích typu Euro Ewing 99 či RMS-2005.
Základem úspěšnosti jakéhokoliv cytogenetického vyšetření je čerstvá nádorová tkáň s živými nádorovými buňkami. Tkáň nesmí být uchována dosud běžně zavedenou technikou fixace ve formolu, a dokonce nesmí být ani zamražena (což nevadí při použití molekulárně genetických technik). Dále musí být odebrána se zachováním podmínek přísné sterility a uložena nejlépe do speciálního cytogenetického transportního růstového média. Do cytogenetické laboratoře by měla být dopravena co nejdříve, nejpozději do 24 hodin po odběru.
Máme li zájem, aby se výhody diagnostického vyšetření karyotypu nádorových buněk staly dostupnými pro všechny děti a mladistvé s nádory měkkých tkání a kostí, je nezbytná účinná spolupráce mezi pediatry, operujícími chirurgy, patology, cytogenetiky a molekulárními genetiky. Všichni jmenovaní by měli být seznámeni s úrovní současných znalostí v nádorové biologii. Jedině tak mohou mít určitou představu o smysluplnosti zachování nádorové tkáně, odebrané při operačním výkonu, pro další vyšetření, kromě nezbytného vyšetření histopatologického.
Pokud se v histologicky málo diferencovaném či nediferencovaném nádoru podaří odhalit některou z diagnosticky uznávaných cytogenetických translokací či jiných specifických změn, mohou tyto změny podpořit ne zcela jednoznačnou histologickou diagnózu či být podnětem k event. přehodnocení diagnózy. Navíc jsou cytogeneticky prokázané změny předstupněm cílenějších vyšetření v oblasti zlomových míst, s následným sekvenováním kandidátních genů, což otevírá nové možnosti pro mnohem citlivější diagnostiku molekulárně genetickými technikami i pro sledování minimální zbytkové choroby a volbu cílené terapie. Proto se předpokládá, že nádorová cytogenetika bude hrát stále důležitější roli v léčebné strategii solidních nádorů.
Poděkování
Autoři děkují laborantkám D. Honsové, I. Lakomé, H. Mendlové a J. Šulcové za vynikající technickou asistenci.
Práce byla podpořena grantem IGA MZ č. NR/9050-3.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.RNDr. Eva Stejskalová
Klinika dětské hematologie a onkologie 2. LF UK a FN Motol
V úvalu 84
150 06 Praha 5 – Motol
e-mail: eva.stejskalova@lfmotol.cuni.cz
Sources
1. Koutecký J a kol. Nádorová onemocnění dětí a mladistvých. Praha: Karolinum 1997.
2. Lazar A, Abruzzo LV, Pollock RE et al. Molecular diagnosis of sarcomas: chromosomal translocations in sarcomas. Arch Pathol Lab Med 2006; 130 : 1199–11207.
3. Sandberg AA. Cytogenetics and molecular genetics of bone and soft-tissue tumors. Am J Med Genet 2002; 115 : 189–193.
4. Slater O, Shipley J. Clinical relevance of molecular genetics to paediatric sarcomas. J Clin Pathol 2007; 60 : 1187–1194.
5. Antonescu CR. The role of genetic testing in soft tissue sarcoma. Histopathology 2006; 48 : 13–21.
6. Miettinen M. From morphological to molecular diagnosis of soft tissue tumors. Adv Exp Med Biol 2006; 587 : 99–113.
7. Sandberg AA, Bridge JA. Updates on the cytogenetics and molecular genetics of bone and soft tissue tumors-Ewing sarcoma and peripheral primitive neuroectodermal tumors. Cancer Genet Cytogenet 2000; 123(1): 1–26.
8. Zhao L, Hayes K, Van Fleet T et al. Detection of a novel reciprocal t(16;22)(q11.2;q12) in a Ewing sarcoma. Cancer Genet Cytogenet 2003; 140 : 55–57.
9. de Alava E. Molecular pathology in sarcomas. Clin Transl Oncol 2007; 9 : 130–144.
10. Zielenska M, Zhang MZ, Kwan N et al. Acquisition of secondary structural chromosomal changes in pediatric Ewing sarcoma is a probable prognostic factor for tumor response and clinical outcome. Cancer 2001; 91 : 2156–2164.
11. Hattinger CM, Rumpler S, Strehl S et al. Prognostic impact of deletions at 1p36 and numerical aberrations in Ewing tumors. Genes Chromosom Cancer 1999; 24 : 243–254.
12. Hattinger CM, Potschger U, Tarkkanen M et al. Prognostic impact of chromosomal aberrations in Ewing tumours. Br J Cancer 2002; 86 : 1763–1769.
13. McManus AP, Min T, Swansbury GJ et al. Der(16) t(1;16)(q21;q13) as a secondary change in alveolar rhabdomyosarcoma. A case report and review of the literature. Cancer Genet Cytogenet 1996; 87 : 179–181.
14. Day SJ, Nelson M, Rosenthal H et al. Der(16)t(1;16) (q21;q13) as a secondary structural aberration in yet a third sarcoma, extraskeletal myxoid chondrosarcoma. Genes Chromosomes Cancer 1997; 20 : 425–427.
15. Kullendorff CM, Mertens F, Donner M et al. Cytogenetic aberrations in Ewing sarcoma: are secondary changes associated with clinical outcome? Med Ped Oncol 1999; 32 : 79–83.
16. Steenman M, Westerveld A, Mannens M. Genetics of Beckwith-Wiedemann syndrome associated tumors: common genetic pathways. Genes Chromosomes Cancer 2000; 28 : 1–13.
17. ACT cytogenetics laboratory manual. In: Barch MJ (ed). ACT cytogenetics laboratory manual. 2nd ed. New York: Raven Press 1991.
18. Stejskalová E, Jarošová M, Kabíčková E et al. Primary mediastinal (thymic) large B-cell lymphoma with a der(14)t(8;14)(q24;q32) and a translocation of MYC to the derivative chromosome 14 with a deleted IgH locus. Cancer Genet Cytogenet 2006; 170 : 158–162.
19. Shaffer LG, Tommerup N (eds). ISCN 2005: An International System for Human Cytogenetic Nomenclature. Basel, Switzerland: S. Karger 2005.
20. Rosoff PM, Hatcher S, West DC. Biphenotypic sarcoma with characteristics of both a Ewing sarcoma and a desmoplastic small round cell tumor. Med Pediatr Oncol 2000; 34 : 407–412.
21. Sorensen PHB, Shimada H, Liu XF et al. Biphenotypic sarcomas with myogenic and neural differentiation express the Ewing’s sarcoma EWS/FLI1 fusion gene. Cancer Res 1995; 55 : 1385–1392.
22. Thorner P, Squire J, Chilton-MacNeil S et al. Is the EWS/FLI-1 fusion transcript specific for Ewing sarcoma and peripheral primitive neuroectodermal tumor? A report of four cases showing this transcript in a wider range of tumor types. Am J Pathol 1996; 148 : 1125–1138.
23. Richkind KE, Romansky SG and Finklestein JZ. t(4;19)(q35;q13.1): A recurrent change in primitive mesenchymal tumors? Cancer Genet Cytogenet 1996; 87 : 71–74.
24. Somers GR, Shago M, Zielenska M et al. Primary subcutaneous primitive neuroectodermal tumor with aggressive behavior and an unusual karyotype: case report. Pediatr Dev Pathol 2004; 7 : 538–545.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2009 Issue 2-
All articles in this issue
- Trastuzumab in the breast cancer treatment: efficacy and resistance mechanisms
- Clinical relevance of chromosomal aberrations in bone and soft tissue tumors in children and young adults
- The preparation of anticancer vaccine for patients with multiple myeloma on the base of monoclonal immunoglobulin loaded dendritic cells
- Bevacizumab in combination with capecitabine and irinotecan (XELIRi) in treatment of metastatic colorectal cancer
- Long term survivors of childhood cancer: Cure and care. The ERICE statement.
- Epidemiological features of testicular cancer in the Slovak Republic – retrospective study
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The preparation of anticancer vaccine for patients with multiple myeloma on the base of monoclonal immunoglobulin loaded dendritic cells
- Trastuzumab in the breast cancer treatment: efficacy and resistance mechanisms
- Clinical relevance of chromosomal aberrations in bone and soft tissue tumors in children and young adults
- Long term survivors of childhood cancer: Cure and care. The ERICE statement.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

