-
Medical journals
- Career
Těžká komunitní pneumonie
Authors: Jakubec P.
Authors‘ workplace: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
Published in: Kardiol Rev Int Med 2019, 21(3): 129-134
Overview
Komunitní pneumonie je akutní infekce plicních alveolů, respiračních bronchiolů a intersticia, která je získána v běžném prostředí (komunitě). Celosvětově se jedná o jednu z nejčastějších infekčních chorob. Těžká komunitní pneumonie je nejvážnější forma tohoto onemocnění a je spojená s výraznou morbiditou a mortalitou, zvláště u osob staršího věku, imunokompromitovaných a pacientů se závažnými komorbiditami. Vstupně je důležité stratifikovat riziko nemoci a rozhodnout o adekvátním místě péče, nejlépe na jednotce intenzivní péče. Základem léčby je včasná a adekvátní antibiotická léčba, léčba akutního respiračního selhání a septického stavu. Nemoc je doprovázena řadou komplikací, z nichž k nejčastějším patří postižení srdce. I v současnosti má toto onemocnění závažný průběh a často špatnou prognózu, zvláště u rizikových skupin.
Klíčová slova:
těžká komunitní pneumonie – zhodnocení rizika – diagnostika – komplikace
Úvod a hodnocení rizika těžké komunitní pneumonie
Pneumonie je akutní infekční zánět v oblasti plicních alveolů, respiračních bronchiolů a intersticia vyvolaný různými mikrobiálními agens, nejčastěji však bakteriemi. Klinicky nejdůležitější rozdělení je epidemiologické hodnotící prostředí vzniku pneumonie a charakteristiky postižených osob. Toto rozdělení predikuje typ vyvolávajícího patogenu a dle toho zvolit vhodné antibiotikum (ATB) k empirické léčbě pneumonie. Tato klasifikace člení pneumonie na komunitní (community-acquired pneumonia – CAP), nozokomiální a pneumonie u imunokompromitovaných osob. Komunitní pneumonie je definována jako pneumonie, která vzniká v běžném prostředí mimo zdravotnické zařízení do 48 hod po přijetí do nemocnice. Komunitní pneumonie tvoří až 90 % všech pneumonií. Diagnóza pneumonie musí splňovat určitá klinická kritéria, ke kterým patří nález čerstvého infiltrátu na skiagramu hrudníku + nejméně dva příznaky infekce respiračního traktu (kašel, dušnost, bolest na hrudníku, teplota a poslechový nález, leukocytóza). Těžká komunitní pneumonie (severe community-acquired pneumonia – SCAP) jako jednotka není dosud jednoznačně a přesně vymezena. Nejčastěji je SCAP definována jako pneumonie s ohrožením nebo selháváním vitálních funkcí, pneumonie vyžadující mechanickou ventilaci nebo agresivní léčbu na jednotce intenzivní péče (JIP) z důvodu šoku a/ nebo orgánové dysfunkce [1]. Obecně platí, že SCAP by měly být přijaty a léčeny na JIP, resp. odděleních anesteziologie, resuscitace a intenzivní medicíny. Základem rozhodování o adekvátním místě péče o pacienta se SCAP je klinické zhodnocení celkového nálezu a stavu nemocného. Nicméně úroveň mortality je vyšší než úroveň přijetí na JIP, tedy že významná část osob se SCAP zemře bez předchozí úvahy o přijetí na JIP [2]. Mnoho pacientů také vstupně nejeví známky těžkého postižení, proto tito pacienti mohou mít nedostatečnou léčbu v době mezi přijetím do nemocnice a překladem na JIP, což je spojeno se zvýšenou mortalitou [3]. Proto byla vypracována řada tzv. skórovacích kritérií, která pomáhají hodnotit tíží pneumonie a predikovat event. přijetí na JIP. V klinické praxi jsou nejpoužívanější kritéria americká PSI (Pneumonia Severity Index) dle Fineho a britská CURB-65, která ale byla primárně vytvořena k predikci mortality pneumonie. PSI systém Americké hrudní společnosti (ATS) je nejpropracovanější a je nejlepším predikátorem mortality a možných komplikací pneumonie (tab. 1). Podle počtu rizikových bodů jsou pacienti rozděleni do pěti skupin (tab. 2). Jako těžké pneumonie jsou označeny skupiny IV a V, kde se mortalita pohybuje mezi 8 – 30 % a zvláště pacienti ze skupiny V by měli být hospitalizováni na JIP [4]. Systém Britské hrudní společnosti (BTS) CURB-65 je jednodušší a slouží k rychlému rozhodování. Hodnotí stav vědomí (confusion – zmatenost), renálních funkcí (urea > 7 mmol/ l), respiraci (dechová frekvence > 30 dechů/ min) a hodnoty krevního tlaku (TK – hypotenze > 90/ 60 mm Hg). Číslice 65 označuje věk > 65 let. Za každý znak se přiděluje jeden bod. Mortalita pneumonie stoupá od 0,7 % při 0 bodech k 40 % při 5 bodech. U pacientů se ≥ 3 body by mělo být zváženo přijetí na JIP [5]. Existuje i zjednodušený německý systém CRB-65, který nevyžaduje laboratorní vyšetření urey. Toto schéma doporučuje hospitalizaci v přítomnosti jednoho nebo více bodů [6]. Výše zmíněná kritéria ale nedostatečně predikují nutnost přijetí pacientů na JIP. Proto byla vytvořena řada novějších skórovacích systémů, které jsou v tomto ohledu citlivější. Patří k nim americká IDSA/ ATS malá kritéria, španělské SCAP skóre a australské SMART-COP. Americká IDSA/ ATS malá kritéria se zdají být ze všech kritérií nejpřesnější a dobře predikují přijetí na JIP, potřebu mechanické ventilace, riziko septického šoku a léčebného selhání (tab. 3) [7]. Recentně se objevily práce, které dokládají, že významnější vliv na tíži nemoci a mortalitu mají hlavně poruchy vědomí, renální selhání a těžká hypoxemie [8 – 10].
Table 1. Riziková kritéria PSI systému. 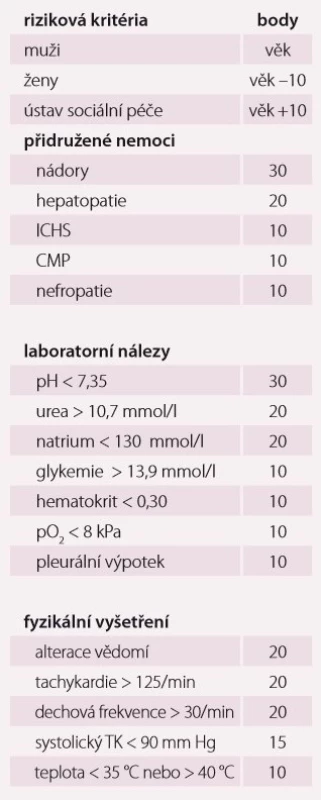
ICHS – ischemická choroba srdeční; CMP – cévní mozková příhoda; TK – krevní tlak; PSI – Pneumonia Severity Index Table 2. Rizikové skupiny PSI systému. 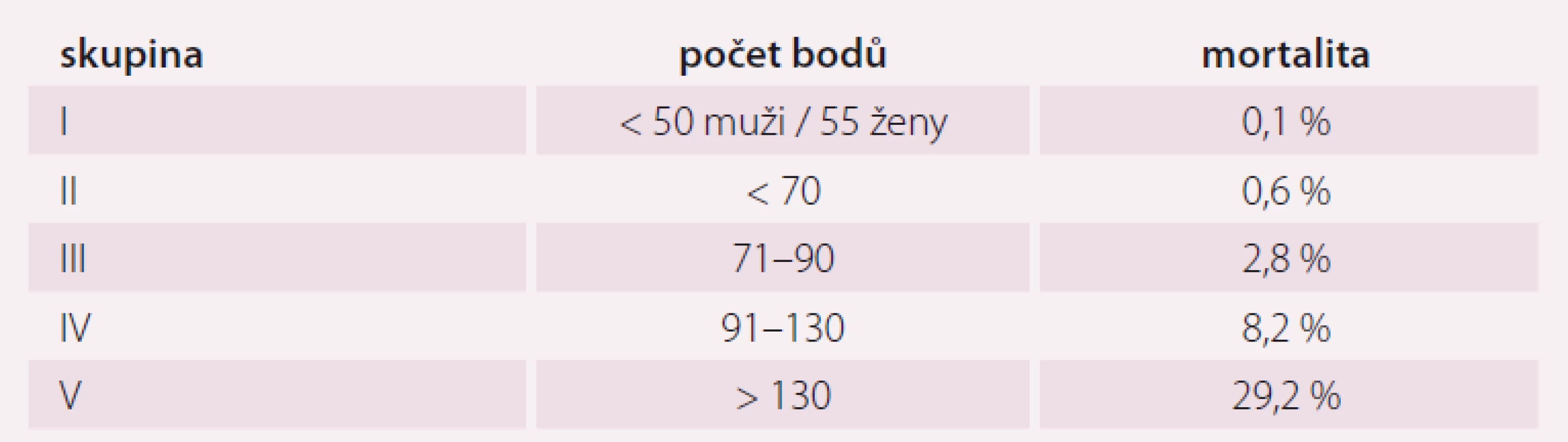
PSI – Pneumonia Severity Index Table 3. IDSA/ATS malá kritéria SCAP (minimálně tři parametry). 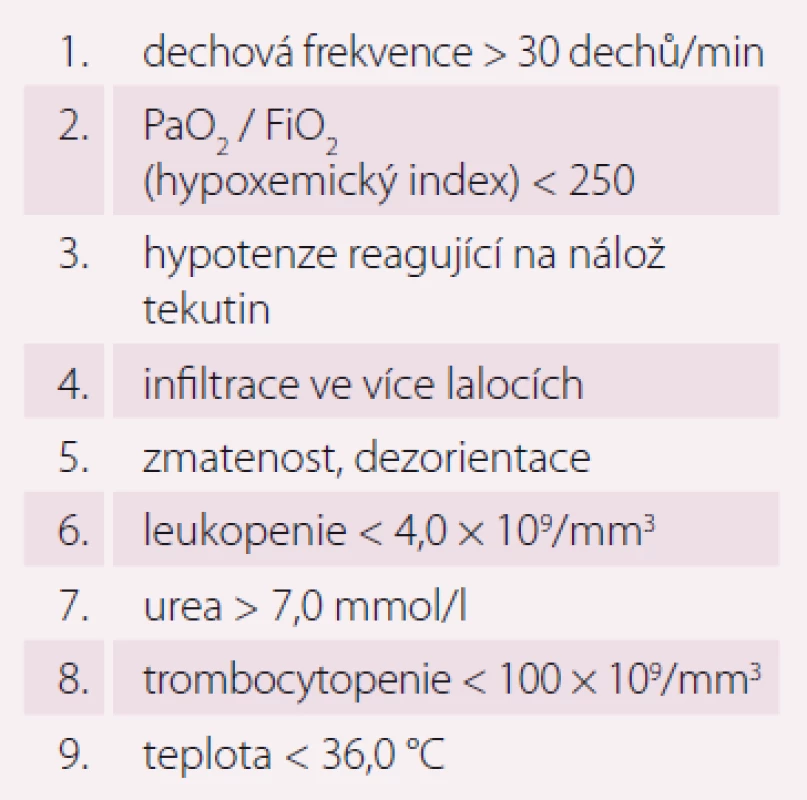
SCAP – těžká komunitní pneumonie, PaO2 – parciální tlak kyslíku, FiO2 – inspirační koncentrace kyslíku Epidemiologie a etiologie SCAP
Incidence CAP se udává mezi 5 – 11 případy na 1 000 obyvatel a je vyšší u starších osob. Hospitalizaci vyžaduje jen asi 20 % nemocných s CAP [11]. Mezi hospitalizovanými se pohybuje zastoupení SCAP v rozmezí 6,6 – 21,0 % [12,13]. CAP může způsobit více než 100 různých patogenů, z nich převládají bakterie. Etiologické agens SCAP se odlišuje od agens způsobující ostatní CAP [14]. Celosvětově nejčastějším patogenem způsobujícím SCAP je Streptococcus pneumoniae. Recentní studie, uvádí, že je odpovědný až za 60 % monomikrobiálních SCAP a je spoluodpovědný za 72 % polymikrobiálních SCAP [15]. Druhou nejčastější příčinou SCAP jsou gramnegativní patogeny (Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Proteus spp., Serratia spp., Acinetobacter spp.), které jsou nalézány u 11 – 35 % SCAP [15 – 17]. Častěji bývají přítomny u pacientů se strukturálními chronickými respiračními onemocněními. Častým příčinným patogenem SCAP je Staphylococcus aureus, který byl v některých studiích nalezen u 17 – 24 % případů SCAP [16,17]. V poslední době stoupá výskyt komunitně získaného meticilin rezistentního Staphylococcus aureus (CA-MRSA) [18]. Legionella pneumophila je také dobře známa jako příčina SCAP i imunitně podmíněného extrapulmonálního poškození. Z respiračních virů se uvádějí jako nejčastější etiologická agens SCAP rhinovirus, influenza, parainfluenza, respiračně syncytiální virus, adenoviry a humánní metapneumovirus. Není zcela jasný význam Mycoplasma pneumoniae a Chlamydophila pneumoniae v etiologii SCAP z důvodů obtížné diagnostiky těchto patogenů. Koinfekce více patogeny je prokazována u přibližně 20 % SCAP [15,19]. Společný nález bakteriálního a virového agens se dle recentních údajů zjišťuje u více než 1/ 5 případů SCAP [18]. Obecně má SCAP s polymikrobiální etiologií těžší průběh a horší prognózu než SCAP vyvolaná jedním patogenem [20].
Diagnostika SCAP
Kromě podrobné anamnézy a pečlivého fyzikálního vyšetření se uplatní celá řada dalších laboratorních a zobrazovacích metod. Výjimečně může být vstupní skiagram hrudníku negativní, pak je doporučeno provést CT vyšetření nebo zopakovat skiagram hrudníku během 24 – 48 hod. Dalším krokem je určení tíže pneumonie, ke kterému slouží mimo základních laboratorních metod hlavně vyšetření acidobazické rovnováhy a krevních plynů, laktátu, C-reaktivního proteinu (CRP), prokalcitoninu (PCT) a dalších parametrů. Komplexní diagnostiku a monitorování SCAP s výjimkou mikrobiologických testů zobrazuje tab. 4. Biomarkery zánětu jako jsou CRP a PCT mohou odlišit pneumonii od neinfekčního postižení plic [21,22]. Také se zdají být nadějnými pomocnými parametry tíže pneumonie a indikace přijetí na JIP [23]. V diagnostice původce těžké pneumonie je doporučeno vyšetření sputa, hemokultur, antigenů Streptococcus pneumoniae a Legionella pneumophila v moči [4]. Odběr biologických materiálů na vyšetření by měl být proveden před zahájením ATB léčby, ale jen pokud to nezvýší riziko pro nemocného [24]. Sputum je vyšetřováno mikroskopicky a kultivačně. Výtěžnost tohoto vyšetření se dle různých studií pohybuje v širokém rozmezí 10 – 86 %. Při mikroskopickém vyšetření se většinou používá barvení dle Grama, v indikovaných případech Ziehl-Neelsenovo barvení na acidorezistentní tyčinky nebo barvení dle Giemsy, které dobře zobrazí také houby vč. Pneumocystis jiroveci, prvoky a virové inkluze. Imunofluorescenční vyšetření sputa se uplatňuje v diagnostice pneumonií vyvolaných viry, legionellami a Pneumocystis jiroveci. Důležitá je správná technika odběru sputa a krátký časový interval mezi odběrem sputa a jeho vyšetřením v mikrobiologické laboratoři. U intubovaných pacientů se místo sputa vyšetřuje endotracheální aspirát. Dalším biologickým materiálem, který lze standardně mikrobiologicky vyšetřovat je pleurální výpotek. Odběr hemokultur je doporučen u všech nemocných se SCAP, a to i přes poměrně nízkou výtěžnost tohoto vyšetření, která se dle literatury pohybuje mezi 7 – 16 % případů. V diagnostice atypických agens jako je Chlamydophila pneumoniae nebo Mycoplasma pneumoniae je dnes doporučována kombinace sérologického vyšetření (hladina imunoglobulinu M, IgM) a molekulárně genetického vyšetření, tedy polymerázové řetězové reakce (polymerase chain reaction – PCR) [24]. Etiologické agens bývá zjištěno u 30 – 50 % případů pneumonií [14]. V posledních letech se rozvíjí metody molekulárně-genetické jako jsou PCR semikvantitativní nebo kvantitativní a řada amplifikačních testů. Velmi nadějně se v tomto směru jeví multiplexní PCR test k detekci 16 virových patogenů, Chlamydophila pneumoniae a Legionella pneumophila z nazofaryngeálního stěru. Při použití těchto metod výtěžnost diagnostiky mikrobiálního původce pneumonie dosahuje 66,7 – 89,0 % případů [25,26].
Table 4. Diagnostika a monitorování SCAP. 
SCAP – těžká komunitní pneumonie; CRP – C-reaktivní protein, CT – výpočetní tomografie, HRCT – výpočetní tomografie s vysokým rozlišením U nemocných, kde není zjištěn původce pneumonie a dochází k selhání empirické ATB léčby nebo těžké progresi choroby, se používají invazivní cílené odběry endoskopické (bronchoalveolární laváž – BAL, chráněná brush biopsie (protected specimen brush – PSB)) nebo punkční (transparietální punkce plic – TPP). Diferenciální diagnostika pneumonie je poměrně široká, řada onemocnění může imitovat klinický obraz pneumonie (kardiální selhání, plicní embolizace, neinfekční pneumonie, aspirace, malignita, vaskulitida, kontuze plíce a další).
Léčba SCAP
Terapie pneumonie je komplexní proces, který je složen z řady léčebných postupů (tab. 5). Základem terapie SCAP je samozřejmě ATB léčba. Zásadní je včasné podání ATB, které významně snižuje mortalitu a je efektivnější, než čekání na výsledky mikrobiologických vyšetření a cílené nastavení ATB terapie [27,28]. Empirická ATB léčba by měla být podána v co nejkratší době od přijetí nebo zjištění diagnózy, a to během prvních 4 – 6 hod, v případě těžké sepse nebo septického šoku již do 60 min [4,29,30]. Preferovaným typem ATB léčby je tzv. deeskalační terapie, kdy jsou empiricky nasazována širokospektrá ATB a dle výsledků mikrobiologických vyšetření jsou pak tato ATB měněna na ATB s užším spektrem působnosti. ATB léčba by měla být iniciálně podávána intravenózně. Přechod na perorální formu je možný, pokud je pacient klinicky zlepšen, hemodynamicky stabilní, schopen přijímat perorálně a má normální funkci gastrointestinálního traktu. Délka ATB léčby je min. 7 dnů, ale u SCAP je většinou delší v závislosti na klinickém průběhu a dalších faktorech. Neadekvátní a neúčinná ATB léčba významně zvyšuje mortalitu, a proto existuje řada národních i mezinárodních doporučení empirické ATB léčby CAP. Aktuální česká doporučení empirické léčby byla vypracována Českou pneumologickou a ftizeologickou společností [31,32]. Vhodná iniciální ATB léčba SCAP je uvedena v tab. 6. V případě infekce CA-MRSA je lékem první volby vankomycin, další možnosti je linezolid. Podání antivirotik by se měla zvážit u všech nemocných se SCAP a typickými chřipkovými příznaky [33]. SCAP je nejobvyklejší příčinou těžké sepse a orgánová selhání vyvolaná pneumonií se většinou manifestují velmi časně [3]. Pro terapii těžké sepse a septického šoku platí doporučení uvedená v příslušných guidelines. Další složkou terapie SCAP je léčba respiračního selhání. U většiny případů SCAP dochází k akutnímu hypoxemickému respiračnímu selhání (AHRS).První volbou bývá kontinuální oxygenoterapie s vysokým průtokem, resp. frakcí kyslíku. V poslední době se v řadě případů s úspěchem používá vysokoprůtoková nosní kanyla s průtokem kyslíku až 60 l/ min [34]. V případě těžkého AHRS je však tato léčba nedostatečná a neúspěšná. Další možností je neinvazivní ventilační podpora (NIV), která má překlenout období těžkého ARHS bez nutnosti endotracheální intubace se všemi doprovodnými komplikacemi jako jsou ventilátorová pneumonie, ventilátorem indukované plicní postižení a další. Tato metoda je ale u SCAP kontroverzní s vysokým procentem neúspěchu ve srovnání s použitím u jiných příčin AHRS [35]. U SCAP má NIV jednoznačně lepší výsledky u osob s respirační nebo kardiální komorbiditou oproti osobám s akutním respiračním selháním de novo, zvláště v případě chronické obstrukční plicní nemoci a srdečního selhání [35,36]. Dle současných guidelines není NIV jasně doporučena v léčbě CAP [4,14]. V případě kontraindikace, intolerance nebo selhání předchozí léčby respiračního selhání je indikována endotracheální intubace a invazivní ventilační podpora. Detaily této terapie přesahují rámec tohoto textu a jsou uvedeny v příslušných dokumentech. U přísně indikované skupiny pacientů, u kterých i přes výše uvedené postupy přetrvává hypoxemie, lze indikovat provedení extrakorporální membránové oxygenace.
Table 5. Léčba SCAP. 
SCAP – těžká komunitní pneumonie Table 6. Volba empirické ATB léčby SCAP. 
ATB – antibiotika; SCAP – těžká komunitní pneumonie Nutné je udržovat průchodné dýchací cesty, vč. případného bronchoskopického odsávání sekretů a nebulizace. Nezřídka je nutná tracheostomie. Jiná farmakologická léčba (mukolytika, expektorancia, antitussika, bronchodilatancia) se podává individuálně s přihlédnutím ke klinickým příznakům a celkovému stavu pacienta. Profylakticky se podává nízkomolekulární heparin ve zvyklé dávce a je indikována časná mobilizace jako prevence vzniku tromboembolické nemoci. Velmi důležitá, ale bohužel často opomíjená je respirační fyzioterapie. Samozřejmostí je adekvátní hydratace a udržování stálého vnitřního prostředí. Častá je malnutrice, která je multifaktoriální etiologie. Nutriční podpora může probíhat parenterální nebo enterální cestou, která je jednoznačně preferována, a to co nejdříve. Podrobnější popis nutriční podpory vychází z obecných doporučení a přesahuje rámec tohoto sdělení. U SCAP může na jedné straně dojít k sekundárnímu deficitu protilátkové a/ nebo buněčné imunity, na druhé straně k nadměrnému syndromu systémové zánětlivé odpovědi (SIRS) a septickému šoku. Při deficitu imunoglobulinů je indikována jejich substituce. U deficitu buněčné imunity je možno podat transfer faktor. Použití kortikoidů v léčbě SCAP je kontroverzní a názory se různí, lehce převažuje pozitivní pohled na jejich efekt [37,38].
Komplikace SCAP
U těžké pneumonie se často objevují komplikace (tab. 7). Dělí se na lokální, vznikající progresí základního patologického procesu, nebo jeho přestupem do okolí. Nejobávanější lokální komplikací je syndrom akutní respirační tísně (acute respiratory distress syndrome – ARDS), který je jednou z hlavních příčin vysoké mortality SCAP. Druhým typem jsou komplikace vzdálené, postihující jiné orgány, většinou hematogenním přenosem infekce. Časté jsou komplikace kardiální, protože CAP jsou asociovány s akutními postiženími srdce. Příčinou bývá hypoxemie, zánětlivý stav a kardiální stres. Tyto kardiální komplikace vedou ke klinickému zhoršení a zvyšují mortalitu [39,40]. Okolo 90 % těchto komplikací se objeví v prvních 7 dnech SCAP a více než polovina v prvních 24 hod [41].
Table 7. Komplikace pneumonie. 
Pneumonie nereagující na léčbu
V řadě případů diagnostikovaných a léčených jako těžká pneumonie není i přes správně nasazenou ATB a další léčbu dosaženo adekvátní klinické odpovědi (a to i po iniciální stabilizaci stavu). V tomto případě mluvíme o pneumonii neodpovídající na léčbu (nonresponding pneumonia). Tyto pneumonie nereagující na léčbu je možno rozdělit do dvou velkých skupin [42]. První je tzv. časná (progresivní) pneumonie, která se objevuje v prvních 72 hod od přijetí a projevuje se klinickým zhoršením, zvláště septickým šokem, nutností mechanické ventilace a změnou ATB léčby. Druhým typem je tzv. perzistující (neodpovídající) pneumonie, která se vyskytuje po > 72 hod od přijetí perzistujícími nebo rekurentními horečkami s respiračními symptomy, nutností mechanické ventilace a septickým šokem. Existuje celá řada příčin, které lze rozdělit do třech velkých skupin – mikrobiální, léčebné a pacientské (tab. 8).
Table 8. Příčiny „nonresponding“ pneumonie. 
ATBI – antibiotika; PSI – Pneumonia Severity Index Prognóza
Prognóza nemocných závisí hlavně na celkovém stavu pacienta a jeho rizikových faktorech. Rizikovými faktory mortality SCAP jsou systolický TK < 90 mm Hg, dechová frekvence > 30/ min, pH < 7,35, arteriální satO2 < 90 %, paO2 < 8,0 kPa, urea > 11,0 mmol/ l, potřeba mechanické ventilace, pozdní přijetí na JIP (≥ 2. den léčby), vyšší bakteriální nálož a bakteriemie [43,44]. Zdá se, že významný vliv na mortalitu má i typ původce pneumonie. Mortalita u gramnegativních bakterií je 41 %, u Staphylococcus aureus 32 %, u Streptococcus pneumoniae a Chlamydia pneumophila 12 – 15 %, u chřipky 9 % a Mycoplasma pneumoniae >1 % [45,46]. Mortalita SCAP se pohybuje mezi 8,8 – 36,5 % případů [45,47 – 50]. V případě závažných komplikací jako je akutní plicní postižení nebo ARDS přesahuje mortalita hrozivých 50 % [51].
Závěr
Těžké pneumonie zůstávají i přes moderní léčbu závazným medicínským problémem s poměrně vysokým výskytem závažných komplikací a mortalitou, u rizikových skupin i s obecně špatnou prognózou. Základem léčby pneumonie je ATB terapie, ventilační podpora u těžkého respiračního selhání a léčba septického stavu. Pět klíčových kroků pro nejlepší časnou léčbu SCAP jsou zhodnocení rizika (vč. pulzní oxymetrie a hladiny laktátu), časná tekutinová resuscitace, rychlá oxygenace, kombinovaná ATB léčba a rozhodnutí o přijetí na JIP [52].
Doručeno do redakce: 23. 7. 2019
Přijato po recenzi: 1. 8. 2019
MU Dr. Petr Jakubec, Ph.D.
Sources
1. Restrepo MI, Anzueto A. Severe community--acquired pneumonia. Infect Dis Clin North Am 2009; 23(3): 503 – 520. doi: 10.1016/ j.idc.2009.04.003.
2. Ananda-Rajah MR, Charles PG, Melvani S et al. Comparing the pneumonia severity index with CURB-65 in patients admitted with community acquired pneumonia. Scand J Infect Dis 2008; 40(4): 293 – 300. doi: 10.1080/ 00365540701663381.
3. Renaud B, Santin A, Coma E et al. Association between timing of intensive care unit admission and outcomes for emergency department patients with community-acquired pneumonia. Crit Care Med 2009; 37(11): 2867 – 2874. doi: 10.1097/ CCM.0b013e3181b02dbb.
4. Mandell LA, Wunderink RG, Anzueto A et al. IDSA/ ATS consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis 2007; 44 (Suppl 2): S27 – S72. doi: 10.1086/ 511159.
5. British Thoracic Society Standards of Care Committee. BTS guidelines for the management of community acquired pneumonia in adults. Thorax 2001; 56 (Suppl 4): 1 – 64. doi: 10.1136/ thorax.56.suppl_4.iv1.
6. Bauer, TT, Ewig, S, Marre R et al. CRB-65 predicts death from community-acquired pneumonia. J Intern Med 2006; 260(1): 93 – 101. doi: 10.1111/ j.1365-2796.2006.01657.x.
7. Marti C, Garin N, Grosgurin O et al. Prediction of severe community-acquired pneumonia: a systematic review and meta-analysis. Crit Care 2012; 16(4): R141. doi: 10.1186/ cc11447.
8. Li HY, Guo Q, Song WD et al. Priority for treatment and intensit care of patients with non-severe community-acquired pneumonie. Am J Med Sci 2018; 356(4): 329 – 334. doi: 10.1016/ j.amjms.2018.08.002.
9. West FM, Awsare BK. Putting the CAP on ICU admissions: can clinical prediction tools help determine appropriate site of care? Am J Med Sci 2018; 356(4): 313 – 314. doi: 10.1016/ j.amjms.2018.08.007.
10. Guo Q, Song WD, Li HY et al. Scored minor criteria for severe community-acquired pneumonia predicted better. Respir Res 2019; 20(1): 22. doi: 10.1186/ s12931-019-0991-4.
11. Karhu J, Ala-Kokko TI, Ohtonen P et al. Severe community-acquired pneumonia treated with beta-lactam-respiratory quinolone vs. beta-lactam-macrolide combination. Acta Anaesthesiol Scand 2013; 57(5): 587 – 593. doi: 10.1111/ aas.12081.
12. Ewig S, Woodhead M, Torres A. Towards a sensible comprehension of severe community-acquired pneumonia. Intensive Care Med 2011; 37(2): 214 – 223. doi: 10.1007/ s00134-010-2077-0.
13. Jain S, Self WH, Wunderink RG et al. Community-acquired pneumonia requiring hospitalization among U.S. adults. N Engl J Med 2015; 373(5): 415 – 427. doi: 10.1056/ NEJMoa1500245.
14. Lim WS, Baudouin SV, George RC et al. BTS guidelines for the management of community acquired pneumonia in adults: update 2009. Thorax 2009; 64 (Suppl 3): 1 – 55. doi: 10.1136/ thx.2009.121434.
15. Cillóniz C, Ewig S, Ferrer M et al. Community--acquired polymicrobial pneumonia in the intensive care unit: aetiology and prognosis. Crit Care 2011; 15(5): R209. doi: 10.1186/ cc10444.
16. Kawai S, Ochi M, Nakagawa T et al. Antimicrobial therapy in community-acquired pneumonia among emergency patients in a university hospital in Japan. J Infect Chemother 2004; 10(6): 352 – 358. doi: 10.1007/ s10156-004-0350-2.
17. Shah BA, Singh G, Naik MA et al. Bacteriological and clinical profile of Community acquired pneumonia in hospitalized patients. Lung India 2010; 27(2): 54 – 57. doi: 10.4103/ 0970-2113.63606.
18. Cillóniz C, Dominedo C, Nicolini A et al. PES pathogens in severe community-acquired pneumonia. Microorganisms 2019; 7(2): 49. doi: 10.3390/ microorganisms7020049.
19. Cillóniz C, Ewig S, Polverino E et al. Community--acquired pneumonia in outpatients: etiology and outcomes. Eur Respir J 2010; 40(4): 931 – 938.
20. Johansson N, Kalin M, Hedlund J. Clinical impact of combined viral and bacterial infection in patients with community-acquired pneumonia. Scand J Infect Dis 2011; 43(8): 609 – 615. doi: 10.3109/ 00365548.2011.570785.
21. Gilbert DN. Procalcitonin as a biomarker in respiratory tract infection. Clin Infect Dis 2011; 52 (Suppl 4): 346 – 350. doi: 10.1093/ cid/ cir050.
22. Ramírez P, Ferrer M, Martí V et al. Inflammatory biomarkers and prediction for intensive care unit admission in severe community-acquired pneumonia. Crit Care Med 2011; 39(10): 2211 – 2217. doi: 10.1097/ CCM.0b013e3182257445.
23. Krüger S, Ewig S, Marre R. Procalcitonin predicts patients at low risk of death from community-acquired pneumonia across all CRB-65 classes. Eur Respir J 2008; 31(2): 349 – 355. doi: 10.1183/ 09031936.00054507.
24.Woodhead M, Blasi F, Ewig S et al. Guidelines for the management of adult lower respiratory tract infections – summary. Clin Microbiol Infect 2011; 17 (Suppl 6): 1 – 24. doi: 10.1111/ j.1469-0691.2011.03602.x.
25. Johansson N, Kalin M, Tiveljung-Lindell A et al. Etiology of community-acquired pneumonia: increased microbiological yield with new diagnostic methods. Clin Infect Dis 2010; 50(2): 202 – 209. doi: 10.1086/ 648678.
26. Shibli F, Chazan B, Nitzan O et al. Etiology of community-acquired pneumonia in hospitalized patients in northern Israel. Isr Med Assoc J 2010; 12(8): 477 – 482.
27. Garin N, Marti C. Community-acquired pneumonia: the elusive quest for the best treatment strategy. J Thorac Dis 2016; 8(7): E571 – E574. doi: 10.21037/ jtd.2016.05.13.
28. Lee JS, Giesler DL, Gellad WF et al. Antibiotic therapy for adults hospitalized with community--acquired pneumonia: a systematic review. JAMA 2016; 315(6): 593 – 602. doi: 10.1001/ jama.2016.0115.
29. Dellinger RP. A lifetime of critical care: changes. Crit Care Med 2016; 44(4): 653 – 654. doi: 10.1097/ CCM.0000000000001734.
30. Gattarello S, Lagunes L, Vidaur L et al. Improvement of antibiotic therapy and ICU survival in severe non-pneumococcal community-acquired pneumonia: a matched case-control study. Crit Care 2015; 19 : 335. doi: 10.1186/ s13054-015-1051-1.
31. Kolek V, Kolář M, Kašák V a kol. Diagnostika a léčba komunitní pneumonie dospělých. In: Kolek Vet al. Doporučené postupy v pneumologii. Praha: Maxdorf 2013 : 107 – 123.
32. Jakubec P, Kolek V, Kolář M. Diagnostika a léčba těžké pneumonie. In: Kolek V a kol. Doporučené postupy v pneumologii. Praha: Maxdorf 2013 : 124 – 140.
33. Muthuri SG, Venkatesan S, Myles PR et al. Effectiveness of neuraminidase inhibitors in reducing mortality in patients admitted to hospital with influenza A H1N1pdm09 virus infection: a meta-analysis of individual participant data. Lancet Respir Med 2014; 2(5): 395 – 404. doi: 10.1016/ S2213-2600(14)70041-4.
34. Frat JP, Arnaud WT, Mercat A et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med 2015; 372(23): 2185 – 2196. doi: 10.1056/ NEJMoa1503326.
35. Ferrer M, Cosentini R, Nava S. The use of non-invasive ventilation during acute respiratory failure due to pneumonia. Eur J Inter Med 2012; 23(5): 420 – 428. doi: 10.1016/ j.ejim.2012.02.011.
36. Stefan MS, Priya A, Pekow PS et al. The comparative effectiveness of nonivasive and invasive ventilation in patients with pneumonia. J Crit Care 2018; 43 : 190 – 196. doi: 10.1016/ j.jcrc.2017.05.023.
37. Wan YD, Sun TW, Liu ZQ et al. Efficacy and safety of corticosteroids for community-acquired pneumonia: a systematic review and meta-analysis. Chest 2016; 149(1): 209 – 219. doi: 10.1378/ chest.15-1733.
38. Huang J, Guo J, Li H et al. Efficacy and safety of adjunctive corticosteroids therapy for patients with severe community-acquired pneumonia. A systematic review and meta-analysis. Medicine 2019; 98(13): e14636. doi: 10.1097/ MD.0000000000014636.
39. Corrales-Medina VF, Musher DM, Shachkina Set al. Acute pneumonia and the cardiovascular system. Lancet 2013; 381(9865): 496 – 505. doi: 10.1016/ S0140-6736(12)61266-5.
40. Viasus D, Garcia-Vidal C, Manresa F et al. Risk stratification and prognosis of acute cardiac events in hospitalized adults with community-acquired pneumonia. J Infect 2013; 66(1): 27 – 33. doi: 10.1016/ j.jinf.2012.09.003.
41. Feldman C, Anderson R. Prevalence, pathogenesis, therapy, and prevention of cardiovascular events in patients with community-acquired pneumonia. Pneumonia 2016; 8 : 11. doi: 10.1186/ s41479-016-0011-0.
42. Goncalves-Pereira J, Conceicao C, Póvoa P. Community-acquired pneumonia: identification and evaluation of nonresponders. Ther Adv Infect Dis 2013; 1(1): 5 – 17. doi: 10.1177/ 2049936112469017.
43. Metersky ML, Waterer G, Nsa W et al. Predictors of in-hospital vs postdischarge mortality in pneumonia. Chest 2012; 142(2): 476 – 481. doi: 10.1378/ chest.11-2393.
44. Restrepo MI, Mortensen EM, Rello J et al. Late admission to the ICU in patients with community-acquired pneumonia is associated with higher mortality. Chest 2010; 137(3): 552 – 557. doi: 10.1378/ chest.09-1547.
45. Fine MJ, Smith MA, Carson CA et al. Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis. JAMA 1996; 275(2): 134 – 141.
46. Kothe H, Bauer T, Marrer R et al. Outcome of community-acquired pneumonia: influence of age, residence status, and antimicrobial treatment. Eur Respir J 2008; 32(1): 139 – 146. doi: 10.1183/ 09031936.00092507.
47. Sligl WI, Eurich DT, Marrie TJ. Only severely limited, premorbid functional status is associated with short - and long-term mortality in patients with pneumonia who are critically ill: a prospective observational study. Chest 2011; 139(1): 88 – 94. doi: 10.1378/ chest.10-1054.
48. Lindenauer PK, Lagu T, Shieh MS et al. Association of diagnostic coding with trends in hospitalizations and mortality of patients with pneumonia, 2003–2009. JAMA 2012; 307(13): 1405 – 1413. doi: 10.1001/ jama.2012.384.
49. Nair GB, Niederman MS. Community-acquired pneumonia: an unfinished battle. Med Clin North Am 2011; 95(6): 1143 – 1161. doi: 10.1016/ j.mcna.2011.08.007.
50. Karhu J, Ala-Kokko TI, Ylipalosaari P et al. Hospital and long-term outcomes of ICU-treated severe community - and hospital-acquired, and ventilator-associated pneumonia patients. Acta Anaesthesiol Scand 2011; 55(10): 1254 – 1260. doi: 10.1111/ j.1399-6576.2011.02535.x.
51. Carron M, Freo U, Zorzi M et al. Predictors of failure of noninvasive ventilation in patients with severe community-acquired pneumonia. J Crit Care 2010; 25(3): 540.e9 – e14. doi: 10.1016/ j.jcrc.2010.02.012.
52. Rello J. Demographics, guidelines, and clinical experience in severe community-acquired pneumonia. Crit Care 2008; 12 (Suppl 6): S2. doi: 10.1186/ cc7025
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2019 Issue 3-
All articles in this issue
- Srdeční selhání a chronická obstrukční plicní choroba
- Plicní hypertenze a syndrom obstrukční spánkové apnoe
- Epidemiologie tuberkulózy
- Těžká komunitní pneumonie
- Idiopatická plicní fibróza – změny v diagnostice a léčbě
- Postižení plíce při užívání amiodaronu – „amiodaronová plíce“
- Sarkoidóza – aktuální pohled na patogenezi, diagnostiku a léčbu
- Kardiovaskulární působení rekreačních drog (kokain, marihuana, metamfetamin)
- PCSK9 inhibitory v klinické praxi – update
- Subfrakcie HDL častíc u srdcového zlyhávania
- Evropský a světový kardiologický sjezd – Paříž 2019
- V hlavní roli adherence - Kongres Evropské společnosti pro hypertenzi, Miláno 2019
- Simultánní intervence více rizikových faktorů – cesta k účinnému snížení kardiovaskulárního rizika
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kardiovaskulární působení rekreačních drog (kokain, marihuana, metamfetamin)
- Sarkoidóza – aktuální pohled na patogenezi, diagnostiku a léčbu
- Epidemiologie tuberkulózy
- PCSK9 inhibitory v klinické praxi – update
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

