-
Medical journals
- Career
Polyfarmakoterapie ve stáří – lékové interakce nejčastěji předepisovaných lékových skupin v kardiologii
Authors: H. Matějovská Kubešová; K. Bielaková; O. Výška; S. Surková; D. Prudius; K. Greplová
Authors‘ workplace: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Published in: Kardiol Rev Int Med 2018, 20(1): 22-28
Overview
V přehledovém článku autoři zdůrazňují specifický rys starší populace – nárůst počtu chorob s následným nárůstem počtu druhů užívaných medikamentů, vyšší pravděpodobností výskytu nežádoucích účinků léků a lékových interakcí a chyb v užívání medikace. Daná situace vyžaduje tvorbu jednoduchého a bezpečného konečného lékového schématu a při pochybnostech o schopnosti staršího nemocného užívat medikamenty bez chyb i zajištění asistence. Dále je zmíněn vývoj systémů kritérií pro zvýšení bezpečnosti terapie starších nemocných od původních Beersových kritérií až po současně užívaná STOPP-START kritéria. Pozornost je věnována nejčastěji užívaným lékovým skupinám – inhibitorům angiotenzin konvertujícího enzymu, betablokátorům, blokátorům kalciového kanálu, diuretikům a statinům. Závěrečná část přehledu je věnována vztahu ztráty soběstačnosti a vyplývajícím rizikům pro bezpečnost farmakoterapie. Článek je zakončen tabulkou s formulací zásad preskripce pro starší nemocné.
Klíčová slova:
polymorbidita – polyfarmakoterapie – lékové interakce – nežádoucí účinky léků – adherence – soběstačnost – kognitivní deficitÚvod
Přibývající počet chorob ve stáří vede ke zvyšování počtu užívaných léků. Na výsledném lékovém schématu, ale také na konečném efektu farmakoterapie u starších nemocných, se podílí řada faktorů (tab. 1).
Table 1. Faktory ovlivňující složení a efektivitu lékového schématu staršího nemocného. 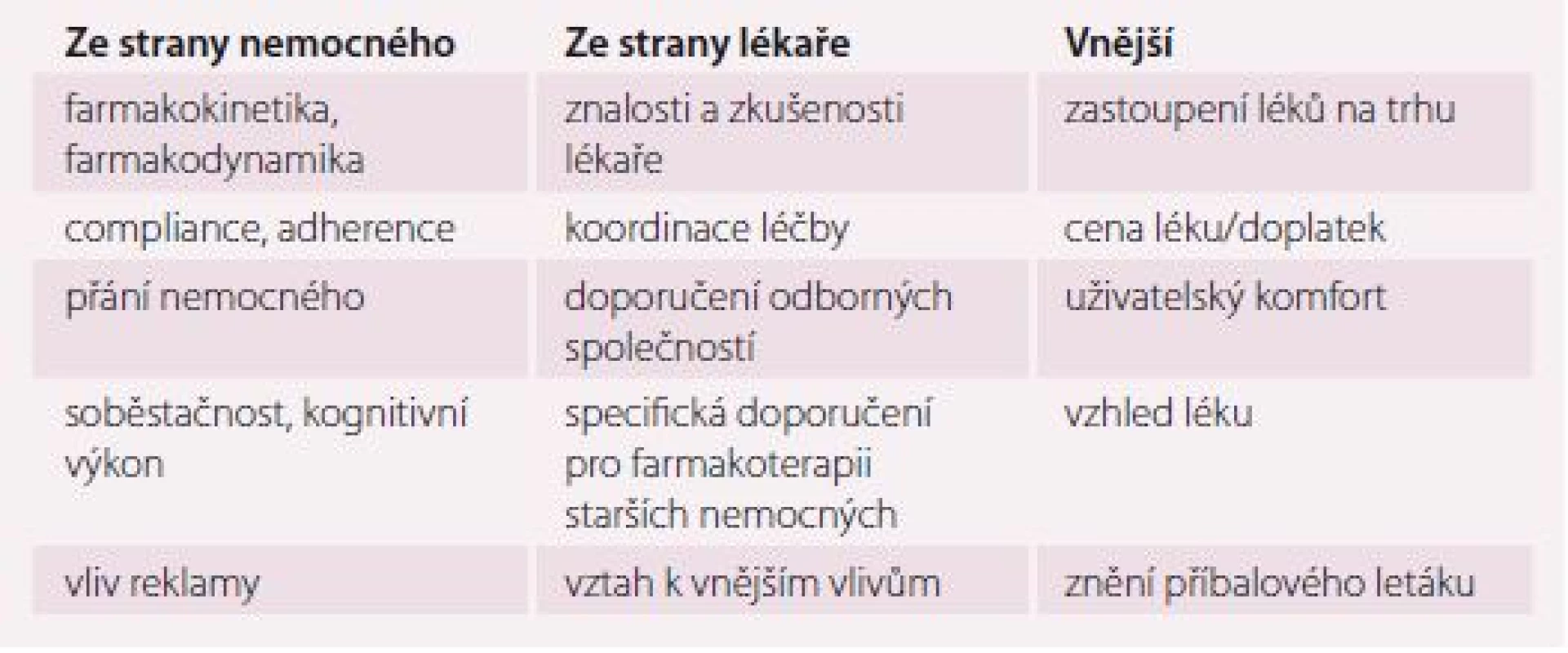
Faktory ovlivňující složení a efektivitu lékového schématu staršího nemocného
Důsledné dodržování doporučení odborných společností u nemocného s onemocněními 3 – 4 orgánových soustav potom vyústí v enormně složité a početné lékové schéma. Mnoha studiemi staršími i novějšími je prokázáno, že čím vyšší počet léků nemocný užívá, tím vyššího počtu chyb se dopouští, a tím významněji klesá jeho compliance i adherence k léčbě. Součet, či možná spíše součin těchto vlivů potom dává známý fakt, že až 28 % hospitalizací seniorů je způsobeno chybami v užívání léků, nežádoucími účinky medikace nebo lékovými interakcemi [1,2].
Hlavním rizikem užívání vyššího počtu druhů léků je nárůst výskytu nežádoucích účinků léčby, kdy např. při průměrném počtu 6 užívaných druhů léků musíme očekávat výskyt nežádoucích účinků u každého 10. nemocného, zatímco při užívání 2 druhů léků pouze u každého 50. nemocného. Z hlediska lékových interakcí je teoreticky možný exponenciální nárůst, přičemž samozřejmě jen některé interakce jsou klinicky závažné. Za nejzávažnější je nutno považovat interakce warfarinu, perorálních antidiabetik, blokátorů protonové pumpy, antiarytmik, prednisonu, digoxinu a v poslední době i přímých orálních antikoagulancií (DOAC). Zástupci těchto skupin medikamentů podávané současně s dalšími léčivy mohou podstatným způsobem ovlivnit jejich účinnost či výskyt nežádoucích vedlejších účinků [3].
K dosažení optimálního efektu farmakoterapie u staršího nemocného je vhodné, aby konečné lékové schéma vytvářel jeden lékař, který má k dispozici vyjádření všech specialistů pečujících o daného nemocného, který zná nemocného dlouhodobě a je schopen určit vývoj jeho soběstačnosti a kognitivního výkonu.
Náš současný systém zdravotnické péče je z tohoto pohledu nevýhodný právě ve smyslu absence jednoho koordinátora léčby u staršího nemocného. V zemích se stabilním vývojem zdravotnického systému se osvědčil a osvědčuje model praktického lékaře jako „gatekeepera“ a následně i finálního koordinátora léčby. U nás zejména ve větších městech dochází z historických důvodů a také z důvodů geografické dostupnosti ordinací specialistů k jevu „cestovatelství“ pacientů po specializovaných ambulancích. Důsledkem je potom situace, že se v domácnosti staršího nemocného kupí medikamenty doporučené nejen praktickým lékařem, ale i několika specialisty. Za této situace citelně chybí koordinátor, který by vytvořil konečné, racionální, jednoduché a zároveň srozumitelné a bezpečné schéma užívání medikace, toto schéma modifikoval podle případných nových doporučení, ale také pravidelně revidoval z hlediska medikamentů již nepotřebných [4].
Rizika farmakoterapie vyplývající z přidružených chorob
Přítomnost přidružených chorob zvyšuje zásadním způsobem riziko výskytu lékových interakcí, a to jednak interakce lék × lék, ale také interakce lék × choroba, případně interakce lék × potravina. Jako příklad lze uvést nemocného s astmatem, který má zároveň kloubní obtíže - budou-li nemocnému podle zaužívaných postupů doporučena nesteroidní antirevmatika, může se bronchiální obstrukce zásadním způsobem zhoršit. Velmi rizikovou interakci lék × potravina představuje lidové doporučení grapefruitové šťávy jako prostředku zesilujícího účinek medikamentů. Tento mocný inhibitor cytochromů může zvýšit například efekt analgetik, ale také zvýšit sérovou hladinu mnoha dalších medikamentů se zvýšením frekvence výskytu nežádoucích vedlejších účinků až známek toxicity. Toto zjištění bylo učiněno v roce 1989 náhodou, při sledování vlivu alkoholu na farmakodynamiku felodipinu. Dobrovolníci dostávali k zapíjení léku a zamaskování chuti alkoholu grapefruitový džus a následně pak bylo naměřeno mnohonásobně vyšší množství léku v krvi. Tento efekt byl potvrzen i pozdějšími studiemi [5,6].
Z pohledu nežádoucích interakcí nejrůznějšího druhu bylo vypracováno postupně již několik systémů kritérií hodnocení léků, např. Beersova kritéria vydaná poprvé v roce 1991 [7] a dále aktualizovaná [8 – 10], McLeodova kritéria [11] atd. Tyto systémy upozorňují na léky nevhodné pro seniory, z nichž však mnohé jsou v rutinní praxi běžně používány jednak z neznalosti, ale také proto, že za ně dosud není adekvátní náhrada. Tyto pomocné systémy tedy nezakazují příslušný lék předepisovat, ale pokud jej lékař do schématu medikace zařadí, měl by si být vědom určitého rizika, nemocného poučit o možných nežádoucích projevech a alespoň zpočátku podávání rizikové léčby více sledovat.
Systém, který nejen upozorňuje na nevhodné léky, ale i na léky, které by naopak seniorům měly být podávány, je nazván STOPP-START a byl publikován v roce 2007 [12] (STOPP – screening tool of older people’s potentially inapropriate prescriptions, START – screening tool to alert doctors to right appropriate, indicated treatment), česká modifikace těchto kritérií byla publikována v roce 2008 [13]. V roce 2013 byla tato česká modifikace formou Delphi konsenzu a expertního panelu aktualizována [14].
Obecně platí, že by mělo být u staršího nemocného ukončeno podávání preparátu, který není indikován dle aktuálních klinických doporučení, jehož indikovaná doba podávání již uplynula a který je podáván současně s dalším preparátem stejné indikační skupiny. Specifická kritéria STOPP-START pro kardiovaskulární a související koagulační systém ukazuje tab. 2 [15].
Table 2. Kritéria STOPP-START pro kardiovaskulární a koagulační systém. 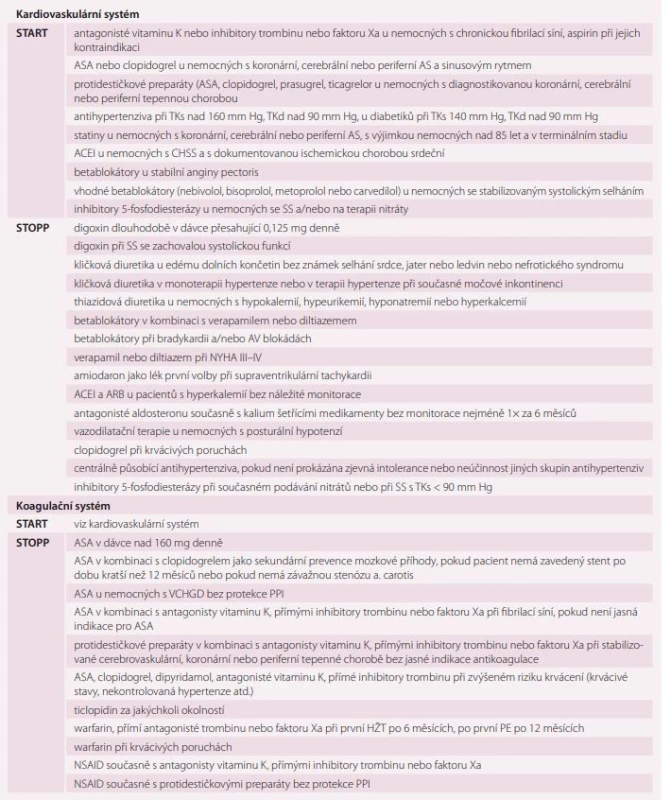
AIM – akutní infarkt myokardu, AS – ateroskleróza, HŽT – hluboká žilní trombóza, ASA – kyselina acetylsalicylová, ACEI – inhibitory angiotenzin konvertujícího enzymu, ARB – blokátory receptorů AT1 pro angiotenzin II, DM – diabetes mellitus, TEN – tromboembolická nemoc, NSAID – nesteroidní antirevmatika, VCHGD – vředová choroba gastroduodena, HT – hypertenze, CHSS – chronické srdeční selhání, CHRI – chronická renální insuficience (Mahoney), PPI – blokátory protonové pumpy, TKs – systolický krevní tlak, TKd – diastolický krevní tlak, PE – plicní embolie Trojice nejdiskutovanějších, ale také nejčastěji chronicky předepisovaných medikamentů či lékových skupin vzbuzujících rozpaky při zavádění do terapie, při posuzování očekávaných interakcí, nežádoucích účinků terapie i při vysazování, je amiodaron, blokátory protonové pumpy a statiny. Amiodaron je se svou excesivní dávkou jódu rizikem vzniku nebo manifestace tyreopatie [16], blokátory protonové pumpy s jejich mohutným potenciálem ovlivnění cytochromů, a tím i efektu mnohých dalších medikamentů [1], statiny s jejich opakovaně prokázanou profylaktickou efektivitou na jedné straně, ale s velmi častou bolestivostí dolních končetin bez průkazu myolýzy, kterou umíme jen velmi málo ovlivnit [17]. Medikace touto trojicí vyžaduje trvale velké pozornosti a obezřetnosti, zejména při akutních změnách stavu, kdy jsou do terapie zaváděny nové medikamenty.
Inhibitory angiotenzin konvertujícího enzymu
Významné a bohužel často opomíjené jsou možné interakce s další kardiologickou, ale i nekardiologickou medikací. Právě podávání inhibitorů angiotenzin konvertujícího enzymu (ACEI) změnilo naše nazírání na hladinu kalia u kardiaků i hypertoniků. V dobách, kdy byla terapie srdečního selhání (SS) vedena kombinací digoxinu a diuretik, byla naší hlavní obavou hypokalemie, která zvyšovala toxicitu digoxinu, a pohotovost k arytmiím. Dbali jsme tedy, aby diuretická terapie byla buď v kombinaci s kalium šetřícím diuretikem nebo suplementací kalia. V současné době řešíme problematiku opačnou – ACEI mají již podstatou svého účinku tendenci způsobovat hyponatremii a hyperkalemii a v kombinaci s kalium šetřícími diuretiky, zvláště s antagonisty aldosteronu, až život ohrožující hyperkalemii. Nejsou výjimkou sérové koncentrace kalia až 8,5 mmol/ l [18]. Z hlediska adekvátní péče o seniory je významná polemika mezi dialyzačními středisky o indikaci hemodialýzy u farmakologicky indukované hyperkalemie (tab. 3).
Table 3. Nejčastější interakce ACEI. 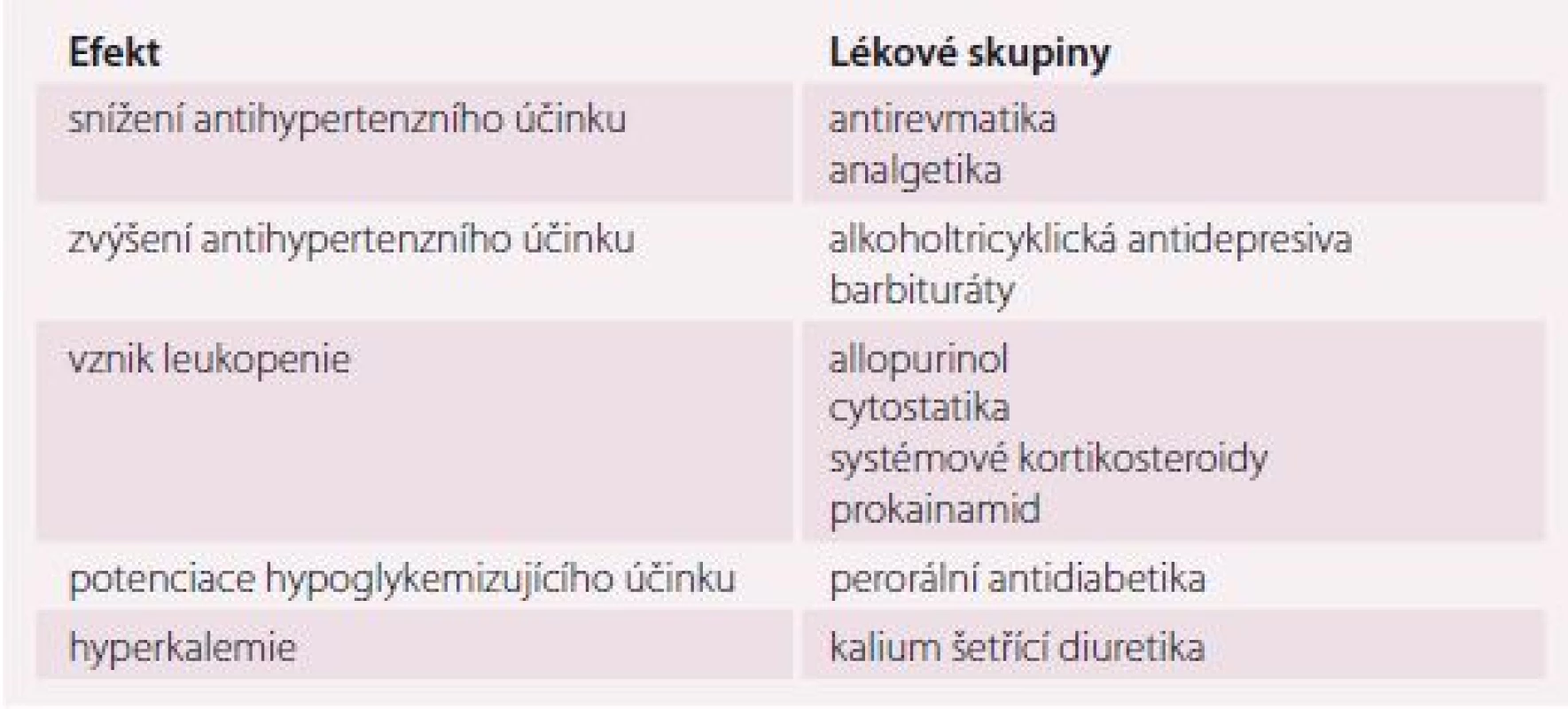
Betablokátory
Betablokátory jsou v dnešní době lékovou skupinou se zcela nepochybně a opakovaně prokázaným příznivým vlivem na morbiditu i mortalitu ischemické choroby srdeční (ICHS). Jsou upřednostňovány v dnešní době v terapii arytmií před ostatními antiarytmiky právě pro svůj dlouhodobý příznivý efekt oproti původním klasickým antiarytmikům. U starších hypertoniků, zvláště se systolickou hypertenzi, je vhodné využít blokády betareceptorů k ovlivnění systolického krevního tlaku. Relativně častou indikací podání ve vyšším věku je i hypertyreóza.
Z hlediska rizik u starších nemocných je nutno mít na paměti, že i nepatrná dávka může u citlivějších seniorů vyvolat závažnou bradykardii a poruchy atrioventrikulárního převodu až s klinickými projevy závratí a pádů s možností závažných poranění. Nejednou je možno zrušit u staršího nemocného s prokázanou atrioventrikulární blokádou plánovanou implantaci kardiostimulátoru, protože kontrolní Holterovo monitorování prokázalo po vysazení poslední minimální dávky betablokátoru vymizení blokády a zrychlení tepové frekvence na zcela přijatelné hodnoty. Tento efekt může být samozřejmě umocněn podáváním dalších medikamentů – nejdéle známe v tomto smyslu efekt digoxinu, v současné době přistupuje i relativně často předepisovaná skupina antidepresiv typu SSRI. Tento vztah potvrdila metaanalýza zkoumající vliv medikace seniorů na výskyt pádů – samotným betablokátorům je přisuzován jen nevýznamný negativní vliv, v kombinaci s dalšími rizikovými skupinami medikamentů však dochází k potenciaci [19]. Opomíjeným vlivem, který může potencovat vznik AV blokády vyšších stupňů při terapii betablokátory, je hypotyreóza.
V případě nežádoucího poklesu krevního tlaku (TK) či tepové frekvence při léčbě starších nemocných s chronickým SS by betablokátory měly být upřednostňovány před ostatními antihypertenzivy nebo bradykardizujícími preparáty [20]. V této oblasti jsou v posledních letech hojně využívány blokátory α - i β-adrenergního účinku – vůbec poprvé proběhla multicentrická, dvojitě slepá, randomizovaná studie CIBIS-ELD srovnávající u starších nemocných s chronickým SS efekt vysoce kardioselektivního betablokátoru bisoprololu a alfa - i betablokátoru carvedilolu. Studie ukázala, že titrace dávky betablokátorů je obtížnější, ale tolerabilita obou preparátů byla podobná [21].
Doporučovány jsou vysoce selektivní betablokátory bisoprolol nebo nebivolol. Souhrnná metaanalýza porovnávající efektivitu bisoprololu, metoprololu s řízeným uvolňováním, carvedilolu a nebivololu u starších nemocných s chronickým SS však ukázala, že při porovnatelné tolerabilitě je nebivolol méně efektivní [22].
Pozdější analýza efektu podle míry redukce ejekční frakce však prokázala, že významněji z léčby profitovali nemocní s nižší ejekční frakcí. Vznikla tedy pochybnost o signifikantním klinickém benefitu podávání betablokátorů u starších nemocných s chronickým SS se zachovalou ejekční frakcí [23]
Celé skupiny betablokátorů se vzhledem k vysokému výskytu diabetu u nemocných vyššího věku týká interakce lék × choroba ve smyslu maskování příznaků hypoglykemie, a potenciace cévních komplikací diabetu. Volbou novějších selektivních betablokátorů lze tato rizika zmírnit, v praxi se ale setkáváme s jevem určité nežádoucí setrvačnosti v preskripci. Tendence léčit starší nemocné právě s kombinací hypertenze a diabetu zastaralými medikamenty byla prokázána zejména u nemocných s kognitivním deficitem (tab. 4) [24].
Table 4. Nejvýznamnější lékové interakce betablokátorů. 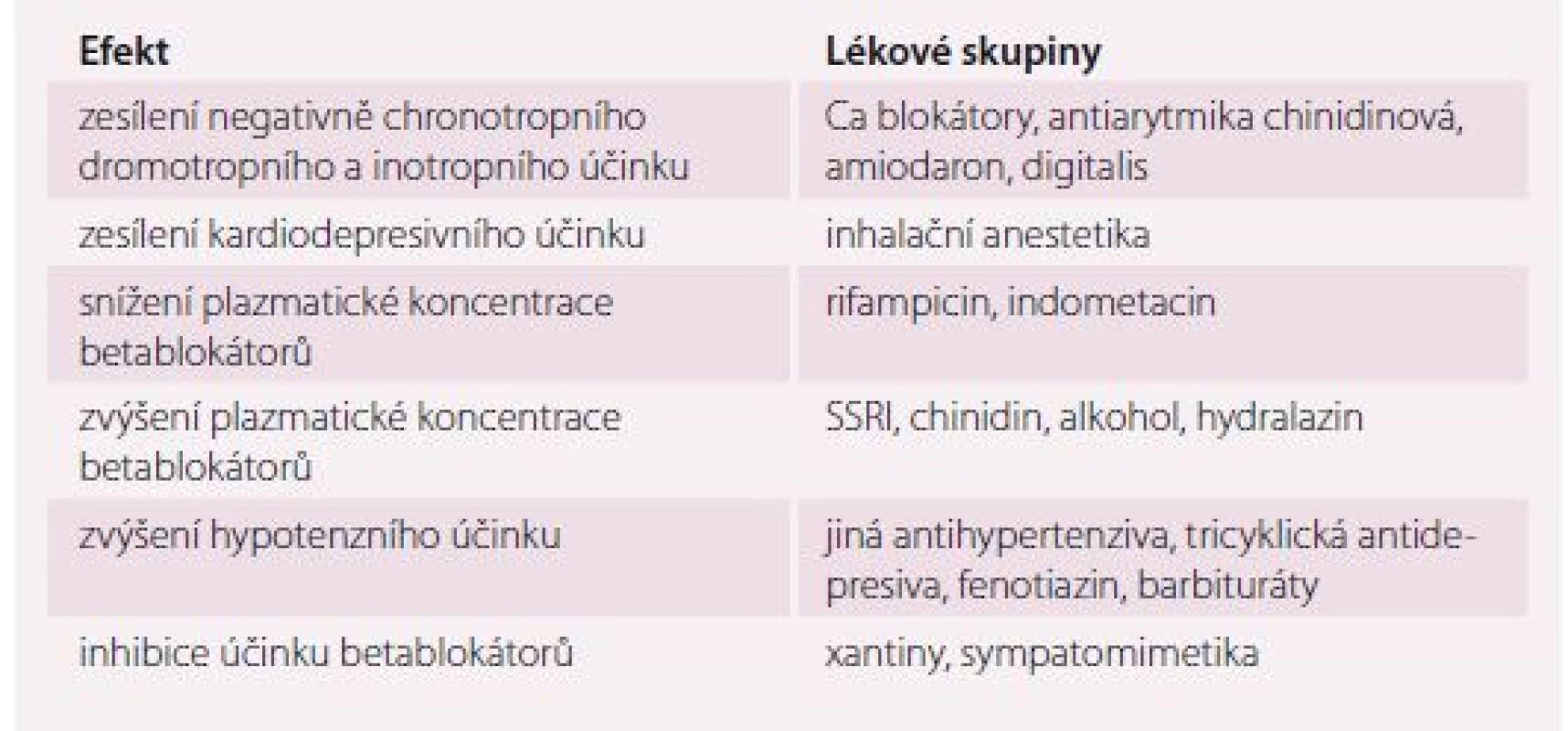
SSRI – serotoninová antidepresiva Blokátory kalciového kanálu
Relaxace hladké arteriální svaloviny je nejvýraznějším účinkem této lékové skupiny – efektu se využívá při snaze o ovlivnění zejména epikardiální části koronárního řečiště, k terapii hypertenze, ke snížení periferní cévní rezistence při námahové angině pectoris a při SS – to vše při minimálním efektu inotropním a dromotropním.
U starších nemocných se obvykle uchylujeme k přidání do kombinační léčby hypertenze, pokud dosavadní kombinací nebylo dosaženo požadovaného efektu, podobně i u anginy pectoris. Dva dříve referované nejčastější nežádoucí účinky se po zavedení retardovaných forem vyskytují podstatně řidčeji. Na druhé straně již studie Syst-Eur napověděla o možném pozitivním efektu této lékové skupiny na vývoj kognitivního výkonu u starších nemocných a další studie tyto efekty nejen u kalciových blokátorů, ale i u skupiny blokátorů angiotenzinových receptorů potvrzují [25,26].
U starších nemocných jsou možnosti terapie kalciovými blokátory omezené jejich relativní kontraindikací u stenotických vad – zvláště aortální stenóza aterosklerotického původu různé závažnosti se vyskytuje podle zkušenosti až u pětiny nemocných (tab. 5).
Table 5. Nejčastější lékové interakce blokátorů kalciového kanálu. 
Diuretika
Nejčastěji jsou předepisována diuretika kličková a thiazidová, chlorthalidon je v monoterapii pokládán za nevhodný u seniorů, protože může způsobovat hypokalemii a interindividuálně rozdílné, ne vždy předvídatelné ztráty tekutin.
Furosemid jako kličkové diuretikum může způsobovat ztráty kalia, kalcia, magnézia a natria – podáván po dlouhou dobu měsíců či dokonce let bez kontroly sérových hladin minerálů může vést zpočátku ke zvýšené nervosvalové dráždivosti, křečím či arytmiím. Hypomagnesemie způsobuje častější a těžší záchvaty anginy pectoris, později dochází až k těžkému, život ohrožujícímu minerálnímu rozvratu.
V terapii SS je nyní s výhodou kombinován s ACEI. Je však nutno mít na paměti vzájemný potencující vliv na vznik hyponatremie – v současné době nejčastější minerální poruchu u geriatrických nemocných, která v akutních stavech významně zhoršuje prognózu nemocných [27 – 29].
Thiazidová diuretika jsou indikována častěji při terapii hypertenze, u starších nemocných je však jejich preskripce limitována jednak pro jejich praktickou neúčinnost při snížené funkci ledvin (pokles GF pod 0,5 ml/ s), jednak by neměla být podávána diabetikům pro možnost zhoršení ledvinných funkcí při diabetické nefropatii a pro zhoršení kompenzace diabetu. Podávání thiazidových diuretik vede k retenci kyseliny močové až po možnost vyvolání dnavého záchvatu.
U těchto starších nemocných by optimální podávaná dávka hydrochlorothiazidu měla být 12,5 mg a neměla by překročit 25 mg denně. Podávání takto nízkých dávek thiazidových diuretik k antihypertenzní terapii je prospěšné z hlediska kompenzace systolického TK a významně neovlivňuje metabolizmus, vč. kompenzace diabetu. V tabletě běžně předepisovaných kombinovaných preparátů je však dávka hydrochlorothiazidu dvojnásobná, tedy 50 mg.
Při podávání indapamidu je u starších nemocných nutno očekávat podobnou situaci, zejména u dávek vyšších než 2,5 mg je výrazněji vyjádřen saluretický efekt.
Obecně je nutno na staršího nemocného léčeného diuretiky pohlížet při jakékoli i nepříliš velké ztrátě tekutin jako na ohroženého akutním vznikem dehydratace se všemi důsledky, vč. prerenálního selhání ledvin a mozkové dysfunkce s delirantním stavem.
Z hlediska režimu podávání diuretik je nutno samozřejmě respektovat podání v ranních hodinách, aby se nezvyšoval počet nočních mikcí a nezhoršovala se compliance nemocného. Dalším velkým úskalím v diuretické terapii seniorů je inkontinence – po zavedení diuretické terapie se mohou příznaky inkontinence zhoršit, zvýší se spotřeba pomůcek pro inkontinenci a nemocný diuretickou terapii spontánně vynechává, což je obvyklou příčinou četných rehospitalizací nemocných s chronickým SS.
Statiny
Poruchy metabolizmu lipidů i metabolický syndrom nepochybně patří k základním faktorům urychlujícím ztrátu soběstačnosti i kognitivního výkonu a o nutnosti jejich intervence dnes již patrně nikdo nepochybuje. Problémem jsou u starších nemocných nežádoucí vedlejší účinky, k nimž dochází častěji (dyspepsie, bolesti hlavy, nespavost, závratě, myalgie, parestezie, cholestatický ikterus, rhabdomyolýza).
Diskuze jsou vedeny zejména ohledně indikací statinů u seniorů vyššího věku, kdy podávání z indikace primární prevence pokračuje i ve věku nad 85 let, tedy v době, kdy už očekávaný profit nepřevažuje nad rizikem nežádoucích vedlejších účinků [30]. V populaci středního věku lze pozorovat druhý extrém – dospělí střední věkové kategorie, kteří mohou z léčby statiny nejvíce dlouhodobě profitovat, vykazují vysokou míru non-adherence v užívání statinů zdůvodňovanou obavami z nežádoucích vedlejších účinků. Tyto informace jsou ovšem často čerpány z různých neodborných zdrojů (tab. 6) [31].
Table 6. Nejčastější lékové interakce statinů. 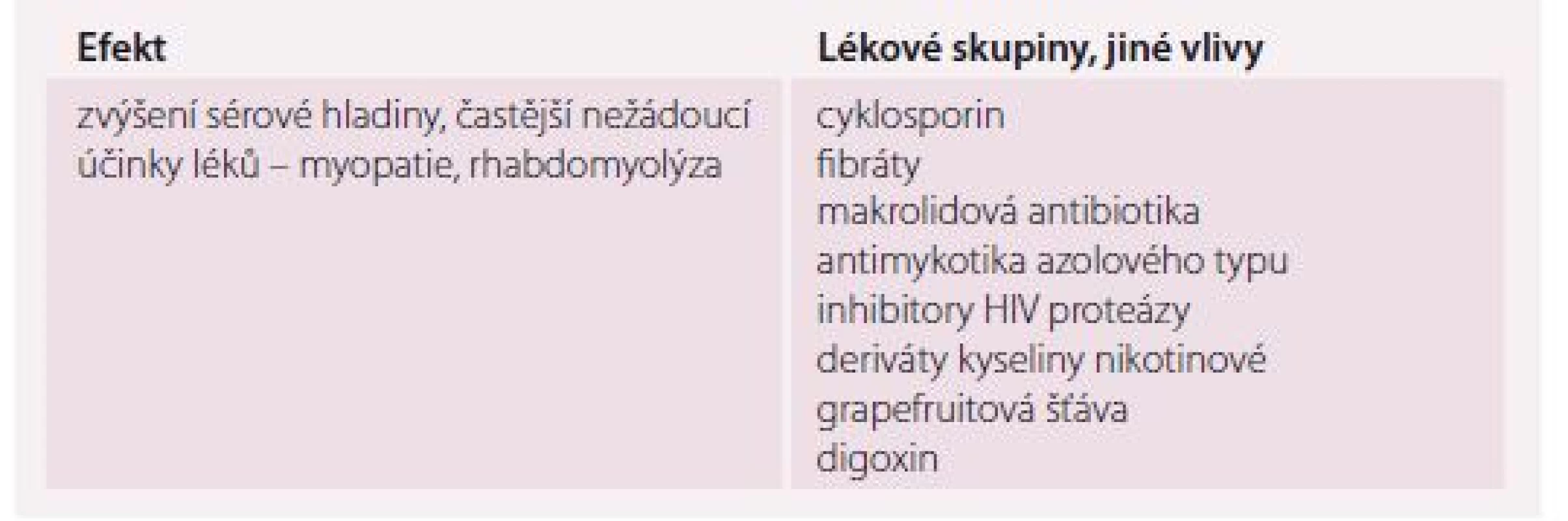
Rizika farmakoterapie starších nemocných vyplývající z poklesu soběstačnosti
Postupná ztráta soběstačnosti ovlivňuje efektivitu farmakoterapie zejména z hlediska adherence. Kumulující se pohybové postižení může omezit dostupnost předepsaného medikamentu v případě, že je lék nutno objednat a nemocný si musí do lékárny přijít znovu. Postižení drobných kloubů ruky společně se sníženou citlivostí může učinit balení léků zhotovené podle aktuálních bezpečnostních předpisů nemocnému nedostupné.
Narůstající senzorický deficit se může podílet na chybách v medikaci způsobený nesprávným přečtením dávkování léku nebo dokonce názvu léku v případě dodávky stejného generika pod jiným názvem a v balení jiného vzhledu. Nabízí se otázka, zda a jak by tuto situaci mohlo ovlivnit častější využívání generické preskripce [32].
Nejpalčivějším z hlediska chyb v užívání medikace, a tím přímého ohrožení nemocného, je počínající úbytek kognitivního výkonu, který se paradoxně sčítá s postupně narůstajícím počtem medikamentů, který má nemocný užívat. Praktická studie reality v této oblasti ukázala, že jen 13 % seniorů je schopno vyjmenovat všechny medikamenty, které pravidelně užívá, a jejich účel. Počet užívaných medikamentů bylo schopno sdělit 48 % dotázaných seniorů. Na druhé straně ale na otázku, zda někdy vynechají některou dávku léku či zda se jim někdy stane, že lék využívají a nemají další balení, tvrdilo 73 % dotázaných, že „nikdy“ [2]. Dostáváme se tedy i do problematiky náhledu na sebe sama a svoje schopnosti či limity. Úbytek kognitivního výkonu je nutno očekávat u 5 % populace 65leté s postupným vzestupem výskytu až po třetinu populace 80leté.
Systematická diagnostika není u nás zatím zavedena, nicméně zcela jednoduše lze použít orientační testy, jako je odečítání po 7 od čísla 100 nebo test kreslení hodin, který je z hlediska dodržování lékového schématu zvláště přínosný. Pacient, který není schopen zakreslit správný čas do předloženého kruhu, bude pravděpodobně značně limitovaný v užívání časovaných léků.
Dalším problémem je nediagnostikovaná deprese, které se ve vyšším věku mohou častěji projevovat somatickými potížemi nebo poruchami spánku než typicky psychickými projevy. Deprese však může být příčinou významného zhoršení spolupráce nemocného v léčbě medikamentózní i nefarmakologické [33].
Závěr
Souhrnně si lze připomenout aktualizovaná doporučení pro preskripci seniorům nejen pro kardiologické medikamenty, ale pro celé lékové schéma (tab. 7) [34].
Table 7. Základní zásady preskripce pro starší nemocné. 
Doručeno do redakce: 18. 1. 2018
Přijato po recenzi: 9. 2. 2018
prof. MU Dr. Hana Matějovská Kubešová, CSc.
Sources
1. Wenger NK, Doherty CL, Gurwitz JH et al. Optimization of drug prescription and medication management in older adults with cardiovascular disease. Drugs Aging 2017; 34(11): 803 – 810. doi: 10.1007/ s40266-017-0494-2.
2. Vepřeková B. Respekt k autonomii geriatrického pacienta: kognitivní a mnestická kapacita. Dizertační práce. Brno: LF MU 2012.
3. Lozano I, Sanchez-Insa E, de Leiras SR. Acute coronary syndromes, gastrointestinal protection, and recommendations regarding concomitant administration of proton-pump inhibitors (omeprazol/ esomeprazole) and clopidogrel. Am J Cardiol 2016; 117(3): 366 – 368. doi: 10.1016/ j.amjcard.2015.11.007.
4. Rappaport R, Arinzon Z, Feldman J et al. The need for medication reconciliation increases with age. Isr Med Assoc J 2017; 19(10): 625 – 630.
5. Bailey DG, Spence JD, Edgar B et al. Ethanol enhances the hemodynamic effects of felodipine. Clin Invest Med 1989; 12(6): 357 – 362.
6. Sica DA. Interaction of grapefruit juice and calcium channel blockers. Am J Hypertens 2006; 19(7): 768 – 773.
7. Beers MH, Ouslander JG, Rollingher I et al. Explicit criteria for determining inappropriate medication use in nursing home residents. Arch Intern Med 1991; 151(9): 1825 – 1832.
8. Beers MH. Explicit criteria for determining potentially inappropriate medication use by the elderly: an update. Arch Intern Med 1997; 157(14): 1531 – 1536.
9. Fick DM, Cooper JW, Wade WE et al. Updating the beers criteria for potentially inappropriate medication use in older adults. Arch Intern Med 2003; 163(22): 2716 – 2724.
10. The American Geriatrics Society 2012 Beers Criteria Update Expert Panel. American Geriatrics Society updated Beers Criteria for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2012; 60(4): 616 – 631. doi: 10.1111/ j.1532-5415.2012.03923.x
11. McLeod PJ, Huang AR, Tamblyn RM et al. Defining inappropriate practices in prescribing for elderly people: a national consensus panel. CMAJ 1997; 156(3): 385 – 391.
12. Gallagher P, Ryan C, Byrne S et al. STOPP (Screeening Tool of Older Person’s Prescriptions) and START (Screening Tool to Alert doctors to Right Treatment). Int J Clin Pharmacol Ther 2008; 46(2): 72 – 83.
13. Topinková E, Mádlová P, Fialová D et al. Nová evidence-based kritéria pro posouzení vhodnosti lékového režimu u seniorů. Kritéria STOPP (Screening Tool of Older Person’s Prescriptions) a START (Screening To ol to Alert doctors to Right Tre atment). Vnitř Lék 2008; 54(12): 1161 – 1169.
14. Fialová D, Topinková E, Matějovská Kubešová H et al. Racionální farmakoterapie ve stáří: Expertní konsensus ČR 2012 v oblasti léčiv a lékových postupů potenciálně nevhodných u seniorů. Geriatrie a gerontologie 2013; 2(1): 5 – 15.
15. O’Mahony D, O’Sullivan D, Byrne et al. STOPP/ START criteria for potentially inappropriate prescribing in older people: version 2. Age Ageing 2015; 44(2): 213 – 218. doi: 10.1093/ ageing/ afu145.
16. Foppiani L, Cascio C, Lo Pinto G. Iodine-induced hyperthyroidism as combination of different etiologies: an overlooked entity in the elderly. Aging Clin Exp Res 2016; 28(5): 1023 – 1027. doi: 10.1007/ s40520-015-0483-4.
17. Taylor BA, Lorson L, White CM et al. A randomized trial of coenzyme Q10 in patients with confirmed statin myopathy. Atherosclerosis 2015; 238(2): 329 – 335. doi: 10.1016/ j.atherosclerosis.2014.12.016.
18. Konopa J, Bullo B, Rutkowski B. Life threatening drug-induced hyperkaliemia – case report. Pol Arch Med Wewm 2006; 115(3): 238 – 242.
19. Woolcott JC, Richardson KJ, Wiens MO. Meta-analysis of the impact of 9 medication classes on falls in elderly persons. Arch Intern Med 2009; 169(21): 1952 – 1960. doi: 10.1001/ archinternmed.2009.357.
20. Galinier M, Emeriau JP. Prescribing beta blockers in elderly patients with heart failure. Presse Med 2008; 37 (6 Pt 2): 1047 – 1054. doi: 10.1016/ j.lpm.2008.02.011.
21. Cleland JG, Coletta AP, Torabi A et al. Clinical trials update from the European Society of Cardiology Heart Failure meeting 2009: CHANCE, B-Convinced, CHAT, CIBIS-ELD, and Signal-HF. Eur J Heart Fail 2009; 11(8): 802 – 805. doi: 10.1093/ eurjhf/ hfp102.
22. Wikstrand J, Wedel H, Castagno D et al. The large-scale placebo-controlled beta-blocker studies in systolic heart failure revisited: results from CIBIS-II, COPERNICUS and SENIORS-SHF compared with stratified subsets from MERIT-HF. J Intern Med 2014; 275(2): 134 – 143. doi: 10.1111/ joim.12141.
23. Edelmann F, Musial-Bright L, Gelbrich G et al. Tolerability and feasibility of beta-blocker titration in HFpEF versus HFrEF: Insights from the CIBIS-ELD Trial. JACC Heart Fail 2016; 4(2): 140 – 149. doi: 10.1016/ j.jchf.2015.10.008.
24. Axmon A, Ahlström G, Höglund P. Prevalence and treatment of diabetes mellitus and hypertension among older adults with intellectual disability in comparison with the general population. BMC Geriatr 2017; 17(1): 272. doi: 10.1186/ s12877-017-0658-2.
25. van Middelaar T, van Vught LA, van Charante EP et al. Lower dementia risk with different classes of antihypertensive medication in older patients. J Hypertens 2017; 35(10): 2095 – 2101. doi: 10.1097/ HJH.0000000000001411.
26. Rouch L, Cestac P, Hanon O el al. Antihypertensive drugs, prevention of cognitive decline and dementia: a systematic review of observational studies, randomized controlled trials and meta-analyses, with discussion of potential mechanisms. CNS Drugs 2015; 29(2): 113 – 130. doi: 10.1007/ s40263-015-0230-6.
27. Kalvach Z, Zadák Z, Jirák R et al. Geriatrie a gerontologie. Praha: Grada Publishing 2004.
28. Woodward M, Gonski P, Grossmann M et al. Diag-nosis and management of hyponatraemia in the older patient. Intern Med J 2018; 48 (Suppl 1): 5 – 12. doi: 10.1111/ imj.13682.
29. Spinar J, Parenica J, Vitovec J et al. Baseline characteristics and hospital mortality in the Acute Heart Failure Database (AHEAD) Main registry. Crit Care 2011; 15(6): R291. doi: 10.1186/ cc10584.
30. Llobet Vila L, Manresa Domínguez JM, Carmona Segado JM. Facing a dilemma in elderly complex and vulnerable patients: to stop or not to stop prevention? Aten Primaria 2017; pii: S0212-6567(17)30174-9. doi: 10.1016/ j.aprim.2017.05.016.
31. Kriegbaum M, Lau SR. Medication non-adherence and uncertainty: Information-seeking and processing in the Danish LIFESTAT survey. Res Social Adm Pharm 2017; pii: S1551-7411(17)30571-5. doi: 10.1016/ j.sapharm.2017.09.002.
32. Riaz H, Krasuski RA. Should physicians be encouraged to use generic names and to prescribe generic drugs? Am J Cardiol 2016; 117(11): 1851 – 1852. doi: 10.1016/ j.amjcard.2016.03.023.
33. Hennein R, Hwang SJ, Au R et al. Barriers to medication adherence and links to cardiovascular disease risk factor control: the Framingham Heart Study. Intern Med J 2017. doi: 10.1111/ imj.13687.
34. Stacey E. Hot topics in General Practice. Oxford: BIOS Scientific Publishers 1996.
Labels
Angiology Paediatric cardiology Vascular surgery Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 1-
All articles in this issue
- Srdeční selhání ve stáří
- Specifika diagnostiky a léčby ve stáří
- Léčba arteriální hypertenze u starších osob
- Polyfarmakoterapie ve stáří – lékové interakce nejčastěji předepisovaných lékových skupin v kardiologii
- Chronické srdeční selhání a paliativní péče
- Tyreopatie ve stáří a kardiovaskulární postižení
- Přínosy a rizika profylaxe tromboembolické nemoci u geriatrického pacienta
- Imunosenescence a infekční komplikace vyššího věku
- Duální inhibice AT1 receptoru pro angiotenzin II a neprilysinu nebo inhibice angiotenzin konvertujícího enzymu?
- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
-
Stručný komentář k novým doporučením pro léčbu hypertenze v USA
2017 ACC/ AHA High Blood Pressure Guideline - Závratě a pády jako častá symptomatologie kardiovaskulárního postižení ve vyšším věku
- Dapagliflozin a studie DECLARE – vstupní charakteristika
- Zvýšená hladina NP u stabilních pacientů 3 měsíce po STEMI je jednoduchý nástroj k predikci dlouhodobé nepříznivé prognózy
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
- Specifika diagnostiky a léčby ve stáří
- Srdeční selhání ve stáří
- Tyreopatie ve stáří a kardiovaskulární postižení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

