-
Medical journals
- Career
Arytmie a cévní mozková příhoda
Authors: doc. MUDr. Petr Heinc, Ph.D.; MUDr. František Kováčik; MUDr. Marie Lazárová; MUDr. Jan Přeček; MUDr. Aleš Smékal; Doc. MUDr. Miloš Táborský, CSc.; Fesc; Mba
Authors‘ workplace: I. interní klinika – kardiologická FN Olomouc petr. heinc@fnol. cz
Published in: Kardiol Rev Int Med 2013, 15(1): 33-36
Category:
Overview
Signifikantní arytmie se vyskytují přibližně u 25 % nemocných hospitalizovaných pro akutní cévní mozkovou příhodu, jejich výskyt je nejvyšší v prvních 24 hod a klesá během prvních tří dnů. Předpokládá se, že arytmie mají primární neurogenní příčinu a evidentně jsou nezávisle spojeny s vyšším věkem a s větším neurologickým postižením, které vede k adekvátnímu uvolnění transmiterů do oběhu. Nejčastější arytmie, která má souvislost s cévní mozkovou příhodou, je fibrilace síní, kde následná embolizační etiologie je příčinou asi 20 % všech cévních mozkových příhod. Pacient s anamnézou fibrilace síní, který i přes jakoukoli antiarytmickou intervenci zůstává v tromboembolizačním riziku, musí být antikoagulován Warfarinem nebo novými antikoagulancii dle rizikové stratifikace (tzv. CHA2DS2 Vasc skóre).
Klíčová slova:
cévní mozková příhoda – arytmie – fibrilace síní – CHA2DS2 Vasc skóreÚvod
Aterosklerotické kardiovaskulární nemoci tvoří nejzávažnější zdravotnický problém ve všech vyspělých zemích. Tyto nemoci jsou v Evropě nejčastější příčinou předčasných úmrtí a to i přes celkový pokles kardiovaskulárních úmrtí v řadě evropských zemí [1]. Kardiovaskulární onemocnění se v Evropě i USA podílejí jednoznačně nejvyšší mírou na celkové mortalitě. Podkladem cévních mozkových příhod (CMP) je dominantně aterosklerotické postižení samotného cévního řečiště mozku, nicméně nemalá míra souvislosti byla prokázána také s arytmiemi, které se mohou podílet na CMP dvojím mechanizmem – hemodynamickým a tromboembolizačním.
Souvislost arytmií s CMP mimo embolizační etiologii
Řada studií dokladuje vysokou incidenci arytmií a EKG změn při akutních cerebrovaskulárních příhodách [2–4]. Tyto arytmie jsou signifikantně častější u pacientů s akutní CMP než u pacientů, kde se původní podezření na akutní CMP následně neprokázalo [2]. Signifikantní arytmie se vyskytují přibližně u 25 % nemocných hospitalizovaných pro CMP a daleko častější jsou dokumentované tachykardické komplikace než bradykardické komplikace [5]. Vzhledem k tomu, že arytmie jsou podstatně častěji přítomny při postižení hemisfér než při postižení mozkového kmene, předpokládá se působení neurotransmiterů, které jsou uvolněny do oběhu a jsou primární neurogenní příčinou arytmií. Tento předpoklad podporují experimentální práce, kde mnoha arytmiím lze zabránit autonomní blokádou [4,6]. Arytmie jsou nezávisle spojeny s vyšším věkem a s větším neurologickým deficitem. Incidence signifikantních arytmií při akutní CMP je nejvyšší v prvních 24 hod a klesá během prvních tří dnů [5]. Zdaleka ne všechny arytmie však mají negativní vliv na CMP. Nejčastěji přítomné komorové či síňové extrasystoly nemají vliv na hemodynamiku a zásadně neovlivňují regeneraci mozkového postižení. Hemodynamický vliv na CMP mají jen setrvalejší tachyarytmie, které vedou k poklesu systémového tlaku nebo výraznému snížení srdečního výdeje. Četnější síňová ektopie však může mít negativní prognostický význam z důvodu možného potenciálu pro budoucí vznik fibrilace síní (FS), a tedy bude vyžadovat intenzivnější monitoraci rytmu po prodělané CMP.
Prediktory srdečních arytmií při CMP
Arytmie se objevují častěji mezi pacienty s preexistujícím srdečním onemocněním a s vaskulárními rizikovými faktory, kterými všeobecně jsou věk, hypertenze a diabetes mellitus. Nicméně po očištění statistických analýz o tyto kofaktory častějšího výskytu arytmií, je nezávislým prediktorem arytmií rozsah mozkového postižení. Rozsah mozkového postižení koreluje se změnou kardiovaskulární autonomní kontroly, projevující se ztrátou celkové autonomní modulace, poškozením senzitivity baroreflexu, snížením parasympatického tonu a převážením sympatické aktivity [7,8]. De facto jen setrvalejší tachyarytmie, které vedou k poklesu srdečního výdeje, mohou přispívat k rozvoji mozkových lézí a zhoršovat takto prognózu CMP [2]. V žádných současných doporučeních pro management CMP a tranzitorní ischemické ataky (TIA) nejsou praktické rady, které pacienty je třeba monitorovat, ani jak dlouho v této monitoraci pokračovat [9–11]. Na základě výše uvedeného by rozsah mozkového postižení a časný výskyt arytmií v akutní fázi CMP měly být vodítkem pro indikaci monitorace srdečního rytmu v prvních 24 hod či déle.
Řada prací popisuje EKG změny, které se objevují u pacientů v akutní fázi CMP [2–4]. Nejčastěji jsou tyto změny spojeny se subarachnoideálním krvácením, ale často jsou přítomny i při ischemické nebo krvácivé CMP. Změny se týkají nejčastěji repolarizační fáze v oblasti ST segmentu a tyto změny mohou až napodobovat infarkt myokardu s ST elevacemi, ale prakticky nikdy se nepozorují ischemické změny ve formě depresí ST. Často je diskutována otázka, zda tyto změny jsou důsledkem doposud skrytého srdečního onemocnění, nebo zda jde o změny ovlivněné akutní mozkovou příhodou. Vzhledem k tomu, že tyto změny i arytmie jsou relativně často přítomny také u mladých jedinců, kde není přítomno žádné strukturální onemocnění srdce, většina autorů se kloní k tomu, že změny jsou indukovány samotným mozkovým postižením, které ovlivní srdce zvýšenou parasympatickou nebo sympatickou aktivitou nebo kombinací obou [7]. Na druhou stranu prognóza pacientů s CMP a s koexistující kardiální abnormalitou se pokládá za velmi vážnou situaci, jelikož poškozené srdeční funkce vedou k dalším hemodynamickým a metabolickým změnám v mozku a tyto změny mohou dále prohloubit následky mozkové příhody a vést až ke smrti pacienta. V případě dokonané CMP neexistuje žádná specifická léčba, ale k dosažení lepší prognózy by měly být intenzivně a okamžitě léčeny všechny komplikace, které se u akutní CMP objeví, čímž jsou především myšleny hemodynamicky závažné, monitorované arytmie.
Souvislost arytmií s CMP embolizační etiologie
Podle epidemiologických dat se v současné době odhaduje výskyt FS asi u 1–2 % obyvatel a pro rychlý nárůst se hovoří až o epidemii FS. Prevalence roste s věkem a ve věkové kategorii 80 let je prevalence kolem 10 %. Přítomnost FS pětinásobně zvyšuje riziko CMP a přibližně 20 % CMP je připisováno arytmické příčině v důsledku FS [12]. Všeobecně je odhadováno, že asi 2 % ischemických CMP jsou v důsledku hemodynamických změn v rámci jakékoli arytmie a přibližně 17 % CMP má embolický původ, dominantně z fibrilace či flutteru síní [2]. Důležitým faktem navíc zůstává, že embolizační CMP jsou vysoce závažné, často trvale invalidizující a ne výjimečně končí smrtí. Z těchto důvodů se intenzivně hledají možnosti, jak ovlivnit tento nepříznivý trend. Přestože lze následky embolizační CMP dnes podstatně efektivněji léčit revaskularizačními technikami, důraz zůstává na primární prevenci tromboembolizační (TE) etiologie ischemické CMP, kterou je nejčastěji FS. V primární prevenci TE máme dvě možnosti – odstranit fibrilaci/flutter síní a pokud to z jakéhokoli důvodu není možné nebo není jistota úplného odstranění arytmie, pak jedinou možností je nastavení účinné antitrombotické léčby dle rizika TE.
Současné možnosti antiarytmické léčby
Antiarytmická farmakoterapie
Antiarytmická léčba je indikována ke kontrole rezistentních symptomů vázaných na jakoukoli arytmii, včetně FS. Nejde o léčbu kauzální, proto nelze předpokládat, že pacient bude zcela bez recidivy arytmie při jakékoli dostupné antiarytmické léčbě. Nelze ani spoléhat na subjektivní pocity nemocného, neboť dlouhodobou monitorací srdečního rytmu pacientů s FS se ukázalo, že symptomatika arytmie může ustoupit i přes reálnou existenci paroxyzmů FS dle dlouhodobé monitorace. Tromboembolizační riziko je přitom stejné u permanentní i paroxyzmální formy FS. Vzhledem k tomu, že ani dlouhodobější monitorace nedává jistotu nepřítomnosti paroxyzmů FS při antiarytmické medikaci, je třeba, aby pacient, který je v tromboembolizačním riziku, byl s antiarytmickou medikací současně antikoagulován.
Katetrizační ablace fibrilace síní
Podle doplněných evropských doporučení pro léčbu FS z roku 2012 je vhodné zvážit katetrizační ablaci jako léčbu první volby v kontrole rytmu u vybraných pacientů s FS [13]. Jsou to především pacienti se symptomatickou paroxyzmální FS, kteří preferují intervenční léčbu a mají nízký rizikový profil. Objevují se i zprávy, že po úspěšné ablaci FS ve zkušeném centru je riziko tromboembolizace ve dvouletém sledování stejné jako u pacientů bez FS. Katetrizační ablace je všeobecně pokládána za účinnější než antiarytmika, může mít signifikantní efekt na funkci levé komory, nicméně určitý počet recidiv FS se vyskytuje i po ablaci, proto antikoagulační medikace zůstává stěžejní přinejmenším po dobu tří měsíců po úspěšné ablaci FS. Pokud není opakovanou dlouhodobou monitorací verifikována nepřítomnost paroxyzmů FS, měla by být v přítomnosti TE rizika antitrombotická léčba dlouhodobá.
Stratifikace rizika tromboembolických komplikací FS v éře nových antikoagulancií
Pacienti s fibrilací/flutterem síní mají zvýšené riziko TE a embolizačních CMP, ať se jedná o permanentní formu nebo paroxyzmální formu, nicméně toto riziko u každého nemocného závisí na počtu přítomných rizikových faktorů. V roce 2010 byla publikována nová riziková stratifikace (tzv. CHA2DS2 Vasc skóre, tab. 1), která klade větší důraz na nízce rizikové faktory, kterými jsou především věk, ženské pohlaví a cévní onemocnění [14]. Tato nová stratifikace má nejlepší prediktivní hodnotu pro vznik CMP či TE proti všem do té doby známým stratifikačním schématům a přitom velmi dobře identifikuje nemocné, kteří jsou skutečně v nízkém riziku TE. U těchto nemocných se skutečně nízkým rizikem TE (CHA2DS2 Vasc skóre = 0) se doporučuje nepodávat jakoukoli antitrombotickou léčbu. U všech ostatních nemocných, kteří jsou zařazení do vyššího rizika TE (CHA2DS2 Vasc skóre > 1), by měla být podávána antikoagulační léčba (tab. 2). Se stoupajícím rizikem TE se při antitrombotické léčbě zvyšuje také riziko krvácivých komplikací. Tato nová riziková stratifikace pacientů pro krvácivé komplikace je stanovena tzv. HAS-BLED skóre (tab. 3) [15].
Table 1. Riziko embolizační mozkové příhody u nemocných s fibrilací síní bez přítomné chlopňové vady pro stanovení antitrombotické léčby dle CHA<sub>2</sub>DS<sub>2</sub>Vasc skórovací stratifikace. 
Table 2. Doporučená léčba pro prevenci tromboembolie dle rizikových faktorů CHA<sub>2</sub>DS<sub>2</sub>Vasc stratifikace. 
Table 3. Stanovení rizika krvácení dle rizikové stratifikace HAS-BLED. 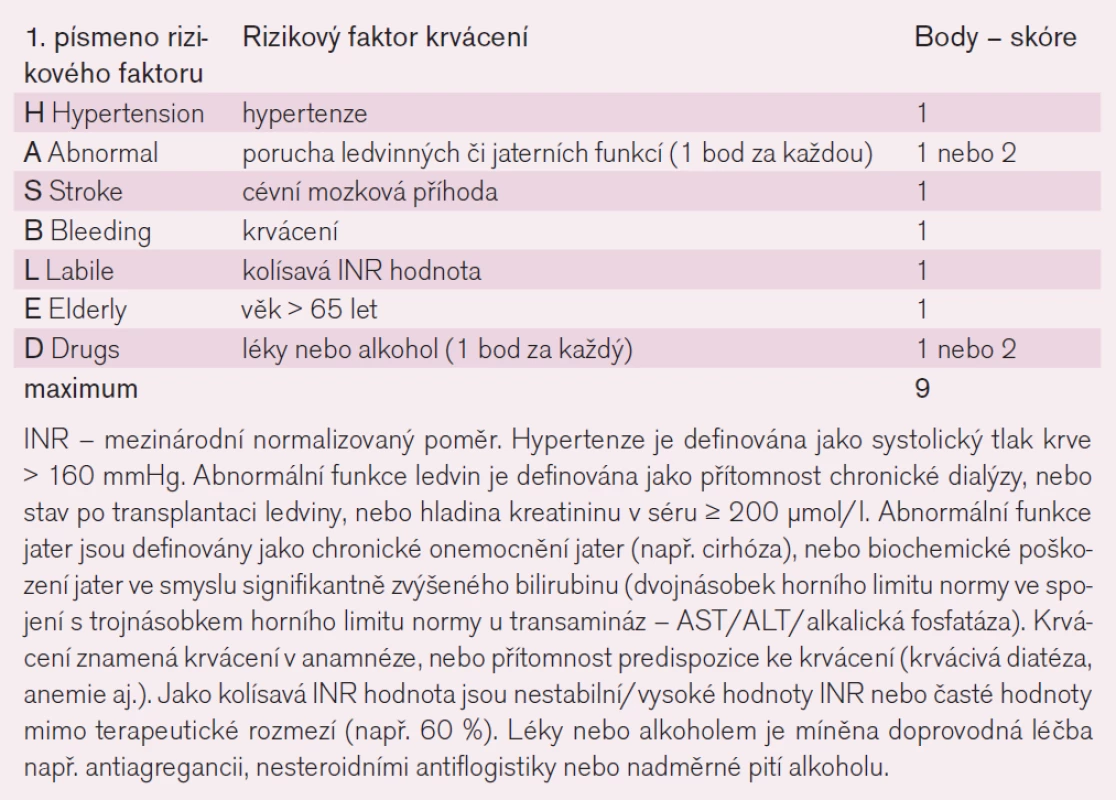
Po 50 letech uniformní antikoagulační léčby Warfarinem byla v posledním desetiletí vyvinuta řada nových antitrombotik. V roce 2012 byly v naší republice schváleny a zavedeny do klinické praxe dvě nové molekuly určené k antikoagulační léčbě nemocných s FS bez přítomnosti chlopenní vady. Jedná se o dabigatran (Pradaxa) a rivaroxaban (Xarelto). I přes existenci nových antikoagulancií však stále platí, že ke každému pacientovi je třeba přistupovat individuálně a je třeba zohlednit poměr rizika TE komplikací a krvácivých komplikací. Nově aktualizované evropské doporučené postupy pro léčbu fibrilace síní upřednostňují tato nová antikoagulancia před Warfarinem [13]. V naší republice platí určité, specifické omezení Státního ústavu pro kontrolu léčiv, které je dáno stanovením úhradového mechanizmu nových antikoagulancií, což de facto znamená, že před nasazením nových antikoagulancií je třeba prokázat nedostatečný efekt Warfarinu (tab. 4).
Table 4. Limitace léčby dabigatranem nebo rivaroxabanem stanovené SÚKL (primární nedostatečná prevence Warfarinem). 
Závěr
Signifikantní arytmie se vyskytují přibližně u 25 % nemocných hospitalizovaných pro akutní CMP, jejich výskyt je nejvyšší v prvních 24 hod a klesá během prvních tří dnů. Předpokládá se, že arytmie mají primární neurogenní příčinu a evidentně jsou nezávisle spojeny s vyšším věkem a s větším neurologickým postižením, které vede k adekvátnímu uvolnění transmiterů do oběhu. Všeobecně je odhadováno, že asi 2 % ischemických CMP jsou v důsledku hemodynamických změn v rámci jakékoli arytmie a přibližně 17–20 % CMP má embolický původ, dominantně z fibrilace či flutteru síní. Pacient s anamnézou fibrilace síní, který i přes jakoukoli antiarytmickou intervenci zůstává v tromboembolizačním riziku, musí být v prevenci CMP antikoagulován Warfarinem nebo novými antikoagulancii dle nové rizikové stratifikace (tzv. CHA2DS2 Vasc skóre).
Doručeno do redakce 15. 1. 2013
Přijato po recenzi 11. 2. 2013
doc. MUDr. Petr Heinc, Ph.D.
MUDr. František Kováčik
MUDr. Marie Lazárová
MUDr. Jan Přeček
MUDr. Aleš Smékal
doc. MUDr. Miloš Táborský, CSc., FESC, MBA
I. interní klinika – kardiologická FN Olomouc
petr.heinc@fnol.cz
Sources
1. Perk J, De Backer G, Gohlke H et al. European Guidelines on Cardiovascular Disease Prevention in Clinical Practice (version 2012). EHJ 2012; 33 : 1635–1701.
2. Norris JW, Froggatt GM, Hachinski VC. Cardiac arrhythmias in acute stroke. Stroke 1978; 9 : 392–396.
3. Reinstein L, Gracey JG, Kline JA et al. Cardiac monitoring in the acute stroke patient. Arch Phys Med Rehabil 1972; 53 : 311–314.
4. Lavy S, Yaar I, Melamed E et al. Effect of acute stroke on cardiac functions as observed in an intensive stroke care unit. Stroke 1974; 5 : 775–780.
5. Kallmünzer B, Breuer L, Kahl N et al. Serious cardiac arrhythmias after stroke. Incidence, time course, and predictors – a systematic, prospective analysis. Stroke 2012; 43 : 2892–2897.
6. Myers MG, Norris JW, Hachinski VC et al. Cardiac sequelae of acute stroke. Stroke 1982; 13 : 838–842.
7. Hilz MJ, Moeller S, Akhundova A et al. High NIHSS values predict impairment of cardiovascular autonomic control. Stroke 2011; 42 : 1528–1533.
8. Hockman CH, Mauck HP, Hoff EC. ECG changes resulting from cerebral stimulation. II. A spectrum of ventricular arrhythmias of sympathetic origin. Am Heart J 1966; 71 : 695–700.
9. European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25 : 457–507.
10. Adams HP Jr, del Zoppo G, Alberts MJ et al. American Heart Association/American Stroke Association Stroke Council; American Heart Association/AmericanStroke Association Clinical Cardiology Council; American Heart Association/American Stroke Association Cardiovascular Radiology and Intervention Council; Atherosclerotic Peripheral Vascular Disease Working Group; Quality of Care Outcomes in Research Interdisciplinary Working Group. Guidelines for the early management of adults with ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: The American Academy of Neurology affirms the value of thisguideline as an educational tool for neurologists. Circulation 2007; 115: e478–534.
11. Furie KL, Kasner SE, Adams RJ et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack. Stroke 2011; 42 : 227–276.
12. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Camm AJ, Kirchhof P, Lipp GY et al. Guidelines for the management of atrial fibrillation: the Task Force for the management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010 : 31 : 2369–2429.
13. Čihák R, Haman L, Heinc P. Souhrn aktualizace doporučených postupů ESC pro léčbu fibrilace síní z roku 2012. Cor Vasa 2012; 54: 532–541.
14. Lip GY, Halperin JL. Improving stroke risk stratification in atrial fibrillation. Am J Med 2010; 124 : 111–114.
15. Pisters R, Lane DA, Nieuwlaat R et al. A novel userfriendly score (HAS-BLED) to assess one-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138 : 1093–1100.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2013 Issue 1-
All articles in this issue
- Arytmie a cévní mozková příhoda
- Primární a sekundární prevence ischemických cévních mozkových příhod
- Antitrombotika v prevenci cévní mozkové příhody. 2. část – Význam antikoagulační léčby
- Kontrola krevního tlaku v primární a sekundární prevenci cévní mozkové příhody
- Levosimendan v kardiochirurgii
- Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
- Terapie akutní ischemické cévní mozkové příhody
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
- Terapie akutní ischemické cévní mozkové příhody
- Primární a sekundární prevence ischemických cévních mozkových příhod
- Arytmie a cévní mozková příhoda
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

