-
Medical journals
- Career
Aortitis – zánět aortální stěny
: D. Ručka
: Kardiol Rev Int Med 2010, 12(4): 166-170
: Angiological Symposium
Termínem aortitis označujeme zánět aortální stěny. Jedná se o nepříliš časté onemocnění, jehož podkladem bývají zpravidla vaskulitidy velkých a středních tepen. Méně častou příčinou jsou infekce. V článku se zabýváme etiologií, klinickými projevy, diagnostikou a léčbou známých forem onemocnění.
Klíčová slova:
aortitis – periaortitis – vaskulitis – horečka neznámého původu – diagnostika FDG-PETÚvod
Aortitida (aortitis) zahrnuje široké spektrum zánětlivých onemocnění postihujících aortální stěnu. Etiologie je infekční i neinfekční. Postižena může být jak hrudní, tak i břišní aorta. Ve většině případů se jedná o prognosticky závažné onemocnění vedoucí dříve nebo později ke stenookluzivnímu postižení aorty nebo naopak k aortální dilataci a tvorbě aneuryzmat [1]. Známá je rovněž souvislost se vznikem disekce nebo perforace aorty. Pro brzké zahájení účinné léčby je nutná včasná diagnostika založená na podrobném klinickém vyšetření, laboratorních testech a efektivně cílených zobrazovacích metodách. Článek přináší ucelený pohled na etiologii, klinické projevy, diagnostiku a léčbu tohoto onemocnění.
Infekční aortitida
K tradičním původcům infekčního postižení aorty patří treponema pallidum a mycobacterium tuberculosis. Tato v minulosti častá onemocnění se v současné době prakticky nevyskytují díky rozšíření antibiotické a antituberkulózní léčby. V případě tuberkulózy však stále existuje potenciální riziko onemocnění u pacientů s oslabenou imunitou.
Syfilitická aortitida byla společně s neurologickým postižením součástí terciálního stadia onemocnění. Byly popsány čtyři formy zánětlivého postižení aorty: nekomplikovaná syfilitická aortitida ascendentní aorty, aortitida s formujícím se aneuryzmatem, aortitida s insuficiencí aortální chlopně a aortitida s ostiálními stenózami koronárních tepen [2]. Treponema pallidum primárně postihuje vasa vasorum probíhající v medii a adventicii aortální stěny. To vede k nekróze medie a zvrásnění intimy, která získává vzhled „kůry stromu“ (tree barking sign).
Tuberkulóza v typickém případě postihuje aortální oblouk a descendentní aortu. Předpokládá se přímý přestup infekce z paravertebrálních uzlin, pleury nebo perikardu [3]. Pravděpodobný je však i miliární rozsev. Ve většině případů vede postižení aorty k formování aneuryzmatu s vysokým rizikem perforace. Jsou však popsány i kazuistiky stenookluzivního postižení připomínající nález při Takayasuově arteritidě nebo akutní disekce aorty [4,5].
V současné době se mezi typické infekční agens vedoucí k zánětu aorty řadí Staphylococcus aureus, Salmonella species, Escherichia coli a Streptococcus pneumoniae. Mykotické nebo virové infekce jsou vzácné. K infikování aortální stěny může dojít několika způsoby: přímým šířením infekce z přilehlých struktur (mediastinitida, břišní nebo paravertebrální abscesy), hematogenní diseminací zánětu nebo septickou embolizací při bakteriální endokarditidě. Zánětem jsou nejčastěji postižena místa již dříve patologicky změněná, například úseky s významnými aterosklerotickými pláty nebo výdutě. Zánětlivá aneuryzmata bývají spíš sakulární než fuziformní. Typicky se vyklenují na straně odvrácené od odstupů velkých větví [3,6]. Samostatnou kapitolu tvoří infekce aortálních protetických náhrad nebo bypassů. Jde vždy o závažnou komplikaci s dramatickým klinickým průběhem vyžadující časné operační řešení a intenzivní antibiotickou léčbu. Mortalita těchto stavů se pohybuje mezi 20–40 % [7].
Na infekční aortitidu bychom měli pomýšlet především u starších nemocných s diabetem a s preexistujícím onemocněním aorty. Příznakem jsou bolesti břicha nebo zad provázené klinickými známkami zánětu. Hemokultury jsou často pozitivní pro některou z typických výše uvedených bakterií. Diagnostickým oříškem může být tuberkulózní aortitida. Je třeba na ni pomýšlet, jestliže se aneuryzma nachází v typické lokalizaci aortálního oblouku u pacientů, kteří v minulosti prodělali tuberkulózu. Stejně tak musíme být obezřetní u imunosuprimovaných nemocných se suspektním nálezem na plicích nebo s lymfadenopatií [3,8].
Neinfekční aortitida
Neinfekční zánět aortální stěny provází celou řadu systémových onemocnění pojiva a vaskulitid. Nejčastěji je spojován s obrovskobuněčnou arteritidou (giant cell arteritis – GCA) a Takayasuovou arteritidou (TA). Obě tyto nemoci postihují aortu a její odstupové větvě a obě vykazují podobný histopatologický obraz. Tepenná stěna je na úrovni medie a adventicie infiltrována zánětlivými buňkami. Jedná se především o T lymfocyty, makrofágy a mnohojaderné obrovské buňky. Zánět vede k destrukci a fragmentaci elastických vláken, ztrátě vláken hladkého svalstva, tvorbě granulomů a zvýšené syntéze vaziva. Výsledkem je retrakce se zvrásněním medie a intimy („tree barking sign“). U TA je tendence k tvorbě vaziva větší než u GCA, což má za následek zřetelnější výskyt stenookluzivního postižení. Naproti tomu u GCA dochází častěji k nekrózám médie a tvorbě aneuryzmat [1]. Detailní patogeneze obou onemocnění zatím není objasněna. Je zřejmé, že se jedná o buněčně zprostředkovanou autoimunitní reakci na zatím neznámou noxu. Postižení aorty bylo zaznamenáno i u jiných systémových onemocnění a vaskulitid (tab. 1). Přesná patogeneze procesu vedoucímu k zánětlivému postižení však není známa [1,3,9–11].
Obrovskobuněčná arteritida
GCA je nejčastější vaskulitida velkých a středně velkých tepen. Postihuje aortu a její sekundární i terciální větvení. Pro typické postižení spánkové artérie je také označována jako temporální arteritida. Prevalence je odhadována na 20 případů na 100 000 obyvatel. Výhradně postihuje jedince starší 50 let s maximem výskytu v osmé dekádě. Ženy onemocní častěji než muži v poměru 3 : 2. Příznaky onemocnění jsou klinické a laboratorní. Přibližně polovina nemocných udává celkové příznaky, kterými jsou zvýšená teplota, únava, noční poty a hubnutí. Stejně častý je i výskyt polymyalgia rheumatica, která je charakterizována bolestí nebo ztuhlostí svalů pletence pažního a pánevního. Dvě třetiny nemocných si stěžují na bolest hlavy a bolestivé zduření v průběhu spánkové tepny. Alarmující jsou oční příznaky, protože znamenají vysoké riziko ztráty zraku. Projevují se jako amaurosis fugax, jiskřící skotomy nebo diplopie. Z laboratorních hodnot jsou důležité vysoká sedimentace (> 50 mm/hod) a vysoká hodnota CRP. Ke stanovení definitivní diagnózy musí být přítomny minimálně tři z pěti kritérií stanovených americkou revmatologickou společností v roce 1990 (tab. 2) [1,3,12].
2. Diagnostická kritéria velkobuněčné arteritidy podle Americké revmatologické společnosti. 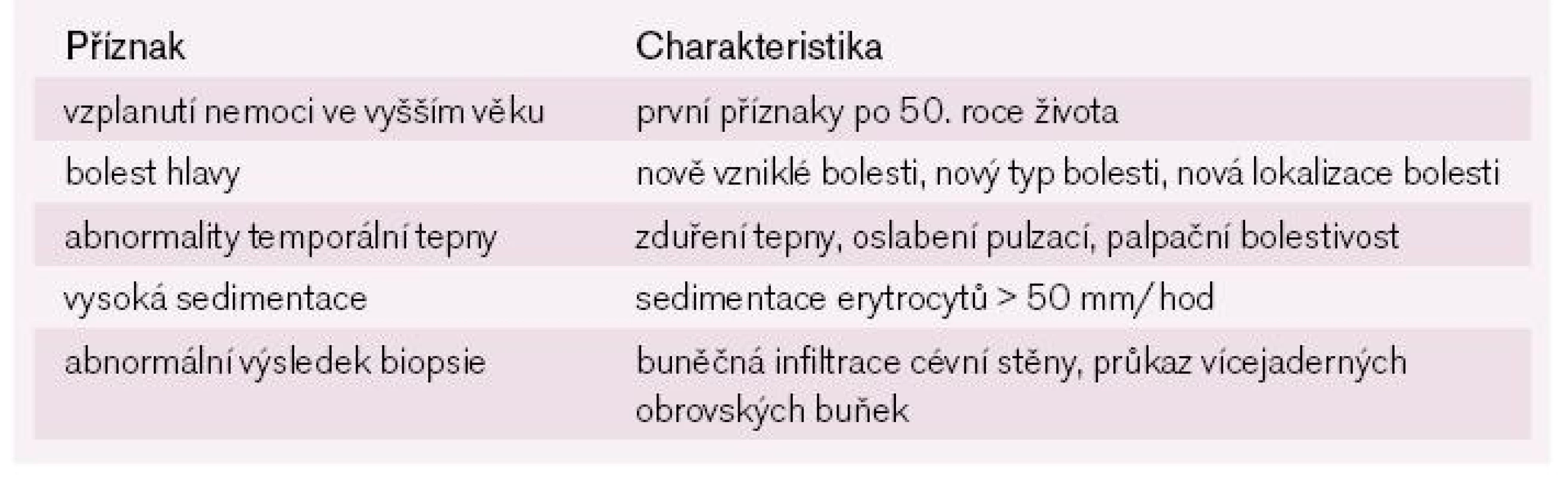
U všech nemocných by mělo být pravidelně prováděno zobrazovací vyšetření aorty. Důvodem je častý výskyt aneuryzmat a zvýšené riziko disekce aorty. V retrospektivní studii Evanse et al vykazovali nemocní s GCA 17krát vyšší riziko vzniku aneuryzmatu hrudní aorty a 2,5krát vyšší riziko aneuryzmatu břišní aorty. Medián časové prodlevy mezi stanovením diagnózy a vznikem aneuryzmatu byl sedm let v případě hrudní aorty a 2,5 roku v případě břišní aorty [13,14].
Stenookluzivní tepenné postižení se v případě GCA vyskytuje převážně v karotickém řečišti. Častěji jsou postiženy větve zevní karotické tepny. Zúžení temporální artérie nebo žvýkací klaudikace jsou popisovány v 50–70 % případů. Naproti tomu výskyt proximálních stenóz nebo uzávěrů tepen odstupujících z aorty je méně častý (3–15 %) [15]. Typické je dlouhé zúžení až obliterace axilární artérie. V případě postižení podklíčkové tepny je v typickém případě postižen úsek distálně od odstupu vertebrální tepny. Proto většina nemocných netrpí subclavian steal syndromem [12,15].
Takayasuova arteritida
Podobně jako GCA postihuje aortu a její větve. Pro vícečetné stenookluzivní postižení končetinových tepen je často označována jako „bezpulzová“ nemoc. V porovnání s GCA se jedná o vzácné onemocnění. Prevalence je v západním světě odhadována na 2,6 případu na milion obyvatel. Ženy jsou postiženy častěji než muži v poměru 10 : 1. Většina onemocnění bývá diagnostikována ve věku 25–30 let. Pro potvrzení diagnózy je opět nutná přítomnost tří ze šesti kritérií stanovených Americkou revmatologickou společností (tab. 3). Celkové příznaky často chybí nebo nejsou tak vyjádřeny jako u GCA. Symptomatologie pramení převážně z ischemie nejvíce postiženého tepenného povodí. Více než polovina nemocných si stěžuje na bolesti horních končetin a na symptomy pramenící z cerebrovaskulární insuficience. Typické jsou zrakové poruchy nebo posturální závratě a nevolnost. Běžný je výskyt hypertenze, jejíž etiologie je renovaskulární nebo je podmíněna stenózou descendentní aorty [1,3]. Významná stenóza aorty je popisována u 53 % nemocných, přičemž nejčastěji je postižena aorta břišní (70 %) [16]. Zánětlivé změny mohou z ascendentní aorty přestupovat do koronárních sinů a podmiňovat významné ostiální stenózy koronárních tepen. Kardiální manifestace TA je popisována u 40 % nemocných [1,16,17]. Aneuryzmata aorty jsou nejméně častou formou aortálního postižení. Přesto se podle zkušeností japonských autorů vyskytují až u 32 % nemocných. Nejčastější lokalizací je descendentní aorta, následuje aorta břišní a nejméně často bývá postižena aorta ascendentní [18].
3. Diagnostická kritéria Takayasu arteritidy podle Americké revmatologické společnosti. 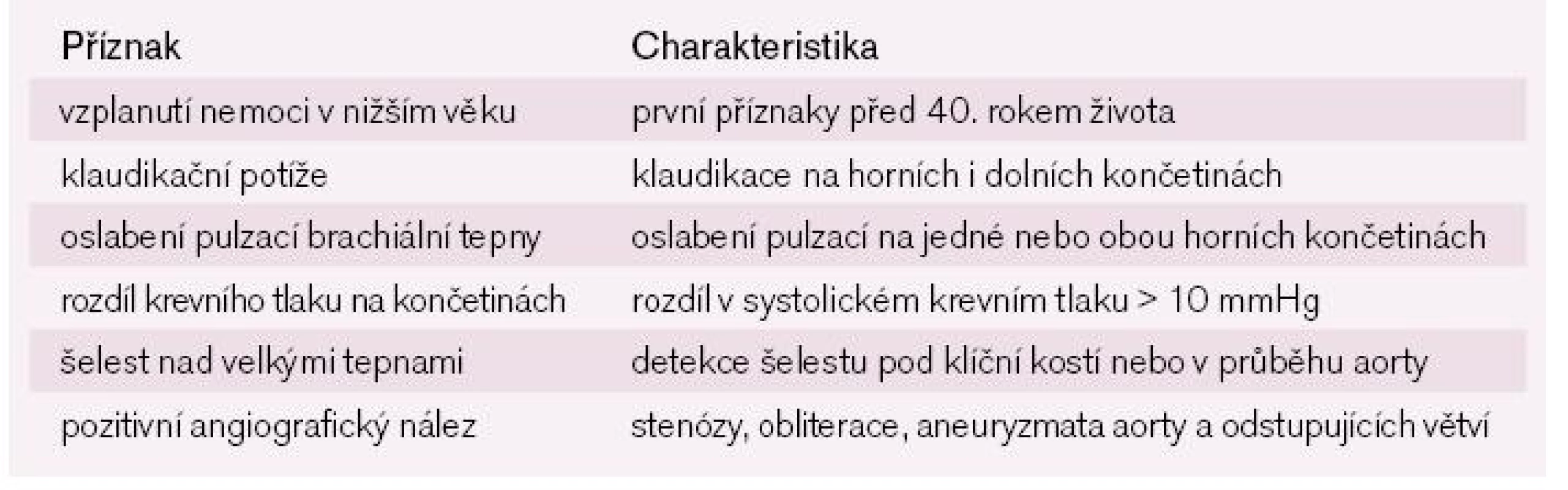
Idiopatická izolovaná aortitida
Tato diagnóza je vyhrazena pro neinfekční zánětlivé onemocnění aorty bez současného postižení odstupujících větví. Přesný výskyt stejně jako patogeneze nejsou známy. Neléčené onemocnění je dáváno do souvislosti se vznikem aneuryzmat, disekcí nebo méně často se stenotickým postižením. Existence onemocnění byla prokázána histopatologickými studiemi provedenými na vzorcích odebraných během kardiochirurgických operací nebo post mortem. Rojo-Leyva se spolupracovníky ve své studii histologicky vyšetřili 1 204 vzorků aorty. V 88 % případů bylo příčinou operace aneuryzma nebo disekce aorty. Idiopatická aortitida byla diagnostikována u 36 (3 %) vzorků. V 67 % případů se jednalo o vzorky žen a průměrný věk nemocných byl 65 let. V 16 případech byly v histologickém obraze přítomny obrovské buňky typické pro GCA. To může podporovat názor, že se jedná o fokální formu onemocnění lokalizovanou na aortální oblouk. Žádný z nemocných však neměl klinické známky tohoto onemocnění ani jinou lokalizaci tepenného postižení [19]. V poslední době je stále častěji popisován obraz izolované aortitidy při vyšetření pozitronovou emisní tomografií za použití 18-fluorodeoxyglukózy (FDG-PET) u nemocných s horečkou neznámé etiologie. Vyšetření má větší diagnostickou výtěžnost než ostatní zobrazovací metody první linie (ultrasonografie, echokardiografie, CT vyšetření), které mohou být negativní. Je možné, že se zvyšující se dostupností PET kamer bude narůstat i četnost diagnostikovaných onemocnění [20].
Chronická periaortitida, retroperitoneální fibróza
Prevalence tohoto onemocnění je odhadována na 0,2–1 : 100 000 obyvatel. Podkladem je zánět vycházející z adventicie abdominální aorty a pánevních tepen vedoucí k masivní produkci vaziva. To se šíří do retroperitonea a vede k útlaku retroperitoneálních struktur, především ureterů. Etiologie zánětu není detailně objasněna. Uvažuje se o excesivní zánětlivé odpovědi na lokální aterosklerotické změny. Častá přítomnost systémových příznaků a elevace zánětlivých markerů však svědčí spíš pro autoimunitní proces. Příslušnost k vaskulitidám velkých a středně velkých tepen potvrzují také nálezy z FDG-PET vyšetření. V oblasti břišní aorty a pánevních tepen zobrazí vzestup metabolické aktivity glukózy odpovídající zánětlivému procesu. Nález je podobný obrazu velkobuněčné arteritidy a až v polovině případů se současně prokáže i postižení oblouku aorty a odstupujících větví [21,22]. Onemocnění je často dáváno do souvislosti s aneuryzmatem břišní aorty, ale vyskytuje se i u nemocných bez aneuryzmatu. V literatuře se setkáme s celou řadou synonym označujících stejné onemocnění. Někteří autoři do této skupiny onemocnění zařazují i zánětlivé, ale neinfekční aneuryzma břišní aorty (tab. 1).
Na rozdíl od ostatních vaskulitid jsou chronickou periaortitidou postižení především muži a to v páté a šesté dekádě života. Poměr postižení mužů a žen je 3 : 1. Příznaky onemocnění jsou v počáteční fázi nespecifické. Objevují se teploty, slabost, únavnost a nadměrné pocení. Postupně se přidávají bolesti břicha a podbřišku podmíněné útlakem retroperitoneálních orgánů a nervových struktur. Útlak ureterů vede ke vzniku obstrukční nefropatie a selhání ledvin. Průměrná doba od vzniku prvních příznaků do stanovení diagnózy je 6–12 měsíců [23]. Diferenciálně diagnosticky je nutno vyloučit maligní onemocnění. Z primárních nádorů se v této oblasti vyskytují lymfomy a sarkomy. Metastatické postižení mívá primární zdroj v plicích, prsu, prostatě nebo tlustém střevě. Fibróza retroperitonea může být rovněž podmíněna předchozí radioterapií pro nádorové onemocnění.
Diagnostické metody
Základem diagnostiky aortitid je pečlivý rozbor anamnézy a klinické vyšetření. V anamnéze pátráme po srdečních nebo cévních operacích, po přítomnosti systémových onemocnění pojiva, revmatologických onemocnění nebo vaskulitidách. Zapomínat bychom neměli ani na tuberkulózu a syfilis. Nezbytnou součástí fyzikálního vyšetření je auskultace v průběhu celé aorty a jejích velkých větví. Šelesty svědčí pro přítomnost stenotického postižení. Pulzující rezistence v břiše nebo malé pánvi je známkou aneuryzmatu. Nutná je pečlivá palpace tepu na všech končetinách a posouzení jeho symetrie. Diagnosticky cenné je změření rozdílných tlaků na obou horních končetinách. U Takayasuovy arteritidy je doporučováno měření tlaku i na končetinách dolních.
V laboratorních testech si všímáme známek zánětu, především vysoké sedimentace erytrocytů a hladiny CRP. Bývají zvýšené u většiny aortitid bez závislosti na etiologii. Pro infekční etiologii je typická leukocytóza s neutrofilií. U neinfekčních aortitid je doporučováno provedení kompletního revmatologického panelu k vyloučení systémového onemocnění pojiva. U vaskulitid velkých a středních tepen je však nutno počítat s negativním výsledkem. U infekčních aortitid laboratorní známky zánětu korelují s aktivitou onemocnění. U neinfekčních aortitid tomu tak není. Velkobuněčná arteritida i Takayasuova arteritida si mohou zachovávat svoji zánětlivou aktivitu i při nízkých hodnotách sedimentace nebo hladin CRP. V budoucnu by mohlo mít význam stanovení sérových hladin interleukinu 6, interleukinu 18 nebo matrix metaloproteináz, jejichž hladina v experimentálních pracích s aktivitou onemocnění korelovala [1,3].
Provedení biopsie s histopatologickým zpracováním vzorků má diagnostický význam GCA a chronické periaortitidy. V prvním případě se biopsie provádí z temporální artérie, v ideálním případě po předchozím ultrasonografickém vyšetření a potvrzení zánětlivých změn. V druhém případě se retroperitoneální biopsie provádí tenkou jehlou pod CT kontrolou. Vyšetření má význam především pro odlišení retroperitoneální fibrózy od nádorového onemocnění [1,3,22, 23].
Mezi zobrazovací metody první linie patří RTG hrudníku, vaskulární a břišní ultrasonografie, echokardiografie, CT vyšetření a magnetická rezonance. Na prostém snímku hrudníku může být patrný stín aneuryzmatu hrudní aorty. Zvětšení uzlin může být projevem sarkoidózy. Vaskulární ultrasonografie je suverénní metodou k posouzení přítomnosti a významnosti stenookluzivního postižení karotid. Typickým nálezem u vaskulitid je difuzní významné ztluštění cévní stěny (obr. 1). U GCA je v oblasti temporální arterie specifickým nálezem hypoechogenní až anechogenní halo kolem zesílené tepenné stěny („halo sign“) [24,25]. Ultrasonografie je rovněž dostatečně citlivá v diagnostice postižení břišní aorty i v detekci retroperitoneální fibrózy. Echokardiograficky je dobře zobrazitelná ascendentní aorta, jícnovou echokardiografií pak aortální oblouk a descendentní aorta.

1. USG obrázek difuzního zesílení cévní stěny společné karotidy v akutní fázi Takayasu arteritidy. a – podélná projekce, b – příčná projekce. 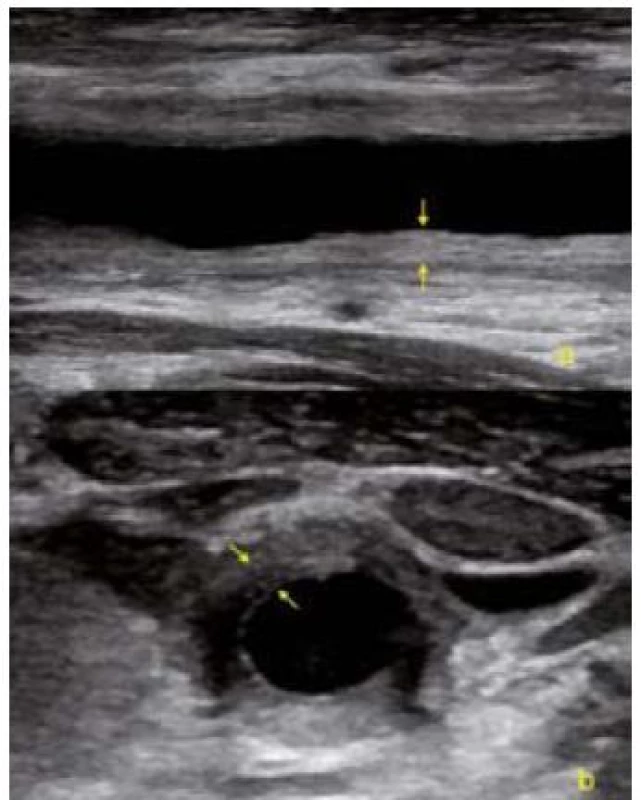
Zesílení aortální stěny při akutní aortitidě je nejlépe zobrazitelné CT angiografií a MR angiografií (obr. 2). U infekčních zánětů je toto zesílení nepravidelné, nehomogenní s častým zatékáním kontrastní látky mimo konturu aortálního lumen. Časté jsou i extravazace kontrastní látky a obraz pseudoaneuryzmatu nebo aneuryzmatu aorty. U chronicky probíhajících aortitid obě vyšetření stanoví rozsah a významnost stenookluzivních změn, eventuálně přítomnost aneuryzmat. Obě vyšetření spolehlivě odhalí přítomnost retroperitoneální fibrózy. Výhodou CT a MR vyšetření je možnost monitorovat efekt léčby (ústup edému aortální stěny) i dlouhodobě sledovat vývoj ektázií a aneuryzmat. Nevýhodou je zatížení kontrastní látkou a opakovaná expozice rentgenovému záření. Nejcitlivější metodou k zobrazení cévních zánětlivých změn je v současné době FDG-PET vyšetření. U vaskulitid velkých tepen má vyšetření senzitivitu 77–92 % a specificitu 89–100 %. Metoda samotná nebo v kombinaci s CT vyšetřením (PET-CT) je schopna zobrazit zánětlivé změny ještě v okamžiku, kdy nedochází k zesílení cévní stěny a ostatní zobrazovací metody jsou negativní. Vyplývá to především ze studií u nemocných, kteří byli vyšetřováni pro horečku neznámé etiologie [20,26].
2. CT obraz zesílení stěny aorty při aortitidě. a – hrudní aorta, b – břišní aorta. 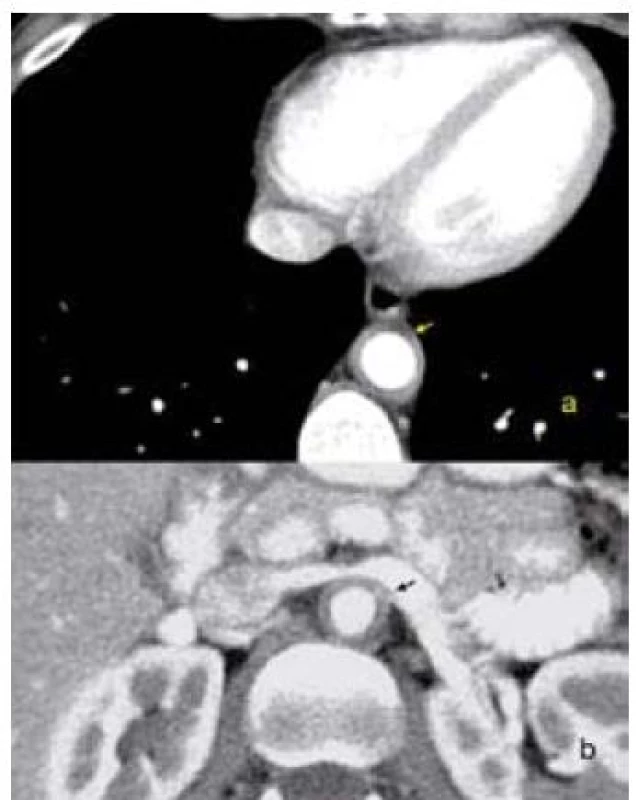
Digitální subtrakční angiografie již ztratila statut zlatého standardu pro vyšetřování nemocných s aortitidou nebo vaskulitidou velkých tepen. Indikujeme ji pouze před plánovaným revaskularizačním výkonem u nemocných s GCA nebo TA (obr. 3).
3. Angiografický obrázek Takayasu arteritidy v chronickém stadiu s obliteracemi magistrálních mozkových tepen. Mozek je zásobován jedinou mohutnou vertebrální tepnou. a – obliterace pravé společné karotidy, b – obliterace levé společné karotidy, c – obliterace levostranné podklíčkové tepny. 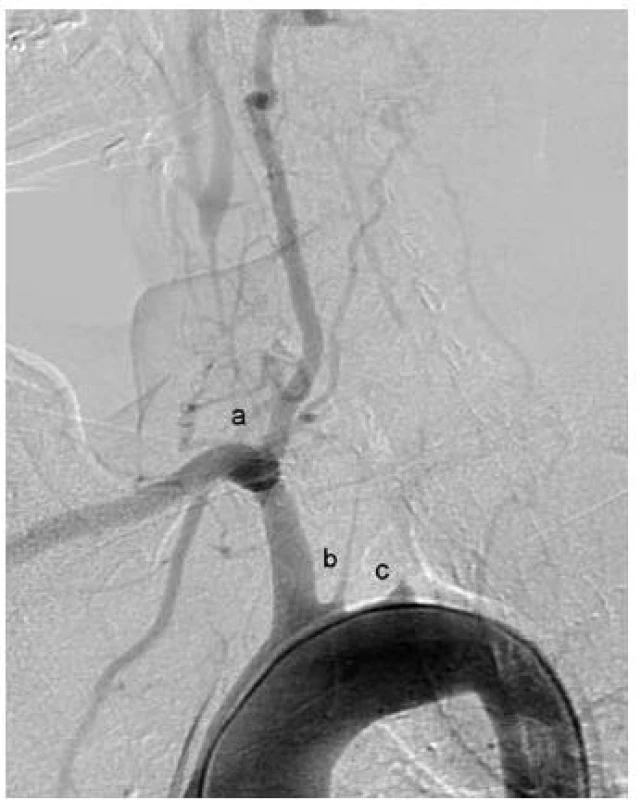
Léčba
Léčba nemocných s aortitidou je dána etiologií. Zásadní je odlišení infekční etiologie od neinfekční. Zatímco v prvním případě je indikována časná chirurgická léčba a intenzivní antibiotická terapie s délkou trvání minimálně šesti týdnů, v druhém případě jsou indikovány kortikoidy [1,3,27]. Před zahájením kortikoterapie je vždy nutné vyloučit tuberkulózní etiologii. Počáteční dávka kortikoidů je udávána v rozmezí 40–60 mg prednisonu denně u GCA a 1 mg/kg/den u TA. V této iniciální dávce je doporučováno pokračovat po dobu 2–4 týdnů v závislosti na ústupu symptomů a sérových zánětlivých markerů. Poté je možno dávku postupně snižovat až na 10 mg denně. Celková délka léčby je obvykle dva roky. Bohužel až v 50 % případů dochází k relapsu onemocnění, který se projeví opětovným zhoršením klinických příznaků a vzestupem sérových známek zánětu. Nízká sedimentace nebo hladina CRP však relaps nevylučuje. Nové vzplanutí choroby vyžaduje opětovné zvýšení dávky prednisonu na 40–60 mg denně. Alternativou je přidání metotrexátu. Hospitalizace s intravenózní léčbou kortikoidy je indikována u nemocných se zrakovými projevy nebo kardiálními příznaky [1,3,12]. Nejasná je situace kolem léčby nemocných s izolovanou aortitidou, u kterých byly zánětlivé změny prokázány histologickým vyšetřením odoperovaného aneuryzmatu. Riziko recidivy totiž není zanedbatelné a jak ukazují data z výše zmíněné práce Rojo-Leyvy, kortikoterapie toto riziko snižuje [19]. Léčba kortikoidy by měla být zvažována individuálně, případ od případu, v závislosti na klinické symptomatologii a rozsahu zánětlivých změn. Nemalé kontraverze panují i v indikacích revaskularizačních výkonů u nemocných se stenotickým postižením a ischemickými příznaky. Většina autorů se shoduje na tom, že by tyto výkony měly být prováděny až v chronické fázi onemocnění, po ústupu zánětlivých změn. U nemocných s vaskulitidou je indikována antiagregační léčba kyselinou acetylsalicylovou v dávce 100 mg denně, protože snižuje riziko cerebrovaskulárních příhod [28].
Léčba chronické periaortitidy a retroperitoneální fibrózy závisí na stupni renální insuficience. V případech pokročilého renálního selhání je indikováno včasné odstranění obstrukce močovodů a to buď retrográdní katetrizací ureterů, nebo perkutánní nefrostomií. Následuje operační řešení spočívající v uvolnění močovodů z okolního vaziva. Postoperačně je doporučována léčba kortikoidy k zabránění progrese onemocnění. V případě absence významnější renální insuficience doporučuje řada autorů primárně postupovat konzervativně a nemocné léčit kortikoidy. Ty vedou k ústupu systémových příznaků i ústupu uretrální obstrukce [23].
Závěr
Aortitida je vzácné zánětlivé onemocnění se závažnými prognostickými důsledky. Na infekční etiologii je nutno pomýšlet u starších nemocných s diabetem a bouřlivou klinickou symptomatologií. Neinfekční příčinou onemocnění jsou nejčastěji vaskulitidy velkých tepen. U mladých nemocných je to Takayasuova arteritida, u starších pacientů velkobuněčná arteritida. FDG-PET vyšetření je nejcitlivější metodou schopnou diagnostikovat probíhající zánět v aortální stěně. Indikováno je u symptomatických nemocných s negativním výsledkem zobrazovacích metod první linie. Léčba infekční aortitidy spočívá v intenzivní antibiotické léčbě a časné operaci. U neinfekční etiologie je indikována imunosupresivní terapie. Aortitida je možnou příčinou aneuryzmat hrudní i břišní aorty.
Doručeno do redakce 20. 9. 2010
Přijato po recenzi 1. 10. 2010MUDr. David Ručka
II. interní klinika kardiologie a angiologie 1. LF UK a VFN, Praha
ruckad@centrum.cz
Sources
1. Gornik HL, Creager MA, Aortitis. Circulation 2008 : 117 : 3039–3051.
2. Heggtveit HA. Syphilitic Aortitis: A Clinicopathologic Autopsy Study od 100 cases, 1950 to 1960. Circulation 1964; 29 : 346–355.
3. Hiratzka LF, Bakris GL, Beckman JA et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. Circulation 2010; 121: e266–e369.
4. Gajaraj A, Victor S. Tuberculous aortoarteritis. Clin Radiol 1981; 32 : 461–466.
5. Meehan JJ, Pastor BH, Torre AV. Dissecting Aneurys‑ma of the Aorta Secondary to Tuberculous Aortitis. Circulation 1957; 16 : 651–620.
6. Cina CS, Arena GO, Fiture AO et al. Ruptured Mycotic Thoracoabdominal Aortic Aneurysma: a Report of Three Cases and Systematic Review. J Vasc Surg 2001; 33 : 861–867.
7. Palma JH, Gomez WJ, Almeina DR et al. Replacement of Infected Thoracic Aortic Prosthesis With a Spiral Composite Vein Graft. Ann Thorac Surg 1998; 65 : 1135–1137.
8. Foote EA, Postier RG, Greenfield RA et al. Infectious aortitis. Curr Treat Options Cardiovasc Med 2005; 7: 89–97.
9. Miller DV, Isotalo PA, Weyand CM et al. Surgical pathology of noninfectious ascending aortitis: a study of 45 cases with emphasis on an isolate variant. Am J Surg Pathol 2006; 30 : 1150–1158.
10. Roldan CA, Chavez J, Wiest PW et al. Aortic root disease and valve disease associated with ankylosing spondylitis. J Am Coll Cardiol 1998 : 32: 1397–1404.
11. Kumar R, Basu S, Torigian D et al. Role of Modern Imaging Techniques for the Diagnosis of Infection in the era of 18 F-Fluorodeoxyglucose Positron Emission Tomography. Clin Mikrob Rev 2008; 21 : 209–224.
12. Tato F, Hoffmann U. Giant cell arteritis: a systemic vascular disease. Vasc Med 2008; 13 : 127–140.
13. Evans JM, O´Fallon WM, Hunder GG. Increased incidence of aortic aneurysm and dissection in giant cell (temporal) arteritis: A population-based study. Ann Intern Med 1995; 122 : 502–507.
14. Evans JM, Bowles CA, Bjornsson J et al. Thoracic aortic aneurysm and rupture in giant cell arthritis: a descriptive study of 41 cases. Arthritis Rheum 1994; 37 : 1539–1547.
15. Klein RG, Hunder GG, Stanson AW et al. Large Artery involvement in giant cell (temporal) arteritis. Ann Intern Med 1975 : 83 : 806–812.
16. Kerr GS, Hallahan CW, Giordano J et al. Takayasu arteritis. Ann Intern Med 1994; 120 : 919–929.
17. Kořínek J, Lubanda JC, Karetová D et al. Takayasu´s disease associated with autoimmune thyroiditis and celiac disease. Clinical course and limitations of treatment. J Mal Vasc 2001; 26 : 191–195.
18. Matsumura K, Hirano T, Takeda K et al. Incidence of aneurysms in Takayasu´s arteritis. Angiology 1991; 42 : 308–315.
19. Royo-Leyva F, Ratliff NB, Cosgrove DM 3rd et al. Study of 52 patients with idiopathic aortitis from a cohort of 1 204 surgical case. Arthritis Rheum 2000; 43 : 901–907.
20. Zalts R, Hamoun S, Bar-Shalom R et al. Panaortitis: Diagnosis via Fluorodeoxyglucose Positron Emission Tomography. Am J Med Sci 2005; 330 : 247–249.
21. Salvarani C, Pipitone N, Versari A et al. Positron Emission Tomography (PET): Evaluation of chronic Periaortitis. Arthritis Rheum 2005; 53 : 298–303.
22. Vaglio A, Corradi D, Manenti L et al. Evidence of autoimmunity in chronic periaortitis: a prospective study. Am J Med 2003; 114 : 454–462.
23. van Bommel EF. Retroperitoneal fibrosis. Neth J Med 2002; 60 : 231–242.
24. Salvarini C, Silingardi M, Ghirarduzzi A et al. Is duplex ultrasonography useful for the diagnosis of giant-cell arthritis? Ann Intern Med 2002; 137 : 232–238.
25. Netuka D, Ostrý S, Belšan T et al. Magnetic resonance angiography, digital subtraction angiography and Doppler ultrasonography in detection of carotid artery stenosis: a comparison with findings from histological specimens. Acta Neurochir (Wien) 2010; 152 : 1215–1221. Epub 2010 Apr 22.
26. Meller J, Sahlmann CO, Gürocak O et al. FDG-PET in patients with fever of unknown origin: the importace of diagnosing large vessel vasculitis. QJ Nucl Med Mol Imaging 2009; 53 : 51–63.
27. Moláček J, Houdek K, Baxa J et al. Infekční onemocnění aorty a velkých tepen způsobené bakterií Salmonella enteritidis. Cor Vasa 2010; 52 : 67–70.
28. Nesher G, Berkun Y, Mates M et al. Low-dose aspirin and prevention of cranial ischemic complications in giant cell arthritis. Arthritis Rheum 2004; 50: 1332–1337.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2010 Issue 4-
All articles in this issue
-
Situace v diagnostice a léčbě ischemické choroby dolních končetin v České republice
(poznatky z projektu MOET ICHDK – Monitoring Efektivní Terapie ICHDK) - News from the 2010 guidelines for the treatment of patients with atrial fibrillation
- Is there a sufficient evidence for cardioprotective effects of mild wine consumption on cardiovascular diseases?
- Rare popliteal artery diseases
- Aortitis – an inflammation of the aortic wall
- Small aneurysms of abdominal aorta – is it time to change our approach?
- Thrombolytic therapy of acute central retinal artery occlusion
- Unusual cause of acute limb ischemia – stent fracture
-
Situace v diagnostice a léčbě ischemické choroby dolních končetin v České republice
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aortitis – an inflammation of the aortic wall
- Thrombolytic therapy of acute central retinal artery occlusion
- Rare popliteal artery diseases
- Small aneurysms of abdominal aorta – is it time to change our approach?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


