-
Medical journals
- Career
Současný stav srdeční resynchronizační léčby u nemocných se srdečním selháním
Authors: P. Heinc
Authors‘ workplace: I. interní klinika, FN Olomouc
Published in: Kardiol Rev Int Med 2009, 11(1): 20-25
Overview
Článek podává aktualizovaný přehled problematiky srdeční resynchronizační léčby. Je diskutována otázka optimálního výběru nemocných k srdeční resynchronizační léčbě. Dále jsou rozebrána specifika srdeční resynchronizační léčby u nemocných s fibrilací síní, u nemocných indikovaných k trvalé kardiostimulaci pro bradyarytmie, u nemocných s přítomnou blokádou pravého Tawarova raménka, u nemocných s mírnými projevy srdečního selhání a z pohledu výběru optimálního přístroje pro srdeční resynchronizační léčbu.
Klíčová slova:
srdeční resynchronizační léčba – srdeční slabost – komorová dyssynchronie – kardioverter-defibrilátorÚvod
Se srdeční resynchronizační léčbou (SRL) pomocí nekonvenční stimulace levé komory, nebo obou komor u nemocných se srdečním selháním (SS) se v klinické praxi začalo v 90. letech minulého století. Podnět k tomu dala zjištění, že 25–50% nemocných se srdečním selháním má prodloužené intraventrikulární vedení s trváním QRS ≥ 120 ms, v 15–27% je také u těchto nemocných přítomna blokáda levého Tawarova raménka (Left Bundle Branch Block – LBBB) a asi třetina nemocných má prodloužené atrioventrikulární (AV) vedení [1]. Prodloužené AV a intraventrikulární vedení dále zhoršuje primárně sníženou funkci levé komory v důsledku základní kardiomyopatie a současně také zvětšuje často přítomnou mitrální regurgitaci. Dyssynchronie tak představuje patofyziologický proces, který zhoršuje funkci komor, způsobuje levokomorovou remodelaci, srdeční selhání a následně zvyšuje morbiditu i mortalitu [2–6].
Dosavadní medicínské důkazy pozitivního vlivu srdeční resynchronizační léčby
Randomizované studie, které hodnotily resynchronizační léčbu (SRL), sledovaly vliv na subjektivní potíže, na progresi onemocnění ve smyslu morbidity i mortality a na srdeční funkce a srdeční remodelaci. Tyto randomizované multicentrické studie a jejich meta analýzy nejdříve zahrnovaly pouze nemocné se sinusovým rytmem (SR), jejichž vstupními podmínkami byla optimální farmakologická léčba, funkční klasifikace NYHA ve třídě III a IV, ejekční frakce (EF) levé komory (LK) < 35%, end diastolický rozměr LK > 55mm a trvání QRS komplexu ≥ 120 nebo 150 ms [7–23] (tab. 1). Všechny randomizované studie potvrdily signifikantní zmírnění symptomů, zvýšenou toleranci námahy, významné zlepšení kvality života a významné snížení počtu hospitalizací i doby hospitalizace pro SS. Problematikou vlivu na mortalitu se zabývaly studie CARE-HF a COMPANION [14–15]. Ve studii COMPANION celkovou mortalitu signifikantně snížila pouze větev se SRL uplatňovanou pomocí implantace defibrilátoru (SRL-D), zatímco ve větvi se SRL uplatňovanou pomocí implantace kardiostimulátoru (SRL-K) došlo jen ke snížení celkové mortality těsně pod hranicí statistické významnosti. Tato studie však měla pro základní i další hodnocení dvě závažné metodologické limitace. Předčasné ukončení studie po 14 měsících pro výrazně lepší výsledky ve větvi se SRL-D znevýhodnily validní hodnocení dalších srovnávaných léčebných postupů – optimální farmakoterapie (OF) a SRL-K. Tím, že nebyla dopředu specifikována analýza ke srovnání větví se SRL-K a se SRL-D, nelze zcela validizovat průkaz superiority jedné léčby před druhou [14]. Ve studii CARE-HF byl signifikantní pokles mortality především dosažen snížením počtu úmrtí na SS. Určitou limitací těchto studií byla jejich krátká doba sledování nemocných po zavedení SRL (3–6 měsíců), nicméně dlouhodobější klinický efekt SRL u přežívajících nemocných ukázaly studie MUSTIC a CARE-HF (24, resp. 29 měsíců). Při sledování srdečních funkcí došlo ke zmenšení end diastolického rozměru LK do 15% a k zvýšení EF LK do 6% [19–23]. Tento efekt byl větší u neischemické kardiomyopatie (KMP) než u ischemické KMP [21,23] a studie CARE-HF ukázala, že proces remodelace není jen dočasný, ale zlepšení trvá dlouhodobě při trvání SRL. Podobné výsledky jako v randomizovaných studiích se ukázaly i v observačních studiích (tab. 2).
Table 1. Vstupní kritéria do randomizovaných studií s resynchronizační stimulační léčbo u u nemocných se srdečním selháním. 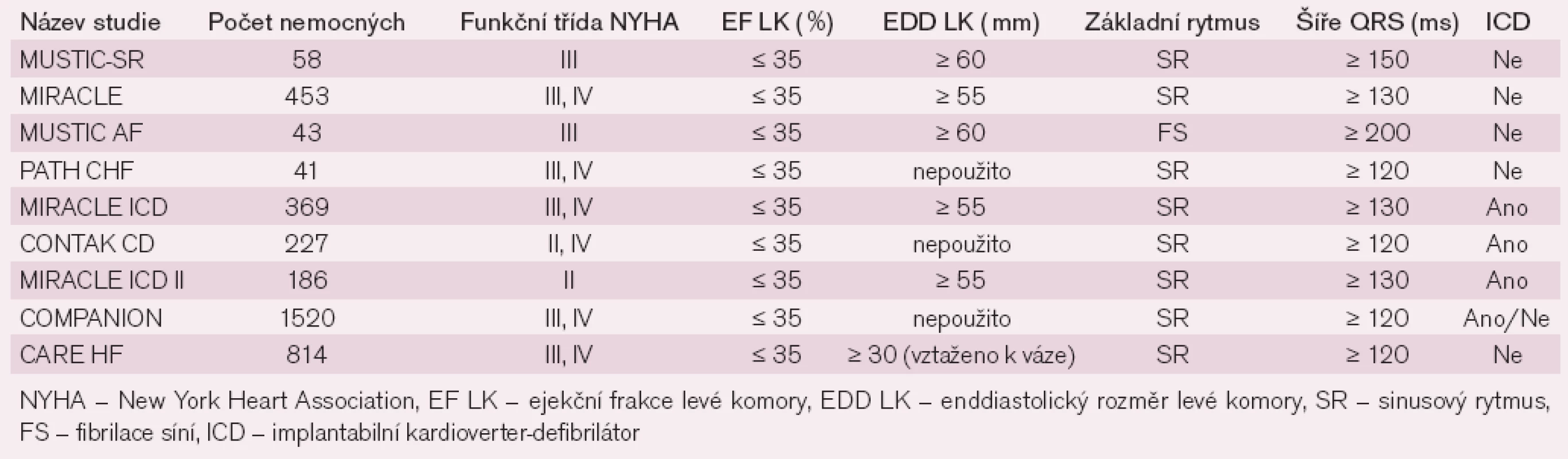
Table 2. Efekt SRL v observačních studiích dle funkční, echokardiografické a kombinované definice responderů. 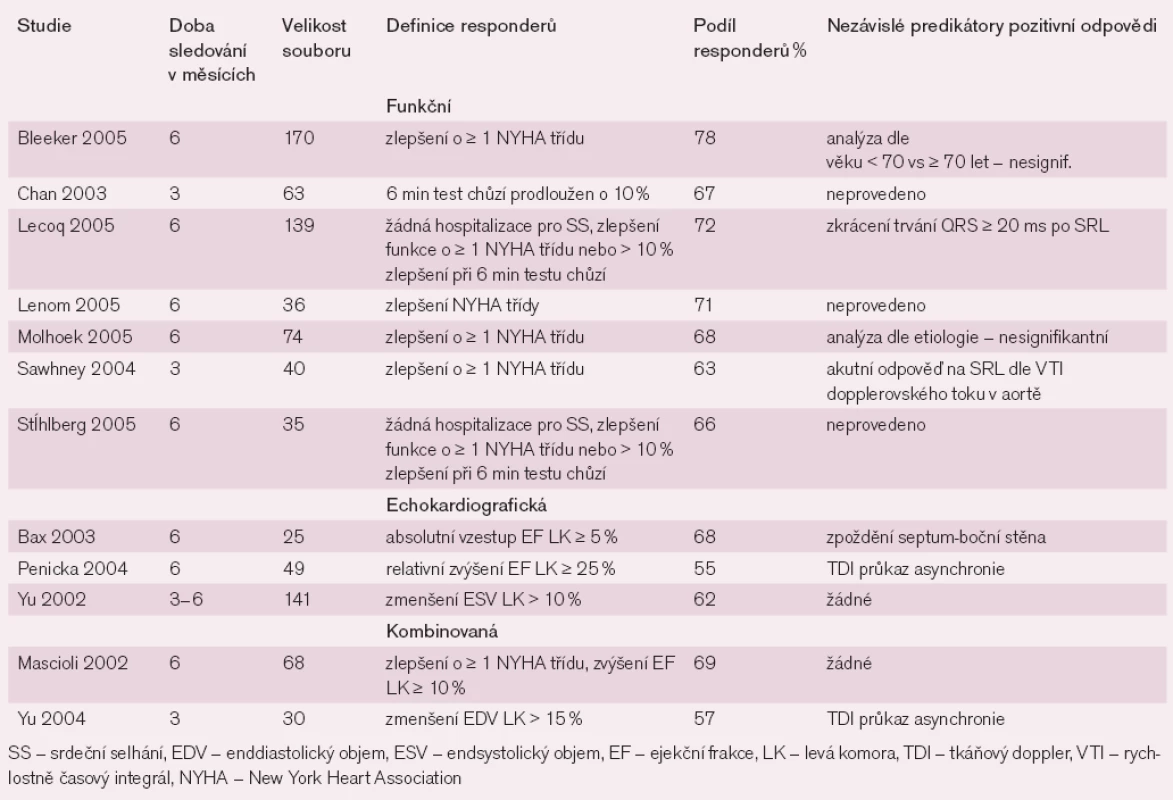
Přetrvávající nejasnosti v oblasti srdeční resynchronizační léčby
Optimální výběr nemocných pro srdeční resynchronizační léčbu
Podle jakých kriterií by měli být vybíráni nemocní k SRL – dle elektrických nebo elektromechanických kritérií dyssynchronie? Vzhledem k tomu, že na SRL pozitivně odpovídá jen asi 60–70% nemocných, je potřeba individuálně léčbu vybírat a zároveň vyvíjet kritéria pro výběr nemocných k SRL [1]. Nicméně zatím je klinický efekt SRL odvozen z randomizovaných studií, které užívaly jako marker komorové dyssynchronie šíři QRS komplexu ≥ 120 ms. Zatím nejsou natolik silné důkazy, aby SRL byla indikována u nemocných se SS s šíří komplexu QRS < 120 ms. Elektrická dyssynchronie není vždy spojena s mechanickou dyssynchronií a naopak [1]. Existuje řada nemocných se SS s prokazatelnou mechanickou dyssynchronií LK dle různých zobrazovacích technik a jejich šíře QRS komplexu je < 120 ms (většinou je šíře 110–120 ms) [24–27]. Navzdory pozitivním výsledkům z observačních studií o prospěšnosti SRL u nemocných se SS, vybraných dle mechanických kritérií dyssynchronie [27–28], bude třeba provést ještě randomizované studie, které stanoví skutečnou hodnotu mechanických kritérií pro výběr nemocných. Toto platí také pro nemocné se SS a s šíří QRS < 120 ms, u nichž rovněž některé observační studie ukázaly pozitivní efekt SRL [29–31].
Problematika nemocných s fibrilací síní
Dosavadní studie se SRL byly většinou vyhrazeny pouze pro nemocné se sinusovým rytmem, přitom prevalence fibrilace síní (FS) u nemocných s mírnou až závažnou SS se pohybuje mezi 25–50% [32]. Nemocní se SS v přítomnosti FS tvořily v randomizovaných studiích se SRL pouze 2% nemocných, proto doposud není mnoho informací o klinické hodnotě SRL u těchto nemocných. Nemocní se SS, FS a s komorovou dyssynchronií jsou starší, mají více konkomitantních onemocnění a mají horší prognózu než nemocní se SR [33]. Navíc zajištění trvalé stimulace s plným uchvácením komor k využití SRL není u nemocných s FS jednoduché, neboť k zablokování atrioventrikulárního (AV) převodu je třeba velmi často vytvoření kompletní AV blokády pomocí radiofrekvenční ablace AV uzlu. Výsledky jsou také obtížně interpretovatelné, neboť jak kontrola srdeční frekvence v důsledku vytvořené AV blokády, tak i SRL přispívají ke změnám v klinickém stavu a nelze přesně stanovit, nakolik se každé z těchto opatření na změnách podílí. Malá studie (MUSTIC-AF) [34] ukázala hraničně signifikantní funkční zlepšení při SRL a větší prospektivní observační studie [35] jasně ukázaly při dlouhodobém sledování významné zlepšení funkce LK a tolerance zátěže při 100% efektní biventrikulární stimulaci po ablaci AV uzlu (srovnatelné s výsledky u nemocných na sinusovém rytmu). V případě nemocných s FS, kde nebyla provedena radiofrekvenční ablace uzlu a blokády bylo dosaženo za pomoci chronotropně negativní farmakoterapie, byly výsledky SRL špatné. Proto ke stanovení efektu SRL u nemocných s FS bude třeba dalších větších randomizovaných studií.
Problematika nemocných se srdeční slabostí indikovaných k trvalé kardiostimulaci pro bradyarytmie
Důležité je rozlišit, zda se na klinickém obraze srdečního selhání podílí spíš bradyarytmie nebo dysfunkce LK. Pokud je výrazně omezena funkční kapacita nemocného i funkce levé komory, je třeba ke zmírnění symptomů zvážit zavedení biventrikulární stimulace. Proto u nemocných s projevy SS a již přítomnou dysfunkcí LK se při indikaci pro trvalou stimulaci doporučuje zavedení biventrikulární stimulace. Dlouhodobá stimulace pravé komory z primární indikace bradyarytmie může vést k vývoji dyssynchronie LK s výrazným zhoršením funkce LK, jak ukázaly studie u nemocných se SS ischemické etiologie [36–37]. Doposud však není dostatek zpráv o vlivu změny způsobu stimulace z pravokomorové na biventrikulární [38]. Nicméně všobecné stanovisko je, aby u nemocných s trvalou stimulací pravé komory, kteří splňují indikační kritéria k SRL, byla provedena výměna za biventrikulární stimulaci, přičemž tuto změnu způsobu stimulace by měly indikovat hlavně symptomy SS a známky dysfunkce LK (NYHA III a EF LK ≤ 35% při OF).
Problematika nemocných se srdeční slabostí a blokádou pravého Tawarova raménka
Ačkoli většina nemocných ve studiích se SRL měla LBBB a efekt u nemocných s blokádou pravého tawarova raménka (Right Bundle Branch Block – RBBB) nebyl prokázán, doporučení pro SRL jsou dána na základě šíře QRS komplexu bez ohledu na jeho morfologii. Oprávnění těchto doporučení podporují studie, které mapovaly průběh aktivace u nemocných s RBBB a ukázaly, že u mnoha z nich je současně opožděná i aktivace levé komory [39], proto je SRL indikována i u této specifické skupiny nemocných při splnění základního elektrického kritéria dyssynchronie (dostatečná šíře QRS).
Problematika nemocných s mírným srdečním selháním nebo asymptomatických nemocných se systolickou dysfunkcí levé komory ve funkční třídě NYHA I-II
Hlavním cílem léčby nemocných ve funkční třídě NYHA I nebo II je prevence progrese základního onemocnění se srdečním selháním a redukce mortality způsobené hlavně náhlou srdeční smrtí (NSS). Hodnocení klinického přínosu tohoto nového způsobu léčby u této populace nemocných vyžaduje definici specifických endpointů (tab. 3). Nejzávažnější je pravděpodobně klinická skladba symptomů, morbidita, mortalita a reverzní remodelace. Jelikož není dostatek studií, které by zodpověděly klinický efekt v intencích uvedených endpointů u těchto nemocných, zůstává klinická aplikace SRL zatím stále limitovaná. Signifikantní reverzní remodelaci po šesti měsících SRL u malé podskupiny nemocných ve funkční třídě NYHA I a II prokázala studie CONTAK-CD [11]. Podobné výsledky ukázala rovněž menší studie MIRACLE ICD II study [13]. Validnější výsledky přinesla právě dokončená randomizovaná studie REVERSE [40], kde u nemocných ve funkční třídě NYHA I a II došlo k signifikantnímu zmenšení endsystolického objemu levé komory po 12 měsících SRL, přičemž toto zlepšení bylo třikrát větší ve skupině s neischemickou KMP proti ischemické KMP. Signifikantně se snížilo riziko rehospitalizací pro SS a při SRL byl signifikantně menší výskyt epizod komorových tachykardií či fibrilací komor. Na druhou stranu SRL nevedla ke zlepšení tolerance zátěže ani kvality života. Studie REVERSE nebyla zaměřena na morbiditu a mortalitu, nicméně z významného snížení rizika rehospitalizací pro SS (marker morbidity) lze odvodit, že v delším časovém intervalu by se dalo očekávat i snížení mortality.
Table 3. Výsledky randomizovaných studií hodnotících stimulaci u srdečního selhání. 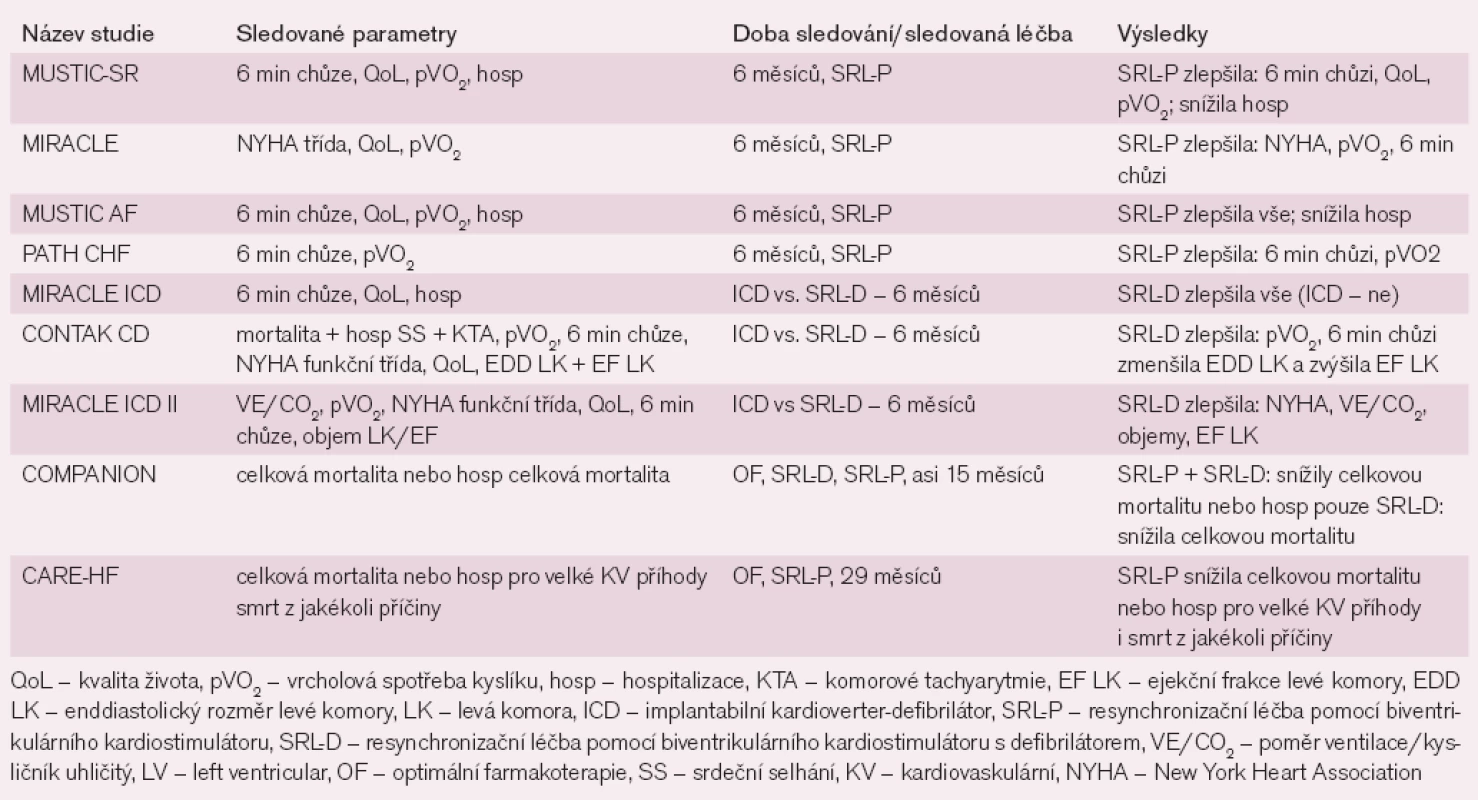
Podle amerických doporučení pro léčbu arytmií pomocí přístrojů z roku 2008 má být zvážena SRL u těch nemocných, kteří jsou indikovaní k trvalé stimulaci pomocí kardiostimulátoru nebo defibrilátoru, kde se předpokládá časté uplatňování srdeční stimulace a jejichž SS při optimální farmakoterapii je vyjádřena EF LK ≤ 35% a funkční třídou NYHA I-II [41].
Problematika nemocných indikovaných k biventrikulární stimulaci a současně i ke kardiochirurgické operaci
Za těchto podmínek srdeční operace může být možností umístění elektrody epikardiálně na boční stěnu levé komory, čímž se lze vyhnout možnému neúspěchu při transvenózním přístupu. Je třeba si také uvědomit, nakolik je základní onemocnění indikované k srdeční operaci odpovědné za dysfunkci LK.
Optimální výběr implantabilního přístroje pro srdeční resynchronizační léčbu –zavádět srdeční resynchronizační léčbu v kombinaci s kardioverterem-defibrilátorem nebo zavádět srdeční resynchronizační léčbu samotnou?
Nemocní se SS jsou ve vysokém riziku NSS, které je sice díky SRL redukované [42], ale tato prevence NSS není pravděpodobně zcela optimalizovaná. Tři prospektivní randomizované studie prokázaly efekt samotné SRL v prevenci NSS u nemocných po prodělaném infarktu myokardu se sníženou EF LK [43–45]. Dvě studie s implantabilními kardiovertery-defibrilátory (Implantable Cardioverter-Defibrillator – ICD) ukázaly snížení rizika smrti u nemocných s ischemickou KMP i u nemocných s neischemickou KMP [14,46]. Studie COMPANION [14] ukázala, že SRL-D signifikantně snížila mortalitu proti OF a studie SCD-HeFT [46] ukázala, že u nemocných s ICD a s mírnou SS došlo ke snížení mortality oproti nemocným s OF a amiodaronem. Více kontroverzní je příznivý vliv ICD v primární prevenci NSS u nemocných s neischemickou KMP – dřívější studie s menším počtem nemocných tento efekt neprokazovaly, zatímco větší randomizované studie již příznivý efekt pozorovaly [14,46–49]. Studie, která zařadila jen nemocné s neischemickou KMP, se SS a s EF LK < 36%, prokázala jen trend snížené celkové mortality bez dosažení statistické významnosti u nemocných s ICD proti OF [47], ale na druhou stranu u nemocných s ICD došlo k signifikantní redukci arytmické mortality. Zatímco jedna studie prokázala protektivní roli SRL-K na NSS, dvě meta analýzy shromažďující data z velkých studií se SRL ukázaly, že SRL-K nemá signifikantní vliv na výskyt NSS nebo dokonce riziko NSS lehce zvyšuje [17]. Navíc současný prospektivně definovaný registr ukázal velký efekt SRL-D v prevenci NSS [50]. Indikace k zavedení SRL-K a SRL-D se do jisté míry překrývají, což při výběru jednoho či druhého způsobu SRL činí určité potíže. Současná doporučení k prevenci NSS zdůrazňují důležitost očekávané délky přežívání při zvažování implantace ICD v primární prevenci NSS [42]. Koncept očekávané délky přežívání paušalizuje všeobecné podmínky nemocných založené především na biologickém věku a přítomnosti závažných doprovodných onemocnění, které mohou mít vliv na jejich prognózu. Tato doporučení specificky stanovují, že implantace ICD v primární prevenci je indikována u nemocných se SS v přítomnosti výrazné dysfunkce LK bez ohledu na etiologii základního onemocnění, kdy je reálný předpoklad minimálně jednoročního přežívání. Studie, které sledovaly poměr ceny k efektivitě léčby, ukázaly, že u SRL-D je oproti SRL-K tento příznivý poměr vztažen k věku nemocného, jelikož kratší přežívání starších nemocných nedokáže zhodnotit přínos této nákladné léčby [51]. Proto se bazálně doporučuje, aby výběr nejvhodnějšího přístroje pro SRL (SRL-K nebo SRL-D) byl založen na pečlivém zhodnocení dvou podmínek:
- očekávaná délka přežívání nemocného při plánované implantaci ICD by měla být větší než jeden rok,
- celková nákladnost zdravotní péče a zvážení nákladů na tento způsob léčby.
Jelikož velká část nemocných, kteří jsou indikováni k SRL, jsou také vhodní kandidáti pro implantaci ICD, odhaduje se, že SRL-D by mohla představovat přes 80% všech indikací k SRL. Proto na základě těchto poznatků již americká společnost FDA (Food and Drug Administration) schválila použití SRL-D u nemocných, kteří splňují současná kritéria pro SRL.
V otázce upřednostnění SRL-D proti SRL-K by měly dát validnější odpověď v současné době probíhající studie RAFT a DECREASE-HF.
Závěr
V současné době se u nás pro indikaci srdeční resynchronizační léčby požadují kritéria pokročilého srdečního selhání ve funkční třídě NYHA II-IV po dobu minimálně šesti měsíců s vyčerpanou standardní farmakoterapií a současně s těžkou dysfunkcí levé komory, vyjádřenou ejekční frakcí levé komory < 35%, a s dyssynchronií levé komory, vyjádřenou šíří QRS ≥ 150 ms (v případě šíře QRS 120–150 ms je požadován průkaz komorové dyssynchronie echokardiografickým vyšetřením).
Pro optimální výběr nemocných při indikaci k srdeční resynchronizační léčbě zatím stále platí elektrická kritéria dyssynchronie (QRS ≥ 120–150 ms) před mechanickými.
Před zavedením srdeční resynchronizační léčby u nemocných s fibrilací síní by měla být provedena radiofrekvenční ablace atrioventrikulárního uzlu k zajištění plně uchvácené biventrikulární stimulace.
U nemocných indikovaných k trvalé kardiostimulaci pro bradyarytmie by měla být zvážena srdeční resynchronizační léčba v případě projevů srdečního selhání s vyjádřenou dysfunkcí levé komory. Podobně by tomu mělo být u nemocných na trvalé konvenční kardiostimulaci, kde progredují známky srdečního selhání s vyjádřenou dysfunkcí levé komory.
Přítomnost blokády pravého Tawarova raménka není překážkou srdeční resynchronizační léčby, pokud jsou splněna současná základní indikační kritéria srdeční resynchronizační léčby. Srdeční resynchronizační léčba zatím není indikována u nemocných s mírným srdečním selháním ve funkční třídě NYHA I, nicméně americká doporučení již nabádají ke zvážení srdeční resynchronizační léčby u těchto nemocných indikovaných k implantaci kardiostimulátoru nebo defibrilátoru, jejichž srdeční selhání je vyjádřeno ejekční frakcí levé komory ≤ 35% a kde se předpokládá časté uplatňování trvalé kardiostimulace.
Při výběru optimálního přístroje pro srdeční resynchronizační léčbu není zatím stanovena priorita mezi biventrikulární stimulací samotnou a biventrikulární stimulací v kombinaci s kardioverterem-defibrilátorem, proto se při indikaci srdeční resynchronizační léčby pomocí biventrikulární stimulace v kombinaci s kardioverterem-defibrilátorem řídíme indikacemi pro implantace kardioverteru-defibrilátoru.
Doručeno do redakce 16. 1. 2009
Přijato po recenzi 12. 2. 2009
doc. MUDr. Petr Heinc, Ph.D.
I. interní klinika, FN Olomouc
Petr.Heinc@fnol.cz
Sources
1. Hawkins NM, Petrie MC, MacDonald MR et al. Selecting patients for cardiac resynchronization therapy: electrical or mechanical dyssynchrony? Eur Heart J 2006; 27 : 1270–1281.
2. Vernooy K, Verbeek XAAM, Peschar M et al. Left bundle branch block induces ventricular remodelling and functional septal hypoperfusion. Eur Heart J 2005; 26 : 91–98.
3. Spragg DD, Leclercq C, Loghmani M et al. Regional alterations in protein expression in the dyssynchronous failing heart. Circulation 2003; 108 : 929–932.
4. Nowak B, Sinha AM, Schaefer WM et al. Cardiac resynchronization therapy homogenizes myocardial glucose metabolism and perfusion in dilated cardiomyopathy and left bundle branch block. J Am Coll Cardiol 2003; 41 : 1523–1528.
5. Ukkonenen H, Beanlands RS, Burwash IG et al. Effect of cardiac resynchronization on myocardial efficiency and regional oxidative metabolism. Circulation 2003; 107 : 28–31.
6. Sundell J, Engblom E, Koistinen J et al. The effects of cardiac resynchronization therapy on left ventricular function, myocardial energetics and metabolic reserve in patients with dilated cardiomyopathy and heart failure. J Am Coll Cardiol 2004; 43 : 1027–1033.
7. Cazeau S, Leclercq C, Lavergne T et al. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med 2001; 344 : 873–880.
8. Abraham WT, Fisher WG, Smith AL et al. Cardiac resynchronization in chronic heart failure. N Engl J Med 2002; 346 : 1845–1853.
9. Auricchio A, Stellbrink C, Sack S et al. Pacing Therapies in Congestive Heart Failure (PATH-CHF) Study Group. Long‑term clinical effect of haemodynamically optimized cardiac resynchronization therapy in patients with heart failure and ventricular conduction delay. J Am Coll Cardiol 2002; 39 : 2026–2033.
10. Auricchio A, Stellbrink C, Butter C et al. Clinical efficacy of cardiac resynchronization therapy using left ventricular pacing in heart failure patients stratified by severity of ventricular conduction delay. J Am Coll Cardiol 2003; 42 : 2109–2116.
11. Higgins SL, Hummel JD, Niazi IK et al. Cardiac resynchronization therapy for the treatment of heart failure in patients with intraventricular conduction delay and malignant ventricular tachyarrhythmias. J Am Coll Cardiol 2003; 42 : 1454–1459.
12. Young JB, Abraham WT, Smith AL et al. Combined cardiac resynchronization and implantable cardioverter defibrillation in advanced chronic heart failure: the MIRACLE ICD trial. JAMA 2003; 289 : 2685–2694.
13. Abraham WT, Young JB, León AR et al. Multicenter InSync ICD II Study Group. Effects of cardiac resynchronization on disease progression in patients with left ventricular dysfunction, an indication for an implantable cardioverter-defibrillator, and mildly symptomatic chronic heart failure. Circulation 2004; 110 : 2864–2868.
14. Bristow MR, Saxon LA, Boehmer J et al. Comparison of Medical Therapy, Pacing, Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350 : 2140–2150.
15. Cleland JGF, Daubert JC, Erdmann E et al. The effect of cardiac resynchronization therapy on morbidity and mortality in heart failure. The CArdiac REsynchronization-Heart Failure (CARE-HF) Study Investigators. N Engl J Med 2005; 352 : 1539–1549.
16. Bradley DJ, Bradley EA, Baughman KL et al. Cardiac resynchronization and death from progressive heart failure: a meta‑analysis of randomized controlled trials. JAMA 2003; 289 : 730–740.
17. Mc Alister FA, Ezekowitz JA, Wiebe N et al. Systematic review: cardiac resynchronization in patients with symptomatic heart failure. Ann Intern Med 2004; 141 : 381–390.
18. Freemantle N, Tharmanathan P, Calvert MJ et al. Cardiac resynchronisation for patients with heart failure due to left ventricular systolic dysfunction: a systematic review and meta‑analysis. Eur J Heart Fail 2006; 8 : 433–440.
19. Linde C, Leclercq C, Rex S et al. Long‑term benefits of biventricular pacing in congestive heart failure: results from the MUSTIC study. J Am Coll Cardiol 2002; 40 : 111–118.
20. Cleland JGF, Daubert JC, Erdmann E et al. Longer‑term effects of cardiac resynchronisation therapy on mortality in heart failure [The Cardiac Resynchronisation-Heart Failure (CARE-HF) trial extension phase]. Eur Heart J 2006; 27 : 1928–1932.
21. Duncan A, Wait D, Gibson D et al. Left ventricular remodelling and haemodynamic effects of multisite biventricular pacing in patients with left biventricular systolic dysfunction and activation disturbances in sinus rhythm: sub‑study of the MUSTIC trial. Eur Heart J 2003; 24 : 430–441.
22. Stellbrink C, Breithardt OA, Franke A. Impact of cardiac resynchronization therapy using hemodynamically optimized pacing on left ventricular remodeling in patients with congestive heart failure and ventricular conduction disturbances. J Am Coll Cardiol 2001; 38 : 1957–1965.
23. St John Sutton MG, Plappert T, Abraham WT et al. Effect of cardiac resynchronization therapy on left ventricular size and function in chronic heart failure. Circulation 2003; 107 : 1985–1990.
24. Leclercq C, Hare JM. Ventricular resynchronization. Current state of the art. Circulation 2004; 109 : 296–299.
25. Bleeker GB, Schalij MJ, Molhoek SG et al. Frequency of left ventricular dyssynchrony in patients with heart failure and a narrow QRS complex. Am J Cardiol 2005; 95 : 140–142.
26. Ghio S, Constantin C, Klersy C et al. Interventricular and intraventricular dysynchrony are common in heart failure patients, regardless of QRS duration. Eur Heart J 2004; 25 : 571–578.
27. Bader H, Garrigue S, Lafitte S et al. Intra-left ventricular electromechanical asynchrony. A new independent predictor of severe cardiac events in heart failure patients. J Am Coll Cardiol 2004; 43 : 248–256.
28. Yu CM, Chan YS, Zhang Q et al. Benefits of cardiac resynchronization therapy for heart failure patients with narrow QRS complexes and coexisting systolic asynchrony by echocardiography. J Am Coll Cardiol 2006; 48 : 2251–2257.
29. Achilli A, Sassara M, Ficili S et al. Long‑term effectiveness of cardiac resynchronization therapy in patients with refractory heart failure and narrow QRS. J Am Coll Cardiol 2003; 42 : 2117–2124.
30. Gasparini M, Mantica M, Galimberti P et al. Beneficial effects of biventricular pacing in patients with a narrow QRS. Pacing Clin Electrophysiol 2003; 26 : 169–174.
31. Bleeker GB, Holman ER, Steendijk P et al. Cardiac resynchronisation therapy in patients with a narrow QRS complex. J Am Coll Cardiol 2006; 48 : 2243–2250.
32. Daubert JC. Atrial fibrillation and heart failure: a mutually noxious association. Europace 2004; 5: S1–S4.
33. Baldasseroni S, Opasich C, Gorini M et al. Left bundle branch block is associated with increased 1-year sudden and total mortality rate in 5,517 outpatients with congestive heart failure: a report from the Italian network on congestive heart failure. Am Heart J 2002; 143 : 398–405.
34. Leclercq C, Walker S, Linde C et al. Comparative effects of permanent biventricular and right-univentricular pacing in heart failure patients with chronic atrial fibrillation. Eur Heart J 2002; 23 : 1780–1787.
35. Gasparini M, Auricchio A, Regoli F et al. Four-year efficacy of cardiac resynchronization therapy on exercise tolerance and disease progression: the importance of performing atrioventricular junction ablation in patients with atrial fibrillation. J Am Coll Cardiol 2006; 48 : 734–743.
36. Wilkoff BL, Cook JR, Epstein AE et al. Dual-chamber or ventricular backup pacing in patients with an implantable defibrillator: the dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 2002; 288 : 3115–3123.
37. Sweeney MO, Hellkamp AS, Ellenbogen KA et al. Adverse effect of ventricular pacing in heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation 2003; 107 : 2932–2937.
38. Leclercq C, Cazeau S, Lellouche D et al. Upgrading from single chamber right ventricular to biventricular pacing in permanently paced patients with worsening heart failure: the RD-CHF study. Pacing Clin Electrophysiol 2007; 30: S23–S30.
39. Fantoni C, Kawabata M, Massaro R et al. Right and left ventricular activation sequence in patients with heart failure and right bundle branch block: a detailed analysis using three-dimensional non‑fluoroscopic electroanatomic mapping system. J Cardiovasc Electrophysiol 2005; 16 : 112–120.
40. Linde C, Abraham WT, Gold MR et al. Randomized Trial of Cardiac Resynchronization in Mildly Symptomatic Heart Failure Patients and in Asymptomatic Patients With Left Ventricular Dysfunction and Previous Heart Failure Symptoms. J Am Coll Cardiol 2008; 52 : 1834–1843.
41. Epstein EA, DiMarco JP, Ellenbogen KA et al. ACC/AHA/HRS 2008 Guidelines for device‑based therapy of cardiac rhythm abnormalities: Executive summary. J Am Coll Cardiol 2008; 51 : 2085–2105.
42. Zipes DP, Camm AJ, Borggrefe M et al. ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Circulation 2006; 114: e385–e484.
43. Moss AJ, Hall WJ, Cannom DS et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. N Engl Med 1996; 335 : 1933–1940.
44. Buxton AE, Lee KL, Fisher JD et al for the Multicenter Unsustained Tachycardia Trial Investigators. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med 1999; 341 : 1882–1890.
45. Moss AJ, Zareba W, Hall JW et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346 : 877–883.
46. Bardy GH, Lee KL, Mark DB et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators: Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005; 352 : 225–237.
47. Kadish A, Dyer A, Daubert JP et al. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004; 350 : 2151–2158.
48. Strickberger SA, Hummel JD, Bartlett TG et al. Amiodarone versus implantable cardioverter-defibrillator: randomized trial in patients with non‑ischemic dilated cardiomyopathy and asymptomatic non‑sustained ventricular tachycardia – AMIOVIRT. J Am Coll Cardiol 2003; 41 : 1707–1712.
49. Bänsch D, Antz M, Boczor S et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation 2002; 105 : 1453–1458.
50. Auricchio A, Metra M, Gasparini M et al for the Multicenter Longitudinal Observational Study (MILOS) Group. Long‑term survival of patients with heart failure and ventricular conduction delay treated with cardiac resynchronization therapy. Am J Cardiol 2007; 99 : 232–238.
51. Yao G, Freemantle N, Calvert MJ et al. The long‑term cost‑effectiveness of cardiac resynchronisation therapy with or without an implantable cardioverter-defibrillator. Eur Heart J 2007; 28 : 42–51.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2009 Issue 1-
All articles in this issue
- Chirurgická léčba fibrilace síní
- Ischemicko-reperfuzní poškození po srdeční zástavě a protektivní účinky hypotermie
- Máme v roce 2009 dostatek důkazů o tom, zda nemocným indikovaným k srdeční resynchronizační léčbě implantovat biventrikulární kardiostimulátor nebo kardioverter-defibrilátor?
- Současný stav srdeční resynchronizační léčby u nemocných se srdečním selháním
- Chronologie akutního koronárního syndromu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ischemicko-reperfuzní poškození po srdeční zástavě a protektivní účinky hypotermie
- Chirurgická léčba fibrilace síní
- Současný stav srdeční resynchronizační léčby u nemocných se srdečním selháním
- Máme v roce 2009 dostatek důkazů o tom, zda nemocným indikovaným k srdeční resynchronizační léčbě implantovat biventrikulární kardiostimulátor nebo kardioverter-defibrilátor?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

