-
Medical journals
- Career
Podání bolusu 500 ml fyziologického roztoku nevede k bezprostřednímu poškození endoteliální glykokalyx stanovitelnému hodnocením sublingvální mikrocirkulace
: J. Pouska 1,2; D. Astapenko 3,4; V. Tégl 1,2,5; J. Beneš 1,2,5; V. Černý 3,4,6-9
: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Plzeň 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta v Plzni, Univerzita Karlova 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové 3; Lékařská fakulta v Hradci Králové, Univerzita Karlova 4; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 5; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně, Masarykova nemocnice, Ústí nad Labem 6; Institut postgraduálního vzdělávání ve zdravotnictví 7; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 8; Dept. of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Kanada 9
: Anest. intenziv. Med., 29, 2018, č. 6, s. 322-327
:
Cíl studie:
Zhodnocení podání 500 ml fyziologického roztoku zdravým dobrovolníkům na alteraci endoteliální glykokalyx pomocí perfused boundary region (PBR) parametru.
Hypotéza:
Podání 500 ml fyziologického roztoku vede k signifikantnímu poškození endoteliální glykokalyx.
Typ studie:
Nerandomizovaná prospektivní dvojcentrická.
Typ pracoviště:
JIP fakultní nemocnice.
Materiál a metoda:
Soubor tvořila skupina 12 zdravých dobrovolníků bez akutního onemocnění. Každému dobrovolníkovi byla podána infuze 500 ml fyziologického roztoku (FR). Před podáním a po podání infuze byla zaznamenána základní hemodynamická data a stanoven perfused boundary region (PBR) parametr jako marker integrity endoteliální glykokalyx. Hodnoty před podáním a po podání tekutiny byly vyhodnoceny párovým t-testem s hladinou významnosti 0,05.
Výsledky:
Podání 500 ml fyziologického roztoku nevedlo ke statisticky signifikantnímu zvýšení hodnoty PBR (2,00 ± 0,21 vs. 2,21 ± 0,36, p = 0,089). Z hlediska makrohemodynamiky došlo k signifikantnímu snížení tepové frekvence.
Závěr:
Naše studie nevedla k průkazu poškození EG stanovitelnému hodnocením PBR parametru bezprostředně po podání tekutinového bolusu 500 ml FR u zdravých dobrovolníků. Z hlediska makrohemodynamiky vedlo podání infuzního roztoku k signifikantnímu snížení tepové frekvence, jiné změny nebyly pozorovány.
klíčová slova
mikrocirkulace – intravenózní infuze – endoteliální glykokalyx
ÚVOD
Endoteliální glykokalyx (EG) je tenká jemná struktura tvořená makromolekulami různého biochemického charakteru a biologické povahy na povrchu endotelu. V posledních letech je uváděn její zásadní podíl na fyziologické regulaci endoteliálních funkcí, jako je aktivní polopropustný charakter membrány (známo též jako revidovaný Starlingův princip) nebo součinnost (ať už humorální, receptorová či mechanická) s koagulačním a imunitním systémem [1, 2]. V současné době je popsáno mnoho patologických nox, které mají potenciál EG poškozovat. Tento fakt pravděpodobně hraje důležitou, ne-li klíčovou roli pro patofyziologii mnoha stavů projevujících se orgánovou dysfunkcí na úrovni mikrocirkulace (např. sepse, anestezie, ischemicko-reperfuzní poškození aj.) [3]. V současné době je snaha tyto noxy vyhledávat, definovat a snažit se kvantifikovat míru jejich působení na EG. Na základě literárních údajů z posledních let a z našich předchozích prací je možné se domnívat, že jednou z těchto nox potenciálně poškozujících integritu EG může být intravenózní podání tekutin, jež má své nežádoucí účinky podobně jako podání jakýchkoli jiných farmak [4]. Otázka správné indikace a výběru infuzního roztoku i s ohledem na interakci s mikrocirkulací je vysoce aktuální. Změny koncentrace sodíku v krevní plazmě (hypernatremie) vedou po navázání Na+ iontů do struktury EG k narušení makromolekul heparansulfátu, a tím ke ztenčení a malfunkci EG po podání takového roztoku [5]. V literatuře je popsáno, že rychlá intravenózní infuze náhradního roztoku způsobující byť krátkodobou hypervolemii vede k degradaci EG – uváděnými mechanismy jsou ischemicko-reperfuzní poškození, mechanické namáhání endoteliálních buněk kapilár a zvýšená produkce atriálního natriuretického peptidu (ANP), který EG degraduje [6]. Vzhledem k výše uvedenému by mělo být možné po podání rychlé infuze fyziologického roztoku (FR) zjistit a kvantifikovat poškození EG těmito mechanismy.
V současné době je několik způsobů, jak hodnotit integritu EG [7]. V reálném čase jde o metody založené na intravitální mikroskopii – v humánní fyziologii měření sublingvální cirkulace – metodou side-stream dark field imaging (SDF). Naše pracoviště užívají tuto metodu v kombinaci s automatickým zhodnocením pomocí softwaru GlykoCheck (GlykoCheck, Maastricht, Nizozemsko). Hlavním parametrem hodnocení je hodnota perfused boundary region (PBR). Cílem naší práce bylo zhodnotit vliv intravenózně podané infuze na EG. Hypotézou naší práce bylo, že rychlé podání 500 mililitrů FR povede ke změně hodnoty PBR u zdravých dobrovolníků.
SOUBOR A METODY
Naše prospektivní nerandomizovaná studie probíhala ve dvou fakultních nemocnicích (FN): FN Hradec Králové a FN Plzeň, po souhlasném vyjádření etické komise. Kohortu tvořili zdraví dospělí dobrovolníci (muži a ženy), kteří podepsali informovaný souhlas se studií. Vyřazovací kritéria byla: přítomnost systémového nebo jiného chronického onemocnění, požití jakékoli systémové medikace 72 hodin před provedením studie, nadměrný fyzický nebo psychický stres nejméně 48 hodin před provedením studie, kouření a akutní onemocnění.
Dobrovolníkům byla zavedená intravenózní kanyla o kalibru 20 G (B. Braun, Melsungen, Německo) na horní končetině (strana dle preference dobrovolníka) a maximální rychlostí byla bolusově podána 500ml infuze fyziologického roztoku (NaCl 0,9%, B. Braun, Melsungen, Německo) o pokojové teplotě za použití přetlakové manžety s tlakem 300 mmHg. Před podáním infuze (čas T1) byla odebrána základní demografická data, změřen neinvazivní krevní tlak, pulz a natočen záznam sublingvální mikrocirkulace pro automatizované stanovení parametru PBR. Hodnota tlaku a pulzu a záznam mikrocirkulace byly provedeny v čase T2 bezprostředně po ukončení podávání infuze.
Vyhodnocení parametru PBR bylo automatické za použití software GlykoCheck (GlykoCheck, Maastricht, Nizozemsko) [8]. Záznam sublingvální mikrocirkulace byl pořízen plně podle navigace programu. KK kamera (Research Technology Limited, Alliance Court, Honiton, Velká Británie) fungující na principu SDF imaging byla přiložena volně pod jazyk dobrovolníka a po stabilizaci obrazu, optimální intenzitě a zaostření začal automaticky záznam, který byl ukončen po uložení nejméně 3 000 kapilárních segmentů o délce 10 mm a průměru 5–25 mm (obr. 1). Program dále automaticky vypočítal průměr středního proudu erytrocytů v kapilárních segmentech a jejich rozptyl odečtením průměru kapiláry od průměrné hodnoty středového sloupce erytrocytů. Výsledný numerický údaj v mm představuje PBR, tedy perfundovanou hraniční zónu, a udává míru penetrace erytrocytů do EG. Čím je vyšší, tím se více erytrocyty přibližují endoteliálním buňkám, což demonstruje ztenčení vrstvy EG. Pro zhodnocení PBR v každém časovém bodě byl použit průměr vždy dvou měření z každé strany jazyka.
1. Vyhodnocování parametru PBR programem GlycoCheck. Červené linky znázorňují cévy o průměru 5–25 mm, zelené linky oddělují hodnocené vaskulární segmenty, žluté linky oddělují neplatné segmenty. (Autor: MUDr. David Astapenko) 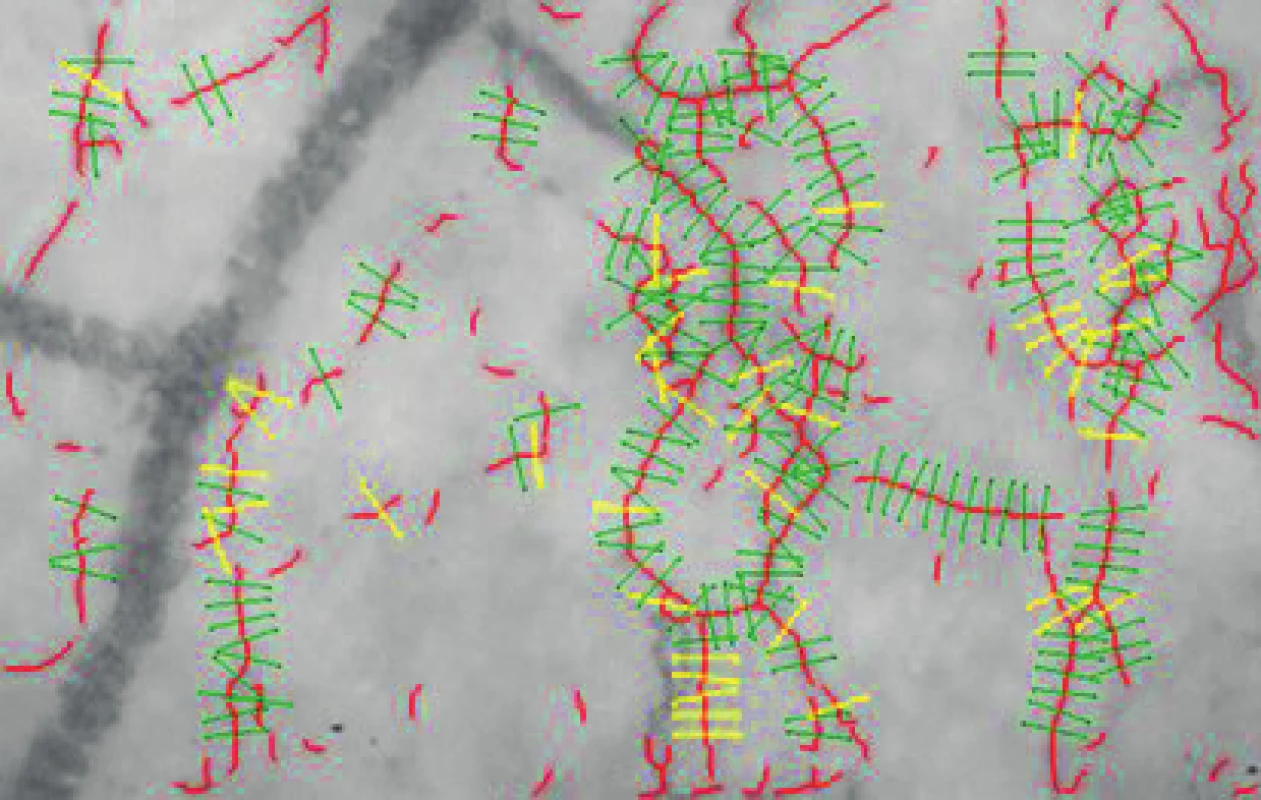
Pro statistické zhodnocení dat byl použit program Graph Pad Prism 6.0 (GraphPad Software, Inc., CA, USA). Velikost souboru byla kalkulována na 12 dobrovolníků (síla testu 0,9; rozdíl mezi měřeními 0,5 jednotky; směrodatná odchylka 0,22; hladina významnosti 0,05). Normalita dat byla hodnocena D’Agostinovým a Pearsonovým omnibus testem. Výsledky po zprůměrování hodnot obou měření byly vyhodnoceny párovým t-testem na hladině významnosti testu 0,05.
VÝSLEDKY
Do studie bylo zařazeno celkem dvanáct dobrovolníků splňujících vstupní kritéria. Průměrný věk dobrovolníků byl 34 let (28‒64), bylo zastoupeno celkem 9 mužů (75 %) a 3 ženy (25 %). Každému dobrovolníkovi byl podán právě jeden tekutinový bolus 500 ml FR1/1 pokojové teploty přetlakovou infuzí do žilní kanyly zavedené na paži. Doba infuze nepřesáhla v žádném z případů 10 minut. Každému dobrovolníkovi byla stanovena hodnota PBR 2× v každém časovém bodě, všechna měření byla úspěšná. Podání bolusu FR nevedlo k signifikantnímu zvýšení hodnoty PBR ihned po podání tekutinového bolusu (2,00 ± 0,21 vs. 2,21 ± 0,36, p = 0,089, obr. 2). Po podání tekutinového bolusu se signifikantně snížila srdeční frekvence (74 ± 10 vs. 68 ± 10, p = 0,003). V případě měření neinvazivního arteriálního tlaku nebyl zaznamenán signifikantní rozdíl v hodnotách před podáním a po podání tekutinového bolusu (tab. 1).
1. PBR a oběhové parametry před podáním bolusu 500 ml FR1/1 a po něm 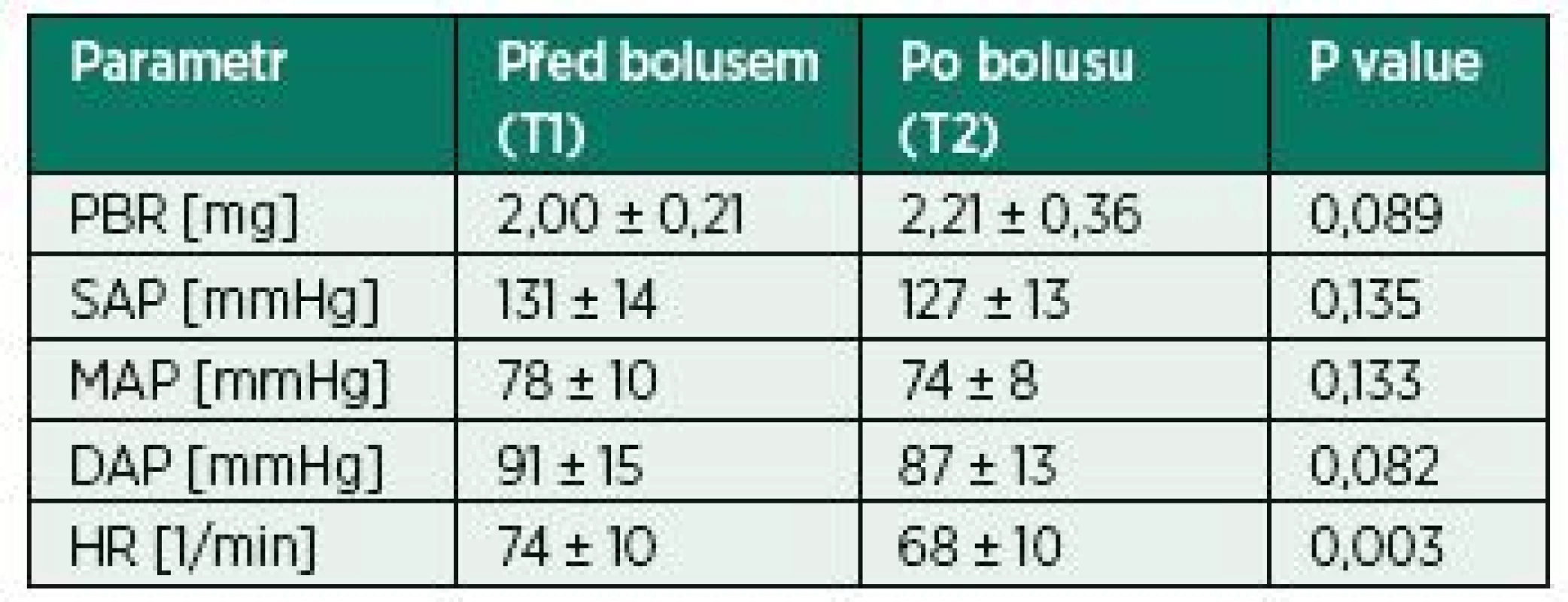
PBR – perfused boundary region, SAP – systolický arteriální tlak, MAP – střední arteriální tlak, DAP – diastolický arteriální tlak, HR – tepová frekvence 2. PBR hodnoty před podáním a po podání tekutiny PBR – perfused boundary region 
DISKUSE
Na vzorku zdravých dobrovolníků v naší studii se nepodařilo prokázat, že rychlé podání tekutinového bolusu vede k signifikantnímu zvýšení hodnoty PBR jako markeru ztenčení, a tedy poškození EG. S ohledem na různorodost údajů o optimální rychlosti podání tekutinového bolusu [9] a zároveň ne zcela jasnému významu rychlosti podání tekutiny na poškození EG jsme se v experimentu rozhodli pro maximální rychlost podání tekutiny (tj. 60 ml/min při užití kanyly G20), která byla limitována pouze průměrem použité nitrožilní kanyly. U všech pozorovaných objektů byl čas podání nižší než deset minut, ačkoli v klinické praxi se uvádí průměrná doba podání 500 ml krystaloidu 24 minut [9]. Nelze zobecnit, jestli by byl pozorovaný efekt podání tekutinového bolusu zesílen či zeslaben při volbě jiné rychlosti podání bolusu [4]. Ukor et al. [10] prokázali, že podání 1 l fyziologického roztoku za 30 minut oproti 120 minutám vede k méně stabilní makrohemodynamické odpovědi, což by mohlo do jisté míry ukazovat na dynamičtější patofyziologické změny rychlejšího podání roztoku.
Z hlediska patofyziologie je možné předpokládat několik mechanismů, které by měly vést ke změně tloušťky EG po podání intravenózní tekutiny. Po podání tekutinového bolusu může dojít ke krátkodobému zvýšení srdečního výdeje na základě Frankova-Starlingova mechanismu, toto zvýšení průtoku může vést v mikrocirkulaci k recruitmentu dosud neperfundovaných kapilár, a tím k lokální reperfuzi. Poškození EG reperfuzí je dobře popsáno v literatuře [11]. Dalším vysvětlením by mohlo být zvýšení srdečního výdeje, a tím zvýšení krevního tlaku na prekapilárním konci kapilárního řečiště, čímž dochází ke zvýšení mechanického namáhání (shear stress) kapiláry a následně k jejímu poškození [12]. Roli také může mít případné uvolnění atriální natriuretického peptidu (ANP) při tranzientní hypervolemii. Ačkoli mechanismus degradace EG působením ANP není zcela jasný, byl v literatuře dobře zdokumentován [6]. Na základě mnoha prací lze tvrdit, že podání intravaskulární tekutiny má vliv na EG [13]. Puskarich et al. [14] zdokumentovali poškození EG po podání tekutiny na základě měření hladiny syndecanu-1, a to přestože stanovení dostupných humorálních markerů poškození EG není zcela specifické pro poškození EG a může být falešně pozitivní v některých situacích (trauma, zánět) [3]. Bohužel není v žádném z těchto patofyziologických konceptů znám přesný časový průběh od počátku působení patologické noxy k detekovatelnému poškození EG případně k poškození EG jinak kvantifikovatelnému (např. maximálnímu). Biochemický proces degradace je pravděpodobně dynamický, a tudíž zachytitelný až po delším čase působení noxy, když se degradace EG dostane na rozlišovací schopnost metody. Bohužel, hodnocení s větším časovým odstupem nebylo v naší práci prováděno.
V současné době je ve většině klinických situací preferováno podání balancovaných roztoků před roztokem 0,9% NaCl, tradičně pojmenovaným jako fyziologický. Aktuálně byla publikována multicentrická SMART trial, kde Self et al.[15] na velkém počtu pacientů (n > 13 000) prokázali kladný efekt podání balancovaných roztoků oproti FR na výsledek léčby. McCluskey et al. [16] prokázali, že kumulativní vyšší hladina chloridů při podání FR perioperačně (autoři uvádějí termín „akutní postoperační hyperchloridemie“) vede u pacientů ke zhoršenému výsledku, přičemž velikost hyperchloridemie je úměrná tomuto zhoršení. Nicméně v některých klinických situacích je podání FR racionální – např. u traumatu mozku s potřebou podání vysoceosmolárních náhrad, případně v situaci hypochloremické alkalózy. O poškození EG vlivem hyperchloridemie nejsou přímé důkazy. Podání většího množství FR vede ovšem také k tranzientní nebo kumulativní hypernatremii. Kusche-Vihrog et al. [17] ukazují biochemickou molekulární podstatu poškození endotelu vysokými dávkami NaCl. EG ze své biochemické podstaty složení funguje jako efektivní pufr Na+ iontů – tyto jsou přitahovány negativními náboji makromolekul EG a akumulovány v síťovité struktuře EG. Při expozici významnému množství Na+ tato pufrovací schopnost nestačí, což vede ke konformačním změnám negativně nabitých reziduí heparansulfátu v EG. Změna komformace makrokomolekul způsobuje insuficienci biosignálních drah na povrchu endotelu s jeho dalším poškozením [5]. Bolus právě fyziologického roztoku tedy měl hypoteticky simulovat poškození EG jak tranzientní hypervolemií, tak hypernatremií, nicméně množství podaného roztoku bylo oproti zmíněným pracím pravděpodobně příliš malé, aby došlo k významným změnám ve struktuře EG.
Jako metodu stanovení poškození EG jsme v experimentu stanovovali hodnotu PBR v sublingvální mikrocirkulaci, jejíž změny odrážejí změny tloušťky EG [8, 18]. Výhodou byla snadnost manipulace s měřicím zařízením, možnost provést měření bezprostředně po podání tekutinového bolusu, její neinvazivita a reprodukovatelnost bez interindividuální variability dané lidským faktorem na kvalitu měření. K limitům práce patří fakt, že stanovení PBR bylo jedinou metodou užitou ke stanovení poškození GCX. Ke komplexnějšímu posouzení alterace EG by bylo třeba použít některou z dalších metod souběžně (např. hladinu degradačních produktů EG či elektronmikroskopické vyšetření EG erytrocytů). PBR hodnota stanovuje míru penetrace erytrocytů ze středu kapiláry směrem k endoteliálním buňkám. Poškození EG různorodými vlivy tuto odchylku pohybu erytrocytů zvětšuje, při nepřítomnosti nebo ztenčení (angl. sheding) vrstvy makromolekul EG se erytrocyty při průchodu kapilárou dostávají blíže k vlastnímu povrchu endoteliální buňky, vzdalují se v průměru více od proudu ve středu lumen kapiláry a narůstá tak hodnota PBR. Nutno ovšem uvést, že tato hodnota je zcela automaticky vypočtena na základě softwarového zpracování obrazu získaného mikroskopickou kamerou. V současné době toto zcela automatické zpracování není všeobecně přijato a zdá se, že v některých situacích může přinášet kontroverzní výsledky.
Podle současných evropských doporučení je softwarová analýza EG „slibná“, ačkoli je třeba ji „validovat v klinické praxi“ a z tohoto důvodu nemůže být zatím klinicky přijata [19]. Stanovení morfologie mikrocirkulace výhradně v sublingvální oblasti je dnes v humánní medicíně bráno jako dostatečné k zobecněné představě o morfologii EG ve většině tkání. V principu by bylo možné stanovit integritu EG během experimentu jinými metodami (např. hodnocením mikroskopického obrazu podle skóre podle De Backera nebo MFI indexem, stanovením humorálních markerů degradace EG z krve – viz výše), ale s ohledem na současnou dostupnost a proveditelnost těchto metod bylo pro naše účely stanovení hodnoty PBR vhodnější. Lze uvést, že zlatý standard stanovení integrity a funkce EG nebyl dosud jasně definován.
Ačkoli při stanovování PBR jde o softwarové zpracování obrazu a nejsme si vědomi faktu, že by bylo možné toto zpracování examinátorem ovlivnit, studie nebyla randomizována ani zaslepena. Dobrovolníci byli instruováni před experimentem dodržet míru „běžné“ hydratace, ačkoli tato nebyla přímo definována. Byli žádáni, aby se v předchozích 48 hodinách před měřením vyvarovali zvýšené námahy a stresu, což je do jisté míry subjektivní. Další limitací práce byl fakt, že nebyla měřena kontrolní skupina, ačkoli je prakticky nereálné očekávat bias vedoucí k „samovolnému“ zlepšení EG během pokusu, které by falešně snižovalo význam intervence v poškození EG.
ZÁVĚR
V naší studii jsme neprokázali poškození EG stanovitelné hodnocením PBR parametru sublingvální mikrocirkulace bezprostředně po podání tekutinového bolusu FR 500 ml v co nejkratším možném čase u skupiny dvanácti zdravých dobrovolníků. Z hlediska makrohemodynamiky vedlo podání infuzního roztoku k signifikantnímu snížení tepové frekvence, jiné změny nebyly pozorovány. Ačkoli jsme nebyli v našem experimentu schopni zaznamenat významnou změnu tloušťky PBR, a tedy poškození EG u zdravých dobrovolníků, nelze zcela vyloučit, že k těmto změnám nemůže dojít při expozici většímu množství intravenózních tekutin na bázi fyziologického roztoku nebo v delším časovém okně.
SEZNAM ZKRATEK
EG – endoteliální glykokalyx
ANP – atriální natriuretický peptid
SDF – sidestream dark-field
FR – fyziologický roztok
PBR – perfused boundary region
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Projednání etickou komisí: Etická komise FN Hradec Králové.
Financování: Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-31881A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce došlo dne 23. 7. 2018.
Do tisku přijato dne 1. 11. 2018.
Adresa pro korespondenci:
MUDr. Jiří Pouska
Sources
1. Jacob M, Chappell D. Reappraising Starling: The physiology of the microcirculation. Curr Opin Crit Care. 2013;19 : 282–289. doi:10.1097/MCC.0b013e3283632d5e.
2. Cerny V, Astapenko D, Brettner F, et al. Targeting the endothelial glycocalyx in acute critical illness as a challenge for clinical and laboratory medicine. Crit Rev Clin Lab Sci. 2017;54 : 343–357. doi:10.1080/10408363.2017.1379943.
3. Murphy LS, Wickersham N, McNeil JB, et al. Endothelial glycocalyx degradation is more severe in patients with non-pulmonary sepsis compared to pulmonary sepsis and associates with risk of ARDS and other organ dysfunction. Ann Intensive Care. 2017;7 : 102. doi:10.1186/s13613-017-0325-y.
4. Vincent JL, Weil MH. Fluid challenge revisited. Crit Care Med. 2006;34 : 1333–1337. doi:10.1097/01.CCM.0000214677.76535.A5.
5. Oberleithner H, Peters W, Kusche-Vihrog K, et al. Salt overload damages the glycocalyx sodium barrier of vascular endothelium. Pflugers Arch Eur J Physiol. 2011;462 : 519–528. doi:10.1007/s00424-011-0999-1.
6. Chappell D, Bruegger D, Potzel J, et al. Hypervolemia increases release of atrial natriuretic peptide and shedding of the endothelial glycocalyx. Crit Care. 2014;18 : 1–8. doi:10.1186/s13054-014-0538-5.
7. Cerny V, Astapenko D, Burkovskiy I, et al. Glycocalyx in vivo measurement. Jünger M, Krüger-Genge A, Jung F, eds. Clin Hemorheol Microcirc. 2017;67 : 1–5. doi:10.3233/CH-179235.
8. Lee DH, Dane MJC, Van Den Berg BM, et al. Deeper penetration of erythrocytes into the endothelial glycocalyx is associated with impaired microvascular perfusion. PLoS One. 2014;9 : 1–8. doi:10.1371/journal.pone.0096477.
9. Cecconi M, Hofer C, Teboul JL, et al. Fluid challenges in intensive care: the FENICE study: A global inception cohort study. Intensive Care Med. 2015;41 : 1529–1537. doi:10.1007/s00134-015-3850-x.
10. Ukor IF, Hilton AK, Bailey MJ, Bellomo R. The haemodynamic effects of bolus versus slower infusion of intravenous crystalloid in healthy volunteers. J Crit Care. 2017;41 : 254–259. doi:10.1016/j.jcrc.2017.05.036.
11. Rehm M, Bruegger D, Christ F, et al. Shedding of the endothelial glycocalyx in patients undergoing major vascular surgery with global and regional ischemia. Circulation. 2007;116 : 1896–1906. doi:10.1161/CIRCULATIONAHA.106.684852.
12. Zeng Y, Tarbell JM. The adaptive remodeling of endothelial glycocalyx in response to fluid shear stress. Vinci MC, ed. PLoS One. 2014;9:e86249. doi:10.1371/journal.pone.0086249.
13. Powell M, Mathru M, Brandon A, et al. Assessment of endothelial glycocalyx disruption in term parturients receiving a fluid bolus before spinal anesthesia: a prospective observational study. Int J Obstet Anesth. 2014;23 : 330–334. doi:10.1016/j.ijoa.2014.06.001.
14. Puskarich MA, Cornelius DC, Tharp J, et al. Plasma syndecan-1 levels identify a cohort of patients with severe sepsis at high risk for intubation after large-volume intravenous fluid resuscitation. J Crit Care. 2016;36 : 125–129. doi:10.1016/j.jcrc.2016.06.027.
15. Self WH, Semler MW, Wanderer JP, et al. Balanced Crystalloids versus Saline in Noncritically Ill Adults. N Engl J Med. 2018;378 : 819–828. doi:10.1056/NEJMoa1711586.
16. Mccluskey SA, Karkouti K, Wijeysundera D, et al. Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: A propensity-matched cohort study. Anesth Analg. 2013;117 : 412–421. doi:10.1213/ANE.0b013e318293d81e.
17. Kusche-Vihrog K, Schmitz B, Brand E. Salt controls endothelial and vascular phenotype. Pflugers Arch Eur J Physiol. 2015;467 : 499–512. doi:10.1007/s00424-014-1657-1.
18. Vlahu CA, Lemkes BA, Struijk DG, et al. Damage of the Endothelial Glycocalyx in Dialysis Patients. J Am Soc Nephrol. 2012;23 : 1900–1908. doi:10.1681/ASN.2011121181.
19. Ince C, Boerma EC, Cecconi M, et al. Second consensus on the assessment of sublingual microcirculation in critically ill patients: results from a task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2018 : 1–19. doi:10.1007/s00134-018-5070-7.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2018 Issue 6-
All articles in this issue
- ERAS in a Czech hospital – Utopia or Reality?
- Administration of 500 ml of normal saline does not result in immediate damage to the endothelial glycocalyx determinable by sublingual microcirculation assessment
- Specifics of anaesthesia and intensive care in organ transplant patients
- Emergency medicine ultrasound curriculum for emergency medicine physicians
- Hypothermia in the operating theatre in paediatric patients: A prospective, monocentric, observational study
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ERAS in a Czech hospital – Utopia or Reality?
- Specifics of anaesthesia and intensive care in organ transplant patients
- Emergency medicine ultrasound curriculum for emergency medicine physicians
- Administration of 500 ml of normal saline does not result in immediate damage to the endothelial glycocalyx determinable by sublingual microcirculation assessment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

