-
Medical journals
- Career
Současné postavení kortikoidů v regionální anestezii a analgezii
Authors: J. Lejčko 1; T. Gabrhelík 2,3
Authors‘ workplace: Centrum pro léčbu bolesti, Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Univerzita Karlova 1; Oddělení anesteziologie, resuscitace a intenzivní medicíny, Krajská nemocnice Tomáše Bati, a. s. 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého v Olomouci 3
Published in: Anest. intenziv. Med., 29, 2018, č. 3, s. 151-157
Category: Review Article
Overview
Kvalitní pooperační analgezie významně přispívá k optimálnímu výsledku chirurgické léčby.
Ve snaze zvýšit a prodloužit účinek lokálních anestetik u jednorázových periferních blokád byla studována řada pomocných látek. Ukazuje se, že perineurální aplikace kortikoidů prodlužuje trvání analgezie a přináší i další benefit – snížení spotřeby opioidů a nižší výskyt nauzey. Nejvíce dat v této indikaci je o dexamethasonu. Perineurální aplikace kortikoidů však patří v Evropě i v USA do kategorie „off label“.
Spinální epidurální aplikace kortikoidů je v současné době nejrozšířenějším postupem v oblasti intervenční léčby bolestí zad. Je to účinná intervenční technika v léčbě bolestí především u hernie disku, radikulární bolesti a u spinální stenózy. Délka účinku je krátká až střednědobá. Výhodou je cílená aplikace steroidu ke strukturám, jež generují bolest. Pro dobrý efekt léčby je naprosto zásadní správný výběr pacientů a načasování léčby. Závažné nežádoucí účinky epidurální injekce kortikoidů jsou sice raritní, avšak mohou být fatální. Proto se důrazně doporučuje respektovat zásady bezpečné spinální aplikace. Ve snaze vyhnout se komplikacím intervence volíme aplikaci nepartikulárních steroidů s podáním testovací dávky. Jakákoliv spinální aplikace steroidů by měla být navigována zobrazovacími metodami v reálném čase.
klíčová slova:
perineurální aplikace kortikoidu – dexamethason − spinální aplikace − bolesti zad – bezpečnost − zobrazovací metody
ÚVOD
Muskuloskeletální bolesti se zánětlivou složkou jsou nejčastějším akutním i chronickým bolestivým syndromem. Zahrnují především poúrazové stavy, degenerativní nemoci pohybového aparátu i typicky civilizační příčiny bolestí zad. Obecným kauzálním faktorem zvyšující se prevalence vertebrogenních bolestí je změna životního stylu s deficitem fyzických aktivit. U mladé populace dominují funkční poruchy a posttraumatické bolesti, s narůstajícím věkem nastupují degenerativní změny struktur páteře zasahující intervertebrální disk, zygapofyzeální (facetové) klouby, obratlová těla, měkké tkáně. Tyto změny mohou vést k radikulární bolesti (nemá jen mechanickou příčinu), diskogenní a facetové bolesti, k posttraumatickým bolestem končetin a často ke smíšené multifaktoriální bolesti. Relativně časté a špatně terapeuticky ovlivnitelné jsou bolesti zad po operacích páteře (FBSS – failed back surgery syndrome).
Léčebný postup, včetně chirurgické léčby, který by zaručoval s vysokou pravděpodobností dlouhodobou úlevu od bolestí zad, kloubů nebo svalových úponů, neexistuje. Lokální injekce kortikoidů k úponům a do oblasti zánětu je využívaná řadou oborů již od 50. let minulého století. Přesto se jedná spíše o empirickou léčbu s řadou rizik bez jednoznačného důkazu jejich účinku dle Evidence Based Medicine (EBM). Aplikace kortikoidu jako adjuvantní látky k lokálnímu anestetiku u periferních blokád je v posledních letech podrobena intenzivnímu studiu. Řada prací prokázala, že dexamethason modifikuje senzitivní i motorickou blokádu, čehož se s výhodou využívá především u posttraumatických stavů a během rehabilitace. Intratékální aplikace kortikoidů se v této indikaci nepoužívá, avšak epidurální aplikace kortikoidů (EAK) je jednou z možných intervenčních technik, která může sehrát významnou roli v léčebném algoritmu bolestí zad. EAK poprvé popsal Lievre v léčbě bolestí bederní páteře a kořenových bolestí [1]. Tato intervence je v současné době nejrozšířenějším postupem v oblasti intervenční léčby bolestí zad a její četnost v posledních letech výrazně roste. Přestože důkaz účinnosti EAK není jednoznačný, jeho oblibu zvyšuje možnost aplikace přímo k místu poškození a zánětlivé reakce. Délka efektu je udávána v rozmezí několika týdnů až jednoho roku [2]. V úvahu je však nutno vzít i nežádoucí účinky EAK, jež mohou mít někdy i tragické důsledky.
MECHANISMUS ÚČINKU KORTIKOIDŮ
Pro analgetický efekt kortikoidů je podstatný jejich antiflogistický účinek. Ukazuje se, že intraspinální zánětlivá reakce je hlavní příčinou radikulární bolesti při herniaci intervertebrálního disku (ID). Nucleus pulposus obsahuje prozánětlivý mediátor fosfolipázu A2 (FLA2) uvolňující se při degeneraci anulus fibrosus zevně z ID do epidurálního prostoru. Působením FLA2 na kyselinu arachidonovou se spouští kaskáda lokální zánětlivé reakce, v níž se uplatňují prostaglandiny, leukotrieny a další cytokiny. Neuropeptidy jako calcitonin gene related peptid a substance P, obsažené ve spinálním gangliu a okolní nervové tkáni, dále zesilují místní zánětlivou odpověď. Kortikoidy inhibují FLA2, blokují syntézu prostaglandinů a dalších proinflamatorních molekul. Po aplikaci kortikoidů se obecně uplatňuje stabilizace membrány hyperexcitovaných nervových struktur. Přínosný je i jejich výsledný antiedematózní účinek. Podstatné je, že po lokální aplikaci kortikoidu (aplikace perineurální, intraspinální) je dosaženo vysoké koncentrace kortikoidu v místě patologického zánětlivého procesu, a to nezávisle na lokálním krevním průtoku. Kortikoidy je možno aplikovat samotné nebo v kombinaci s lokálním anestetikem (LA) a opioidem. Nejužívanějším LA je bupivakain ve výsledné koncentraci 0,1 % až 0,25 %. V některých případech, zejména u akutního a subakutního lumboischialgického syndromu, který je vyvolán hernií ID a je spojen s vysokou intenzitou bolesti, má smysl i aplikace opioidu. Pro cílenou aplikaci je nejvhodnější potentní lipofilní opioid sufentanil.
Jednotlivé kortikoidy se liší svou protizánětlivou potencí. Nejsilnější protizánětlivý efekt má dexamethason. Rozdílná je také délka efektu kortikosteroidů. Krátkodobý účinek mají hydrokortison a kortison (řádově hodiny), dlouhodobý pak betamethason a dexamethason (týdny). Ostatní kortikoidy mají střední dobu účinku (tab. 1).
Table 1. Kortikosteroidy – protizánětlivý efekt a délka účinku 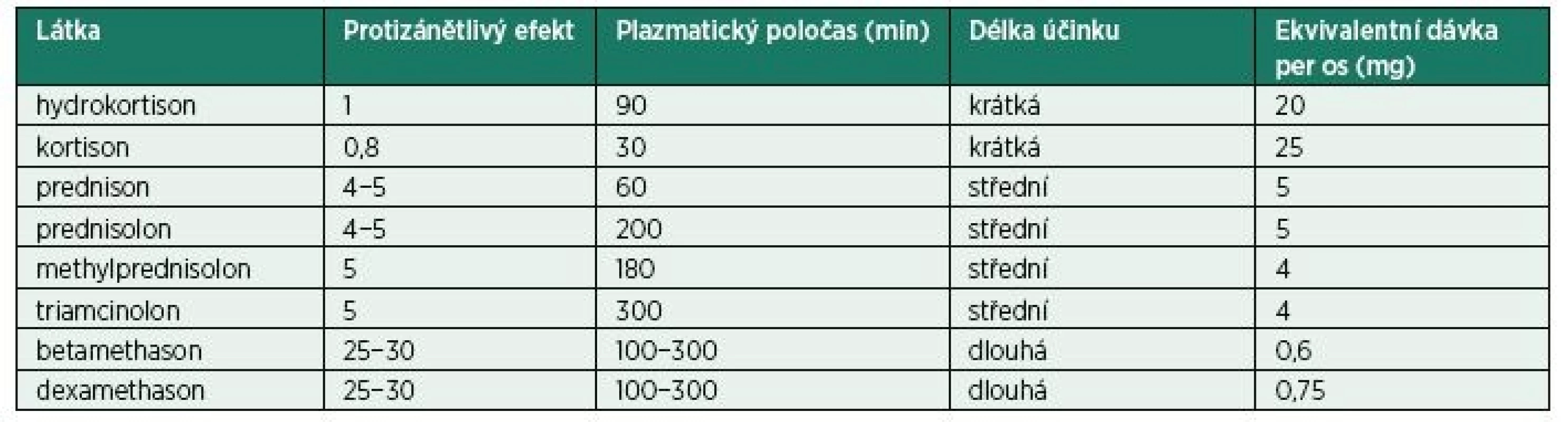
Kortikoidy je možno rozdělit podle mikroskopické velikosti jejich částic v jednotlivých steroidních přípravcích na „nepartikulární“ a „partikulární“. Nepartikulární kortikoidy (dexamethason) jsou solubilní s částicemi vzhledu transparentních tyčí menšími než 5 µm a mají nízkou tendenci k agregaci. Částice partikulárních kortikoidů (methylprednisolon, triamcinolon, betamethason) jsou větší, amorfní, neprůhledné a agregují do shluků větších než 100 µm. Částice větší než 5 µm mohou okludovat kapiláry (5–8 µm), metaarterioly (20–50 µm) a arterioly (≥ 50 µm). Tyto údaje jsou klíčové pro výběr jednotlivých steroidních přípravků zejména v oblasti spinálních intervencí.
PERINEURÁLNÍ APLIKACE KORTIKOIDŮ
Aplikace kortikoidů k periferním nervům či nervovým pletením je běžnou klinickou praxí ve většině zemí s rozvinutým zdravotnickým systémem. Perineurální aplikace kortikoidů je v klinické praxi používána několik desetiletí, přestože se řadí mezi „off label“ techniky. Ani v současné době však nemáme k dispozici jasná doporučení a informace týkající se dávkování kortikoidů, délky analgezie nebo intenzity senzitivní či motorické blokády. Většina prací poukazuje ve svých závěrech na absenci kvalitních randomizovaných studií.
Nejčastěji používaným a studovaným kortikoidem u perineurální aplikace je dexamethason. Mezi jeho hlavní výhody patří dlouhodobý účinek, výrazný antiinflamatorní efekt a také jeho nepartikulární složení, které je pravděpodobně spojeno s nižší incidencí závažných komplikací (viz dále). Albrecht et al. ve své systematické review prokázali na velmi heterogenním souboru 29 studií signifikantní prodloužení účinku krátce, středně i dlouhodobě účinných lokálních anestetik po přidání dexamethasonu (p < 0,00001). Délka analgezie nebyla ovlivněna dávkou (4 vs. 8 mg) dexamethasonu [3]. K podobným závěrům dospěla další metaanalýza, která navíc prokázala signifikantní redukci délky nástupu senzitivní i motorické blokády při použití dexamethasonu [4]. Studie zaměřené na efekt aplikace dexamethasonu s lokálními anestetiky u blokád brachiálního plexu prokázaly lepší analgetický efekt a prodloužení délky senzitivní i motorické blokády nezávisle na dávce kortikoidu (4 až 10 mg dexamethasonu). Na rozdíl od předchozích studií však prokázaly prodloužení nástupu účinku blokády. Prodloužené trvání motorické blokády zařadily vzhledem k požadavku časné fyzioterapie mezi nežádoucí účinky blokády, čemuž lze do jisté míry zabránit aplikací nižší koncentrace lokálního anestetika. Výskyt dalších komplikací blokád s použitím dexamethasonu nebo bez jeho použití byl srovnatelný v obou sledovaných skupinách [5, 6]. Porovnání účinku různých dávek dexamethasonu jako adjuvantní látky k 0,25% bupivakainu u supraklavikulární blokády k artroskopii ramene prokázalo stejné prodloužení analgezie u přidání 1, 2 nebo 4 mg dexamethasonu proti skupině pacientů s aplikací čistého lokálního anestetika (p = 0,105) [7]. Přes všechny tyto výsledky zůstává perineurální aplikace kortikoidů „off-label“ technikou. Proto se recentní studie zabývaly porovnáním intravenózní (schválené) a perineurální aplikace kortikoidů. Review Wiesmanna et al. poukázala na podobný efekt prodloužení blokády a zesílení analgezie u obou způsobů aplikace a doporučila intravenózní podání pro možnou lokální neurotoxicitu po perineurální aplikaci [8]. K podobnému závěru dospěl Rosenfeld ve studii porovnávající efekt u interskalenického bloku s ropivakainem v chirurgii ramene. Dexamethason podaný v dávce 8 mg perineurálně nebo parenterálně prodloužil srovnatelně signifikantně délku pooperační analgezie, snížily se nároky na spotřebu opioidu a antiemetik [9]. Další recentní metaanalýza roku prokázala delší dobu účinku a lepší analgezii při perineurálním podání kortikoidu a neprokázala rozdíl ve výskytu nežádoucích účinků. Přesto doporučila rezervovat perineurální aplikaci dexamethasonu pro případy, kde je žádoucí delší senzitivní i motorická blokáda [10]. Potenciální neurotoxické účinky dexamethasonu nebyly potvrzeny na animální studii z letošního roku. Při porovnání skupin blokád sedacího nervu u myší byl prokázán nejdelší efekt senzitivní blokády při perineurální aplikaci ropivakainu a dexamethasonu (660 minut), kratší u perineurálního podání ropivakainu a systémové aplikaci dexamethasonu (480 minut) a nejkratší u podání čistého ropivakainu perineurálně (330 minut). Nebyly shledány rozdíly v neurotoxickém působení jednotlivých technik [11].
EPIDURÁLNÍ APLIKACE KORTIKOIDŮ
Kortikoidy můžeme aplikovat do epidurálního prostoru páteře třemi základními přístupy – interlaminárně, transforaminálně a kaudálně. Ultrasonografická (USG) nebo skiaskopická (SKIA) navigace jsou u těchto postupů přínosné a zvyšují účinnost i bezpečnost jednotlivých technik. Interlaminární injekce (ILI) nebo interspinózní cesta umožňuje cílenější aplikaci v segmentu předpokládané patologie. Je možno aplikovat menší objem roztoku (5−10 ml), který se distribuuje dominantně v zadním epidurálním prostoru kraniálně, stranově non-dependentně. I přes anesteziology zažitý postup identifikace epidurálního prostoru metodou ztráty odporu je při EAK doporučeno použít SKIA nebo USG navigaci pro riziko punkce dury.
Transforaminální injekce (TFI) je nejcílenější. Směřuje do anterolaterálního epidurálního prostoru, kde je uloženo spinální ganglion a kortikoid je možno podat v redukované dávce a v malém objemu lokálního anestetika (2–3 ml). Navigace SKIA nebo USG je u tohoto přístupu nezbytná. Kaudální epidurální injekce (KEI) přes hiatus sacralis (kaudální blok) je většinou dobře proveditelná a má nižší riziko durální punkce. K dosažení cílových struktur však vyžaduje aplikaci většího objemu léčebného roztoku (10–30 ml, ale i více).
ÚČINNOST EPIDURÁLNÍ APLIKACE KORTIKOIDŮ
Efektivita EAK byla poprvé systematicky studována a popsána Americkou společností intervenčních algeziologů v roce 2009 (ASIPP – IPM guidelines). V souladu s Evidence Based Medicine byl bederní i cervikální ILI přiřazen stupeň 1C v indikaci hernie disku či radikulitidy, pro diskogenní bolesti bez herniace pak stupeň 2C. Síla důkazu bederní TFI indikované pro radikulární bolest s iradiací do dolní končetiny byla stanovena na úrovni 1C. Nejvyšší úroveň důkazu A/1B byla shledána u KEI v indikaci hernie disku či diskogenní bolesti bez herniace [12].
Následovaly další systematické review studií z let 1966–2011 provedené skupinou kolem Manchikantiho. Pro různé přístupy v krční, hrudní i bederní páteři stanovili střední dobu efektu EAK u diskogenní a radikulární bolesti na šest měsíců. Kombinace LA s kortikoidem měla signifikantně lepší efekt proti samotnému LA. U diagnóz axiální bolesti, spinální stenózy nebo postoperační bolesti prokázali mírný benefit intervence s LA s kortikoidem/bez kortikoidu proti placebu [13, 14].
V roce 2013 publikoval Cohen systematickou studii 12 dostupných review a 43 randomizovaných studií zabývajících se spinální aplikací kortikoidů. Prokázal mírné zlepšení diskogenních či radikulárních bolestí u 50 % pacientů po dobu nejméně tří měsíců. TFI vyhodnotil jako signifikantně lepší postup než ILI nebo KEI. Vážné komplikace sledovaných intervencí byly raritní [15]. Tyto závěry potvrdil Chou ve své metaanalýze EAK pro radikulopatii, ve které prokázal krátkodobou signifikantní redukci bolestí do tří měsíců, zlepšení funkčního stavu pacientů a snížení rizika chirurgického řešení stavu. Na rozdíl od předešlých prací však výsledek nebyl závislý na typu intervence či přístupu. Výskyt nežádoucích účinků hodnotil jako ojedinělý [16]. Nezávislost dobrého efektu EAK pro lumbosakrální radikulární bolest na typu přístupu do epidurálního prostoru pak potvrdila i další recentní práce [17].
Manchikanti v roce 2015 potvrdil efekt LA s kortikoidem nebo bez něj i v případě bolestí u bederní spinální stenózy u více než 70 % pacientů s délkou účinku více než 65 týdnů, což dřívější práce popíraly [18]. ILI měl signifikantně vyšší účinnost než KEI po dobu alespoň tří týdnů, 84 % vs. 51 % u LA, resp. 83 % vs. 57 % u aplikací LA s kortikoidem [19]. V systematické review potvrdil účinnost cervikální ILI nejen u spinální stenózy (level II), ale také u hernie disku, pooperační bolesti a radikulární bolesti s iradiací do horní končetiny [20].
INDIKACE EPIDURÁLNÍ APLIKACE KORTIKOIDŮ
Účinnost EAK závisí na řadě faktorů, jako jsou trvání bolesti, vlastní příčina bolestivého stavu, komorbidity atd. EAK je intervence, která stojí na pomezí konzervativní a radikální léčby. Její indikace se v průběhu posledních let posouvá stále více do oblasti terapie akutní a subakutní fáze bolestivého syndromu. Vhodné indikace pro EAK jsou:
- radikulární bolest při hernii ID v cervikální a lumbální oblasti,
- axiální a diskogenní bolest v lumbosakrální krajině,
- centrální a laterální stenóza páteřního kanálu,
- spondylolýza,
- bolesti zad po operaci páteře (failed back surgery syndrome),
- postherpetická neuralgie a jiné radikulitidy.
Pro riziko lokálních a systémových nežádoucích účinků se doporučuje provádět EAK u jednoho pacienta maximálně třikrát ročně [21].
KONTRAINDIKACE EAK
Absolutní kontraindikace:
- alergie na aplikované léky,
- systémová a lokální infekce,
- antikoagulační léčba a koagulopatie,
- lokální malignita.
- Relativní kontraindikace:
- kongestivní srdeční selhání,
- nestabilní diabetes mellitus,
- gravidita,
- imunosuprese.
RIZIKA EPIDURÁLNÍ APLIKACE KORTIKOIDŮ
Rychle rostoucí počet EAK v léčbě vertebrogenních bolestí je provázen nárůstem nežádoucích účinků a v některých případech i fatálních komplikací této intervence. Většina nežádoucích příhod těchto intervencí je dobře známa a popsána. Nejčastěji se vyskytujícím rizikem je výskyt postpunkčních bolestí hlavy (incidence 0,5–1 %). Mezi další komplikace EAK patří krvácení a hematom v místě punkce (incidence 0,02 %), infekce (incidence 0,01 %), méně často také zhoršení bolestí zad a končetin, vazovagální reakce, totální spinální blokáda, hypertenze, hyperglykemie, erytém v obličeji, zvýšená teplota v den procedury, vertigo, nauzea, zvracení, pneumotorax, svalové spasmy.
Ojedinělá, avšak velmi závažná rizika EAK zahrnují neurovaskulární komplikace (infarkt míchy, infarkt mozku a mozečku) způsobené aplikací léků v dané lokalizaci a přímé poškození nervových struktur zaváděnou jehlou [22]. U vaskulárních komplikací je nejčastější příčinou intraarteriální aplikace partikulárního kortikoidu po TFI v cervikální, lumbální a sakrální oblasti s incidencí 0,005 % [23]. V cervikální oblasti jsou embolizací s rizikem míšní léze ohroženy arteria vertebralis, segmentální radikulární arterie, vzestupná arterie a hluboké cervikální arterie nacházející se v blízkosti foramin [24]. V lumbální a sakrální oblasti je rizikovou cévou Adamkiewiczova arterie (syndrom arteria spinalis anterior), někdy i atypicky ležící v úrovni L4, L5 a S1. Z této tepny je pro každý kořen kaudy určena příslušná radikulomedulární arterie. Možné je i přímé cévní trauma perforující jehlou s následným spasmem nebo vznikem disekce. Závažné příhody po TFI sice nejsou časté, vyskytly se spíše jako ojedinělé případy nejčastěji po TFI v cervikální oblasti, ale následky mohou být fatální. Ve snaze předcházet těmto neurovaskulárním komplikacím s permanentním neurologickým poškozením s kvadruparézou, až plegií ustanovil úřad FDA (Food and Drug Administration) pracovní skupinu (FDA Safe Use Initiative) složenou ze zástupců odborných lékařských společností zabývajících se intervenční léčbou bolestí zad. Cílem pracovní skupiny bylo stanovit postup intervenční léčby s EAK s ohledem na minimalizaci fatálních neurovaskulárních rizik. Je-li EAK indikovaná, důrazně se doporučuje respektovat tato bezpečností pravidla [25]:
- před každou EAK v cervikální oblasti je nutno vyhodnotit výsledky příslušných zobrazovacích metod (CT, MR – šíře epidurálního prostoru v cílovém segmentu, anatomické abnormality apod.),
- každá EAK v cervikální oblasti (ILI i TFI) musí být vedena se SKIA navigací v laterální či šikmé projekci s aplikací kontrastní látky (KL),
- cervikální ILI se provádí ve výši C7/Th1 nebo C6/C7, nikdy ne výše,
- v cervikální krajině (C6/7 a C7/T1) mají ILI přednost před TFI,
- u cervikální TFI má být před EAK v průběhu SKIA navigace aplikována KL v „reálném čase“ v anteroposteriorní (AP) projekci, optimálně s použitím prodlužovací hadičky (snížení rizika dislokace inzerované jehly při výměně stříkačky),
- v cervikální oblasti je dexamethason kortikoidem první volby, partikulární kortikoidy jsou metodou druhé volby pouze při ILI,
- lumbální ILI se provádí se SKIA navigací s podáním KL, u TFI se aplikuje KL v „reálném čase“ v AP projekci,
- lumbální TFI mají přednost u jednostranné symptomatologie s monoradikulárním postižením, ILI se doporučují při oboustranné kořenové symptomatologii,
- u lumbální TFI je dexamethason kortikoidem první volby, partikulární kortikoidy jsou metodou druhé volby,
- cervikální i lumbální EAK mohou být provedeny bez aplikace KL v případě zdokumentované alergie; za těchto podmínek je kontraindikována aplikace partikulárního kortikoidu,
- EAK nesmí být prováděny při hluboké analgosedaci, lehká sedace je možná, možnost komunikace je podmínkou.
Nejvyšší riziko intravaskulární aplikace kortikoidu je v cervikální oblasti, nejnižší u KEI. Ani negativní aspirace nevylučuje intravaskulární pozici konce jehly. Dexamethason je upřednostňován před partikulárními kortikoidy, protože všechny závažné neurologické komplikace byly spojeny právě s jejich aplikací (methylprednisolon, triamcinolon). Druhým důvodem je, že dle klinických studií není dexamethason prokazatelně méně účinný než suspenzní kortikoidy [26]. Zejména v cervikální oblasti nelze podcenit ani přímé míšní trauma způsobené inzerovanou jehlou při ILI. Vyšší cervikální segmenty jsou pro ILI nevhodné ze dvou důvodů. Epidurální prostor bývá v této úrovní páteře velmi těsný a ligamentum flavum (důležité pro dobře rozpoznatelnou náhlou ztrátu rezistence při průchodu Tuohyho jehly) je zde často nedostatečně vyvinuté, až deficitní [27]. Tím se významně zvyšuje riziko traumatu míchy. Proto by ILI měla být provedena jen v doporučované úrovni. Spoléhání jen na klasickou metodu „ztráty odporu“ nezaručuje bezpečné provedení ILI. K tomu je nutná SKIA navigace ve dvou projekcích – AP a laterální. Většina doporučení je však na úrovni „expert consensus“ a nikdy nemůže být validně testována pro velmi nízkou incidenci [25].
ZÁVĚR
Optimalizace pooperační analgezie významně ovlivňuje výsledek chirurgické léčby, jelikož umožňuje včasné uplatnění rehabilitačních postupů a restituci funkčního oslabení. Techniky regionální anestezie a analgezie hrají podstatnou roli. Kortikoidy svým adjuvantním účinkem přispívají k prodloužení účinku lokálních anestetik a ke zlepšení kvality kontroly bolesti. Vhodnou první volbou v této indikaci je dexamethason v dávce 4 až 8 mg. Perineurální aplikace kortikoidu „off-label“ může zvýšit celkovou účinnost regionálních technik i v oblasti léčby chronické bolesti – aplikace u diskogenních bolestí, blok nervus suprascapularis u syndromu bolestivého ramene, periferní posttraumatické neuropatie apod.
Specifickou problematikou je spinální aplikace kortikoidu. EAK je účinná intervenční technika v léčbě bolestí především u hernie disku a radikulární bolesti, ale také u spinální stenózy nebo pooperační bolesti. Délka účinku se v literatuře značně liší, obecně však EAK platí jako intervence s krátko - až střednědobým efektem. Výhodou je cílená aplikace steroidu do místa potíží, která je provázena nízkou incidencí komplikací. Pro efektivní a bezpečnou léčbu je naprosto zásadní správný výběr pacientů a načasování terapie. Závažné nežádoucí účinky EAK jsou relativně vzácné, avšak mohou být fatální. Platí důrazné doporučení respektovat kritéria pro spinální aplikaci navržená expertní skupinou FDA. Ve snaze vyhnout se závažným komplikacím je vhodnou první volbou nepartikulární forma kortikoidu s podáním testovací dávky. Každá EAK by měla být navigována skiaskopicky, CT nebo ultrasonograficky v reálném čase.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Oba autoři se podíleli na vytvoření článku stejným dílem, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Do redakce došlo dne 12. 1. 2018.
Do tisku přijato dne 28. 4. 2018.
Adresa pro korespondenci:
doc. MUDr. Tomáš Gabrhelík, Ph.D.
Sources
1. Lievre JA, Bloch-Michel H, Pean G. L’hydrocortisone en injection locale. Rev Rheum. 1953;20 : 310.
2. Schilling LS, Markman JD. Corticosteroids for Pain of Spinal Origin: Epidural and Intraarticular Administration. Rheum Dis Clin North Am. 2016;42 : 137−155.
3. Albrecht E, Kern C, Kirkham KR. A systematic review and meta-analysis of perineural dexamethasone for peripheral nerve blocks. Anaesthesia. 2015;70 : 71−83.
4. Hyunh TM, Marret E, Bonnet F. Combination of dexamethasone and local anaesthetic solution in peripheral nerve blocks: A meta-analysis of randomised controlled trials. Eur J Anaesthesiol. 2015;32 : 751−758.
5. Choi S, Rodseth R, McCartney CJ. Effects of dexamethasone as a local anaesthetic adjutant for brachial plexus block: a systematic review and meta-analysis of randomised trials. Br J Anaesth. 2014;112 : 427−439.
6. Knezevic NN, Anantamongkol U, Candido KD. Perineural dexamethasone added to local anesthesia for brachial plexus block improves pain but delays block onset and motor blockade recovery. Pain Physician. 2015;18 : 1−14.
7. Liu J, Richman KA, Grodofsky SR, et al. Is there a dose response of dexamethasone as adjutant for supraclavicular brachial plexus block? A prospective randomized double-blinded clinical study. J Clin Anesth. 2015;27 : 237−242.
8. Wiesmann T, Volk T, Steinfeldt T. Glucocorticoids as an adjunct in peripheral regional anesthesia. Move to the „Holy grail of perineural analgesia“?! Anaesthesist. 2016;65 : 295–298.
9. Rosenfeld DM, Ivancic MG, Hattrup SJ, et al. Perineural versus intravenous dexamethasone as adjuncts to local anaesthetic brachial plexus block for shoulder surgery. Anaesthesia. 2016;71 : 380−388.
10. Chong MA, Berbenetz NM, Lin C, et al. Perineural versus intravenous dexamethasone as an adjuvant for peripheral nerve blocks: A systematic review and meta-analysis. Reg Anesth Pain Med. 2017;42 : 319−326.
11. Marty P, Bennis M, Legaillard B, et al. A new step toward evidence of in vivo perineural dexamethasone safety: an animal study. Reg Anesth Pain Med. 2017; Ap7 7. Doi 10.1097/AAP 0000000000000392. [Epub ahead of print]
12. Manchikanti L, Boswell MV, Singh V, et al. ASIPP-IPM. Comprehensive evidence-based guidelines for interventional techniques in the management of chronic spinal pain. Pain Physician. 2009;12 : 699−802.
13. Diwan S, Manchikanti L, Benyamin RM, et al. Effectiveness of cervical epidural injections in the management of chronic neck and upper extremity pain. Pain Physician. 2012;15 : 405−434.
14. Manchikanti L, Buenaventura RM, Manchikanti KN, et al. Effectiveness of therapeutic lumbar transforaminal epidural steroid injections in managing lumbar spinal pain. Pain Physician. 2012;15 : 199−245.
15. Cohen SP, Bicket MC, Jamison D, et al. Epidural steroids: a comprehensive, evidence-based review. Reg Anesth Pain Med. 2013;38 : 175−200.
16. Chou R, Hashimoto R, Friedly J, et al. Epidural Corticosteroid Injections for Radiculopathy and Spinal Stenosis: A Systematic Review and Meta-analysis. Ann Intern Med. 2015;163 : 373−381.
17. Liu J, Zhou H, Lu L, et al. The Effectiveness of Transforaminal Versus Caudal Routes for Epidural Steroid Injections in Managing Lumbosacral Radicular Pain: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016;95 : 3373.
18. Manchikanti L, Cash KA, McManus CD, et al. A randomized, double-blind controlled trial of lumbar interlaminar epidural injections in central spinal stenosis: 2-year follow-up. Pain Physician. 2015;18 : 79−92.
19. Manchikanti L, Falco FJ, Pampati V, et al. Lumbar interlaminar epidural injections are superior to caudal epidural injections in managing lumbar central spinal stenosis. Pain Physician. 2014;17 : 691−702.
20. Manchikanti L, Nampiaparampil DE, Candido KD, et al. Do cervical epidural injections provide long-term relief in neck and upper extremity pain? A systematic review. Pain Physician. 2015;18 : 39−60.
21. Manchikanti L, Atluri S. Lumbar epidural Nerve Block. In: Waldman SD. Pain Management. Philadelphia: Saunders Elsevier, 2007 : 1281−1293.
22. Neal JM, Bernards CM, Hadzic A, et al. ASRA Practice Advisory on Neurologic Complications in Regional Anesthesia and Pain Medicine. Reg Anesth Pain Med. 2008;33 : 404−415.
23. Dawley JD, Moeller-Bertram T, Wallace MS, et al. Intra-arterial injection in the rat brain: evaluation of steroids used for transforaminal epidurals. Spine. 2009;34 : 1638-1643.
24. Huntoon M. Anatomy of the cervical intervertebral foramina: vulnerable arteries and ischemic injuries after transforaminal epidural injections. Pain. 2005;117 : 104−111.
25. Rathmell JP, Benzon HT, Dreyfuss P, et al. Safeguards to prevent neurologic complications after epidural steroid injections: consensus opinions from a multidisciplinary working group and national organizations. Anesthesiology. 2015;122 : 974−984.
26. El-Yahchouchi C, Geske JR, Carter RE, et al. The noninferiority of the nonparticulate steroid dexamethasone and triamcinolone in lumbar transforamial epidural steroid injections. Pain Med. 2013;14 : 1650−1657.
27. Lirk P, Kolbitsch C, Putz G, et al. Cervical and high thoracic ligamentum flavum frequently fails to fuse in the midline. Anesthesiology. 2003;99 : 1387−1390.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2018 Issue 3-
All articles in this issue
- Zlepšení kognitivních funkcí po oboustranné karotické endarterektomii. Jsou nízké hodnoty rSO2 zjištěné NIRS indikací ke kyslíkové léčbě?
- Regionální anestezie k operacím ramene – současné trendy
- Selhání analýzy rytmu automatizovaným externím defibrilátorem u mimonemocniční náhlé zástavy oběhu
- Generalizovaný konvulzivní status epilepticus v dětském věku
- Anesteziologická problematika u dětí s Williamsovým syndromem
- Současné postavení kortikoidů v regionální anestezii a analgezii
- Urgentní infraglotické zajištění dýchacích cest – koniopunkce, koniostomie, BACT
- „Slavné osmičky“ v historii anesteziologie
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Urgentní infraglotické zajištění dýchacích cest – koniopunkce, koniostomie, BACT
- Generalizovaný konvulzivní status epilepticus v dětském věku
- Regionální anestezie k operacím ramene – současné trendy
- Současné postavení kortikoidů v regionální anestezii a analgezii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

