-
Medical journals
- Career
Energotrauma a ventilátorem indukované plicní poškození
: J. Máca 1,2; F. Burša 1,2
: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava 1; Katedra intenzivní medicíny, urgentní medicíny a forenzních oborů, Lékařská fakulta, Ostravská univerzita 2
: Anest. intenziv. Med., 28, 2017, č. 3, s. 163-167
: Intensive Care Medicine - Review Article
Ventilátorem indukované plicní poškození (VILI) je závažný stav vznikající na podkladě použití traumatizující umělé plicní ventilace (UPV). V současné literatuře je možné se setkat s novým pohledem na problematiku vzniku VILI. Jde o tzv. „mechanical power concept“, který definuje vztah statických i dynamických parametrů nastavení UPV a energetické zátěže respiračního systému, včetně VILI. Cílem tohoto textu je stručná charakteristika tohoto konceptu ve vztahu k recentní literatuře.
Klíčová slova:
ventilátorem indukované plicní postižení – mechanická energie – umělá plicní ventilaceÚVOD
Ventilátorem indukované plicní poškození (ventilator-induced lung injury, VILI) je závažným problémem intenzivní péče. Lze je definovat jako poškození plicního parenchymu iniciované nebo zhoršené umělou plicní ventilací (UPV) pozitivním přetlakem (positive pressure ventilation, PPV) [1,2].
V odborné literatuře i v klinické praxi bývá problematika VILI spojována především s pacienty se syndromem akutní dechové tísně (ARDS), u kterých je největší riziko traumatizující (neprotektivní) UPV vlivem patologických změn narušujících mechanické vlastnosti plicního parenchymu. Rozvoj plicního poškození byl popsán u ventilovaných pacientů bez primárně plicního onemocnění [3].
Recentně byla navržena změna výkladu samotné zkratky VILI, a to vzhledem k často neoprávněně opomíjené skutečnosti, že plicní poškození může vzniknout i u spontánně ventilujících pacientů. VILI by mělo být přesněji interpretováno spíše jako „ventilací indukované plicní poškození“ oproti původnímu „ventilátorem indukované plicní poškození“ [4].
Za stěžejní mechanismus vedoucí ke vzniku VILI je považována nadměrná mechanická zátěž buněčných elementů (pneumocyty, endoteliální buňky a plicní imunocyty) a nebuněčných složek (elastin a kolagen, makromolekuly matrix intersticia) plicního parenchymu, tzv. mechanotransdukce. Dochází při ní ke zvýšení produkce cytokinů a rozvoji patologické zánětlivé odpovědi [5]. Patogenetickým podkladem mechanotransdukce je především tlakové a objemové přetížení, tzv. barotrauma/volutrauma, které vzniká při 1. vysoké hodnotě transpulmonálního tlaku (Ptp), což je rozdíl mezi tlakem v dýchacích cestách a pleurální dutinou a obvykle reprezentuje stres (angl. stress), a 2. deformaci plicní tkáně vznikající při nadměrném dechovém objemu (Vt), označované jako napětí (angl. strain). Stres a napětí jsou za fyziologické situace lineárně závislé, tzn. stres = napětí × K. Parametr K se označuje jako tzv. specifická plicní elastance a odpovídá hodnotě Ptp při Vt o stejné velikosti jako end-exspirační objem ventilovatelné části plic (u ARDS se jedná o objem tzv. „baby lung“), tzn. modul Vt/baby lung je roven 1, viz rovnice 1.
1. Ptp (stress) = K × (Vt/baby lung) (strain)
Dalším mechanismem je tzv. atelektrauma, které je způsobeno přítomností tzv. střižných sil (angl. shear forces) na rozhraní mezi vzdušnou a nevzdušnou plicní tkání při cyklickém uzavírání a otevírání (angl. intertidal colapse/decolapse) nestabilních alveolů.
Na vzniku VILI se podílejí také další faktory:
- a) přímé mechanické poškození endotelu, tzv. kapilární stresové selhání (capillary stress failure – CSF), které je charakterizováno narušením („roztržením“) strukturální integrity vrstvy buněk endotelu, bez vztahu k zánětu indukovanému mechanotransdukcí [6],
- b) hyperoxické plicní poškození při podávání vysoké inspirační frakce O2 (FiO2), provázené zvýšenou tvorbou reaktivních kyslíkových sloučenin (ROS). To vede k dysregulaci redoxní signalizace a narušení redoxní rovnováhy s následným poškozením cílových intracelulárních struktur: oxidace proteinů, lipidů a genetického materiálu (DNA),
- c) porucha tvorby a funkce endogenního surfaktantu [7].
VILI je výsledek interakce mezi parametry ventilace a faktory souvisejícími s aktuálními vlastnostmi plicního parenchymu, především mírou plicního edému [8, 9] (tab. 1). Parametry nastavení UPV mají pak svůj specifický vliv na velikost energie dodané respiračnímu systému.
1. Základní a odvozené parametry nastavení režimu umělé plicní ventilace a faktory odvozené od stavu plicního parenchymu 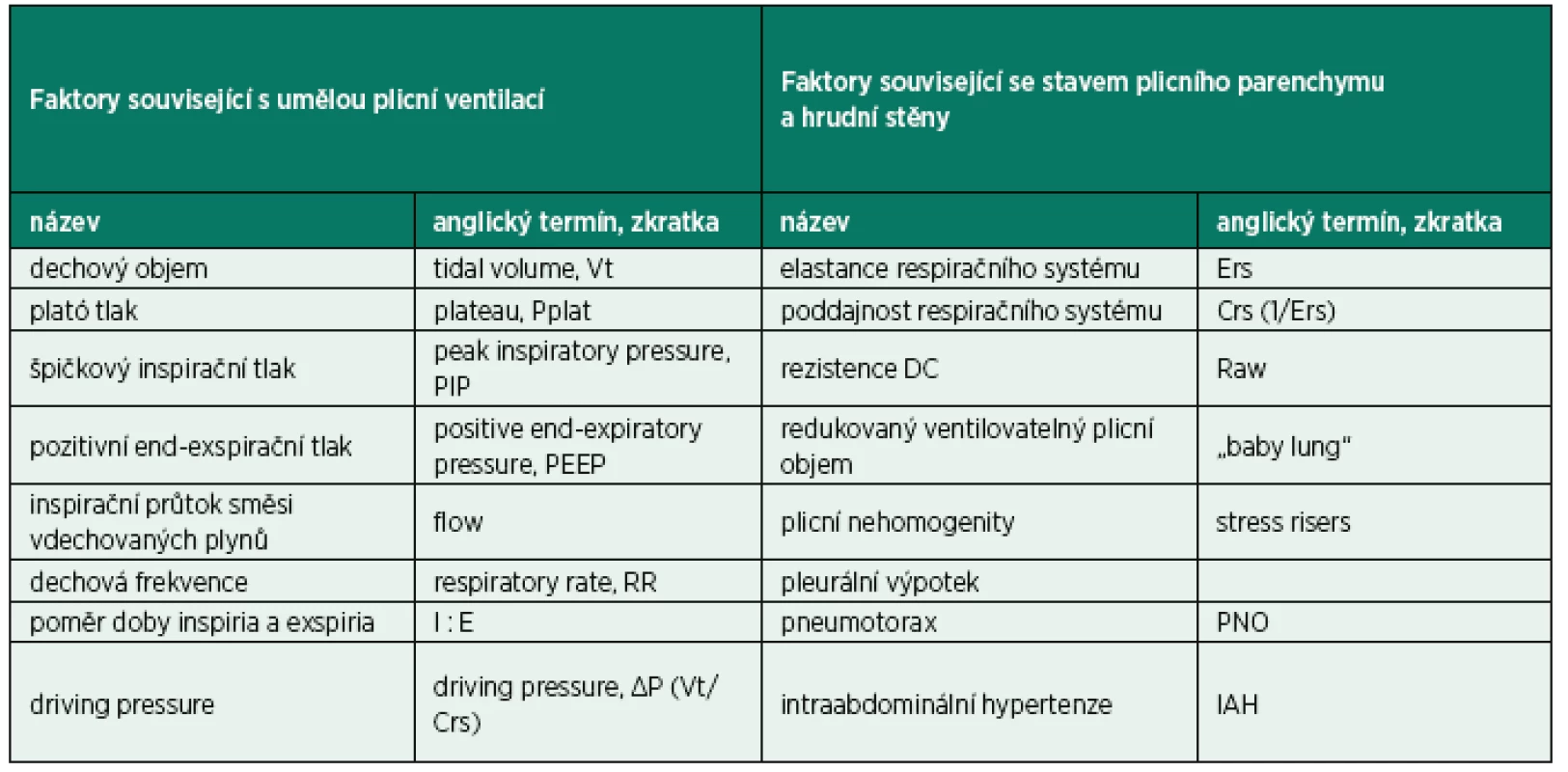
PLICNÍ ENERGOTRAUMA
Plicní skelet se skládá ze dvou základních vláknitých proteinových systémů: 1. Z centrifugálního systému vedoucího v peribronchiálních prostorech od hilů do plicní periferie a 2. z centripetálního systému, který je ukotven v oblasti viscerální pleury a proplétá se s prvním systémem na úrovni plicních alveolů. Do tohoto systému jsou zakomponovány buněčné struktury jako plicní endotel, epitel a buňky plicního intersticia. Vlastní ukotvení buněk a vzájemná interakce s molekulami intersticiálního matrix a plicního skeletu jsou zprostředkovány převážně transmembránovým integrinovým proteinovým systémem [10]. Mechanická zátěž plicního skeletu v průběhu PPV vede k jeho prostorové molekulární reorganizaci, a tím ke zvýšení vnitřního napětí (strain). Mechanická energie, která je takto plicnímu parenchymu dodána, je dávána do souvislosti se vznikem VILI [8, 11-13]. Celkovou energii (Eb), která je doručena respiračnímu systému, lze odhadnout jako součet statické (Estat) a dynamické energie (Edyn) v průběhu jednoho dechu. Její jednotkou jsou jouly (J).
2. Eb = Estat + Edyn
Estat je energie potřebná k udržení respiračního systému v rozepnutém stavu, tzn. za statických podmínek, kdy není přítomen průtok směsi plynů, a reprezentuje statickou/potenciální energii (static strain). Edyn lze definovat jako energii vznikající na podkladě kinetické energie (dynamic strain). Tato energie je spotřebována na proces rozepnutí parenchymu, tzn. zajištění průtoku plynů dýchacími cestami a překonání odporu dýchacích cest a odporu plicního parenchymu (vzájemný posun tkáňových struktur). V úvodu inspiria je většina energie plynoucí z PPV investována do dynamické práce k postupnému rozepnutí parenchymu, a tím zajištění průtoku směsi plynů, tzn. překonání třecích a viskózních sil směsi plynů. Na konci inspiria je pak převaha energie spotřebována na statickou práci k udržení rozepnutí plicní tkáně, viz obrázek 1 popisující inspirační fázi dechového cyklu. Část energie doručené v průběhu inspirační fáze dechového cyklu je v exspirační fázi předána proudícím plynům v podobě kinetické energie a celková dodaná energie pak odpovídá hysterezi mezi inspirační a exspirační částí tlakově-objemové křivky.
1. Dynamická (Edyn) a statická (Estat) složka mechanické energie dodané respiračnímu systému v inspirační fázi při umělé plicní ventilaci pozitivním přetlakem. 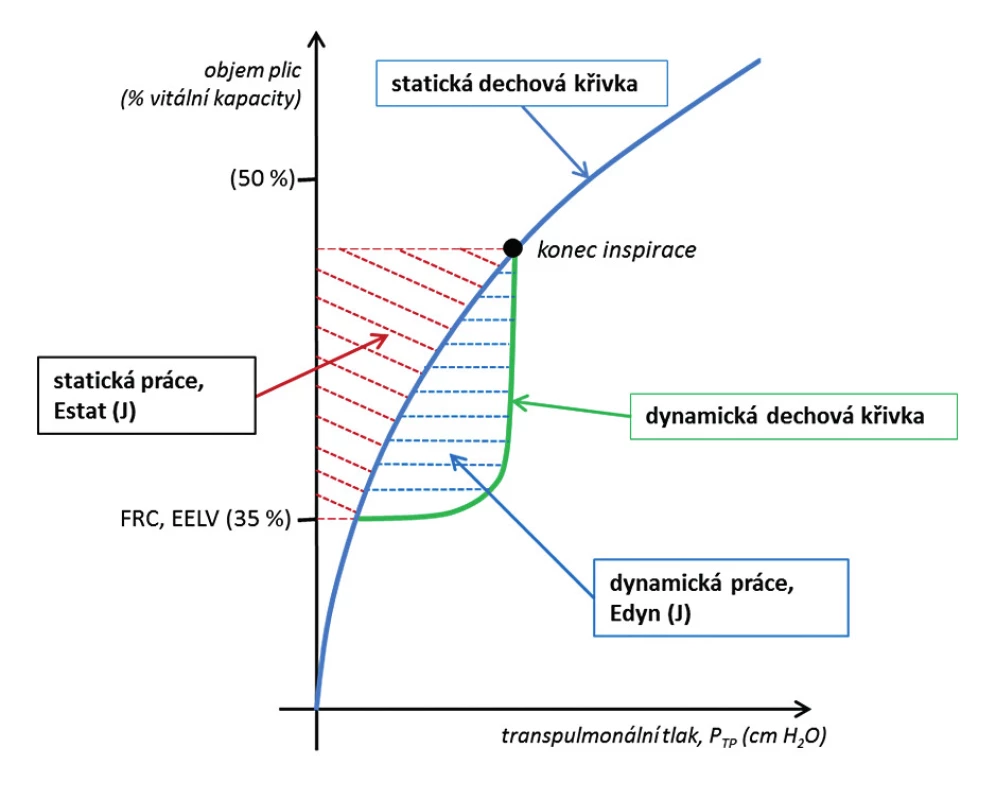
(Převzato a volně adaptováno se svolením www.PulmCCM.org, Jon-Emile S. Kenny.) Pokud vynásobíme Eb dechovou frekvencí (respiratory rate, RR) za jednu minutu, dostaneme celkové množství energie (Etot) dodané cestou PPV vztaženou na jednotku času (minuta) [14].
3. Etot = Eb × RR
MECHANICAL POWER CONCEPT
Prevence vzniku plicního poškození při UPV byla již od prvního popisu VILI zaměřena především na snahu o redukci Vt, tlaku v dýchacích cestách (Paw), popřípadě na hledání optimální hodnoty pozitivního tlaku na konci exspiria (PEEP) [15,16]. Tyto parametry ventilace ovšem byly doposud více či méně zkoumány izolovaně. S unifikující teorií, která zahrnuje kromě statických parametrů plicní ventilace také dynamické parametry jako inspirační flow a RR, přichází recentně skupina kolem profesora Gattinoniho.
Cressoni a Gattinoni ve své experimentální práci publikované v květnu 2016 definovali tzv. koncept mechanické síly/energie, tzv. mechanical power concept [13]. Tento koncept se snaží popsat míru energetické zátěže respiračního systému v rámci PPV. Na prasečím modelu byly testovány Vt, které jsou považovány za letální (až 39 ml/kg), v různých dechových frekvencích, za podmínky zachování konstantních hodnot ostatních ventilačních parametrů. Zvířata byla myorelaxována a analgosedována. Bylo zjištěno, že přestože rozdíl mezi nejnižší (3/min) a nejvyšší (15/min) RR byl pouze 5násobný, energie dodaná do respiračního systému byla u vyšších RR až 11krát vyšší. Prahovou hodnotou energetické zátěže související s rozvojem VILI byla autory stanovena hodnota 12 J/min. Při kontrolním testování byla nastavena RR 35/min pro všechny zkoumané subjekty, rozdílem byly dvě hodnoty Vt, z nichž jedna přesahovala uznávaný práh pro traumatizaci (22 ml/kg) a druhá byla pod tímto prahem (11 ml/kg). Opět bylo prokázáno, že jen ty subjekty, které byly ventilovány energií větší než 12 J/min, rozvinuly dle počítačové tomografie (CT) plicní poškození charakteru VILI. Velikost Vt tedy nebyla hlavním faktorem vedoucím k plicnímu poškození. Velikost mechanické energie pozitivně korelovala s hmotností plic, plicní elastancí a negativně korelovala s indexem PaO2/FiO2. Subjekty, které byly ventilovány pod stanovenou hranicí energetické zátěže, rozvinuly pouze izolované plicní nehomogenity (denzity) [13].
Převod zmíněných animálních dat z této studie do klinické praxe je obtížný. Brání tomu na jednu stranu standardní problémy s extrapolací experimentálních dat do humánní medicíny, např. anatomické poměry, rozměry a tvar plic ve vztahu k hrudnímu koši, různá specifická elastance plicního parenchymu u různých živočišných druhů (12 cmH2O u člověka, 6 cmH2O u prasete a 4 cmH2O u krys) [14]. Dalším důvodem je časté užití tlakově kontrolovaných ventilačních režimů v podmínkách intenzivní péče, především v evropských podmínkách. Ty neumožňují úplnou kontrolu nad dosaženým Vt, transpulmonálním tlakem (Ptp) a inspiračním průtokem (flow) směsi plynů systémem. Z tohoto důvodu je omezená i kontrola energetické zátěže respiračního systému. Tato skutečnost dominuje především u pacientů, kteří mají alespoň částečně zachovanou spontánní dechovou aktivitu. Použití myorelaxace v časné fázi těžkých forem ARDS je pravděpodobně schopné navozením absence dechového úsilí zajistit úplnou kontrolu nad zmíněnými ventilačními parametry (Vt, Ptp, flow). Vlivem konceptu mechanické síly lze také do jisté míry vysvětlit selhání některých nekonvenčních ventilačních režimů, jako je vysokofrekvenční ventilace (HFV), především oscilační ventilace (HFOV). Přestože je u těchto režimů významně redukován Vt, celková energetická zátěž respiračního systému může překonat uvedený práh traumatizace [17, 18].
Stejný tým publikoval v srpnu 2016 další práci, která je založena na snaze o vytvoření jednotné rovnice pro kalkulaci mechanické energie (mechanical power equation), tentokrát v podmínkách klinické praxe [8]. Cílem bylo také zhodnocení míry vlivu jednotlivých statických i dynamických parametrů UPV na vlastní velikost energetické zátěže respiračního systému. Bylo zařazeno 30 subjektů na UPV s normálními vlastnostmi plicního parenchymu a 50 subjektů s diagnózou ARDS. Kalkulace mechanické energie vycházela z klasické rovnice síly (power equation) založené na dynamické pressure-volume křivce při PEEP 5 a 15 cm H2O a Vt 6, 8,10, 12 ml/kg predikované váhy. Výsledná rovnice výpočtu energetické zátěže obsahuje tyto parametry: Vt – dechový objem, elastanci respiračního systému (Ers = 1/Crs), I : E – poměr délky inspiria a exspiria, Raw – rezistence dýchacích cest, RR a PEEP.
Největší (exponenciální) vliv na velikost Etot má velikost Vt, driving pressure (ΔP, poměr mezi Vt/Crs) a flow (exponent 2), což zjednodušeně znamená, že např. při nárůstu dechového objemu z 6 ml na 12 ml/kg predikované tělesné hmotnosti (PBW) dojde k 4násobnému navýšení energetické zátěže respiračního systému. Z dalších parametrů byl vliv RR také exponenciální (exponent 1,4) a vliv PEEP lineární povahy [8].
Praktický význam této práce spočívá v tom, že všechny parametry zahrnuté v rovnici výpočtu MP je možné poměrně jednoduše získat z naprosté většiny dnes standardně používaných přístrojů pro UPV. Práce také zdůrazňuje exponenciální vliv velikosti RR na míru energetické zátěže, což je skutečnost, která se v klinické praxi velice často opomíjí.
Zajímavým a mírně kontroverzním poznatkem ovšem je, že i když se hodnota PEEP nepodílí na cyklické energetické zátěži respiračního systému v průběhu každého dechového cyklu, přítomnost PEEP zvyšuje celkovou energetickou nálož o faktor odpovídající PEEP × Vt, jinými slovy pokud zvýšíme PEEP o 20 % při zachovaném Vt, dodaná energie se zvýší o 20 %. Pozitivní vliv PEEP spočívá v řadě případů v příznivém ovlivnění některých parametrů souvisejících s vlastnostmi plicního parenchymu, např. zvýšení homogenity plicního parenchymu a redukce alveolárního kolapsu/dekolapsu v průběhu dechového cyklu. Výsledný efekt PEEP závisí na tom, který z těchto dvou vlivů u konkrétního pacienta převažuje [8].
Pokud akceptujeme myšlenku, že velikost mechanické energie dodané při UPV úzce souvisí s rozvojem VILI, je pravděpodobné, že k plicnímu poškození povede až taková kombinace různě nastavených parametrů UPV, která ve vztahu k aktuálnímu stavu respiračního systému překročí určitý traumatizující energetický práh.
ZÁVĚR
Velikost energie dodané mechanickou zátěží plicního parenchymu při PPV je možné vypočítat na podkladě sjednocení vlivu statických a dynamických složek parametrů UPV. Je pravděpodobně možné stanovit energetický práh, jehož překročení souvisí s rozvojem VILI. Koncept plicního energotraumatu by mohl do budoucna vést na jedné straně k odklonu od snahy o ovlivnění izolovaných ventilačních parametrů (např. Vt nebo Paw) a na druhé straně k většímu respektování aktuální mechaniky plic, především poddajnosti respiračního systému (Vt/ΔP) a jejích dynamických změn v průběhu UPV.
Práce je původní a nebyla publikována v jiném médiu ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Oba autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Do redakce došlo dne 3. 11. 2016.
Do tisku přijato dne 6. 2. 2017.
Adresa pro korespondenci:
MUDr. Jan Máca
e-mail: jan.maca@fno.cz
Sources
1. Plötz FB, Slutsky AS. Ventilator-induced lung injury and multiple system organ failure: a critical review of facts and hypotheses. Intensive Care Med 2004;30 : 1865–1872.
2. Maron-Gutierrez T, Pelosi P, Rocco PRM. Ventilator-induced lung injury, New Developments in Mechanical Ventilation, Eur Respir Mon. Monographs 2012;55 : 1–18.
3. Neto AS, Jaber S. What’s new in mechanical ventilation in patients without ARDS : lessons from the ARDS literature. Intensive Care Med 2016;42 : 5–7.
4. Gattinoni L, Quintel M. How ARDS should be treated. Crit Care 2016;20(1):86.
5. Slutsky AS, Ranieri VM. Ventilator-Induced Lung Injury. N Engl J Med 2013;369 : 2126–2136.
6. West JB. Cellular Responses to Mechanical Stress Invited Review: Pulmonary capillary stress failure. J Appl Physiol 2000;89 : 2483–2489.
7. Raghavendran K, Willson D, Notter R. Surfactant Therapy of ALI and ARDS. Crit Care Clin 2011;27 : 525–559.
8. Gattinoni L, Tonetti T, Cressoni M, et al. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med 2016;42 : 1567–1575.
9. Cressoni M, Cadringher P, Chiurazzi C, et al. Lung Inhomogeneity in Patients with Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med 2014;189(2):149–158.
10. Sheppard D. Functions of Pulmonary Epithelial Integrins: From Development to Disease. Physiol Rev 2003;83 : 673–686.
11. Nieman GF, Satalin J, Andrews P, et al. Lung stress, strain, and energy load: engineering concepts to understand the mechanism of ventilator-induced lung injury (VILI). Intensive Care Med Exp. 2016;4 : 16.
12. Protti A, Andreis DT, Milesi M, et al. Lung anatomy, energy load, and ventilator-induced lung injury. Intensive Care Med Exp. 2015;3 : 34.
13. Cressoni M, Gotti M, Chiurazzi C, et al. Mechanical Power and Development of Ventilator-induced Lung Injury. Anesthesiology. 2016;124 : 1100–1108.
14. Kenny JES, 2016. ICU Physiology in 1,000 Words: ARDS – Part 1. http://pulmccm.org/main/2016/ards-review/icu-physiology-1000-words-ards-part-1/.
15. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342 : 1301–1308.
16. Brower R, Lanken P, MacIntyre N, et al. Higher versus Lower Positive End-Expiratory Pressures in Patients with the Acute Respiratory Distress Syndrome. N Engl J Med. 2004;351 : 327–336.
17. Ferguson N, Cook D, Guyatt H, et al. High-frequency oscillation in early acute respiratory distress syndrome. N Engl J Med. 2013;368 : 795–805.
18. Young D, Lamb S, Shah S, et al. High-Frequency Oscillation for Acute Respiratory Distress Syndrome. N Engl J Med. 2013;368 : 806–813.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2017 Issue 3-
All articles in this issue
- Selected Aspects of Interdisciplinary Collaboration in the Delivery Room
- Healthcare associated pneumonia in intensive care patients – optimal choice of initial empirical antimicrobial therapy: Results of a multicenter, observational study
- Practical application of the results of clinical trials
- Pulmonary trauma by energy load – ventilator-induced lung injury
- Epidemiology of out-of-hospital cardiac arrest in the Czech Republic – national results of the EuReCa ONE trial
- Statistics in biomedical research II
-
Anestezie v Rakousko -Uhersku během I. světové války a po vzniku samostatného československého státu
Část I - Úvod
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Epidemiology of out-of-hospital cardiac arrest in the Czech Republic – national results of the EuReCa ONE trial
- Pulmonary trauma by energy load – ventilator-induced lung injury
- Healthcare associated pneumonia in intensive care patients – optimal choice of initial empirical antimicrobial therapy: Results of a multicenter, observational study
- Practical application of the results of clinical trials
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

