-
Medical journals
- Career
Inhalační aplikace furosemidu - univerzální lék na dušnost?
: R. Škulec
: Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem Masarykova nemocnice v Ústí nad Labem 1; Zdravotnická záchranná služba Středočeského kraje, Kladno 2; Klinika anesteziologie a intenzivní medicíny, Univerzita Karlova, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 3; Centrum pro výzkum a vývoj, Univerzita Karlova, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 4
: Anest. intenziv. Med., 28, 2017, č. 2, s. 101-105
:
Dušnost je závažný symptom vyžadující kauzální a/nebo paliativní řešení u řady akutních i chronických onemocnění. Ukazuje se, že inhalační aplikace furosemidu (IAF) má potenciál být novým účinným postupem k ovlivnění dušnosti v řadě indikací. Tato forma podání má bronchodilatační efekt, tlumí aferentaci do centrálního nervového systému, tlumí pocit dušnosti a má minimální diuretický efekt. V práci autor prezentuje literární souhrn poznatků o využití IAF u astma bronchiale, chronické obstrukční nemoci bronchopulmonální, srdečního selhávání a v paliativní léčbě dušnosti a vlastní kazuistickou sérii.
Klíčová slova:
inhalační furosemid – dušnostÚVOD
Dušnost je subjektivní symptom s velmi komplexním a s doposud ne zcela prozkoumaným mechanismem vzniku. Zároveň se jedná o velmi častý symptom vyžadující urgentní řešení. Příčiny dušnosti mohou být u konkrétního pacienta odstranitelné i neodstranitelné a kromě kauzální léčby je často nutná i symptomatická terapie. Furosemid je kličkové diuretikum používané v diuretické indikaci řadu desetiletí, perorálně nebo nitrožilně. V posledních letech budí zájem inhalační aplikace furosemidu (IAF). Touto cestou podání se pravděpodobně uplatňují lokální nediuretické mechanismy působení, které vedou k potlačení pocitu dušnosti různé příčiny. Přes malé množství důkazů může IAF v budoucnosti znamenat renesanci furosemidu v urgentní medicíně. Následující text shrnuje publikovanou evidenci i osobní zkušenosti autora s tímto postupem.
KAZUISTIKA
Ke 63leté diabetičce s chronickou obstrukční nemocí bronchopulmonální (CHOPN) IV. stupně byla vyslána posádka zdravotnické záchranné služby pro dušnost. Dlouhodobě aplikuje inhalačně budesonid, fenoterol a ipratropium, perorálně užívá aminofylin. Na místě si stěžuje na dvanáct hodin progredující dušnost a mírný dráždivý kašel. V posledních dvanácti hodinách aplikovala minimálně 10 dávek fenoterolu a ipratropia bez efektu. Objektivně cyanotická, klidově dušná, přítomny mírné spastické fenomény. Ventilaci zhoršuje výrazná kyfoskolióza. Dechová frekvence 28/min, periferní saturace O2 69%, tělesná teplota 37,3 °C, krevní tlak 180/100 mm Hg, tepová frekvence 105/min, glykémie 8,1 mmol/l. Na EKG inkompletní blokáda pravého raménka Tawarova, urgentní sonografie hrudníku prokázala mírnou dilatace pravé komory srdeční a dolní duté žíly, normální funkci levé komory srdeční a na plicích oboustranně A profil. Oxygenoterapie s nebulizací fenoterolu a ipratropia, nitrožilně metylprednisolon a aminofylin bez efektu. Jako farmakologické ultimum refugium bylo proto podáno nebulizací 40 mg furosemidu, průtok O210 l/min. Během 20 minut trvajícího transportu na lokální interní oddělení došlo k subjektivní úlevě o 40 %, k poklesu dechové frekvence a k úpravě oxygenace. Přednemocniční i nemocniční průběh byl bez komplikací a pacientka byla po 10 dnech obvyklé konzervativní léčby propuštěna do domácího ošetřování.
Mechanismus působení inhalačně aplikovaného furosemidu
Mechanismus ovlivnění dušnosti inhalačně podaným furosemidem ještě není zcela známý. Jedná se o efekt nesouvisející s diuretickým účinkem, který může, ale nemusí být přítomen. V experimentu bylo prokázáno, že IAF inhibuje aktivitu NaKCl kotransportéru v různých typech bronchopulmonálních receptorů (SARs, slowly adapting stretch receptors; RARs, rapidly adapting stretch receptors; C-fibre receptors) [1]. To vyvolává nárůst koncentrace intracelulárního sodíku v receptorových buňkách. Tím komplexně a nespecificky působí na vagovou aferentaci do centrálního nervového systému a vede k utlumení pocitu dušnosti, zvyšuje se tolerance apnoe a dušnosti vyvolané fyzickou zátěží [2–9]. Toto potlačení dušnosti je nezávislé na bronchodilatačním efektu, který byl do určité míry po IAF také popsán. IAF inhibuje vyplavení histaminu a leukotrienů a redukuje bronchokonstrikční aktivitu v různých klinických situacích [6, 10–12]. Konečně, IAF zlepšuje u astmatiků permeabilitu plicního epitelu [13]. Hemodynamický efekt IAF je zřejmě minimální [14].
Komplexní efekt inhalačně podaného furosemidu z něj činí kandidátní intervenci na tlumení pocitu dušnosti v různých indikacích.
Inhalační aplikace furosemidu u astma bronchiale
Bylo prokázáno, že IAF působí u astmatiků preventivně proti bronchokonstrikci indukované alergeny, cvičením, inhalací chladného vzduchu a inhalací nebulizovaného NaCl [15–18]. Byly proto realizovány klinické studie ověřující účinnost IAF u nemocných s astmatickým záchvatem.
Inokuchi et al. publikovali metaanalýzu, do které zařadili šest randomizovaných dvojitě zaslepených klinických studií ověřujících účinek IAF u nemocných s astmatickým záchvatem [19]. Celkem 157 pacientů bylo randomizováno k jednorázové inhalaci furosemidu nebo placeba. Ve dvou studiích byla dávka furosemidu 40 mg, v jedné 20 mg a ve třech, ve kterých byly randomizovány děti, byla dávka 1 mg/kg nebo 10 mg/m2. Bylo zjištěno, že inhalační podání furosemidu mělo statisticky významný příznivý efekt na potlačení astmatického záchvatu (Z 2.70; 95% CI 0,14–0,85; p = 0,007). Po inhalaci furosemidu došlo ke zlepšení vrcholové výdechové rychlosti (Z 2,23; p = 0,026) a usilovně vydechnutého objemu vzduchu za 1 sekundu (FEV1; Z 1,84; p = 0,066) ve srovnání s placebem. Ve spojení s inhalací furosemidu nebyly referovány žádné nežádoucí účinky. Naopak Hinckley et. al v randomizované klinické studii u 35 dospělých pacientů s astmatickým záchvatem neprokázali příznivý efekt inhalačního furosemidu [20].
Přestože převažují pozitivní výsledky, jejich interpretace musí být opatrná. Do studií bylo zařazeno velmi málo pacientů a efekt tohoto postupu musí být ověřen ve větších randomizovaných klinických studiích. Potenciálně se však může v budoucnu jednat o bezpečnou terapeutickou možnost u nemocných s astmatickým záchvatem rezistentním na konvenční léčbu.
Inhalační aplikace furosemidu u akutní exacerbace CHOPN
Dušnost je základním příznakem CHOPN. Její patogeneze je komplexní a nesouvisí pouze s bronchiální obstrukcí. U pokročilých forem onemocnění jsou příčiny z větší části ireverzibilní. V poslední době se proto věnuje pozornost terapeutickému ovlivnění bronchopulmonální vagové aferentaci, které by příznivě zasáhlo do řetězce vedoucímu ke vzniku pocitu dušnosti [3, 21, 22]. Jedním z možných postupů je IAF.
Jensen et al. randomizovali ve dvojitě zaslepené crossover klinické studii 20 nemocných s těžkou CHOPN k inhalačnímu podání 40 mg furosemidu a placeba a po 30 minutách provedli plicní funkční vyšetření a zátěžový test. Podání furosemidu vedlo k nárůstu tolerance zátěže a ke zlepšení některých ventilačních funkcí [4]. Ong et al. randomizovali v klinické studii s podobným crossover designem 19 pacientů se středně těžkou nebo těžkou stabilní CHOPN k inhalaci 40 mg furosemidu nebo placeba. Po aplikaci furosemidu pozorovali statisticky významné snížení pocitu dušnosti při konstantní fyzické zátěži a také mírné, ale významné zlepšení FEV1 a usilovné vitální kapacity [23]. Vahedi et al. se zaměřili na nemocné s akutní exacerbací CHOPN. Sto pacientů randomizovali k inhalačnímu podání 40 mg furosemidu nebo placeba jako přídavek ke konvenční terapii. Ve skupině s furosemidem došlo ke statisticky významnému zlepšení subjektivního pocitu dušnosti a také ke zlepšení FEV1 a k mírnému poklesu krevního tlaku [24].
Pilotní klinické studie u nemocných s CHOPN tedy naznačují, že doplnění konvenční terapie o jednorázové inhalační podání furosemidu vede ke snížení subjektivního pocitu dušnosti a také k mírnému příznivému ovlivnění dynamických plicních funkcí. Tyto slibné výsledky je však nutné ověřit v dalších klinických studiích. Důležitou otázkou je, zda je možné příznivý efekt furosemidu pozorovat pouze po jedné dávce, anebo perzistuje při opakovaném podávání. Není také známé, jestli je IAF vhodné terapeutické opatření pro dlouhodobou léčbu CHOPN v obdobích mezi exacerbacemi.
Inhalační aplikace furosemidu v paliativní léčbě dušnosti
Doposud bylo publikováno několik kazuistických sérií hodnotících inhalační podání furosemidu v paliativní péči o nemocné v terminální fázi maligního onemocnění [22, 25–27]. Výsledky jsou rozporuplné, pozitivní i neutrální a tuto indikaci, jakkoliv se jeví lákavá, je nutné ověřit v dalších klinických studiích.
Není také jasná pozice IAF v paliativní léčbě dušnosti u nenádorových onemocnění, např. v terminální fázi CHOPN, srdečního selhávání či intersticiálních plicních onemocnění [21].
Inhalační aplikace furosemidu u srdečního selhání
Intravenózní podání furosemidu je klíčovým lékem v terapii akutního srdečního selhání. Paradoxně však nemáme téměř žádné informace o jeho účinku v této indikaci po inhalační aplikaci. Newton et al. randomizovali 32 stabilních nemocných indikovaných k srdeční katetrizaci pro pokročilé srdeční selhávání k inhalačnímu podání 40 mg furosemidu nebo placeba. Po 60 minutách nebyla pozorována žádná změna tlaku v zaklínění a. pulmonalis ani dalších hemodynamických parametrů. Ve skupině s furosemidem byla ale pozorována statisticky významně vyšší diuréza (186 versus 76 ml, p = 0,020) [14].
Doposud však nebyly publikovány žádné zkušenosti s použitím inhalačního furosemidu u nemocných s plicním edémem, respektive s akutními projevy srdečního selhání. V těchto indikacích se může hemodynamická i terapeutická odpověď lišit od experimentálního podání u stabilních pacientů.
VLASTNÍ ZKUŠENOSTI
Autor doposud použil furosemid v inhalační aplikaci v rámci přednemocniční neodkladné péče u nemocných s akutní exacerbací CHOPN se závažnou klidovou dušností, s akutní respirační insuficiencí s absencí ultrasonografických známek plicního edému a systolické dysfunkce levé komory srdeční a s rezistencí na betamimetika a anticholinergika. Podán byl po aplikaci obvyklých léků podle platných doporučení běžným nebulizačním setem připojeným na standardní kyslíkovou masku v jednorázové dávce během cca 5–10 minut. Tabulka 1 shrnuje výsledky u série deseti konsekutivních pacientů. Je patrné, že podání inhalační podání furosemidu vedlo k subjektivnímu zlepšení stavu až o jednu třetinu a došlo ke statisticky významnému zlepšení oxygenace, ventilace i poklesu tepové frekvence. Všichni pacienti tolerovali podání furosemidu výborně a nepozorovali jsme žádné nežádoucí účinky terapie v následujících 24 hodinách. Po tuto dobu žádný z pacientů nevyžadoval umělou plicní ventilaci. V uvedeném způsobu léčby budeme pokračovat dál formou klinické studie.
1. Sledované parametry u deseti konsekutivních nemocných léčených v přednemocniční neodkladné péči inhalačním podáním 40 mg furosemidu 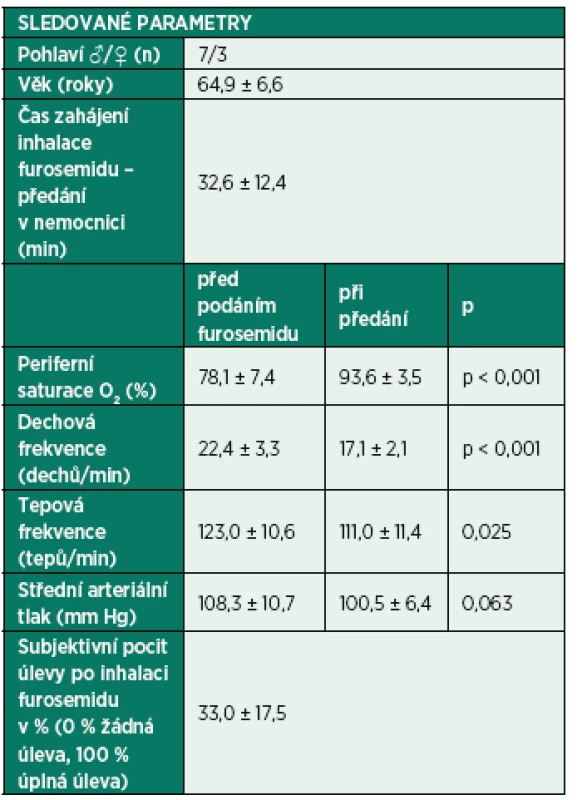
Data jsou ve formátu průměr ± směrodatná odchylka. Shrnutí současné pozice inhalační aplikace furosemidu a doporučení pro praxi
Přestože máme k dispozici až překvapivě málo klinických důkazů o účinnosti inhalačně aplikovaného furosemidu, zdá se, že jeho podání obvyklou nebulizací v dávce 20–40 mg může tlumit pocit dušnosti a dokonce zlepšit oxygenaci a ventilaci u nemocných s astmatickým záchvatem, s akutní exacerbací CHOPN nebo s terminálním nádorovým onemocněním. Tento účinek je výsledkem nediuretického působení léku, i když mírný diuretický efekt je pravděpodobně zachován i po inhalačním způsobu aplikace.
Dosavadní zkušenosti zatím ukazují, že inhalační aplikace furosemidu je bezpečná. Způsob podání nebulizací je běžně realizovatelný v urgentní přednemocniční i nemocniční péči a výhodou je i velmi nízká cena.
I přes nízkou evidenci o jednoznačné účinnosti se proto domnívám, že IAF lze již nyní v klinické praxi použít v terapii astmatického záchvatu a akutní exacerbace CHOPN v případě rezistence na konvenční farmakoterapii a pokusit se zabránit nutnosti umělé plicní ventilace. Ze stejných argumentů se IAF může stát i další modalitou volby v paliativní terapii dušnosti.
S využitím v terapii plicního edému při akutním srdečním selhání nebyly doposud publikovány žádné zkušenosti a zde je použití IAF rezervováno pouze pro režim klinické studie.
Otázkou zůstává, zda je IAF účinná pouze při jednorázovém podání, anebo bude efektivní i dlouhodobé podávání a jaké je správné dávkování.
Pokud bude účinek u různých příčin dušnosti prokázán, může se z inhalačně aplikovaného furosemidu stát „univerzální“ lék na dušnost zejména v situacích přednemocniční neodkladné péče, kde v často v prvním kontaktu nejsme schopni spolehlivě rozlišit klasické dilema, zda je dušnost kardiální či plicní.
Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autor prohlašuje, že nemá střet zájmů v souvislosti s tématem práce.
Do redakce došlo dne 21. 1. 2016.
Do tisku přijato dne 12. 11. 2016.
Adresa pro korespondenci:
MUDr. Roman Škulec, Ph.D.
e-mail: skulec@email.cz
Sources
1. Greger, R., Wangemann, P. Loop diuretics. Ren. Physiol., 1987, 10, 3–4, p. 174–183.
2. Nishino, T., Ide, T., Sudo, T., Sato, J. Inhaled furosemide greatly alleviates the sensation of experimentally induced dyspnea. Am. J. Respir. Crit. Care Med., 2000, 161, 6, p. 1963–1967.
3. Nishino, T. Dyspnoea: Underlying mechanisms and treatment. Br. J. Anaesth., 2011, 106, 4, p. 463–474.
4. Jensen, D., Amjadi, K., Harris-McAllister, V., Webb, K. A., O’Donnell, D. E. Mechanisms of dyspnoea relief and improved exercise endurance after furosemide inhalation in COPD. Thorax, 2008, 63, 7, p. 606–613.
5. Nishino, T. Pathophysiology of dyspnea evaluated by breath-holding test: studies of furosemide treatment. Respir. Physiol. Neurobiol., 2009, 167, 1, p. 20–25.
6. Sudo, T., Hayashi, F., Nishino, T. Responses of tracheobronchial receptors to inhaled furosemide in anesthetized rats. Am. J. Respir. Crit. Care Med., 2000, 162, 3, p. 971–975.
7. Undem, B. J. The Role of Vagal Afferent Nerves in Chronic Obstructive Pulmonary Disease. Proc. Am. Thorac. Soc., 2005, 2, 4, p. 355–360.
8. Sant’Ambrogio, G., Widdicombe, J. Reflexes from airway rapidly adapting receptors. Respir. Physiol., 2001, 125, 1–2, p. 33–45.
9. Lee, L. Y., Pisarri, T. E. Afferent properties and reflex functions of bronchopulmonary C-fibers. Respir. Physiol., 2001, 125, 1–2, p. 47–65.
10. Niven, A. S., Argyros, G. Alternate treatments in asthma. Chest, 2003, 123, 4, p. 1254–1265.
11. Corboz, M. R., Ballard, S. T., Gao, H. et al. Differential effects of furosemide on porcine bronchial arterial and airway smooth muscle. J. Appl. Physiol., 2000, 89, 4, p. 1360–1364.
12. Saitoh, Y., Sasaki, F., Sakai, T. et al. Effects of inhaled furosemide after indomethacin premedication on bronchial hyperresponsiveness in patients with chronic congestive heart failure. Nihon. Kyobu. Shikkan. Gakkai. Zasshi., 1994, 32, 5, p. 413–417.
13. Bhure, U. N., Bhure, S. U., Bhatt, B. M. et al. Lung epithelial permeability and inhaled furosemide: added dimensions in asthmatics. Ann. Nucl. Med., 2009, 23, 6, p. 549–557.
14. Newton, P. J., Davidson, P. M., Krum, H., Ollerton, R., Macdonald, P. The acute haemodynamic effect of nebulised frusemide in stable, advanced heart failure. Heart. Lung. Circ., 2012, 21, 5, p. 260–266.
15. Cavaliere, F., Masieri, S. Furosemide protective effect against airway obstruction. Curr. Drug. Targets., 2002, 3, 3, p. 197–201.
16. Bianco, S., Pieroni, M. G., Refini, R. M., Rottoli, L., Sestini, P. Protective effect of inhaled furosemide on allergen-induced early and late asthmatic reactions. N. Engl. J. Med., 1989, 321, 16, p. 1069–1073.
17. Munyard, P., Chung, K. F., Bush, A. Inhaled frusemide and exercise-induced bronchoconstriction in children with asthma. Thorax, 1995, 50, 6, p. 677–679.
18. Seidenberg, J., Dehning, J., von der Hardt, H. Inhaled frusemide against cold air induced bronchoconstriction in asthmatic children. Arch. Dis. Child., 1992, 67, 2, p. 214–217.
19. Inokuchi, R., Aoki, A., Aoki, Y., Yahagi, N. Effectiveness of inhaled furosemide for acute asthma exacerbation: a meta-analysis. Crit. Care, 2014, 18, 6, p. 1–6.
20. Hinckley, J. Inhaled furosemide in the treatment of acute exacerbations of asthma. Acad. Emerg. Med., 2000, 7, 10, p. 1167.
21. Uronis, H. E., Currow, D. C., Abernethy, A. P. Palliative management of refractory dyspnea in COPD. Int. J. Chron. Obstruct. Pulmon. Dis., 2006, 1, 3, p. 289–304.
22. Kallet, R. H. The role of inhaled opioids and furosemide for the treatment of dyspnea. Respir. Care, 2007, 52, 7, p. 900–910.
23. Ong, K. C., Kor, A. C., Chong, W. F., Earnest, A., Wang, Y. T. Effects of inhaled furosemide on exertional dyspnea in chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med., 2004, 169, 9, p. 1028–1033.
24. Sheikh Motahar Vahedi, H., Mahshidfar, B., Rabiee, H. et al. The adjunctive effect of nebulized furosemide in COPD exacerbation: a randomized controlled clinical trial. Respir. Care, 2013, 58, 11, p. 1873–1877.
25. Shimoyama, N., Shimoyama, M. Nebulized furosemide as a novel treatment for dyspnea in terminal cancer patients. J. Pain. Symptom. Manage., 2002, 23, 1, p. 73–76.
26. Kohara, H., Ueoka, H., Aoe, K. et al. Effect of nebulized furosemide in terminally ill cancer patients with dyspnea. J. Pain. Symptom. Manage, 2003, 26, 4, p. 962–967.
27. Wilcock, A., Walton, A., Manderson, C. et al. Randomised, placebo controlled trial of nebulised furosemide for breathlessness in patients with cancer. Thorax, 2008, 63, 10, p. 872–875.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2017 Issue 2-
All articles in this issue
- Inhalational application of furosemide – the breathlessness panacea?
- Long-term treatment and addiction to opioids
- Dexmedetomidine and its use in anaesthesia and intensive care
- Paediatric airway management update: Myths and traditions versus evidence-based medicine (EBM)
- The physician and the law II – forensic medical experts and expert institutions
- The correlation between the citrate contained in the transfused blood products and the plasma concentration of ionised calcium in cardiac surgery patients
- Anaphylactic reaction to sugammadex administered at the end of surgery
- Impact of night work on the QT interval in nurses and doctors (EQUINDOC trial)
- Deep vein thrombosis and pulmonary embolism in pregnancy
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Deep vein thrombosis and pulmonary embolism in pregnancy
- Dexmedetomidine and its use in anaesthesia and intensive care
- Inhalational application of furosemide – the breathlessness panacea?
- The physician and the law II – forensic medical experts and expert institutions
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

