-
Medical journals
- Career
Patofyziologie a diagnostika anafylaktoidního těhotenského syndromu
: A. Černý; A. Pařízek; Patrik Šimják
: Gynekologicko-porodnická klinika Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy v Praze
: Anest. intenziv. Med., 26, 2015, č. 5, s. 291-296
: Obstetric anaesthesia and analgesia - Review Article
Embolie plodovou vodou (nebo také anafylaktoidní těhotenský syndrom) je sice vzácná, ale smrtelná komplikace v těhotenství. Příznaky můžou být od lehkých až po náhlou srdeční zástavu až smrt. Embolie plodovou vodou patří v rozvinutém světě mezi nejčastější příčiny mateřské úmrtnosti. Základem je průnik plodové vody nebo částic v ní rozpuštěných do krevního oběhu matky. Předpokládá se, že tady částice působí zejména na mechanismu imunitní reakce. Výsledkem plně rozvinutého syndromu je široké spektrum klinických projevů, ze kterých vynikají zejména komplikace kardiovaskulární, respirační a hematologické. Léčba těchto stavů vyžaduje akutní mezioborovou spolupráci. Mortalita na tuto těhotenskou patologii v posledních letech klesá. Stává se tak v důsledku zvyšování kvality intenzivní péče a zařazováním lehkých případů do registrů perinatologických patologií.
Klíčová slova:
embolie plodovou vodou – anafylaktický šok – sepseÚVOD
Embolie plodovou vodou (dále také AFE – amniotic fluid embolism) je vzácná těhotenská komplikace s častými smrtelnými následky. Proti AFE neexistuje žádný způsob prevence a její výskyt nemůžeme obvykle nijak předvídat. AFE proto patří mezi nejzávažnější a nejčastější příčiny morbidity a mortality v perinatologii ve vyspělých zemích. Článek má za úkol nastínit obci porodníků, anesteziologů a intenzivistů podstatu AFE a také poskytnout stručný souhrn péče o rodičku postiženou AFE. Při řešení komplikací spojených s AFE je nevyhnutný mezioborový přístup [1, 2].
PATOFYZIOLOGIE, PATOGENEZE
Základním předpokladem vzniku AFE je průnik některé ze složek plodové vody do krevního oběhu matky. Částice můžou být tuhé – lanugo, epitelie, mázek, hlen anebo solubilní – prostaglandiny, aktivátory komplementu, imunologické faktory. Nejčastějším místem vstupu do oběhu matky jsou mikroskopické lacerace dolního děložního segmentu, otevřená rána ve venózních pleteních v okolí dělohy nebo oblast placentární inzerce. Předpokladem je tlakový gradient podporující přechod plodové vody do oběhu. Po průniku plodové vody do oběhu matky pozorujeme určitou latenci do vzniku obtíží [3].
Přesný mechanismus AFE není známý. Předpokládá se, že v oběhu způsobuje plodová voda:
- mechanickou obstrukci cév (embolizaci),
- zánětlivou odpověď organismu,
- imunologickou reakci organismu (aktivace komplementu a koagulační kaskády).
Plodová voda, a látky v ní rozpuštěné, jsou běžné v oběhu i u fyziologických těhotných a rodiček. Proč se u nich AFE nerozvíjí, není známo. Některé práce uvádějí, že se příznaky syndromu AFE nerozvinuly ani u pokusných zvířat, kterým bylo aplikováno větší množství plodové vody nitrožilně [4].
Z klinického hlediska plně rozvinutý AFE připomíná spíše prudkou alergickou reakci, anafylaxi nebo sepsi než embolickou příhodu. Nerozvíjí se ale kožní příznaky ani zvýšení tělesné teploty. V současnosti se proto označuje spíše jako „anafylaktoidní těhotenský syndrom“ [4].
Příznaky AFE obvykle nastupují v peripartálním období, nejdéle do 2–4 hodin od přechodu plodové vody do oběhu, respektive porodu plodu [3].
Průběh příznaků AFE se rozděluje zpravidla do 2 fází:
1. akutní fáze – prvních asi 30 minut po přestupu agens do oběhu matky. Plodová voda s částicemi způsobí plicní vazokonstrikci. Předpokládá se, že se jedná o reakci způsobenou endotelinem [3]. Na ní nasedá plicní hypertenze se srdečním selháváním, systémová hypotenze a hypoxémie matky. Akutní hypoxémie vznikající v důsledku hypoperfuze plic může vyústit až v infarkt myokardu. Vznik infarktu myokardu podporuje i přímá přítomnost faktorů z plodové vody působících na myokard depresivně [5]. Současně solubilní částice v plodové vodě zvyšují sekvestraci endotelu plicních kapilár, a vedou tak ke vzniku nekardiálního plicního edému s bronchospasmem. V tomto stadiu umírá většina nepřeživších.
2. pozdní fáze – na základě ischémie myokardu se rozvíjí levostranné srdeční selhání [3], vzniká kardiogenní šok. Následně vzniklá vazodilatace způsobí prohloubení závažné hypotenze. Primární plicní postižení se často rozvíjí do ARDS [6].
Plodová voda obsahuje kromě jiných také srážecí faktory II, VII a X a tkáňový faktor. Tyto mohou spustit koagulační kaskádu s intravaskulární konzumpcí koagulačních faktorů. Vzniklá koagulopatie může vyústit v plně rozvinutý časný DIC a život ohrožující krvácení s následným hemoragickým šokem.[3].
Z důvodu hypoxie u matky a plodu může dojít ke vzniku neurologických dysfunkcí, a to jak u plodu, tak u matky. Ty jsou jedny z nejčastějších dlouhotrvajících následků AFE.
INCIDENCE
Neexistuje přesný údaj o incidenci AFE. Nejpřesnější údaje jsou z národních registrů AFE.
V současnosti známe jen 2 samostatné a plnohodnotné registry AFE – The United Kingdom Amniotic Fluid Embolism Register ve Velké Británii (součást The United Kingdom Obstetric Surveillance System) [10] a National Registry for Amniotic Fluid Embolism v USA [4].
V jiných zemích data vychází z retrospektivních studií zkoumajících obecné registry porodů (např. Australasian Maternity Outcomes Surveillance System – AMOSS, Canadian Perinatal Surveillance System atd.).
Do registrů se v USA a ve Velké Británii zadávají pacientky vykazující následující příznaky:
- akutní hypotenze nebo srdeční zástava, arytmie;
- akutní hypoxie (dyspnoe, cyanóza) nebo zástava dechu;
- nevysvětlitelná koagulopatie (DIC, fibrinolýza, hemoragie);
- ztráta vědomí, křeče, excitace, otupění, dušnost;
- fetální mistress;
- výskyt v průběhu porodu, císařského řezu, dilatace nebo evakuace dutiny děložní nebo v časném šestinedělí (asi do 30 minut po porodu).
Nezbytná je současná absence jiného možného vysvětlení vzniklého stavu, nebo pokud AFE diagnostikujeme u pacientek post mortem nálezem fetálních buněk nebo lanuga v plicích [2, 4].
Plně klinicky vyjádřená AFE se odhadem objevuje v 1 : 8 000 až 1 : 80 000 těhotenství [4]. Velký rozptyl je daný širokým spektrem symp-tomů a nejednoznačnou diagnostikou u žen, které přežijí.
Incidence se liší podle zvolené metody sběru dat. U prospektivních studií je popsán výskyt AFE 1,9 až 6,1 na 100 000 těhotných, u retrospektivních 5,5 až 6,1 na 100 000 těhotných [7].
Ve Spojeném království je incidence 1,9/100 000 porodů, v Nizozemsku 2,5/100 000 porodů, v USA 5,5/100 000 porodů, v Kanadě 6,0/100 000 porodů, v Austrálii průměrně 6,1/100 000 porodů [7].
MORTALITA, MORBIDITA
Mateřská mortalita v souvislosti s AFE kolísá mezi hodnotami 0,5 až 1,7 úmrtí na 100 000 porodů ve vyspělých zemích (0,5 ve Švédsku a ve Spojeném království, 0,7 v Kanadě, 1,5 v Austrálii a 1,0–1,7 v USA). V rozvojových zemích je mateřská úmrtnost mezi 1,8 až 5,9 na 100 000 porodů [8].
Ve Velké Británii jde o pátou nejčastější příčinu úmrtí těhotných. Ve Francii umírá 13 % těhotných s rozvinutým AFE, je to třetí nejčastější příčina mateřské mortality. V Singapuru je uváděná mortalita AFE 30%, zároveň je to nejčastější příčina úmrtí těhotných žen [9].
V porovnání se staršími studiemi mateřská mortalita v dnešní době klesá – je to následek pokroku v léčbě a z důvodu přesnější diagnostiky stavů připomínajících AFE [8]. Jednoznačně se však mortalita a morbidita snižují také z důvodu pokročilé mezioborové spolupráce.
PREDIKCE, RIZIKOVÉ FAKTORY
Přesná predikce výskytu AFE není dosud možná. Na základě hodnocení registrů perinatologických patologií (Austrálie, Kanada, Nizozemsko, UK, USA) byly zjištěny některé faktory zvyšující relativní riziko (dále také RR) vzniku AFE [7]. Jednotlivé registry mají rozdílná kritéria pro sbírání dat. To následně způsobuje rozdíly v hodnotách z různých registrů.
V literatuře se popisují 4 skupiny faktorů způsobujících zvýšení RR pro AFE:
- Anamnestické faktory
- Těhotenské faktory
- Indukce porodu
- Porodní faktory (poznámka – menší plod, např. IUGR (Intrauterine Growth Restriction) nebo předčasný porod, vykazuje RR nižší [5])).
Podrobnější rozdělení včetně některých hodnot relativního rizika (tab. 1).
1. Přehled rizikových faktorů a relativních rizik pro vznik AFE 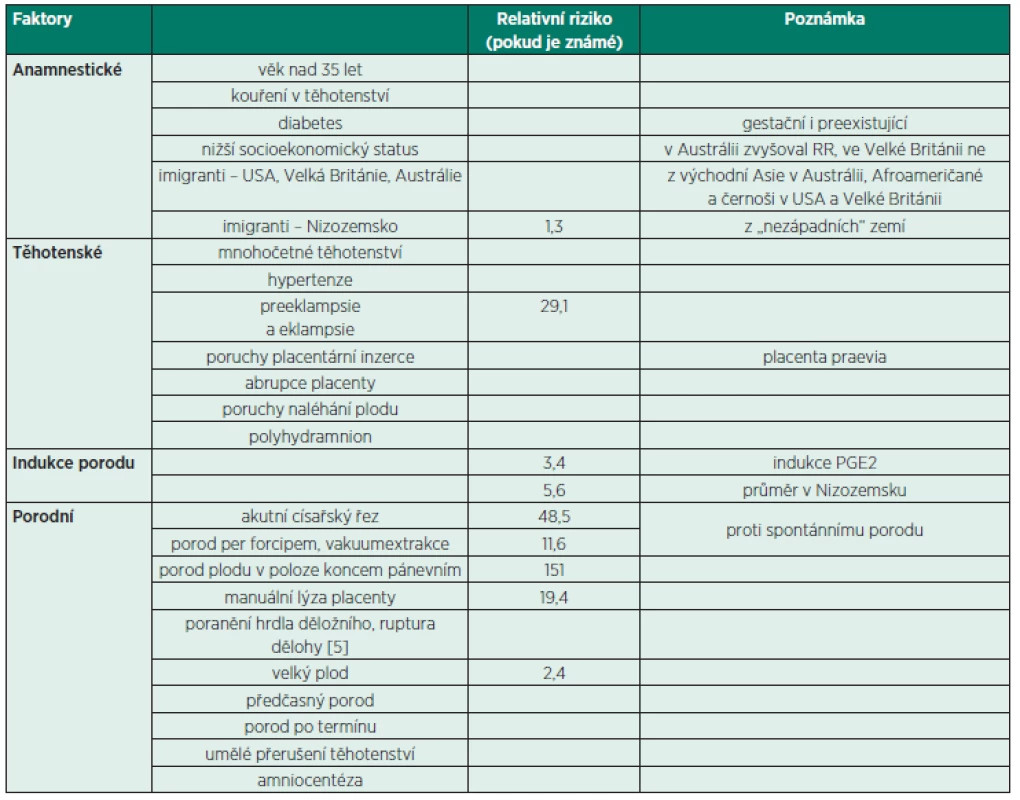
Je popsán i vznik AFE po výkonech nebo traumatech na těhotné děloze – např. extrakce cerkláže stehu nebo po skrytém abdominálním traumatu [6]. Vyšší výskyt je také vázán na mužské pohlaví plodu a Rh izoimunizaci [4].
Mortalitu zvyšují i následné faktory: vyšší věk rodičky (nad 35 let), multiparita, kouření v těhotenství, nižší socioekonomický status, černošská rasa nebo obecně etnická menšina v dané společnosti, indukce porodu a způsob porodu (operační ukončení zvyšuje relativní riziko) [7].
DIAGNOSTIKA
Diagnostika je možná jen na základě příznaků po vyloučení jiných stavů (tzv. diagnostika per exclusionem!), které mají podobné příznaky. Jednoznačnou diagnózu vyslovujeme jen při pitvě po nálezu částic plodové vody v plicních kapilárách (epitelie, lanugo, mekonium, mázek) [1].
Mezi příznaky závažné AFE patří (v závorce procentuální výskyt, převzato z dostupné literatury):
- hypotenze (100 % případů),
- fetální distress (100 %, pokud se AFE vyskytne před vybavením plodu),
- plicní edém nebo ARDS (93 %),
- kardiopulmonální zástava (87 %),
- cyanóza (83 %),
- koagulopatie (83 %),
- dyspnoe (49 %),
- poruchy vědomí nebo záchvaty (třes, křeče, připomínající epileptický záchvat atd. – 48 %),
- atonie dělohy (23 %),
- bronchospasmus (15 %),
- tranzitorní hypertenze (11 %),
- kašel (7 %),
- bolesti hlavy (7 %),
- bolesti na hrudníku (2 %) [3].
Podobné příznaky mají i stavy jako alergie/anafylaxe, kardiopulmonální selhání, sepse, plicní embolie (jiná než AFE), aspirace žaludečního obsahu, eklamptický záchvat, ischemická choroba srdeční, hemoragie, transfuzní reakce, toxicita anestetik apod. Je proto nezbytné tyto stavy postupně vyloučit.
V současnosti neznáme absolutně přesný laboratorní test na AFE u přeživších. K laboratorní diagnostice se odebírá periferní krev matky, bronchiální sekret nebo krev z centrálního venózního katétru.
Z běžně zjistitelných laboratorních markerů, které můžeme detekovat u přeživších, patří zejména součásti komplementu C3 a C4, u kterých dochází k poklesu hladin po konzumpci při vzniku koagulopatií, zejména pak u žen s nějakou alergickou anamnézou.
Dále můžeme zjišťovat hladinu sérové tryptázy – uvolňuje se z mastocytů společně s histaminem (ten je v malé míře detekovatelný v moči) při anafylaktoidní reakci, samotné příznaky ale nezpůsobuje [11].
Z dalších markerů je to Zn-koproporfyrin (ZnCP-1), obsažený v mekóniu, dále STN (sialosyl Tn) obsažený v hlenu a mekóniu. STN se v poslední době ukazuje spíše jako prognostický faktor mortality po AFE [12].
Z dalších proteinů jsou to zejména látky produkované fetálními buňkami do plodové vody – tumor markery jako SCC (squamous cell carcinoma), CEA (carcinoembryonic antigen), CA125, hCG beta apod. [12].
Novým významným diagnostickým parametrem se zdá být insulin-like growth factor binding protein-1 (IGFBP-1), jehož výrazně zvýšené hladiny byly prokázány u pacientek po AFE (jeho hladina v plodové vodě je asi 150krát vyšší než v mateřském séru) [13, 14].
TERAPIE
Terapie musí být neodkladná a dostatečně agresivní. Ideální je mezioborová spolupráce porodníka, anesteziologa a případně hematologa společně se středním zdravotnickým personálem (zkušená porodní asistentka s anesteziologickou sestrou).
Porodník má za cíl péči o matku a nenarozený plod z pohledu porodnického – tady je ale nutno si uvědomit, že v případě ohrožení života matky má její život jasnou prioritu před životem plodu, který je až sekundární prioritou. Pokud ale pokusy o resuscitaci rodičky nevedou k zlepšení nebo stabilizaci jejího stavu, je vhodné provést akutní císařský řez, v případě nutnosti i přímo na porodním boxu.
Z databáze z Velké Británie vyplývá, že porodník byl průměrně přítomen do 0,5 minuty od prvních projevů AFE (od 0 do 166 minut) a anesteziolog průměrně do 1 minuty (od 0 do 198 minut) [15].
Terapie AFE je především podpůrná – podpora životních funkcí, řešení příčiny a následně vzniklých patologií a komplikací. Z pohledu intenzivisty má 4 základní cíle:
- zajištění dýchacích cest, oxygenace organismu;
- udržení srdečního výdeje a krevního tlaku;
- stabilizace vnitřního prostředí a korekce jeho poruch;
- terapie koagulopatie.
Při podezření na AFE je proto nutno okamžitě:
- podat kyslík maskou;
- kontinuálně hodnotit vitální funkce včetně EKG;
- přivolat zkušeného porodníka a anesteziologa, k nim dostatečný počet středního zdravotnického personálu;
- zajistit vedení dokumentace (vitální funkce, podané léky, jiné výkony). Poznámky vede 1 osoba (nejlépe lékař, ale i porodní asistentka nebo anesteziologická sestra) čitelně a srozumitelně, podle přesné časové posloupnosti.
Ve spolupráci porodník-anesteziolog-sestra dále
Dýchací cesty
- Udržovat jejich průchodnost, případně zvážit orotracheální intubaci a umělou plicní ventilaci.
- Při známkách plicního edému vhodný PEEP.
- CAVE – při anémii matky může i přesto dojít k hypoxémii plodu, je proto vhodné zvážit časné podání transfuze.
- K léčbě bronchospasmu lze použít beta2-sympatomimetika.
Krevní oběh
- Pokud nastane AFE ještě před porodem, tak uložit matku na levý polobok (prevence aortokavální komprese). Lze využít i sklopení pacientky do Trendelenburgovy polohy jako prvotní korekci vzniklé hypotenze, ta vede rovněž k zvýšení preloadu.
- Zajistit odpovídající intravenózní přístupy, je indikováno zavedení centrálního žilního katétru a invazivní měření arteriálního tlaku (ideálně před rozvojem DIC).
- Volumoterapie i. v. krystaloidy a koloidy (CAVE podávání tekutin při zhoršování plicního edému!).
- Monitorovat krevní obraz a koagulační parametry (očekáván DIC) – ideální je využití rychlých bedside testů dostupných na porodních nebo operačních sálech.
- ECHO vyšetření.
Koagulace
- Aktivně řešit vznikající krvácivý stav – erymasa (pokud lze, tak deleukotizovaná), plazma, fibrinogen, trombonáplavy, včasné podání rekombinantního faktoru VII. Obecně postupovat podle doporučených postupů pro řešení peripartálního život ohrožující krvácení.
Další postup
- Okamžitě (tj. ideálně do 3–4 minut od vzniku akutního stavu [16]) ukončit těhotenství (ukončení těhotenství následně rozšíří možnosti léčby a zjednoduší případnou resuscitaci, např. snížením útlaku dolní duté žíly těhotnou dělohou).
- Podle stavu nasadit kontinuální vazopresorickou podporu noradrenalinem, udržení perfuzních tlaků.
- Při srdečním selhávání nasadit inotropní podporu srdečního oběhu (dobutamin).
- Podání hydrokortizonu v dávce až do 2 g/24 hod redukuje plicní vazospasmus a plicní edém a potencuje srdeční odpověď na katecholaminy.
- Konzultovat léčbu DIC s hematologem (podávání krevních derivátů, eventuálně heparinu v hyperkoagulační fázi DIC).
- Kontrolovat krvácení z dělohy (podání uterotonik, kontrola poporodního krvácení, ultrazvukové vyšetření dělohy – podle postupů pro řešení peripartálního život ohrožujícího krvácení.
- Další diferenciální diagnostika příčin kardiopulmonálního selhání nebo DIC a vyšetření k určení příčiny vzniklého stavu (komplement C3 a C4 a jiné laboratorní markery – viz Diagnostika na s. 294) [1, 18].
Podle dostupnosti a v případě kritického stavu oběhu lze zvážit:
- intraoperační rekuperaci krve („cell salvage“),
- pokusit se o eliminaci „spouštěčů“ z oběhu rodičky (hemofiltrace, plazmatická výměna),
- mechanickou srdeční podporu,
- intraaortální balonkovou kontrapulzaci [16, 17].
ZÁVĚR
AFE je závažná komplikace, která vyžaduje sledování a další studium. Zde je na místě otázka, zda právě nenadešel ten správný čas vytvořit i v našich podmínkách národní registr mapující všechny porody v zemi a patologie vzniklé v průběhu a krátce po porodu.
Zhodnocením dat můžeme také přispět k vysvětlení mechanismu embolizace plodové vody do oběhu matky a vzniku život ohrožujících klinických projevů. Zároveň nám registr poskytne obraz o všech jiných patologiích v české perinatologii.
Poznámka:
Jedná se o upravený článek, původně publikovaný v časopise Česká gynekologie [2014, 79, č. 4, s. 255–259], autorů Černý A., Pařízek A., Šimják P.: Embolie plodovou vodou – přehledovýčlánek.
Adresa pro korespondenci:
MUDr. Andrej Černý
Nevanova 1060/34
163 00 Praha 17
e-mail: andrej.cerny@gmail.com
Sources
1. Benson, M. D. Current concepts of immunology and diagnosis in amniotic fluid embolism. Clin. Dev. Immunol., 2012, 946576, s. 7.
2. Knight, M., Berg, C., Brocklehurst, P. et al. Amniotic fluid embolism incidence, risk factors and outcomes: a review and recommendations. BMC Pregnancy and Childbirth, 2012, 12, 11 s. Dostupné na www: http://www.biomedcentral.com/1471-2393/12/7.
3. Kobayashi, H., Naruse, K., Sado, T. et al. Search for amniotic fluid-specific markers: novel biomarker candidates for amniotic fluid embolism. The Open Women’s Health Journal, 2011, 5, s. 7–15.
4. Clark, S. L., Hankins, G. D. V., Dudley, D. A. et al. Amniotic fluid embolism: Analysis of the national registry. Am. J. Obstet. Gynecol., 1995, 172, s. 1158–1169.
5. Thongrong, C., Kasemsin, P., Hofmann, J. P. et al. Amniotic fluid embolism. Int. J. Crit. Inj. Sci., 2013, 3, p. 51–57.
6. Tuffnell, D. J. Amniotic fluid embolism. Curr. Opin. Obstet. Gynecol., 2003, 15, s. 119–122.
7. Knight, M., Tuffnell, D., Brocklehurst, P. et al. Incidence and risk factors for amniotic-fluid embolism. Obstet gynecol., 2010, 115, s. 910–917.
8. Kramer, M. S., Rouleau, J., Liu, S. et al. Amniotic fluid embolism: incidence, risk factors, and impact on perinatal outcome. BJOG, 2012, 119, s. 874–879.
9. McDonnell, N. J., Percival, V., Peach, M. J. Amniotic fluid embolism: a leading cause of maternal death yet still a medical conundrum. Int. J. Obstet. Anesth., 2013, 22, s. 329–336.
10. Pařízek, A. Embolie plodovou vodou. In Pařízek, A. Kritické stavy v porodnictví. Kamenice: Mother-Care-Centrum Publishing, 2012, s. 108–110.
11. Tuffnell, D. J. United Kingdom amniotic fluid embolism register. BJOG, 2005, 112, s. 1625–1629.
12. Legrand, M., Rossignol, M., Dreux, S. et al. Diagnostic accuracy of insulin-like growth factor binding-protein-1 for amniotic fluid embolism. Crit. Care Med., 2012, 40, s. 2059–2063.
13. Conde-Agudelo, A., Romero, R. Amniotic fluid embolism: an evidence based review. Am. J. Obstet. Gynecol., 2009, 201, s. 445, e1-445.13.
14. Busardo, F. P., Frati, P., Zaami, S. et al. Amniotic fluid embo-lism patophysiology suggests the new diagnostic armamentarium: β-tryptase and complement fractions C3-C4 are the indispensable working tools. Int. J. Mol. Sci., 2015, 16, p. 6557–6570.
15. Fitzpatrick, K. E., Tuffnell, D., Kurinczuk, J. J. et al. Incidence, risk factors, management and outcomes of amniotic-fluid embolism: a population-based cohort and nested case-control study. BJOG, 2015, 12. Dostupné na www: www.bjog.org.
16. Firstenberg, M. S., Abel, E., Blais, D. et al. Temporary extracorporeal circulatory support and pulmonary embolectomy for catastrophic amniotic fluid embolism. Heart Surg. Forum, 2011, 14, s. 157–159.
17. Dobbenga-Rhodes, Y. A. Responding to amniotic fluid embolism. AORN J., 2009, 89, s. 1079–1088.
18. Bláha, J. Trombembolické příhody v porodnictví. In Hájek, Z.et al. Porodnictví. 3. přepracované a doplněné vydání. Praha: Grada Publishing, a. s., 2014, s. 401–411. ISBN 978-/80-247-4529-9.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2015 Issue 5-
All articles in this issue
- Survey of transfusion practices in Jehovah’s Witnesses
- Comparison of heparin and citrate anticoagulation during continuous veno-venous haemodialysis (CVVHD) in critically ill children – prospective, crossover study
- Echocardiography for preload and fluid responsiveness assessment
- Practice advisory on anesthetic care for magnetic resonance imaging
- Patophysiology and diagnostics of anaphylactic syndrome of pregnancy
- The 140th anniversary of the opening of the “St. Apollinaire’s” National Maternity Hospital
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Comparison of heparin and citrate anticoagulation during continuous veno-venous haemodialysis (CVVHD) in critically ill children – prospective, crossover study
- Patophysiology and diagnostics of anaphylactic syndrome of pregnancy
- Echocardiography for preload and fluid responsiveness assessment
- Practice advisory on anesthetic care for magnetic resonance imaging
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

