-
Medical journals
- Career
Echokardiografie – měření srdečního výdeje u kriticky nemocných
: M. Lipš 1; J. Krupička 2; J. Kořínek 3; J. Kunstýř 1
: Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF, Univerzita Karlova v Prazea Všeobecná fakultní nemocnice v Praze 1; III. interní klinika 1. LF, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze 2; II. interní klinika 1. LF, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze 3
: Anest. intenziv. Med., 26, 2015, č. 4, s. 228-232
:
Zhodnocení hemodynamiky s cílem zjistit dostatečnost orgánové perfuze a dodávky kyslíku do tkání patří k důležitým diagnostickým procesům v péči o kriticky nemocné. Měření srdečního výdeje se v posledních desetiletích stalo zásadním tématem intenzivní medicíny a s tím souvisí rozvoj různých metodik umožňujících ať již intermitentní či kontinuální monitorování srdečního výdeje. Echokardiografie nabízí relativně přesnou a přitom neinvazivní možnost taková měření u pacienta opakovaně uskutečnit. Pro smysluplné využití echokardiografie k měření srdečního výdeje je nutné porozumět základním principům ultrazvukových technik, uvědomit si nejen výhody, ale i limity a možné chyby samotného měření či následné interpretace výsledků.
Klíčová slova:
echokardiografie – tepový objem – srdeční výdej – pulzní dopplerÚVOD
Transtorakální echokardiografie je v prostředí jednotek intenzivní péče stále populárnější, protože umožňuje získat neinvazivní cestou přímo u lůžka během několika minut základní informace o hemodynamice pacienta [1]. Hlavní výhodou echokardiografie je množství a komplexní charakter informací, které jsme touto diagnostickou metodou schopní získat [2]. Je však nutné si uvědomit limity echokardiografie dané možností přístrojové techniky (nedostatečně kvalitní zobrazení, artefakty), zvláštnostmi pacientů na jednotce intenzivní péče (vynucená supinní poloha, umělá plicní ventilace, podkožní emfyzém, drény) a v neposlední řadě zkušeností, schopnostmi a racionalitou vyšetřujícího. S postupným zdokonalováním přístrojové techniky se snižuje procento prakticky nevyšetřitelných pacientů, nicméně i nadále existuje skupina pacientů, kteří jsou echokardiograficky vyšetřitelní velmi obtížně.
Spolu s dalšími dostupnými systémy monitorování srdečního výdeje (plicnicový katétr, transpulmonární diluční techniky, kontinuální jícnové dopplerovské vyšetření) je echokardiografie dnes již zavedenou a odbornými společnostmi doporučovanou metodou [3]. Na rozdíl od dilučních technik měření srdečního výdeje, přítomnost významné trikuspidální regurgitace u vyšetřovaného pacienta nesnižuje přesnost echokardiografického měření [4].
MĚŘENÍ SRDEČNÍHO VÝDEJE
V intenzivní péči je hodnota srdečního výdeje (či spíše jeho dostatečnost vzhledem k aktuálním potřebám pacienta) častým terapeutickým cílem, zvláště u pacientů v šokovém stavu. Pomocí echokardiografie – jak transtorakální, tak jícnové – můžeme získat nejen absolutní hodnotu srdečního výdeje, ale současně stanovit všechny tři základní determinanty tepového objemu (předtížení, dotížení, kontraktilitu-stažlivost). Dvourozměrná echokardiografie (2D) umožňuje zobrazit srdeční struktury s možností zhodnocení jejich anatomie, velikosti a funkce. K měření srdečního výdeje nemůžeme využít 2D zobrazení pro nepřesné detekce hranic endokardu (na rozdíl od zhodnocení kontraktility a výpočtu ejekční frakce). Budoucností je třírozměrné zobrazení se zlepšením výpočtu objemů krve v jednotlivých srdečních oddílech, zatím je však tato metoda spíše doménou kardiologů v echokardiografických laboratořích, případně na operačních sálech kardiochirurgie.
V praxi pro stanovení tepového objemu používáme dopplerovský způsob vyšetření. Obecně platí, že srdeční výdej, respektive tepový objem (stroke volume-SV) můžeme měřit v kterémkoliv místě kardiovaskulárního systému s laminárním prouděním krve. Úskalím správného výpočtu je nutnost stanovení plochy takovéto anatomické struktury. Vzhledem k tomu, že mitrální a i trikuspidální ústí mají poměrně komplikovanou strukturu, kdy plocha ústí není jednoduše měřitelná, tak prakticky používáme k měření tepového objemu výtokové trakty obou srdečních komor, případně obě hlavní tepny (aorta, plicní artérie). Změříme-li plochu průřezu výtokového traktu levé komory (S-LVOT), pak její násobek s integrálem rychlosti proudění v průběhu jeho trvání (VTI – velocity time integral) v systole je roven tepovému objemu. Z následující rovnice jsme schopni vypočítat tepový objem, vynásobením tepovou frekvencí (TF) získáme srdeční výdej (CO) [5]:
SV (ml) = VTI (cm) . S-LVOT (cm2)
CO (ml/min) = SV(ml) . TF (min-1)
Prakticky měření provádíme tak, že umístíme vzorkovací objem pulzního doppleru (PW) v LVOT zhruba do vzdálenosti 1 cm od anulu aortální chlopně (nutno v místě, kde provádíme měření průměru LVOT – obr. 1, 2). Následně se snažíme pomocí jemného naklánění sondy detekovat co nejvyšší rychlosti průtoku a maximálně se tak přiblížit přesnosti měření (snaha minimalizovat chybu při dvojrozměrném vyšetření trojrozměrného charakteru průtoku krve). Důležitou podmínkou přesnosti měření je absence významnější regurgitační vady na chlopni, před níž vyšetření provádíme. Pro výpočet VTI označíme stopu PW v LVOT v průběhu ejekce, načež přístroj dopočítá plochu pod křivkou (obr. 3). Pro reprezentativní údaj při přirozené variabilitě tepového objemu je s výhodou zprůměrovat minimálně tři měření VTI. Při arytmiích (fibrilace síní) se doporučuje spočítat průměrné VTI pro 5–10 různých křivek [6]. Pro získání validní hodnoty tepového objemu, respektive srdečního výdeje, je potřeba splnit následující podmínky [7]:
1. Měření průměru výtokového traktu levé komory (LVOT) v midsystole z parasternální projekce na dlouhou osu (PLAX) 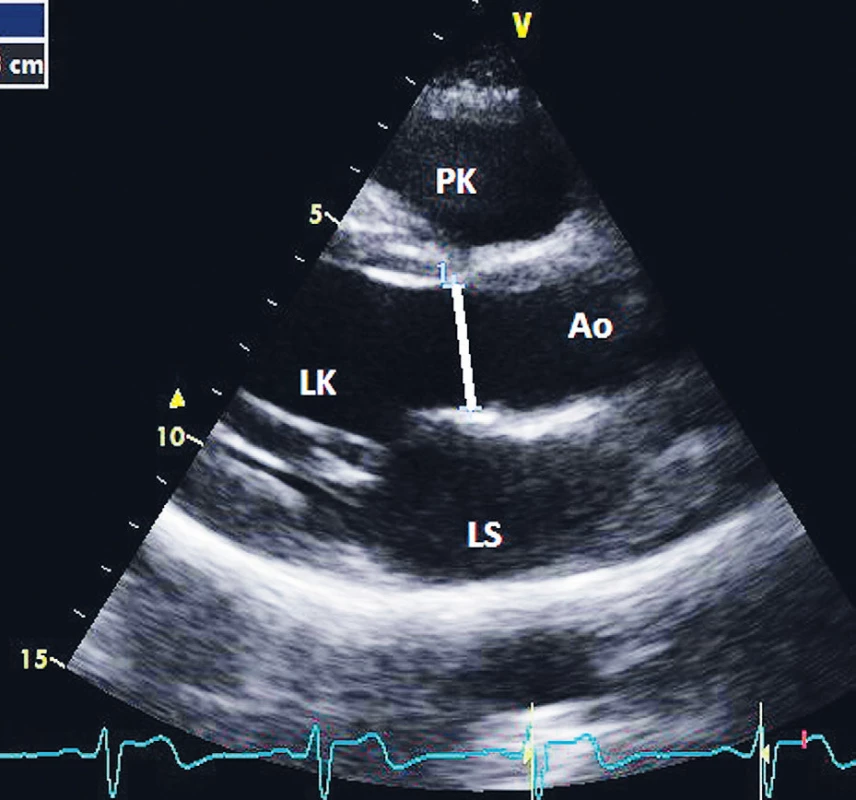
LK – levá komora, PK – pravá komora, LS – levá síň, Ao – aorta 2. Umístění vzorkovacího objemu PW doppleru do LVOT v apikální „pětidutinové“ projekci (5AC) 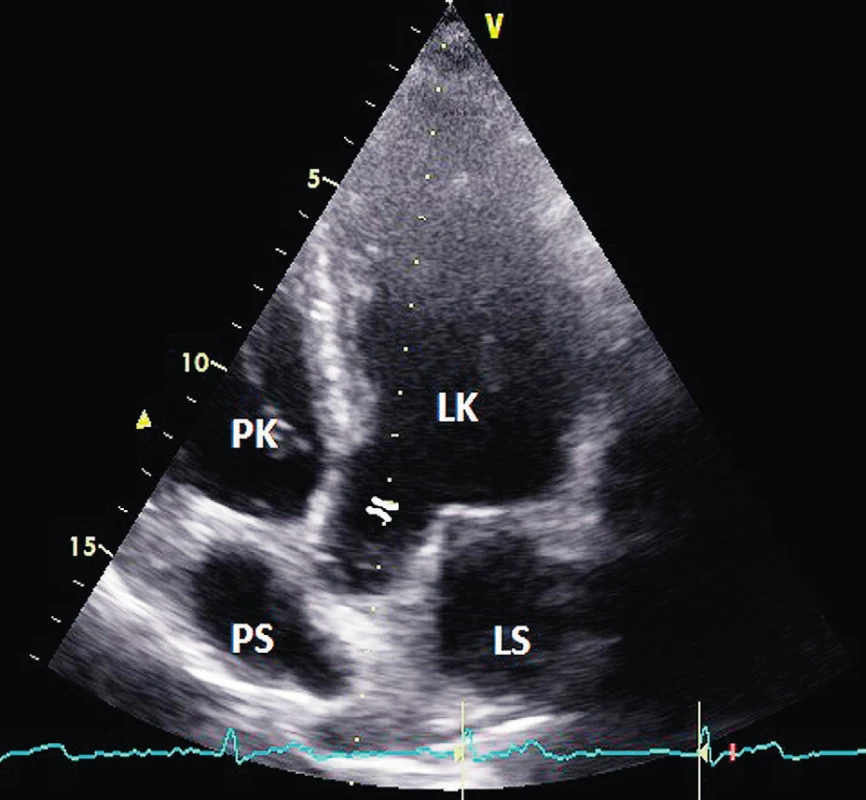
1. Plocha v místě měření tepového objemu musí splňovat podmínku kruhového průřezu (r), abychom mohli spočítat plochu ze vzorce:
CSA (cross sectional area) = π . r2.
Jakákoliv odchylka od skutečné plochy měřeného ústí (chybné měření průměru, nepravidelný tvar, změny plochy během systoly) je tak umocněna a výsledkem je významná chyba při výpočtu tepového objemu. Této chybě předejdeme kvalitním zobrazením měřeného úseku, případně měřením ve dvou různých projekcích. V praxi provádíme měření LVOT při transtorakálním vyšetření v parasternální projekci na dlouho osu (PLAX), kde jsou obě stěny LVOT kolmé ke směru ultrazvukového vlnění, a využíváme tak lepšího axiálního rozlišení. Měření musí být prováděno v systole (v ejekční fázi), s nezbytným využitím EKG (zejména při arytmiích). Při nekvalitním zobrazení transtorakálním způsobem je možné využít projekce na dlouho osu levé komory pomocí jícnového vyšetření s přesnějším měřením rozměru LVOT. Pokud nejsme schopni přesně změřit plochu, respektive průměr daného místa měření, je racionálnější vycházet z tabulkových hodnot či vystačit se samotnou hodnotou VTI. Absolutní hodnota srdečního výdeje pro nás totiž často není tak důležitá jako vývoj VTI v čase a v závislosti na našich terapeutických intervencích, jelikož lze předpokládat, že rozměr LVOT se příliš měnit nebude. Další možností je stanovení střední rychlosti proudění v LVOT pomocí PW. Po dosazení této hodnoty do rovnice:
CI (ml/min/m2 ) = 172 × mean velocity – 172
tak získáme srdeční index. Metoda dobře koreluje s termodiluční technikou při standardní odchylce 0,24 l/min/m2 [8].
2. Měření provádíme v oblastech předpokládaného laminárního proudění krve (absence stenózy výtokového traktu). Křivka získaná PW metodou musí být pravidelného tvaru (plochý profil proudění) reprezentující průměrné rychlosti v celém průřezu daného výtokového traktu.
3. Linie PW signálu musí být co nejvíce rovnoběžná se směrem toku krve. Čím větší incidenční úhel spolu směr šíření ultrazvuku a proud krve svírají, tím větší (ve smyslu podhodnocení) je chyba měření (cos 0 = 1). Incidenční úhel pod 20° garantuje chybu měření do 6 %, úhel 30° pak přináší chybu vyšší než 10 %. Další zvětšování úhlu je příčinou exponenciálního nárůstu chyby měření. V praxi vyhledáme projekci, ve které je krevní tok co nejvíce paralelní s rovinou dopplerovského signálu a mikropohybem sondy se snažíme najít sklon s nejvyšší zobrazenou detekovatelnou rychlostí.
4. Místo měření rychlostí krevního proudu a měřené plochy ústí musí být identické ve smyslu anatomickém i časovém. Pokud si pro místo měření vybereme strukturu, která mění svou velikost v závislosti na srdeční frekvenci či míře preloadu (anulus atrioventrikulárních chlopní), musíme měření plochy a rychlosti toku krve provádět vždy znovu a v identický moment s měřením PW.
MÍSTA PRO MĚŘENÍ TEPOVÉHO OBJEMU
Tepový objem může být měřen na různých místech srdce a velkých cév při splnění výše zmíněných podmínek.
LVOT (výtokový trakt levé komory)
Měření v LVOT je nečastější a i nejpřesnější echokardiografickou metodou stanovení srdečního výdeje. Výhodou měření tepového objemu v LVOT je přítomnost relativně laminárního proudění i při strukturálním postižení aortální chlopně a fixní velikost plochy LVOT ve vztahu ke změnám preloadu či srdeční frekvence. Kvalitní zobrazení umožňuje měření u většiny vyšetřovaných. Průměr LVOT měříme z PLAX projekce v midsystole pod aortální chlopní jako rozměr mezi endokardem septa a bází předního cípu mitrální chlopně (obr. 1). Vzorkovací objem při PW vyšetření pak umístíme v apikální čtyřdutinové projekci s aortou neboli „pětidutinové“ projekci (A5C) pod aortální anulus do LVOT (obr. 2). Výsledná křivka musí odpovídat laminárnímu proudění v LVOT (obr. 3).
3. Měření VTI v LVOT Nadprůměrná hodnota VTI 31,5 cm je daná sportovní anamnézou vyšetřovaného. 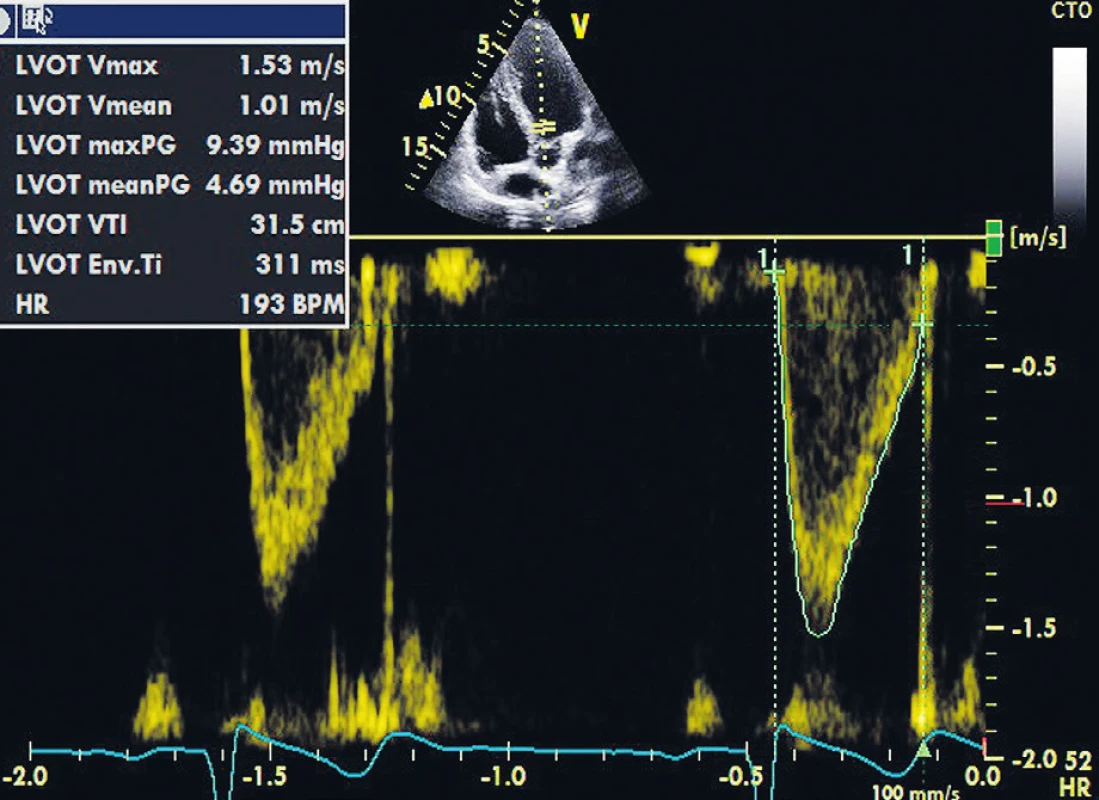
Ascendentní aorta
Daleko méně využívaným místem pro měření je ascendentní aorta. Průměr ascendentní aorty můžeme změřit z PLAX projekce. Rychlostní spektrum pak změříme buď z apikální A5C projekce či ze suprasternální projekce. V případě měření kontinuálně dopplerovským způsobem je ideální zvolit sinotubulární junkci jakožto nejužší místo ascendentní aorty s předpokládanými nejvyššími rychlostmi průtoku krve [7].
RVOT (výtokový trakt pravé komory),plicní arterie
Měření plochy daného ústí a dopplerovské měření rychlosti proudu krve provádíme z parasternální projekce na krátkou osu (PSAX) na úrovni velkých cév (obr. 4). Při vyšetření pomocí jícnové echokardiografie využíváme projekce z horní části jícnu se zaměřením na velké cévy. Měření srdečního výdeje z RVOT či plicní arterie využíváme především v situaci suspektního či potvrzeného intrakardiálního zkratového proudění, kdy měříme zvlášť srdeční výdej pravé a levé komory srdeční. Problémem však nezřídka bývá suboptimální zobrazení RVOT, kdy nemusí být zcela jasné, kde měřit jeho rozměr, což v konečném důsledku může vést k větší chybě.
4. Měření průměru výtokového traktu pravé komory (RVOT) 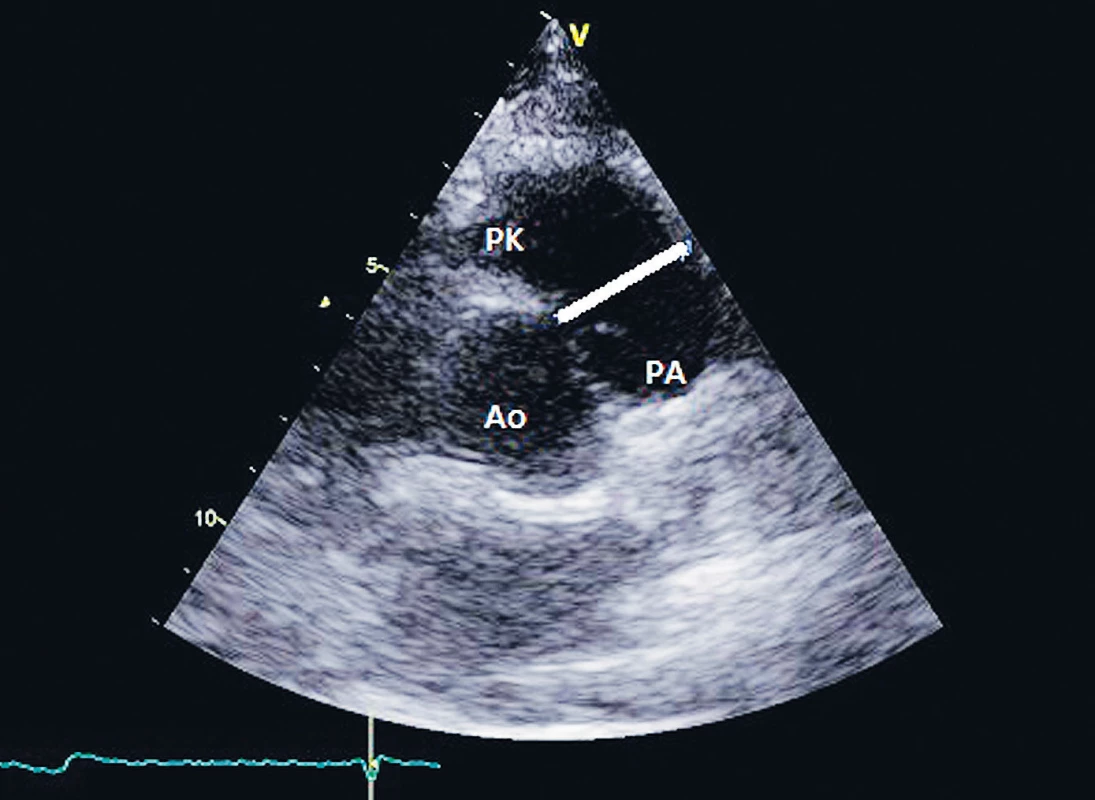
PK – pravá komora, PA – plicní arterie, Ao – aorta Aortální chlopeň
Teoretickou možností je umístit vzorkovací objem PW mezi otevřené cípy aortální chlopně. Hodnotu průměru ústí chlopně pro výpočet plochy pak získáme pomocí M modu z parasternální projekce na dlouhou osu (PLAX) [9]. Je to však měření velmi nepřesné, zejména v situaci, kdy je přítomna chlopenní vada. Ale i přesné stanovení u normální chlopně nemusí být jednoduché a v praxi se nepoužívá. Variantou je sledování pouze VTI, kdy je stejně jako v případě LVOT přesně dána pozice pro PW.
Mitrální chlopeň
Poněkud komplikovanější, nicméně v literatuře popisované, je měření tepového objemu pomocí PW doppleru na úrovni anulu mitrální chlopně. Nicméně v porovnání s měřením v LVOT je korelace s termodilučním měřením srdečního výdej poněkud horší [10] a též variabilita výsledků daná osobou vyšetřujícího je vyšší [11]. V klinice se proto také prakticky nevyužívá.
ZÁVĚR
Echokardiografie v intenzivní péči je jistě významný pomocník při diagnosticko-terapeutických rozvahách u lůžka kriticky nemocného pacienta. S dalším rozvojem techniky se stává dostupnější a využitelnější pro stále větší kohortu pacientů. Teoretická nevýhoda absence konti-nuálního sledování je vyvážena množstvím dalších informací, které pomocí ultrazvukového vyšetření můžeme získat. Na druhou stranu, nezpochybnitelný benefit echokardiografie může být ztracen nekvalitním vyšetřením nebo špatnou interpretací získaných dat. Echokardiografie není konkurentem kontinuálních metod stanovení srdečního výdeje, ale spíše nabízí další možnosti ve složitém diagnostickém procesu bez nutnosti invazivního vstupu. Kontinuální metody může naopak zpřesňovat jejich intermitentní kalibrací. Jedině v rukou zkušeného lékaře je echokardiografie užitečný nástroj v diagnostice hemodynamické nestability na JIP. Není ambicí intenzivisty provádět vyšetření rozsahem srovnatelné s elektivním vyšetřením v „pohodlí“ echokardiografické laboratoře. Nicméně i orientační vyšetření u lůžka pacienta musí být komplexní a pokud možno co nejpřesnější, aby minimalizovalo chyby, vedoucí k přehlédnutí důležitých patologických nálezů. Při vyšetření je nutná i pokora, racionalita a vědomí, že ne všechny nemocné je možné kvalitně vyšetřit a ne každý vyšetřující je schopný zobrazit a změřit, vše co si předsevzal. Často je lepší odkázat na nekvalitní či nedostatečné zobrazení, než za každou cenu provést zavádějící výpočty s možnými negativními důsledky pro nemocného.
Tvorba článku byla podpořena granty PRVOUK-P35/LF1/5 a projektem OP Prague Competitiveness, reg.no. CZ.2.16/3.1.00/21565
Tento článek je původní a nebyl dosud publikován či prezentován a ani nabídnut k publikaci do jiného média.
Autoři si nejsou vědomi konfliktu zájmů.
Do redakce došlo dne 11. 5. 2015.
Do tisku přijato dne 11. 5. 2015.
Adresa pro korespondenci:
MUDr. Michal Lipš
KARIM VFN
U Nemocnice 2
128 08 Praha 2
email: michal.lips@vfn.cz
Sources
1. McLean, A. S. International recommendations on competency in critical care ultrasound: pertinence to Australia and New Zealand. Crit. Care Resusc., 2011, 13, 1, p. 56–58.
2. Salem, R., Vallee, F., Rusca, M., Mebazaa, A. Hemodynamic monitoring by echocardiography in the ICU: the role of the new echo techniques. Curr. Opin Crit. Care, 2008, 14, p. 561–568.
3. Douglas, P. S., Garcia, M. J., Haines, D. E., Lai, W. W., Man-ning, W. J., Patel, A. R., Picard, M. H., Polk, D. M., Ragosta, M., Parker Ward, R. et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 Appropriate Use Criteria for Echocardiography. A Report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiography, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance American College of Chest Physicians. J. Am. Soc. Echocardiogr., 2011, 24,p. 229–267.
4. Balik, M., Pachl, J., Hendl, J. Effect of the degree of tricuspid regurgitation on cardiac output measurements by thermodilution. Intensive Care Med., 2002, 28, 8, p. 1117–1121.
5. Linhart, A., Paleček, T., Aschermann, M. Echokardiografie pro praxi. Praha: Audioscan, 2002.
6. Huang, S. J., McLean, A. S. Appreciating the strengths and weaknesses of transthoracic echocardiography in hemodynamic assessments. Cardiol. Res. Pract., 2012, 894308.
7. Otto, C. M. Textbook of clinical echocardiography. St. Louis: W. B. Saunders, 2000.
8. Evangelista, A., Garcia-Dorado, D., Garcia del Castillo, H., Gonzalez-Alujas, T., Soler-Soler, J. Cardiac index quantification by Doppler ultrasound in patients without left ventricular outflow tract abnormalities. J. Am. Coll. Cardiol., 1995, 25, p. 710–716.
9. Feigenbaum, H. Feigenbaum‘s Echocardiography. 6th Edition edn: Lippincott Williams & Wilkins, 2005.
10. Dubin, J., Wallerson, D. C., Cody, R. J., Devereux, R. B. Comparative accuracy of Doppler echocardiographic methods for clinical stroke volume determination. Am. Heart J., 1990, 120, p. 116–123.
11. Lewis JF, Kuo LC, Nelson JG, Limacher MC, Quinones MA: Pulsed Doppler echocardiographic determination of stroke volume and cardiac output: clinical validation of two new methods using the apical window. Circulation 1984, 70, 3, p. 425–431.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2015 Issue 4-
All articles in this issue
- Vasopressin and its role in anaesthesiology and intensive care medicine
- Echocardiography for cardiac output assessment in critically ill patients
- Peri-operative management of the obese surgical patient 2015
- Use of interactive education in undergraduate teaching of acute medicine: the virtual and standardised patient, operating theatre broadcasting
- Results of ECMO therapy in cohorts of neonates and children
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vasopressin and its role in anaesthesiology and intensive care medicine
- Echocardiography for cardiac output assessment in critically ill patients
- Peri-operative management of the obese surgical patient 2015
- Results of ECMO therapy in cohorts of neonates and children
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

