-
Medical journals
- Career
Současné postupy v porodnické anestezii V. – pooperační péče po císařském řezu
: Bláha Jan 1,2; Klozová Radka 1,3; Nosková Pavlína 1,2; Seidlová Dagmar 1,4; Štourač Petr 1,5; Pařízek Antonín 6
: Sekce porodnické anestezie a analgezie ČSARIM 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. lékařská fakulta Univerzity Karlovy v Praze a Všeobecná fakultní nemocnice v Praze 2; Klinika anesteziologie a resuscitace, 2. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnice v Motole 3; II. anesteziologicko-resuscitační oddělení, Fakultní nemocnice Brno 4; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta Masarykovy univerzitya Fakultní nemocnice Brno 5; Gynekologicko-porodnická klinika, 1. lékařská fakulta Univerzity Karlovy v Prazea Všeobecná fakultní nemocnice v Praze 6
: Anest. intenziv. Med., 26, 2015, č. 2, s. 87-98
: Anesthesiology - Review Article
Tento článek uzavírá sérii přehledových článků Současné postupy v porodnické anestezii. Hlavním cílem této části je zdůraznit zásadní význam dostatečné analgezie, časné mobilizace a časného perorálního přijmu tekutin i jídla u pacientek po císařském řezu jako významného prvku redukce celkové pooperační morbidity.
Klíčová slova:
císařský řez – pooperační péče – analgezie – časná mobilizaceÚVOD
Císařský řez je závažnou břišní operací s významnými autonomními, fyziologickými a hormonálními důsledky, a to i přes svou vysokou incidenci, standardizovaný průběh a relativní technickou jednoduchost. Specializovaná poanestetická péče není většinou vyžadována, protože se většinou jedná o mladou a zdravou ženu a nutnost délky pobytu na dospávacím pokoji (Post-Anaesthesia Care Unit, PACU) většinou nepřesahuje 1–3 hodiny [1]. Na druhou stranu až u 10 % žen po císařském řezu je nutný příjem na oborovou JIP, což je z 80 % zapříčiněno již předoperačně přítomnými přidruženými onemocněními. Příjem na resuscitační oddělení je nutný pouze u malého počtu rodiček (1–3,5 %) [2]. Spíše než specializovaná pooperační péče jsou tak po standardním průběhu císařského řezu podstatné postupy pro rychlé zotavení po chirurgických výkonech, tj. především časná mobilizace, časný perorální příjem tekutin i jídla a dostatečná pooperační analgezie [3].
Mobilizace
Význam časné pooperační mobilizace byl popsán již více než před 10 lety u chirurgických pacientů v rámci tzv. fast-track surgery, čili zrychleného zotavení po chirurgických výkonech [4]. Jedním z cílů tohoto přístupu je celková redukce pooperační morbidity [5]. Časná mobilizace po císařském řezu u jinak nerizikových pacientek je nejvýznamnějším preventivním opatřením ke snížení rizika tromboembolické nemoci (TEN), jak bylo již podrobněji diskutováno v úvodním článku celé série – Současné postupy v porodnické anestezii I. [6]. Přesné časové vymezení pojmu časná mobilizace není ale jednoznačně definováno. Literární údaje se v jeho určení poměrně rozcházejí a jako časná mobilizace pacientky (šestinedělky) je brána její vertikalizace mezi 6 a 24 hodinami od císařského řezu. Ve Velké Británii je kupříkladu 72 % pacientek mobilizováno do 12 hodin po císařském řezu nebo po odeznění neuroaxiální blokády [7]. Čas mobilizace pacientek po standardním výkonu je současně i jednoduchým a přitom efektivním kontrolním ukazatelem pooperačního průběhu. Mezi limitující faktory časné mobilizace patří na prvním místě nedostatečná analgezie, a dále neúplné zotavení z účinků anestezie, přetrvávající motorická blokáda po neuroaxiální anestezii a pooperační nauzea a zvracení [3]. Samotná volba anestezie na časnost mobilizace po císařském řezu rozhodující vliv nemá. Účinky u nás i ve světě běžně používaných celkových anestetik u císařského řezu by neměly přetrvávat déle než jen do bezprostředního pooperačního období (1–3 hodiny). Zhruba stejný časový interval je nutný i k úplnému odeznění neuroaxiální blokády [1, 8].
Významným faktorem limitace mobilizace šestinedělky po císařském řezu může být postpunkční cefalea. Vzhledem ke skutečnosti, že typicky vzniká 24–48 hodin po subarachnoidální punkci či perforaci, tedy většinou 24–48 hodin po císařském řezu, není většinou postpunkční cefalea limitací časné mobilizace. Rozvinutý postpunkční syndrom se ale následně stává významnou limitací mobility pacientky a možnosti její péče o novorozence. Je proto namístě významně aktivní přístup k jeho terapii s maximální prodlevou 48 hodin od identifikace obtíží do aplikace krevní záplaty, která je jedinou prokazatelně účinnou terapií. Jedinou prevencí rozvoje syndromu je použití tenkých subarachnoidálních jehel G26 a tenčích. Odložená vertikalizace po operačním výkonu preventivně nepůsobí. Podrobně byla tato problematika zpracována v článku Postpunkční cefalea v porodnictví [9].
Nejzávažnějším rizikem časné mobilizace je pád pacientky, oprávněně považovaný za mimořádnou nežádoucí událost. Mobilizaci pacientky po císařském řezu proto musí být vždy přítomna ošetřující sestra, která ještě před vertikalizací zhodnotí všechny rizikové faktory a vlastní vertikalizaci a prvním krokům je přítomna. Hlavními rizikovými faktory pádu jsou nedostatečné zotavení z účinku celkové i regionální anestezie, oběhová nestabilita (nejčastěji při absolutní či relativní hypovolémi) a výraznější anémie (Hb < 70 g/l), spolu s nedostatečně nebo naopak příliš (až sedativně) tlumenou pooperační bolestí. Vznik synkopy v rámci ortostatické hypotenze při příliš rychlé vertikalizaci je dalším nepříznivým faktorem pro úspěšnou mobilizaci. Absolutním požadavkem je, že po celé časné pooperační období (24 hod) je pacientka protokolizovaně a v pravidelných intervalech sledována (základní životní funkce, intenzita bolesti, míra sedace, výskyt komplikací apod.).
1. Kombinace analgetik – multimodální analgezie 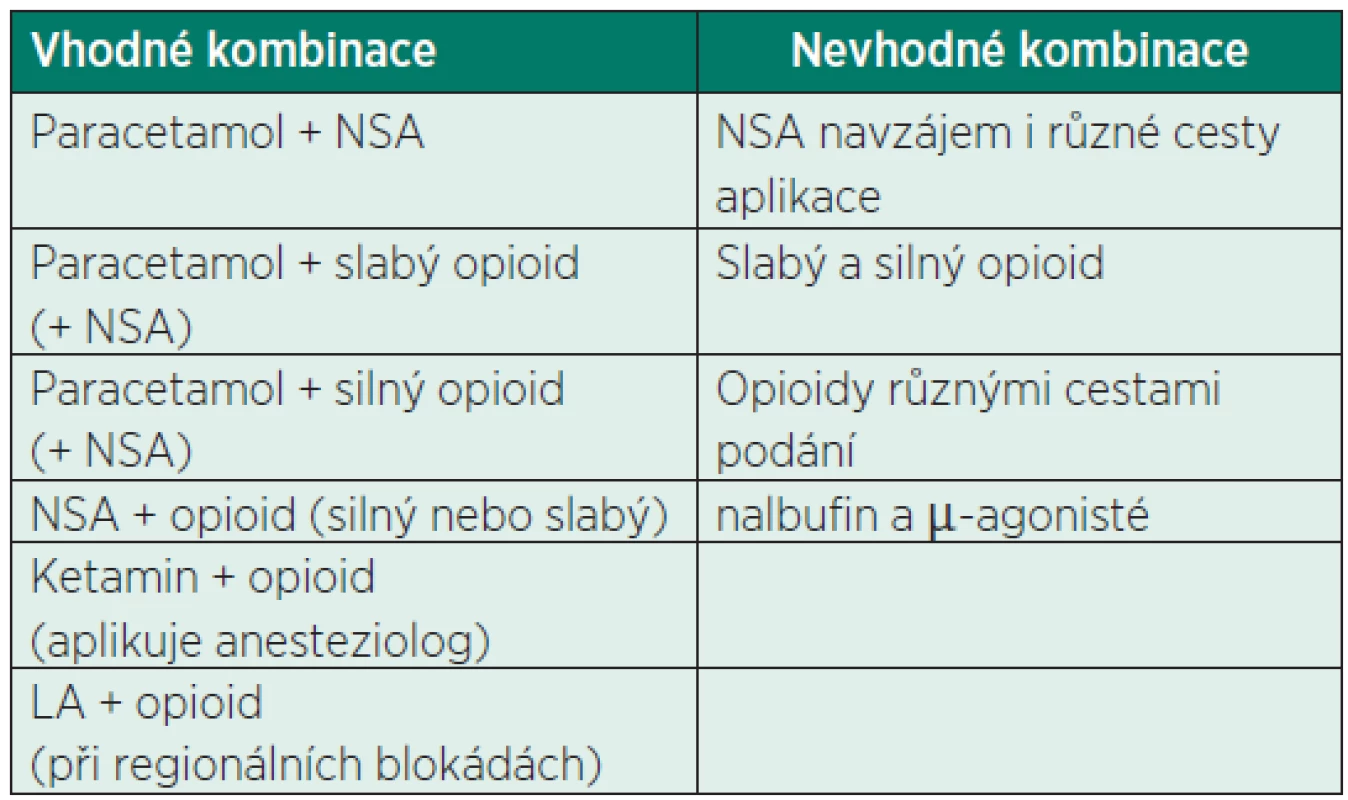
Podle doporučeného postupu ČSARIM Léčba akutní pooperační bolesti (2008)[18]. NSA – nesteroidní antiflogistika, LA – lokální anestetikum POOPERAČNÍ ANALGEZIE
Kvalitně nastavená pooperační analgezie je jedním z faktorů, které mohou významně pooperační mobilizaci ovlivnit. Oproti všeobecně přijímané představě o císařském řezu jako o výkonu s předpokládanou malou pooperační bolestivostí je skutečností, že střední bolest, tj. VAS 4–7, zažije po výkonu polovina žen [10]. Cílem pooperační analgezie je kromě vlastního zajištění účinné analgezie i prevence orgánových poškození v důsledku vegetativní a somatické reflexní odpovědi na traumatizaci tkání, rychlé a úplné obnovení obranných reakcí a plná normalizace dýchání. Umožnění časné mobilizace je rovněž prevencí respiračních komplikací a tromboembolické nemoci. Absence kvalitní pooperační analgezie se naopak negativně odráží i na celkovém pooperačním průběhu. Nedostatečně tlumená akutní pooperační bolest vede k aktivaci sympatického nervového systému, k zvýšení spotřeby kyslíku a podílí se na zvýšené morbiditě a mortalitě. Nejčastějšími komplikacemi jsou hypertenze a tachykardie, mohou se vyskytnout ale i závažnější komplikace (i když méně často než po jiných abdominálních výkonech) – ischémie, arytmie, hypoventilace, atelektázy, bronchopneumonie, stresová hyperglykémie, opožděná enterální realimentace, ileus, poruchy hojení rány, infekční komplikace, snížená mobilizace, zvýšené riziko trombembolické nemoci, a psychické stavy – úzkost, deprese, nedůvěra ve zdravotnický personál, poruchy spánku, delirium [11].
Nedostatečně tlumená pooperační bolest rovněž zvyšuje riziko vzniku chronické pooperační bolesti, která se po císařském řezu vyskytuje až v 6–18 %, přičemž častěji se objevuje po celkové anestezii a nedostatečné neuroaxiální anestezii. Její rozvoj naopak snižuje použití nesteroidních antiflogistik (NSA) v pooperačním období [12–14].
Je třeba proto zdůraznit, že účinnou analgezii nelze upírat ani v šestinedělí, a že účinná analgezie je možná i při kojení. Při výběru analgezie je nutno vzít do úvahy i možnou kumulaci medikamentů v organismu matky a jejich následné vylučování mateřským mlékem. Skutečností ovšem je, že nejsilnější (opioidní) analgetika jsou indikována převážně v prvních hodinách po císařském řezu, kdy je laktace ještě nerozvinuta. Hlavní principy analgezie po císařském řezu se příliš neliší od všeobecných zásad pooperační léčby bolesti. U císařského řezu často využívaný ketamin 0,25–0,5 mg/kgpřed úvodem do celkové anestezie bohužel nemá preemptivní účinek na pooperační bolest a jeho efekt je tak pouze ve snížení stresové odpovědi na intubaci a incizi [15, 16]. Příklady schémat pooperační analgezie po císařském řezu nabízí tabulka 2 a Příloha 1 (pooperační ordinace VFN v Praze). Pooperační bolest po císařském řezu je bolest akutní a maximální intenzity dosahuje bezprostředně po výkonu a první pooperační den [17]. Podle principu analgetického žebříčku WHO (World Health Organisation) postupujeme v léčbě systémem „step down“, tedy od nejsilnějších analgetik vhodných pro předpokládanou pooperační intenzitu bolesti (silné opioidy) směrem dolů k neopiodním analgetikům. Snahou je, co nejdříve přejít na perorální příjem léků.
2. Možné varianty pooperační analgezie podle anestezie podané k císařskému řezu 
Nejúčinnější metodou pooperační analgezie po císařském řezu je nesporně epidurální analgezie [19–21]. Vzhledem k charakteru výkonu a míře předpokládané střední pooperační bolesti [22] není ale zavedení epidurální analgezie pouze z důvodu tlumení pooperační bolesti po císařském řezu, pro možné komplikace spojené s aplikací epidurální blokády, indikováno [23]. Je však nereálné očekávat dostatečný účinek aplikací monoterapie neopioidními analgetiky. Uspokojivé úrovně bolesti (tj. VAS <4) lze dosáhnout systémovou multimodální analgezií, to je kombinací analgetik různých skupin, zajištujících aditivní účinek a snižující nežádoucí účinky analgetik [24, 25]. Vhodné a nevhodné vzájemné kombinace ukazuje tabulka 1. Nejrozšířenější volbou po císařském řezu je kombinace nesteroidního antiflogistika (NSA) s krátkým biologickým poločasem, a to především diklofenaku (při p. o. příjmu i ibuprofenu) se silným opioidem (morfin, u nás i piritramid). První volbou z neopioidních analgetik v celém peripartálním období je paracetamol. Diklofenak je první volbou z NSA a standardně se podává v dávce 50 mg po 8 hod. (velmi účinná a bezpečná je rektální aplikace) [21, 24], nebo intravenózně 75 mg po 12 hod. (Almiral). Podle studií lze podávat až 200 mg/den bez vlivu na pooperační krvácení [26], ale tato dávka již překračuje maximální denní dávku podle SPC. Účinnou variantou je paracetamol v dávce 1 g po 6 hod. (CAVE u osob s hmotností pod 50 kg je nutno dodržovat maximální jednotlivou dávku 10 mg/kg a maximální denní dávku 60 mg/kg). Jednou z možných alternativ, zejména v rámci multimodální analgezie, je kombinace NSA či paracetamolu s metamizolem. Tato kombinace je u nás často používána, i když podle SPC není podávání metamizolu v době kojení doporučováno [24, 27]. Absolutní kontraindikace jeho podání se týká ale především třetího trimestru těhotenství pro jeho slabý, ale patrný účinek na inhibici prostaglandinů. Nejčastější doporučované varianty pooperační analgezie po císařském řezu ukazuje tabulka 2.
Často v praxi opomíjeným pravidlem je podávání analgetik v pravidelných časových intervalech („podle hodin“) i při nízké úrovni bolesti, a ne „až to bude bolet“. Tento princip udrží základní hladinu analgezie a následné výkyvy v intenzitě bolesti nedosahují tak vysokých hodnot. Obecným trendem je zahájit pooperační léčbu bolesti s předstihem, tj. již peroperačně s včasně navazující pooperační analgezií, aby se předešlo nežádoucím účinkům z nedostatečné analgezie. Již samotná institucionalizace léčby bolesti systémem Acute Pain Service (APS) po císařském řezu vede ke snížení intenzity pooperační bolesti [21, 28]. Jako příklad může sloužit záznam hodnocení pooperační analgezie po císařském řezu FN Brno (Příloha 2).
Pro časnou systémovou analgezii jsou i v porodnictví nejvhodnější opioidy, které jsou po dobu prvních 24 hod. od císařského řezu nutné a bezpečné, a není je třeba rodičce z důvodu kojení odpírat. Díky genetické variabilitě opioidních µ-receptorů se ale analgetický účinek opioidů může u jednotlivých pacientek výrazně lišit, a to až s 5násobným rozdílem potřebné účinné plasmatické hladiny opioidu [29, 30]. Neexistuje tak jediné správné dávkovací schéma a individualizovaný, multioborový a multimodální přístup je zde zcela nezbytný. Při tvorbě vlastního dávkovacího schématu je třeba vzít v úvahu, že většina dostupných prací se shoduje v tom, že kontinuální podání opioidů je spojeno s vyšším rizikem předávkování, respektive závažných nežádoucích účinků.
Intravenózní aplikace čistých µ-agonistů se nedoporučuje s výjimkou morfinu, který je v tomto případě naopak lékem 1. volby [31]. Díky své hydrofilii představuje morfin bezpečný opioid, do mateřského mléka se dostává méně než 1 % podané látky. Morfin patří pro své dlouhodobé užívání, nízkou cenu a znalost farmakologie k celosvětově nejpoužívanějšímu opioidu k řešení pooperační bolesti. Aplikace morfinu je ideálně v režimu pacientem kontrolované analgezie (PCA), která je z pohledu pacienta prokazatelně účinnější alternativou oproti sestrou řízené analgezii [32, 33]. Kontroverze existuje, pokud optimální dávkovací schéma morfinu je kombinací bazální konti-nuální dávky (0,5–1 mg/hod.) s aditivními bolusy, nebo se skládá pouze z jednotlivých bolusových dávek (1–1,5 mg). Výsledky jsou v tomto směru poměrně kontroverzní, stejně tak jako výsledný efekt [34]. Morfin může být podávaný i epidurálně a intratekálně. CAVE: i při jednorázové neuro-axiální aplikaci morfinu je nutno vzhledem k riziku respirační deprese zajistit adekvátní monitorování pacientek. Intratekální aplikace purifikovaného morfinu (bez konzervačních látek) v dávce 0,1–0,2 mg zajistí dobrou pooperační analgezii v délce 12–24 hod. [35]. V účinnosti dokonce obě neuroaxiální možnosti předčí intravenózní aplikaci, ale za cenu vyššího výskytu pruritu [36], jehož závažnost je přímo závislá na velikosti podané dávky. Účelná léčba svědění představuje buď intravenózní aplikaci naloxonu 0,1 mg/hodinu (ale s rizikem zvýšení úrovně bolesti), nebo nalbufinu 3 mg i. v., což se v současnosti zdá být nejefektivnější možností [37, 38]. Podávání droperidolu, prothazinu nebo malých dávek propofolu se ukázalo bez efektu [39].
Piritramid představuje vhodnou volbu silného opioidu tam, kde není nutná kontinuální intravenózní aplikace silných opioidů. Často se užívá již peroperačně – bolusové podání 15 mg subkutánně 30 minut před koncem výkonu zajistí následně analgezii na 6–8 hodin bez rizika kumulace. V literatuře je popsáno i kontinuální dávkovací schéma piritramidu 45 mg i. v. pro die [18] s dobrou účinností.
Nalbufin svým ovlivněním κ-receptorů zajišťuje analgezii bez vlivu na dechové centrum, ale limitující mohou být sedace a stavy dysforie, které s receptorem kappa souvisí. Intravenózní podání je možné bolusově v dávce 10–20 mg/70 kg (0,1–0,3/mg/kg)nebo v kontinuální infuzi 5–10 mg/hod. se startovací dávkou 5 mg. Nástup účinku je 2–3 min., délka účinku 3–6 hod.
Sufentanil se v porodnictví pro své riziko kumulace k systémové aplikaci nedoporučuje, je však v našich podmínkách hlavním opioidem k epidurální aplikaci. Sufentanil se díky své lipofilii snadno vstřebává cévami z epidurálního prostoru do systémové cirkulace. Přestup do kolostra a mléka není znám, ale dá se v omezené míře předpokládat. Kontinuální epidurální aplikace by měla být omezena na maximálně 36 hod. jako prevence vzniku toxicity s rizikem dechové deprese novorozence. Jako bezpečná dávka při tomto podávání, která nevede ke klinicky významným hladinám v kolostru, se uvádí 5 µg/hod. [40, 41].
Ve světě rozšířenou metodou podávání pooperační analgezie je režim PCA (pacientem kontrolovaná analgezie) pro intravenózní i epidurální (PCEA) aplikaci. Pacient má přístrojem nastavenu bazální kontinuální dávku s možností aplikace bolusu při zvýšené intenzitě bolesti. Aby nedošlo k předávkování opioidem, je na zařízení nastaven bezpečnostní interval (tzv. lock out interval) mezi jednotlivými bolusovými dávkami. Pacient má pocit, že sám ovládá tlumení bolesti, což má výrazný pozitivní psychický efekt. Celkově tak metoda vede ke snížené spotřebě analgetik včetně opioidů. V České republice je z finančních důvodů (pořizovací cena přístroje v roce 2014 cca 40 000 Kč) zatím širší užití PCA limitováno. Dalším důvodem jsou i organizační a kompetenční problémy managementu pooperační bolesti na jednotlivých pracovištích. V režimu PCA je možno k léčbě pooperační bolesti v porodnictví použít při vhodném nastavení prakticky kterýkoli opioid, celosvětově se nejčastěji užívá již zmiňovaný morfin.
Vhodnou moderní metodou k řešení pooperační analgezie by mohla být lokální infiltrační analgezie (LIA). Princip spočívá v aplikaci lokálních anestetik do oblasti operační rány. Infiltrace operační rány lokálním anestetikem (10–20 ml 0,25–0,5% bupivakainu) chirurgem na konci operačního výkonu je běžně používanou analgetickou technikou. Přes svůj analgetický potenciál není tato metoda v porodnictví zatím příliš rozšířena a její účinnost u císařského řezu tak není jednoznačně podepřena recentně publikovanými pracemi, případně je i zpochybňována [7, 42–45]. Některé studie však ukazují, že kontinuální infuze 0,25% levobupivakainu subfasciálně v místě incize dokáže zajistit analgezii s účinností podobnou epidurálně podanému 0,125% levobupivakainu [46–48]. Hlavními výhodami LIA jsou redukce analgetik a sedace, snížení výskytu průlomové bolesti, urychlení mobilizace a zkrácení doby hospitalizace. V literatuře se setkáme i s aplikací NSA do oblasti operační rány, kde zabráněním vzniku hyperalgezie dochází ke snížené spotřebě opioidů v pooperačním období [49].
INFUZNÍ TERAPIE
Specifická infuzní terapie při absenci známek hypovolémie není nutná. Většina rodiček spadá do kategorie s nízkým rizikem, profitujícím z peroperačního příjmu krystaloidů 20–30 ml/kg. Tato tekutinová nálož u nízkorizikových chirurgických výkonů zlepšuje celkový pooperační průběh snížením pooperační bolesti, nauzey či výskytu závratí [50].
Naopak neuvážená infuzní terapie v rámci pooperační péče se může podílet na stupni močové retence. Ve výskytu retence moči nejsou pozorovány rozdíly mezi celkovou a neuroaxiální anestezií. Jako rizikové faktory pooperační retence moči byly naopak identifikovány opioidy podávané k tlumení pooperační bolesti, mnohočetné těhotenství a nízký BMI [51, 52]. Bez ohledu na skutečnost, zda je močový katétr extrahován bezprostředně po operaci či v prvních 24 hodinách, nebyl nalezen rozdíl ve výskytu močové retence, dysurie, febrilií, pozitivním mikroskopickém nálezu moči či délce hospitalizace [53].
VÝŽIVA A PERORÁLNÍ PŘÍJEM
Běžná rodička je nutričně na zátěž způsobenou operačním porodem císařským řezem vybavena a nevyžaduje v případě elektivního výkonu žádnou speciální přípravu. Těhotné s alterovaným celkovým stavem (preeklampsie, HELLP syndrom, diabetičky) sice vykazují často známky malnutrice či deficitu plazmatických bílkovin [54–56], ale představa o nutriční podpoře v předoperačním období je většinou v případě rodiček nereálná. Většinou se jedná o pacientky zařazované do operačního programu semiakutně a akutně a jediné, co tak lze v tomto případě učinit, je při výrazném poklesu hladiny bílkovin doplnit albumin. Jestli a při jak nízké hladině albuminu jeho suplementace zlepšuje pooperační průběh, ale není známo. V tomto vztahu je hladina albuminu prokazatelně pouze prediktorem celkového průběhu [57].
Císařský řez je sice nitrobřišní (intraperitonální) operací, ale bez porušení integrity střeva a s relativně malou manipulací v dutině břišní. Nauzea a zvracení v průběhu výkonu je naproti tomu relativně častou komplikací císařského řezu se vztahem k neuroaxiální blokádě. Po císařském řezu tak není třeba přijímat zvláštní opatření týkající se zahájení perorálního příjmu po dosažení plného zotavení z účinků anestezie. Při srovnání časného zahájení perorálního příjmu (4–8 hodin po výkonu) oproti opožděnému vede první zvolená strategie k časnějšímu zahájení peristaltiky a časnějšímu propuštění z porodnice [58, 59]. Naproti tomu nebyly nalezeny rozdíly ve výskytu pooperační nauzey a zvracení, paralytického ileu či potřeby analgezie. NICE guidelines stanovují, že ženy dobře zotavené z účinků anestezie bez jiných komplikací mohou „jíst a pít, jakmile mají hlad a žízeň“ [60]. Naopak, s hladověním po císařském řezu jsou spojeny četné nežádoucí účinky [61].
Časný pooperační perorální příjem jak tekutin, tak stravy je pro běžné pacientky přínosný. U výkonů vedených ve svodné anestezii a případně i se svodnou pooperační analgezií bude jeho zavedení samozřejmě jednodušší a dřívější. Pozvolný perorální příjem čirých tekutin po neuroaxiální anestezii může být zahájen ihned, po celkové ane-stezii do 1–2 hodin. V nekomplikovaných stavech je příjem nekorpuskulární stravy (přesnídávka, jogurt), v komplikovanějších sipping formou tekuté stravy, zahajován 4 hodiny po operaci. Pokud je výkon v operačním programu dopoledne, rodička už dostává lehkou večeři (bramborová kaše, banán, piškoty). Od 1. pooperačního dne pak pokračuje výživa již běžnou nenadýmavou stravou. Rutinní farmakologická podpora peristaltiky není nutná. V indikovaných případech lze střevní pasáž podpořit simethikonem (Espumisan), eventuálně metoklopramidem (i. v. nebo per os) 30 minut před plánovaným hlavním jídlem. Stejně tak není nezbytné i podávání antacid, přesto se na řadě pracovišť standardně stále podávají [7].
U pacientek, kde výchozí stav metabolismu není příznivý (nejčastěji jde o rodičky se závažnou hypoalbuminémií při proteinurii) je přínosná kombinace běžného perorálního příjmu s parenterální výživou. Nejčastěji jsou dnes používány systémy „All-In-One“. Tam, kde není zavedený centrální žilní vstup, je možné použít tyto přípravky určené do periferního žilního systému. Podávání zahajujeme již první pooperační den. Do perorálního příjmu je vhodné zařadit bílkovinné doplňky stravy a tekutou stravu s vysokým podílem bílkovin. Výživa sondou je po císařském řezu zcela výjimečnou záležitostí [62, 63].
PROFYLAXE TROMBOEMBOLICKÉ NEMOCI
Trombembolická nemoc (TEN) patří ve vyspělých zemích k nejčastější příčině mateřské mortality a tvoří okolo 10 % všech úmrtí ve spojení s porodem [64–67]. Hlavní příčinou 5–10násobně zvýšeného rizika trombembolie v těhotenství oproti netěhotným [67–70] je fyziologický hyperkoagulační stav, který má chránit ženu při porodu či potratu proti nadměrné krevní ztrátě [71–74]. I přes to, že v těhotenství je riziko TEN několikanásobně zvýšeno, naprostá většina těhotných žen preventivní antikoagulaci nepotřebuje. Výjimkou jsou těhotné ženy s deficitem proteinu C, proteinu S a antitrombinu, získané mateřské trombofilie (např. syndrom antifosfolipidových protilátek) a především homozygotní formy mutace faktoru II a V (Leidenská mutace), které až 10násobně zvyšují v těhotenství riziko TEN, při kombinaci obou je riziko dokonce až 70násobně vyšší! Naopak mutace metylentetrahydrofolátreduktázy (MTHFR) není dnes již dávána do souvislostí se zvýšeným rizikem TEN, a to ani její homozygotní forma [75–78]. V euro-americké populaci se vrozené trombofilie vyskytují přibližně u 15 % populace. A přestože podle současných dat vzniká TEN v těhotenství až v 50 % všech případů na podkladě trombofilie, komplikuje TEN pouze okolo 0,1% těhotenství. Dokonce i absolutní riziko TEN u těhotných žen s trombofilií se pohybuje pouze okolo 1–2 % s převahou výskytu postpartálně [77–79].
Přes vše výše uvedené, současné názory zpochybňující univerzální nutnost farmakologické profylaxe u všech těhotných žen podstupujících císařský řez. Recentní data ukazují, že pravděpodobně díky dnes časné mobilizaci pacientek je výskyt TEN po císařském řezu asi výrazně nižší, než se předpokládá. Ve studii sledující výskyt žilní trombózy po císařském řezu byly sonografické známky DVT zaznamenány pouze u 0,5 % žen [79], tj. méně než u obecně chirurgických pa-cientů. Císařský řez, a to včetně předtermínového, u nekomplikovaně probíhajícího těhotenství bez dalších rizikových faktorů, je dnes řadou expertů řazen mezi výkony s nízkým rizikem TEN, tj. bez nutné farmakologické profylaxe. Podmínkou je ale právě časná mobilizace rodiček. Tomu odpovídají i současná doporučení Royal College of Obstetricians and Gynaecologists a American College of Chest Physicians (tab. 3, Schéma 1)[77, 80, 81]. Pokud je nutná farmakologická profylaxe, tak aplikace nízkomolekulárního heparinu (low molecular weight heparins; LMWH) je v těhotenství preferována před aplikací nefrakcionovaného heparinu (UFH) [76, 82]. Dostatečný profylaktický efekt standardních dávek LMWH je ale v těhotenství nejistý. Podstatným problémem je totiž fakt, že doporučované profylaktické dávkování LMWH je pouze převzato od dávkovacích schémat vytvořených a vyzkoušených pro chirurgické a ortopedické pacienty, tj. není přizpůsobeno fyziologicky odlišnému těhotenství. Přitom je jasné, že těhotné ženy se od průměrného chirurgického či ortopedického pacienta zcela zásadně liší nejen svým věkem, a tím i výskytem přidružených onemocnění a ostatních komplikací, ale především se právě odlišují fyziologickým posunem koagulační rovnováhy na stranu hyperkoagulace i současně zrychleným metabolismem LMWH. Současná doporučení tromboprofylaxe u těhotných žen jsou tak postavena především na kazuistikách, konsenzuálních stanoviscích a studiích provedených na netěhotné populaci, nikoli na podkladě dostatečně velkých randomizovaných studií. Podrobněji byla problematika pooperační tromboprofylaxe po císařském řezu i vztahu LMWH a regionální analgezie probrána již dříve [6, 83, 84].
3. Základní stupně profylaxe TEN po císařském řezu 
Podle doporučení RCOG 2009 [80]. Schéma 1 Zhodnocení a management rizika TEN po porodu Adaptováno z doporučení RCOG 2009 [80]. ![Schéma 1 Zhodnocení a management rizika TEN po porodu
Adaptováno z doporučení RCOG 2009 [80].](https://pl-master.mdcdn.cz/media/image/405a38a2fdbbe80c12530a43b825d182.jpg?version=1537793631)
Do redakce došlo dne 31. 12. 2014.
Do tisku přijato dne 30. 1. 2015.
Adresa pro korespondenci:
MUDr. Jan Bláha, Ph.D.
KARIM 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.blaha@lf1.cuni.cz
Sources
1. Cohen S. E., Hamilton, C. L., Riley, E. T., Walker, D. S., Macario, A., Halpern, J. W. Obstetric postanesthesia care unit stays: reevaluation of discharge criteria after regional anesthesia. Anesthesiology, 1998, 89, 6, p. 1559–1565.
2. Thomas, J., Callwood, A., Brocklehurst, P., Walker, J. The National Sentinel Caesarean Section Audit. BJOG, 2000, 107, 5, p. 579–580.
3. Lucas, D. N., Gough, K. L. Enhanced recovery in obstetrics – a new frontier? International Journal of Obstetric Anesthesia, 2013, 22, 2, p. 92–95.
4. Wilmore, D. W., Kehlet, H. Management of patients in fast track surgery. BMJ, 2001, 322, 7284, p. 473–476.
5. Niranjan, N., Bolton, T., Berry, C. Enhanced recovery after Sumery – current trends in perioperative care. Update in Anaesthesia, 2010, 26, 1, p. 18–23.
6. Bláha, J., Nosková, P., Klozová, R., Seidlová, D., Štourač, P., Pařízek, A. Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu. Anest. intenziv. Med., 2013, 24, 2, p. 91–101.
7. Aluri, S., Wrench, I. J. Enhanced recovery from obstetric surgery: a U.K. survey of practice. International Journal of Obstetric Anesthesia, 2014, 23, 2, p. 157–160.
8. Štourač, P. Obstetric Anaesthesia and Analgesia Month Attributes – reálná zpráva o anesteziologické praxi na českých porodních odděleních. Anest. intenziv. Med., 2013, 24, 2, p. 81–82.
9. Nosková, P., Bláha, J., Klozová, R., Seidlová, D., Štourač, P., Pařízek, A. Postpunkční cefalea v porodnictví. Anest. intenziv. med., 2014, 25, 3, p. 194–202.
10. Bush, D. J., Lyons, G., MacDonald, R. Diclofenac for analgesia after caesarean section. Anaesthesia, 1992, 47, 12, p. 1075–1077.
11. Practice guidelines for acute pain management in the perioperative setting: an updated report by the American Society of Anesthesiologists Task Force on Acute Pain Management. Anesthesiology, 2012, 116, 2, p. 248–273.
12. Belci, D., Di Renzo, G. C., Stark, M., Duric, J., Zoricic, D., Bel-ci, M., Peteh, L. L. Morbidity and chronic pain following different techniques of caesarean section: A comparative study. Journal of obstetrics and gynaecology: the journal of the Institute of Obstetrics and Gynaecology, 2014, p. 1–5.
13. Nikolajsen, L., Sorensen, H. C., Jensen, T. S., Kehlet, H. Chronic pain following Caesarean section. Acta Anaesthesiol Scand., 2004, 48, 1, p. 111–116.
14. de Brito Cancado, T. O., Omais, M., Ashmawi, H. A., Tor-res, M. L. Chronic pain after cesarean section. Influence of anesthetic/surgical technique and postoperative analgesia. Revista brasileira de anestesiologia, 2012, 62, 6, p. 762–774.
15. Bilgen, S., Koner, O., Ture, H., Menda, F., Ficicioglu, C., Aykac, B. Effect of three different doses of ketamine prior to general anaesthesia on postoperative pain following Caesarean delivery: a prospective randomized study. Minerva anestesiologica, 2012, 78, 4, p. 442–449.
16. Reza, F. M., Zahra, F., Esmaeel, F., Hossein, A. Preemptive analgesic effect of ketamine in patients undergoing elective cesarean section. The Clinical journal of pain, 2010, 26, 3, p. 223–226.
17. Jakobi, P., Solt, I., Tamir, A., Zimmer, E. Z. Over-the-counter oral analgesia for postcesarean pain. American journal of obstetrics and gynekology, 2002, 187, 4, p. 1066–1069.
18. ČSARIM: Doporučené postupy diagnostiky a terapie. Léčba akutní pooperační bolesti. 2008.
19. Wu, C. L., Cohen, S. R., Richman, J. M., Rowlingson, A. J., Courpas et al. Efficacy of postoperative patient-controlled and continuous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis. Anesthesiology, 2005, 103, 5, p. 1079–1088; quiz 1109–1110.
20. Rosaeg, O. P., Lui, A. C., Cicutti, N. J., Bragg, P. R., Crossan, M. L., Krepski, B. Peri-operative multimodal pain therapy for caesarean section: analgesia and fitness for discharge. Canadian journal of anaesthesia, 1997, 44, 8, p. 803–809.
21. Stourac, P., Kucharova, E., Krikava, I., Maly, R., Kosinova, M. et al. Establishment and evaluation of a post caesarean acute pain service in a perinatological center:retrospective observational study. Česka gynekologie, 2014, 79, 5, p. 363–370.
22. Dolin, S. J., Cashman, J. N., Bland, J. M. Effectiveness of acute postoperative pain management: I. Evidence from published data. BJA, 2002, 89, 3, p. 409–423.
23. Royakkers, A. A., Willigers, H., van der Ven, A. J., Wilmink, J.,Durieux, M., van Kleef, M. Catheter-related epidural abscesses – don’t wait for neurological deficits. Acta Anaesthesiol. Scand., 2002, 46, 5, p. 611–615.
24. Štourač, P., Seidlová, D., Bártíková, I., Kuchařová, E., Janků, P.et al. Srovnání opioidní a neopioidní analgezie po císařském řezu v celkové anestezii – prospektivní observační studie. Anest. intenziv. Med., 2014, 25, 1, p. 8–16.
25. Munishankar, B., Fettes, P., Moore, C., McLeod, G. A. A double-blind randomised controlled trial of paracetamol, diclofenac or the combination for pain relief after caesarean section. International Journal of Obstetric Anesthesia, 2008, 17, 1, p. 9–14.
26. Dahl, V., Hagen, I. E., Sveen, A. M., Norseng, H., Koss, K. S., Steen, T. High-dose diclofenac for postoperative analgesia after elective caesarean section in regional anaesthesia. International Journal of Obstetric Anesthesia, 2002, 11, 2, p. 91–94.
27. SPC-Novalgin Injekce [www.sukl.cz/download/spc/SPC14383.pdf].
28. Practice guidelines for acute pain management in the perioperative setting. A report by the American Society of Anesthesiologists Task Force on Pain Management, Acute Pain Section. Anesthesiology, 1995, 82, 4, p. 1071–1081.
29. Owen, H., Brose, W. G., Plummer, J. L., Mather, L. E. Variables of patient-controlled analgesia. 3: Test of an infusion-demand system using alfentanil. Anaesthesia, 1990, 45, 6, p. 452–455.
30. Landau, R., Kraft, J. C. Pharmacogenetics in obstetric anesthesia. Current opinion in Anaesthesiology, 2010, 23, 3, p. 323–329.
31. Chestnut, D. H. (ed.) Obstetric Anesthesia: Principles and Practice. 4 edn. Philadelphia: Mosby, Elsevier Inc., 2009.
32. Ebneshahidi, A., Akbari, M., Heshmati, B. Patient-controlled versus nurse-controlled post-operative analgesia after caesarean section. Advanced Biomedical Research, 2012, 1, p. 6.
33. Hudcova, J., McNicol, E., Quah, C., Lau, J., Carr, D. B. Patient controlled opioid analgesia versus conventional opioid analgesia for postoperative pain. Cochrane Database Syst Rev 2006(4):CD003348.
34. Practice guidelines for acute pain management in the perioperative setting: an updated report by the American Society of Anesthesiologists Task Force on Acute Pain Management. Anesthesiology, 2004, 100, 6, p. 1573–1581.
35. Dahl, J. B., Jeppesen, I. S., Jorgensen, H., Wetterslev, J., Moiniche, S. Intraoperative and postoperative analgesic efficacy and adverse effects of intrathecal opioids in patients undergoing cesarean section with spinal anesthesia: a qualitative and quantitative systematic review of randomized controlled trials. Anesthesiology, 1999, 91, 6, p. 1919–1927.
36. Lim, Y., Jha, S., Sia, A. T., Rawal, N. Morphine for post-caesarean section analgesia: intrathecal, epidural or intravenous? Singapore medical Journal, 2005, 46, 8, p. 392–396.
37. Somrat, C., Oranuch, K., Ketchada, U., Siriprapa, S., Thipawan, R. Optimal dose of nalbuphine for treatment of intrathecal-morphine induced pruritus after caesarean section. The Journal of Obstetrics and Gynaecology Research, 1999, 25, 3, p. 209–213.
38. Slappendel, R., Weber, E. W., Benraad, B., van Limbeek, J., Dirksen, R. Itching after intrathecal morphine. Incidence and treatment. European Journal of Anaesthesiology, 2000, 17, 10, p. 616–621.
39. Horta, M. L., Morejon, L. C., da Cruz, A. W., Dos Santos, G. R., Welling et al. Study of the prophylactic effect of droperidol, alizapride, propofol and promethazine on spinal morphine-induced pruritus. British Journal of Anaesthesia, 2006, 96, 6, p. 796–800.
40. Ausseur, A., Theeten, G., Levron, J. C., Krivosic-Horber, R. Continuous epidural infusion of sufentanil after Caesarean sec-tion: concentration in breast milk. British Journal of Anaesthesia, 1994, 72, sup 1, A206.
41. Vertommen, J. D., Vandermeulen, E., Aken, H. V., Vaes, L., Soetens, M. et al. The Effects of the Addition of Sufentanil to 0.125% Bupivacaine on the Quality of Analgesia during Labor and on the Incidence of Instrumental Deliveries. Anesthesiology, 1991, 74, 5, p. 809–814.
42. Moiniche, S., Mikkelsen, S., Wetterslev, J., Dahl, J. B. A qualitative systematic review of incisional local anaesthesia for postoperative pain relief after abdominal operations. British Journal of Anaesthesia, 1998, 81, 3, p. 377–383.
43. McKeen, D. M., George, R. B., Boyd, J. C., Allen, V. M.,Pink, A. Transversus abdominis plane block does not improve early or late pain outcomes after Cesarean delivery: a randomized controlled trial. Canadian Journal of anaesthesia, 2014, 61, 7, p. 631–640.
44. Kainu, J. P., Sarvela, J., Halonen, P., Puro, H., Toivonen, H. et al. Continuous wound infusion with ropivacaine fails to provide adequate analgesia after caesarean section. International Journal of Obstetric Anesthesia, 2012, 21, 2, p. 119–124.
45. Fusco, P., Scimia, P., Paladini, G., Fiorenzi, M., Petrucci, E.et al. Transversus abdominis plane block for analgesia after cesarean delivery. A systematic review. Minerva anestesiologica, 2014.
46. Bamigboye, A. A., Hofmeyr, G. J. Caesarean section wound infiltration with local anaesthesia for postoperative pain relief – any benefit? South African medical journal, 2010, 100, 5, p. 313–319.
47. Givens, V. A., Lipscomb, G. H., Meyer, N. L. A randomized trial of postoperative wound irrigation with local anesthetic for pain after cesarean delivery. American Journal of Obstetrics and Gynekology, 2002, 186, 6, p. 1188–1191.
48. Ranta, P. O., Ala-Kokko, T. I., Kukkonen, J. E., Ohtonen, P. P.,Raudaskoski, T. H. et al. Incisional and epidural analgesia after caesarean delivery: a prospective, placebo-controlled, randomised clinical study. International Journal of Obstetric Anesthesia, 2006, 15, 3, p. 189–194.
49. Lavand’homme, P. M., Roelants, F., Waterloos, H., De Kock, M. F. Postoperative analgesic effects of continuous wound infiltration with diclofenac after elective cesarean delivery. Anesthesiology, 2007, 106, 6, p. 1220–1225.
50. Doherty, M., Buggy, D. J. Intraoperative fluids: how much is too much? British Journal of Anaesthesia, 2012, 109, 1, p. 69–79.
51. Sharma, K. K., Mahmood, T. A., Smith, N. C. The short term effect of obstetric anaesthesia on bladder function. Journal of Obstetrics & Gynaecology, 1994, 14, 4, p. 254–255.
52. Liang, C. C., Chang, S. D., Chang, Y. L., Chen, S. H., Chueh, H. Y., Cheng, P. J. Postpartum urinary retention after cesarean delivery. International journal of gynaecology and obstetrics, 2007, 99, 3, p. 229–232.
53. Onile, T. G., Kuti, O., Orji, E. O., Ogunniyi, S. O. A prospective randomized clinical trial of urethral catheter removal following elective cesarean delivery. International Journal of Gynaecology and Obstetrics, 2008, 102, 3, p. 267–270.
54. Ward, N.: Nutrition support to patients undergoing gastrointestinal surgery. Nutrition Journal, 2003, 2, p. 18.
55. Salvino, R. M., Dechicco, R. S., Seidner, D. L. Perioperative nutrition support: who and how. Cleveland Clinic Journal of Medicine, 2004, 71, 4, p. 345–351.
56. Giner, M., Laviano, A., Meguid, M. M., Gleason, J. R. In 1995 a correlation between malnutrition and poor outcome in critically ill patients still exists. Nutrition, 1996, 12, 1, p. 23–29.
57. Seong, W. J., Chong, G. O., Hong, D. G., Lee, T. H., Lee, Y. S. et al. Clinical significance of serum albumin level in pregnancy-related hypertension. The Journal of Obstetrics and Gynaecology Research, 2010, 36, 6, p. 1165–1173.
58. Mangesi, L., Hofmeyr, G. J. Early compared with delayed oral fluids and food after caesarean section. Cochrane Database Syst Rev 2002(3):CD003516.
59. Jalilian, N., Ghadami, M. R. Randomized clinical trial comparing postoperative outcomes of early versus late oral feeding after cesarean section. The Journal of Obstetrics and Gynaecology Research, 2014, 40, 6, p. 1649–1652.
60. Wee, M. Y., Brown, H., Reynolds, F. The National Institute of Clinical Excellence (NICE) guidelines for caesarean sections: implications for the anaesthetist. International Journal of Obstetric Anesthesia, 2005, 14, 2, p. 147–158.
61. Lennard-Jones, J. E., Centre KsF, Enteral WPo, Hospital PFi, Home a: A Positive Approach to Nutrition as Treatment: Report of a Working Party Chaired by Professor J. E. Lennard-Jones on the Role of Enteral and Parenteral Feeding in Hospital and at Home: King’s Fund Centre; 1992.
62. McClave, S. A., Martindale, R. G., Vanek, V. W., McCarthy, M.,Roberts, P. et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN, 2009, 33, 3, p. 277–316.
63. Braga, M., Ljungqvist, O., Soeters, P., Fearon, K., Weimann, A.,Bozzetti, F. ESPEN Guidelines on Parenteral Nutrition: surgery. Clin. Nutr., 2009, 28, 4, p. 378–386.
64. Lyons, G. Saving mothers‘ lives: confidential enquiry into maternal and child health 2003-5. International Journal of Obstetric Anesthesia, 2008, 17, 2, p. 103-105.
65. James, A. H. Prevention and management of venous thromboembolism in pregnancy. The American Journal of Medicine, 2007, 120, 10 Suppl 2, S26–34.
66. Kujovich, J. L. Hormones and pregnancy: thromboembolic risks for women. Br. J. Haematol., 2004, 126, 4, p. 443–454.
67. Heit, J. A., Kobbervig, C. E., James, A. H., Petterson, T. M., Bailey, K. R., Melton, L. J. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Annals of Internal Medicine, 2005, 143, 10, p. 697-706.
68. Pomp, E. R., Lenselink, A. M., Rosendaal, F. R., Dog-gen, C. J. Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. Journal of Thrombosis and Haemostasis: JTH, 2008, 6, 4, p. 632–637.
69. James, A. H. Pregnancy and thrombotic risk. Crit. Care Med., 2010, 38, 2 Suppl, S57–63.
70. Buhimschi, C. S., Buhimschi, I. A., Abdel-Razeq, S., Rosenberg, V. A., Thung, S. F. et al. Proteomic biomarkers of intra-amniotic inflammation: relationship with funisitis and early-onset sepsis in the premature neonate. Pediatric Research, 2007, 61, 3, p. 318–324.
71. Mahieu, B., Jacobs, N., Mahieu, S., Naelaerts, K., Vertes-sen, F. et al. Haemostatic changes and acquired activated protein C resistance in normal pregnancy. Blood coagulation & fibrinolysis: an international journal in haemostasis and thrombosis, 2007, 18, 7, p. 685–688.
72. Brenner, B. Haemostatic changes in pregnancy. Thrombosis Research, 2004, 114, 5–6, p. 409–414.
73. Johnson, R. F., Herman, N. L., Johnson, H. V., Arney, T. L. et al. Effects of fetal pH on local anesthetic transfer across the human placenta. Anesthesiology, 1996, 85, 3, p. 608–615.
74. Start, R. J., Greenberg, D. J., Herman, N. L. Use of a Wilson Convex Frame in removing “irretrievable“ epidural catheters. Anesthesia and Analgesia, 1992, 75, 2, p. 305–306.
75. Widimský, J., Malý, J., Eliáš, P., Lang, O., Franc, P., Roztočil, K.Doporučení diagnostiky, léčby a prevence plicní embolie. Vnitr. lek., 2008, 54, Suppl 1, S25-S72.
76. Horlocker, T. T., Wedel, D. J., Rowlingson, J. C., Enneking, F. K.,Kopp, S. L. et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg. Anesth. Pain Med., 2010, 35, 1, p. 64–101.
77. Marik, P. E. Venous thromboembolism in pregnancy. Clinics in chest medicine, 2010, 31, 4, p. 731–740.
78. Rosenberg, V. A., Lockwood, C. J. Thromboembolism in pregnancy. Obstetrics and Gynecology Clinics of North America, 2007, 34, 3, p. 481–500.
79. Sia, W. W., Powrie, R. O., Cooper, A. B., Larson, L., Phipps, M. et al. The incidence of deep vein thrombosis in women undergoing cesarean delivery. Thrombosis Research, 2009, 123, 3, p. 550–555.
80. Bates, S. M., Greer, I. A., Pabinger, I., Sofaer, S., Hirsh, J. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, 6 Suppl, p. 844S–886S.
81. RCOG: Thrombosis and Embolism during Pregnancy and the Puerperium, Reducing the Risk (Green-top 37a). In., 2009.
82. Bates, S. M., Greer, I. A., Hirsh, J., Ginsberg, J. S. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest, 2004, 126, 3 Suppl, p. 627S–644.
83. Bláha, J., Bláhová, K., Kolníková, I., Nosková, P. Tromboprofylaxe u císařského řezu. Prakt. Gyn. 2012, 16, 2–4, p. 81–88.
84. Bláha, J., Nosková, P., Kolníková, I., Bláhová, K. Tromboprofylaxe a neuroaxiální anestezie v porodnictví. Anest. intenziv. Med., 2012, 23, 1, p. 42–49.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2015 Issue 2-
All articles in this issue
- Sore throat after laryngeal mask insertion
- Obstructive sleep apnea (OSA) in perioperative medicine
- Current practice in Obstetric Anaesthesia. Part V – Postoperative Care after Caesarean Section
- Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine.
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obstructive sleep apnea (OSA) in perioperative medicine
- Current practice in Obstetric Anaesthesia. Part V – Postoperative Care after Caesarean Section
- Sore throat after laryngeal mask insertion
- Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



