-
Medical journals
- Career
Anesteziolog a nové technologie a trendy v kontrole glukózové homeostázy*
: Poljaková Iveta 1,2
: Ústav fyziologie Lékařské fakulty Univerzity Palackého v Olomouci 1; Středomoravská nemocniční a. s., Nemocnice Přerov 2
: Anest. intenziv. Med., 23, 2012, č. 4, s. 188-196
: Anaesthesiology - Review articles
*Přehledový článek s využitím zkušeností z vlastní studie a materiálů z 5. mezinárodní konference Advanced Technologies and Treatments for Diabetes, Barcelona 8.–11. 2. 2012.
Přehledový článek se věnuje novým možnostem v kontrole metabolismu glukózy v podmínkách perioperativní a intenzivní péče. Zahrnuje použití kontinuálního monitorování glukózy, vývoj automatického glukostatu a intervence ke snížení perioperativní hyperglykémie.
Klíčová slova:
kontrola glykémie – kontinuální monitorování glykémie – perioperativní péče – stresová hyperglykémie – diabetes mellitus – chirurgieÚvod
Chirurgická intervence aktivuje stresovou endokrinní osu – uvolňují se „katabolické“ hormony kontraregulační k účinku inzulinu (adrenalin, noradrenalin, kortizol, glukagon) a zároveň klesá vylučování inzulinu. Zvyšuje se lipolýza, glukoneogeneze v játrech a dochází k fenoménu známému jako stresová hyperglykémie (stress-induced hyperglycaemia, SIH).
Diabetici jsou v této situaci vulnerabilní nejen z důvodu narušených mechanismů kontroly glykémie, ale také kvůli preexistující cévní a imunitní dysfunkci.
Diabetes mellitus postihuje v ČR přibližně 800 000 lidí a jeho výskyt stále roste.
Opakovaně bylo potvrzeno, že rozkolísání vnitřního prostředí při nedostatečné kontrole glykémie je faktorem, který u nich přispívá k vyššímu výskytu pooperačních infekcí i cévních komplikací. Rizikem je dlouhodobější perzistující hyperglykémie i výrazná variabilita glykémie [1–3]. K tomu, aby jejich pooperační prognóza byla srovnatelná s nediabetickou populací, potřebujeme nové technologie umožňující personalizovaný přístup v kontrole glukózové homeostázy.
Po letech diskusí (studie Leuvenská, GLUControl, NICE-SUGAR, VISEP, SPRINT) se odborná veřejnost shodla na konsenzu, že pooperační komplikace lze redukovat „liberální“ kontrolou glykémie. Ta by měla být udržována v cílovém rozmezí od 4,4 do 10 mmol/l, přičemž spíše než nebezpečné výkyvy glykémie při snaze o příliš těsnou kompenzaci je tolerována ojedinělá hyperglykémie do 11 mmol/l. Trendem je nastolit glykemickou stabilitu v rámci denního biorytmu glykémie.
V běžné praxi u diabetiků operovaných v ČR však splňuje tato kritéria pouze malá část z nich – v naší vlastní studii za použití CGMS [4] byla v pásmu euglykémie po dobu tří perioperativních dní jen 4 z 20 provedených měření, přičemž polovina sledovaných pacientů běžně překračovala glykémie 15 mmol/l.
Při kontrole glykémie jsme prozatím odkázáni na izolované intermitentní manuální odběry. Ty jsou pracné, zatěžují pacienty a poskytují pouze bodovou, nikoliv kompletní informaci o glykemickém profilu operovaného diabetika. To nám znemožňuje udržet pacienty bezpečně v doporučeném glykemickém rozmezí a jako menší zlo jsou tolerovány hyperglykemické epizody.
Kdy dojde k tomu, abychom tak, jak jsme zvyklí peroperačně sledovat on line hemodynamické a ventilační parametry, zapnuli na monitoru „metabolický“ modul? Nejblíže k realizaci je právě monitorování glykémie.
Subkutánní minimálně invazivní senzory ke kontinuálnímu měření glykémie (Minimally invasive subcutaneous glucose sensing)
Senzory schopné kontinuálně měřit glykémii v intersticiální tekutině, tzv. Real Time Continuous Glucose Monitoring systems (RT-CGMS) se již od roku 1999 používají v ambulantním self-monitoringu diabetiků.
V ČR jsou používány zatím dva typy senzorů – Guardian® REAL-Time CGMS firmy Medtronic a dále Dexcom TM Seven ® Plus firmy DexCom. Zavádějí se na dobu ne delší než jeden týden.
Oba systémy využívají miniaturní podkožní elektrodu. K jejímu umístění je možné použít prakticky kterékoliv místo, kde zavedený senzor nevadí a nehrozí jeho dislokace. Většinou se zavádí v oblasti břicha vpravo či vlevo od pupku, používá se i rameno. Samotný výkon zavedení elektrody hodnotili pacienti zahrnutí v naší studii [4] jako méně bolestivý, než je běžná injekce inzulinu. Detekce glukózy probíhá na enzymatickém podkladě. Senzor firmy Medtronic využívá glukooxygenázovou reakci, i když možné jsou i jiné technologie [5, 6]. Při reakci s glukózou dochází úměrně její koncentraci ke vzniku elektrického proudu, který je registrován a převáděn na vysílač – transmitter, připojený k senzoru. Měření se provádí po 10 sekundách, průměr z těchto hodnot je vysílán každých pět minut do monitoru, který může být buďto samostatný (obr. 1), či integrovaný do inzulinové pumpy, popř. se může jednat i o systém zaslepený, kdy se data ze senzoru stáhnou až po ukončení monitorování. Se senzorem přelepeným náplastí se lze sprchovat i koupat. Transmitter má omezený dosah – zhruba 2,5 m, proto je třeba monitor udržet v blízkosti těla. Monitor je zařízení velikosti menšího mobilního telefonu, zachycený signál se v něm zpracuje a přepočítá na koncentraci glukózy v krvi. Tento algoritmus bere v úvahu prostřednictvím kalibrační hodnoty aktuální fyziologii daného pacienta. Dvakrát denně je nutno monitor kalibrovat externím vložením hodnoty glykémie změřené dostupným spolehlivým analyzátorem.
1. Zavedený senzor s transmitterem přelepený náplastí, monitor Guarrdiian<sup>®</sup> REAL-Tiime CGMS firmy Medtronic (foto autorka) 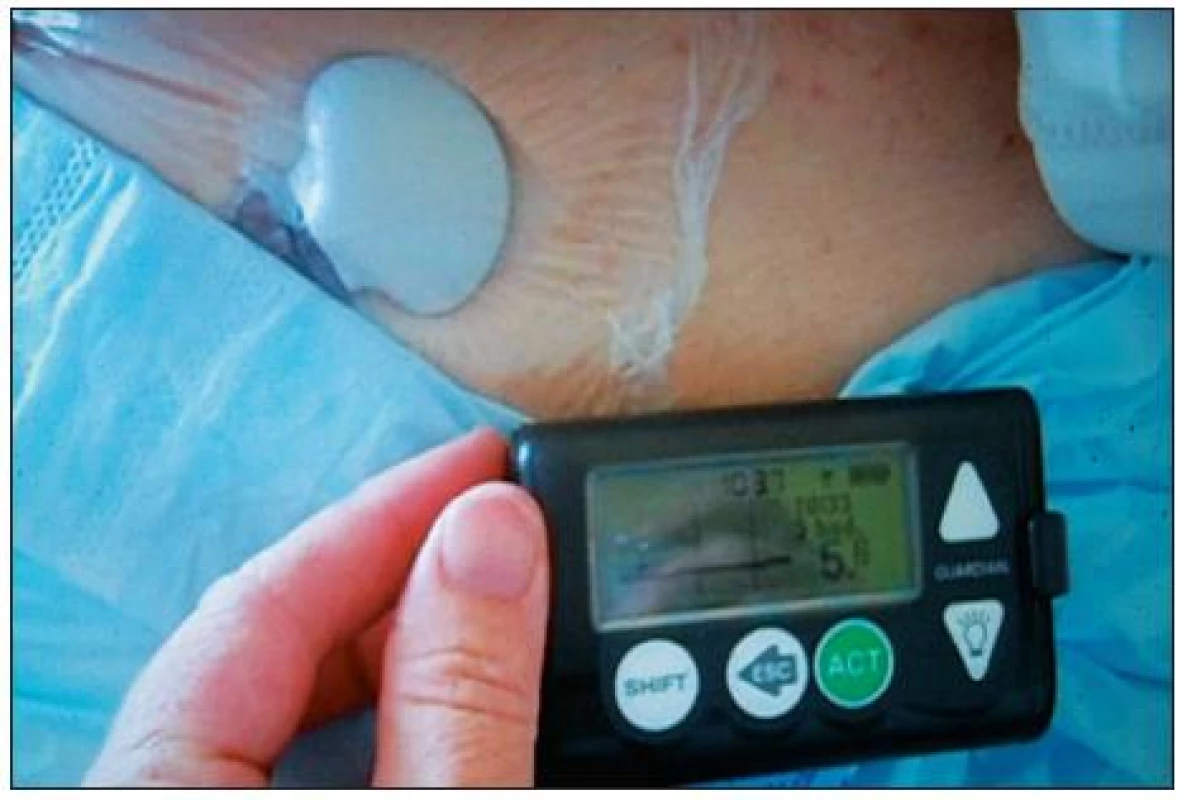
Na displeji monitoru můžeme sledovat aktuální glykémii i historickou křivku jejího vývoje. Je možné nastavit alarmy upozorňující nejen na aktuální krajní hodnoty glykémie, ale také na trend směřující k těmto extrémům. Data lze stáhnout do PC a vyhodnotit statistickým softwarem. Je možno hodnotit reakci glykémie na přívod inzulinu, medikaci, chirurgickou intervenci (operace v anestezii, bolestivý převaz), jídlo a fyzickou aktivitu – tyto i jiné údaje lze průběžně do monitoru či pumpy zadávat.
Dalšími komerčně dostupnými subkutánními senzory na světovém trhu jsou FreeStyle Navigator® System firmy Abbott, a GlucoMen Day firmy Menarini (jako jediný založený na mikrodialýze). Přesnost všech těchto nejznámějších miniinvazivních glukózových senzorů se sice v určitých situacích poněkud liší [7, 8], ale klinicky je poměrně srovnatelná.
Spolehlivý biosenzor glukózy je základním kamenem pro vývoj tzv. closed-loop systems – tedy zcela uzavřené smyčky, technologie umělého pankreatu. Firmy své výrobky proto stále zdokonalují ve snaze vyvinout co nejpřesnější „high performance“ senzory, pracující neomylně za jakýchkoliv fyziologických i patologických situací. Nově vyvíjená generace bude zřejmě využívat fluorescenci, která eliminuje rušivé vlivy kyslíkových radikálů z reakce kolem implantátu. Na zvířecích modelech jsou testovány implantabilní senzory schopné dlouhodobého výkonu.
Neinvazivní CGMS
Za zmínku stojí i vývoj neinvazivních, transdermálních senzorů. Tyto zatím nedosahují dostatečné přesnosti, aby byly schváleny ke klinickému použití – potýkají se zejména s variabilním odporem kožní bariéry. K překonání tohoto handikepu některé systémy používají tzv. multitechnologii – měří více parametrů současně včetně kožní teploty a tím částečně eliminují chybu měření. Kalibrace je u nich nezbytností.
Mívají formu náramku (GlucoWatch® biographer na principu iontoforézy), ušního klipu (GlucoTrack multisenzor využívajíci ultrazvuk, elektromagnetické vlnění a termistor), nebo jsou připevněny páskem k tělu (C8 MediSensors na principu Ramanovy spektroskopie).
Bezpečnost subkutánních senzorů
Při zavedení senzoru je dosud jediným známým nežádoucím účinkem vznik reakce kolem cizího tělesa. Společná studie lékařských fakult v Olomouci a v Košicích vyhodnotila vedlejší účinky 420 senzorů zavedených celkem po dobu 2537 dní. Za tuto dobu se vyskytla pouze jedna závažnější komplikace – týkala se senzoru atypicky zavedeného v nepříznivé lokalizaci na hýždi, kolem něhož se vytvořil absces s následnou nutností drenáže [9].
Subklinická tkáňová reakce se kolem elektrody vyskytuje běžně, tvorba biofilmu na povrchu membrány a vznik kyslíkových radikálů s postupujícím věkem senzoru může být příčinou nepřesností v měření [10].
Přesnost měření glykémie a CGMS
Obecně nejpřesnější metodou měření glykémie jsou certifikované laboratorní analyzátory. V podmínkách intenzivní péče je dobrým standardem analyzátor krevních plynů. I tyto metody mají určitou míru neshody, a to zejména při nižších hodnotách glykémie. Glukometry, přestože v intenzivní péči u nás často používané, nejsou pro klinickou praxi považovány za dostatečně přesné [11–13].
Arbitrárně stanoveným měřítkem přesnosti jednotlivých biosenzorů glykémie je Mean Absolute Relative Difference (MARD), což je míra průměrné odchylky hodnot naměřených senzorem ke standartu – krevnímu analyzátoru Yellow Springs Instruments – YSI. Čím nižší je hodnota MARD, tím je senzor přesnější. Další mírou přesnosti je modifikovaná Clarkova „chybová mřížka“ tzv. Clarke glucose-error grid analysis, která nejenže porovnává přesnost měření se standartem, ale také zohledňuje chybu měření CGMS s ohledem na závažnost případné navazující nesprávné nebo nedostatečné terapeutické intervence [14, 15]. Pro kontinuální měření glukózy se využívá modifikace této metody – CG-EGA [16].
První CGMS měly omezenou přesnost zejména v pásmu hypoglykémie, od té doby se však jejich spolehlivost významně zvýšila. Nejnovější, již komerčně dostupná generace senzorů firmy Medtronic (Enlite) dosahuje MARD 15,3 %. Konkurent DexCom vyvíjí senzor Dexcom Gen4 Sensor s MARD 12,3 %.
Pěkné přirovnání CGMS k laboratorním analyzátorům glykémie uvádí Rice [17]: „Hodnota z analyzátoru odpovídá přesnému statickému snímku (absolutní hodnota glykémie), zatímco kontinuální měření lze přirovnat k natáčení videokamerou (trend vývoje glykémie). Obraz na videofilmu, pokud ho zastavíme, je méně ostrý, ale film jako celek nám poskytuje přesnější vhled do probíhajícího děje než série snímků.“
Vzhledem k tomu, že senzory měří v jiném tělním kompartmentu než v krvi – totiž v intersticiu – musíme brát při interpretaci výsledků v úvahu tzv. time-lag, čili zpoždění do vyrovnání koncentrace glukózy mezi krví a intersticiem. Intersticium se opožďuje za hladinou v krvi při vzestupu glykémie o 15–20 minut, při poklesu do 5 minut, přičemž tato doba záleží na typu senzoru. Je však otázkou, zda hodnota v intersticiu není pro klinika vlastně více vypovídající – hypoglykémie v CNS se projeví až při nedostatku glukózy v intersticiální tekutině. Hladina glukózy v intersticiu tedy může odrážet přesněji koncentraci glukózy v CNS než její hladina v krvi. Tuto teorii dosud nikdo neprozkoumal, bylo by ji možné posoudit paralelním měřením glukózy v CNS mikrodialyzačními senzory.
Klinická použitelnost subkutánních CGMS peroperačně
Průkopnicí v peroperačním používání CGMS je Hannah Piper z Children’s Hospital v Bostonu (Harvard Medical School). V r. 2006 použila senzory Medtronic Minimed na 22 dětech do 3 let, které podstupovaly kardiochirurgický výkon. Získala 246 párových hodnot glykémií porovnávajících senzory s laboratorním analyzátorem. Zjistila, že použití senzorů je bezpečné (žádné krvácení ani reakce tkáně kolem senzoru) a že senzory dobře fungují i v podmínkách alterované perfuze podkoží při hypotermii, nutnosti inotropní podpory a otocích. Uzavřela, že jejich použití usnadňuje peroperační management glykémie [18].
V období od 1. 7. 2010 do 30. 6. 2011 jsme provedli 20 peroperativních měření senzory Guardian® REAL-Time CGMS firmy Medtronic u pacientů s DM II či poruchou glukózového metabolismu (IGT) v průběhu celkem 95 perioperativních dní [4]. Naše zkušenosti lze shrnout do následujících bodů:
- Senzor je nutno zavést minimálně dvě hodiny před plánovanou operací. Tyto dvě hodiny potřebuje k aklimatizaci v podkožní tkáni, pak teprve sám zvukovým signálem na monitoru zažádá o kalibraci a poté začne ukazovat hodnoty glykémie.
- Kalibrace je z hlediska přesnosti měření zásadní úkon. Je vhodné, aby na kontinuální monitorování dohlížel vyškolený SZP tým.
- Pro kalibraci je nutné zvolit dobu, kdy glykémie co nejméně kolísá (tj. před jídlem, nikoliv při infuzi glukózy, po injekci inzulinu atd.) a kdy je tedy co nejmenší předpoklad nepoměru koncentrace glukózy mezi krevní plazmou a intersticiem. Samotný odběr glykémie musí být proveden bezchybně a její hodnota měřena na co nejspolehlivějším přístroji. Nejvhodnější pro intenzivní péči je analyzátor krevních plynů, pokud je dostupný. Lze jej sice nahradit glukometrem (pro ambulantní self-monitoring diabetiků je standardem), avšak při použití za peroperačních podmínek, kdy hodnoty glykémie mohou více kolísat a nároky na přesnost jsou vyšší, není tento postup zcela spolehlivý. Je zapotřebí alespoň vybrat osvědčený typ glukometru, který např. neinterferuje s hladinami hemoglobinu. Pokud zadáme kalibrační glykémii nepřesně, celé glukózové monitorování na dalších 12 hodin je tomu úměrně zkreslené. Pro zpřesnění je možno kalibrovat i v mezidobí mezi dvěma předepsanými kalibracemi [19].
- Je třeba počítat s tím, že senzory firmy Medtronic měří glykémii pouze v rozpětí 2,2–22,5 mmol/l.
- Jak již bylo řečeno, je monitor je nutné udržovat ve vzdálenosti maximálně 2,5 m od těla monitorovaného pacienta. Telemetrické propojení se vzdáleným monitorem by bylo pro klinické využití v budoucnu rozhodně vhodné. Občasné výpadky signálu v monitorování jsou ve valné většině způsobeny nedodržením tohoto pravidla (obr. 2, 3).
- Při samotném měření na operačním sále jsme na rozdíl od předchozí uvedené práce [18] nezaznamenali žádnou interferenci s používanými elektrickými přístroji (např. elektrokauter) ani s anesteziologickou elektronikou.
- Péče o CGMS je poměrně snadná, vyžaduje krátkou edukaci ošetřujícího zdravotního personálu, který jsme vybavili stručným návodem k použití a SOS telefonním číslem. Bez problémů byla spolupráce se SZP na JIP (chirurgických i JIP interní). Na standardních odděleních byla reakce SZP individuální, ale spíše převládala obava z nové techniky, přičemž výhody CGMS zůstávaly do značné míry nevyužity. Tuto nevýhodu by odstranil vyčleněný mobilní SZP tým, který by prováděl supervizi CGM na standardních odděleních a průběžně jejich personál doškoloval.
- Nutno ještě podotknout, že je třeba dát pozor na případnou náhlou perioperační indikaci magnetické rezonance ze strany chirurga a monitorování před tímto vyšetřením ukončit.
- Souhrnem, v současnosti perioperativní CGM může posloužit jako užitečné vodítko pohybu glykémie. Hodnota na displeji nemůže být sice jediným podkladem k léčebné intervenci – je třeba ji ověřit odběrem glykémie – ale je podstatné, že nám může zavčas avizovat nutnost tohoto odběru.
2. Žena (1932), DM 2. typu na inzulinu Dne 30. 7. 2011 provedena amputace dolní končetiny v Chopartově kloubu. Perzistentní perioperativní hyperglykémie. 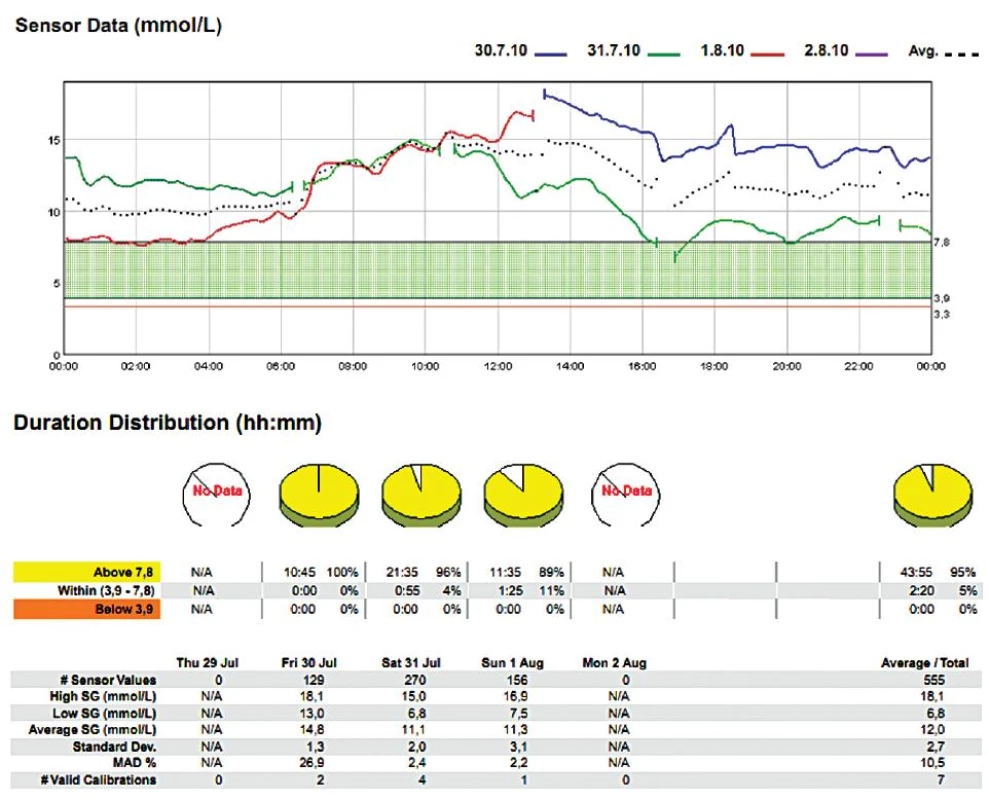
3. Muž (1953), DM 2. typu na inzulinu Dne 21. 6. 2011 proveden aortofemorální bypass s profundoplastikou (10.30–14.30 hod) v celkové anestezii, téhož dne reoperován – provedena endarterektomie a trombektomie (14.30–16.30 hod) v subarachnoidální anestezii. Přes den podány tři infuze s glukózou: glukóza 10% 500 ml s 4 j. Humulin R od 6.00 do 9.00 hod, glukóza 10% 500 ml s 20 j. Humulin R od 15.30 do 17.30 hod, glukóza 10% 500 ml s 20 j. Humulin R od 19.30 do 21.30 hod. 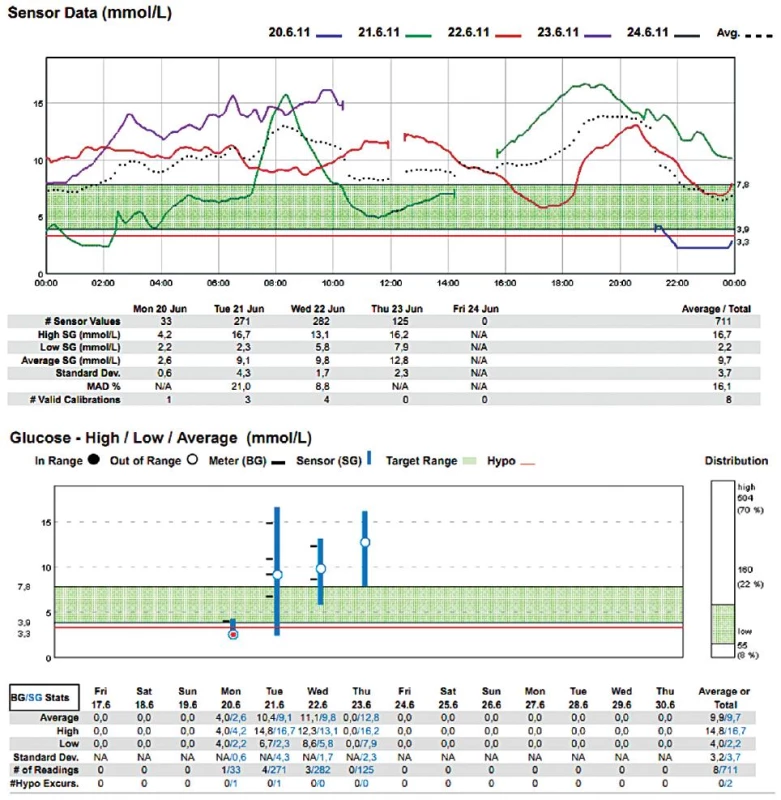
Použitelnost subkutánních CGM v intenzivní péči
Brzy od zavedení CGMS do klinické praxe byly tyto přístroje testovány v podmínkách intenzivní péče.
V roce 2004 Goldberg použil Medtronic MiniMed u 22 pacientů interní JIP po dobu 3 dní. 98,7 % hodnot bylo klinicky akceptovatelných podle Clarke Error Grid Analysis. Uzavřel, že se jedná o metodu omezující výkyvy glykémie na JIP, slibnou i pro vědecké účely [20]. V roce 2007 byl Medtronic MiniMed testován v intenzivní péči kardiaků a byl shledán vhodným pro usnadnění sesterského ošetřování [21]. Logtenberg r. 2009 shledává CGM bezpečným a vyhovujícím přijatým standardům, ale podotýká, že drobné nepřesnosti brání jeho neomezenému použití v klinické praxi [22]. Další pracoviště využilo senzory k vyhodnocení rozsahu hyperglykémie u 20 kriticky nemocných nediabetických dětí [23]. Ukázalo se, podobně jako u naší studie [4], že rozsah hyperglykémie je při použití intermitentních odběrů podceněn. Scuffi [24] využívá výsledků CGM k výpočtu glykemické variability u kriticky nemocných v reálném čase. Samostatnou kapitolou je užití CGMS u nedonošených dětí a novorozenců diabetických matek. CGMS zde úspěšně odhalilo mnoho epizod hypoglykémie nerozpoznaných intermitentními odběry [25, 26], i když větší senzitivita CGMS v oblasti hypoglykémie by u této specifické skupiny byla přínosem (u použitých senzorů firmy Medtronic je omezena spodním limitem detekce glykémie 2,2 mmol/l).
V ČR se použitím CGMS v intenzivní péči zabývala A. Stoszková. Srovnávala mikrodialýzu a senzory RT-CGM Guardian, Medtronic s arteriální a smíšenou žilní glykémií. Její výsledky (Pearsonův korelační koeficient u obou metod blízký 0,7) nepodpořily použití senzorů u kriticky nemocných [27]. Na její stranu se přiklání i Ligtenberg, který zkoumal přesnost senzorů Gold (Medtronic Minimed) a přestože 98,3 % hodnot se nacházelo v klinicky akceptabilních zónách podle EGA, kvůli 1,5 % hodnot, kde by mohlo dojít k nesprávné léčbě (šlo o 9 pacientů, 8 z nich bylo léčeno vazopresory) nedoporučuje subkutánní CGMS jako jedinou metodu ke kontrole glykémie za podmínek intenzivní péče [28].
Hodně citovaná Brunnerova práce [29] zahrnuje data ze dvou randomizovných studií, celkem 174 pacientů intenzivní péče, kteří k udržení normoglykémie potřebovali inzulin. Byl použit systém RT-CGM Guardian, Medtronic a odebráno 2045 párových hodnot glykémie. Hodnoty získané pomocí CGMS byly srovnány s arteriální krví (analyzátor krevních plynů). Pearsonův korelační koeficient byl 0,92, s 92,9 % hodnot v mezích ISO standartu a 99,1 % hodnot v rozmezí přijatelně spolehlivém pro klinické použití. Výsledek práce vyzněl dle závěru autorů ve prospěch spolehlivosti tohoto typu CGMS u kriticky nemocných.
Studie Holzingerové [30] dospěla k závěru, že CGM (Medtronic) redukuje hypoglykemické epizody u kriticky nemocných, i když nezlepšuje kontrolu glykémie ve srovnání s intenzivní inzulinovou terapií řízenou algoritmem. Další zajímavá práce z téhož pracoviště [31] neprokázala žádný vliv oběhového selhání vyžadujícího podporu noradrenalinem během 72hodinového měření na přesnost měření téhož CGMS.
Lze shrnout, že se zdokonalováním senzorů a za použití přesné techniky kalibrace se CGMS stává použitelným v monitorování kriticky nemocných. Se zvýšenou spolehlivostí senzorů a jejich nižší cenou lze v budoucnu předpokládat široký nástup této technologie.
Intravenózní senzory
Takzvané intravenous blood glucose monitoring system’s – jsou invazivní systémy vyvíjené přímo pro účely intenzivní péče, pro pacienty se zajištěnou žilní linkou.
Firma Edwards Lifesciences Corporation, známá z oblasti hemodynamického monitorování, ve spolupráci s firmou DexCom vyvíjejí automatický intravenózní GMS použitelný pro jednotku intenzivní péče GLUCOCLEAR. Sestává z i. v. katétru obsahujícího elektrodu a senzor (opět na podkladě glukooxidázové reakce) a kalibrační i. v. infuze. Senzor vydává hodnoty každých 7,5 minut. Zatím je ve fázi klinických studií [32].
OptiScanner (OptiScan Biomedical) aspiruje každých 15 minut 3ml vzorek krve, po centrifugaci změří v 0,12 ml krve koncentraci glukózy v plazmě infračerveným senzorem a zbylou krev vrací do oběhu pacienta. Jiná zařízení rovněž aspirují vzorek krve a detekují glukózu na principu enzymatické reakce. Švédská firma CMA Microdialysis vyvíjí systém na principu mikrodialýzy využívající centrální venózní katétr. Zkoušejí se i jiné technologie [33–36].
Intravenózní senzory nejsou ovšem zatím v rutinním klinickém použití a jejich rizikem je nutnost nitrožilního přístupu, možná interference s intravenózně podávanými roztoky a u některých i nutnost antikoagulace.
Umělý glukostat („artificial pancreas“, AP)
Vývoj technologie léčby diabetu spěje k vytvoření „closed loop“ („uzavřené smyčky“), tedy zařízení, které si bude samo dávkovat inzulin a dokáže jej titrovat na cílové hodnoty bez vnějšího zásahu člověka.
Novější inzulinové pumpy propojené se senzorem již disponují funkcí automatického zastavení přívodu inzulinu v případě hrozící hypoglykémie (tzv. LGS – „low-glucose suspend“ pumpy, v ČR je dostupná Paradigm® Veo™ firmy Medtronic). Jsou vynikající v prevenci nočních hypoglykémií a diabetici s nimi dosahují těsnější kompenzace, protože jsou jištěni proti hypoglykémii.
Evropský projekt výzkumu umělého pankreatu AP@home má modulární strukturu. Jednotlivé výzkumné týmy řeší vymezené úkoly.
Idea umělého pankreatu obecně sestává ze tří úhelných kamenů – prvním z nich jsou výše popsané biosenzory glykémie, které se stále zdokonalují, miniaturizují a směřují k menší invazivitě. Druhým jsou zařízení dodávající inzulin, kde také dochází k miniaturizaci – vyvíjejí se již dokonce pumpy „náplasťové“. Aby nebyly nutné dvě perforace kůže, jsou testovány dokonce „single port“ mikroperfuzní katétry, které simultánně měří i dodávají inzulin. Jsou také snahy o vývoj kanyly, která v sobě spojuje funkci senzoru i pumpy – reaguje totiž na koncentraci glukózy v intersticiu a podle ní mění svou propustnost pro inzulin (hydrogel s nanopóry) [37]. V podstatě však mezi oba koncové články, senzor a pumpu, musí být vložen inteligentní mechanismus schopný predikce vývoje glykémie a úpravy dávkování inzulinu.
Na algoritmus MPC (model predictive control) a jeho personalizaci se nyní soustředí mezinárodní vědecké úsilí. Kontrolovat glykémii přes den, při různorodé fyzické aktivitě a nahodilém příjmu smíšené potravy s různým výsledným glykemickým indexem, je výzvou pro informatiky [38]. Problém je v interindividuálních fyziologických rozdílech – vstřebávání potravy u mnohých diabetiků zpomaluje gastroparéza, vyskytují se u nich častěji také poruchy zevní sekrece pankreatu, mají různou citlivost k inzulinu a také jeho variabilní absorpci z podkoží. Vznikají aproximativní absorpční modely pro různá směsná jídla a behaviorální modely anticipace dalšího jídla. Překážkou je také časový posun mezi objevením se inzulinu v oběhu a detekcí snižující se glykémie monitorem.
Umělý pankreas se tedy zatím testuje hlavně „in silico“, tedy simulacemi na počítači. Probíhají testy na zvířecích modelech.
Je testován i umělý pankreas bihormonální (kromě inzulinu využívá i glukagon).
Dokončení vývoje umělého pankreatu pro běžné denní použití se předpokládá již v této nebo v další dekádě.
Automatický glukostat pro intenzivní péči
Kdy budeme moci v intenzivní či peroperační péči nastavit glykémii na „autopilota“?
Glukostat do podmínek intenzivní péče je konstrukčně snazší – větší rozměry zde nevadí, invazivní nitrožilní přístup je většinou zajištěn, pohyb pacienta minimalizován a dodané kalorie jsou kontrolovatelné.
Tato zařízení jsou vyvíjena již od r. 1977, kdy byl testován Biostator [39] a vzápětí po něm v Japonsku Nikkiso STG-22 Blood Glucose Controller [40]. Vývoj „umělého pankreatu“ pro intenzivní péči však byl relativně pomalý a podfinancovaný [41]. Snad nejvíce zkušeností s ním mají Japonci. Sedované a ventilované pacienty udrží v těsném rozmezí glykémie 4,44–8,33 mmol/l, bez hypoglykémie. Přístroj velikosti ventilátoru zatím není přenosný. Studií s jeho inovovaným prototypem byla publikována celá řada za podmínek perioperativní medicíny, postoperativní sepse, resekce pankreatu aj. [42–46].
Roku 2003 byl učiněn pokus použít subkutánní senzor Medtronic Minimed pro uzavřenou smyčku kontroly krevního cukru [47].
Jako „otevřenou smyčku“ v podmínkách intenzivní péče lze uvést systém Glucommander v USA nebo u nás testovaný systém Space GlucoseControl firmy B. Braun Medical. Oba sestávají z perfuzoru a algoritmu, který na základě kumulativních naměřených hodnot glykémie, případně obsahu sacharidů v parenterální a enterální stravě, generuje doporučení dávkování inzulinu v následujícím časovém úseku. Konečné rozhodnutí je ale na ošetřujícím personálu a není užíváno kontinuální měření glykémie.
Nebezpečí nerozpoznané hypoglykémie v průběhu anestezie nebo ve spánku
Spekuluje se, že určité procento pooperačních „iktů“ nebo „tranzitorních ischemických atak CNS“ mohlo být zapříčiněno nerozpoznanými peroperačními hypoglykémiemi. Zde by mělo rutinní peroperační použití CGMS u rizikových pacientů velký preventivní účinek.
V našem souboru 20 měření [4] jsme jeho prostřednictvím žádnou peroperační hypoglykémii nezachytili, zřejmě rutinní předoperační „vykrývací infuze“ glukózy byly dostatečnou prevencí – ovšem za cenu, že kyvadlo glykémie rozkývaly na opačnou stranu (viz obr. 2, 3). Zaregistrovali jsme však hypoglykémie denní i noční v pooperačním období, které nebyly zachyceny běžnými intermitentními odběry (viz obr. 3).
Intenzivisté sloužící na RZP se setkávají se syndromem náhlé smrti ve spánku („Dead in bed“ syndrom). U pacientů vybavených CGMS, kteří zemřeli na tento syndrom, byly retrospektivním vyhodnocením křivky nalezeny hypoglykémie předcházející úmrtí. To vedlo k přehodnocení pohledu na etiologii tohoto syndromu, z kterého byly dosud obviňovány především náhlé srdeční arytmie. Zřejmě může být často pravou příčinou (a případným triggerem arytmie) nerozpoznaná noční hypoglykémie. Přitom večerní hodnoty glykémie nebývají pro výskyt nočních hypoglykémií prediktivní.
Co s pooperační inzulinovou rezistencí?
Lze ji snížit i jinak než zvýšenými dávkami inzulinu?
Rychlé a správné zvládnutí základního onemocnění, kontrola infekce, bolesti (i při převazech) a procesy podporující rychlé hojení nejúčinněji přispívají k úpravě glukózové homeostázy.
Zajímavé by bylo srovnání různých druhů vedení anestezie na glukózový metabolismus [48].
Zamezení zbytečně dlouhému předoperačnímu lačnění a vhodná časná pooperační realimentace snad také snižují pooperační inzulinovou rezistenci [49, 50].
Ojedinělé práce hodnotily příznivý vliv různých medikamentů na stresovou hyperglykémii – byl zkoušen metformin a propranolol u spálenin [51], glukagon-like peptid-1 [52] a také sympatolytická premedikace klonidinem (antagonista alfa adrenergních receptorů), která mechanismem snížení cirkulujících katecholaminů nejen snižuje peroperační hypertenzi (u nás pozorování doc. Hesse), ale přispívá také k metabolické stabilitě [53].
Velmi nadějné jsou výsledky studie RABBIT s použitím bazálního inzulinu v peroperačním období [54].
K odstranění stresu patří i omezení psychické nepohody. Pečujeme-li o diabetika po amputaci končetiny, který se trápí tím, jak zvládne péči o nemocného na něm závislého partnera, nevystačíme si jen s technologií – bude zapotřebí sjednocené úsilí lékaře, psychologa či kněze, sociálního pracovníka, rehabilitační sestry i pacientovy rodiny.
Závěr
Diabetologie prodělává v současné době prudký vývoj. Účelem článku bylo seznámit anesteziology a intenzivisty se současnými možnostmi použití kontinuálního měření glykémie a souvisejícími technologiemi a postupy, jejichž cílem je bezpečné dodržení doporučeného rozmezí glykémie i u pacientů v dynamických podmínkách perioperativního období a intenzivní péče.
Podpořeno grantem IGA UP LF 2010/009.
Do redakce došlo dne 4. 4. 2012.
Do tisku přijato dne 12. 6. 2012.
Adresa pro korespondenci:
MUDr. Iveta Poljaková
Ústav fyziologie LFU
Hněvotínská 3
775 15 Olomouc
e-mail: iveta.poljakova@seznam.cz
Sources
1. Bochicchio, G. V., Joshi, M., Bochicchio, K. M. Early hyperglycemic control is important in critically injured trauma patients. 2007, 63, 6, p. 1353–1359.
2. Lipshutz, A. K. M., Gropper, M. A., Ramos, M. Perioperative Glycemic Control: An Evidence-based Review. 2009, 110, 2, p. 408–421.
3. Ramos, M., Khalpey, Z., Lipsitz, S. et al. Relationship of perioperative hyperglycemia and postoperative infections in patients who undergo general and vascular surgery. 2008, 248, 4, p. 585–591.
4. Poljaková, I., Chlup, R., Kalabus, S. et al. Zkušenosti s perioperativním monitoringem glykémie. 2011, 5, p. 286.
5. Rice, M. J., Pitkin, A. D., Coursin, D. B. Glucose measurement in the operating room: More complicated than it seems. 2010, 110, p. 1056–1065.
6. Oliver, N. S.,Toumazou, C., Cass, A. E. G. et al. Glucose sensors: a review of current and emerging technology. 2009, 26, 3, p. 197–210.
7. Buckingham, B. Clinical overview of continuous glucose monitoring. 2008, 2, 2, p. 300–306.
8. Kovatchev, B., Anderson, S., Heinemann, L., Clarke, W. Comparison of the Numerical and Clinical Accuracy of Four Continuous Glucose Monitors. 2008, 31, 6, p. 1160–1164.
9. Chlup, R., Matušková, V., Jadviščoková, T. et al. Prezentováno na 44. diabetologických dnech v Luhačovicích 17.–19. 4. 2008.
10. Klueh, U., Frayleyi, J., Qiaoi, Y. et al. The role of macrophages in continuous glucose monitoring. 2007, 1, 5, p. 669–675.
11. Desachy, A., Vuagnat,. A. C., Ghazali, A. D. et al. Accuracy of bedside glucometry in critically ill patients: Influence of clinical characteristics and perfusion index. 2008, 83, p. 400–405.
12. Kanji, S., Buffie, J., Hutton, B. et al. Reliability of point-of - -care testing for glucose measurement in critically ill adults. 2005, 33, 12, p. 2778–2785.
13. Bláha, J. Kontrola glykémie v intenzivní péči. Ne jestli, ale jak. 2009, 19, 3, s. 128–130.
14. Clarke, W. L., Kovatchev, B. Continuous Glucose Sensors: Continuing Questions about Clinical Accuracy. 2007, 1, 5, p. 669–675.
15. Kovatchev, B. P., Gonder-Frederick, L. A., Cox, D. J., Clarke, W. L. Evaluating the accuracy of continuous glucose-monitoring sensors: Continuous glucose-error grid analysis illustrated by TheraSense Freestyle Navigator data. 2005, 28, 10, p. 2412–2417.
16. Clarke, W., Kovatchev, B. Statistical Tools to Analyze Continuous Glucose Monitor Data. Diabetes Technol. Ther., 2009, 11, S1, p. 45–54.
17. Rice, M. J., Coursin, D. B. Continuous Measurement of Glucose: Facts and Challenges. 2012, 116, 1, p. 199–204.
18. Piper, H. G., Alexander, J. L., Shukla, A. et al. Real-Time Continuous Glucose Monitoring in Pediatric Patients During and After Cardiac Surgery. 2006, 118, 3, p. 1176–1184.
19. Beauharnais, C. C., Nathan, D. M., Russell, S. J. et al. Presented at Advanced Technologies and Treatments for Diabetes, 5th International Conference, Barcelona, 8.–11. 2. 2012.
20. Goldberg, P. A., Siegel, M. D., Russell, R. R. et al. Experience with the Continuous Glucose Monitoring System® in a Medical Intensive Care Unit. 2004, 6, 3, p. 339–347.
21. Rowen, M., Schneider, D. J., Pratley, R. E. et al. On rendering continuous glucose monitoring ready for prime time in the cardiac care unit. 2007, 18, 5, p. 405–409.
22. Logtenberg, S. J., Kleefstra, N., Snellen, F. et al. Pre - and Postoperative Accuracy and Safety of a Real-Time Continuous Glucose Monitoring System in Cardiac Surgical Patients: A Randomized Pilot Study. 11, 1, 200, p. 31–37.
23. Allen, H. F., Rake, A., Roy, M. et al. Prospective detection of hyperglycemia in critically ill children using continuous glucose monitoring. 2008, 9, 2, p. 153–158.
24. Scuffi, C., Lucarelli, F., Valgimigli, F. Presented at Advanced Technologies and Treatments for Diabetes, 5th International Conference, Barcelona, 8.–11. 2. 2012.
25. Harris, D. L., Battin, B. R., Weston, P.J. et al. Continuous Glucose Monitoring in Newborn Babies at Risk of Hypoglycemia 2010, 157, 2, p.198–202.
26. Platas, I. I., Lluch,M. T., Alminana, N.P. et al. Continuous glucose monitoring in infants of very low birth weight. 2009, 9, p. 217–223.
27. Stoszková Vlková, A., Dostál, P., Musil, F. et al. Hladina glukózy v krvi a ve tkáni u kriticky nemocných pacientů – srovnání odlišných metod stanovení intersticiální hladiny glukózy. 2009, 3, s. 153–157.
28. Ligtenberg, J. J., Borggreve, H. F., Sternerdink, A.et al. Subcutaneous glucose measurements and glucose regulation (?). 2010, 36, p.897–898.
29. Brunner, R., Kitzberger, R., Miehsler, W. et al. Accuracy and reliability of asubcutaneous continuous glucose-monitoring system in critically ill patients. 2011, 39, 4, p.659–664.
30. Holzinger, U., Warszawska, J., Kitzberger, R. et al. Real-time continuous glucose monitoring in critically ill patients: A prospective randomized trial. 2010, 33, p. 467–472.
31. Holzinger, U., Warszawska, J., Kitzberger, R.et al. Impact of shock requiring norepinephrine on the accuracy and reliability of subcutaneous continuous glucose monitoring. 2009, 35, 8, p.1383–1389.
32. Bochicchio, G., Joseph, J., Magee,M. Multicenter Evaluation of AFirst Generation Automated Blood Glucose Monitor in the or/Icu. 2011, 39, 12, p.55.
33. Skjaervold, N. K., Sollgard, E., Hjelme, D. R.et al. Continuous Measurement of Blood Glucose: Validation of aNew Intravascular Sensor. 2011, 114, 1, p.120–125.
34. Jax, T., Heise,T., Nosek, L. et al. Automated near-continuous glucose monitoring measured in plasma using mid-infrared spectroscopy. 2011, 5, p. 345–352.
35. Torjman,M. C., Dalal, N., Goldberg, M. E. Glucose Monitoring in Acute Care: Technologies on the Horizon. 2008, 2, 2, p. 178–181.
36. Joseph, J. I., Hipszer, B., Mraovic, B. et al. Challenges in Glycemic Control in Perioperative and Critically Ill Patients. Clinical Need for Continuous Glucose Monitoring in the Hospital. 2009, 3, 6, p. 1309–1318.
37. Zhang, K.,Wu, X. Y. Modulated insulin permeation across a glucose-sensitive polymeric composite membrane. 2002, 80, 1-3, p. 169–178.
38. Hovorka, R. Continuous glucose monitoring and closed - -loop systems. 2006, 23, 1, p. 1–12.
39. Clemens, A.H., Chang, P. H., Myers, R.W. The development of Biostator, aglucose controlled insulin infusion system (GCIIS). 1977, Suppl. 7, p.23–33.
40. Yatabem, T., Yamazaki, R., Kitagawa, H. et al. The evaluation of the ability of closed-loop glycemic control device to maintain the blood glucose concentration in intensive care unit patients. 2011, 39, p. 575–578.
41. Cobelli, C., Renard, E., Kovatchev, B. Artificial Pancreas: Past, Present, Future. 2011, 60, 11, p. 2672–2682.
42. Hanazaki, K., Maeda, H. Tight perioperative glycemic control using an artificial endocrine pankreas. 2010, 40, 1, p. 1–7.
43. Hanazaki, K., Okabayashi,T. What Should the Targeted Range of Blood Glucose Levels Be to Reduce the Incidence of Surgical Site Infection Following General Surgery? 2011, 146, 3, p.368–369.
44. Tsukamoto, Z., Okabayashi, T. Progressive artificial endocrine pancreas: The era of novel perioperative blood glucose control for surgery. 2011, 41, 10, p. 1344–1351.
45. Takahashi,G., Sato, N., Matsumoto, N. et al. Preliminary Study on Glucose Control with an Artificial Pancreas in Postoperative Sepsis Patients. 2011, 47, 1, p. 32–38.
46. Hanazaki, K., Maeda, H. Relationship between perioperative glycemic control and postoperative infections. 2009, 15, 33, p. 4122–4125.
47. Chee, F., Fernando,T., van Heerden, P. V. Closed-loop glucose control in critically ill patients using continuous glucose monitoring system (CGMS) in real time. 2003, 7, p. 43–53.
48. Anderson, R.E., Ehrenberg, J., Barr, G. et al. Effects of thoracic epidural analgesia on glucose homeostasis after cardia surgery in patients with and without diabetes mellitus. 2005, 22, 7, p. 524–529.
49. Svantfeldt,M., Thorell, A., Nygren, J. et al. Postoperative parenteral nutrition while proactively minimizing insulin resistance. 2006, 22, 5, p.457–464.
50. Lidder, P., Flanagan, D., Fleming, S., Russell, M. et al. Combining enteral with parenteral nutrition to improve postoperative glucose control. 2010, 103, 11, p. 1635–1641.
51. Akçay,M. N., Akçay, G. The effects of metformin and oral propranolol on insulin resistance in thermally injured patients. 2005, 17, 2, p. 189–192.
52. Meier, J. J., Weyhe, D., Michaely,M. et al. Intravenous glucagon-like peptide 1 normalizes blood glucose after major surgery in patients with type 2 diabetes. 2004, 32, 3, p.848–851.
53. Belhoula, M., Ciébiéra, J. P., De La Chapelle, A.et al. Clonidin premedication improves metabolic control in type 2 diabetic patients during ophthalmic surgery. 2003, 90, 4, p.434–439.
54. Umpierrez, G., Smiley, D., Zisman, A. et al. Randomized Study of Basal-Bolus Insulin Therapy in the Inpatient Management of Patients With Type 2 Diabetes (RABBIT 2 Trial). 2007, 30, 9, p.2181–2186.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2012 Issue 4-
All articles in this issue
- Risks of anaesthesia in children with Angelman syndrome
- The anaesthetist and new trends and technologies in glucose homeostasis
- Assessment of variability of normal and pathological microcirculation by SDF
- International expert statement on training standards for critical care ultrasonography
- Practice Guidelines for Central Venous Access
- 20th Hoder Day, December 8th, 2011 Airway Management – abstracts
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Practice Guidelines for Central Venous Access
- Risks of anaesthesia in children with Angelman syndrome
- 20th Hoder Day, December 8th, 2011 Airway Management – abstracts
- The anaesthetist and new trends and technologies in glucose homeostasis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

