-
Medical journals
- Career
Terapeutická hypotermie po srdeční zástavě
Authors: Škulec Roman
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
Published in: Anest. intenziv. Med., 23, 2012, č. 3, s. 138-146
Category: Update in Intensive Care Medicine
Overview
Přehledový článek o terapeutické hypotermii (TH) po srdeční zástavě je přepisem přednášky na kurzu Institutu postgraduálního vzdělávání ve zdravotnictví Novinky v intenzivní medicíně 2011. Autor v něm popisuje zakotvení TH v algoritmu komplexní léčby syndromu po srdeční zástavě, analyzuje odpovědi na otázky „Kdy začít chladit?“, „Koho chladit?“, „Jak dlouho a jak hluboko chladit?“ a „Jak chladit?“, rozebírá procedurální podrobnosti provádění TH a vyjadřuje osobní názor na současné argumenty pro používání TH a proti jeho používání. Nadále platí, že TH u nemocných po srdeční zástavě je účinná metoda v prevenci posthypoxické encefalopatie. Ochlazovat bychom měli začít co nejdříve a co nejrychleji dosáhnout cílové terapeutické teploty 33 °C a následně udržovat rozmezí 32–34 °C po dobu 12–24 hodin. Rychlost vzestupu tělesné teploty během následné fáze řízeného ohřívání nemá být vyšší než 0,5 °C/h. Celá procedura by měla být vedená podle psaného protokolu a v kontextu komplexní intenzivní péče.
Klíčová slova:
srdeční zástava – terapeutická hypotermie
*Novinky v oboru, Praha, prosinec 2011Úvod
Terapeutická hypotermie je rutinní součást časné intenzivní péče po srdeční zástavě. Systematicky je používaná od roku 2002. Snižuje riziko závažné posthypoxické encefalopatie a pravděpodobně i mortalitu.
Terminologie
V literatuře je metoda nazývána různě: mírná hypotermie, terapeutická hypotermie, terapeutická mírná hypotermie. V roce 2011 doporučila skupina expertů pro metodu termín „targeted temperature managment“ [1]. Zatím se však příliš neujal a v tomto textu budeme nadále používat označení terapeutická hypotermie (TH).
Zakotvení metody v doporučeních
Publikace randomizovaných klinických studií o účinnosti a bezpečnosti metody byla rychle následovaná implementací TH do evropských a českých doporučení (tab. 1).
Table 1. Evropská a česká doporučení pro používání TH v časovém sledu 
Pokroky v roce 2011
V roce 2011 nebyl v problematice TH publikován žádný zásadní objev. Praktické otázky, které se objevily hned na počátku používání metody a jsou rozebírány dále v textu, zůstávají v řešení více či méně i nadále.
Patofyziologie, syndrom po srdeční zástavě
Úspěšně resuscitovaná srdeční zástava není děj, který začíná vznikem zástavy a končí návratem spontánní cirkulace (ROSC), ale patofyziologický proces navzájem navazujících dějů, které probíhají desítky hodin po ROSC a svými důsledky ovlivňují organismus dny a týdny po ROSC. Ischemicko-anoxická fáze a hypoxická fáze s hypoperfuzí během srdeční zástavy vedou k rozvoji ischemicko-reperfuzní fáze o různé intenzitě, která se klinicky projevuje jako syndrom po srdeční zástavě (PCAS, post-cardiac arrest syndrome). Hlavní klinické komponenty PCAS jsou:
- poškození mozku,
- dysfunkce myokardu,
- syndrom systémové zánětlivé odpovědi,
- trvající příčina zástavy [8].
Poškození mozku
Poškození mozku nejvíce ovlivňuje prognózu a je příčinou až dvou třetin úmrtí úspěšně resuscitovaných nemocných. V akutní fázi se klinicky projevuje jako bezvědomí trvající po ROSC. Patofyziologii znázorňuje obrázek 1 [9]. Podkladem posthypoxické encefalopatie jsou oba mechanismy buněčné smrti – nekróza i apoptóza neuronů. Nevzniká okamžitě během srdeční zástavy, ale rozvíjí se desítky hodin s významným přispěním ischemicko-reperfuzního poškození (IRP). Ovlivnění poškození mozku je hlavním cílem terapeutické hypotermie.
Image 1. Celulární a subcelulární mechanismy ischemicko-reperfuzního poškození mozku ATP – adenosintrifosfát, NMDA – N-metyl-D-aspartátový receptor, AMPA – amino-3-hydroxy-5-metylisoxazole-4-propionátový receptor, NO – oxid dusnatý, VMK – volné mastné kyseliny, ARCH – kyselina arachidonová, COX – cyklooxygenáza, LOX – lipooxygenáza, DNA – kyselina deoxyribonukleová 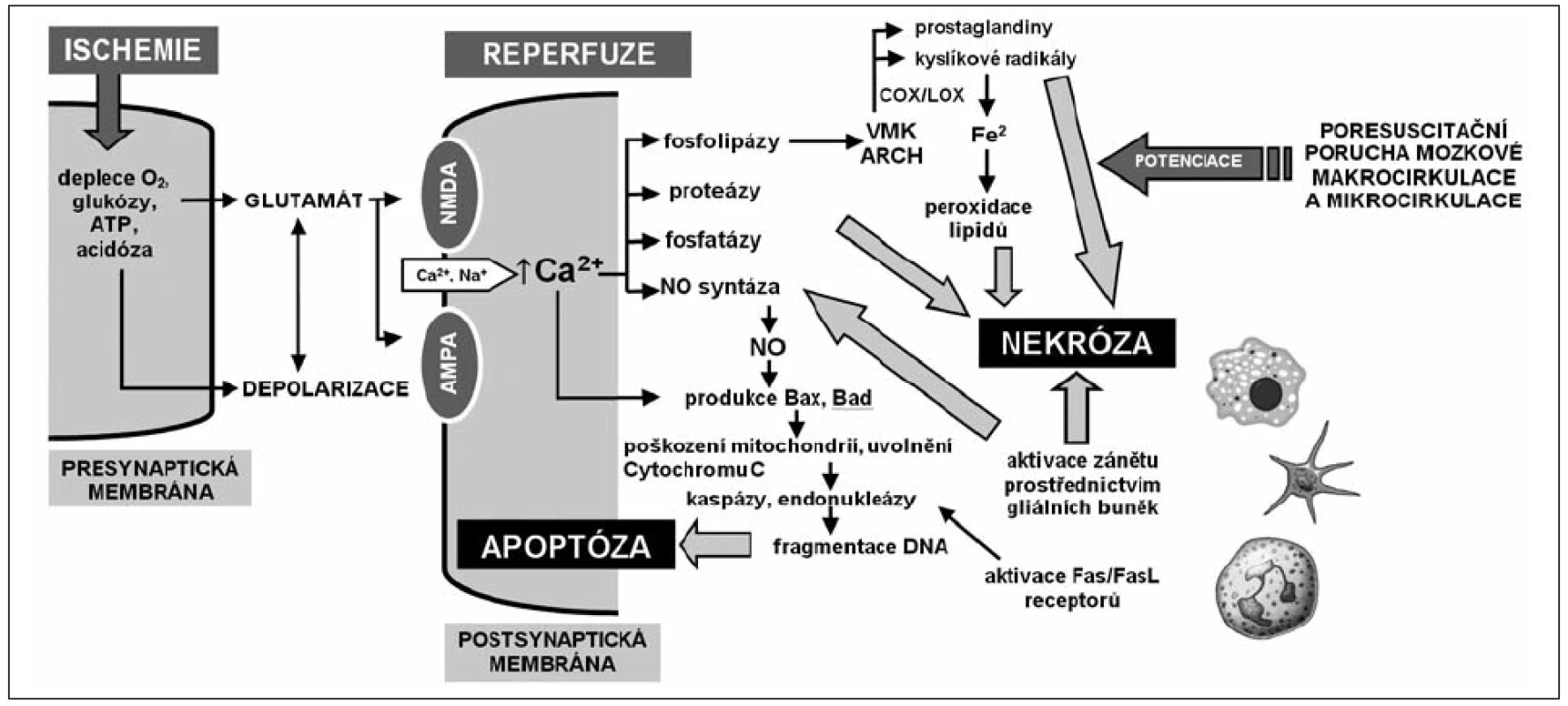
Mechanismus působení terapeutické hypotermie
Doposud byly studovány stovky neuroprotektiv s podobným scénářem – slibné úvodní experimentální výsledky byly následovány experimentálním nebo klinickým selháním. Příčinou je pravděpodobně komplexnost IRP, které nemůže být ovlivněno specifickým zablokováním jedné metabolické cesty. Na druhou stranu, TH je robustní nespecifická intervence, která simultánně tlumí všechny procesy IRP, redukuje metabolismus mozku cca o 7 % na každý 1 °C poklesu tělesné teploty (TT) a snižuje celkovou spotřebu kyslíku [10]. Další mechanismy neuroprotektivního působení TH jsou uvedeny v tabulce 2 [11–20].
Table 2. Neuroprotektivní mechanismy terapeutické hypotermie 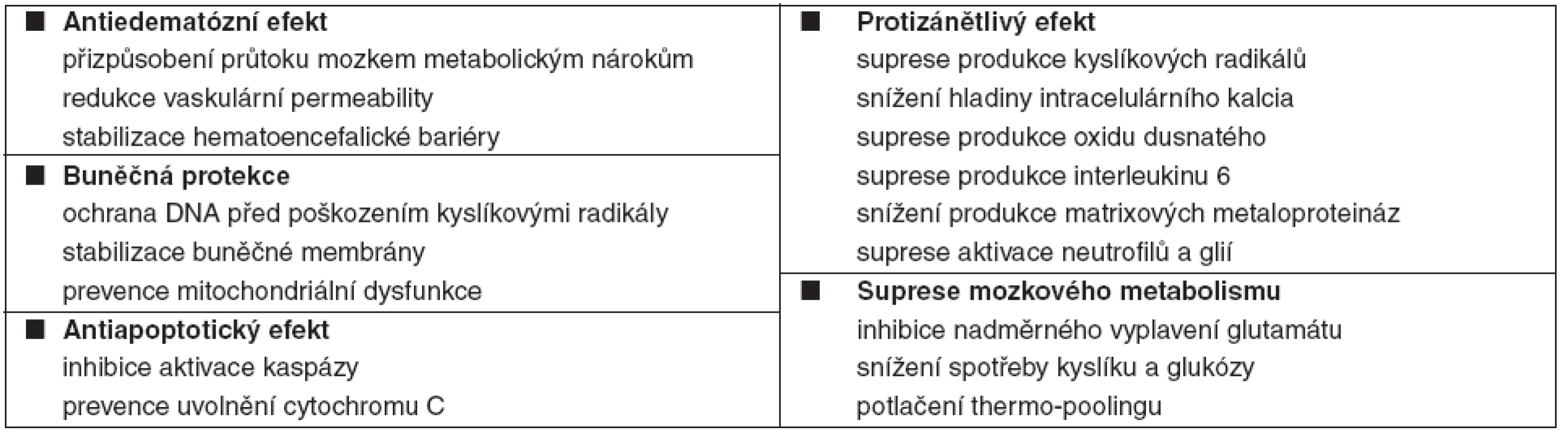
Klinické studie
I když myšlenka TH není nová, její implementaci do rutinních postupů umožnily až randomizované klinické studie publikované v roce 2002. Obě měly podobný design a vedly k podobným výsledkům, které podporují bezpečné používání TH po srdeční zástavě (tab. 3).
Table 3. Zásadní randomizované klinické studie o TH 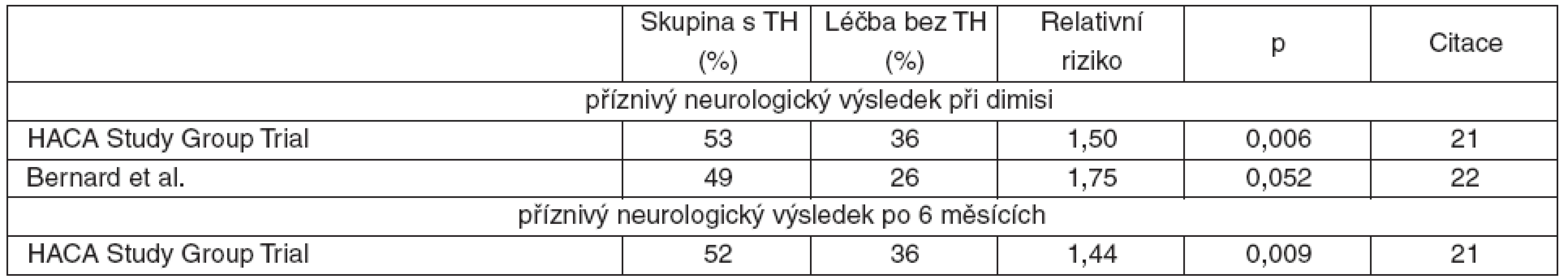
Ve studii skupiny The European Hypothermia After Cardiac Arrest (HACA) bylo 275 nemocných úspěšně resuscitovaných pro mimonemocniční srdeční zástavu s fibrilací komor randomizováno do skupiny s konvenční léčbou anebo k indukci terapeutické hypotermie 32–34 °C po dobu 24 hodin. Kromě neuroprotektivního účinku byla v intervenční skupině pozorovaná redukce šestiměsíční mortality (RR 0,74; CI 95% 0,58–0,95, p < 0,05) [21].
Bernard et al. za použití stejných kritérií randomizovali 77 pacientů ke konvenční léčbě anebo k ochlazení na 32–34 °C v trvání 12 hodin. Zjistili příznivý vliv na neurologický výsledek resuscitace [22]. V obou studiích nebyl ve skupině s hypotermií vyšší výskyt nežádoucích účinků.
Analýzy registrů a metaanalýzy převážně podporují účinnost TH (tab. 4). Více se o tomto tématu diskutuje v závěru.
Table 4. Výsledky analýz registrů a metaanalýz 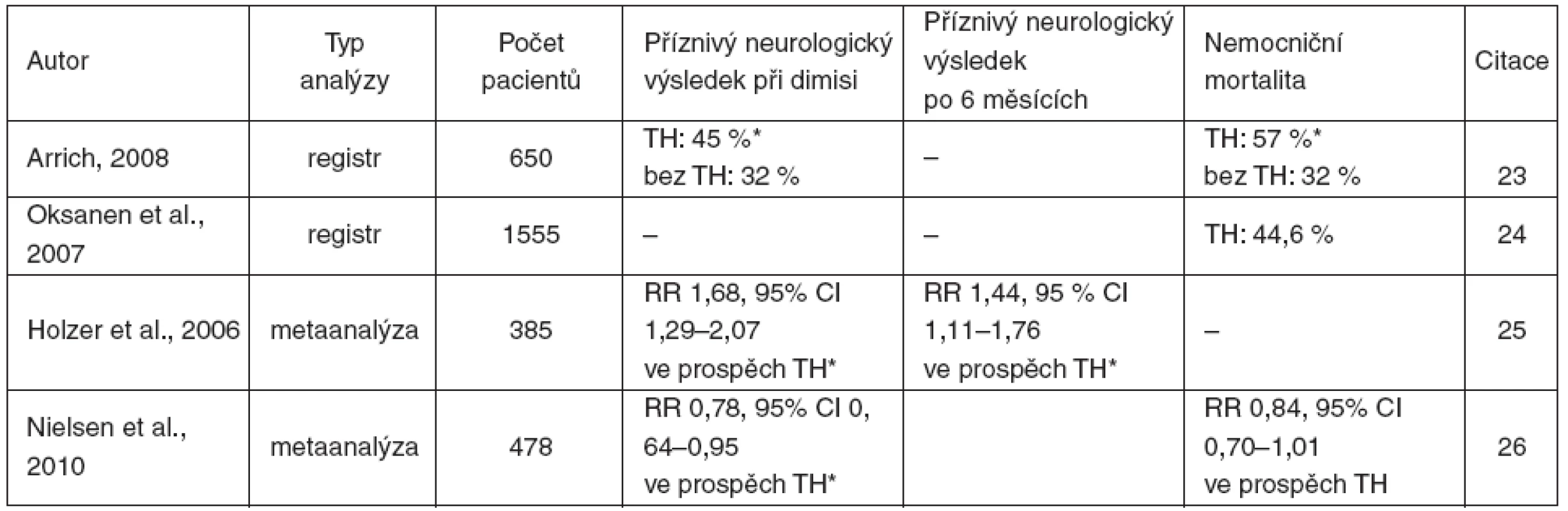
*p < 0.05 Komplexní péče po srdeční zástavě
Každý intenzivista by měl mít na paměti, že TH po srdeční zástavě není samospasitelná a jediná léčebná metoda. Komplexní léčba zahrnuje:
- terapeutickou hypotermii;
- urgentní koronarografii a perkutánní koronární intervenci (PCI), pokud jsou indikované;
- kontrolu glykémie;
- časné dosažení hemodynamických cílů;
- kontrolu normoventilace a
- kontrolu křečí.
Léčba dalších orgánových dysfunkcí a infekčních komplikací se neliší od běžné intenzivní péče. Sunde et al. prokázali, že přechod od konvenčního pasivního přístupu k aktivnímu standardizovanému léčebnému protokolu zahrnujícímu uvedené modality může zlepšit prognózu [27]. Další studie toto pozorování potvrdily [28–30]. Je proto důležité přistupovat ke každému pacientovi po srdeční zástavě jako ke každému jinému kriticky nemocnému vyžadujícímu komplexní, aktivní a protokolem vedenou terapii za horizontem pouhé TH.
Kdy začít chladit?
U nemocných s akutním infarktem myokardu (AIM) nebo polytraumatem je nejlepších výsledků dosaženo, pokud je specifická léčba zahájena během první hodiny od inzultu. Hovoří se o zlaté hodině. Platí to pravděpodobně i pro pacienty po srdeční zástavě. Pokud vezmeme v úvahu současný trend primárního transportu nemocných do často vzdálenější specializované nemocnice s kardiocentrem, je zjevné, že zlatá hodina u mimonemocniční srdeční zástavy probíhá na místě zástavy a během transportu. Z této úvahy logicky vyplývá otázka, zda je vhodné zahájit ochlazování již v přednemocniční neodkladné péči (PNP), tedy řádově minuty po ROSC. Doposud nebyla spolehlivě zodpovězena. První studie byly designovány k posouzení proveditelnosti a bezpečnosti ochlazování v PNP a neprokázaly vliv na prognózu [31–34]. Některé další studie naznačili prospěšnost tohoto postupu. Kim et al. randomizovali 125 nemocných úspěšně resuscitovaných pro OHCA k rychlé intravenózní aplikaci chladných krystaloidních roztoků (RIVA) v dávce 500–2 000 ml v PNP nebo k běžné přednemocniční terapii bez ochlazování s následnou TH v nemocnici. U pacientů s fibrilací komor zjistili trend k nižší mortalitě ve skupině s ochlazováním v PNP (34 vs. 55 %, p = 0,150) [34]. Castrén et al. randomizovali 200 pacientů k intranazálnímu ochlazování v PNP nebo k běžné péči v PNP bez TH s následnou TH v nemocnici. V podskupině nemocných s prvním resuscitačním pokusem do 10 minut od kolapsu pozorovali vyšší nemocniční přežívání ve skupině s aktivní léčbou než u nemocných v kontrolní skupině (59,1 vs. 29,4 %, p = 0,028) [35]. V české observační studii PRE-COOL jsme analyzovali 40 konsekutivních pacientů ochlazených v PNP metodou RIVA a 40 nemocných léčených bez ochlazovacích pokusů v PNP. V podskupině pacientů léčených TH v PNP s rychlou návazností nemocničního ochlazování jsme zjistili vyšší šance na příznivý neurologický výsledek (OR 4.1, CI95% 1.1–18.2, p = 0,046) [36]. Je třeba zdůraznit, že jsme nesrovnávali dvě skupiny, TH v PNP ano versus ne, ale 4 podskupiny, které v reálném životě pozorujeme, a to TH v PNP ano + v nemocnici ano, TH v PNP ano + v nemocnici ne, TH v PNP ne + v nemocnici ano, TH v PNP ani v nemocnici ne.
Haugk et al. publikovali retrospektivní analýzu 588 pacientů léčených TH v nemocnici. U nemocných s příznivým neurologickým výsledkem byl čas do dosažení TT 34 °C 209 minut, zatímco u těch s nepříznivým 158 minut (p = 0,04). Nelze však říci, zda horší prognóza byla následkem rychlého ochlazení nebo rychlé ochlazení je odrazem závažnosti stavu [37]. Nielsen et al. v analýze 986 nemocných také nezjistili vztah mezi rychlostí ochlazení a prognózou. Výsledky z nemocnice ale nelze automaticky extrapolovat na chlazení PNP a naopak [38]. Současná doporučení pro kardiopulmonální resuscitaci se časovému doporučení zahájení TH vyhýbají [7].
Souhrnem lze říci, že experimentální data podporují paradigma „čím dříve, tím lépe“. Klinické studie doposud neprokázaly platnost ani neplatnost tohoto tvrzení. Studie hodnotící zahájení ochlazování v PNP naznačují, že při těsné návaznosti přednemocničního chlazení a nemocniční TH je možné prognózu nemocných zlepšit. Považuji proto snahu ochladit pacienta na cílovou TT co nejrychleji za účelnou.
Koho chladit?
K TH jsou indikováni dospělí pacienti s ROSC po úspěšné KPR pro mimonemocniční nebo nemocniční srdeční zástavu s iniciálním defibrilovatelným (fibrilace komor/komorová tachykardie) nebo nedefibrilovatelným rytmem (asystolie/bezpulzová elektrická aktivita), s přetrvávajícím bezvědomím a s nutností umělé plicní ventilace. Indukce TH může být individuálně indikována také u dětí po splnění stejných indikačních kritérií. Nejvyšší stupeň evidence je dokumentován pro dospělé po mimonemocniční srdeční zástavě s fibrilací komor. To znamená, že k TH je indikovaná většina nemocných se srdeční zástavou [4–7].
Jednoznačné kontraindikace publikovány nebyly a jejich výčet se v různých přehledných pracích a doporučeních liší. Tabulka 5 nabízí přehled absolutních či relativních kontraindikací metody.
Table 5. Kontraindikace terapeutické hypotermie 
Jak dlouho a jak hluboko chladit?
Pacienti po srdeční zástavě mají být ochlazeni na tělesnou teplotu (TT) 32–34 °C po dobu 12–24 hodin. Protokol TH se skládá ze čtyř fází (obr. 2):
- ochlazovací fáze,
- udržovací fáze,
- fáze kontrolovaného ohřívání,
- fáze kontroly normotermie.
Image 2. Protokol terapeutické hypotermie 
Doposud nebyla zodpovězena otázka, jaké je optimální trvání TH. V klinických studiích byl prokázán příznivý vliv na prognózu pro dvanáctihodinový i dvacetičtyřhodinový protokol [21, 22]. V praxi je nejčastěji používán 24hodinový [39]. Pro delší trvání TH prozatím nejsou důkazy. V každém případě by neměl protokol trvat méně než 12 hodin.
Podobně nedořešená je otázka hloubky hypotermie. Obecně se ví, že pokles pod 32 °C je spojen s vyšším rizikem nežádoucích účinků TH [40, 41]. Otázkou je, zda stejný efekt jako TH nemá pečlivé udržování normotermie. Odpověď na tuto otázku by měla dát klinická studie TTM (Target temperature management) [26].
Další postupy během terapeutické hypotermie
Během TH by měla být navozena hluboká analgosedace s cílovým SAS 1. Pokud přesto dochází ke svalovému třesu, je indikovaná myorelaxace nebo eventuálně podání pethidinu. Při kontinuální myorelaxaci je vhodné její monitorování [5]. Z osobních praktických zkušeností vyplývá, že v ochlazovací fázi je myorelaxace vhodná vždy. Navození TH je doprovázena řadou metabolických a orgánových změn (tab. 6).
Table 6. Fyziologické dopady hypotermie 
Často je obtížné stanovit, zda jde o efekt hypotermie nebo důsledek kritického onemocnění jako takového. Jedná se zejména o metabolické dysbalance, a to hypokalémii, hypomagnezémii, hypofosfatémii, hypokalcémii a hyperglykémii. Je proto nutné pravidelné monitorování a v případě magnézia a draslíku substituce. Hypokalcémii, pokud možno, tolerujeme, protože podání kalcia může zhoršit IRP. Během udržovací fáze lze tolerovat také mírnou hypokalémii, abychom zabránili vzestupu draslíku během ohřívání. Glykémii korigujeme podle konvenčních kritérií [42, 43]. Pokles TT navozuje hemodynamické změny – relativní i absolutní hypovolémii, bradykardii a pokles krevního tlaku a srdečního výdeje. Je doporučeno dosáhnout hemodynamické cíle uvedené v tabulce 7 pomocí obvyklých postupů [7].
Table 7. Hemodynamické cíle během terapeutické hypotermie 
Další častou komplikací je infekce (pneumonie). Tabulka 8 ukazuje výskyt komplikací v souboru 986 pacientů léčených TH [38].
Table 8. Nežádoucí účinky terapeutické hypotermie 
Randomizované klinické studie neprokázaly významný rozdíl mezi pacienty léčenými TH a bez TH.
Komplikace může způsobovat i ochlazovací metoda. Povrchové ochlazování může působit omrzliny, rychlé intravenózní podání chladných krystaloidních roztoků (RIVA) hypervolémii a plicní edém, endovaskulární katétrové ochlazování zvyšuje riziko hluboké žilní trombózy [9].
Prevence stresového vředu a tromboembolické nemoci, péče o ústní dutinu, polohování a umělá plicní ventilace podléhá stejným zásadám jako u kriticky nemocných obecně. Nejsou žádná doporučení ohledně klinické nutrice. Nejčastěji je zahajovaná po dokončení fáze kontrolovaného ohřívání [39].
Antiagregační, antikoagulační, eventuálně trombolytická léčba podléhá běžným indikacím a TH není její kontraindikací [7].
Během TH je nutné monitorování TT. Musí být kontinuální. Vhodná místa měření jsou arteria pulmonalis, rektum, močový měchýř a jícen. Zlatým standardem je arteria pulmonalis, ale měření TT by nemělo být jedinou indikací zavedení Swan-Ganzova katétru. Pro PNP je akceptovatelné měření tympanální TT.
Klinický stav si může vynutit předčasné ukončení TH. Indikacemi jsou:
- přítomnost kontraindikace TH,
- opakovaná srdeční zástava,
- zlepšení neurologického nálezu – GCS ≥ 13 bodů,
- arytmie nereagující na terapii a vedoucí ke zhoršení klinického stavu nemocného,
- významná oběhová nestabilita se známkami tkáňové hypoperfuze,
- život ohrožující koagulopatie a krvácivé projevy,
- nekorigovatelná porucha vnitřního prostředí [5].
Jak chladit?
V současnosti máme k dispozici širokou nabídku ochlazovacích metod. Lze je rozdělit na metody vedoucí k celotělovému ochlazení a metody určené k lokálnímu ochlazování mozku (tab. 9) [9]. Lokální metody by měly být pouze doplňkové.
Přestože z prognostického hlediska doposud nebyla prokázána priorita přístrojových ochlazovacích technik (endovaskulární katétrové ochlazování, povrchové ochlazování chladicí matrací či chladicími obklady) před konvenčními (povrchové ochlazování ledovými obklady, chladná intravenózní infuze, výplachy chladným roztokem), poskytují vyšší stabilitu TT během ochlazování s nižším rizikem nadměrného ochlazení, jsou přívětivější z ošetřovatelského hlediska a umožňují kontrolu normotermie v poslední fázi ochlazovacího protokolu [9]. To však rozhodně neznamená diskvalifikaci konvenčních postupů z klinického používání a dokazuje to i obrázek 3 [39].
Image 3. Četnost používání různých ochlazovacích metod v nemocnicích v České republice v roce 2008 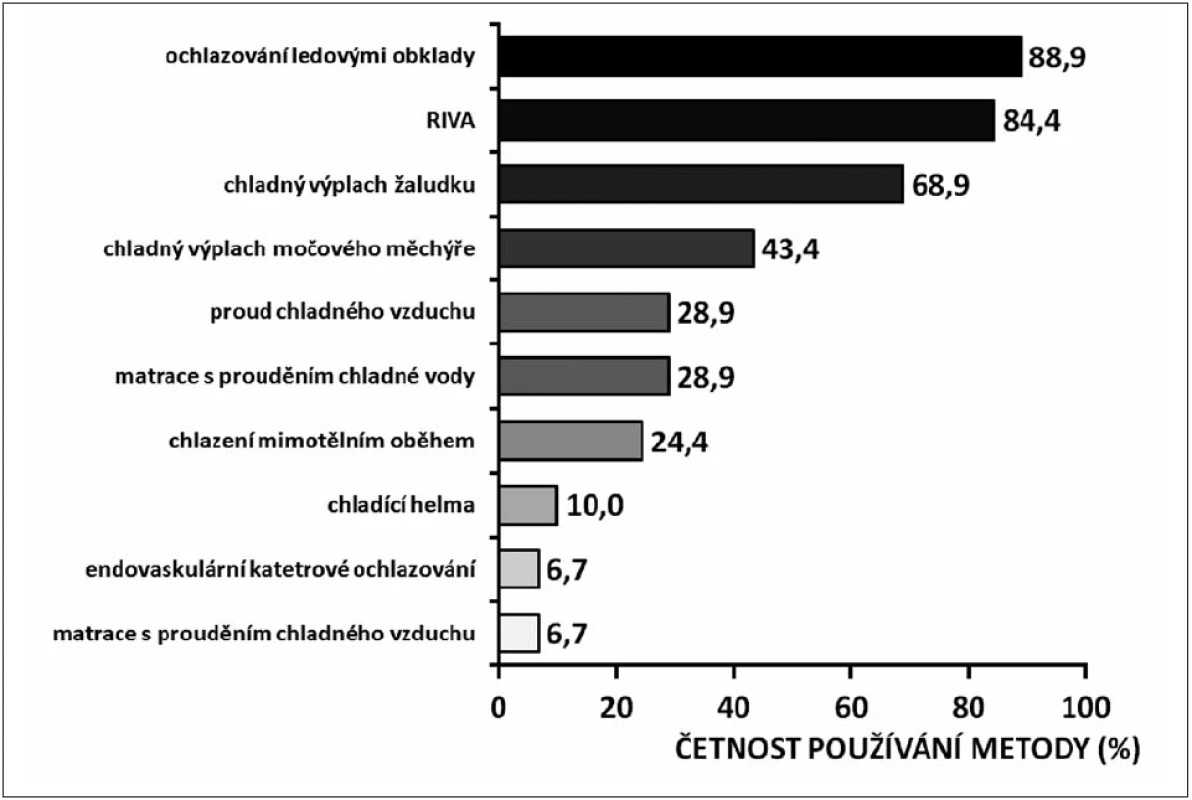
Povrchové ochlazovací metody jsou používány nejčastěji. Existuje řada modifikací s různou ochlazovací rychlostí. Nejspolehlivější je ochlazování pomocí matrace s cirkulací vody (obr. 4). Při použití těchto metod je třeba dbát zejména na prevenci omrzlin.
Image 4. Různé ochlazovací metody Vlevo nahoře – povrchové ochlazování ledovými obklady; vpravo nahoře – reálný pacient a schéma endovaskulárního katétrového ochlazování (CoolGard 3000TM, Icy femoral cathether TM, Alsius Corp., Irvine, USA). Vlevo dole – umístění lednice ve voze zdravotnické záchranné služby a detail na obsah lednice (Little ENGEL MRFD-015 12V, Jupiter, USA) – výbava k ochlazování v přednemocniční neodkladné péči; vpravo dole – ochlazování chladicí matrací s cirkulací vody (Blanketrol III, Cincinnati Sub-Zero Products, Inc., Cincinnati, USA). 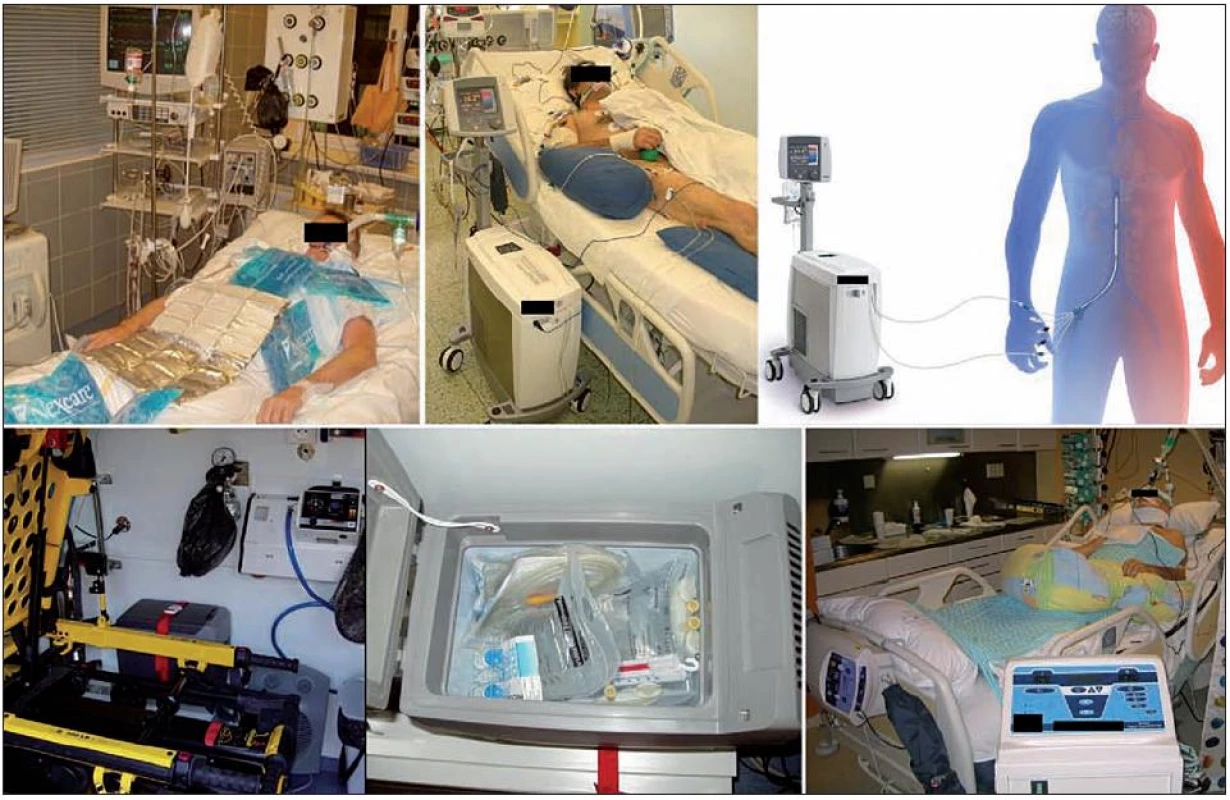
Intravenózní aplikace chladných krystaloidních roztoků je účinná, jednoduchá a bezpečná metoda. Rychlé podání 15–30 ml/kg 4 °C chladného fyziologického nebo Ringerova roztoku může navodit pokles TT cca o 1,5 °C. Metoda má krátkodobý efekt a v udržovací fázi TH je třeba pokračovat jinou metodou. Endovaskulární katétrové ochlazování je invazivní metoda. Chladicím katétrem zavedeným do dolní duté žíly proudí chladná tekutina a řídicí jednotkou je zajištěna dobrá ochlazovací rychlost 1,0–1,5 °C/h a vynikající stabilita cílové teploty [9].
Terapeutická hypotermie u nemocných s akutním infarktem myokardu
Akutní infarkt myokardu je nejčastější příčinou srdeční zástavy. Srdeční zástava komplikující AIM může vyvolat některé otázky:
- Co je důležitější, TH nebo urgentní PCI?
- Ovlivňuje TH angiografický výsledek PCI?
- Může být nemocnému léčenému TH podána antitrombotická a/nebo trombolytická léčba?
- Jaký je vliv TH na funkci myokardu?
Pro pacienty s akutním infarktem myokardu komplikovaném srdeční zástavou je stejně důležitá koronární reperfuzní léčba i neuroprotektivní terapie. Indukce TH proto nesmí oddalovat PCI a naopak. Paralelní provedení obou procedur standardním postupem je dobře proveditelné [44].
Noc et al. prokázali, že TH během PCI nemá vliv na angiografický výsledek [45]. Další studie ukázaly, že TH nezvyšuje riziko závažných krvácivých komplikací PCI [46].
Obecně podávání antitrombotik a/nebo fibrinolytik není kontraindikací TH. TH ale komplexně ovlivňuje jejich farmakokinetiku a farmakodynamiku, a proto je optimální dávkování monitorovat.
Dysfunkce myokardu je běžnou součástí syndromu po srdeční zástavě. Byly publikovány experimentální i klinická data, že TH nemá negativní vliv na dysfunkci myokardu po srdeční zástavě a TH je třeba zvážit i u nemocných v kardiogenním šoku, pokud reagují na léčbu [30, 47].
Kontroverze – máme pro používání TH dostatek důkazů?
V posledních dvou letech se diskutuje o zásadní otázce: Máme o prospěšnosti TH po srdeční zástavě dostatek důkazů? Argumenty z tábora pro a proti lze shrnout do následujících tezí.
Pro TH
- Randomizované klinické studie prokázaly efekt TH na neurologický výsledek a mortalitu.
- Metaanalýzy potvrdily účinnost metody.
- Účinnost metody prokázaly i analýzy registrů.
- Metoda byla hodnocena řadou expertních týmů a pronikla do doporučení.
- Počet publikovaných klinických a experimentálních prací podporujících TH mnohonásobně převyšuje počet těch, které metodu zpochybňují [48].
Proti TH
- Přes množství publikovaných prací lze do metaanalýzy podle současných kritérií zahrnout pouze 4 randomizované a 1 pseudorandomizovanou klinickou studii.
- Podle GRADE kritérií (grading levels of evidence and strength of recommendations) je kvalita důkazů těchto studií spíše nízká.
- Všechny studie jsou zatížené různě velkým rizikem systematické a nahodilé chyby a byl do nich zařazen nedostatečný počet nemocných.
- Největší randomizovaná studie zařadila pouze 8 % potenciálních kandidátů TH.
- Chybí srovnání TH s normotermií, v kontrolních skupinách byl velký výskyt hypertermie [26].
Otázkou zůstává, jak s těmito protichůdnými hodnoceními naložit. Domnívám se, že v hodnocení je třeba vzít v úvahu následující aspekty:
- Zpochybnit lze prakticky každou klinickou i experimentální studii.
- Nedostatek důkazů o metodě neznamená, že metoda nefunguje.
- Klinické studie a metaanalýzy hodnotící TH byly navrženy a provedeny v kontextu znalostí své doby a z tohoto pohledu je evidence dobrá (pokud bychom zpětně hodnotili starší randomizované studie z pohledu současných přísných kritérií, drtivá většina by jich neobstála).
- Problém srovnání TH s normotermií řeší právě probíhající klinická studie TTM, nicméně ho zcela nevyřeší. To by vyžadovalo nejenom srovnání TH versus normotermie, ale navíc i třetí skupinu bez ovlivnění tělesné teploty a ta z etických důvodů pravděpodobně v žádné studii již nebude.
Domnívám se proto, že terapeutická hypotermie zůstává nadále jediný známý a plně indikovaný postup, který zlepšuje prognózu nemocných po srdeční zástavě, pokud je prováděn podle současných indikací a bezpečným, protokolem vedeným způsobem. Další klinické studie jsou v každém případě žádoucí a povedou k novým poznatkům o problematice srdeční zástavy, k optimalizaci protokolu a indikací TH a budou mostem k rozvoji dalších neuroprotektivních metod.
Přepis přednášky na kurzu IPVZ Novinky v intenzivní medicíně 2011, blok srdeční zástava.
Do redakce došlo dne 30. 4. 2012.
Do tisku přijato dne 31. 5. 2012.
Adresa pro korespondenci:
MUDr. Roman Škulec
KARIM FN
Sokolská 525
500 05 Hradec Králové
e-mail: skulecrfhk.cuni.cz
Sources
1. Nunnally, M. E. et al. Targeted temperature management in critical care: a report and recommendations from five professional societies. Crit. Care Med., 2011, 39, p. 1113–1125.
2. Nolan, J. P. et al. Advancement Life support Task Force of the International Liaison committee on Resuscitation: Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life support Task Force of the International Liaison committee on Resuscitation. Resuscitation, 2003, 57, p. 231–235.
3. Nolan, J. P. et al., European Resuscitation Council: European Resuscitation Council guidelines for resuscitation 2005. Section 4. Adult advanced life support. Resuscitation, 2005, 67 Suppl 1, p. S39–S86.
4. Cvachovec, K. et al. Konsenzuální stanovisko k použití terapeutické hypotermie. Anest. intenziv. Med., 2009, 20, p. 221–224.
5. Cvachovec, K. et al. Konsenzuální stanovisko k použití terapeutické hypotermie. Urg. Med., 2009, roč. 12, s. 31–33.
6. Šeblová, J. et al. Doporučení pro používání terapeutické mírné hypotermie v přednemocniční neodkladné péči u nemocných po mimonemocniční náhlé zástavě oběhu: doporučený postup č. 17. Urg. Med., 2010, roč. 13, s. 22–25.
7. Deakin, C. D. et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. Resuscitation, 2010, 81, p. 1305–1352.
8. Nolan, J. P. et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A Scientific Statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke. Resuscitation, 2008, 79, p. 350–379.
9. Škulec, R. et al. Current cooling methods for induction of mild hypothermia in cardiac arrest survivors. Vnitr. Lek., 2009, roč. 55, s. 1060–1069.
10. Erecinska, M. et al. Effects of hypothermia on energy metabolism in mammalian central nervous system. J. Cereb. Blood Flow Metab., 2003, 23, p. 513–530.
11. Ošťádal, P. Ischemia-reperfusion injury following cardiac arrest and protective effects of hypothermia. Kardiol. Rev., 2009, roč. 11, s. 11–15.
12. Polderman, K. H. Mechanisms of action, physiological effects, and complications of hypothermia. Crit. Care Med., 2009, 37 (7 Suppl), p. S186–S202.
13. Liu, L. et al. Therapeutic hypothermia: neuroprotective mechanisms. Front. Biosci., 2007, 12, p. 816–825.
14. Busto, R. et al. Effect of mild hypothermia on ischemia-induced release of neurotransmitters and free fatty acids in rat brain. Stroke, 1989, 20, p. 904–910.
15. Kataoka, K. et al. Mild hypothermia – a revived countermeasure against ischemic neuronal damages. Neurosci. Res., 1998, 32, p. 103–117.
16. Globus, M. Y. et al. Detection of free radical activity during transient global ischemia and recirculation: effects of intraischemic brain temperature modulation. J. Neurochem., 1995, 65, p. 1250–1256.
17. Lei, B. et al. Effect of moderate hypothermia on lipid peroxidation in canine brain tissue after cardiac arrest and resuscitation. Stroke, 1994, 25, p. 147–152.
18. Xu, L. et al. Mild hypothermia reduces apoptosis of mouse neurons in vitro early in the cascade. J. Cereb. Blood Flow Metab., 2002, 22, p. 21–28.
19. Huang, Z. G. et al. Biphasic opening of the blood-brain barrier following transient focal ischemia: effects of hypothermia. Can. J. Neurol. Sci., 1999, 26, p. 298–304.
20. Fischer, S. et al. Hypothermia abolishes hypoxia-induced hyperpermeability in brain microvessel endothelial cells. Brain Res. Mol., 1999, 74, p. 135–144.
21. Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N. Engl. J. Med., 2002, 346, p. 549–556.
22. Bernard, S. A. et al. Treatment of comatose survivors of out--of-hospital cardiac arrest with induced hypothermia. N. Engl. J. Med., 2002, 346, p. 557–563.
23. Arrich, J. European Resuscitation Council Hypothermia After Cardiac Arrest Registry Study Group. Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit. Care Med., 2007, 35, p. 1041–1047.
24. Oksanen, T. et al. Intensium Consortium study group. Therapeutic hypothermia after cardiac arrest: implementation and outcome in Finnish intensive care units. Acta Anaesthesiol. Scand., 2007, 51, p. 866–871.
25. Holzer, M. et al. Efficacy and safety of endovascular cooling after cardiac arrest: cohort study and Bayesian approach. Stroke, 2006, 37, p. 1792–1797.
26. Nielsen, N. et al. Hypothermia after cardiac arrest should be further evaluated-A systematic review of randomised trials with meta-analysis and trial sequential analysis. Int. J. Cardiol., 2011, 151, p. 333–341.
27. Sunde, K. et al. Implementation of a standardised treatment protocol for post resuscitation care after out-of-hospital cardiac arrest. Resuscitation, 2007, 73, p. 29–39.
28. Werling, M. et al. Treatment and outcome in post-resuscitation care after out-of-hospital cardiac arrest when a modern therapeutic approach was introduced. Resuscitation, 2007, 73, p. 40–45.
29. Tømte, O. et al. Strong and weak aspects of an established post-resuscitation treatment protocol-A five-year observational study. Resuscitation, 2011, 82, p. 1186–1193.
30. Škulec, R. et al. Induction of mild hypothermia in cardiac arrest survivors presenting with cardiogenic shock syndrome. Acta Anaesthesiol. Scand., 2008, 52, p. 188–194.
31. Virkkunen, I. et al. Induction of therapeutic hypothermia after cardiac arrest in prehospital patients using ice-cold Ringer’s solution: a pilot study. Resuscitation, 2004, 62, p. 299–302.
32. Kämäräinen, A. et al. Prehospital therapeutic hypothermia for comatose survivors of cardiac arrest: a randomized controlled trial. Acta Anaesthesiol. Scand., 2009, 53, p. 900–907.
33. Hammer, L. et al. Immediate prehospital hypothermia protokol in comatose survivors of out-of-hospital cardiac arrest. Am. J. Emerg. Med., 2009, 27, p. 570–573.
34. Kim, F. et al. Pilot randomized clinical trial of prehospital induction of mild hypothermia in out-of-hospital cardiac arrest patients with a rapid infusion of 4 degrees C normal saline. Circulation, 2007, 115, p. 3064–3070.
35. Castrén, M. et al. Intra-arrest transnasal evaporative cooling: a randomized, prehospital, multicenter study (PRINCE: Pre-ROSC IntraNasal Cooling Effectiveness). Circulation, 2010, 122, p. 729–736.
36. Skulec, R. et al. Pre-hospital cooling of patients following cardiac arrest is effective using even low volumes of cold saline. Crit. Care, 2010, 14, R231.
37. Haugk, M. et al.; Time to Target Temperature Study Group. Relationship between time to target temperature and outcome in patients treated with therapeutic hypothermia after cardiac arrest. Crit. Care, 2011, 15, R101.
38. Nielsen, N. et al.; Hypothermia Network. Outcome, timing and adverse events in therapeutic hypothermia after out-of--hospital cardiac arrest. Acta Anaesthesiol. Scand., 2009, 53, p. 926–934.
39. Škulec, R. et al. The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech Republic. Minerva Anestesiol., 2010, 76, p. 617–623.
40. Merchant, R. M. et al. Therapeutic hypothermia after cardiac arrest: unintentional overcooling is common using ice packs and conventional cooling blankets. Crit. Care Med., 2006, 34 (12 Suppl), p. S490–S494.
41. Škulec, R. et al. Overcooling during mild hypothermia in cardiac arrest survivors-phenomenon we should keep in mind. Vnitr. Lek., 2008, 54, p. 609–614.
42. Losert, H. et al. Strict normoglycaemic blood glucose levels in the therapeutic management of patients within 12h after cardiac arrest might not be necessary. Resuscitation, 2008, 76, p. 214–220.
43. Polderman, K. H. Mechanisms of action, physiological effects, and complications of hypothermia. Crit. Care Med., 2009, 37, 7 Suppl., p. S186–S202.
44. Koester, R. et al. Coronary angiography and intervention during hypothermia can be performed safely without cardiac arrhythmia or vasospasm. Clin. Res. Cardiol., 2011, 100, p. 1013–1019.
45. Noc, M. Hypothermia during percutaneous coronary intervention in comatose survivors of cardiac arrest. Signa vitae, 2010, 5, Suppl. 1, p. 13–16.
46. Schefold, J. C. et al. Mild therapeutic hypothermia after cardiac arrest and the risk of bleeding in patients with acute myocardial infarction. Int. J. Cardiol., 2009, 132, p. 387–391.
47. Murphy, M. C. et al. Hypothermia Does Not Ameliorate Post--Cardiac Arrest Myocardial Dysfunction. Circulation, 2010, 122, Suppl., p. A235.
48. Walters, J. H. et al. The role of hypothermia in post-cardiac arrest patients with return of spontaneous circulation: a systematic review. Resuscitation, 2011, 82, p. 508–516.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2012 Issue 3
Most read in this issue- Podávání transfuzních přípravků v pediatrii a neonatologii
- Mechanická srdeční podpora
- Současné možnosti ECMO podpory v léčbě respiračního a oběhového selhání u dětí
- Jak dělat vizitu na jednotce intenzivní péče
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

