-
Medical journals
- Career
Má mírná terapeutická hypotermie stejný vliv na výsledný neurologický stav nemocných po resuscitaci v nemocnici a mimo nemocnici pro defibrilovatelný a nedefibrilovatelný rytmus?
: Fiala Hynek 1; Berta Emil 2; Gabrhelík Tomáš 1; Šafránek Petr 1
: Klinika anesteziologie, resuscitace a intenzivní medicíny Fakultní nemocnice Olomouc 1; Dept. of Anesthesia and Intensive Care, Ringerike Hospital (Vestre Viken HF), Hønefoss, Norway 2
: Anest. intenziv. Med., 22, 2011, č. 4, s. 216-226
: Intensive Care Medicine - Original Paper
Cíl studie:
Ověřit vliv terapeutické hypotermie na výsledný neurologický stav nemocných po mimonemocniční a nemocniční kardiopulmonální resuscitaci pro defibrilovatelné a nedefibrilovatelné rytmy.Typ studie:
Komparativní nerandomizovaná studie.Typ pracoviště:
JIRP fakultní nemocnice.Materiál a metoda:
Ve studii byla porovnána skupina nemocných přijatých po kardiopulmonální resuscitaci na JIRP v roce 2010 se skupinou nemocných z roku 2006. Skupiny byly rozděleny do dvou souborů: po mimonemocniční resuscitaci a resuscitaci v nemocnici. Soubory byly dále rozděleny do dvou podsouborů: po resuscitaci pro defibrilovatelný a nedefibrilovatelný rytmus. Pomocí Glasgow outcome scale (GOS) byl srovnán neurologický stav nemocných při propuštění nebo přeložení na ošetřovatelské lůžko.Výsledky:
Ve srovnání s rokem 2006 došlo v roce 2010 ve všech podsouborech ke zvýšení úmrtnosti a snížení počtu nemocných propuštěných v dobrém neurologickém stavu. V souboru mimonemocniční KPR pro fibrilaci komor (KF) se úmrtnost zvedla o 21 %. S GOS 4–5 bylo v roce 2010 propuštěno o 17 % méně nemocných. V podsouboru resuscitovaných pro asystolii vzrostla úmrtnost o 58 %, s GOS 4–5 jich bylo propuštěno o 11 % méně. Po resuscitaci v nemocnici úmrtnost po defibrilovatelném rytmu vzrostla o 43 % a o 38 % po nedefibrilovatelném rytmu. Podíl nemocných propuštěných s GOS 4–5 klesl o 19 % bez ohledu na vstupní rytmus.Závěr:
V rozporu s pracemi jiných autorů se nepodařilo prokázat pozitivní vliv terapeutické hypotermie na neurologický stav nemocných po resuscitaci pro defibrilovatelný rytmus. Potvrdilo se, že na neurologický stav nemocných po resuscitaci pro nedefibrilovatelný rytmus nemá vliv nebo jej zhoršuje. Je pravděpodobné, že výsledky ve sledované skupině ovlivnily chyby při provádění terapeutické hypotermie.Klíčová slova:
kardiopulmonální resuscitace – defibrilovatelný rytmus – nedefibrilovatelný rytmus – terapeutická hypotermie – tělesná teplota – neurologický výsledekÚvod
V Evropě před 75. rokem života umírá na kardiovaskulární choroby okolo 40 % obyvatel, z toho velká část na náhlou zástavu oběhu (NZO). Kardiopulmonální resuscitace (KPR) umožňuje překonat kritické období mezi zástavou oběhu – klinickou smrtí a smrtí mozku, a tím i jedince. Pravděpodobnost přežití zástavy oběhu je však stále velice nízká – kolem 10 % v případě mimonemocniční zástavy a 20 % při NZO v nemocnici. Vliv na výsledný neurologický stav těchto nemocných má řada okolností: jejich fyzický stav a komorbidity, délka KPR do obnovení oběhu, první zachycený rytmus, přítomnost kvalitní laické KPR.
Mírná terapeutická hypotermie (MTH) je od roku 2005 doporučována Evropskou radou pro resuscitaci (ERC) jako metoda, jež snižuje úmrtnost a zlepšuje konečný neurologický stav komatózních nemocných po úspěšné kardiopulmonální resuscitaci. Zpočátku byla doporučena pro nemocné po zástavě oběhu mimo nemocnici pro defibrilovatelný rytmus, pak byla indikace rozšířena na dospělé nemocné po jakékoliv nemocniční zástavě oběhu a nakonec na všechny úspěšně resuscitované pacienty jakéhokoliv věku včetně novorozenců narozených po 36. gestačním týdnu ohrožených encefalopatií pro perinatální asfyxii. V experimentech i klinických studiích je zkoumán vliv hypotermie na výsledný neurologický stav po jiných než hypoxických inzultech centrálního nervového systému (CNS) [1].
Mírná hypotermie zabraňuje ischemicko-reperfuznímu poškození: snižuje kyslíkovou spotřebu neuronů, snižuje spotřebu glukózy, inhibuje presynaptické uvolňování glutamátu a dalších excitačních neurotransmiterů, stabilizuje buněčné membrány. Podchlazení rovněž omezuje tvorbu prozánětlivých cytokinů (interleukinu 6), oxidu dusnatého (tím i celkové zánětlivé odpovědi organismu), produkci volných kyslíkových radikálů, zpomaluje apoptózu buněk [2].
V současnosti je arbitrárně stanovena cílová centrální teplota po uvedení do hypotermie na 32–34 °C. Rozsah doporučených teplot byl zvolen s ohledem na účinnost a případné komplikace a nežádoucí účinky. I při těchto teplotách se můžeme setkat se svalovým třesem s nutností svalové relaxace. Hypotermie stimuluje diurézu, což vede k hyponatrémii, hypofosfatémii, hypokalcémii, zvyšuje glykémii snížením produkce inzulinu a zvýšením inzulinorezistence. Dále zvyšuje periferní vaskulární rezistenci, může provokovat arytmie (většinou bradykardii), pravděpodobně narušuje i koagulaci, negativně ovlivňuje imunitní systém supresí leukocytární migrace a fagocytózy [3]. Metabolismus sedativ, svalových relaxancií a některých dalších léčiv je prodloužen [4]. Vzácně může dojít k intracerebrálnímu krvácení či manifestní pankreatitidě. Při větším poklesu centrální teploty jsou tyto nežádoucí účinky výraznější. Komplikace MTH jsou terapeuticky ovlivnitelné přinejmenším zvýšením tělesné teploty. Možnost chlazení na vyšší teplotu [5] i různá délka podchlazení jsou proto nadále předmětem studie.
Za prokázaný je považován pozitivní vliv MTH na neurologický stav nemocných po komorové fibrilaci/tachykardii (KF/KF), nemáme však dostatek důkazů pro toto tvrzení ve vztahu k resuscitovaným pro asystolii či bezpulzovou srdeční aktivitu (pulseless electrical activity – PEA) [1]. Na otázku „Komu hypotermie prospěla?“ jsme se v podmínkách fakultní nemocnice pokusili odpovědět i my a srovnali jsme neurologický outcome nemocných po NZO v různých podmínkách (mimonemocniční vs. nemocniční) pro různý první diagnostikovaný rytmus (defibrilovatelný vs nedefibrilovatelný).
Soubor pacientů a metoda
Výzkum byl schválen Etickou komisí Fakultní nemocnice Olomouc dne 17. 1. 2011 pod číslem jednacím 13/11. V rámci projektu dlouhodobého sledování vývoje konečného neurologického stavu nemocných po úspěšné kardiopulmonální resuscitaci jsme vybrali skupinu všech nemocných přijatých na JIRP KAR v roce 2010. Vyloučili jsme nemocné, u nichž byla zástava oběhu vyústěním jiného děje, tj. traumatu, hemoragického nebo septického šoku, dále nemocné, kteří nebyli z různých důvodů chlazeni (uvedena byla oběhová nestabilita, porucha koagulace, ale často nebyl důvod vůbec uveden) a nemocné zmírající na kardiogenní šok do 12 hod od příjmu na JIRP. Celkem bylo přijato 75 nemocných, zařazeno 48. Skupinu jsme rozdělili do dvou souborů: mimonemocniční KPR (soubor M, n = 31) a nemocniční KPR (soubor N, n = 17) Soubory jsme rozdělili do dalších podsouborů podle prvního diagnostikovaného rytmu: po mimonemocniční KF/KT (podsoubor Md, n = 17), po mimonemocniční asystolii/PEA (podsoubor Mn, n = 14), po nemocniční KF/KT (podsoubor Nd, n = 9) a po nemocniční asystolii/PEA (podsoubor Nn, n = 8) – viz obrázek 1.
1. Rozdělení sledovaného souboru 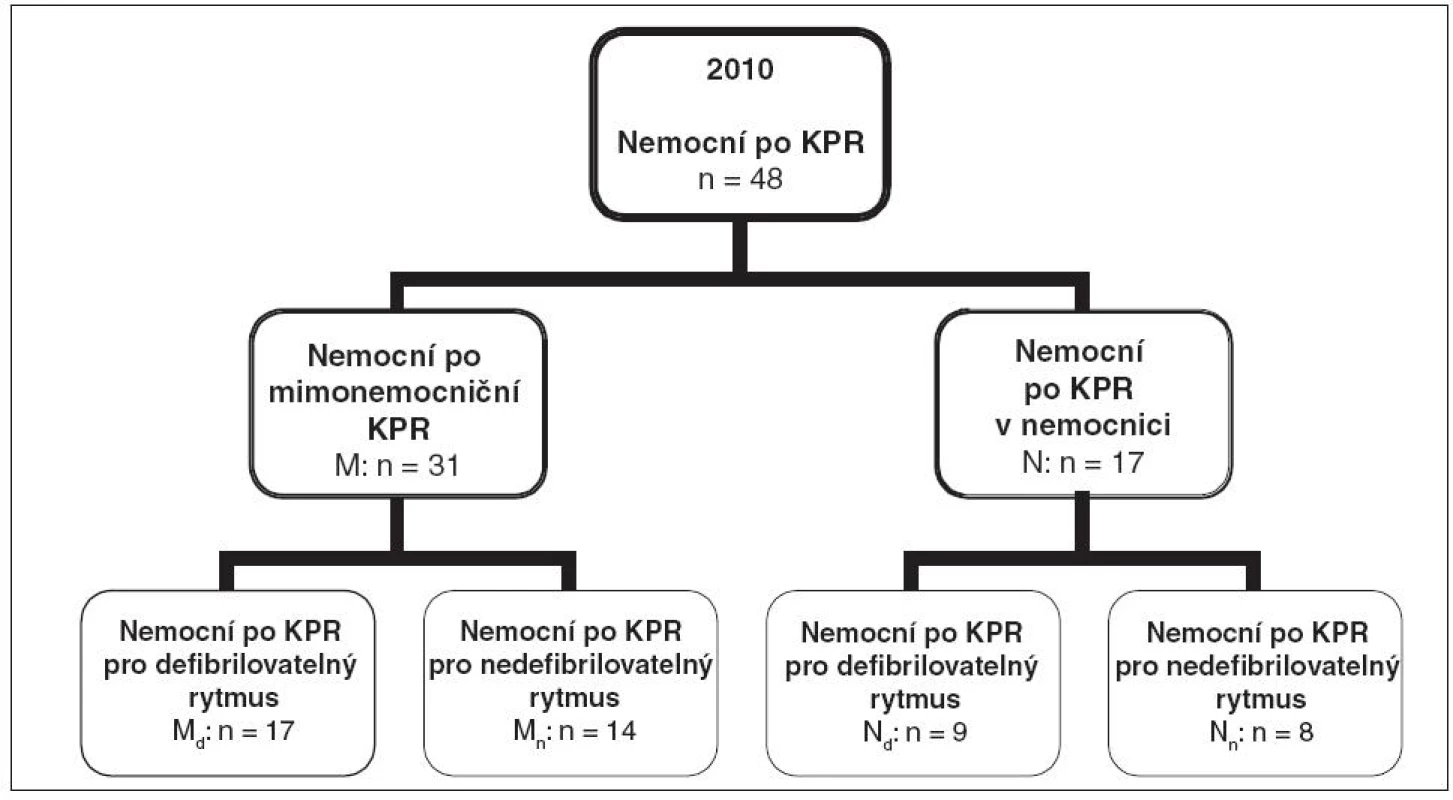
Kontrolní skupinou byla historická skupina nemocných přijatých po KPR na JIRP KAR v roce 2006. V roce 2006 bylo po KPR na JIRP přijato 69 nemocných. Vyřazovací kritéria byla obdobná jako ve sledované skupině (nemocní nebyli chlazeni, ani aktivně zahříváni), zařazeno jich bylo 53. Rozdělení do souborů a podsouborů bylo stejné jako ve sledované skupině: mimonemocniční KPR (soubor O, n = 29) a nemocniční KPR (soubor P, n = 24), po mimonemocniční KF/KT (podsoubor Od, n = 21), po mimonemocniční asystolii/PEA (podsoubor On, n = 8), po nemocniční KF/KT (podsoubor Pd, n = 8) a po nemocniční asystolii/PEA (podsoubor Pn, n = 16) – viz obrázek 2.
2. Rozdělení kontrolního souboru 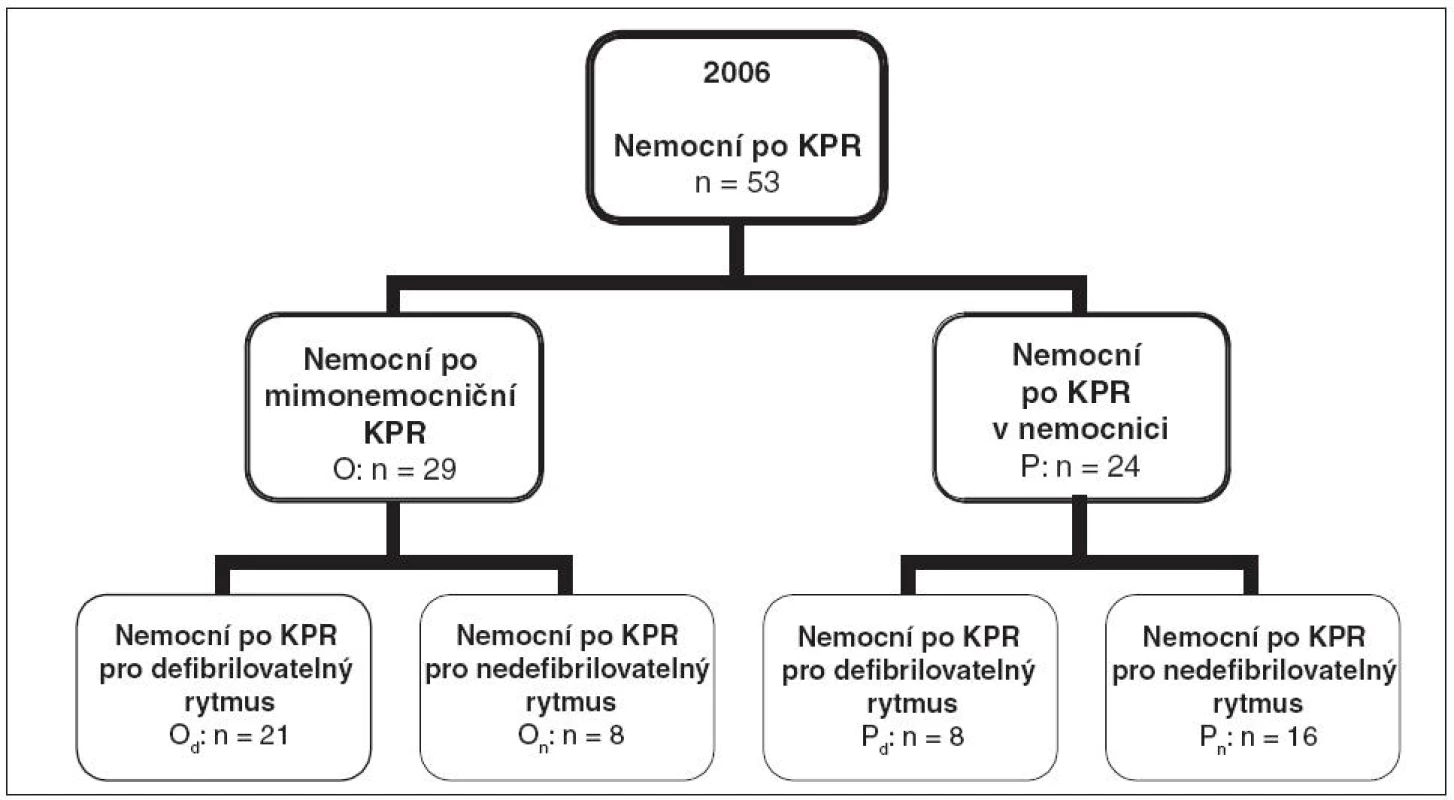
Všechny čtyři podsoubory jsme vzhledem k předpokládanému různému konečnému neurologickému stavu (v souvislosti s rytmem a místem NZO) posuzovali odděleně, vždy sledovaný vs kontrolní historický soubor. Porovnali jsme demografická data, zjištěné příčiny NZO, délku KPR do obnovení spontánního oběhu (Return of spontaneous circulation, ROSC), vstupní hladinu laktátu (míru anaerobního metabolismu během KPR, prediktor outcome) [6, 7]. Dále jsme zhodnotili provedení MTH ve sledované skupině (čas ROSC – zahájení MTH, čas do dosažení cílové teploty, kolísání teploty – hodnoty minimální a maximální teploty v průběhu chlazení) a tělesnou teplotu nemocných v kontrolní skupině. Tělesná teplota byla měřena kontinuálně termistorem zavedeným v močovém měchýři se záznamem do dokumentace každých 60 minut. Nakonec jsme v jednotlivých podsouborech porovnali konečný neurologický stav nemocných při propuštění z nemocnice (nebo překladu na ošetřovatelské lůžko). Ke srovnání neurologického stavu jsme použili Glasgow outcome scale (GOS, viz tab. 1) [8], hodnocení jsme zjednodušili na tři stupně: úmrtí (GOS 1), těžké neurologické postižení (GOS 2 + 3), žádné nebo lehké neurologické postižení (GOS 3 + 4).
1. Glasgow outcome scale (volně podle Jennetta a Bonda [8]) ![Glasgow outcome scale (volně podle Jennetta a Bonda [8])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/eadf43cea9fad5b5c369919417ffd0d7.jpeg)
Získaná data jsme statisticky zhodnotili pomocí softwaru SPSS verze 15. Všechny testy byly provedeny na hladině signifikance 0,05. Získaná data jsme statisticky zhodnotili pomocí softwaru SPSS verze 15. Všechny testy byly provedeny na hladině významnosti p = 0,05. Kategoriální data byla zhodnocena Fisherovým přesným testem, numerická data Mannovým-Whitneyovým U testem.
Výsledky
Při srovnání parametrů charakterizujících všechny soubory demograficky (věk, pohlaví) a po stránce kvality provedené KPR (délka KPR do ROSC, přítomnost laické resuscitace a vstupní hladina laktátu) nebyly zjištěny statisticky významné odchylky (tab. 2, 3, 4, 5).
2. Nemocní po KPR mimo nemocnici pro KF/KT 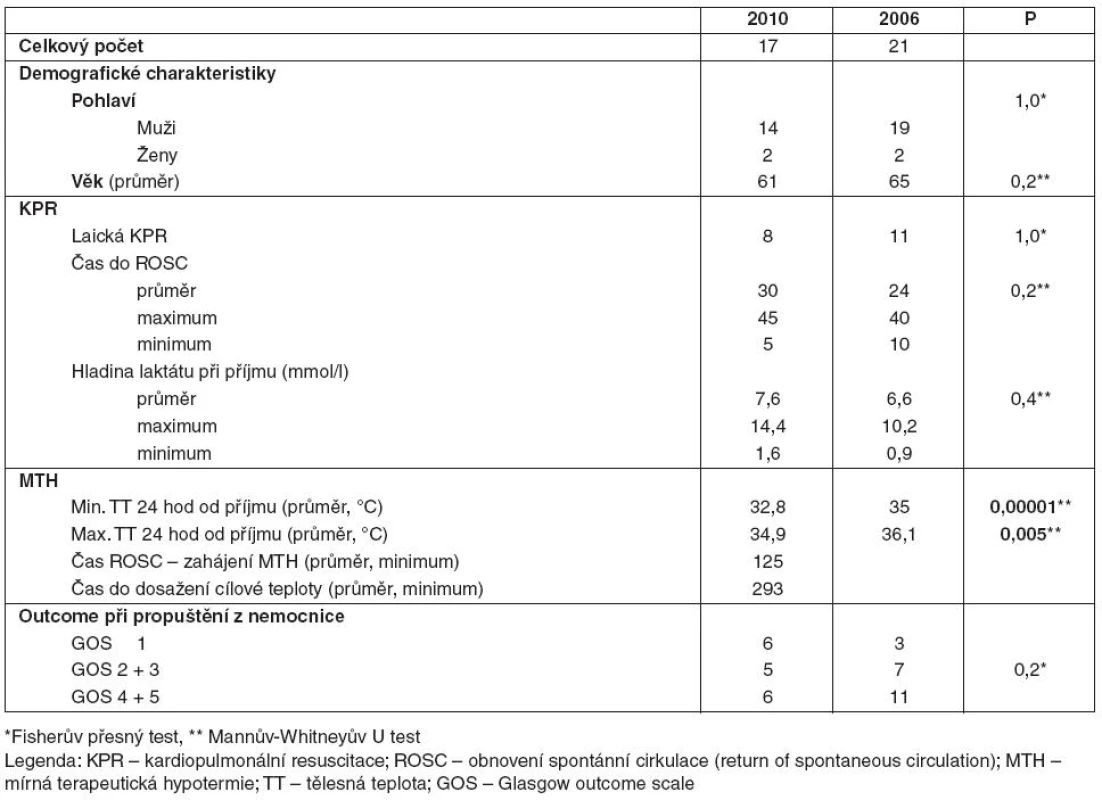
3. Nemocní po KPR mimo nemocnici pro asystolii/PEA 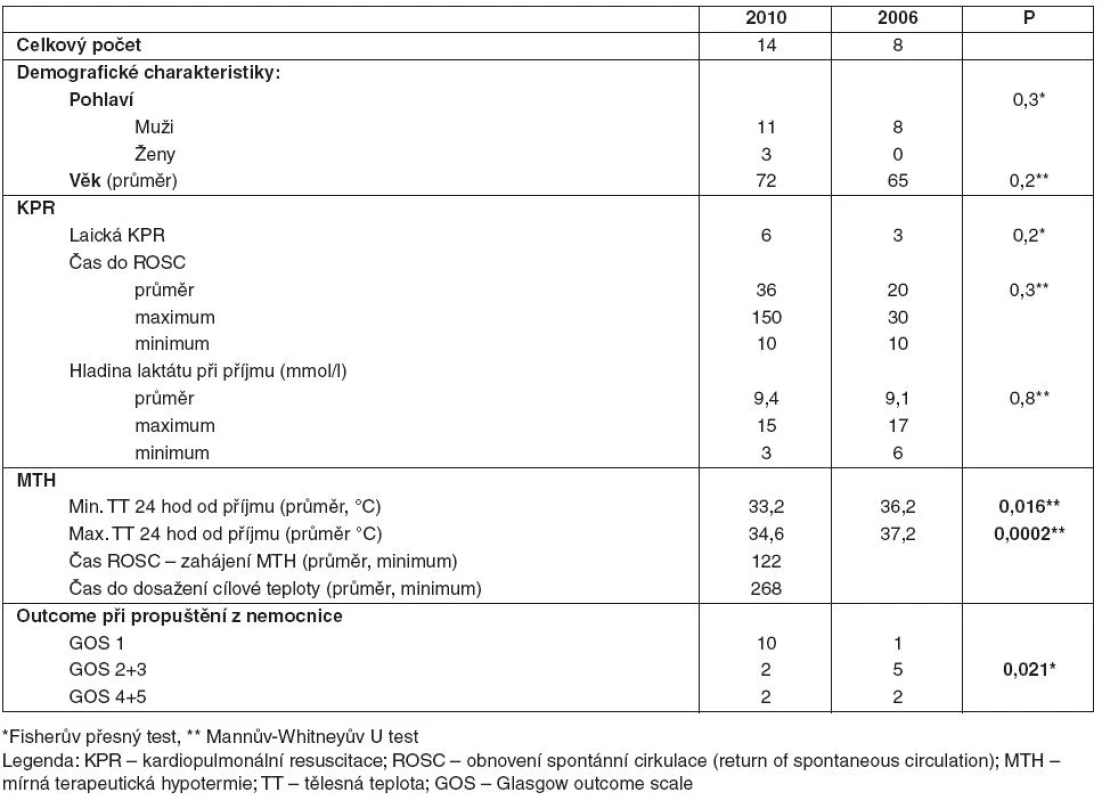
4. Nemocní po KPR v nemocnici pro KF 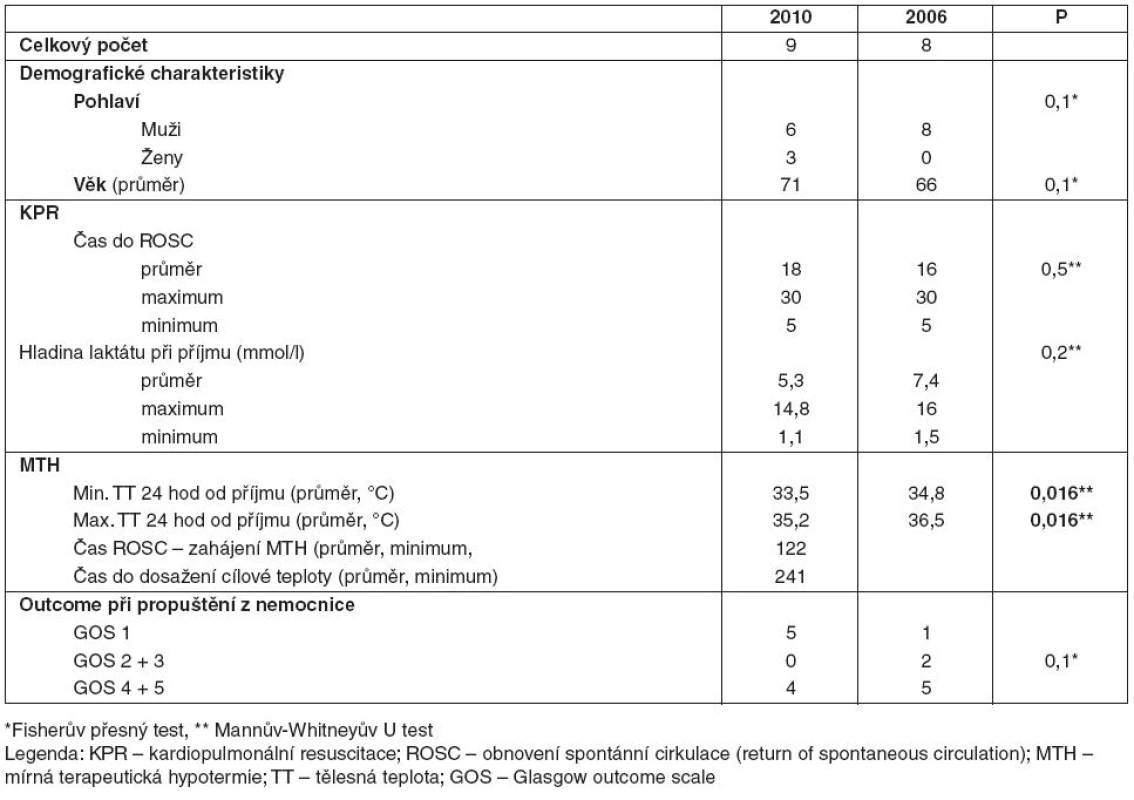
5. Nemocní po KPR v nemocnici pro asystolii/PEA 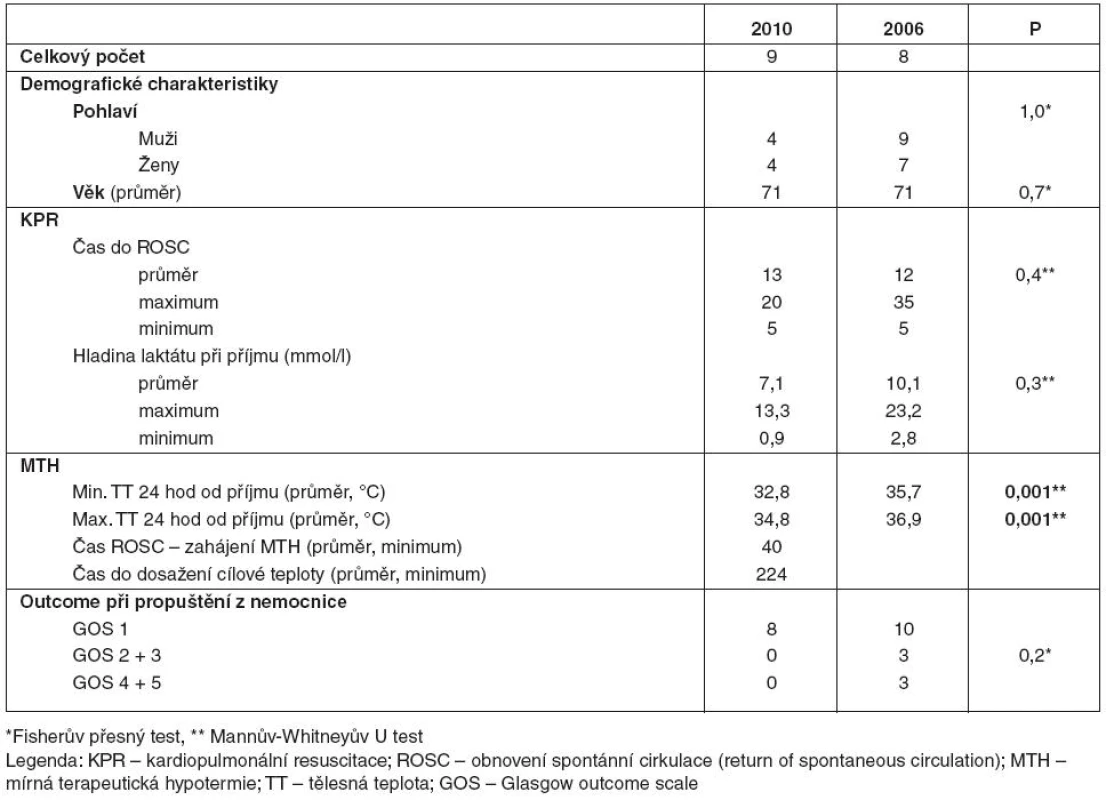
1. Mimonemocniční KPR pro fibrilaci komor/komorovou tachykardii
V podsouboru Md byli nemocní uvedeni do terapeutické hypotermie s průměrnou dosaženou teplotou 32,8 °C, průměrná minimální teplota nemocných v kontrolním podsouboru Od v prvních 24 hodinách od příjmu na JIRP byla 35,0 °C. Maximální průměrná teplota v podskupině Md byla 34,9 °C, v kontrolní skupině Od byla teplota v prvních 24 hodinách hospitalizace na JIRP 36,1 °C. Rozdíl byl statisticky významný (p = 0,00001, respektive p = 0,005 pro maximální teplotu). Průměrný čas do zahájení terapeutické hypotermie od ROSC byl v roce 2010 125 minut, cílové teploty bylo dosaženo v průměru po 293 minutách od zahájení terapeutické hypotermie.
Ve skupině Md v roce 2010 zemřelo šest nemocných (35 % s GOS 1). V kontrolním podsouboru Od v roce 2006 to byli tři nemocní (14 % s GOS 1).
S GOS 2 a 3 bylo z nemocnice propuštěno pět nemocných, tzn. 29 % z podsouboru bylo propuštěno s těžkým neurologickým deficitem. V kontrolním podsouboru to bylo sedm nemocných (33 %).
S lehkým neurologickým deficitem GOS 4 a 5 bylo z nemocnice propuštěno šest nemocných (35 % podsouboru). V kontrolním podsouboru to bylo 11 nemocných (52 %). Rozdíly nebyly statisticky významné (p = 0,2) – viz tabulka 2.
2. Mimonemocniční KPR pro nedefibrilovatelný rytmus
V podsouboru Mn byli nemocní uvedeni do terapeutické hypotermie s průměrnou dosaženou teplotou 33,2 °C, průměrná minimální teplota nemocných v kontrolním podsouboru On v prvních 24 hodinách od příjmu na JIRP byla 36,2 °C. Maximální průměrná teplota v souboru Mn byla 34,8 °C, v kontrolním souboru On pak byla teplota v prvních 24 hodinách hospitalizace na JIRP 37,2 °C. Rozdíl byl statisticky významný (p = 0,0002). Průměrný čas do zahájení terapeutické hypotermie od ROSC byl v roce 2010 122 minut, cílové teploty bylo dosaženo v průměru po 268 minutách od zahájení terapeutické hypotermie.
V podsouboru Mn v roce 2010 zemřelo celkem 10 nemocných (71 % s GOS 1). V kontrolním podsouboru On v roce 2006 před propuštěním zemřel jeden nemocný (13 %).
S GOS 2 a 3 byli v roce 2010 propuštěni dva nemocní (14 % z podsouboru bylo propuštěno s těžkým neurologickým deficitem), v kontrolním podsouboru pět pacientů (63 %).
S lehkým neurologickým deficitem GOS 4 a 5 byli v roce 2010 z nemocnice propuštěni dva nemocní (14 % podsouboru). V kontrolním podsouboru byli z nemocnice propuštěni dva nemocní (25 %) v dobrém neurologickém stavu.
Tyto rozdíly byly vyhodnoceny jako statisticky signifikantní (p = 0,021) – viz tabulka 3.
3. Nemocniční KPR pro fibrilaci komor/komorovou tachykardii
V podsouboru Nd byli nemocní uvedeni do terapeutické hypotermie s průměrnou dosaženou teplotou 33,5 °C, průměrná minimální teplota nemocných v kontrolním podsouboru Pd v prvních 24 hodinách od příjmu na JIRP byla 34,8 °C. Maximální průměrná teplota v podsouboru Nd byla 35,2 °C, v kontrolním podsouboru Pd pak byla teplota v prvních 24 hodinách hospitalizace na JIRP 36,5 °C. Rozdíl byl statisticky významný (p = 0,016). Průměrný čas do zahájení terapeutické hypotermie od ROSC v roce 2010 byl 122 minut, cílové teploty bylo dosaženo v průměru po 241. minutě od zahájení terapeutické hypotermie.
V podsouboru Nd v roce 2010 zemřelo za hospitalizace pět pacientů (56 % s GOS 1). V kontrolním podsouboru Pd v roce 2006 před propuštěním zemřel jeden nemocný (12 %).
S GOS 2 a 3 byli v roce 2010 s těžkým neurologickým deficitem nebyl propuštěn nikdo. V kontrolním podsouboru byli z nemocnice s GOS 2 a 3 propuštěni dva nemocní (25 % podsouboru).
S lehkým neurologickým deficitem GOS 4 a 5 byli z nemocnice propuštěni čtyři nemocní (44 % podsouboru). V kontrolním podsouboru bylo propuštěno s minimálním deficitem 5 nemocných (63 % – viz tab. 4). Rozdíly nebyly statisticky signifikantní (p = 0,1) – viz tabulka 4.
4. Nemocniční KPR pro nedefibrilovatelný rytmus
V podsouboru Nn byli nemocní uvedeni do terapeutické hypotermie s průměrnou dosaženou teplotou 32,8 °C, průměrná minimální teplota nemocných v kontrolním podsouboru Pn v prvních 24 hodinách od příjmu na JIRP byla 35,7 °C. Maximální průměrná teplota v podsouboru Nn byla 34,8 °C, v kontrolním podsouboru Pn pak byla teplota v prvních 24 hodinách hospitalizace na JIRP 36,9 °C. Rozdíl byl statisticky významný (p = 0,001). Průměrný čas do zahájení terapeutické hypotermie od ROSC byl v roce 2010 40 minut, cílové teploty bylo dosaženo v průměru po 224 minutách od zahájení terapeutické hypotermie.
V podsouboru Nn v roce 2010 zemřeli všichni nemocní před propuštěním (100 % s GOS 1). V kontrolním podsouboru Pn v roce 2006 na JIRP jich zemřelo 10 (63 %).
V kontrolním podsouboru byli s těžkým deficitem propuštěni tři nemocní (19 % podsouboru) a v dobrém stavu tři nemocní (19 %). Rozdíly nebyly statisticky signifikantní (p = 0,2) – viz tabulka 5.
Diskuse
Terapeutická hypotermie u nemocných po kardiopulmonální resuscitaci je doporučována a aplikována na základě výsledků dnes již „historických“ studií Australana Stephena Bernarda [9] a evropské Hypothermia after Cardiac Arrest Study Group [10]. Obě multicentrické studie navázaly na experimenty na zvířecích modelech realizované v 90. letech 20. století a pokusy o uvedení nemocných po KPR do hypotermie prováděné na přelomu 50. a 60. let minulého století. Prokázaly pozitivní vliv mírné terapeutické hypotermie uskutečňované po dobu 12–24 hodin na neurologický stav a mortalitu, především po mimonemocniční zástavě oběhu pro defibrilovatelný rytmus. Následovala řada studií, ať už randomizovaných, či srovnávacích, s historickou kontrolní skupinou s podobnými závěry. Belliard et al. srovnali neurologický outcome resuscitovaných před zavedením terapeutické hypotermie a po jejím zavedení na jednom pracovišti [11], multicentrická studie Arriche prokázala bezpečnost a efektivitu různými metodami prováděné MTH [12].
Zatímco důkazy o efektu terapeutické hypotermie po komorové fibrilaci či tachykardii je možno považovat za jednoznačné, po jiných než defibrilovatelných vstupních rytmech tomu tak není. Přesto je tato metoda doporučována i po asystolii či resuscitaci pro významnou bradykardii nebo bezpulzovou srdeční aktivitu, neboť její benefit může vyvážit či převážit případná rizika [13]. Stephen Bernard ji doporučuje používat v klinické praxi po zvážení možných rizik pro všechny nemocné po hypoxickém inzultu CNS bez ohledu na jeho příčinu, neboť prognóza těchto nemocných je velmi špatná a možnosti ji ovlivnit omezené [14].
I my jsme se pokusili zjistit, které skupině nemocných prospívá terapeutická hypotermie. Jako metodu jsme zvolili srovnání souboru nemocných po zavedení standardního postupu provádění MTH s historickou kontrolní skupinou z období, kdy nebyla většina nemocných chlazena. Domníváme se, že v současné době, kdy je příznivý vliv terapeutické hypotermie na výsledný neurologický stav považován za prokázaný (alespoň po defibrilovatelném rytmu), by nebylo únosné vytvářet kontrolní skupinu pacientů, kterým bychom podchlazení odepřeli. Výsledky zjištěné srovnáním jednotlivých podsouborů však přinesly zklamání. Ve všech podsouborech jsme zaznamenali zhoršení neurologického stavu při propuštění z nemocnice. Přehledně to zobrazuje obrázek 3 a 4.
3. Neurologický stav při propuštění z nemocnice (rok 2006) 
Obr. 4. Neurologický stav při propuštění z nemocnice (rok 2010) 
V podsouboru zahrnujícím nemocné po mimonemocniční KPR pro defibrilovatelný rytmus, kde jsme předpokládali dobrý efekt terapeutické hypotermie, bylo v roce 2010 v dobrém či uspokojivém stavu propuštěno o 17 % méně nemocných než v kontrolním podsouboru. V podsouboru mimonemocniční KPR pro nedefibrilovatelný rytmus to bylo o 11 % méně. Srovnání úmrtnosti dopadlo ještě hůře, došlo ke vzestupu o 21 %, respektive o 58 %.
O 19 % klesl počet pacientů propuštěných v dobrém neurologickém stavu po nemocniční KPR pro KF/KT, kde jsme očekávali nejlepší efekt podchlazení. Úmrtnost vzrostla o 41 %. V roce 2010 zemřeli všichni nemocní resuscitovaní v nemocnici pro asystolii, v roce 2006 zemřelo „jen“ 63 %, ale v dobrém stavu jich bylo propuštěno 19 %.
Znamená to, že terapeutická hypotermie není účinná, nebo že dokonce škodí?
Přestože je mezi sledovanými skupinami rozdíl čtyř let, nedošlo k žádnému posunu v kvalitě KPR. Ochota a schopnost svědků zástavy oběhu pomoci se nezměnila ani po zavedení metodiky telefonicky asistované neodkladné resuscitace na dispečincích zdravotnické záchranné služby. V naší spádové oblasti jsou rozmístěny automatické externí defibrilátory, avšak u žádného z nemocných zařazených do studie nebyly použity. Ve sledovaném období se v terénu nezkrátila délka KPR do ROSC, naopak se, byť nesignifikantně, prodloužila (KF/KT: 2006 – 24 min, 2010 – 27 min; asystolie: 2006 – 21 min, 2010 36 min, tento průměrný čas byl ovlivněn úspěšnou resuscitací mladé ženy resuscitované celkem 150 minut pro asystolii při embolii do arteria pulmonalis (EAP), která zemřela až během hospitalizace.
Uvedené skutečnosti umožnily srovnání dvou skupin nemocných, mezi nimiž byl časový rozdíl.
Vyloučením nemocných zemřelých před příjmem na JIRP a v průběhu prvních dvanácti hodin hospitalizace jsme se pokusili vyřadit pacienty umírající na oběhové komplikace poresuscitačního syndromu. Žádný zemřelý ve sledovaných souborech nenabyl po KPR vědomí. Většina zemřela po provedení změny kategorie léčby z důvodu přetrvávání hlubokého kómatu spojeného s orgánovým selháváním.
Při analýze příčin zhoršení neurologického stavu ve sledovaném souboru jsme narazili na problém kvality provádění terapeutické hypotermie. Ačkoli by terapeutická hypotermie měla být podle zavedeného protokolu zahajována již na oddělení urgentního příjmu, nebylo tomu tak vždy – zahájena byla v průměru po 120 minutách od ROSC a cílové teploty bylo dosaženo v průměru až po 293 minutách (KF/KT), respektive po 268 minutách (asystolie/PEA) od začátku ochlazování. Vliv rychlosti zahájení chlazení na outcome je prokázán ve studiích na zvířecím modelu [15]. Do současnosti nebyl tento fakt prokázán v humánních studiích, přesto se domníváme, že čas do zahájení a do dosažení cílové teploty byl příliš dlouhý. Cílové teploty bylo dosahováno rovněž s velkým odstupem od zahájení hypotermie. Obě skutečnosti mohly neurologický výsledek ovlivnit.
Jako problematické se ukázalo udržení stabilní tělesné teploty v průběhu terapeutické hypotermie. U mnohých nemocných nebylo dosaženo vyrovnané teploty v rozmezí 32–34 °C, někdy tělesná teplota stoupala i do pásma normotermie. Část nemocných byla ochlazována pomocí proudu studeného vzduchu, zchlazenými gelovými polštářky a podáváním studených roztoků, další část byla ochlazována přístrojem pro zevní chlazení bez zpětnovazebního řízení aktuální tělesnou teplotou s manuálním ovládáním (HICO - -Variotherm 550, výrobce Hirtz & Co. KG Hospitalwerk, SRN). Jen dva nemocní byli podchlazeni zapůjčeným přístrojem s intravenózním chlazením s plnou automatikou (Thermogard XP™, výrobce Zoll Medical Corporation, Massachusetts, USA). Největší rozptyl teplot byl zaznamenán u nemocných chlazených bez přístroje, ale ani použití přístroje bez zpětné vazby nebylo prosto výkyvů tělesné teploty do normotermie. Přístroj s automatikou pracoval bez komplikací a zásahů obsluhy, udržoval teplotu na nastavené hodnotě. Navíc oba nemocní byli propuštěni ve velmi dobrém stavu. O vlivu kolísání teploty během hypotermie na neurologický výsledek a ideální rozmezí teplot se v současnosti intenzivně diskutuje, stále však chybí velká randomizovaná studie; stávající doporučení jsou opřena o studie observační [16]. Na našem souboru se ukázalo, že automatické přístroje jsou vhodnější, neboť další činností nezatěžují ošetřující personál, který je stále více rozptylován narůstajícím množstvím mnohdy ryze administrativních úkonů. Pokud není automatický přístroj k dispozici, je nutné klást dostatečný důraz na promptní reakci na zvýšení tělesné teploty a na zamezení jejího kolísání, optimální je zavést přesný ošetřovatelský protokol a trvat na jeho dodržování. Způsob chlazení, pokud je dodržována cílová teplota, nemá na neurologický výsledek vliv [17].
Nemocniční KPR měla ve sledovaném souboru menší úspěšnost. Ve sledované skupině byla po nemocniční KPR vyšší úmrtnost, nebyl rozdíl v počtu nemocných propuštěných v dobrém neurologickém stavu.
KPR v nemocnici odlišují od mimonemocniční KPR tyto okolnosti: reakce na NZO je rychlejší, zpravidla je svědkem školený zdravotnický pracovník, i základní resuscitace je prováděna odborně a je rychle následována rozšířenou resuscitací. V naší studii se to projevilo v kratším průměrném čase do ROSC a ve vyšším procentu přežívajících KPR pro KF/KT ve sledovaném i kontrolním souboru ve srovnání s mimonemocniční KPR. I v tomto podsouboru jsme zaznamenali zhoršení výsledného neurologického stavu ve sledované skupině. Na neúspěchu se mohl rovněž podílet nedostatečný důraz na kvalitu provedení terapeutické hypotermie i rozdílná převažující příčina NZO.
Nejhorší byly výsledky nemocniční KPR pro asystolii/PEA. Pravděpodobnost úspěšné resuscitace je sice vyšší než u mimonemocniční asystolie, ale prognóza nemocných je podobně špatná. Za předpokladu, že asystolii předchází různou dobu trvající komorová fibrilace, je její nezachycení známkou pozdní diagnostiky náhlé zástavy oběhu [18]. V nemocnici to znamená nedostatečný dohled na standardním oddělení nebo nedostatečné monitorování na JIP. Příčinou asystolie v souboru byla z poloviny respirační insuficience, následovaná podceněním situace a nedostatečně agresivní terapií. Druhá polovina měla souvislost s akutním koronárním syndromem.
Výsledek KPR hospitalizovaných nemocných a jejich následnou prognózu ovlivňují ve velké míře onemocnění, pro která jsou v nemocnici. To dokládá nejen vysoká úmrtnost (v roce 2010 : 100 %, v roce 2006 : 62,5 %), ale i nízký počet nemocných do podskupiny zařazených, a naopak vysoký počet vyřazených (především pro časné úmrtí). Vysvětlit se tím dá i nejhorší výsledný neurologický stav ze všech sledovaných podsouborů, který byl ve skupině se zavedenou MTH ve srovnání s kontrolní ještě více beznadějný.
Výsledky byly neočekávané. Je možné, že byly ovlivněny chybou při malých počtech nemocných zařazených do jednotlivých podsouborů. Až na jednu výjimku nebyly rozdíly statisticky významné. Dále je možné, že výsledný stav nemocných z roku 2006 byl pouze náhodně lepší, než tomu bylo v ostatních letech. Valentin ve studii zahrnující 253 pacientů resuscitovaných v nemocnici (publikované v roce 1995, dlouho před zavedením terapeutické hypotermie), uvádí, že pouze 20 % přežije resuscitaci v nemocnici, z úspěšně resuscitovaných zemře 64 % [19]. V letos publikované práci Florence Dumasové bylo v dobrém stavu propuštěno 39 % nemocných přijatých po resuscitaci pro defibrilovatelný rytmus a jen 16 % pro nedefibrilovatelný rytmus [20]. V našem sledovaném souboru byla úmrtnost nemocných po úspěšné KPR pro defibrilovatelný rytmus 42 %, v dobrém stavu bylo propuštěno 38 % nemocných. Úmrtnost nemocných po KPR pro nedefibrilovatelný rytmus byla 82%, v dobrém stavu bylo propuštěno 9 %. V kontrolním souboru byly výsledky lepší: po defibrilaci bylo propuštěno v dobrém stavu 55 % pacientů a 14 % zemřelo, po nedefibrilovatelném rytmu zemřelo 46 % a 21 % opustilo nemocnici s minimálním neurologickým deficitem.
Vedlejším nálezem, neméně překvapivým, byl laxní přístup k provedení terapeutické hypotermie s mnoha chybami a především nedostatečnou kontrolou dosažení a udržení doporučené cílové teploty.
Netroufáme si na základě výsledků malé komparativní studie vyslovit závěr, že terapeutická hypotermie zhoršuje neurologický výsledek a úmrtnost nemocných po KPR pro defibrilovatelný rytmus. Byl by v kontradikci s výsledky studií s většími soubory a odporoval by i současnému doporučení ERC.
Prokázat pozitivní vliv terapeutické hypotermie na neurologický stav nemocných po KPR pro nedefibrilovalené rytmy se nepodařilo, podobně jako v práci Dumasové et al. [20]. Naopak, po zavedení MTH do klinické praxe došlo ke snížení (v případě mimonemocniční asystolie/PEA statisticky signifikantnímu) počtu nemocných propuštěných v dobrém neurologickém stavu a zhoršení úmrtnosti. Nedokonalé provedení hypotermie se na tom může podílet, stejně jako možné rozdíly v závažnosti přidružených onemocnění ve sledované a kontrolní skupině.
Závěr
- Pozitivní vliv mírné terapeutické hypotermie na průběh poresuscitačního syndromu pacientů po KPR pro nedefibrilovatelný rytmus nebyl prokázán. Outcome ve sledované skupině se zhoršil bez ohledu na místo náhlé zástavy oběhu. Tento výsledek je v souladu s některými publikovanými pracemi. Je možné, že byl ovlivněn nedokonale provedenou technikou hypotermie, avšak není vyloučeno, že podchlazení outcome po asystolii zhoršuje. V takovém případě by bylo nutno přehodnotit dosavadní doporučení.
- Po zavedení protokolu terapeutické hypotermie se zhoršil i outcome nemocných po KPR pro defibrilovatelný rytmus. Ani v tomto případě nezáleželo na místě NZO. Pravděpodobnou příčinou rozdílnosti výsledků po KPR pro defibrilovatelný rytmus ve srovnání s pracemi jiných autorů je nedostatečný vliv na ischemicko-reperfuzní poškození CNS při opožděném zahájení terapeutické hypotermie a pozdním dosažení cílové teploty. Vliv kolísání teploty v průběhu hypotermie je zapotřebí dále studovat.
- Výsledky studie mohou být významně ovlivněny malým počtem nemocných. Bylo by vhodné studii zopakovat jako prospektivní za účasti více center. Vhodná by byla i analýza příčin nezahájení chlazení v indikovaných případech.
Došlo dne 18. 3. 2011.
Přijato dne 20. 6. 2011.Adresa pro korespondenci:
MUDr. Hynek Fiala
Hněvotín 91
783 47
e-mail: hyfa@seznam.cz
Sources
1. Deakin, C. D., Nolan, J. P., Soar, J., Sunde, K., Koster, R. W., Smith, G. B., Perlina, G.D. European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. Resuscitation, 2010, 81, 10, p. 1305–1352. Dostupný také z www:
http://www.erc.edu/index.php/ doclibrary/en/209/1.
2. Sahuquillo, J., Vilalta, A. Cooling the injured brain: how does moderate hypothermia influence the pathophysiology of traumatic brain injury. Curr. Pharm. Des., 2007, 13, 22, p. 2310–2322.
3. Polderman, K. H., Herold, I. Therapeutic hypothermia and controlled normothermia in the intensive care unit: practical considerations, side effects, and cooling methods. Crit. Care Med., 2009, 37, p. 1101–1120.
4. Tortorici, M. A., Kochanek, P. M., Poloyac, S. M. Effects of hypothermia on drug disposition, metabolism, and response: a focus of hypothermia-mediated alterations on the cytochrome P450 enzyme system. Crit. Care Med., 2007, 35, p. 2196–204.
5. Gál, R., Slezák, M., Zimová, I., Čundrle, I., Ondrášková, H., Seidlová, D. Therapeutic hypothermia after out-of-hospital cardiac arrest with the target temperature 34–35 °C. Bratislava Medical Journal – Bratislavské lékarske listy, 2009, 110, 4, p. 222–225.
6. Samson, C., Rogers, M. A., Dahl, J., Kellermann, A. L. Predictors of survival from out-of-hospital cardiac arrest: a systematic review and meta-analysis. Cirk. Cardiovasc. Qual. Outcomes, 2010, 3, 1, p. 63–81.
7. Shinozaki, K., Oda, S., Sadahiro, T. et al. Blood ammonia and lactate levels on hospital arrival as a predictive biomarker in patients with out-of-hospital cardiac arrest. Resuscitation, 2011. Dostupný také z www:
http://www.resuscitationjournal.com/article/S0300-9572% 2810%2901061-0/fulltext.
8. Jennett, B., Bond, M. Assessment of outcome after severe brain damage: A Practical Scale. Lancet, 1975, p. 480–484.
9. Bernard, S., A., Gray, T., W., Buist, M., D. et al. Treatment of Comatose Survivors of Out-of hospital cardiac arrest with induced hypothermia. N. Engl. J. Med., 2002, 346, p. 557–563.
10. Hypothermia after Cardiac Arrest Study Group Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N. Engl. J. Med., 2002, 346, 8, p. 549–556. Dostupné také z WWW: http://www.nejm.org/doi/full/10.1056/ NEJMoa012689#t=articleTop
11. Belliard, G., Catez, E., Charron, C. et al. Efficacy of therapeutic hypothermia after out-of-hospital cardiac arrest due to ventricular fibrillation. Resuscitation, 2007, 75, 2, p. 252–259.
12. Arrich, J. Hypothermia After Cardiac Arrest Registry Study Group. Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit. Care Med., 2007, 35, 4, p. 1041–1047.
13. Don, C. W., Longstreth, W. T. Jr, Maynard, C. et al. Active surface cooling protocol to induce mild therapeutic hypothermia after out-of-hospital cardiac arrest: a retrospective before-and-after comparison in a single hospital. Crit. Care Med., 2009, 37, 12, p. 3062–3069.
14. Bernard, S. Hypothermia after cardiac arrest: expanding the therapeutic scope. Crit. Care Med., 2009, 37, 7 Suppl., p. 227–233.
15. Kuboyama, K., Safar P. et al. Delay in cooling negates the beneficial effect of mild resuscitative cerebrál hypothermia after cardiac arrest in dogs: a prospective, randomized study. Crit. Care Med., 1993, 21, 9, p. 1348–1358.
16. Nolan, J. P., Soar J. Mild therapeutic hypothermia after cardiac arrest: Keep on chilling. Crit. Care Med., 2011, 39, 1, p. 206–207.
17. Hoedemaekers, C. W. et al. Comparison of cooling methods to induce and maintain normo - and hypothermia in intensive care unit patients: a prospective intervention study. Crit. Care, 2007, 11, 4, p. R91
18. Nolan, J. P. et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 1. Executive summary. Resuscitation, 2010, 81, 10, p. 1222. Dostupný také z WWW: http://www.erc.edu/index.php/doclibrary/en/209/1.
19. Valentin, A. et al. Outcome of cardiopulmonary resuscitation in hospitalized patiens. Resuscitation, 1995, 30, p. 217–221.
20. Dumas, F., Grimaldi, D., Zuber et al. Is Hypothermia After Cardiac Arrest Effective in Both Shockable and Nonshockable Patients? Insights From a Large Registry. Circulation, 2011, 123, 8, p. 877–886.
Poděkování: Děkujeme paní Mgr. Kateřině Langové, Ph.D., z Ústavu biofyziky Lékařské fakulty Univerzity Palackého v Olomouci za statistické zpracování dat.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2011 Issue 4-
All articles in this issue
- Usage of peroperative transoesophageal echocardiography (TOE) during cardiac surgery in the Czech Republic by anaesthetists
- Oral analgesic sedation of mentally handicapped patients – preliminary results
- Does mild therapeutic hypothermia have the same influence on patients’ neurological outcome following in-hospital and out-of-hospital resuscitation due to shockable and non-shockable rhythms?
- Superficial and interfascial cervical block – MRI study
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Oral analgesic sedation of mentally handicapped patients – preliminary results
- Superficial and interfascial cervical block – MRI study
- Does mild therapeutic hypothermia have the same influence on patients’ neurological outcome following in-hospital and out-of-hospital resuscitation due to shockable and non-shockable rhythms?
- Usage of peroperative transoesophageal echocardiography (TOE) during cardiac surgery in the Czech Republic by anaesthetists
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

