-
Medical journals
- Career
Měření transalveolárního tlaku pomocí plícnicového katétru
: Zvoníček Václav; Suk Pavel; Šrámek Vladimír; Pavlík Martin
: Anesteziologicko-resuscitační klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta Masarykovy univerzity
: Anest. intenziv. Med., 20, 2009, č. 4, s. 192-199
: Intensive Care Medicine - Original Paper
Cíl studie:
Transalveolární tlak je rozdíl alveolárního a pleurálního tlaku a je důležitou proměnnou v umělé plicní ventilaci. Pleurální tlak, nezbytný k výpočtu transalveolárního tlaku, je měřen pomocí ezofageálního balonku, který se běžně nepoužívá. Cílem práce bylo testovat měření respiračních změn pleurálního tlaku, a tím změn transalveolárního tlaku pomocí respiračních změn centrálního žilního tlaku (CVP), tlaků v a. pulmonalis (PAP) a tlaků v zaklínění plícnicového katétru (PAOP). Metoda využívá faktu, že změny pleurálního tlaku během respiračního cyklu se do těchto tlaků přenášejí. Podle hypotézy se předpokládalo, že změny pleurálního a vaskulárních tlaků během respiračního cyklu jsou přibližně shodné.Typ studie:
Prospektivní studie, srovnání metod měření.Typ pracoviště:
JIP fakultní nemocnice.Materiál a metoda:
Pacientům na řízené umělé plicní ventilaci (n = 23) byly aplikovány různé dechové objemy a simultánně zaznamenány změny během nádechu a výdechu ezofageálního tlaku a vaskulárních tlaků měřených plínicovým katétrem. Změny transalveolárního tlaku během respiračního cyklu vypočtené standardní metodou pomocí ezofageálního tlaku (PtES) byly srovnány se změnami transalveolárního tlaku měřeného pomocí CVP (PtCVP), PAP (PtPAP) a PAOP (PtPAOP).Výsledky:
Bias a limit shody podle Bland-Altmana byly při srovnání PtCVP -1,3 (-4,1–1,5), PtPAP 1,6 (-2,3–5,4), PtPAOP 0,9 (-3,6–5,5) cm H2O. Nejlepších výsledků bylo dosaženo při odhadu PtES pomocí změn tlaků v zaklínění plínicového katétru, kdy konec katétru byl ideálně umístěn v zóně III podle Westa. Za těchto okolností 80 % měření vykazovalo dobrou klinickou shodu.Závěr:
Změnu transalveolárního tlaku během respiračního cyklu lze přijatelně odhadnout z křivky tlaku v zaklínění a. pulmonalis za podmínky ideálního umístění plínicového katétru.Klíčová slova:
pleurální tlak – transalveolární tlak – centrální žilní tlak – tlak v zaklínění a. pulmonalis – umělá plicní ventilaceÚvod
Otázky bezpečného nastavení tlaků při umělé plicní ventilaci jsou léta předmětem diskusí [1]. Převládá shoda, že tlak v dýchacích cestách (plateau) by neměl přesáhnout 30 cm H2O [2], vyšší hodnoty mohou vést k postižení plic – ventilatory induced lung injury (VILI) [3]. Tlak v dýchacích cestách (plateau pressure) však není adekvátní proměnou pro odhad plicního stresu způsobeného UPV [4]. Síla, která rozepíná plíce je transalveolární tlak, tj. rozdíl alveolárního a pleurálního tlaku. Transalveolární tlak je skutečným spouštěčem VILI. K prevenci VILI by bylo pro nastavení ventilace vhodnější používat transalveolární tlak.
Pleurální tlak je v klinice měřen pomocí tlaku ezofageálního [5]. Měření vyžaduje zavedení balonkového katétru do jícnu a zařízení k měření tlaku, které není běžně dostupné. Pleurální tlak, v literatuře zjednodušeně uváděn jako intratorakální tlak, je řídícím faktorem interakcí oběhu a dýchání.
Do křivek centrálního žilního tlaku (CVP) a do tlaků v a. pulmonalis se přenáší místní pleurální tlak. Na základě doposud provedených studií lze předpokládat, že změny CVP, tlaku v a. pulmonalis (PAP) a v a. pulmonalis po zaklínění (PAOP) během respiračního cyklu těsně sledují změny pleurálního tlaku [6, 7].
Naše hypotéza předpokládala, že změny pleurálního a vaskulárních tlaků během respiračního cyklu jsou přibližně shodné, tzn. že rozdíly mezi hodnotami tlaků nebudou klinicky významné. V případě platnosti hypotézy by bylo možno využít změn vaskulárních tlaků k měření pleurálního tlaku a výpočtu transalveolárního tlaku.
Cílem studie bylo srovnat měření změn transalveolárního tlaku během respiračního cyklu standardní metodou pomocí ezofageálního tlaku a změn transalveolárního tlaku měřeného pomocí respiračních výkyvů CVP, PAP a PAOP.
Metodika
Studie probíhala se souhlasem etické komise na lůžkovém oddělení Anesteziologicko-resuscitační kliniky FN U sv. Anny v Brně v letech 2006–2008. Do studie byli zařazeni pacienti, kteří byli na umělé plicní ventilaci (Servo 300, Siemens-Asea, Sweden nebo Avea ViasysTM, Healthcare USA, měli nezávisle na studii zavedený plícnicový katétr (7.5F, Edwards, Life Sciences, USA) a neměli kontraindikaci k zavedení jícnového katétru.
Monitorování
K měření byl zaveden jícnový katétr (Nasogastric balloon catheter, Smarth Cath, Bicore,USA), jeho poloha ověřena okluzním testem [8] a přítomnosti kardiálních artefaktů na křivce ezofageálního tlaku.
Hemodynamické parametry byly měřeny na standardním monitoru: monitor Datex Ohmeda S/5 (Instrumentarium Corp., Finland). Měřené tlaky byly v digitální formě sbírány a data ukládána pomocí softwaru Datex-Ohmeda Collect program.
Respirační tlaky a průtok v dýchacích cestách byl měřen u prvních 9 pacientů pomocí ventilátoru Avea (ViasysTM, Healthcare USA) u následujících pacientů na speciálním monitoru k tomuto účelu sestaveném. Monitor sestával z diferenciálních tlakových převodníků Validyn DP45 (Validyne Engineering, Northridge, CA, USA), mřížkového pneumotachografu (Harvard HSE, USA), modulátoru signálu a hardwarového (National Instruments DAQPad-6015, USA) a akvizičního softwaru (ScopeWin, ©Jurák, ČR).
Správné zaklínění plícnicového katétru muselo splňovat následující kritéria: změna tvaru křivky po zaklínění (pokles křivky a utlumení křivky), tlak v zaklínění je nižší než diastolický tlak v a. pulmonalis, změna tlaku během respiračního cyklu v a. pulmonalis je menší než tlaková změna v zaklínění plícnicového katétru, PPAOP/PPAP < 1,35 (viz níže) [9].
Procedura
Pacienti byli hluboce analgosedovaní a případně relaxovaní, byli ventilovaní v režimu objemově řízené ventilace. Během procedury byla kontinuálně ukládána respirační a hemodynamická data během aplikace 5–12 různých dechových objemů (aby bylo dosaženo různých ezofageálních tlaků). Ukládány byly hodnoty: tlak v dýchacích cestách, ezofageální tlak, průtok v dýchacích cestách, EKG, arteriální tlak, tlak v centrální žíle a v a. pulmonalis.
Během ventilace s určitým objemem (v rozsahu 350–900 ml) byl aplikován dech s inspirační okluzí, následovaný výdechem s aplikací exspirační okluze, takový dech byl aplikován dvakrát: při nezaklíněném a zaklíněném plícnicovém katétru (obr. 1).
1. Schéma měření – ukázka měření (výstup z programu ScopeWin) Jednotlivé křivky tlaků (shora dolů: ezofageální tlak, tlak v a. pulmonalis a CVP) byly časově synchronizovány. V době inspiračního plateau a na konci exspiria byly proloženy přímky, a to v nejnižších bodech příslušných tlaků. Rozdíl inspiračních a exspiračních úrovní tlaků představoval změny ezofageálního tlaku (P<sub>ES</sub>), změny centrálního žilního tlaku (P<sub>CVP</sub>), tlaku v a. pulmonalis (P<sub>PAP</sub>) a změny tlaku v zaklínění (P<sub>PAOP</sub>). 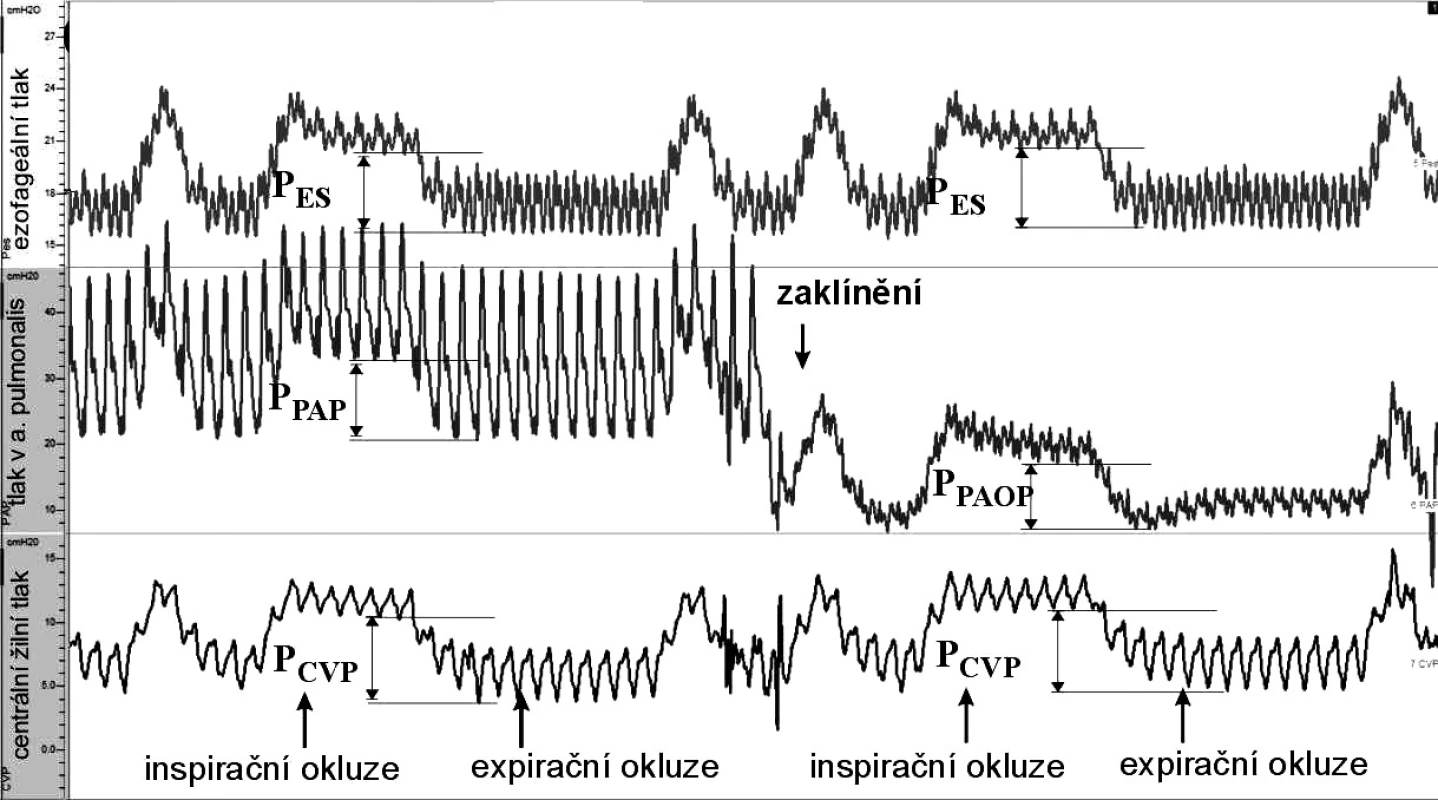
Zpracování
Křivky tlaků získaných z respiračního monitoru a hemodynamického monitoru byly pomocí analytického softwaru sloučeny, synchronizovány v čase a převedeny na stejné jednotky – cm H2O (1 mm Hg = 1,36 cm H2O).
Na křivkách byl vyhodnocen rozdíl tlaků mezi tlakem měřeným během inspirační okluze a tlakem měřeným během exspiria. Tlaky byly měřeny proložením přímky v nejnižších bodech příslušné tlakové přímky a změřením rozdílu úrovní inspirační a exspirační křivky (viz obr. 1). K analýze byly použity respirační rozdíly tlaků ezofageálních (PES), centrálního žilního tlaku (PCVP), tlaků v a. pulmonalis (PPAP) a tlaků v a. pulmonalis po zaklínění (PPAOP). (Poznámka: správnější by bylo pro změny tlaků uvádět dPES, dPCVP apod., pro jednoduchost v textu označujeme změny tlaků jen jako PES a PCVP atd. Naopak chyby měření jsou vyjádřeny jako dPES, dPCVP apod. – viz níže).
Změna transalveolárního tlaku, byla vypočítána jako PtES = Pair–PES, kde Pair je rozdíl inspiračního tlaku a exspiračního tlaku v dýchacích cestách na konci exspirační pauzy (total PEEP). Změna transalveolární tlaku měřená pomocí centrálního žilního tlaku, tlaku v a. pulmonalis a tlaku v zaklínění byla vypočítána jako PtCVP= Pair – PCVP, PtPAP= Pair – PPAP a PtPAOP= Pair – PPAOP.
Index podle Teboula byl vypočten jako PPAOP/PPAP [9]. Tento index hodnotí správné uložení konce plícnicového katétru vzhledem k Westovým zónám, ideální hodnota je blízká jedné.
Elastance respiračního systému (Etot) byla vypočítána jako Etot= Pair/TV, elastance hrudní stěny Ew= PES/TV, elastance plic jako El= Etot-Ew, hodnoty jsou vyjádřeny v cm H2O/l (TV = dechový objem).
Statistika
Chyby měření změn transalveolárního tlaku pomocí centrálního žilního tlaku (dPtCVP), tlaku v a. pulmonalis (dPtPAP) a tlaku v zaklínění (dPtPAOP) byly definovány jako rozdíl mezi změnou transalveolárního tlaku měřenou originální metodou (PtES) a příslušným vaskulárním tlakem tedy: dPtCVP= PtES – PtCVP, dPtPAP= PtES – PtPAP, dPtPAOP = PtES – PtPAOP. Bias je definován jako průměrná chyba měření a limit shody jako 1,96násobek standardní odchylky měření. V grafické prezentaci chyb byla použita modifikace klasické prezentace podle Bland-Altmana: jako bias sloužila regresní křivka závislosti rozdílu hodnot měření na průměru hodnot. Přímky limitů shody představují 1,96násobek standardní chyby rozdílu měření, vypočteny metodou lineární regrese odchylek od průměrné regresní křivky [10, 11].
Relativní chyba měření určovala, o kolik procent bylo měření novou metodou odlišné od měření standardního, byla vypočítána jako rozdíl mezi příslušným vaskulárním tlakem a ezofageálním tlakem dělený hodnotou ezofageálního tlaku, např. pro PtPAOP je relativní chyba (PtPAOP – PtES)/PtES (= PtPAOP/PtES – 1) v procentech.
Absolutní hodnota chyby menší než 2 cm a absolutní hodnota relativní chyby menší než 20 % byla považována za klinicky nevýznamnou.
Závislost chyby měření na jiných proměnných byly testovány pomocí lineární korelace mezi průměry chyb měření u jednotlivých pacientů a průměry hodnot zkoumaných proměnných u těchto pacientů; byl vypočítán Pearsonův korelační koeficient r a statistická významnost korelace.
Za statisticky významnou byla považována hladina významnosti menší než 0,05. K redukci statistické chyby typu I při mnohočetných analýzách byl použit průměrný false discovery rate, FDR, na základě metody Benjamina a Hochberga [12].
Hodnoty byly vyjádřeny – pokud nebylo specifikováno jinak – jako průměr a SD.
Výsledky
Do studie bylo zařazeno 23 pacientů, 18 mužů a 5 žen, věk 63 (14) let, příjmové APACHE II skóre v den přijetí 28 [6], mortalita zkoumaného souboru byla 57%.
Základní parametry souboru – tabulka 1.
1. Hemodynamická a ventilační data souboru (n = 23) 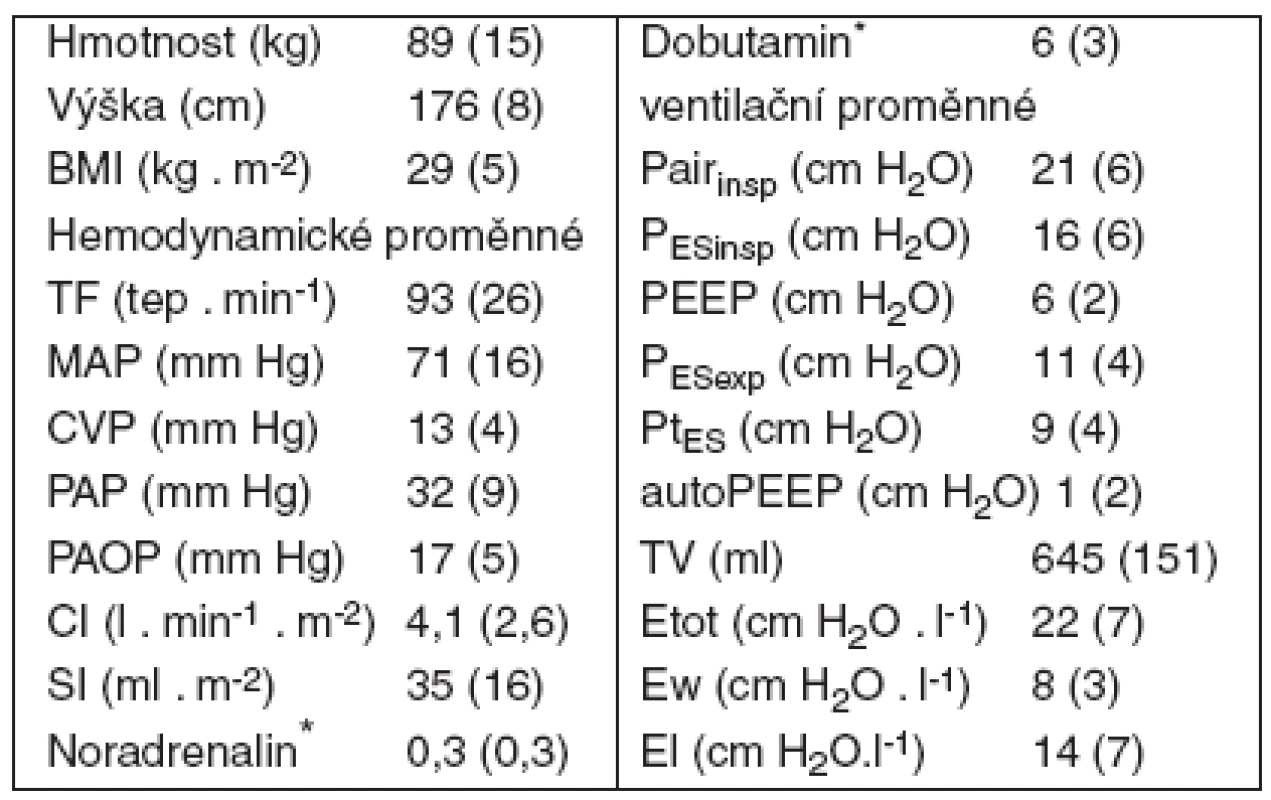
Vysvětlivky: Hodnoty vyjádřeny jako průměry a SD všech měření. MAP – střední arteriální, CVP – centrální žilní tlak, PAP – plícnicový tlak, PAOP – tlak v zaklínění, CI – kardiální index, SI – tepový index; Pairinsp, PEEP, PESinsp, PESexp jsou inspirační plateau a expirační tlaky v dýchacích cestách a ezofagu. TV – dechový objem; Etot, Ew, El elastance respiračního systému, hrudní stěny a plic. *Noradrenalin mělo 21 pacientů, dobutamin 9, dávky μg . kg-1 . min-1 Celkem tak bylo analyzováno 356 párů měření PtES a PtCVP (průměrně 16 na pacienta), 178 párů měření PtESa PtPAP (8 na pacienta), 227 párů PtESa PtPAOP(10 na pacienta). U 14 pacientů bylo během jedné sady provedeno měření PtCVP a příslušného PES dvakrát a měření PPAOP a PPAP jedenkrát (viz obr. 1). U prvních 9 pacientů bylo v jedné sadě provedeno měření pro všechny proměnné jedenkrát, u 4 pacientů z nich chybělo vyhodnocení PPAP.
1. Změny transalveolárního tlaku měřené standardně a pomocí vaskulárních tlaků Měření transalveolárního tlaku standardní metodou pomocí ezofageálního katétru Pt<sub>ES</sub> proti měření pomoci centrálního žilního tlaku, tlaku v a. pulmonalis a tlaku v zaklínění, Pt<sub>CVP</sub>, PtPAP a Pt<sub>PAOP</sub>. V případě, že by měření byla shodná, jednotlivé body by ležely na linii identity. 
Skutečná změna transalveolárního tlaku (PtES) korelovala s PtCVP, PtPAP a PtPAOP (p < 0,001), korelační koeficienty r byly 0,94, 0,88 a 0,82.
Průměrná chyba (bias) a limit shody při měření změn transalveolárního tlaku pomocí centrálního žilního tlaku dPtCVP byl -1,3 (-4,1–1,5) cm H2O, při měření s použitím tlaku v a. pulmonalis dPtPAP 1,6 (-2,3–5,4) cm H2O a při využití tlaku v zaklínění dPtPAOP0,9 (-3,6–5,5) cm H2O je uvedena a srovnána s měřením ezofageálního tlaku v tabulce 2. Průměrné chyby měly tendenci růst při vyšších hodnotách transalveolárního tlaku u měření pomocí plícnicových tlaků (tab. 2) – regresní rovnice pro dPtPAP a dPtPAOP a graf 2 a 3, interval limitu shody byl širší při vyšších hodnotách transalvelárního při měření pomocí CVP (graf 4).
2. Analýza chyb měření 
Rozdíly mezi měřením změn transalveolárního tlaku pomocí centrálního žilního tlaku (dPtCVP), tlaku v a.pulmonalis (dPtPAP), tlaku v zaklínění (dPtPAOP) a měřením pomocí ezofageálního tlaku. dPCVP, dPPAP a dPPAOP jsou rozdíly mezi měřením ezofageálního tlaku pomocí centrálního žilního tlaku , tlaku v a.pulmonalis a tlaku v zaklínění a měřením pomocí ezofageálního tlaku. Index 0,7-1 představuje podskupinu měření, při níž byl index dle Teboula (PPAP/PPAOP viz metodika a diskuse) větší než 0,7 a menší než 1. Index > 0,7-1 jsou měření, která tuto podmínku nesplňují. Bias byl vypočten jako průměr rozdílu (chyb), limit shody uveden v závorce, vypočten jako bias-1,96 . SD a bias + 1,96 . SD. Regresní rovnice se vztahují k analýze podle Bland-Altmana, r je Pearsonův korelační koeficient, p je statistická významnost korelace. 2. Chyba měření transalveolárního tlaku pomocí CVP Graf podle Bland-Altmana, na ose x je průměrná hodnota měření originální a zkoumané metody zastupující pravou hodnotu měření a na ose y rozdíl hodnot představující chybu měření. Přímky průměrné chyby (bias) a limitů shody byly získány regresní metodou, limit shody je v rozsahu ± 1,96násobku standardní odchylky chyb. Bias měření pomocí centrálního žilního tlaku tlaku (dPt<sub>CVP</sub>) – přerušovaná přímka – se neměnil, limit shody (nepřerušovaná přímka) se rozšiřuje s nárůstem měřené hodnoty (r = 0,3, p < 0,001, r je Pearsonův korelační koeficient, p je statistická významnost korelace). 
3. Chyba měření transalveolárního tlaku pomocí PAP Graf podle Bland-Altmana pro Pt<sub>PAOP</sub>, vysvětlení viz graf 2. Bias měření pomocí tlaku v zaklínění (dPt<sub>PAP</sub>) – přerušovaná přímka – rostl s nárůstem měřené hodnoty (r = 0,26, p < 0,001), limit shody (nepřerušovaná přímka) se významně nerozšiřoval. 
4. Chyba měření transalveolárního tlaku pomocí PAOP Graf podle Bland-Altmana Pt<sub>PAOP</sub>, vysvětlení viz graf 2. Bias měření pomocí tlaku v zaklínění (dPt<sub>PAOP</sub>) – přerušovaná přímka – rostl s nárůstem měřené hodnoty (r = 0,20, p = 0,002), limit shody (nepřerušovaná přímka) se výzmaně nerozšiřoval. 
Klinicky nevýznamná chyba (max. ± 2 cm H2O, viz metodika) byla u 72 % měření transalveolárního tlaku pomocí PtCVP a u 64 % měření transalveolárního tlaku pomocí PtPAP a PtPAOP. Měření PtCVP vykazovalo v 62 % nevýznamnou relativní chybu (max. + -20%, viz metodika), v případě PtPAP a PtPAOP v 61 % a 60 % měření.
Elastance hrudní stěny (měřená při objemu 480 až 600 ml) a změna ezofageálního tlaku u jednotlivých pacientů korelovaly s dPtCVP (r = -0,55 a -0,5, p = 0,006 a 0,01), pacienti s vyšším Ew a PES měli tendenci vykazovat zápornější (v absolutním vyjádření větší) chybu měření.
Přesnost měření s použitím PAOP závisela na indexu podle Teboula, s nárůstem indexu rostla chyba měření (r = 0,7, p < 0,001). Nejlepších výsledků bylo dosaženo při indexu v rozsahu 0,7–1, kdy bias a limit shody pro dPtPAOP byly 0,3 (-3–4,2) H2O. Během těchto měření byla v 76 % chyba klinicky nevýznamná a 79 % měření PtPAOP mělo nevýznamnou relativní chybu (graf 5). Měření, která nesplňovala tuto podmínku indexu, měla statisticky významně odlišný bias a limit shody 1,2 (-4–5,9) H2O (p = 0,01; Student T test) a absolutní chyba menší než 2 cm byla u 58 % případů a relativních chyba měření < 20 % u 52 % měření, rozdíly jsou opět významné (p = 0,008 a p < 0,001; chi-kvadrát test).
5. Rozložení relativní chyby ((Pt<sub>PAOP</sub> – Pt<sub>ES</sub>)/Pt<sub>ES</sub>) měření transalveolárního tlaku pomocí tlaku v zaklínění Graf zahrnuje jen měření, kdy index podle Teboula byl 0,7–1. Zvýrazněny tmavě jsou počty relativních chyb, které nejsou klinicky významné. 
Chyby měření nekorelovaly s body mass indexem, inspiračními a exspiračními tlaky v dýchacích cestách a s ezofageálním tlakem, hodnotou autoPEEP, s dechovým objemem, hodnotou PAOP a CVP měřeného na konci exspiria, hodnotou středního arteriálního tlaku a tlaku v a. pulmonalis, s kardiálním výdejem, s dávkou katecholaminů s Etot a El.
Diskuse
Změna transalveolárního tlaku během respiračního cyklu měřená pomocí vaskulárních tlaků vykazovala průměrnou malou odchylku a korelovala se změnou transalveolárního tlaku měřeného pomocí ezofageálního katétru, široký limit shody měření však zpochybňuje použitelnost měření Pt pomocí přenosů tlaků do cév. V průměru PtCVP nadhodnocoval a naopak PtPAP a PtPAOP podhodnocovaly skutečnou změnu transalveolárního tlaku. Klinicky nevýznamné chyby u většiny měření a nejmenší průměrné chyby bylo dosaženo při měření změn transalveolárního tlaku pomocí tlaků v zaklínění za podmínky idelního umístění plícnicového katétru hodnoceného indexem podle Teboula.
I když změny transalveolárního tlaku během respiračního cyklu úzce korelují se změnami tlaků CVP, PAP a PAOP, nepotvrdili jsme spolehlivě, že velikosti změn jsou identické.
Vysvětlení špatné klinické shody může být výsledkem spolupůsobení několika faktorů.
Samotné měření pleurálního tlaku pomocí ezofageálního balonku je zatíženo chybou. Tíha mediastinálních struktur falešně zvyšuje v poloze na zádech ezofageální tlak [13]. Ezofageální tlak na konci exspiria je často vyšší než tlak v dýchacích cestách; to bylo důvodem, proč jsme použili změnu transalveolárního tlaku a ne absolutní hodnoty transalveolárního tlaku. Navíc při inflaci plic dochází k nadzdvižení srdce a zmírnění tlaku na jícen, změna ezofageálního tlaku během inspiria tak v poloze na zádech může nadhodnocovat změnu pleurálního tlaku [14]. Důležitější je, že ezofageální tlak nemusí přesně odrážet tlak v okolí srdce. Obecně je ezofageální tlak nižší o 10 % nebo o 1,4–4 cm H2O než tlak epikardiální a perikardiální [7], z toho plyne, že transalveolární tlak vypočtený pomocí ezofageálního tlaku je větší než tlak vypočtený pomocí tlaku epikardiálního či perikardiálního (Pt = Pair – PES). To by mohlo vysvětlovat, proč transalveolární tlak, vypočtený pomocí ezofageálního tlaku v našem souboru, byl větší než vypočtený pomocí respiračních změn v PAP a PAOP.
Respirační změny CVP a PAOP nemusí být způsobené jen přenosem změn okolního (intratorakálního) tlaku. Do změn centrálního žilního tlaku se při zvýšeném intratorakálním tlaku promítá jak pokles systémového venózního návratu, tak i vytlačení krve z intraabdominálního kompartmentu při vzestupu intraabdominálního tlaku způsobeného poklesem bránice, což může být významné u hypervolémie [6]. Také tlak v zaklínění odráží cyklické změny preloadu během umělé plícní ventilace. Při inflaci plic je vytlačena krev z plicních kapilár umístěných v zóně III, což v závislosti na náplni plicních žil ovlivňuje plnění levé síně srdce [15]. Změny v plnění pravé a levé síně během respiračního cyklu mohou být různé při hypovolémii a hypervolémii, v našem souboru jsme takovou závislost nezaznamenali, chyby měření nezávisely na hodnotách CVP a PAOP.
Za důležité zjištění považujeme závislost mezi indexem podle Teboula a chybou měření. Teboul [9] našel jednoduchý index jak ověřit, že konec plícnicového katétru je umístěn v III zóně plic podle Westa. Je založen na předpokladu, že okolní tlak pro plicní arterie a žíly je stejný jako pleurální tlak. Vzestup pleurálního tlaku v inspiriu se stejně projeví v plicním arteriálním tlaku (PPAP), plicním venózním tlaku, v levé síni srdce, a tím i v tlaku zaklínění (PPAOP). V zóně III podle Westa tak bude PPAP< PPAOP a index PPAOP/PPAP < 1. V situaci, kdy je naopak konec PAC umístěn v zóně I, pak změna tlaku v a. pulmonalis v zaklínění během inspiria bude odrážet změnu alveolárního tlaku, ten je větší než pleurální, bude proto PPAOPvětší než PPAP a index PPAOP/PPAP > 1. Teboul potvrdil, že index PPAOP/PPAP je schopen odlišit, zda tlak v zaklínění odráží tlak v levé síni nebo alveolární tlak. V práci je pro správné umístění konce plícnicového katétru navrhována hodnota indexu „kolem“ 1, jako horní hranice je navrhován index 1,35. Výsledky naší práce nepřímo potvrzují přepoklady Teboula, při nižších hodnotách indexu změna tlaku v zaklínění přesněji odpovídala změně pleurálního tlaku a jí odpovídající změně tlaku transalveolárního. Za předpokladu, že byl index 0,7–1, byla měření v 80 % klinicky přijatelná a průměrný bias nízký.
Inverzní závislost chyby měření dPtCVP na změně ezofageálního tlaku (PES) a na elastanci hrudní stěny (Ew) odráží skutečnost, že chyba měření ezofageálního tlaku pomocí CVP (dPCVP) rostla s velikostí ezofageálního tlaku (viz regresní rovnice pro dPCVP, tab. 2 a graf 3). U pacientů s vyšším PES byla chyba měření pomocí CVP větší, z čehož lze pro vypočtený translalveolární tlak odvodit námi měřenou závislost, že chyba měření PtCVP klesala (byla negativnější) s větší PES (PES> PCVP → (Pair – PES) < (Pair – PCVP) → PtES – PtCVP < 0, dPtCVP = PtES – PtCVP → dPtCVP < 0). Obdobně je možno vysvětlit negativní závislost dPtCVP na Ew – pacienti s vyšší Ew měli větší PES a opět negativnější dPtCVP.
Určitým překvapením bylo, že změna transalveolárního tlaku měřená pomocí centrálního žilního tlaku, nevykazovala větší chybu. Předpoklad byl, že CVP nebude spolehlivé pro odhad pleurálních tlaků [16], neboť venózní rezervoár pro pravé srdce je mimo hrudník, naopak rezervoárem pro levé srdce jsou plicní žíly, které jsou umístěny v hrudníku. Na druhé straně existují autoři, kteří považují odhad pleurálního tlaku z křivky CVP za přesnější než měření pleurálního tlaku pomocí ezofageálního katétru [17].
Srovnání změn ezofageálního tlaku a změn CVP a tlaku v zaklínění nedávno publikoval Bellemare [16]. Při umělé plicní ventilaci pozitivním přetlakem naměřil obdobný bias dPPAOP -0,5 H2O (v naší studii -0,9 cm H2O ), limit shody byl užší (-3,8–2,8) H2O než námi měřený, což je pravděpodobně dáno malým počtem měření (10 měření). Navíc testoval změnu ezofageálního tlaku a změnu CVP a PAOP při usilovném nádechu (20 měření), negativita výchylky byla v ezofageálním tlaku větší než v CVP a PAOP v průměru o 2,2 a 2,8 cm H2O, limit shody širší než v naší práci (-3,9–8,9) a (-4,6–10,3) cm H2O. Je možné, že při usilovném nádechu hrají větší roli cyklické změny preloadu než při umělé plicní ventilaci.
Rozšíření měření transalveolárního tlaku by potenciálně v klinické praxi pomohlo např. identifikovat nemocné s nízkou poddajností hrudní stěny, u kterých bychom mohli použít ventilaci s vyššími tlaky v dýchacích cestách, než je doposud doporučeno. Zřejmě by se transalveolární tlak stal v případě dostupnosti jeho měření důležitým parametrem při individuálním nastavení bezpečné umělé plícní ventilace.
Závěr
Změnu transalveolárního tlaku během respiračního cyklu lze přijatelně odhadnout z křivky tlaku v zaklínění a. pulmonalis za podmínky ideálního umístění plícnicového katétru v zóně III podle Westa. Měření změn transalveolárního tlaku pomocí změn tlaku v centrálním žilním tlaku a v a. pulmonalis bez kontroly umístění katétru jsou v průměru shodná s měřením pomocí ezofagálního tlaku, ale velký rozptyl chyby měření neumožňuje jejich klinické využití u individuálního pacienta.
Studie byla provedena s podporou grantu IGA MZ ČR NR/8870-3.
Došlo dne 15. 1. 2009.
Přijato dne 12. 5. 2009.
Adresa pro korespondenci:
MUDr. Václav Zvoníček
ARK, Fakultní nemocnice u sv. Anny
Pekařská 53
656 91 Brno
e-mail: zvonicek@fnusa.cz
Sources
1. Terragni, P. P., Rosboch, G., Tealdi, A., Corno, E., Menaldo, E., Davini, O., Gandini, G., Herrmann, P., Mascia, L., Quintel, M., Slutsky, A. S., Gattinoni, L., Ranieri, V. M. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med., 2007, 175, 2, p. 160–166.
2. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N. Engl. J. Med., 2000, 342, 18, p. 1301–1308.
3. Gattinoni, L., Carlesso, E., Cadringher, P., Valenza, F., Vagginelli, F., Chiumello, D. Physical and biological triggers of ventilator-induced lung injury and its prevention. Eur. Respir. J. Suppl., 2004, 47, p. 15s–25s.
4. Chiumello, D., Carlesso, E., Cadringher, P., Caironi, P., Valenza, F., Polli, F., Tallarini, F., Cozzi, P., Cressoni, M., Colombo, A., Marini, J. J., Gattinoni, L. Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med., 2008, 178, 4, p. 346–355.
5. Zin, W.A., Milic-Emili, J. Esophageal pressure measurement In: Tobin, M. J. Principles and Practice of Intensive Care Monitoring, McGraw-Hill: 1997, pp 545–552 . ISBN 0070650942.
6. Pinsky, M. R. Hemodynamic Effects ov Ventilation and Ventilatory Maneuvers. In: Scharf, S. M., Pinsky, M. R., Magder, S. Respiratory-Circulatory Interactions in Health and Disease. Marcel Dekker, Inc.: New York 2001. Chapter 8, pp. 183–218. ISBN 0824704746.
7. Kallet, R. H., Katz, J. A., Pittet, J. F., Ghermey, J., Siobal, M., Alonso, J. A., Marks, J. D. Measuring intra-esophageal pressure to assess transmural pulmonary arterial occlusion pressure in patients with acute lung injury: a case series and review. Respir. Care, 2001, 45, 9, p. 1072–1084.
8. Baydur, A., Behrakis, P. K., Zin, W. A. et al. A simple method for assessing the validity of the esophageal balloon technique. Am. Rev. Respir. Dis., 1982, 126, p. 788–791.
9. Teboul, J. L., Besbes, M., Andrivet, P., Axler, O., Douguet, D., Zelter, M., Lemaire, F., Brun-Buisson, C. A bedside index assessing the reliability of pulmonary artery occlusion pressure measurements during mechanical ventilation with positive end-expiratory pressure. Journal of Critical Care, 1992, 7, 1, p. 22–29.
10. Bland, J. M., Altman, D. G. Measuring agreement in method comparison studies. Stat. Methods Med. Res., 1999, 8, 2, p. 135–160.
11. Bland, J. M. The Half-Normal distribution method for measurement error: two case studies. 2005. Dostupné na www: www-users.york.ac.uk/~mb55/talks/halfnor.pdf
12. Benjamini, Y., Hochberg, Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J. Roy. Statist. Soc., 1995, 57, 1, p. 289.
13. Washko, G. R., O’Donnell, C. R., Loring, S. H. Volume-related and volume-independent effects of posture on esophageal and transpulmonary pressures in healthy subjects. J. Appl. Physiol., 2006, 100, 3, p. 753–758.
14. Marini, J. J., O’Quin, R., Culver, B. H., Butler, J. Estimation of transmural cardiac pressures during ventilation with PEEP. J. Appl. Physiol., 1982, 53, 2, p. 384–391.
15. Brower, R., Wise, R. A., Hassapoyannes, C., Bromberger-Barnea, B., Permutt, S. Effect of lung inflation on lung blood volume and pulmonary venous flow. J. Appl. Physiol., 1985, 58, 3, p.954–963.
16. Bellemare, P., Goldberg, P., Magder, S. A. Variations in pulmonary artery occlusion pressure to estimate changes in pleural pressure. Intensive Care Med., 2007, 33, 11, p. 2004–2008.
17. Walling, P. T., Savege, T. M. A comparison of oesophageal and central venous pressures in the measurement of transpulmonary pressure change. Br. J. Anaesth., 1976, 48, 5, p. 475–479.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 4-
All articles in this issue
- iNO in acute respiratory failure of the newborns. A comparison of its combination with CMV and HFOV
- Early identification of critically ill patients with the MEDICAL EMERGENCY SYSTEM in St. Ann University Hospital, Brno
- Measurement of trans-alveolar pressure with a pulmonary artery catheter
- A patient with severe and protracted hypoglycaemia
- The utilization of fiberoptic bronchoscopy in intensive care
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The utilization of fiberoptic bronchoscopy in intensive care
- A patient with severe and protracted hypoglycaemia
- Early identification of critically ill patients with the MEDICAL EMERGENCY SYSTEM in St. Ann University Hospital, Brno
- Measurement of trans-alveolar pressure with a pulmonary artery catheter
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

