-
Medical journals
- Career
Delirium v pooperačním období a v intenzivní medicíně
: Hála Martin 1; Ševčík Pavel 2
: Centrum kardiovaskulární a transplantační chirurgie, Brno 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno 2
: Anest. intenziv. Med., 20, 2009, č. 3, s. 158-164
: Intesive Care Medicine - Review Article
Článek se zabývá problematikou deliria v intenzivní péči, definuje jeho typy a ukazuje možnosti jeho diferenciální diagnostiky. Popisuje možnosti nefarmakologických i farmakologických preventivních a léčebných postupů k jeho ovlivnění.
Klíčová slova:
delirium – intenzivní péče – diagnostika – léčbaÚvod
Delirium je definováno jako kvalitativní porucha vědomí se sníženou schopností soustředit a udržet pozornost, poruchou kognitivních funkcí (orientace, paměť, zpracování informací, vyjadřování) a poruchou vnímání (vznik iluzí a halucinací). Změněny jsou i úroveň psychomotorické aktivity, emoce a spánkový cyklus. Typický je rychlý vznik příznaků (během hodin) a jejich proměnlivost v čase [1].
Dezorientace je obvykle časem a místem, pacient často nerozpoznává jiné osoby, ale dezorientace vlastní osobou je vzácná. Postižení paměti je evidentní u krátkodobé paměti. Mezi vyjadřovací potíže patří dysartrie, dysnomie a dysgrafie. Porucha vnímání se může manifestovat jako porucha interpretace skutečnosti, iluze nebo halucinace. Tyto halucinace jsou nejčastěji zrakové, mohou však být i sluchové, taktilní a jiné [2].
Udává se, že 10–40 % pacientů (ve zřejmé závislosti na věku) prodělá během hospitalizace delirium [2]. Typicky vzniká delirium po operaci, a to tím častěji, čím je chirurgické trauma rozsáhlejší. Nemocní stižení deliriem mají vyšší mortalitu, a to nejen během hospitalizace, ale i v době po propuštění. Uvádí se, že prodělané delirium zvyšuje pravděpodobnost dlouhodobého kognitivního deficitu až desetinásobně. Delirium je také sdruženo se signifikantně vyšší morbiditou (respirační insuficience, pneumonie, dekubity, poruchy hojení), což má za následek delší pobyt v nemocnici, vyšší riziko ztráty soběstačnosti a překladu do zařízení následné péče. Přiměřeně tomu stoupají i ošetřovatelské náklady [3, 4].
Podle charakteru symptomů se rozlišují tři typy deliria: hyperaktivní, hypoaktivní a smíšený typ. U hyperaktivního deliria nacházíme typicky neklid, podrážděnost, nesoustředěnost, nespolupráci, halucinace, hlasitou a rychlou řeč, zrychlenou motoriku. Hypoaktivní delirium je charakterizováno spavostí, netečností, nepozorností, zpomalenou motorikou, omezením komunikace s okolím. Míra porušení kognitivních funkcí je u obou typů srovnatelná. Asi v polovině případů se vyskytuje smíšený typ, který v různé míře zahrnuje příznaky obou typů předchozích [5].
Diagnostika deliria
Posouzení, zda je u pacienta delirium přítomno, vychází ze dvou stupňů klinického vyšetření: posouzení míry sedace či agitovanosti pacienta a posouzení eventuální kvalitativní poruchy vědomí [6]. První krok slouží k popisu, do jaké míry a jakou formou je možné s pacientem navázat kontakt, druhý krok pak diagnostikuje nebo vyloučí delirium. K posouzení míry sedace může sloužit skórovací systém RASS (The Richmond Agitation and Sedation Scale, tab. 1).
Pacienti se skóre -4 a -5 se dále diagnosticky nevyšetřují, opakované posouzení se provede s časovým odstupem. U pacientů s dosaženým skóre -3 až +4 se pokračuje druhým krokem (Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Algoritmus pro posouzení deliria vychází z jeho definice a obsahuje čtyři položky. Pro splnění kritérií musí být splněny položky 1 a 2 + jedna z položek 3 nebo 4 (tab. 2).
2. Diagnostika deliria (CAM-ICU) 
Diferenciální diagnostika deliria [2]
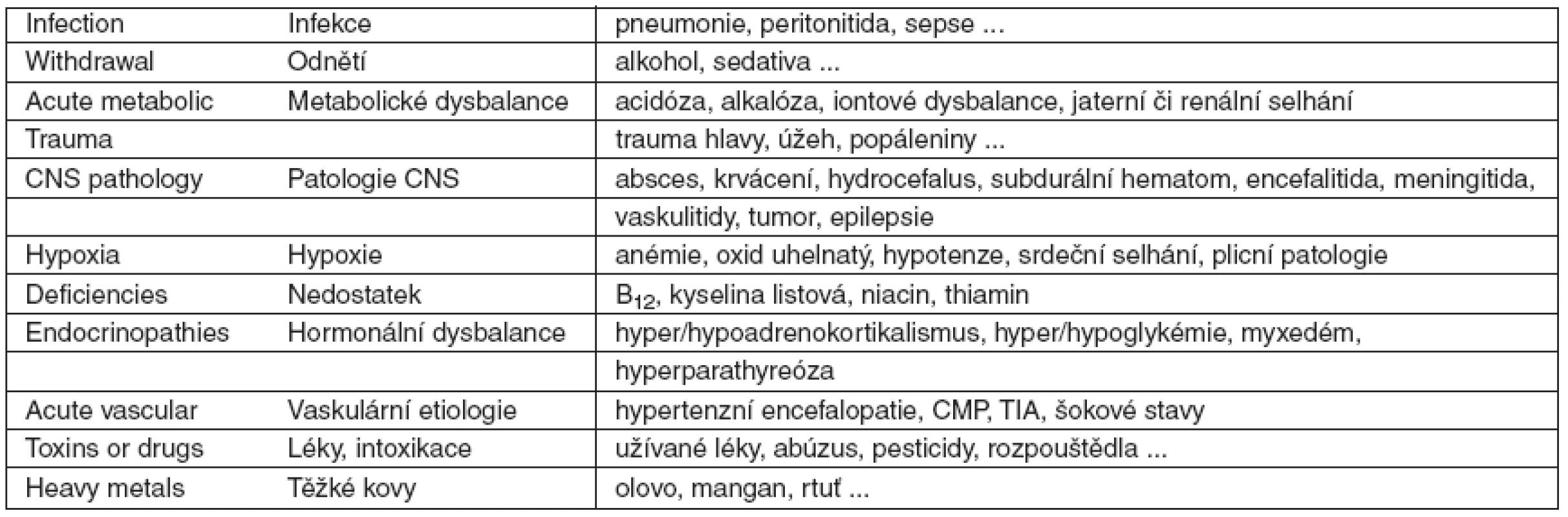
Možné příčiny deliria uvádí tabulka 3 („I WATCH DEATH“).
Odlišnosti mezi příznaky deliria a demence uvádí tabulka 4.
4. Diferenciální diagnostika deliria a demence 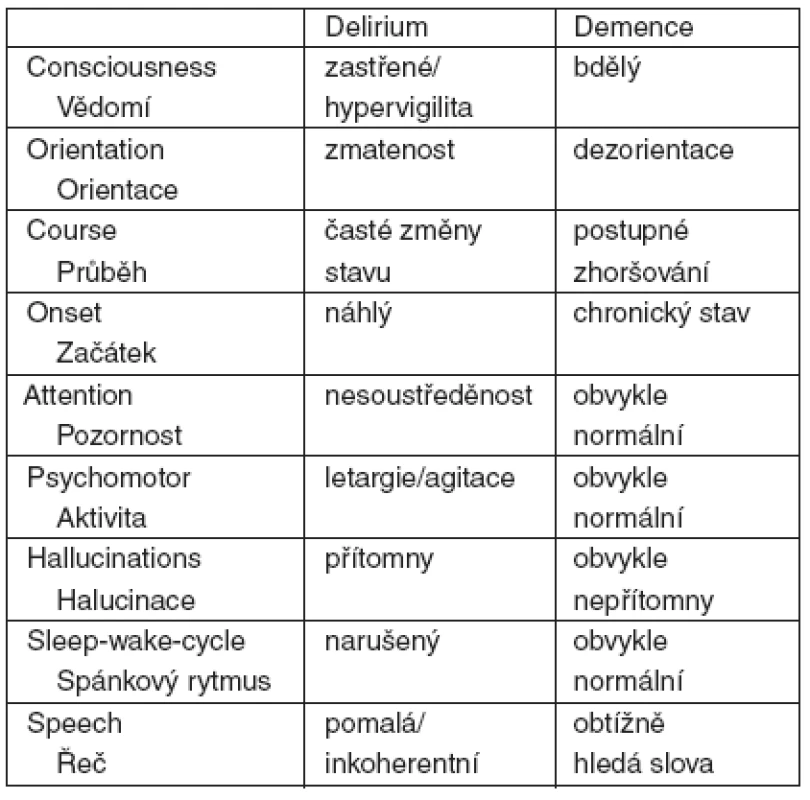
Skórování závažnosti deliria
Pro výzkumné účely může být užitečné kvantifikovat závažnost symptomů deliria [7]. Umožní to sledovat vývoj pacienta v čase, hodnotit vliv terapeutických intervencí a srovnávat různé skupiny pacientů navzájem. „The Intensive Care Delirium Screening Checklist“ (ICDSC) opět vychází z diagnostických kritérií DSM-IV [1]. Jedná se o jednoduchý 8položkový screeningový test: u každé položky se zapíše jeden bod (je-li symptom přítomen) nebo 0 bodů (je-li nepřítomen). Sledované symptomy jsou uvedeny v tabulce 5.
Dosažené skóre 4 a vyšší je diagnostické pro delirium. Zásadní rozdíl proti výše uvedeným algoritmům je v tom, že se vychází z retrospektivně získaných informací od ošetřujícího personálu za posledních 24 hodin. Oba diagnostické nástroje (RASS, ICDSC) umožňují i lékaři bez psychiatrické erudice či jinému zdravotníkovi, poměrně rychle delirium diagnostikovat.
Nefarmakologická opatření k prevenci deliria
Jejich stručný přehled je uveden v tabulce 6 [2].
6. Nefarmakologická opatření k prevenci deliria 
Farmakologická léčba deliria
První krok ve farmakologickém ovlivnění deliria spočívá ve zhodnocení podávané medikace a případném vysazení léků, které se mohou na jeho symptomatologii podílet [2]. Jedná se zejména o anxiolytika (benzodiazepiny), sedativa (barbituráty), opioidy (meperidin), H2-blokárory (cimetidin), tricyklická antidepresiva (amitriptylin), antihistaminika (prothazin), antiparkinsonika (selegilin), steroidy aj. [8]. Nedostatečná analgezie může zhoršovat průběh deliria, proto je kontrola bolesti po operaci nebo invazivním výkonu důležitou součástí celkové strategie. Zejména míra klidových bolestí má vztah k rozvoji deliria [9]. Způsob, jakým je dostatečné analgezie dosaženo, je méně významný, je však vhodné zvážit nesteroidní antiflogistika [10]. Žádný lék není přímo určen pro léčbu deliria na JIP nebo pro léčbu deliria pooperačního. Americká FDA také doposud neschválila žádný lék pro užití v této indikaci. Psychofarmaka jsou však běžně používána, předepisují se v obecné indikaci zvládnutí psychomotorického neklidu – nejčastěji jsou předepisována neuroleptika, benzodiazepiny a nově také antipsychotika ze skupiny selektivních antagonistů serotoninu a dopaminu (SDA). Jedná se vždy o symptomatickou terapii.
Benzodiazepiny (BDZ) obecně nejsou doporučeny k léčbě deliria, jelikož jsou samy rizikovým faktorem jeho vzniku, navíc se vyznačují centrálně anticholinergním působením, čímž mohou delirantní symptomatologii ještě zhoršovat. Nicméně, u některých případů však mohou být BDZ užitečné – např. u deliria z odnětí (sedativa, alkohol) nebo tam, kde užití preparátů z jiných lékových skupin vede k vážným nežádoucím účinkům [2].
Neuroleptika jsou antagonisté dopaminových receptorů v CNS, blokují dopaminergní neurotransmisi, čímž potlačují pozitivní psychotické příznaky (bludy, halucinace, agitovanost, agresivitu). Nesou s sebou množství vedlejších účinků: sedaci, hypotenzi, poruchy soustředění, anticholinergní účinky, extrapyramidové účinky, vznik srdečních dysrytmií (prodloužení intervalu QT, torsades de pointes), trombotické komplikace a maligní neuroleptický syndrom. Neuroleptika se podle klinického účinku a receptorové selektivity dělí na sedativní, incisivní a atypická.
Sedativní neuroleptika ovlivňují dopaminové, adrenergní, acetylcholinové a histaminové receptory. Mají výrazný tlumivý účinek a ovlivňují kardiovaskulární systém (hypotenze, tachykardie, ortostatické kolapsy). Jejich představiteli jsou např. chlorpromazin (Plegomazin), levomepromazin (Tisercin).
Incisivní neuroleptika mají selektivnější účinek na dopaminových receptorech. Mají méně vyjádřený sedativní účinek. Patří mezi ně např. haloperidol (Haloperidol), melperon (Buronil).
Atypická neuroleptika jsou heterogenní skupinou léčiv, jejich společnou vlastností je minimální vliv na extrapyramidový motorický systém. Nejčastěji používaným lékem této skupiny je tiaprid (Tiapridal).
Serotonin-dopaminová antipsychotika (SDA) jsou moderní skupinou léčiv, která působí antagonisticky na dopaminové receptory selektivně v limbickém systému, čímž potlačují psychotické příznaky, zatímco k ostatním dopaminovým receptorům mají afinitu nízkou, a proto je ovlivnění extrapyramidového systému malé. V CNS působí též antagonisticky na serotoninových a alfa-1 receptorech. Používanými přípravky jsou risperidon (Risperdal), olanzapin (Zyprexa), quetiapin (Seroquel) a perospiron.
Práce kanadských autorů z ledna 2007 [11], ve které analyzovali 180 článků zabývajících se problematikou léčby deliria (pacienti interní, chirurgičtí, v intenzivní péči), zjistila některé pozoruhodné skutečnosti. Především to byl fakt, že jen málo prací se vyznačovalo dostatečnou kvalitou. Přestože vstupní kritéria nebyla nijak striktní (prospektivní studie, použití standardizovaných metod pro diagnostiku deliria a pro měření jeho závažnosti, vyřazení prací zabývajících se intoxikací nebo odnětím), pouze 14 prací (z let 1995–2005) s celkovým počtem 448 pacientů je splnilo. Devět z nich se zabývalo sledováním jednoho léku, 5 studií bylo srovnávacích (haloperidol-chlorpromazin-lorazepam, haloperidol-olanzapin, haloperidol-mianserin, 2krát haloperidol-risperidon).
Velká většina pacientů ve studiích vykázala zlepšení psychotických příznaků, které byly kvantifikovány podle Delirium Severity Score. Avšak vzhledem k tomu, že žádná ze studií neobsahovala placebo skupinu, výpovědní hodnota udávaných zlepšení je malá, a to z těchto důvodů:
- Při absenci kontrolní skupiny nelze určit, je-li pozorované zlepšení závažnosti deliria výsledkem podávané medikace nebo přirozeným průběhem deliria s tendencí k úpravě při účinné léčbě primárního onemocnění.
- V žádné studii nebyl posuzován současný vliv nefarmakologických opatření, která mají prokazatelný vliv na delirantní symptomatiku.
- Studie zahrnovaly malý počet pacientů (6–79, medián 12).
- Jen málo studií zahrnovalo pacienty s preexistující demencí, která je důležitým predisponujícím faktorem pro vznik deliria a která zhoršuje odpověď na léčbu.
- Většina studií nerozlišovala mezi jednotlivými subtypy deliria, přestože hyperaktivní typ má o něco lepší prognózu a odpověď na léčbu než typ hypoaktivní.
Vážné nežádoucí účinky byly pozorovány v rozmezí 0–6 %, nezávažné vedlejší účinky byly pozorovány častěji u haloperidolu než u olanzapinu nebo risperidonu. Autoři analýzy doporučují tato bezpečnostní opatření:
- Užívat minimální účinné dávky léků; u starých pacientů začít s polovinou doporučené dávky.
- Časté hodnocení stavu pacienta s cílem ukončit léčbu co nejdříve.
- Sledovat změny EKG křivky během léčby ve srovnání se záznamem před léčbou, zejména prodlužování QT intervalu.
Americká psychiatrická asociace doporučuje pro léčbu deliria užívat haloperidol, přestože toto doporučení vychází z nerandomizovaných studií a kazuistik (úroveň důkazu třídy C). Toto doporučené dávkování je poměrně nízké: 1–2 mg haloperidolu p. o. po 2–4 hod., jiná doporučení uvádějí 2–5 mg haloperidolu i. v. po 6 hod nebo 5–10 mg haloperidolu i. v. kontinuálně za hodinu, eventuálně s úvodním 10mg bolusem [2, 11].
Z atypických antipsychotik je uváděn jako alternativa risperidon p. o. 0,5-1-4 mg za den, olanzapin p. o. 2,5–5 mg za den, perospiron p. o. 10 mg za den, quetiapin p. o. 25–200 mg 2krát denně.
Na našem pracovišti používáme v léčbě pooperačního deliria nejčastěji tiaprid v dávce 100–200 mg po 6–8 hod., eventuálně kontinuálně 20–60 mg . hod-1 i. v. Při výrazném motorickém neklidu (zejména v noci) je vhodnější užít levopromazin s výrazným sedativním účinkem v dávce 25–50 mg i. v. frakcionovaně podle potřeby. V terapeuticky rezistentních případech přidáváme propofol v kontinuální infuzi – zde je riziko dechové deprese a oblenění kašlacího reflexu při vyšších dávkách.
K sedaci neklidných pacientů jsou však užívány i další léky – dexmedetomidin, fentanyl, morfin aj. Cholinergní léky (fysostigmin, tacrin) byly ojediněle popsány jako účinné v léčbě deliria vyvolaného anticholinergní medikací (skopolamin, meperidin, ranitidin). U fysostigminu jsou uváděny dávky 0,16–2 mg i. m. nebo i. v., eventuálně 3 mg . hod-1 kontinuálně. Mezi další inhibitory acetylcholinesterázy patří donepezil, galantamin a rivastigmin – jsou účinné v léčbě demence, jejich použití k léčbě deliria však není podpořeno jasnými důkazy.
Delirium a operační výkon
Příznaky pooperačního deliria jsou vnějším vyjádřením určitého vnitřního procesu, který probíhá v organismu a nastává jako následek jiného primárního děje. Tím bývá nejčastěji operační výkon (ale může to být i jiný inzult – závažná infekce, fraktura, trauma, nekróza tkáně aj.). Tyto různé situace mají jeden společný následek: kaskádu dějů, kterou označujeme jako systémovou zánětlivou reakci. Prevence rozvoje perioperačního systémového zánětu může být i prevencí vzniku pooperačního deliria. Podrobný rozbor možností obsahuje práce Laffeyho [12], zde je uveden jen stručný přehled.
Hemodynamická stabilita v průběhu výkonu, dostatečné perfuzní tlaky a srdeční výdej jsou zásadní pro prevenci hypoperfuze splanchniku, narušení její bariérové funkce a translokace bakterií do krevního oběhu.
Z farmak používaných během operace je v tomto ohledu nejzajímavější propofol, který zvyšuje produkci protizánětlivých cytokinů, snižuje produkci prozánětlivých cytokinů, narušuje řadu funkcí neutrofilů a slouží jako zametač kyslíkových radikálů. Podobné působení lze prokázat i u morfinu a ketaminu. Inhalační anestetika snižují produkci prozánětlivých cytokinů a brání ischemicko-reperfuznímu poškození myokardu.
Používání miniinvazivních technik v chirurgických oborech snižuje tkáňové trauma a tím i zánětlivou odpověď organismu. Do této skupiny postupů patří i kardiochirurgické operace bez použití mimotělního oběhu. Používání mimotělního oběhu (MTO) s sebou nese řadu momentů indukujících systémový zánět. Existují však možnosti jeho ovlivnění: potažení vnitřního povrchu hadic okruhů MTO heparinem (zvyšuje jejich biokompatibilitu a snižuje aktivaci komplementu), používání membránových oxygenátorů, užití techniky teplé krevní kardioplegie, pulzatilní tok během MTO (snižuje hladiny cytokinů, endotoxinu, endotelinu a zvyšuje hladinu NO), užití cell-saveru. Názory na optimální teplotu krve během MTO (ve vztahu k rozvoji zánětlivé reakce) se různí. Snížená teplota krve během MTO snižuje zánětlivou odpověď organismu, ale neplatí to přímo úměrně, je možné, že nejvýhodnější teplota leží v rozmezí mezi 32 a 34 °C.
Koncentráty dárcovských erytrocytů obsahují množství zánětlivých mediátorů a jejich podání dále stimuluje prozánětlivou odpověď příjemce. Navíc déle skladované erytrocyty jsou hůře deformabilní a přispívají tím k okluzi mikrocirkulace. Podání většího množství transfuzí je v literatuře opakovaně uváděno jako jeden z rizikových faktorů pro vznik pooperačního deliria [3, 13, 14, 15, 20].
Nesprávné provádění umělé plicní ventilace (nedostatečný „recruitment“, opakované rozepínání a kolaps určitých okrsků plicní tkáně, její nadměrná distenze apod.) vede k tzv. ventilátorem indukovanému plicnímu poškození (VILI). Ačkoli VILI je primárně mechanická, nikoli prozánětlivou záležitost, zvyšuje produkci cytokinů a jejich uvolňování do systémové cirkulace. V situaci bakteriálního osídlení plicního parenchymu může usnadňovat translokaci bakterií přes alveolo-kapilární membránu.
Selektivní střevní dekontaminace patří mezi experimentální postupy. Perorální aplikace nevstřebatelných antibiotik sice u pacientů operovaných v MTO dokáže snížit hladinu endotoxinu, TNF a IL-6, nese s sebou však i rizika (změna bakteriální flóry, vznik rezistence apod.)
Časné obnovení enterální výživy po operaci dokáže zlepšit výživu střeva, stimuluje jeho prokrvení a bariérovou funkci. Zvláště její obohacení tzv. imunonutrienty (arginin, glutamin, omega-3 nenasycené mastné kyseliny) zlepšuje imunitní funkce, zkracuje trvání SIRS a snižuje frekvenci infekčních komplikací.
Hemofiltrace dokáže odstranit z plasmy řadu prozánětlivých cytokinů, čímž se vysvětluje zlepšení některých orgánových funkcí při jejím použití. Studie se však zaměřovaly především na pediatrické pacienty, u dospělých použití hemofiltrace nebylo efektivní.
Deleukotizace krve cirkulující v MTO, transfundované krve nebo krevní kardioplegie může snížit plicní a myokardiální poškození po MTO u rizikových pacientů. U polytransfundovaných nemocných bylo prokázáno, že deleukotizace krve vede k poklesu infekčních komplikací a mortality, hlavně na multiorgánové selhání. Novinkou v tomto směru je inaktivace leukocytů a spuštění procesů vedoucích k jejich apoptóze pomocí specifických protilátek kovalentně vázaných na membránu filtru [16].
Aprotinin je nespecifická serin-proteáza s řadou prokázaných protizánětlivých účinků jak in vitro, tak in vivo; tyto účinky mají i klinicky významné důsledky (redukce poškození myokardu a plic po ischemicko-reperfuzním poškození po MTO, snížení incidence cévní mozkové příhody po koronární revaskularizaci). V současné době však není v ČR žádný lék obsahující aprotinin volně na trhu.
Pentoxifylin je nespecifický inhibitor fosfodiesterázy, který je užíván pro jeho příznivý účinek na reologické vlastnosti krve – zvyšuje deformabilitu krevních elementů. Kromě toho však redukuje hladiny prozánětlivých cytokinů, aktivaci a sekvestraci granulocytů, a snižuje tak endoteliální poškození. Bylo popsáno i zlepšení splanchnické perfuze u kardiochirurgických pacientů. Jeho klinický přínos však nebyl prokázán, stejně jako u zametačů volných radikálů (vitamin C a E, N-acetylcystein, manitol).
Podání kortikoidů v období před MTO redukuje uvolňování endotoxinu, hladiny prozánětlivých cytokinů, aktivaci a sekvestraci granulocytů. Klinicky zjevný přínos však nebyl prokázán a vzhledem k jejich nežádoucím účinkům nejsou rutinně používány.
Podávání inzulinu v perioperačním období a jako součást péče o kriticky nemocné je předmětem intenzivního výzkumu. Vedle řady příznivých metabolických účinků má i účinky nemetabolické, v jejichž centru stojí ovlivnění endogenní produkce NO. Je známo, že inzulin akutně (v řádu minut) zvyšuje aktivitu endoteliální nitric oxid syntázy (eNOS) a při dlouhhodobé stimulaci (> 4 hod) zvyšuje transkripci genu pro eNOS [17]. Dále inzulin snižuje plasmatickou hladinu asymetrického dimetylargininu (ADMA), přirozeného inhibitoru NOS [18]. Následkem je antiadhezivní, protizánětlivé a protektivní působení produkovaného NO a snížení aktivace endotelu. Kromě toho inzulin snižuje aktivaci inducibilní formy NOS (iNOS), která produkuje excesivní množství NO, jež vede k nadměrné vazodilataci, tvorbě volných radikálů, expresi adhezivních molekul, zánětu a tkáňovému poškození. Podávání inzulinu vede též ke snížení hladiny C-reaktivního proteinu jako markeru zánětlivé aktivity [19].
Statiny bývají předepisovány pro svoje hypolipidemické působení; známy jsou však jejich další, nemetabolické účinky: zlepšení endoteliální funkce a stability aterosklerotických lézí, snížení oxidativního stresu a zánětu. V souladu s těmito skutečnostmi jsou výsledky práce, která popisuje snížení incidence pooperačního deliria u kardiochirurgických pacientů užívajících statiny [20].
Závěr
Delirium v pooperačním období a v intenzivní péči je závažná orgánová komplikace s potenciálně devastujícími následky pro pacienty. Přesto je pravidlem, že nebývá – s výjimkou agitovaných pacientů – diagnostikováno včas a často nebývá diagnostikováno vůbec. V povědomí zdravotníků nesprávně přetrvává představa deliria jako synonyma pro jeho hyperaktivní typ. Stejně tak nebývají zavedena systematická ošetřovatelská opatření k prevenci deliria a k podpoře delirantních pacientů.
Přestože naše znalosti o patofyziologii deliria zůstávají neúplné, existuje řada opatření, která můžeme pro naše pacienty udělat. Především však je potřeba na tuto komplikaci myslet a včas ji diagnostikovat a léčit.
Použité zkratky
ADMA – asymetrický dimetylarginin
BDZ – benzodiazepiny
BMI – Body Mass Index
CAM-ICU – Confusion Assessment Method for the Intensive Care Unit
CMP – cévní mozková příhoda
CRP – C-reaktivní protein
DSM – The Diagnostic and Statistical Manual of Mental Disorders
DSS – Delirium Severity Score
eNOS – endoteliální NOS
GCS – Glasgow Coma Score
ICDSC – The Intensive Care Delirium Screening Checklist
IL-6 – interleukin 6
iNOS – inducibilní NOS
NO – oxid dusnatý
NOS – Nitric Oxide Synthase
MTO – mimotělní oběh
POD – pooperační delirium
RASS – The Richmond Agitation and Sedation Scale
SDA – selektivní antagonisté serotoninu a dopaminu
SIRS – Systemic Inflammatory Response Syndrom
TIA – tranzitorní ischemická ataka
TNF – Tumor Necrosis Factor
VILI – Ventilator Induced Lung Injury
Došlo 7. 11. 2008.
Přijato 11. 3. 2009.
Adresa pro korespondenci:
MUDr. Martin Hála
Voříškova 43
623 00 Brno
e-mail: haalis@seznam.cz
Sources
1. American Psychiatric Association Diagnostic and Statistical Manual of Mental Disorders. Fourth Edition (DSM-IV). Washington: APA 1994.
2. American Psychiatric Association: Practice guideline for the treatment of patients with delirium. Am. J. Psychiatry, 1999, 156, 5 suppl, p. 1–20.
3. Bucerius, J., Gummert, J. F. Predictors of delirium after cardiac surgery: effect of beating heart surgery. J. Thor. Cardiovas. Surg., 2004, 127, p. 57–64.
4. Franco, K., Litaker, D. The cost of delirium in the surgical patient. Psychosomatics, 2001, 42, p. 68–73.
5. Liptzin, B., Levkoff, S. E. An empirical study of delirium subtypes. Brit. J. Psych., 1992;161 : 843-5.
6. Ely, E. W., Truman, B., Shintani, A., Thomason, J. W. W., Wheeler, A. P., Gordon, S. Monitoring sedation status over time in ICU patients: the reliability and validity of the Richmond Agitation Sedation Scale (RASS). JAMA, 2003, 289, p. 2983–2991.
7. Bergeron, N., Dubois, M. J., Dumont, M., Dial, S., Skrobik, Y. Intensive Care Delirium Screening Checklist: evaluation of a new screening tool. Intensive Care Med., 2001, 27, 5, p. 859–864.
8. Karlsson, I. Drugs that induce delirium. Dementia and Geriatric Cognitive Disorders, 1999, 10, p. 412–415.
9. Lynch, E. P., Lazor, M. A. The impact of postoperative pain on the development of postoperative delirium. Anesth. Analg., 1998, 86, p. 781–785.
10. Hála, M., Pavlík, P., Wagner, R. Podávání inhibitoru cyklooxygenázy typu 2 modifikuje průběh pooperačního deliria u kardiochirurgických pacientů. Anest. intenziv. Med., 2006, 17, 5, p. 235–240.
11. Dallas, P. S., Sudeep S. G., van Zyl, L. T. Antipsychotics in the Treatment of Delirium: A Systematic review. J. Clin. Psychiatry, 2007, 68, p. 11–21.
12. Laffey, J. G., Boylan, J. F., Cheng, D. C. H. The systemic inflammatory response to cardiac surgery – implications for the anesthesiologist. Anesthesiology, 2002, 97, p. 215–252.
13. McAlpine, J. N., Hodgson, E. J., Abramowitz, S. The incidence and risk factors associated with postoperative delirium in geriatric patients undergoing surgery for suspected gynecologic malignancies. Gynecol. Oncol., 2008, 109, 2, p. 296–302.
14. Balasundaram, B., Holmes, J. Delirium in vascular surgery. Eur. J Vasc. Endovasc. Surg., 2007, 34, 2, p. 131–134.
15. Norkiene, I., Ringaitiene, D., Misiuriene, I. Incidence and precipitating factors of delirium after coronary artery bypass grafting. Scand. Cardiovasc. J., 2007, 41, 3, p. 180–185.
16. Scholz, M., Cinatl, J. First efficacy and safety results with the antibody containing leukocyte inhibition module in cardiac surgery patients with neutrophil hyperaktivity. ASAIO Journal, 2005, 51, p. 144–147.
17. Christon, R., Drouin, O. Redox modulation of insulin signalling and endothelial function. Antioxidants and Redox Signaling, 2005, 7, 7–8, p. 1062–1070.
18. Siroen, M. P., van Leeuwen, P. A. Modulation of asymmetric dimethylarginine in critically ill patients receiving intensive insulin treatment. Crit. Care Medicine, 2005, 33, 3, p. 504–510.
19. Langouche, L., Vanhorebeek, I. Intensive insulin therapy protects the endothelium of critically ill patiens. J. Clin. Invest., 2005, 115, p. 2277–2286.
20. Katznelson, R., Djaiani, G., Borger, M. Preoperative Use of Statins Is Associated with Reduced Early Delirium Rates after Cardiac Surgery. Anesthesiology, 2009, 110, 1, p. 67–73.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 3-
All articles in this issue
- Analgosedation in Intensive Care Units (ICU) in the Czech Republic – the results of questionnaire study
- Dynamic parameters of preload in pressure support ventilation
- Regional cooling of blood in the extracorporeal circuit: New way of anticoagulation during CRRT
- Catheter-related blood stream infections
- Blood and tissue glucose level in critically ill patients: Comparison of different methods of measuring interstitial glucose levels
- Delirium during the postoperative period and in the intensive medicine
- Polarography – major contribution of Jaroslav Heyrovský to the intensive therapy
- Dr. Zdeněk Křivánek: Krivanek’s Anaesteshesiologist Biannual Meeting in Pardubice
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Analgosedation in Intensive Care Units (ICU) in the Czech Republic – the results of questionnaire study
- Delirium during the postoperative period and in the intensive medicine
- Catheter-related blood stream infections
- Dynamic parameters of preload in pressure support ventilation
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career