-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nejnovější informace v oblasti terapeutických cílů a preparátů pro léčbu karcinomu prostaty rezistentního na kastrační léčbu
Updates on therapeutic targets and agents in castrate-resistant prostate cancer
Prostate cancer (PCa) is the most commonly diagnosed noncutaneous cancer in men and the second to third most common cause of cancer death in the western world. Nearly all patients with metastatic disease will eventually experience disease progression despite castration with a median duration of response of 18–24 months; development of castration-resistant prostate cancer (CRPC) is only a matter of time. CRPC is defined by disease progression despite androgen-deprivation therapy. CRPC presents a spectrum of disease ranging from rising PSA levels to metastases and significant debilitation from cancer symptoms. Prognosis is associated with several factors, including performance status, presence of bone pain, extent of disease on bone scan, and serum levels of alkaline phosphatase. Based on our enhanced understanding of tumor biology, including the role of tumor, host, and hormonal signaling, there has been rational development of new therapies for CRPC. Over the last decade, several clinical trials have been launched to study novel agents targeting different mechanisms of PCa progression that has been culminated by success of four new agents for CRPC (cabazitaxel, sipuleucel-T, denosumab, and abiraterone acetate) and several more molecules are on the horizon. The purpose of this review is to discuss the new therapeutic targets in CRPC focusing on new promising agents.
Key words:
prostate cancer, castrate-resistance prostate cancer, bone metastasis, androgen receptor, chemotherapy, immunotherapy, angiogenesis
Autoři: M. O. Bishr; J.-B. Lattouf; P. O. Gannon; F. Saad
Působiště autorů: University of Montreal Hospital Center, 1560 Sherbrooke east, Montreal, Canada
Vyšlo v časopise: Urol List 2012; 10(2): 15-23
Souhrn
Karcinom prostaty (PCa) představuje nejčastěji diagnostikovaný karcinom (s výjimkou kožních malignit)u mužů a druhou až třetí nejčastější příčinu úmrtí na karcinom v západním světě. Téměř u všech pacientů s metastazujícím karcinomem dojde nakonec k progresi onemocnění, a to i navzdory kastrační léčbě (střední doba trvání odpovědi na léčbu činí 18–24 měsíců); vznik karcinomu prostaty rezistentního na kastrační léčbu (CRPC) je pouze otázkou času. CRPC lze definovat jako progresi onemocnění navzdory androgen-deprivační terapii. CRPC zahrnuje celé spektrum stavů, od zvýšení hladiny PSA až po vznik metastáz a závažné oslabení pacienta v důsledku symptomů karcinomu. Prognóza závisí na různých faktorech, jako jsou celkový stav pacienta, bolest ve skeletu, rozsah onemocnění na kostním scanu a hladina alkalické fosfatázy v séru. Díky nejnovějším poznatkům týkajícím se biologické povahy tumoru (jako např. role tumoru, hostitele a hormonálních signálních drah) došlo k podstatnému vývoji v oblasti nových terapií pro léčbu CRPC. Během posledních deseti let byla zahájena řada klinických studií testujících nové agens zaměřené na nejrůznější mechanizmy progrese karcinomu prostaty. Tato snaha byla korunována úspěchem v podobě čtyř nových preparátů pro léčbu CRPC (cabazitaxel, sipuleucel-T, denosumab a abirateron acetát) a na obzoru se rýsují další molekuly. Autoři tohoto přehledového článku se zabývají novými terapeutickými cíly při léčbě CRPC se zaměřením na nové slibné preparáty.
Klíčová slova:
karcinom prostaty, karcinom prostaty rezistentní na kastrační léčbu, metastázy ve skeletu, androgenní receptorimunoterapie, angiogeneze
Karcinom prostaty (PCa) zůstává v západním světě i nadále významnou příčinou morbidity a mortality. Karcinom prostaty představuje nejčastěji diagnostikovaný karcinom (s výjimkou kožních malignit) u mužů a druhou až třetí nejčastější příčinu úmrtí na karcinom v západním světě [1]. Díky screeningu karcinomu prostaty pomocí měření hladiny prostatického specifického antigenu (PSA) je karcinom u většiny pacientů diagnostikován včas a v lokalizovaném stadiu. Pro většinu pacientů je volba radikální prostatektomie nebo radioterapie s ohledem na dobu přežití a možnost vyléčení ekvivalentní [2]. Téměř u všech pacientů s metastazujícím, lokálně pokročilým karcinomem s vysokým rizikem dojde nakonec k progresi onemocnění, a to i navzdory medikamentózní či chirurgické kastraci (střední doba trvání odpovědi na léčbu 18–24 měsíců) [3]; vznik karcinomu prostaty rezistentního na kastrační léčbu (CRPC) je pouze otázkou času.
DEFINICE
CRPC lze definovat jako progresi onemocnění navzdory androgen-deprivační terapii [4]. Termín CRPC je v současné době upřednostňován před dříve běžně užívaným označením androgen-independentní karcinom prostaty a karcinom prostaty refrakterní na hormonální léčbu vzhledem k tomu, že nejnovější publikace prokazují, že androgenní receptor (AR) je v buňkách CRPC stále aktivní a že navzdory nízké hladině testosteronu v séru zůstává v buňkách karcinomu prostaty dostatečná hladina androgenů umožňující aktivaci AR [5,6].
CRPC zahrnuje celé spektrum stavů od zvýšení hladiny PSA až po vznik metastáz a závažné oslabení pacienta v důsledku symptomů karcinomu. Prognóza závisí na různých faktorech, jako jsou celkový stav pacienta, bolest ve skeletu, rozsah onemocnění na kostním scanu a hladina alkalické fosfatázy v séru. U 90 % mužů s CRPC dojde ke vzniku kostních metastáz, jež mohou být příčinou závažné morbidity, v podobě bolesti, patologických zlomenin, komprese míchy a útlumu kostní dřeně. Častý je rovněž výskyt paraneoplastických projevů, jako jsou anémie, úbytek váhy, únava, hyperkoagulabilita a větší náchylnost k infekci [4].
MECHANIZMUS REZISTENCE NA ANDROGENNÍ DEPRIVACI
Předpoklad principu účinku sekundární hormonální manipulace byl založen na skutečnosti, že androgen je produkován v nadledvinách pacientů s CRPC [7]. Nejnovější poznatky týkající se biologické podstaty rezistence na androgenní deprivaci nasvědčují tomu, že samotná tkáň karcinomu prostaty hraje zásadní roli v rámci této odpovědi. Tuto skutečnost lze vysvětlit aktivací AR (alternativní spojování, mutace genu aktivující AR), produkcí androgenu samotným tumorem, vazbou AR na ostatní hormony, aktivací cílů dysregulací transkripčních faktorů (např. vazba často se přeskupovaných Ets onkogenních faktorů o nadměrné expresi na promotory regulované androgeny) [8] a dalšími, dosud neidentifikovanými mechanizmy. Tyto koncepty byly ověřeny v preklinických studiích a představují impulz k testování nových terapií zacílených na AR v klinických studiích.
LÉČBA CRPC
Díky nejnovějším poznatkům týkajícím se biologické povahy tumoru (jako např. role tumoru, hostitele a hormonálních signálních drah) došlo k podstatnému vývoji v oblasti nových terapií pro léčbu CRPC. Autoři tohoto přehledového článku se zabývají novými terapeutickými cíly při léčbě CRPC se zaměřením na nové slibné preparáty.
Chemoterapie
Ačkoli dvě studie III. fáze [9,10] neprokázaly u pacientů s CRPC žádný benefit v době přežití při aplikaci mitoxantronu (antracyklin), mitoxantron v kombinaci s prednisonem představuje standardní metodu léčby CRPC u pacientů s detekovatelným metastazujícím onemocněním. Tato kombinace zajišťuje kontrolu onemocnění, paliaci a zlepšení kvality pacientova života.
V roce 2004 byl docetaxel (taxan, jenž vyvolává polymerizaci mikrotubulů a fosforylaci proteinu bcl-2) v kombinaci s prednisonem zvolen léčbou první volby v rámci systémové chemoterapie u pacientů s CRPC s detekovatelnými metastázami. Toto rozhodnutí bylo učiněno primárně na základě publikace dvou nezávislých randomizovaných kontrolovaných studií (SWOG 9916 a TAX327) srovnávajících tuto kombinaci se dřívější standardní kombinací mitoxantron plus prednison [11,12].
Studie SWOG 9916 srovnává aplikaci docetaxelu (aplikace jednou za tři týdny) s estramustinem s kombinací mitoxantron plus prednison. Studie prokázala 27% zvýšení doby přežití bez progrese (PFS), 55% zvýšení míry objektivní odpovědi (RR) a zlepšení střední hodnoty celkové doby přežití (OS) o 1,9 měsíce při aplikaci docetaxelu v kombinaci s estramustinem (17,5 měsíců vs 15,6 měsíců; p = 0,02) [11].
Studie TAX327 srovnává dva různé protokoly aplikace docetaxelu (jednou týdně nebo každé tři týdny) plus prednison, a mitoxantron plus prednison u pacientů s CRPC [12]. Opět byl zaznamenán benefit v době přežití při aplikaci docetaxelu každé tři týdny (ve srovnání s mitoxantronem, OS 19,2 měsíců vs 16,3 měsíců, p = 0,009), při aplikaci docetaxelu jednou týdně však nebyl zaznamenán žádný významný rozdíl (střední doba přežití 17,8 měsíců). Při aplikaci docetaxelu byla rovněž zaznamenána lepší kontrola bolesti a PSA-RR (45 vs 32 %). Toxicita byla pacienty dobře snášena a ačkoli 32 % pacientů trpělo neutropenií ≥ 3. stupně, incidence neutropenické horečky v obou studiích byla méně než 3 %. Na základě těchto pilotních studií se v současné době doporučuje u mužů s klinicky nebo biochemicky prokázanou progresí a metastázami intravenózní léčba pomocí docetaxelu 75 mg/m2 (intravenózně jednou za tři týdny) v kombinaci s perorální aplikací 5 mg prednisonu dvakrát denně. Tato léčba povede ke zlepšení celkové doby přežití, ke kontrole onemocnění, zmírnění symptomů a zlepšení kvality pacientova života [13,14].
Nejnovější preparáty v klinických studiích
Ačkoli docetaxel v kombinaci s prednisonem zlepšuje ve srovnání s mitoxantronem dobu přežití, celkový benefit je pouze nepatrný. Výzkum se tedy poslední dobou zaměřuje na zlepšování klinických výsledků vývojem alternativních chemoterapeutických preparátů, moderních cílených agens a kombinovaných protokolů. V uplynulém roce byla prokázána účinnost několika slibných preparátů s rozmanitým mechanizmem účinku a rozdílnými cíly.
Cabazitaxel
Mimo jiné mechanizmy je rezistence na taxany zprostředkovávána rezistencí P-glykoproteinu na různé preparáty nebo alteracemi mikrotubulů, rezistence na jeden typ taxanu však automaticky neznamená kompletní klinickou rezistenci na ostatní agens z této skupiny [15]. Cabazitaxel je preparát ze skupiny taxanů stabilizující mikrotubuly, u něhož byl prokázán významný účinek na preklinickém modelu rezistentním na docetaxel a nízká afinita na P-glykoprotein. Cabazitaxel v kombinaci s prednisonem vs mitoxantron v kombinaci s prednisonem byly testovány ve studii III. fáze (TROPIC trial) [16] u pacientů s CRPC, u nichž došlo po léčbě první volby pomocí docetaxelu k progresi. Studie prokázala 30% pokles rizika úmrtí (HR = 0,70;p < 0,001) a zlepšení celkové doby přežití o 2,4 měsíců při léčbě pomocí cabazitaxelu (15,1 měsíců vs 12,7 měsíců). Toxicita 3/4 stupně zahrnovala případy neutropenie (81,7 %), febrilní neutropenie (7,5 %), infekce (10,2 %), zvracení (1,9 %) a průjmu (6,2 %). Za zmínku stojí, že dávka cabazitaxelu ve studii TROPIC byla vyšší než dávka doporučovaná na základě hodnocení I. fáze (25 mg/m2 vs 20 mg/m2).V současné době je v plánu studie III. fáze, jež bude přímo srovnávat cabazitaxel 25 mg/m2 vs 20 mg/m2. Jiná studie III. fáze bude hodnotit účinnost cabazitaxelu v rámci léčby první volby ve srovnání s docetaxelem.
Epothilony
Jedná se o látky stabilizující mikrotubuly z jiné skupiny, než jsou taxany.
Ixabepilon byl testován jako chemoterapeutikum první volby u pacientů s CRPC v multicentrické randomizované studii II. fáze, jako monoterapie nebo v kombinaci s estramustinem; oba protokoly byly pacienty dobře snášeny, 50% pokles hladiny PSA byl zaznamenán u 44 % pacientů léčených pouze pomocí ixabepilonu a u 69 % pacientů užívajících kombinovanou léčbu. Objektivní odpověď byla zaznamenána u 32 % pacientů užívajících monoterapii a u 48 % pacientů užívajících kombinovanou léčbu [17]. V randomizované studii II. fáze byl testován ixabepilon vs mitoxantron/prednison jako chemoterapeutikum druhé volby u pacientů s CRPC. Více než 50% snížení hladiny PSA bylo zaznamenáno u 17 % pacientů užívajících ixabepilon a u 20 % pacientů užívajících mitoxantron/prednison [18]. Vzhledem k absenci zkřížené rezistence mezi ixabepilonem a mitoxantronem/prednisonem, jež byla zaznamenána v předchozí studii [6], byla kombinace ixabepilon + + mitoxantron + prednison (IMP) testována v multicentrické studii II. fáze, jež prokázala ≥ 50% pokles hladiny PSA u 45 % pacientů [19].
Dalším derivátem epothilonu je patupilon, který je v současné době testován jako chemoterapeutikum druhé volby u pacientů s CRPC, u nichž došlo po šestiměsíční aplikaci docetaxelu k progresi (v rámci studie II. fáze). Studie uvádí výskyt nepříznivých účinků 3/4 stupně, jako např. únava, průjem a anorexie [20,21]. Léčba vedla ke zlepšení symptomů i PSA, tento protokol je však nutné dále testovat ve studiích III. fáze.
Chemoterapie na bázi platiny
CRPC se může rozvinout do skutečně androgen independentního tumoru, tento je označován jako anaplastický nebo neuroendokrinní karcinom prostaty (NEPC), jenž neexprimuje androgenní receptor (AR), PSA ani ostatní geny regulované androgeny. Toto onemocnění má obvykle velmi agresivní klinický průběh – většina pacientů přežívá méně než jeden rok [22]. Existuje rozšířená hypotéza, že tato podskupina pacientů může mít benefit z terapie na bázi platiny.
Satraplatina je preparát na bázi platiny, který je podáván perorálně. Tento preparát byl testován v rámci léčby druhé volby ve studii III. fáze v kombinaci s prednisonem ve srovnání se samotným prednisonem u pacientů, u nichž došlo po chemoterapii první volby k progresi. Studie prokázala zlepšení PFS (HR = 0,69; p < 0,001) i PSA a RR tumoru (25 vs 12 %; p < 0,001; 7 vs 1 %;, p < 0,002), ovšem žádné statisticky významné zlepšení OS (61,3 vs 61,4 týdnů, p = 0,800) [23].
Terapie cílené na androgeny
Antagonista androgenního receptoru
Mezi klasické antagonisty androgenního receptoru (ARAs) patří nesteroidní preparáty bicalutamid, nilutamid a flutamid stejně jako cyproteron acetát, v Evropě užívaný steroidní ARA [24]. Tyto preparáty byly užívány k celkové androgenní blokádě (TAB) u pacientů, kteří podstoupili monoterapii s aplikací agonisty hormonu uvolňujícího luteinizační hormon a pacientů, kteří podstoupili orchiektomii. ARA jako např. bicalutamid mohou vést k poklesu PSA u 30–35 % pacientů [25,26]. Lepší porozumění významu AR signálních drah a mechanizmu zodpovědného za rezistenci na androgenní deprivaci u pacientů s CRPC podnítilo zájem o vyvíjení účinnějších a lépe snášených antagonistů androgenního receptoru (ARAs).
Tab. 1. Preparáty užívané při léčbě CRPC. 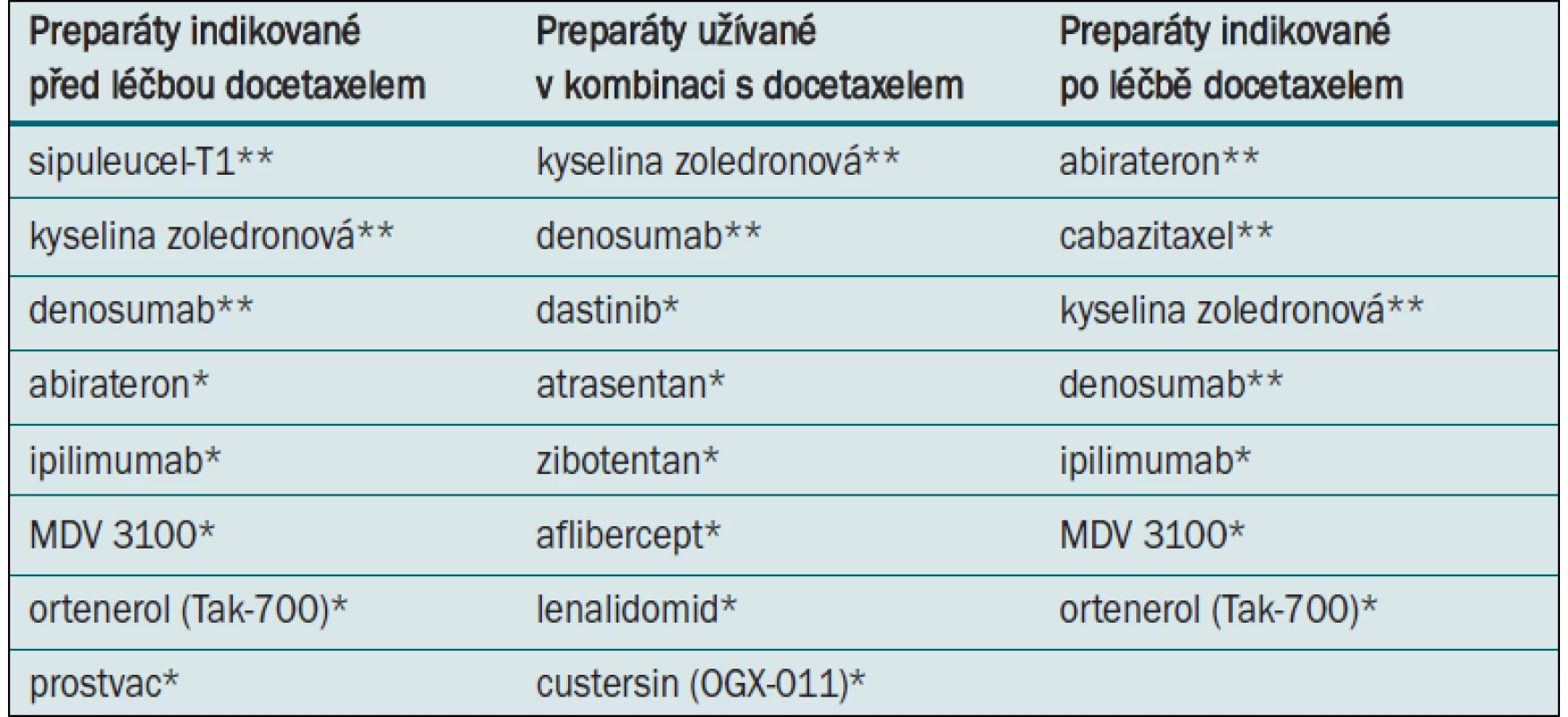
*V současné době probíhající studie III. fáze. **Pozitivní výsledky studie III. fáze. Abirateron acetát
Abirateron acetát je nezvratný inhibitor enzymu androgenní biosyntézy CYP17, který je znám rovněž pod označením 17-a--hydroxyláza a C17,20-lyáza, který se podílí na biosyntéze androgenu v nadledvinách a pravděpodobně rovněž v buňkách karcinomu prostaty [27]. Abirateron je silnější a selektivnější inhibitor CYP17 než ketokonazol [28]. Studie II. fáze testující účinnost abirateronu v kombinaci s prednisonem u pacientů s CRPC, kteří nebyli dříve léčeni pomocí chemoterapie, a pacientů s CRPC, kteří užívali docetaxel, prokázaly 51–85% PSA-RR a trvalou radiologickou odpověď. Aplikace abirateronu byla bezpečná a výskyt nepříznivých účinků se týkal symptomů spojených s nadbytkem mineralokortikoidů, jako jsou hypokalemie, retence tekutin a hypertenze [29–31]. Tyto povzbudivé výsledky byly impulzem k uskutečnění dvou randomizovaných studií III. fáze srovnávajících účinnost abirateronu + prednisonu vs placebo + prednison u pacientů s CRPC, kteří nepodstoupili léčbu pomocí chemoterapie i pacientů léčených pomocí docetaxelu. U pacientů po předchozí léčbě docetaxelem bylo zaznamenáno zlepšení OS o čtyři měsíce (14,8 měsíců vs 10,9 měsíců), významné zlepšení PFS (5,6 měsíců vs 3,6 měsíců) a RR (38 vs 10 %) [32]. Zatímco u pacientů, kteří dříve nebyli léčeni pomocí chemoterapie, byl ukončen nábor do studie (http://clinicaltrials.gov/ct2/show/NCT00887198).
Ortenerol (TAK-700)
Ortenerol (TAK-700) je selektivní nesteroidní inhibitor 17,20-lyázy. Výsledky studie I. fáze jsou povzbudivé, u všech 26 léčených pacientů byl zaznamenán významný pokles hladiny PSA [33]. U pacientů užívajících ≥ 300 mg ve třech a více cyklech činila PSA-RR 80 %. Případy toxicity zahrnovaly únavu, nevolnost/zvracení, zácpu a anorexii, nebyl zaznamenán žádný případ toxicity vyžadující snížení dávky (DLT). V současné době probíhají dvě studie III. fáze srovnávající TAK-700/prednison vs placebo/prednison u mužů s CRPC, kteří nebyli dosud léčeni pomocí chemoterapie (http://clinicaltrials.gov/ct2/show/NCT01193244), a pacientů, u nichž došlo k progresi onemocnění po léčbě pomocí docetaxelu (http://clinicaltrials.gov/ct2/show/NCT01193257).
MDV3100
MDV3100 je silný selektivní ARA, jehož účinek spočívá v blokádě vazby testosteronu na AR, prevenci jaderné translokace a vazby AR na DNA; posledními dvěma zmiňovanými mechanizmy se MDV3100 vyznačuje od ostatních antiandrogenů.
Ve srovnání s bicalutamidem, MDV3100 vazebná afinita na AR je 5–8krát vyšší bez agonistické aktivity, navíc odpověď LNCaP xenograft tumorů s nadměrnou expresí AR je lepší u MDV3100 [34]. Ve studii I./II. fáze zahrnující 140 pacientů byl protinádorový účinek pozorován jak u pacientů, kteří nebyli léčeni pomocí chemoterapie, tak u pacientů léčených pomocí docetaxelu (PSA-RR 56 %, RR měkké tkáně 22 %). Nejčastějším projevem toxicity byla únava (11 %), již bylo možné eliminovat snížením dávky, dalším projevem omezujícím vyšší dávky byly záchvaty, které se nevyskytovaly při aplikaci méně účinné dávky [35]. V současné době byl dokončen nábor pacientů (léčených v minulosti pomocí docetaxelu) do studie III. fáze (AFFIRM) (http://clinicaltrials.gov/ct2/show/ /NCT00974311) a zároveň probíhá další studie III. fáze zahrnující pacienty s CRPC, kteří nebyli dosud léčeni pomocí chemoterapie (PREVAIL) (http://clinicaltrials.gov/ct2/show/NCT01212991). V současné době jsou rovněž klinicky testovány silné antiandrogeny nové generace – duální antiandrogen a inhibitor CYP17, TOK-001.
Terapie cílená na AR signální dráhu
Koncept blokády aktivace AR signální dráhy cílením ostatních komponent AR signální dráhy otevřel zcela nové možnosti ve výzkumu modalit pro léčbu CRPC. Mezi nejvíce zkoumané komponenty patří tzv. proteiny tepelného šoku (Heat shock protein-90 HSP-90), histonové deacetylázy (HDACs) a savčí cíl pro rapamycin (mTOR) [24].
Terapie cílené na cévní zásobení tumoru
Angiogeneze představuje významnou součást procesu růstu tumoru, invaze i šíření metastáz. Bylo prokázáno, že ligandy a receptory vaskulárního endoteliálního růstového faktoru (VEGF) hrají hlavní roli v rámci regulace těchto procesů. U pacientů s metastazujícím CRPC představuje zvýšená hladina VEGF v séru predikátor progrese onemocnění a nepříznivé prognózy [36]. Na experimentálním modelu karcinomu prostaty bylo prokázáno, že inhibice receptoru VEGF má protinádorový efekt [37].
Bevacizumab
Bevacizumab je monoklonální protilátka zacílená proti VEGF-A, jež vyvolává silnou inhibici signálních drah VEGFR a angiogeneze. Studie II. fáze CALGB 90006 testující účinnost bevacizumabu v kombinaci s chemoterapií prokázala 77% PSA-RR (pokles o ≥ 50 %), dobu do vzniku progrese (TTP) = 9,7 měsíců a OS = 21 měsíců [38]. Na základě těchto výsledků byla zahájena studie III. fáze (CALGB 90401) srovnávající účinnost docetaxelu + prednisonu s bevacizumabem vs placebo. Navzdory významnému zvýšení PFS (9,9 měsíců vs 7,5 měsíců; p < 0,001) i míry odpovědi (RR tumoru 53,2 vs 42,1 %; p = 0,01; PSA-RR 69,5 vs 57,9 %; p < 0,001), CALGB 90401 nedosáhla primárního cílového parametru v podobě OS (22,6 měsíců vs 21,5 měsíců; p = 0,910) [39].
Aflibercept (VEGF Trap)
Aflibercept (VEGF Trap) je silný inhibitor VEGF a VEGF-B a dalších členů VEGF rodiny, jenž se váže na VEGFR-1 a VEGFR-2, včetně placentárního růstového faktoru. Jedná se o rekombinantní VEGF protein, který obsahuje extracelulární domény VEGF receptorů 1 a 2 spojené s kons-tantní oblastí IgG, jež se váže na VEGF a neutralizuje jej [40]. Studie I. fáze testující aflibercept v kombinaci s docetaxelem prokázala bezpečnost léčby, mezi hlavními projevy toxicity 3.–4. stupně se vyskytoval HTN (15 %), toxicita 2. stupně zahrnovala případy proteinurie (12 %), epistaxe (8 %) a dysfonie (2 %) [41]. Byla ukončena studie III. fáze testující docetaxel a prednison s afliberceptem, nebo bez něj a očekáváme data finální analýzy (http://clinicaltrials.gov/ct2/show/NCT00519285).
Inhibitory tyrosinkinázy – sunitinib
Sunitinib je inhibitor tyrosinkinázy (TKI), jenž významně zlepšuje dobu přežití bez progrese (PFS) u pacientů s metastazujícím karcinomem z renálních buněk [42]. Studie II. fáze testující účinnost sunitinibu u pacientů s CRPC refrakterním na léčbu docetaxelem uvádí PFS 19,4 týdnů, ≥ 50% pokles hladiny PSA u 21,2 % pacientů a 30% redukci velikosti tumoru podle kritérií RECIST u 11 % pacientů s měřitelným onemocněním. 52,8 % pacientů léčbu ukončilo v důsledku toxicity [43]. Studie III. fáze srovnávající účinnost sunitinibu v kombinaci s prednisonem vs placebo/prednison u mužů s CRPC, u nichž došlo k progresi po léčbě pomocí docetaxelu, byla bohužel pozastavena na úrovni interim analýzy v důsledku absence účinku.
Imunomodulační preparáty
Thalidomid je imunomodulační preparát, jenž způsobuje inhibici angiogeneze. Bylo prokázáno, že thalidomid v kombinaci s docetaxelem (jednou týdně) přináší benefit při léčbě CRPC. Randomizovaná studie II. fáze zahrnující 60 pacientů s CRPC prokázala, že kombinovaná léčba vede k významnému zlepšení OS o 18 měsíců oproti samotné aplikaci docetaxelu (69,3 vs 47,2 %; p < 0,05) [44]. Vedlejší účinky zahrnovaly případy gastrointestinální toxicity a deprese, incidence tromboembolie se významně zvýšila po nasazení thalidomidu (žilní tromboembolie u 20 % pacientů, přechodná ischemická ataka u 7 % pacientů).
Lenalidomid je silnější a méně toxický derivát thalidomidu. Studie I. fáze prokázala bezpečnost kombinace lenalidomidu s docetaxelem: 47% PSA-RR u pacientů, kteří nebyli dosud léčeni pomocí chemoterapie, 50% PSA-RR u již léčených pacientů [45]. Na základě těchto výsledků byla zahájena studie III. fáze srovnávající kombinaci docetaxelu s prednisonem vs docetaxel, prednison a lenalidomid (MAINSAIL) (http://clinicaltrials.gov/ct2/show/NCT00988208).
Tasquinimod
Tasquinimod je perorálně podávaný antiangiogenní preparát, který v randomizované studii II. fáze zahrnující 206 pacientů s metastazujícím CRPC významně zlepšoval PFS (ve srovnání s placebem) (24,7 týdnů vs 12,9 týdnů) [46]. Incidence vedlejších účinků byla nízká. U pacientů, u nichž se komplikace vyskytly, však tyto měly závažný charakter: cévní příhody (tj. infarkt myokardu, srdeční selhání, cévní mozková příhoda) u 3 % pacientů a trombóza hlubokých žil u 4 % pacientů užívajících tasquinimod (u pacientů užívajících placebo nebyl pozorován výskyt žádné z těchto komplikací). Nejčastější nepříznivé reakce zahrnovaly gastrointestinální potíže, únavu a muskuloskeletální bolest, u 38 % pacientů užívajících tasquinimod byla zaznamenána toxicita ≥ 3. stupně (vs u 10 % pacientů užívajících placebo). V letošním roce byla zahájena studie III. fáze srovnávající tasquinimod a placebo u mužů s asymptomatickým nebo minimálně symptomatickým metastazujícím CRPC (http://clinicaltrials.gov/ct2/show/NCT01234311).
Imunoterapie
Vakcinace
Obecná strategie imunoterapie spočívá v „nastartování“ imunitního systému jeho vystavením jedinečnému antigenu tumoru, který spouští protinádorový účinek, jenž překoná imunologickou toleranci maligního onemocnění. Vakcinace je pacienty obvykle dobře snášena. Mezi nejčastější vedlejší účinky patří reakce na infuzi a symptomy připomínající chřipku, které se objevují během několika prvních dnů léčby a následně vymizí.
Sipuleucel-T (provenge)
Sipuleucel-T (provenge) je autologní vakcína vyvinutá ke stimulaci imunity T-lymfocytů proti kyselé prostatické fosfatáze (PAP). V rámci přípravy vakcíny pacient podstoupí odběr 1,5–2,0 ml krve k provedení leukaferézy mononukleárních buněk. Z produktu leukaferézy jsou izolovány antigen prezentující buňky (APC), které jsou následně zpracovány s rekombinantním antigenem kyselé prostatické fosfatázy, antigenem karcinomu prostaty a faktorem stimulujícím kolonie granulocytů a makrofágů. Výsledná látka je pak intravenózně aplikována pacientovi. Studie I. a II. fáze prokazují, že sipuleucel-T je pacienty dobře snášen, nejčastějším vedlejším účinkem této léčby bývá horečka [47]. Dosud byly provedeny tři studie III. fáze, jež srovnávají sipuleucel-T s placebem u pacientů s metastazujícím asymptomatickým nebo minimálně symptomatickým CRPC (D9901, D9902, IMPACT) [48–50]. Ačkoli doba přežití nebyla primárním cílovým parametrem studií D9901 ani D9002, kombinovaná analýza na základě výsledků obou studií prokázala benefit v době přežití. Na tomto základě FDA (USA, Úřad pro kontrolu potravin a léčiv) schválila v roce 2010 užívání sipuleucelu-T pro tuto indikaci. Aplikace sipuleucelu-T vedla ke snížení rizika úmrtí na jakoukoli příčinu o 26,5 % a prodloužení střední OS o 3,9 měsíců. Navzdory prodloužení OS byla v kontrolní skupině zaznamenána neobvykle nepříznivá doba přežití (21,7 měsíců). V této skupině nedošlo ke zvýšení míry poklesu PSA ani zvýšení míry PFS. Existuje možnost, že PSA-RR ani PFS nejsou nejlepšími parametry pro hodnocení odpovědi u pacientů užívajících imunoterapii. Nedostupnost tohoto preparátu v Evropě, komplikovaná aplikace a cena léčby značně limitují klinické využití sipuleucelu-T.
PROSTVAC-VF
PROSTVAC-VF se skládá z rekombinantní vakcíny vyvinuté k expresi lidského genu PSA a dalších stimulačních molekul a viru ptačí chřipky, s cílem stimulace imunitního systému hostitele a spuštění cílené imunitní reakce proti buňkám tumoru exprimujícím PSA. Studie I. fáze testující účinnost podkožní aplikace PROSTVAC v rámci heterologního režimu u pacientů s CRPC prokázala bezpečnost léčby a stabilizaci PSA u 40 % pacientů [51]. Randomizovaná, dvojitě zaslepená studie II. fáze srovnávající PROSTVAC-VF s placebem nesplnila primární cílový parametr v podobě PFS (TTP 3,9 měsíců vs 3,7 měsíců). Ovšem navzdory skutečnosti, že 50 % pacientů přestoupilo k aktivní léčbě, byl zde zaznamenán benefit v OS o 8,5 měsíců (25,1 měsíců vs 16,6 měsíců). Vzhledem k tomu, že tato studie nebyla designována k detekci rozdílu v celkové době přežití, jsou tyto výsledky nejasné, zejména při absenci zlepšení doby přežití bez progrese [52]. V současné době probíhá randomizovaná studie III. fáze testující účinnost docetaxelu s PROSTVAC nebo bez něj v rámci léčby první volby [53].
GVAX
GVAX je vakcína tvořená deaktivova-nými buňkami karcinomu prostaty (PC-3, LNCaP) geneticky upravenými transferem adenovirů k vylučování GM-CSF, což způsobuje účinnou prezentaci antigenu tumoru. Dvě studie II. fáze testující efekt GVAX u pacientů s asymptomatickým metastazujícím CRPC prokázaly povzbudivé protinádorové účinky [54,55]. Na základě těchto výsledků byly zahájeny dvě studie III. fáze testující GVAX u pacientů s CRPC. První ze studií (VITAL-1) srovnává GVAX s docetaxelem a prednisonem [56], druhá studie (VITAL-2) srovnává GVAX/docetaxel s docetaxelem/prednisonem [57] (ClinicalTrials.gov identifier: NCT00133224). Studie VITAL-2 byla IDMC komisí (Independent Data Monitoring Committee) ukončena z důvodu nadměrného počtu úmrtí ve větvi pacientů užívajících GVAX. Studie VITAL-1 s kompletním náborem byla ukončena, neboť analýza prokázala ≤ 30% šanci na dosažení benefitu v době přežití.
Preparáty regulující imunitu
Ipilumimab je lidská monoklonální protilátka, jež blokuje kostimulační molekulu CTLA-4, která se vyskytuje na povrchu T-lymfocytů a účinkuje jako negativní regulátor aktivace T-buněk, což vede k zeslabení odpovědi T-buněk proti buňkám tumoru [58]. V randomizované studii II. fáze měli pacienti léčení pomocí ipilimumabu a androgenní ablace větší pravděpodobnost, že u nich bude po třech měsících nedetekovatelná hladina PSA, než pacienti, kteří podstoupili samotnou androgenní ablaci (55 vs 38 %). Studie rovněž prokázala významnou klinickou odpověď [59]. Nejčastější nepříznivé účinky 3.–4. stupně zahrnují kolitidu (4,5 %) a průjem (4,5 %), 27,7 % pacientů zaznamenalo kožní změny. Předběžné údaje studie I./II. fáze testující ipilimumab v kombinaci s radioterapií u pacientů s CRPC rovněž prokazují účinnost (21% PSA-RR, střední délka trvání 4,8 měsíců). V současné době probíhají studie III. fáze testující účinek léčby před aplikací docetaxelu i po ní (http://clinicaltrials.gov/ct2/show/NCT01057810 and NCT00861614).
Další terapie
Chaperonové proteiny
Custirsen (OGX-011) je oligonukleotid druhé generace, který způsobuje inhibici tvorby clusterinu – chaperonového proteinu, který podporuje přežití buněk a jehož nadměrná exprese u pacientů s CRPC souvisela s progresí onemocnění a rezistencí na léčbu [60,61]. V randomizované studii II. fáze testující OGX-011 v kombinaci s docetaxelem a prednisonem nebo mitoxantronem a prednisonem u pacientů s CRPC (kteří již byli léčeni pomocí docetaxelu) bylo zaznamenáno zvýšení míry PFS ve prospěch následující kombinace: OGX-011, docetaxel a prednison (4,7 měsíců vs 2,6 měsíců ) [62]. Jiná studie II. fáze testující účinnost docetaxelu s/bez OGX-011 v rámci léčby první volby prokázala lepší OS při kombinované léčbě (23,8 měsíců vs 16,0 měsíců, HR = 0,61), multivariační analýza prokázala u pacientů užívajících docetaxel + OGX-011 o 51 % nižší míru úmrtí než u pacientů užívajících pouze docetaxel (HR = 0,49; p = 0,012) [63]. V současné době probíhají dvě studie III. fáze testující účinek docetaxelu s OGX-011 i bez něj (SYNERGY a SATURN). Jedna ze studií se zaměřuje na dobu přežití, zatímco druhá se zabývá úlevou symptomů (http://clinicaltrials.gov/ct2/show/NCT01188187 and NCT01083615).
Růstový faktor podobný inzulinu
Uváděná korelace mezi aktivací osy inzulinu podobného faktoru (IGF) a progresí CRPC [64] představuje impulz pro výzkum rekombinantních monoklonálních terapeutických protilátek proti receptoru inzulinu podobného faktoru I (IGF-IR) v klinických studiích zaměřených na PCa. Studie I. fáze testující aplikaci CP-751,871 s docetaxelem prokázala, že tato kombinace je pacienty dobře snášena. Randomizovaná studie II. fáze testující účinnost docetaxelu s, nebo bez CP-751,871 neprokázala žádný významný rozdíl (http://clinicaltrials.gov/ct2/show/NCT00313781). Studie II. fáze testující účinnost samotného IMC-A12 (cixutumumab) při léčbě pacientů s metastazujícím CRPC, kteří dosud nepodstoupili chemoterapii, uvádí PFS > 6 měsíců u 9,8 % pacientů [65]. U čtyř pacientů došlo ke vzniku hyperglykemie 3. stupně. Závažnost tohoto vedlejšího účinku bude nutné posoudit v dalších studiích.
Antagonista receptoru endotelinu
Endotelinová (ET) osa zahrnuje tři peptidy (ET-1, ET-2 a ET-3), jež se váží na dva receptory (ET-A a ET-B). Na základě nadměrné exprese ET-1 a ET-A, jež byla prokázána u pacientů s metastazujícím PCa, se předpokládá, že ET osa podporuje u pacientů s PCa reakci osteoblastů na metastazující onemocnění [66–68].
Atrasentan
Atrasentan je selektivní antagonista ET-A. Studie I. fáze prokázala protinádorový účinek této látky a lepší kontrolu bolesti u pacientů s CRPC. Preparát byl pacienty dobře snášen [69]. Dvě další randomizované, dvojitě zaslepené, placebem kontrolované studie III. fáze neprokázaly žádný benefit v PFS (OS nepředstavovala primární cílový parametr, protože studie umožňovala přechod k jiné léčbě) [70,71]. Analýza však u pacientů užívajících astrasentan prokázala významně nižší hladinu molekulárních markerů (PSA a alkalické fosfatázy) indikujících progresi onemocnění. Na základě těchto výsledků byla zahájena studie III. fáze testující docetaxel/prednison s atrasentanem, nebo bez něj při léčbě metastazujícího CRPC (S0421) (http://clinicaltrials.gov/ct2/show/NCT00134056).
Zibotentan (ZD4054)
Zibotentan (ZD4054) je další antagonista endotelinového receptoru. Randomizovaná studie II. fáze srovnávající zibotentan s placebem prokázala počáteční zlepšení OS (23,9 měsíců vs 19,9 měsíců; p = 0,100) u pacientů s metastazujícím CRPC s mírnými symptomy [72]. Na základě těchto údajů byly zahájeny tři studie III. fáze: první z nich srovnává účinek docetaxelu se zibotentanem, nebo bez něj (http://clinicaltrials.gov/ct2/show/NCT00617669), druhá studie testující zibotentan vs placebo u pacientů s asymptomatickým metastazujícím CRPC byla následně v důsledku absence účinku zastavena. Třetí studie zahrnující pacienty s nemetastazujícím CRPC (s dobou do vzniku metastáz a celkovou dobou přežití jako primárními cílovými parametry) byla rovněž zastavena v důsledku absence účinku.
Kalcitriol (DN-101)
Na preklinických modelech bylo prokázáno, že kalcitriol (hlavní metabolit vitaminu D) vykazuje protinádorové účinky a působí synergisticky s docetaxelem [73]. V randomizované studii II. fáze (ASCENT-1), jež srovnává aplikaci docetaxelu jednou týdně s/bez DN-101 o vysoké dávce, nebyl prokázán žádný významný dopad na PSA-RR (63 vs 52 %; p = 0,070), došlo však k signifikantnímu zlepšení OS (24,5 měsíců vs 16,4 měsíců) [74]. Na základě těchto výsledků byla provedena studie III. fáze srovnávající DN-101 + docetaxel jednou týdně vs docetaxel jednou za tři týdny (ASCENT-2). U pacientů užívajících DN-101 byl zaznamenán větší počet úmrtí (OS 16,8 měsíců vs 19,9 měsíců; p = 0,01) [75]. Horší doba přežití mohla souviset s aplikací docetaxelu jednou týdně v experimentální větvi (ve srovnání s docetaxelem aplikovaným každé tři týdny v kontrolní větvi), neboť rovněž ve studii TAX327 bylo užívání docetaxelu jednou týdně spojeno s kratší dobou přežití (ve srovnání s docetaxelem aplikovaným každé tři týdny).
Terapie cílená na skelet
Pacienti s metastazujícím karcinomem prostaty jsou z důvodu křehčího skeletu náchylnější ke vzniku kostních komplikací, jako jsou např. patologické fraktury, oslabující bolest ve skeletu nebo komprese míchy. Tento stav je zčásti důsledkem samotného onemocnění, jež samo představuje rizikový faktor pro vznik osteoporózy, a nežádoucím působením ADT, která dále zhoršuje důsledky oslabení kostí způsobeného přítomností kostních metastáz [76–78].
Bisfosfonáty
Kyselina zoledronová je bisfosfonát se substituovaným dusíkem, jenž zvyšuje u pacientů s karcinomem prostaty, kteří užívají ADT, denzitu kostních minerálů prostřednictvím inhibice kostní resorpce působené inhibicí osteoklastů [79,80]. V randomizované, placebem kontrolované studii III. fáze, testující účinek kyseliny zoledronové (4 mg každé 3 týdny) u pacientů s CRPC s asymptomatickými nebo minimálně symptomatickými kostními metastázami, byl zaznamenán významný pokles počtu pacientů s alespoň jednou SRE (38 vs 49 %; p = 0,02). Studie dále prokázala signifikantní prodloužení intervalu do vzniku první SRE (488 dnů vs 321 dnů; p = 0,009) a rovněž 36% pokles incidence SRE u léčených pacientů [81]. Bezpečnost kyseliny zoledronové byla prokázána v klinických studiích v rámci nejrůznějších cytotoxických protokolů [82]. Terapie cílené na skelet jsou spojeny se zvýšeným rizikem osteonekrózy čelisti (ONJ). Riziko ONJ lze snížit kvalitní hygienou dutiny ústní, počátečním vyšetřením dutiny ústní pro identifikaci rizikových jedinců a kontraindikací zákroků v dutině ústní během terapie. Až donedávna představovala kyselina zoledronová jediný preparát schválený FDA pro prevenci nepříznivých účinků ve skeletu (SREs) u pacientů s kostními metastázami rezistentními na kastrační léčbu.
Inhibitor systému RANK-RANKL
RANK-RANKL systém, klíčový mediátor tvorby osteoklastů, jejich vyzrávání a působení osteolýzy, hraje stěžejní roli v rámci vzniku a šíření kostních metastáz [86].
Denosumab byl v roce 2010 schválen FDA pro prevenci SREs u mužů s metastazujícím CRPC a kostními metastázami. Jedná se o lidskou monoklonální protilátku, která brání vazbě RANKL na RANK, a způsobuje tak inhibici resorpce kostí osteoklasty. Studie III. fáze srovnávající denosumab (120 mg subkutánně jednou za 4 týdny) a kyselinu zoledronovou (4 mg intravenózně jednou za 4 týdny) u pacientů s CRPC a kostními metastázami prokázala u pacientů užívajících denosumab prodloužení intervalu do vzniku první SRE (20,7 měsíců při aplikaci denosumabu vs 17,1 měsíců při aplikaci kyseliny zoledronové; p = 0,008) a nižší incidenci mnohočetných SREs (p = 0,004) [87]. Výskyt vedlejších účinků byl v obou větvích srovnatelný a zahrnoval primárně horečky, zácpu a bolest v kloubech. Incidence hypokalemie činila 13 % při aplikaci denosumabu (vs 6 % při aplikaci kyseliny zoledronové), incidence osteonekrózy čelisti 2,3 % (vs 1,3 % při aplikaci kyseliny zoledronové; p = 0,09). Mezi další výhody denosumabu patří snadná podkožní aplikace (oproti intravenózní aplikaci kyseliny zoledronové). Léčba navíc není spojena s nefrotoxicitou a nevyžaduje monitorování hladiny kreatininu v séru. Zatím není známo, zda je vhodné kyselinu zoledronovou a denosumab podávat sekvenčně po selhání jiného preparátu. Rovněž dosud nebyla stanovena ani délka trvání účinku či optimální frekvence podávání preparátu. Stojí za zmínku, že studie III. fáze testující dopad denosumabu vs placebo na oddálení vzniku kostních metastáz u mužů s nemetastazujícím CRPC prokazuje předběžně pozitivní výsledky, mezi větvemi studie byl zaznamenán rozdíl 4,2 měsíců. V současné době očekáváme finální výsledky, zda tyto předběžné výsledky povedou ke zlepšení výsledku celkového.
Inhibitory skupiny SRC
SRC je prototypický člen SRC skupiny non-receptor tyrosinkináz, který se podílí na progresi kostních metastáz u pacientů s karcinomem prostaty, neboť hraje zásadní roli v aktivitě osteoklastů, kostní resorpci, proliferaci osteoblastů a ukládání kostní hmoty [88].
Dasatinib je silný inhibitor kináz SRC rodiny. Na preklinickém modelu PCa bylo prokázáno, že dasatinib vykazuje významný protinádorový účinek [89]. Studie I./II. fáze testující účinek kombinace dasatinibu s docetaxelem a prednisonem prokázala účinek s 49% PSA-RR, 42% parciální RR měkkých tkání a 28% redukcí kostních metastáz [90]. V současné době byl ukončen nábor pacientů do studie III. fáze testující účinnost dasatinibu v kombinaci s docetaxelem a jsou očekávány výsledky (http://clinicaltrials.gov/ct2/show/NCT00744497).
ZÁVĚR
Lepší porozumění biologické podstatě karcinomu prostaty nám pomohlo objevit nové terapeutické cíle v karcinomu prostaty zahrnující signální dráhy androgenního receptoru, kostní faktory, angiogenezi, místa kontrol buněčného cyklu, aktivaci tyrosinkinázy a sledování imunity hostitele. Během posledních deseti let byla zahájena řada klinických studií testujících nové agens zaměřené na nejrůznější mechanizmy progrese karcinomu prostaty. Tato snaha byla korunována úspěchem v podobě čtyř nových preparátů pro léčbu CRPC (cabazitaxel, sipuleucel-T, denosumab a abirateron acetát) a na obzoru se rýsují další molekuly. Dalším důležitým krokem bude definovat pravidla pro výběr vhodných kandidátů, načasování léčby a délku trvání aplikace každého z preparátů.
Dr. Fred Saad, M.D., FRCS
Professor and Chair of Urology
University of Montreal Hospital Center
1560 Sherbrooke east
Montreal, Quebec, Canada, H2L 4M1
fred.saad@umontreal.ca
Zdroje
1. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2008. CA: Cancer J Clin 2008; 58(2): 71–96.
2. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer V.2. 2009. Available at: http://www.nccn.org/ professionals/physician_gls/f_guidelines.asp. Accessed April 2011.
3. Sharifi N, Dahut WL, Steinberg SM et al. A retrospective study of the time to clinical endpoints for advanced prostate cancer. BJU Int 2005; 96(7): 985–989.
4. Hotte SJ, Saad F. Current management of castrate-resistant prostate cancer. Current oncology 2010; 17 (Suppl 2): S72–79.
5. Mohler JL, Gregory CW, Ford OH 3rd et al. The androgen axis in recurrent prostate cancer. Clin Cancer Res 2004; 10(2): 440–448.
6. Mostaghel EA, Page ST, Lin DW et al. Intraprostatic androgens and androgen-regulated gene expression persist after testosterone suppression: therapeutic implications for castration-resistant prostate cancer. Cancer Res 2007; 67(10): 5033–5041.
7. Fossa SD, Slee PH, Brausi M et al. Flutamide versus prednisone in patients with prostate cancer symptomatically progressing after androgen-ablative therapy: a phase III study of the European organization for research and treatment of cancer genitourinary group. J Clin Oncol 2001; 19(1): 62–71.
8. Knudsen KE, Scher HI. Starving the addiction: new opportunities for durable suppression of AR signaling in prostate cancer. Clin Cancer Res 2009; 15(15): 4792–4798.
9. Tannock IF, Osoba D, Stockler MR et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 1996; 14(6): 1756–1764.
10. Kantoff PW, Halabi S, Conaway M et al. Hydrocortisone with or without mitoxantrone in men with hormone-refractory prostate cancer: results of the cancer and leukemia group B 9182 study. J Clin Oncol 1999; 17(8): 2506–2513.
11. Petrylak DP, Tangen CM, Hussain MH et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351(15): 1513–1520.
12. Tannock IF, de Wit R, Berry WR et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351(15): 1502–1512.
13. Winquist E, Waldron T, Berry S et al. Non-hormonal systemic therapy in men with hormone-refractory prostate cancer and metastases: a systematic review from the Cancer Care Ontario Program in Evidence-based Care's Genitourinary Cancer Disease Site Group. BMC Cancer 2006; 6 : 112.
14. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer. Available at: www.nccn.org/professionals//physician_gls/PDF/prostate.pdf Accessed April 2011.
15. Loriot Y, Massard C, Gross-Goupil M et al. The interval from the last cycle of docetaxel-based chemotherapy to progression is associated with the efficacy of subsequent docetaxel in patients with prostate cancer. Eur J Cancer 2010; 46(10): 1770–1772.
16. de Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376(9794): 1147–1154.
17. Galsky MD, Small EJ, Oh WK et al. Multi-institutional randomized phase II trial of the epothilone B analog ixabepilone (BMS-247550) with or without estramustine phosphate in patients with progressive castrate metastatic prostate cancer. J Clin Oncol 2005; 23(7): 1439–1446.
18. Rosenberg JE, Galsky MD, Rohs NC et al. A retrospective evaluation of second-line chemotherapy response in hormone-refractory prostate carcinoma: second line taxane-based therapy after first-line epothilone-B analog ixabepilone (BMS-247550) therapy. Cancer 2006; 106(1): 58–62.
19. Small E, Harzstark A, Weinberg VK et al. Ixabepilone, mitoxantrone, and prednisone in patients with metastatic castration-resistant prostate cancer refractory to docetaxel-based therapy: A phase II study of the DOD Prostate Cancer Clinical Trials Consortium. J Clin Oncol 2009; 27.
20. Beardsley EK, Saad F, Eigl B et al. A phase II study of patupilone in patients (pts) with metastatic castration - resistant prostate cancer (CRPC) who have progressed after docetaxel. J Clin Oncol 2009; 27.
21. Chi KN, Beardsley EK, Venner PM et al. A phase II study of patupilone in patients with metastatic hormone refractory prostate cancer (HRPC) who have progressed after docetaxel. J Clin Oncol 2008; 26.
22. Tetu B, Ro JY, Ayala AG et al. Small cell carcinoma of the prostate. Part I. A clinicopathologic study of 20 cases. Cancer 1987; 59(10): 1803–1809.
23. Sternberg CN, Petrylak DP, Sartor O et al. Multinational, double-blind, phase III study of prednisone and either satraplatin or placebo in patients with castrate-refractory prostate cancer progressing after prior chemotherapy: the SPARC trial. J Clin Oncol 2009; 27(32): 5431–5438.
24. Zhu W, Zhu DS, Madan RA et al. Treatment of castration-resistant prostate cancer: updates on therapeutics targeting the androgen receptor signaling pathway. Am J Ther 2010; 17(2): 176–181.
25. Sciarra A, Cardi A, Di Silverio F. Antiandrogen monotherapy: recommendations for the treatment of prostate cancer. Urol Int 2004; 72(2): 91–98.
26. Cox RL, Crawford ED. Estrogens in the treatment of prostate cancer. J Urol 1995; 154(6): 1991–1998.
27. Potter GA, Barrie SE, Jarman M et al. Novel steroidal inhibitors of human cytochrome P45017 alpha (17 alpha-hydroxylase-C17,20-lyase): potential agents for the treatment of prostatic cancer. J Med Chem 1995; 38(13): 2463–2471.
28. Barrie SE, Potter GA, Goddard PM et al. Pharmacology of novel steroidal inhibitors of cytochrome P450(17) alpha (17 alpha-hydroxylase/C17-20 lyase). J Steroid Biochem Mol Biol 1994; 50(5–6): 267–273.
29. Attard G, Reid AH, A'Hern R et al. Selective inhibition of CYP17 with abiraterone acetate is highly active in the treatment of castration-resistant prostate cancer. J Clin Oncol 2009; 27(23): 3742–3748.
30. Danila DC, Morris MJ, de Bono JS et al. Phase II multicenter study of abiraterone acetate plus prednisone therapy in patients with docetaxel-treated castration-resistant prostate cancer. J Clin Oncol 2010; 28(9): 1496–1501.
31. Ryan CJ, Smith MR, Fong L et al. Phase I clinical trial of the CYP17 inhibitor abiraterone acetate demonstrating clinical activity in patients with castration-resistant prostate cancer who received prior ketoconazole therapy. J Clin Oncol 2010; 28(9): 1481–1488.
32. Saad F, de Bono JS, Haqq CM et al. Abiraterone acetate plus low-dose prednisone has a favorable safety profile, improves survival and produces PSA and radiographic responses in metastatic castration--resistant prostate cancer progressing after docetaxel--based chemotherapy: results from COU-AA-301, a randomized, double-blind, placebo-controlled, phase III study. J Urol 2011;1 85: e283.
33. Dreicer R, Agus DB, MacVicar GR et al. Safety, pharmacokinetics, and efficacy of TAK-700 in metastatic castration-resistant prostrate cancer: A phase I/II, open-label study. J Clin Oncol 2010; 28: abstract 3084.
34. Tran C, Ouk S, Clegg NJ et al. Development of a second-generation antiandrogen for treatment of advanced prostate cancer. Science 2009; 324(5928): 787–790.
35. Scher HI, Beer TM, Higano CS et al. Antitumour activity of MDV3100 in castration-resistant prostate cancer: a phase 1-2 study. Lancet 2010; 375(9724): 1437–1446.
36. George DJ, Halabi S, Shepard TF et al. Prognostic significance of plasma vascular endothelial growth factor levels in patients with hormone-refractory prostate cancer treated on Cancer and Leukemia Group B 9480. Clin Cancer Res 2001; 7(7): 1932–1936.
37. Melnyk O, Zimmerman M, Kim KJ et al. Neutralizing anti-vascular endothelial growth factor antibody inhibits further growth of established prostate cancer and metastases in a pre-clinical model. J Urol 1999; 161(3): 960–963.
38. Picus J, Halabi S, Kelly WK et al. A phase 2 study of estramustine, docetaxel, and bevacizumab in men with castrate-resistant prostate cancer: results from Cancer and Leukemia Group B Study 90006. Cancer 2011; 117(3): 526–533.
39. Kelly WK, Halabi S, Carducci MA et al. A randomized, double-blind, placebo-controlled phase III trial comparing docetaxel, prednisone, and placebo with docetaxel, prednisone, and bevacizumab in men with metastatic castration-resistant prostate cancer (mCRPC): Survival results of CALGB 90401. J Clin Oncol 2010; 28: abstract LBA4511.
40. Verheul HM, Hammers H, van Erp K et al. Vascular endothelial growth factor trap blocks tumor growth, metastasis formation, and vascular leakage in an orthotopic murine renal cell cancer model. Clin Cancer Res 2007; 13(14): 4201–4208.
41. Isambert N, Freyer G, Zanetta S et al. A phase I dose escalation and pharmacokinetic (PK) study of intravenous aflibercept (VEGF trap) plus docetaxel (D) in patients (pts) with advanced solid tumors: Preliminary results. J Clin Oncol 2008; 26: abstract 3599.
42. Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356(2): 115–124.
43. Sonpavde G, Periman PO, Bernold D et al. Sunitinib malate for metastatic castration-resistant prostate cancer following docetaxel-based chemotherapy. Annals of oncology 2010; 21(2): 319–324.
44. Dahut WL, Gulley JL, Arlen PM et al. Randomized phase II trial of docetaxel plus thalidomide in androgen-independent prostate cancer. J Clin Oncol 2004; 22(13): 2532–2539.
45. Petrylak DP, Resto-Garces K, Tibyan M et al. A phase I open-label study using lenalidomide and docetaxel in castration - resistant prostate cancer. J Clin Oncol 2009; 27, 15s.
46. Pili R, Haggman M, Stadler WM et al. A randomized, multicenter, international phase II study of tasquinimod in chemotherapy naďve patients with metastatic castrate-resistant prostate cancer (CRPC). J Clin Oncol 2010; 28.
47. Small EJ, Fratesi P, Reese DM et al. Immunotherapy of hormone-refractory prostate cancer with antigen-loaded dendritic cells. J Clin Oncol 2000; 18(23): 3894–3903.
48. Kantoff PW, Higano CS, Shore ND et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363(5): 411–422.
49. Small EJ, Schellhammer PF, Higano CS et al. Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer. J Clin Oncol 2006; 24(19): 3089–3094.
50. Higano CS, Schellhammer PF, Small EJ et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 2009; 115(16): 3670–3679.
51. Madan RA, Arlen PM, Mohebtash M et al. Prostvac-VF: a vector-based vaccine targeting PSA in prostate cancer. Expert Opin Investig Drugs 2009; 18(7): 1001–1011.
52. Kantoff PW, Schuetz TJ, Blumenstein BA et al. Overall survival analysis of a phase II randomized controlled trial of a Poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancer. J Clin Oncol 2010; 28(7): 1099–1105.
53. Antonarakis ES, Carducci MA, Eisenberger MA. Novel targeted therapeutics for metastatic castration-resistant prostate cancer. Cancer Lett 2010; 291(1): 1–13.
54. Small EJ, Sacks N, Nemunaitis J et al. Granulocyte macrophage colony-stimulating factor--secreting allogeneic cellular immunotherapy for hormone-refractory prostate cancer. Clin Cancer Res 2007; 13(13): 3883–3891.
55. Higano CS, Corman JM, Smith DC et al. Phase 1/2 dose-escalation study of a GM-CSF-secreting, allogeneic, cellular immunotherapy for metastatic hormone-refractory prostate cancer. Cancer 2008; 113(5): 975–984.
56. Small E, Demkow T, Gerritsen WR et al. A phase III trial of GVAX immunotherapy for prostate cancer in combination with docetaxel versus docetaxel plus prednisone in symptomatic, castration-resistant prostate cancer (CRPC). Available at: http://www. asco.org/ ascov2/Meetings/Abstracts?&vmview=abst_detail_view&confID=64&abstractID=20295 2009; Abstract #7.
57. Cell Genesys Inc: Cell Genesys Halts VITAL-2 GVAX Trial in Advanced Prostate Cancer. Available at: http://www.drugs.com/news/cell-genesys-halts-vital-2-gvax-trial-advanced-prostate-cancer-13371.html16, 2008.
58. Chambers CA, Kuhns MS, Egen JG et al. CTLA-4-mediated inhibition in regulation of T cell responses: mechanisms and manipulation in tumor immunotherapy. Annu Rev Immunol 2001; 19 : 565–594.
59. Tollefson MK, Karnes RJ, Thompson RH et al. A randomized phase II study of ipilimumab with androgen ablation compared with androgen ablation alone in patients with advanced prostate cancer. Available at: http://www.asco.org/ascov2/Meetings/ Abstracts?&vmview=abst_detail_view&confID=73&abstractID=30897 2010.
60. Miyake H, Nelson C, Rennie PS et al. Testosterone-repressed prostate message-2 is an antiapoptotic gene involved in progression to androgen independence in prostate cancer. Cancer Res 2000; 60(1): 170–176.
61. July LV, Akbari M, Zellweger T et al. Clusterin expression is significantly enhanced in prostate cancer cells following androgen withdrawal therapy. Prostate 2002; 50(3): 179–188.
62. Saad F, Hotte SJ, North SA et al. A phase II randomized study of custirsen (OGX-011) combination therapy in patients with poor-risk hormone refractory prostate cancer (HRPC) who relapsed on or within six months of 1st-line docetaxel therapy. J Clin Oncol 2008; 26.
63. Chi KN, Hotte JS, Yu EY et al. Randomized Phase II Study of Docetaxel and Prednisone With or Without OGX-011 in Patients With Metastatic Castration-Resistant Prostate Cancer. J Clin Oncol 2010; 28(27): 4247–4254.
64. Krueckl SL, Sikes RA, Edlund NM et al. Increased insulin-like growth factor I receptor expression and signaling are components of androgen-independent progression in a lineage-derived prostate cancer progression model. Cancer Res 2004; 64(23): 8620–8629.
65. Higano C, Alumkal J, Ryan CJ et al. A phase II study evaluating the efficacy and safety of single agent IMC A12, a monoclonal antibody (MAb), against the insulin-like growth factor-1 receptor (IGF-IR), as monotherapy in patients with metastastic, asymptomatic castration-resistant prostate cancer (CRPC). J Clin Oncol 2009; 27.
66. Akhavan A, McHugh KH, Guruli G et al. Endothelin receptor A blockade enhances taxane effects in prostate cancer. Neoplasia 2006; 8(9): 725–732.
67. Nelson JB, Hedican SP, George DJ et al. Identification of endothelin-1 in the pathophysiology of metastatic adenocarcinoma of the prostate. Nat Med 1995; 1(9): 944–949.
68. Yin JJ, Mohammad KS, Kakonen SM et al. A causal role for endothelin-1 in the pathogenesis of osteoblastic bone metastases. Proc Natl Acad Sci U S A 2003; 100(19): 10954–10959.
69. Carducci MA, Nelson JB, Bowling MK et al. Atrasentan, an endothelin-receptor antagonist for refractory adenocarcinomas: safety and pharmacokinetics. J Clin Oncol 2002; 20(8): 2171–2180.
70. Carducci MA, Saad F, Abrahamsson PA et al. A phase 3 randomized controlled trial of the efficacy and safety of atrasentan in men with metastatic hormone-refractory prostate cancer. Cancer 2007; 110(9): 1959–1966.
71. Nelson JB, Love W, Chin JL et al. Phase 3, randomized, controlled trial of atrasentan in patients with nonmetastatic, hormone-refractory prostate cancer. Cancer 2008; 113(9): 2478–2487.
72. James ND, Caty A, Payne H et al. Final safety and efficacy analysis of the specific endothelin A receptor antagonist zibotentan (ZD4054) in patients with metastatic castration-resistant prostate cancer and bone metastases who were pain-free or mildly symptomatic for pain: a double-blind, placebo-controlled, randomized Phase II trial. BJU Int 2010; 106(7): 966–973.
73. Peehl DM, Skowronski RJ, Leung GK et al. Antiproliferative effects of 1,25-dihydroxyvitamin D3 on primary cultures of human prostatic cells. Cancer Res 1994; 54(3): 805–810.
74. Beer TM, Ryan CW, Venner PM et al. Double-blinded randomized study of high-dose calcitriol plusdocetaxel compared with placebo plus docetaxel in androgen-independent prostate cancer: a report from the ASCENT Investigators. J Clin Oncol 2007; 25(6): 669–674.
75. Scher HI, Chi KN, De Wit R et al. Docetaxel (D) plus high-dose calcitriol versus D plus prednisone (P) for patients (Pts) with progressive castration-resistant prostate cancer (CRPC): Results from the phase III ASCENT2 trial. J Clin Oncol 2010; 28.
76. Weinfurt KP, Li Y, Castel LD et al. The significance of skeletal-related events for the health-related quality of life of patients with metastatic prostate cancer. Ann Oncol 2005; 16(4): 579–584.
77. Diamond TH, Higano CS, Smith MR et al. Osteoporosis in men with prostate carcinoma receiving androgen-deprivation therapy: recommendations for diagnosis and therapies. Cancer 2004; 100(5): 892–899.
78. Preston DM, Torrens JI, Harding P et al. Androgen deprivation in men with prostate cancer is associated with an increased rate of bone loss. Prostate Cancer Prostatic Dis 2002; 5(4): 304–310.
79. Smith MR, McGovern FJ, Zietman AL et al. Pamidronate to prevent bone loss during androgen-deprivation therapy for prostate cancer. N Engl J Med 2001; 345(13): 948–955.
80. Smith MR, Eastham J, Gleason DM et al. Randomized controlled trial of zoledronic acid to prevent bone loss in men receiving androgen deprivation therapy for nonmetastatic prostate cancer. J Urol 2003; 169(6): 2008–20012.
81. Saad F, Gleason DM, Murray R et al. Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 2004; 96(11): 879–882.
82. Ullen A, Lennartsson L, Harmenberg U et al. Additive/synergistic antitumoral effects on prostate cancer cells in vitro following treatment with a combination of docetaxel and zoledronic acid. Acta Oncol 2005; 44(6): 644–650.
83. Eymard JC, Oudard S, Gravis G et al. Docetaxel reintroduction in patients with metastatic castration-resistant docetaxel-sensitive prostate cancer: a retrospective multicentre study. BJU Int 2010; 106(7): 974–978.
84. Di Lorenzo G, Buonerba C, Autorino R et al. Castration-resistant prostate cancer: current and emerging treatment strategies. Drugs 2010; 70(8): 983–1000.
85. Sartor AO, Oudard S, Ozguroglu M et al. Cabazitaxel or mitoxantrone with prednisone in patients with metastatic castration-resistant prostate cancer (mCRPC) previously treated with docetaxel: Final results of a multinational phase III trial (TROPIC). Available at: http://www.asco.org/ascov2/Meetings/ /Abstracts?&vmview=abst_detail_view&confID=73&abstractID=30560 2010;Abstract 9.
86. Boyce BF, Xing L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Arch Biochem Biophys 2008; 473(2): 139–146.
87. Fizazi K, Carducci MA, Smith MR et al. Denosumab versus zoledronic acid for treatment of bone metastasis in men with castration-resistant prostate cancer: a randomized, double-blind study. The Lancet 2011; 377(9768): 813–822.
88. Fizazi K. The role of Src in prostate cancer. Ann Oncol 2007; 18(11): 1765–1773.
89. Nam S, Kim D, Cheng JQ et al. Action of the Src family kinase inhibitor, dasatinib (BMS-354825), on human prostate cancer cells. Cancer Res 2005; 65(20): 9185–9189.
90. Araujo J, Armstrong AJ, Braud EL et al. Dasatinib and docetaxel combination treatment for patients with castration-resistant progressive prostate cancer: A phase I/II study (CA180086). J Clin Oncol 2009; 27.
Štítky
Dětská urologie Urologie
Článek Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostatyČlánek Kongres Americké urologické asociace z trochu jiného pohledu aneb jak chutná vlastní medicínaČlánek Technické triky a tipy pro retroperitoneální laparoendoskopickou nefrektomii jedním portem (LESS)Článek Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýřeČlánek Karcinom ledvinyČlánek Karcinom močového měchýře
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostaty
- Nejnovější informace v oblasti terapeutických cílů a preparátů pro léčbu karcinomu prostaty rezistentního na kastrační léčbu
- Etiologie a diagnostika nádorů horních močových cest
- Ureteroskopická biopsie tumorů horních cest močových: endoskopické a cytologické techniky
- Technické triky a tipy pro retroperitoneální laparoendoskopickou nefrektomii jedním portem (LESS)
- Chemoterapie karcinomů horních cest močových
- Léčba generalizovaných nádorů ledvin: systémová imunoterapie, paliativní léčba
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Léčba nádorů, které neprorůstají do svaloviny: transuretrální resekce, nové postupy
- Chemoterapie a radioterapie u nádorů močového měchýře
- Léčba metastatických nádorů močového měchýře, systémová chemoterapie, symptomatická léčba
- Antimuskarinika a lékové interakce
- Kongres Americké urologické asociace z trochu jiného pohledu aneb jak chutná vlastní medicína
- Extrakt ze Serenoa repens při léčbě benigní hyperplazie prostaty
- Karcinom ledviny
- Karcinom močového měchýře
- EAU Guidelines pro vazektomii
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antimuskarinika a lékové interakce
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Chemoterapie a radioterapie u nádorů močového měchýře
- Karcinom močového měchýře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



