-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Umělá inteligence v cytomorfologii kostní dřeně: Morphogo a Scopio
Autoři: D. Starostka 1; R. Doležílek 2; K. Chasáková 1; P. Miczková 1; P. Kováč 2
Působiště autorů: Laboratoř hematoonkologie a klinické bio chemie, Nemocnice Havířov, p. o. 1; Oddělení patologie, Nemocnice Havířov, p. o. 2
Vyšlo v časopise: Transfuze Hematol. dnes,30, 2024, No. 1, p. 49-52.
Kategorie: Dopisy redakci
doi: https://doi.org/10.48095/cctahd2024prolekare.cz6Vážená redakce,
v rámci multidisciplinární diagnostiky v hematoonkologii jsou definovány přesné cytomorfologické znaky pro klasifikaci nádorů hematopoetické a lymfoidní tkáně a mnoha nenádorových stavů. Kostní dřeň má nejsložitější cytologický vzorec, který je tvořen více než 200 typy buněk, a správné a pečlivé hodnocení a interpretace nátěrů kostní dřeně je nepostradatelnou součástí rozpoznání převážné většiny známých hematologických neoplazmat [1–3]. Zlatým metodickým standardem v této cytomorfologické diagnostice zůstává optická mikroskopie. Tato vysoce profesionální, pracná a časově náročná analýza klade značné nároky na hluboké znalosti a dlouholeté zkušenosti příslušných odborníků a je provázena přirozenou intra-expertní a inter-expertní variabilitou související se subjektivitou hodnocení [1,4,5].
V poslední době došlo k nebývalému inovativnímu rozvoji na poli automatizované klasifikace obrazu a rozhodování s podporou umělé inteligence (AI). Management obrazových dat je charakteristickou oblastí uplatnění AI. Automatizovaná digitální morfologie s rychlým skenováním nátěrů kostní dřeně spolu s algoritmy rozpoznávání a klasifikace buněk založenými na systémech strojového i hlubokého učení (subdomény AI) představují skutečnou revoluci v morfologické analýze krevních buněk. Skenování celého sklíčka umožňuje získat komplexní digitální data během několika minut a snímání při velkém zvětšení (vysoce kvalitní 100× objektivy s olejovou imerzí) dosahuje vynikající kvality zobrazení [1,4]. Složité algoritmy AI umožňují precizní klasifikaci jednotlivých buněk a v některých případech identifikují detaily, které by lidskému oku mohly uniknout. Automatizovaná digitální morfologie též otevírá zcela netradiční způsoby interpretace obrazových dat při zobrazení skupinového buněčného kontextu analyzovaných populací [1,6,7].
Obr. 1. Pracovní algoritmus zařízení Morphogo (adaptováno dle Dr. Qian Wu, Zhiwei, China). 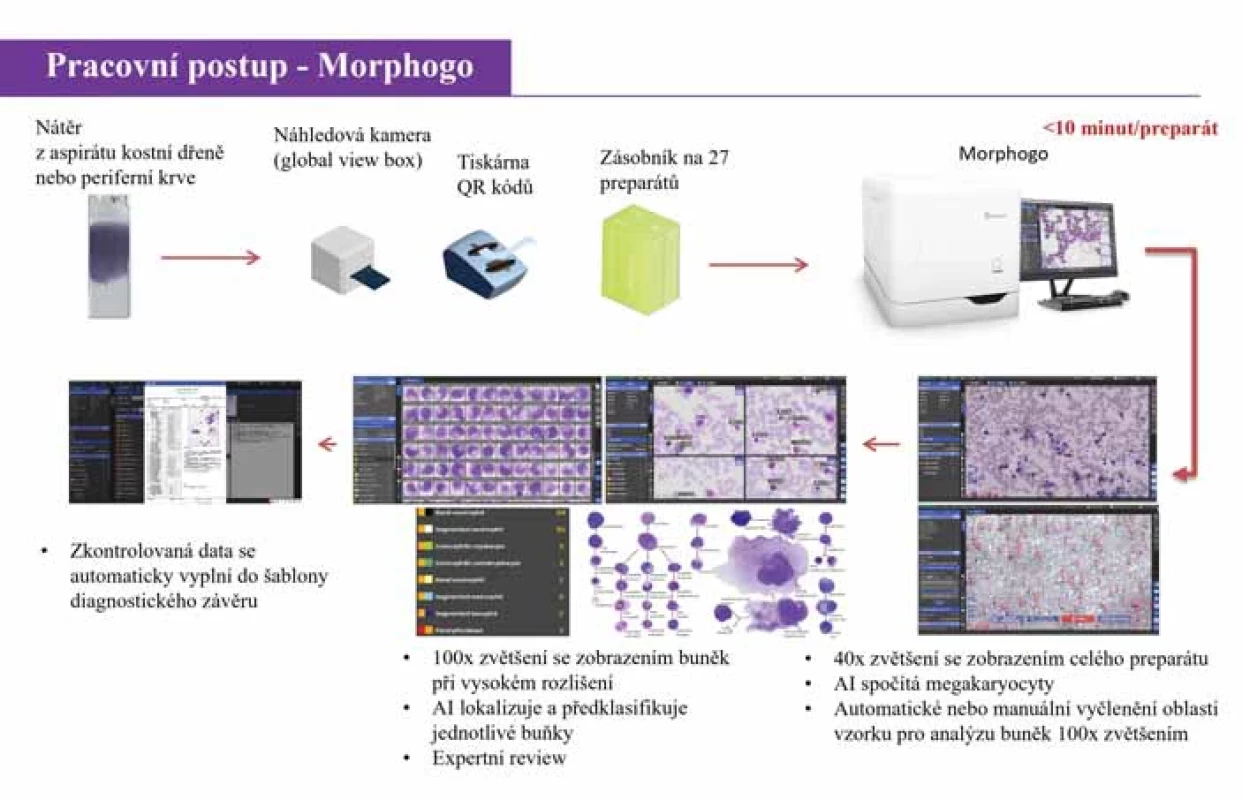
Mezi hlavní výhody automatizované digitální analýzy v hematologické cytomorfologii patří bezprecedentní rychlost zpracování, eliminace subjektivity hodnocení, snížení oční zátěže personálu a možnost distančního přístupu. Snížení analytické subjektivity je spojeno se zvýšením kvality a standardizace a procesní harmonizací. Digitalizace obrazu přináší také významné snížení počtu revizí nátěrů periferní krve optickou mikroskopií a s tím související časovou a ekonomickou úsporu. Virtuální preparáty se v průběhu času neznehodnocují a mají minimální prostorové nároky na skladování. Též jsou trvale disponibilní pro revize, konzultace a publikace a slouží k vytváření digitálních obrazových archivů, rozsáhlých didaktických databází a knihoven. V tomto ohledu jde o zásadní změnu v edukaci odborného personálu zvyšující rychlost, kvalitu, efektivitu a komplexnost tohoto procesu [1,2,4,6,7]. Automatizovaná digitální analýza kostní dřeně má mimořádný potenciál minimálně v některých ohledech překonat obrazovou, klasifikační a diagnostickou ekvivalenci s konvenční analýzou v rutinní praxi [2,4,7].
AI nachází uplatnění také v dalších metodách diagnostické hematoonkologie. Digitální morfologie má své místo v hematopatologii. V průtokové cytometrii se AI zatím nevyužívá rutinně, ovšem klasifikátory s podporou AI byly navrženy např. pro kvantitativní imunofenotypizaci zralých lymfocytárních neoplázií a automatickou kvantifikaci minimální reziduální choroby [1,8,9].
Pro předběžnou klasifikaci buněk periferní krve v běžné laboratorní praxi již dlouhou dobu existují různé komerční platformy s mimořádně vysokou kvalitou zobrazení a sofistikovaně propracovaným algoritmickým softwarem. Nejrozšířenější systém CellaVision (Lund, Švédsko) dokáže kompletně skenovat nátěr periferní krve, vyhledávat buňky, zaznamenávat jejich obraz ve vysokém rozlišení a provádět předběžnou klasifikaci. Expert pak reviduje navrženou klasifikaci buněk [6]. Tyto systémy významným způsobem ovlivňují workflow v hematologických laboratořích.
Morphogo (Zhiwei, Hangzhou, Čína) je unikátní automatické cytopatologické zařízení s certifikací CE-IVDR (In vitro Medical Devices Regulation), které má integrovaný skenovací hardware a software řízený AI na základě hlubokého učení (CNN, konvoluční neuronové sítě). Tento přístroj používaný od roku 2019 dokáže plně skenovat nátěry periferní krve a kostní dřeně. Vysoce inovativní samoučící algoritmus rozpoznávání buněk, jehož iniciální trénink byl proveden na 9 mil. buněk, je schopen lokalizovat a předběžně klasifikovat jaderné buňky kostní dřeně a provádět statistickou analýzu pro kompletaci myelogramu. Počet analyzovaných jaderných elementů je volitelný, výběr oblasti pro záznam s vysokým rozlišením se provádí automaticky nebo manuálně. Morphogo je schopen rozlišit 35 buněčných typů v kostní dřeni a periferní krvi. Zařízení rovněž ukládá kompletní datové informace ve formě digitálních obrázků na svém lokálním serveru [5,7]. Tento systém je leaderem v oblasti digitalizace kostní dřeně s významným potenciálním dopadem na pracovní postupy hematologických laboratoří [7]. Publikace týkající se Morphogo jsou zaměřeny téměř výhradně na cytomorfologii kostní dřeně, vč. cenných validačních dat v asijské populaci [5,7,10,11]. Rozsáhlé validační studie prokázaly, že Morphogo má vysokou přesnost v klasifikaci buněk vč. robustní a stabilní shody s profesionálními hematopatology [5,10,11]. V poslední publikované studii dosahovala klasifikační přesnost 99 % a u většiny buněčných typů zastoupených v kostní dřeni byla prokázána mimořádně vysoká korelace s hematopatologickou expertizou [11]. Morphogo dokáže v kostní dřeni také identifikovat a členit elementy megakaryopoézy a rozpoznat metastatické nádorové buňky [12,13]. Kromě toho lze předpokládat, že v rámci zralých lymfocytárních novotvarů by další trénink a zdokonalování rozpoznávacích algoritmů mohly umožnit také subklasifikaci do specifických diagnostických jednotek [14] (obr. 1).
Scopio (Scopio Labs, Tel Aviv, Izrael) je dalším komerčně dostupným zařízením pro automatizovanou digitální morfologii periferní krve a kostní dřeně. Stejně jako Morphogo poskytuje tento přístroj možnost skenování nátěrů periferní krve a kostní dřeně, lokalizace jaderných elementů a jejich obrazového záznamu a klasifikace, na jejímž základě provádí sestavení myelogramu. Modely AI zajišťující tyto procesy byly trénovány na rozsáhlých a různorodých souborech dat s expertní podporou předních odborníků v oblasti hematologie a patologie a fungují plně v souladu s doporučením ICSH (Mezinárodní výbor pro standardizaci v hematologii). Detailní datové informace obrazového charakteru jsou plně digitalizovány a archivovány. Tento systém pro podporu rozhodování umožnuje uživateli přidat do diferenciálního rozpočtu též buňky mimo oblast automatické analýzy. Platforma disponuje standardní multilicencí pro distanční přístup využívající internet. Vynikající výsledky systému Scopio při vyšetření periferní krve jsou dobře zdokumentovány [15]. Efektivita současného modulu pro hodnocení kostní dřeně vycházejícího též z analýzy rizik byla ověřena v klinické studii. Software je pravidelně aktualizován a validován. Publikace pojednávající detailně o komplexní validaci uvedeného klasifikačního systému je v současné době v recenzním řízení a certifikace CE-IVDR a plná komercionalizace se očekává v horizontu několika měsíců (obr. 2).
Obr. 2. Dvě kapacitní varianty zařízení Scopio, laskavostí fi rmy Beckman Coulter. 
Autoři tohoto článku měli příležitost absolvovat studijní pobyt v laboratoři prof. Kvasnicky na Instituts für Pathologie und Molekularpathologie, Helios Universitätsklinikum Wuppertal, a vyšetřit v této laboratoři 333 nátěrů kostní dřeně s využitím zařízení Morphogo. Na základě prvních zkušeností lze mezi další přednosti automatizované digitální morfologie zařadit:
- objektivní stanovení celularity kostní dřeně;
- objektivizaci kontaminace dřeňového aspirátu periferní krví;
- přehledné a instruktivní zobrazení celulárního kontextu klasifikace;
- předběžnou klasifikaci hraničních vývojových forem v jednotlivých liniích;
- předběžnou klasifikaci interliniových hraničních forem;
- nabídku alternativních možností klasifikace na základě klasifikační pravděpodobnosti;
- významné zvýšení spolehlivosti klasifikace monocytů a vývojových stadií v monocytární linii vč. klasifikace monoblastů;
- možnost rozlišení fyziologických a patologických subpopulací v rámci jednoho buněčného vývojového typu nebo vývojové linie;
- předběžnou klasifikaci při snížené kvalitě zobrazení;
- uvedení údaje o velikosti buňky;
- přehledné a kvalitní zobrazení vysokého počtu megakaryocytů;
- kontextuální zobrazení morfologických změn megakaryocytů;
- automatizované rozpoznání megaloblastových změn.
Diagnostika s pomocí AI má obrovský potenciál pro další zdokonalení a inovativní proměnu hematoonkologické praxe. Před všeobecnou implementací AI v cytomorfologii kostní dřeně a systémovou integrací této metody do rutinní multidisciplinární diagnostiky je třeba cizelovat procesní standardizaci zahrnující standardizaci metody barvení, velikosti a kvality obrazu, rozpoznávání buněk a kvalitativního hodnocení a procesní harmonizaci [1]. Další výzvou je pečlivé provedení podrobnějších validačních studií zahrnujících hodnocení klasifikační a interpretační (diagnostické) validity digitální morfologie. Detailní validační údaje pro kavkazskou populaci neexistují a doposud nebyly spolehlivě identifikovány limitace metody stejně jako její problematické diagnostické oblasti, které mohou významně sloužit k dalšímu zdokonalení aplikačního software. Velký prostor zůstává také pro uplatnění AI v rozpoznávání kvalitativních změn vč. liniových dysplastických rysů, v hlubším studiu morfologie megakaryopoézy a prognostického významu patomorfologických změn [1]. Ukládání digitálních dat klade značné nároky na kapacitu úložišť, zálohovací systémy a kybernetickou bezpečnost. Výzkumní pracovníci a zdravotníci by si také měli být vědomi relativně vysokých nákladů na systémy a zařízení pro digitální morfologii [1].
Přestože technologický pokrok využívající AI v analýze kostní dřeně nelze zastavit, bude pro finální celulární klasifikaci a diagnostickou interpretaci vždy zcela nezbytný vysoce kvalifikovaný a zkušený morfolog, přičemž expertiza zůstává trvale absolutním základem cytomorfologické diagnostiky v hematoonkologii.
Zdroje
1. Starostka D, Dolezilek R, Chasakova K. Artificial intelligence increases reliability in diagnostic hematooncology. J Clin Transl Pathol. 2023; 3 (3): 146–147. doi: 10.14218/JCTP.2023. 00015.
2. Zini G, Barbagallo O, Scavone F, Béné MC. Digital morphology in hematology diagnosis and education: The experience of the European LeukemiaNet WP10. Int J Lab Hematol. 2022; 44 (Suppl 1): 37–44. doi: 10.1111/ijlh.13908.
3. Xing Y, Liu X, Dai J, et al. Artificial intelligence of digital morphology analyzers improves the efficiency of manual leukocyte differentiation of peripheral blood. BMC Med Inform Decis Mak. 2023; 23 (1): 50. doi: 10.1186/s12911-023-02153-z.
4. Kratz A, Lee SH, Zini G, Riedl JA, Hur M, Machin S. International Council for Standardization in Haematology. Digital morphology analyzers in hematology: ICSH review and recommendations. Int J Lab Hematol. 2019; 41 (4): 437–447. doi: 10.1111/ijlh.13042.
5. Jin H, Fu X, Cao X, et al. Developing and preliminary validating an automatic cell classification system for bone marrow smears: a pilot study. J Med Syst. 2020; 44 (10): 184. doi: 10.1007/s10916-020-01654-y.
6. Walter W, Haferlach C, Nadarajah N, et al. How artificial intelligence might disrupt diagnostics in hematology in the near future. Oncogene. 2021; 40 (25): 4271–4280. doi: 10.1038/s41388-021-0 1861-y.
7. Lin E, Fuda F, Luu HS, et al. Digital pathology and artificial intelligence as the next chapter in diagnostic hematopathology. Semin Diagn Pathol. 2023; 40 (2): 88–94. doi: 10.1053/j.semdp.2023.02.001.
8. Starostka D, Kriegova E, Kudelka M, et al. Quantitative assessment of informative immunophenotypic markers increases the diagnostic value of immunophenotyping in mature CD5-positive B-cell neoplasms. Cytometry B Clin Cytom. 2018; 94 (4): 576–587. doi: 10.1002/cyto.b. 21607.
9. Bazinet A, Wang A, Li X, et al. Automated quantification of measurable residual disease in chronic lymphocytic leukemia using an artificial intelligence-assisted workflow. Cytometry B Clin Cytom. 2023. Published on-line: February 23. doi: 10.1002/cyto.b.22116.
10. Fu X, Fu M, Li Q, et al. Morphogo: an automatic bone marrow cell classification system on digital images analyzed by artificial intelligence. Acta Cytol. 2020; 64 (6): 588–596. doi: 10.1159/000509524.
11. Lv Z, Cao X, Jin X, Xu S, Deng H. High-accuracy morphological identification of bone marrow cells using deep learning-based Morphogo system. Sci Rep. 2023; 13 (1): 13364. doi: 10.1038/s41598-023-40424-x.
12. Wang X, Wang Y, Qi C, et al. The application of Morphogo in the detection of megakaryocytes from bone marrow digital images with convolutional neural networks. Technol Cancer Res Treat. 2023; 22 : 15330338221150069. doi: 10.1177/15330338221150069.
13. Chen P, Chen Xu R, Chen N, et al. Detection of metastatic tumor cells in the bone marrow aspirate smears by artificial intelligence (AI) -based Morphogo system. Front Oncol. 2021; 11 : 742395. doi: 10.3389/fonc.2021.742395.
14. Tang G, Fu X, Wang Z, Chen M. A Machine learning tool using digital microscopy (Morphogo) for the identification of abnormal lymphocytes in the bone marrow. Acta Cytol. 2021; 65 (4): 354–357. doi: 10.1159/000518382.
15. Katz B-Z, Feldman MD, Tessema M, et al. Evaluation of Scopio Labs X100 Full Field PBS: The first high-resolution full field viewing of peripheral blood specimens combined with artificial intelligence-based morphological analysis. Int J Lab Hematol. 2021; 43 (6): 1408–1416. doi: 10.1111/ijlh.13681.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
DS, RD – příprava rukopisuKCH, PM – revize rukopisuPK – příprava obrazové dokumentaceČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 27. 9. 2023.
Přijato po recenzi dne: 24. 10. 2023.MUDr. David Starostka, Ph.D.
Laboratoř hematoonkologie a klinické biochemie
Nemocnice s poliklinikou Havířov, p. o.
Dělnická 1132/24
736 01 Havířov
e-mail: david.starostka@nemhav.czŠtítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2024 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Terapie zacílená proti antigenu CD19 u difuzního velkobuněčného B-lymfomu
- Deskriptivní epidemiologie vybraných hematoonkologických onemocnění v České republice
- Editorial
- Protilátka anti-Kpb v těhotenství
- Mnohočetný myelom s primárním multifokálním extramedulárním postižením a raritní cytogenetickou změnou
- Umělá inteligence v cytomorfologii kostní dřeně: Morphogo a Scopio
- 16. Střešovický transfuzní den „Krví přenosné infekce – staré i nové hrozby“
- Certifikovaný kurz „Walking Blood Bank“
- Cena České hematologické společnosti ČLS JEP za nejlepší publikaci v oboru hematologie v roce 2023.
- Prof. MUDr. Jaroslav Čermák, CSc. – jubilující
- Jubileum profesora Romana Hájka
- Monoklonální gamapatie klinického významu a další nemoci
- Ibrutinib s venetoklaxem s fixní délkou podávání v první linii léčby CLL – pětiletá data ze studií CAPTIVATE a GLOW
- Možnosti léčby pacientů s AML s nepříznivým rizikem v roce 2024
- Současné možnosti použití ivosidenibu v terapii akutní myeloidní leukemie
- Nový inhibitor BTK píše novou kapitolu léčby CLL
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapie zacílená proti antigenu CD19 u difuzního velkobuněčného B-lymfomu
- Deskriptivní epidemiologie vybraných hematoonkologických onemocnění v České republice
- Umělá inteligence v cytomorfologii kostní dřeně: Morphogo a Scopio
- Mnohočetný myelom s primárním multifokálním extramedulárním postižením a raritní cytogenetickou změnou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



