-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapie zacílená proti antigenu CD19 u difuzního velkobuněčného B-lymfomu
Therapy targeting CD19 antigen in diffuse large B-cell lymphoma
Diffuse large B-cell lymphoma (DLBCL) is the most common type of malignant lymphoma in the Czech Republic. It represents a very heterogeneous group of aggressive tumors with diverse biology, and varied clinical manifestations. The standard of therapy is based on immunotherapy targeted against the CD20 antigen of the tumor cells. The combination of the monoclonal antibody rituximab with chemotherapy has historically demonstrated a major benefit of cytotoxic immunity mechanisms in patients. This therapeutic concept, which has historically led to cure in nearly two-thirds of patients, has encountered its limits. Research into alternative immunotherapy approaches has led to the introduction of a generationally successful new class of drugs targeting the CD19 antigen with different mechanisms of action ranging from simple antibody action (tafasitamab) to antibody-drug conjugate (ADC) administration (loncastuximab-tesirine), to the formation of sophisticated CAR-T lymphocyte chimeric constructs (axicabtagene ciloleucel, tisagenlecleucel and lisocabtagene maraleucel). The review aims to summarize the findings of advanced medical research of new molecules, their sequences, and combinations with implications for therapeutic practice in the Czech Republic.
Keywords:
immunotherapy – Monoclonal antibodies – CD19 antigen – diff use large B-cell lymphoma
Autoři: Viktor Procházka 1
; V. Hanáčková 1; L. Henzlová 2; P. Flodr 3; T. Papajík 1
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc 1; Klinika nukleární medicíny LF UP a FN Olomouc 2; Ústav klinické a molekulární patologie, LF UP a FN Olomouc 3
Vyšlo v časopise: Transfuze Hematol. dnes,30, 2024, No. 1, p. 13-25.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd2024prolekare.cz2Souhrn
Difuzní velkobuněčný B-lymfom (diffuse large B-cell lymphoma – DLBCL) je nejčastějším typem maligního lymfomu v České republice. Tento zastřešující termín ve skutečnosti reprezentuje velmi heterogenní skupinu agresivních nádorů s různorodou biologií, pestrými klinickými projevy, u nichž je standardem terapie koncept imunoterapie zacílené proti antigenu CD20 nádorových buněk. Kombinace monoklonální protilátky rituximabu s chemoterapií historicky ukázala zásadní přínos mechanizmů cytotoxické imunity nemocného. Tento terapeutický koncept, který historicky vedl k vyléčení u téměř 2/3 nemocných, narazil na své limity. Výzkum alternativních postupů imunoterapie vedl k zavedení generačně nové úspěšné skupiny léčiv zacílené proti antigenu CD19 s různým mechanizmem účinku, od prostého působení protilátky (tafasitamab) přes podání konjugátu protilátky a toxinu (antibody-drug conjugate – ADC; loncastuximab-tesirine) po tvorbu sofistikovaných chimerických konstruktů CAR-T lymfocytů axicabtagene ciloleucel, tisagenlecleucel a lisocabtagene maraucel. Review má za cíl shrnout poznatky pokročilého medicínského výzkumu nových molekul, jejich sekvence a kombinace s přesahem do léčebné praxe v podmínkách České republiky.
Klíčová slova:
monoklonální protilátky – imunoterapie – difuzní velkobuněčný B-lymfom – antigen CD19
ÚVOD
Skupina velkobuněčných B-lymfomů zahrnuje široké spektrum nádorů. Ačkoli jsou obvykle tvořeny středně velkými až velkými buňkami s kulatými až ovoidními jádry a vezikulárním chromatinem, mohou se objevit i případy se středně velkými a blastoidními buňkami. Aktuální verze klasifikace lymfoidních malignit Světové zdravotnické organizace (World Health Organization – WHO) rozeznává krom „obecného“ difuzního velkobuněčného B-lymfomu (diffuse large B-cell lymphoma, not otherwise specified – DLBCL NOS) 17 dalších specifických jednotek, kam spadají i tzv. high-grade B-cell lymphoma (HGBL) [1]. Pro účely tohoto review budeme užívat obecný „zastřešující“ pojem difuzní velkobuněčný B-lymfom, s tím, že tam, kde je to relevantní, bude popsán konkrétní typ v souladu s klasifikací WHO-HAEM5. Difuzní velkobuněčný B-lymfom je nejčastějším podtypem nehodgkinského lymfomu (NHL), který tvoří třetinu všech nově diagnostikovaných NHL [2]. Odhaduje se, že v České republice je ročně diagnostikováno kolem 600 nemocných s DLBCL [3].
Iniciální chemoimunoterapie rituximabem, cyklofosfamidem, doxorubicinem, vinkristinem a prednisonem (R-CHOP) vede přibližně u 60–70 % pacientů k dlouhodobé remisi [4]. U těch, u nichž dojde k relapsu, je standardem podání záchranné chemoimunoterapie platinovým režimem následované autologní transplantací kmenových buněk (autologous stem-cell transplantation – ASCT) [5]. Pro tuto terapii je bohužel vhodná menšina nemocných z důvodu komorbidit, pokročilého věku nebo onemocnění, které je rezistentní na chemoterapii [6–8]. Pacienti, kteří nejsou kandidáty pro ASCT nebo kteří relabují do 12 měsíců, mají po tomto postupu velmi nepříznivou prognózu, přičemž medián přežití se odhaduje na méně než 12 měsíců [9–11].
Dostupná léčba relabovaného nebo refrakterního (R/R) DLBCL prošla od roku 2017 dramatickou změnou. Pokroky v základním a translačním medicínském výzkumu vedly ke generačnímu posunu v možnostech imunoonkologické léčby lymfoidních malignit. Tyto inovace vyvrcholily schválením osmi inovativních preparátů pro léčbu pacientů s R/R DLBCL americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration – FDA).
Patří mezi ně např. monoklonální protilátky zaměřené proti CD19 antigenu, konjugáty protilátky a toxinu, bispecifické protilátky, modifikované autologní T-lymfocyty (chimérické antigenní receptory vložené do T-lymfocytu, CAR-T). Klinický přínos těchto nových modalit se liší a je ovlivněn stavem nemocného, aktivitou onemocnění i typem předchozí podávané léčby. Optimální pořadí podání (sekvence) inovativních imunoonkologických preparátů zatím nebylo stanoveno, nicméně již nyní je zřejmé, že preparáty zaměřené proti antigenu CD19 budou hrát v terapii DLBCL stěžejní roli.
PŘIROZENÁ ROLE CD19 A ÚLOHA V B-LYMFOMAGENEZI
CD19 je transmembránový glykoprotein typu 1, který patří do superrodiny imunoglobulinů (Ig) [12,13]. Skládá se z jedné transmembránové domény, cytoplazmatického C-konce a extracelulárního N-konce. CD19 je hlavní signální složkou multimolekulárního komplexu, který se nachází na povrchu zralých B-buněk spolu s tetraspaninovým membránovým proteinem CD81, receptorem komplementu CD21 a CD225. CD19 je na povrchu B buněk exprimován všudypřítomně od časných až po zralá stadia vývoje. CD19 je exprimován v časnějším pre-B stadiu než CD20, který vymizí až ve stadiu plazmatických buněk. CD19 se z povrchu B buněk nevylučuje do cirkulace. Ve fyziologických buňkách hraje CD19 klíčovou roli v mnoha funkcích B buněk, vč. vývoje a diferenciace, proliferace a signalizace.
CD19 také moduluje signalizaci B-buněčného receptoru v několika fázích vývoje B-buněk a ovlivňuje aktivaci B-buněk nezávislou na antigenu a vyvolanou imunoglobuliny prostřednictvím různých proteinkináz.
B-buněčné receptory se skládají z povrchově exprimovaného imunoglobulinu spojeného s heterodimery CD79A a CD79B, které jsou nezbytné pro přenos signálu, expresi na plazmatické membráně a intracelulární signalizaci. U DLBCL je exprese B-buněčných receptorů zachována a tyto receptory hrají klíčovou roli v patogenezi lymfomu a jeho proliferaci. Podtyp DLBCL s aktivovanými B-buňkami (ABC) je charakterizován chronickou aktivní signalizací B-buněčných receptorů a aktivací signální dráhy nukleárního faktoru kappa B a exprimuje především imunoglobulinové M (IgM) -B-buněčné receptory [14,15]. Podtyp B-buněk podobných germinálnímu centru (GCB) exprimuje IgG-B-buněčné receptory. Signalizace IgM-B-buněčných receptorů přednostně indukuje pro přežití a mitogenní signály, zatímco signalizace IgG-B-buněk upřednostňuje diferenciaci v plazmatické buňky.
Ve vývoji B-buněk a při normální expresi CD19 hraje roli transkripční faktor 5 (PAX5) specifický pro B-buňky. PAX5 a CD19 regulují hladiny multifunkčního transkripčního faktoru c-MYC posttranskripčním mechanizmem, který působí prostřednictvím fosfoinositid-3-kinázové dráhy nezávisle na aktivitě B-buněčných receptorů [16]. Zvýšená exprese c-MYC vede k nekontrolovanému růstu buněk a rozvoji nádorů. Regulační smyčka c-MYC-CD19, v níž CD19 a c-MYC působí synergicky, urychluje B-buněčnou lymfomagenezi a progresi lymfomu.
První pokusy o cílení na CD19 prostřednictvím vývoje monoklonálních protilátek proti CD19, které si zachovávají nativní Fc oblast imunoglobulinu G1 (IgG1), byly neúspěšné. Nativní protilátky proti CD19 obsahují nemodifikované Fc oblasti a nemohou vyvolat klíčové efektorové funkce protilátek, protože neindukují programovanou buněčnou smrt a mají omezenou účinnost při spouštění cytotoxicity závislé na komplementu (complement-dependent cytotoxicity – CDC), na protilátkách závislou buněčnou cytotoxicitu (antibody-dependent cell cytotoxicity – ADCC) a na protilátkách závislou buněčnou fagocytózu (antibody-dependent cell phagocytosis – ADCP). To podnítilo vývoj nových strategií cílené anti-CD19 terapie, které se ukázaly být slibné zejména u B-buněčných lymfomů [17,18].
PŘEHLED LÉČIV ZAMĚŘENÝCH PROTI ANTIGENU CD19
Fc-modifikované anti-CD19 monoklonální protilátky – tafasitamab
Přehled léčiv zaměřených proti antigenu CD19 je uveden v rámci obr. 1 [19]. Tafasitamab je humanizovaná monoklonální protilátka typu IgG1 s modifikovaným Fc fragmentem, která se váže na CD19 exprimovaný na povrchu pre-B a zralých B lymfocytů. Působí tak, že zprostředkovává ADCC a ADCP a má přímý cytotoxický účinek. V oblasti Fc byly vytvořeny dvě aminokyselinové záměny na S239D a I332E, což znamená, že tafasitamab má zvýšenou afinitu k receptorům Fc gama, vč. FcgRIIIa (exprimovaného na povrchu NK buněk, makrofágů a mnoha gd T buněk), a zvýšenou aktivitu ADCC a ADCP zprostředkovanou FcgRIIIa [20,21].
V preklinických studiích zahrnujících modely lymfomů a leukemií prokázal tafasitamab 100–1000násobně zvýšené ADCC ve srovnání s anti-CD19 IgG1 analogem in vitro [20,21]. Tafasitamab demonstroval aktivitu i v monoterapii u R/R DLBCL a dalších B-buněčných malignit, přičemž někteří pacienti dosáhli trvalých odpovědí. Preklinické důkazy také ukázaly, že tafasitamab působí synergicky v kombinaci s lenalidomidem [22,23]. Lenalidomid má přímou antineoplastickou aktivitu a nepřímé účinky zprostředkované různými imunitními buňkami v mikroprostředí nádoru. Lenalidomid zejména stimuluje proliferaci a aktivaci NK-buněk, čímž zvyšuje ADCC zprostředkovanou NK-buňkami tafasitamabem in vitro [24].
Obr. 1. Přehled léčiv zaměřených proti antigenu CD19. Upraveno dle [19]. ![Přehled léčiv zaměřených proti antigenu CD19. Upraveno dle [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e40586ef9824e9d4fc41d9dfb06bc257.png)
Obr. 2. Série vybraných imunohistochemických vyšetření tkáně tumoru z doby relapsu, barveno hematoxylin-eosinem (A), CD 20 (B), CD19 (C) a c-myc (D). 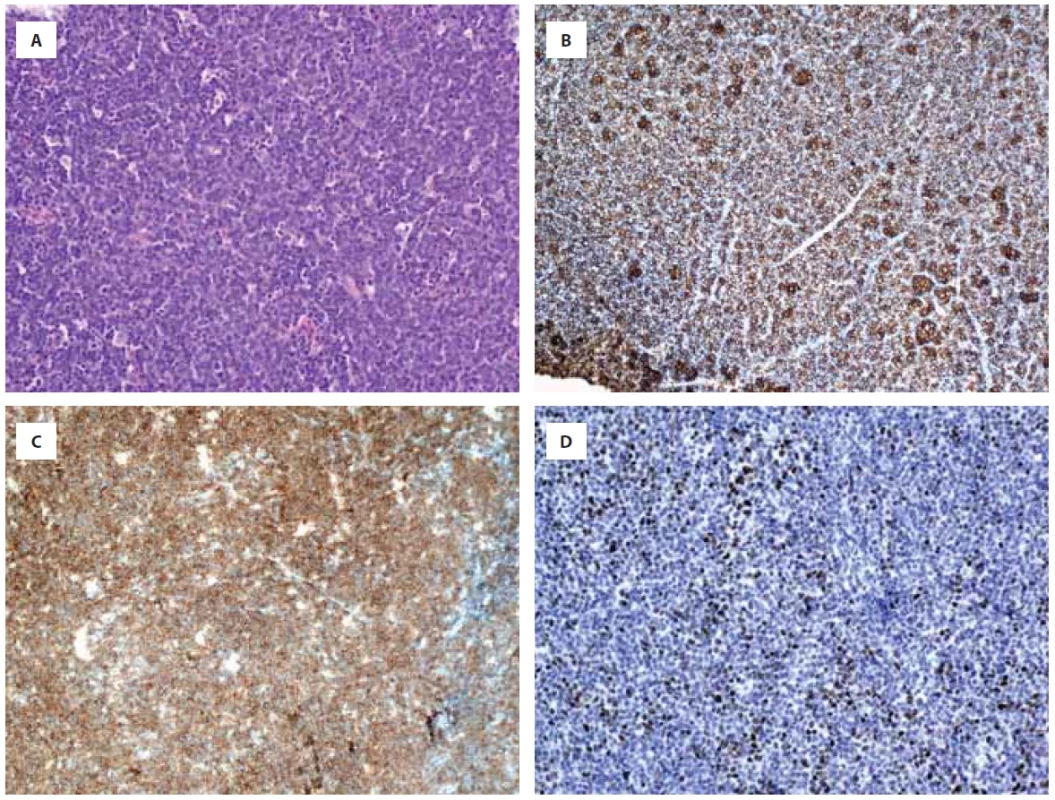
Studie první fáze tafasitamabu poskytly údaje o jeho bezpečnosti, účinnosti, farmakokinetice a vhodném dávkování, které podpořily druhou fázi vývoje. Studie First-MIND (NCT04134936) byla studie fáze 1b zkoumající bezpečnost a účinnost tafasitamabu v kombinaci s R-CHOP nebo tafasitamabu a lenalidomidu s R-CHOP u dospělých pacientů s nově diagnostikovaným DLBCL, přičemž rameno A obsahovalo 6 cyklů R-CHOP-21 + tafasitamab 12 mg/kg i.v. den 1, 8, 15 a rameno B bylo doplněné o lenalidomid 25 mg p. o. den 1–10. Studie nezjistila žádnou neočekávanou toxicitu a ani vliv na relativní dávkovou intenzitu podání R-CHOP. Předběžné analýzy účinnosti ukázaly vysokou celkovou míru odpovědi (overall response rate – ORR), míru kompletní remise dosahující 75,8 % (CR 72,7 %) v rameni s tafasitamabem a 81,8 % (CR 66,7 %) v rameni s tafasitamabem a lenalidomidem [25].
Studie druhé fáze – L-MIND (NCT023 99085) zkoumala kombinaci i.v. tafasitamabu (12 mg/kg) a p. o. lenalidomidu (25 mg/den) podávaných do maximálního počtu 12 cyklů (doba trvání cyklu 28 dní) a následovanou monoterapií tafasitamabem u 80 pacientů s DLBCL, kteří relabovali po jednom až třech systémových režimech a kteří nebyli vhodní pro ASCT. Mezi vylučovací kritéria patřil primárně refrakterní DLBCL, definovaný jako absence odpovědi na léčbu 1. linie nebo progrese do 6 měsíců od terapie. Celkem 42,0 % a 44,4 % pacientů bylo refrakterních na rituximab, resp. na poslední linii léčby. Medián počtu předchozích linií systémové léčby byl dvě, přičemž 50 % pacientů (n = 40) dostávalo tafasitamab jako druhou linii léčby [23].
Nežádoucí účinky jakéhokoli stupně (treatment-emergent adverse events – TEAE) se vyskytly u 100 % pacientů. Nejčastějšími TEAE stupně 3 nebo vyššího u kombinace tafasitamabu a lenalidomidu byly neutropenie (48 %), trombocytopenie (17 %) a febrilní neutropenie (12 %). Reakce související s infuzí (všechny 1. stupně a během první infuze) byly hlášeny u 6 % pacientů, žádná z nich nevyžadovala přerušení léčby. Závažné nežádoucí účinky byly hlášeny u 51 % pacientů a 25 % pacientů přerušilo léčbu z důvodu nežádoucích účinků.
Po téměř třech letech sledování dosáhla ORR 57,5 % (46 pacientů) a 40,0 % (32 pacientů) dosáhlo úplné odpovědi (complete response – CR). Medián trvání odpovědi (duration-of-response – DOR) byl 43,9 měsíců a medián PFS byl 11,6 měsíců při mediánu sledování 33,9 měsíců. Medián celkového přežití (overall survival – OS) byl 33,5 měsíce s mediánem sledování 42,7 měsíce. Medián PFS byl 23,5 měsíce u pacientů, kteří dostávali tafasitamab plus lenalidomid jako 2. linii léčby, ve srovnání se 7,6 měsíce u těch, kteří dostávali kombinaci jako 3. linii nebo později. Medián OS byl 45,7 oproti 15,5 měsíce [26].
V post-hoc analýze podskupin pacientů ve studii L-MIND, kteří byli refrakterní na primární léčbu (n = 15) nebo na svou poslední linii léčby (n = 35), bylo ORR podobné jako u nerefrakterních pacientů (v obou případech 60 %). V porovnání kohort pacientů s R/R DLBCL vhodných pro ASCT (76 pacientů v každé kohortě), které odpovídalo počtu pacientů v kohortách L-MIND a RE-MIND v reálné praxi, vedla kombinace tafasitamabu a lenalidomidu k významně lepšímu ORR, CRR a OS ve srovnání s monoterapií lenalidomidem (ORR 67,1 vs. 34,2 %; OR 3,89; 95% CI 1,90–8,14; p < 0,0001) [27].
Evropská léková agentura udělila tafasitamabu registraci 26. srpna 2021, a to v indikaci R/R DLBCL, nevhodného k provedení ASCT v kombinaci s lenalidomidem. Probíhá studie hodnotící použití tafasitamabu v 1. linii léčby DLBCL – Front-MIND [NCT0482409258]).
Kazuistika nemocné léčené režimem tafasitamab-lenalidomid
Šedesáti šestileté pacientce byl v srpnu 2021 diagnostikován leukemizovaný DLBCL, nonGCB typ, s pozitivní mutací genu MYD88 a nálezem paraproteinu (obr. 2A–2D). Stážovací PET/CT vyšetření prokázalo postižení lymfatických uzlin nad i pod bránicí, v měkkých tkáních nazofaryngu s postižením tonzil, postižení sleziny a nehomogenní postižení jater (obr. 3A). Rozsah choroby hodnocen jako klinické stadium IVA, IPI 4 (high risk). Vzhledem k rozsahu postižení pacientka promptně zahájila terapii režimem R-CHOP s velmi dobrým efektem a dosažením kompletní remise po 6 cyklech v únoru 2022 (obr. 3B). Po 11 měsících, v lednu 2023 nově zjištěno ložisko podkoží břicha vlevo od pupku, dle UZ obraz maligní etiologie. Provedena biopsie ložiska a histologicky potvrzen časný relaps DLBCL. Dle restážovacího PET/CT (obr. 3C) popsáno postižení podkoží břicha a mezi svaly laterálně od levého kyčelního kloubu. V únoru 2023, krátce po dokončení diagnostiky relapsu onemocnění, zahájena salvage terapie režimem R-EDHAP nad 60 let (rituximab, cisplatina, etoposid, cytarabine, dexamethason). Podání terapie bylo komplikováno kolapsovým stavem, rozvojem clostridiové enteritidy a nutností redukce podávané terapie. Klinicky byla léčba bez efektu (dosaženo pouze stabilní choroby), a proto bylo rozhodnuto o zařazení nemocné do studie firmMIND a podání kombinace tafasitamab + lenalidomid v dávkách: tafasitamab 12 mg/kg i.v. à 1 týden v průběhu 3 cyklů, od 4. cyklu à 2 týdny a lenalidomid 25 mg p. o. D1–21 každého cyklu. Již v průběhu podávání 1. cyklu terapie byl pozorován klinicky promptní a jednoznačný efekt na ložisko v podkoží břicha vedle pupku, které znatelně regredovalo. Efekt terapie byl potvrzen také na kontrolním PET/CT provedeném po podání 2 cyklů terapie. Pacientka dosáhla kompletní metabolické remise (obr. 3D). V prosinci 2023 pacientka pokračovala 10. cyklem terapie, klinicky bez známek aktivity onemocnění. Během léčby nemocná prodělala dvě epizody infekce močových cest grade 2, bez jednoznačné souvislosti s podávanou terapií a bez záchytu hematologické toxicity a nutnosti přerušení terapie.
Konjugáty protilátky proti CD19: lonkastuximab-tesirin
Vlastnosti CD19 (tj. rychlá internalizační kinetika, širší expresní profil než CD20 a absence uvolnění do oběhu) z něj činí lepší cíl pro konjugáty protilátka-toxin než antigen CD20 [28]. Lonkastuximab-tesirin je ADC sestávající z protilátky cílené na CD19 konjugované s cytotoxickým pyrrolobenzodiazepinovým dimerem, který vede k ireverzibilnímu propojení (cross-linking) vláken DNA. Po navázání na CD19-pozitivní buňky je lonkastuximab-tesirin internalizován uvnitř buňky, kde se uvolňuje pyrrolobenzodiazepin, který vyvolá buněčnou smrt [29,30].
V jednoramenné studii 2. fáze LOTIS-2 (NCT03589469) byl lonkastuximab-tesirin zkoumán u pacientů s R/R difuzním velkobuněčným nebo high-grade B-lymfomem (n = 145), u nichž selhaly nejméně dva předchozí systémové léčebné režimy (přičemž 9,7 % nemocných bylo po CAR-T a 16,6 % po ASCT). Preparát byl podáván každé 3 týdny v dávce 150 μg/kg po 2 cykly a poté v dávce 75 μg/kg do progrese nebo neakceptovatelné toxicity. Po průměrně 4,6 cyklu léčby dosáhla ORR 48,3 % pacientů a 25 % pacientů dosáhlo CR. Medián DOR byl 12,6 měsíce u 70 nemocných, kteří dosáhli léčebné odpovědi (CR, PR), a nebyl dosažen u pacientů, kteří dosáhli CR. Celková míra léčebné odpovědi u pacientů ve věku ≥ 75 let, s double/triple-hit DLBCL nebo s transformovaným DLBCL byla 52,4 %, 33,3 % a 44,8 %. U 15 pacientů, kteří po lonkastuximab-tesirinu byli léčeni anti-CD19 CAR T-buněčnou terapii, byla ORR 46,7 % [31].
Jednoramenná studie LOTIS-3 (NCT03 684694) fáze I/II hodnotila lonkastuximab-tesirin v kombinaci s ibrutinibem v dávce 560 mg u pacientů s R/R DLBCL nebo lymfomem z plášťových buněk. Při mediánu trvání léčby 70 dní byla ORR 62,9 % u všech pacientů hodnotitelných z hlediska účinnosti (n = 37) a 58,6 % (n = 17) u 29 pacientů s DLBCL. Mezi časté TEAE stupně 3 nebo vyššího patří abnormality jaterních enzymů a cytopenie [32].
Údaje z preklinických studií naznačují, že přidání rituximabu prodlužuje dobu trvání odpovědi. Třetí fáze randomizované studie 2. fáze LOTIS-5 (NCT04384484) zkoumá účinnost lonkastuximab-tesirinu s rituximabem oproti režimu rituximab-gemcitabin-oxaliplatina jako standardní imunochemoterapii u pacientů s R/R DLBCL [33].
V souhrnné analýze bezpečnosti lonkastuximab-tesirinu se neutropenie stupně ≥ 3, trombocytopenie a anémie vyskytly u 32,1 %, 20,0 % a 12,6 % pacientů s R/R DLBCL. Většina těchto příhod byla zvládnutelná odložením dávky a nevyžadovala snížení dávky ani přerušení léčby. U lonkastuximab-tesirinu je také časté zvýšení jaterních enzymů, které je pravděpodobně způsobeno navázaným toxinem [34].
Lonkastuximab-tesirin získal schválení FDA pro použití u pacientů s R/R DLBCL, kteří obdrželi nejméně dvě předchozí systémové terapie.
Obr. 3. Série PET/CT vyšetření při diagnóze (A), při dosažení první kompletní remise (B), v relapsu (C) a po terapii dvěma cykly tafasitamab-lenalidomid (D). 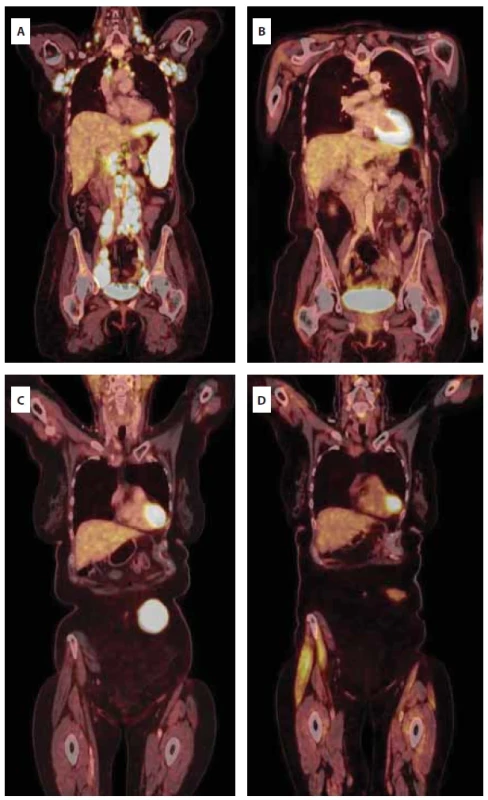
Tab. 1. Nové látky schválené pro třetí a další linii léčby DLBCL [31,37–39]. ![Nové látky schválené pro třetí a další linii léčby DLBCL [31,37–39].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3e1b9d93e636a8b0235ad8d5885b8ca0.png)
CRR – míra kompletní odpovědi; DOR – doba trvání odpovědi; mPFS – medián přežití bez progrese; ORR – míra celkové odpovědi; OS – medián celkového přežití Terapie CAR-T lymfocyty zaměřenými proti CD19 antigenu
Pro léčbu R/R DLBCL po dvou nebo více liniích systémové léčby jsou schváleny tři anti-CD19 CAR T-buněčné produkty: axicabtagene ciloleucel (axi-cel) a tisagenlecleucel (tisa-cel), a lisocabtagene maraleucel (liso-cel). Ačkoli všechny tři molekuly používají stejný jednořetězcový variabilní fragment (scFv) odvozený od klonu FMC63, existují mezi nimi rozdíly. Např. axi-cel obsahuje kostimulační doménu CD28, zatímco tisa-cel a liso-cel obsahují kostimulační doménu 41-BB. Není však jasné, zda tyto rozdíly ovlivňují funkci, účinnost nebo bezpečnost. Žádné přímé srovnání účinnosti těchto CAR-T konstruktů nebylo provedeno a klinické studie se liší svým designem a populací pacientů [35,36].
Tab. 2. Nové látky schválené pro druhou linii léčby DLBCL [25,42–44]. ![Nové látky schválené pro druhou linii léčby DLBCL [25,42–44].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1f2570964d1af0719a73756f43570aef.png)
DOR – medián trvání odpovědi; HDT-ASCT – vysokodávkovaná terapie a autologní transplantace kmenových buněk; ORR – celková odpověď; OS – medián celkového přežití; PFS – medián přežití bez progrese; TTR – doba do odpovědi Terapie CAR-T ve 3. linii léčby
Schválení CAR-T léčby vycházelo ze studií ZUMA-1, JULIET a TRANSCEND (tab. 1). [37–39]. Dlouhodobý léčebný potenciál terapie CAR-T byl prokázán u axi-celu, přičemž údaje z pětiletého sledování ukazují na 32% přežití bez progrese (PFS) a 51% přežití specifické pro dané onemocnění a také u CTL019 (tisa-cel) s pětiletým PFS ve výši 31 %. Terapie CAR-T sice zjevně má léčebný potenciál, ale může být spojena se specifickými nežádoucími účinky, přičemž u všech konstruktů CAR-T byly zaznamenány syndrom uvolňování cytokinů (cytokine-release syndrome – CRS) a neurotoxicita, stejně jako prolongovaná cytopenie, a to až ve 45 % případů. Studie TRANSCEND zahrnovala volnější kritéria pro zařazení než ostatní studie, umožňující zařazení pacientů vyššího věku, se sekundárním postižením centrálního nervového systému (CNS) a s mírnou renální a kardiální insuficiencí. Účinnost a toxicita produktů CAR-T ve 3. linii nebyla přímo srovnávána. Nepřímé srovnání studií ZUMA-1 a TRANSCEND prokázalo srovnatelnou účinnost axi-celu a liso-celu s nižší mírou toxicity u liso-celu, což podtrhuje rozdílné funkce kostimulačních domén CD28 vs. 4-1BB [40].
Terapie CAR-T ve 2. linii léčby
ASCT je kurativní u méně než 30 % pacientů s R/R LBCL vhodných k transplantaci ve 2. linii léčby. Její účinnost je obzvláště nízká u pacientů s primárně refrakterním nebo časně relabovaným onemocněním [15] (tab. 2). Vzhledem k významné aktivitě terapie CAR-T u DLBCL ve 3. linii léčby bylo logickým krokem testovat účinnost CAR-T ve druhé linii terapie. Byly provedeny 3 velké randomizované kontrolované studie u pacientů vhodných k ASCT (ZUMA-7, BELINDA a TRANFORM) srovnávající CAR-T vs. standardní péči (standard-of-care, SOC) v druhé linii, přičemž SOC spočívala v chemoimunoterapii 2. linie následované ASCT u vysoce rizikové skupiny nemocných s primárně refrakterním nebo časně relabujícím DLBCL do 12 měsíců od ukončení 1. linie léčby [41–43]. Studie ZUMA-7 a TRANSFORM splnily své primární cíle účinnosti, zatímco BELINDA nikoli. Ve studii ZUMA-7 bylo 359 pacientů s vysoce rizikovým DLBCL randomizováno k léčbě axi-celem oproti SOC. Medián přežití bez příhod (event-free survival – EFS) byl významně vyšší u axi-celu, a to 8,3 měsíce oproti 2 měsícům u standardní péče, přičemž dvouleté EFS činilo 41 % u axi-celu a 16 % u standardní péče. Lepší výsledky s axi-celem byly pozorovány také u pacientů ve věku ≥ 65 let. Tyto výsledky se promítly i do lepšího celkového přežití po terapii axi-celem. Studie TRANSFORM se 184 pacienty randomizovanými k liso-celu vs. SOC využívala podobný design studie jako ZUMA-7, ačkoli podle protokolu byl povolen crossover do ramene s liso-celem. Podobně byl medián EFS lepší u liso-celu (10,1 vs. 2,4 měsíce) s 18měsíčním EFS 53 % a 21 % u liso-celu a standardní péče). V analýze OS byl zaznamenán trend ke zlepšení OS v rameni s liso-celem, s 18měsíčním OS 73 % u liso-celu a 54 % u SOC. Ve studiích ZUMA-7 i TRANSFORM nedošlo k žádnému úmrtí v důsledku CRS nebo neurotoxicity.
Vzhledem k příznivému profilu účinnosti a toxicity přípravku liso-cel u R/R DLBCL vhodných k transplantaci byla provedena jednoramenná studie fáze 2 PILOT, která zkoumala účinnost přípravku liso-cel ve 2. linii také u 74 pacientů s R/R LBCL nevhodných k transplantaci. Celková míra odpovědi (ORR) byla 80 % (CR 54 %) s mediánem PFS 9 měsíců, přičemž medián OS nebyl dosažen. U pacientů, kteří dosáhli CR, byl medián PFS dokonce 23 měsíců
Na základě pozitivních výsledků studií ZUMA-7, TRANSFORM a PILOT schválila FDA a následně EMA axi-cel i liso-cel pro pacienty s vysoce rizikovým DLBCL, u nichž došlo k relapsu onemocnění v průběhu 12 měsíců od ukončení chemoimunoterapie 1. linie nebo jsou vůči této léčbě refrakterní.
SEKVENCE TERAPIE U R/R DLBCL
Současná situace v léčbě DLBCL je s dobou před pěti lety neporovnatelná. Existuje mnoho nových léčebných možností, z nichž většina nebyla přímo srovnávána v přímých studiích. Při stanovení optimálního pořadí léčby by se kromě účinnosti mělo vycházet z bezpečnosti, snášenlivosti a dalších faktorů souvisejících s pacientem a onemocněním (obr. 4).
Obr. 4. Schéma možné sekvence léčby nemocných s RR DLBCL. Upraveno dle [4]. ![Schéma možné sekvence léčby nemocných s RR DLBCL. Upraveno dle [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1b03d601ee590d471a576b7033a9be94.png)
Současné postavení ASCT v léčbě relapsu DLBCL
Prvním krokem v sekvenování léčby je posouzení doby do progrese/relapsu R/R DLBCL a případné způsobilosti pacienta pro CAR-T léčbu, případně vůči vysokodávkované terapii a autologní transplantaci krvetvorných buněk (high-dose therapy and autologous stem cell transplant – HDT-ASCT).
Aktuálně je indikace typu léčby 2. linie ovlivněna dobou do relapsu lymfomu; u nemocných s relapsem do 12 měsíců od ukončení léčby 1. linie, kteří jsou schopni podstoupit CAR-T terapii, je indikováno podání axi-celu nebo liso-celu. U nemocných s relapsem po 12 měsících od ukončení léčby 1. linie je v případě vhodnosti k podání vysokodávkované terapie indikováno podání záchranné terapie založené na platinových derivátech (např. ICE, DHAP, ESAP). U mladších nemocných (do 65 let, v případě dobrého klinického stavu do 70 let), kteří dosáhnou alespoň parciální remise po salvage terapii, pak následuje ASCT.
Při výběru pacientů vhodných pro HDT-ASCT se řídíme věkem, výkonnostním stavem, orgánovými funkcemi, komorbiditami, úspěšným odběrem štěpu a chemosenzitivitou nádoru.
Nemáme žádnou striktní věkovou hranici, i když pacienti starší 75 let jsou transplantováni jen zřídka. Jako podmínku pro indikace pacienta je považován výkonnostní stav (ECOG < 3), adekvátní orgánové funkce (tj. ejekční frakce levé srdeční komory > 50 %, difuzní kapacita plic pro oxid uhelnatý > 60 %, clearance kreatininu > 30 ml/min) a předchozí odpověď na imunochemoterapii. Dosažení kontroly lymfomu před ASCT je zásadní, neboť hlubší remise je spojena s mnohem lepšími výsledky [46,47].
Nicméně i v případě nemocných s časným relapsem nebo refrakterním onemocněním na terapii R-CHOP dosahuje až 30 % nemocných CR po záchranné léčbě režimem R-ICE. Tito pacienti, pokud jsou konsolidováni ASCT, mají podobné PFS a OS ve srovnání s pacienty s pozdním relapsem (> 12 měsíců) [48]. Salvage terapie je tedy stále určitou možností v případě nedostupnosti CAR-T léčby i pro nemocné s časným relapsem lymfomu.
Možnosti léčby u osob nevhodných k ASCT
Pokud pacienti nejsou vhodní pro ASCT, pak druhým krokem, který v rámci sekvenování učiníme, je určení, zda jsou vhodní pro terapii CAR-T. Kritéria způsobilosti v současné době zahrnují primárně refrakterní DLBCL nebo onemocnění, které relabovalo do 12 měsíců od ukončení chemoimunoterapie, nebo relaps po chemoimunoterapii 1. linie u pacientů s komorbiditami, pokročilým věkem nebo obojím, které vylučují způsobilost pro ASCT. Konsenzus pro stanovení horní věkové hranice nebo hodnocení komorbidit, které by určovaly způsobilost pro léčbu buňkami CAR-T, byl publikován v kapitole 20 knihy České hematologické společnosti [49]. Pokud jsou nemocní vhodní, upřednostňujeme potenciálně kurativní léčbu pomocí CAR T-buněk v časnější fázi onemocnění před jinými nebuněčnými terapiemi, protože ve srovnávacích studiích ZUMA-7 a TRANSFORM, které tyto dvě modality porovnávaly. Ukázalo se, že provedení ASCT je spojeno s horším přežitím. U pacientů s pozdním relapsem, kteří nejsou vhodní k transplantaci, byla realizována studie PILOT s preparátem liso-cel, která přinesla srovnatelné klinické výsledky co do ORR jako studie ZUMA-7 a TRANSFORM při poněkud nižším procentu kompletních remisí.
Nemocní nevhodní ke CAR-T nebo ASCT terapii jsou kandidáty terapie pomocí inovativních molekul – protilátek namířených proti antigenu CD19, polatuzumab-vedotinu, konvenční imunochemoterapii (např. režimem gemcitabin-oxaliplatina), případně je vhodné uvažovat o zařazení pacienta do klinických studií.
Tafasitamab (s lenalidomidem) je alternativou schválenou FDA pro 2. linii léčby. Zkušenosti mimo klinické studie ukazují, že tento přípravek lze použít i u starších pacientů s významnými komorbiditami a sníženým výkonnostním stavem. V multicentrické retrospektivní studii 82 pacientů z devíti různých léčebných center byla míra ORR 27 %, přičemž míra CR činila 17 %. Medián PFS byl 2,8 měsíce a medián OS 6,8 měsíce. Není překvapením, že pacienti s refrakterním onemocněním si vedli hůře, s PFS a OS kratšími než 2, resp. 6 měsíců. Předchozí léčba CAR-T nebo jiná léčba zaměřená na CD19 nebyla spojena s horšími výsledky [50]. Hamadani a kolegové publikovali podobně neuspokojivé výsledky. PFS a OS byly významně lepší u pacientů, kteří tuto kombinaci dostávali ve 2. linii oproti 3. linii nebo později (PFS: 23,5 měsíce oproti 7,6 měsíce; OS: 45 měsíců oproti 15,5 měsíce) [51]. Celkově jsou klinické výsledky tafasitamabu a lenalidomidu v běžné klinické praxi pravděpodobně horší, než bylo pozorováno v klinické studii fáze 2 L-MIND. Tafasitamab s lenalidomidem považujeme za možnost pro pacienty, kteří nejsou způsobilí k transplantaci nebo léčbě CAR T-buňkami, bez vysoce rizikových biologických vlastností lymfomu (double - nebo triple-hit) a pro ty, kteří trpí značnými komorbiditami (např. periferní neuropatií) vylučujícími použití látek jako polatuzumab-vedotin.
Polatuzumab-vedotin v kombinaci s bendamustinem a rituximabem je možností léčby 2. linie, která vykazuje celkovou míru odpovědi mezi 30 % a 65 %, s mírou CR 23–40 %. Postmarketingová analýza pola-BR uvádí nižší účinnost, zejména u refrakterních pacientů nebo při zvýšeném počtu předchozích systémových terapií, což podtrhuje obecnější princip, že pola-BR může být účinnější v časnější fázi relapsu DLBCL. Pola-R (bez bendamustinu) můžeme použít jako přemosťující léčbu před léčbou CAR T-buňkami, případně po provedení aferézy kombinovat i s bendamustinem [52,53].
Terapie DLBCL ve třetích a dalších liniích je mnohem komplikovanější. Opakované relapsy jsou provázeny horším celkovým stavem pacienta, projevy kumulativní toxicity předchozích terapií a potenciální ztrátou CD19 na povrchu maligních buněk. Stávající údaje ukazují, že u vhodných pacientů nabízí terapie CAR T-buňkami nejlepší šanci na hlubokou a trvalou remisi a je preferovanou strategií, pokud nebyla léčba CAR-T terapií (axi-cel, liso-cel) indikována ve 2. linii. Celkově se zdá, že léčebné výsledky jednotlivých CAR-T přípravků jsou podobné, přičemž přibližně třetina pacientů dosahuje trvalé kontroly onemocnění. Vzhledem k podobnosti výsledků je jedním z hlavních faktorů výběru profil toxicity dostupných molekul. V klinických studiích se CRS vyskytla u 93 % ve studii ZUMA-1, u 58 % ve studii JULIET a u 42 % ve studii TRANSCEND, přičemž CRS ≥ 3. stupně postihla 10 %, 17 % a 2 % pacientů. Medián doby do nástupu CRS byl dva dny po infuzi axi-celu, tři dny po tisa-celu a pět dní po liso-celu [39,40,54]. Neurotoxicita se obvykle vyskytuje po nástupu CRS (medián pět dní po axi-celu, šest dní po tisa-celu a devět dní po liso-celu) a vyskytla se u 67 % pacientů ve studii ZUMA-1, u 21 % pacientů ve studii JULIET a u 30 % pacientů ve studii TRANSCEND. Údaje z reálné praxe ukázaly podobnou nebo o něco méně častou četnost a závažnost CRS a neurotoxicity u pacientů, kteří dostávali axi-cel. V případě tisa-celu multicentrické analýzy prokázaly nižší míru CRS ve srovnání se studiemi (jakýkoli stupeň 39 %, stupeň 3 a vyšší 1 %) a také nižší míru neurotoxicity (11 % jakýkoli stupeň, 1 % stupeň 3 a vyšší) [55–57]. Údaje o použití liso-celu v reálném světě se nadále hromadí a dozrávají. U zdatnějších pacientů obvykle používáme axi-cel a u křehčích pacientů liso-cel.
Pokud léčba pomocí buněk CAR-T nepřipadá v úvahu, lze zvážit po ≥ 2 liniích léčby použití tafasitamabu/lenalidomidu, režimu pola-BR (pokud nebyly podávány dříve), lonkastuximab tesirinu, bispecifických protilátek, případně lenalidomidu v monoterapii, a u nemocných ve velmi dobrém stavu je možné zvažovat i provedení alogenní transplantace krvetvorných buněk.
Lonkastuximab tesirin lze použít po dvou nebo více liniích léčby u pacientů s různým rizikovým profilem, vč. double/triple hit lymfomu. Studie LOTIS-2 vyloučila pacienty s bulky onemocněním (> 10 cm), což je třeba vzít v úvahu při výběru pacienta pro léčbu lonkastuximabem [58]. Použití lonkastuximabu jako léčebné alternativy vyhrazujeme pro pacienty s DLBCL, kteří již měli buňky CAR-T nebo kteří nejsou vhodní pro použití buněk CAR-T, zejména pokud mají další vysoce rizikové znaky (např. genetické změny double - nebo triple-hit).
Dostupnost více látek, které cílí na povrchový antigen CD19, vyvolává potenciální problém maskování nebo down-regulace antigenu, což je relevantní zejména v případě, že je zvažována anti-CD19 CAR-T terapie [59]. Je dobře známo, že ztráta antigenu CD19 po terapii buňkami CAR-T je hlavní příčinou úniku imunitního systému u B-ALL. Nové údaje naznačují, že k tomuto jevu dochází také u pacientů s B-buněčnými lymfomy léčenými buňkami CAR-T, což se uvádí přibližně u 30 % případů [60]. Údaje o perzistenci CD19 po léčbě tafasitamabem nebo lonkastuximab-tesirinem jsou omezeny na malé série nebo kazuistiky, ale zdá se, že sekvenční podání látek cílených na CD19 lze úspěšně provést. V jedné malé kohortě byla exprese CD19 na DLBCL znovu hodnocena u 10 pacientů po relapsu nebo progresi při léčbě lonkastuximab-tesirinem. Nebyly zaznamenány žádné případy relapsu s negativním antigenem CD19. Po léčbě CAR-T dosáhlo šest z těchto pacientů CR, přičemž u pěti ze šesti pacientů léčba pokračovala v mediánu 6 měsíců [61]. Analýza ve studii LOTIS-2 ukázala, že k odpovědi došlo u pacientů s velmi nízkou expresí CD19 v nádoru, měřenou imunohistochemicky, s odhadovanou povrchovou hustotou nádorových buněk až 1 000 molekul/buňku, což je obvykle pod úrovní detekce. Předchozí terapie CAR-T navíc nevylučovala odpověď na lonkastuximab-tesirin [58]. Laboratorní studie ukázaly, že tafasitamab nezhoršil expresi CD19 ani aktivitu CAR-T [62]. Dokud nebude k dispozici více kvalitnějších údajů, budeme i nadále preferovat co nejčasnější použití potenciálně léčebné anti-CD19 CAR T-buněčné terapie vzhledem k teoretickému riziku down-regulace nebo maskování antigenního cíle. K dokumentaci exprese CD19 velmi doporučujeme opakované hodnocení exprese cílového antigenu pomocí tkáňové biopsie, pokud je to možné, analýzy pomocí imunohistochemie a případně i průtokové cytometrie.
Bispecifické protilátky představují atraktivní možnost pro léčbu relapsu DLBCL, a to i po CAR-T terapii vzhledem k jejich účinnosti a dobré snášenlivosti. Ve studii Dickinsona a kolegů mělo 33 % pacientů léčených glofitamabem předchozí CAR-T terapii (celkový počet nemocných ve studii n = 154). V této skupině dosáhla míra CR 35 % [63]. U pacientů léčených epcoritamabem (n = 157) mělo 61 pacientů (39 %) předchozí terapii CAR-T a míra ORR a CR byla v této populaci 54,1, resp. 34,4 % [64]. V případě odronextamabu byla dosažena 33% (10 z 30) míra ORR a 27 % (8 ze 30) nemocných dosáhlo CR (po CAR T terapii) [65]. Míra ORR mosunetuzumabu mezi pacienty s předchozí terapií CAR-T byla 36,8 %, z toho 26,3 % dosáhlo CR [66]. V současné době podáváme léčbu bispecifickými protilátkami přednostně u pacientů s relapsem po CAR-T, případně ve 3. linii u nemocných, kteří na CAR-T nejsou vhodní.
ZÁVĚRY
Během posledních několika let se objevila řada perspektivních inovativních léků pro léčbu nemocných s relabovaným DLBCL. Poté, co se v České republice dobře etablovala buněčná terapie CAR-T lymfocyty a byly získány zkušenosti s režimem polatuzumab-bendamustin-rituximab, přicházejí další modality, ať už zacílené proti antigenu CD19 (tafasitamab, lokastuximab-tesirin), nebo CD20 bispecifické protilátky (glofitamab, epcoritamab), a dále výrazně mění léčebné možnosti a zažité algoritmy. S dostupností nových molekul ruku v ruce přichází i posun některých z nich do časnějších fází léčby. Tento stav přináší paradox volby: namísto toho, aby usnadňoval výběr léčby, může více možností léčby bez jediné jednoznačně nejlepší alternativy celý proces výběru léčby komplikovat. Ideální načasování a sekvence podání inovativních molekul je zásadní pro léčebný úspěch a bude klást nároky na pečlivou stratifikaci a identifikaci nejrizikovějších pacientů. Nadějí je velmi rychlý přísun nových informací z reálné praxe, které nám v nejbližších měsících napoví, jaká je pozice jednotlivých léčebných modalit. Probíhající studie současně řeší otázku účinnosti nových léčiv v kombinaci s chemoterapií nebo mezi sebou navzájem.
Zdroje
1. Alaggio R, Amador C, Anagnostopoulos I, et al. The 5th edition of the World Health Organization Classification of haematolymphoid tumours: lymphoid neoplasms [published cor - rection appears in Leukemia. 2023; 37 (9): 1944–1951]. Leukemia. 2022; 36 (7): 1720–1748.
2. Teras LR, DeSantis CE, Cerhan JR, Morton LM, Jemal A, Flowers CR. 2016 US lymphoid malignancy statistics by World Health Organization subtypes. CA Cancer J Clin. 2016; 66 (6): 443–459.
3. Trneny M, Campr V, Janikova A, et al. The improving outcome of non-Hodgkin lymphoma (NHL) within 15 years period-real world data of national-wide lymphoma project. Haematologica. 2016; 2016 (101): 479–480.
4. Coiffier B, Thieblemont C, Van Den Neste E, et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d‘Etudes des Lymphomes de l‘Adulte. Blood. 2010; 116 (12): 2040–2045.
5. Philip T, Guglielmi C, Hagenbeek A, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin‘s lymphoma. N Engl J Med. 1995; 333 (23): 1540–1545.
6. Farooq U, Maurer MJ, Thompson CA, et al. Clinical heterogeneity of diffuse large B cell lymphoma following failure of front-line immunochemotherapy. Br J Haematol. 2017; 179 (1): 50–60.
7. Gisselbrecht C, Glass B, Mounier N, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era [published correction appears in J Clin Oncol. 2012; 30 (15): 1896]. J Clin Oncol. 2010; 28 (27): 4184–4190.
8. Al-Mashhadi AL, Jakobsen LH, Brown P, et al. Real-world outcomes following third or subsequent lines of therapy: A Danish population-based study on 189 patients with relapsed/refractory large B-cell lymphomas. Br J Haematol. Published online November 27, 2023. doi: 10.1111/bjh.19201.
9. Rassy E, Danu A, Ibrahim T, et al. Outcomes of transplant-eligible patients with relapsed or refractory diffuse large B-cell lymphoma after second-line salvage chemotherapy: the Gustave Roussy experience. Clin Lymphoma Myeloma Leuk. 2021; 21 (4): e373–e380. doi: 10.1016/j.clml. 2020.11.008.
10. Crump M, Kuruvilla J, Couban S, et al. Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem-cell transplantation for relapsed and refractory aggressive lymphomas: NCIC-CTG LY.12. J Clin Oncol. 2014; 32 (31): 3490–3496.
11. Tun AM, Maliske S, Wang Y, et al. Progression-free survival at 24 months as a landmark after autologous stem cell transplant in relapsed or refractory diffuse large B-cell lymphoma. Transplant Cell Ther. 2022; 28 (9): 610–617.
12. Tedder TF, Isaacs CM. Isolation of cDNAs encoding the CD19 antigen of human and mouse B lymphocytes. A new member of the immunoglobulin superfamily. J Immunol. 1989; 143 (2): 712–717.
13. Wang K, Wei G, Liu D. CD19: a biomarker for B cell development, lymphoma diagnosis and therapy. Exp Hematol Oncol. 2012; 1 (1): 36. doi: 10.1186/2162-3619-1-36.
14. Visco C, Tanasi I, Quaglia FM, Ferrarini I, Fraenza C, Krampera M. Oncogenic mutations of MYD88 and CD79B in diffuse large B-cell lymphoma and implications for clinical practice. Cancers (Basel). 2020; 12 (10): 2913. https: //doi.org/10.3390/cancers12102913.
15. Young RM, Shaffer AL, 3rd, Phelan JD, Staudt LM. B-cell receptor signaling in diffuse large B-cell lymphoma. Semin Hematol. 2015; 52 (2): 77–85.
16. Raufi A, Ebrahim AS, Al‐Katib A. Targeting CD19 in B‐cell lymphoma: emerging role of SAR3419. Cancer Manag Res. 2013; 5 : 225–233. doi: 10.2147/cmar.s45957 17.
18. Robkopf S, Eichholz KM, Winterberg D, et al. Enhancing CDC and ADCC of CD19 antibodies by combining Fc protein-engineering with Fc glyco-engineering. Antibodies (Basel). 2020; 9 (4): 63. doi: 10.3390/antib9040063.
19. Ramon Ortiz C, Wang S, Stathis A, et al. How to integrate CD19 specific chimeric antigen receptor T cells with other CD19 targeting agents in diffuse large B-cell lymphoma?. Hematol Oncol. Published online November 8, 2023. doi: 10.1002/hon.3237.
20. Horton HM, Bernett MJ, Pong E, et al. Potent in vitro and in vivo activity of an Fc‐engineered anti‐CD19 monoclonal antibody against lymphoma and leukemia. Cancer Res. 2008; 68 (19): 8049–8057. doi: 10.1158/0008‐5472.can‐08‐2268.
21. Awan FT, Lapalombella R, Trotta R, et al. CD19 targeting of chronic lymphocytic leukemia with a novel Fc‐domain‐engineered monoclonal antibody. Blood. 2010; 115 (6): 1204–1213.
22. Jurczak W, Zinzani PL, Hess G, et al. A Phase IIa, open‐label, multicenter study of single‐agent tafasitamab (MOR208), an Fcoptimized anti‐CD19 antibody, in patients with relapsed or refractory B‐cell non‐Hodgkin’s lymphoma: long‐term follow‐up, final analysis. Blood. 2019; 134 (Suppl 1): 4078.
23. Salles G, Duell J, Gonzalez Barca E, et al. Tafasitamab plus lenalidomide in relapsed or refractory diffuse large B‐cell lymphoma (LMIND): a multicentre, prospective, single‐arm, phase 2 study. Lancet Oncol. 2020; 21 (7): 978–988.
24. Gribben JG, Fowler N, Morschhauser F. Mechanisms of action of lenalidomide in B‐cell non‐Hodgkin lymphoma. J Clin Oncol. 2015; 33 (25): 2803–2811.
25. Belada D, Kopeckova K, Bergua Burgues JM, et al. Safety and efficacy of tafasitamab with or without lenalidomide added to first-line R-CHOP for DLBCL: the phase 1b First-MIND study. Blood. 2023; 142 (16): 1348–1358.
26. Duell J, Maddocks KJ, Gonzalez‐Barca E, et al. Long‐term outcomes from the phase II L‐MIND study of tafasitamab (MOR208) plus lenalidomide in patients with relapsed or refractory dif - fuse large B‐cell lymphoma. Haematologica. 2021; 106 (9): 2417–2426.
27. Nowakowski GS, Rodgers TD, Marino D, et al. RE‐MIND study: a propensity score‐based 1 : 1 matched comparison of tafasitamab + lenalidomide (L‐MIND) versus lenalidomide monotherapy (realworld data) in transplant‐ineligible patients with relapsed/refractory (R/R) diffuse large B‐cell lymphoma (DLBCL). J Clin Oncol. 2020; 38 (15_Suppl): 8020.
28. Hammer O. CD19 as an attractive target for antibody‐based therapy. MAbs. 2012; 4 (5): 571–577.
29. Kahl BS, Hamadani M, Radford J, et al. A phase I study of ADCT‐402 (loncastuximab tesirine), a novel pyrrolobenzodiazepinebased antibody‐drug conjugate, in relapsed/refractory B‐cell non‐Hodgkin lymphoma. Clin Cancer Res. 2019; 25 (23): 6986–6994.
30. Jain N, Stock W, Zeidan A, et al. Loncastuximab tesirine, an anti‐CD19 antibody‐drug conjugate, in relapsed/refractory B‐cell acute lymphoblastic leukemia. Blood Adv. 2020; 4 (3): 449–457.
31. Zinzani PL, Caimi PF, Carlo‐Stella C, et al. LOTIS 2 follow‐up analysis: updated results from a phase 2 study of loncastuximab tesirine in relapsed or refractory diffuse large B‐cell lymphoma. Hematol Oncol. 2021; 39 (S2): 252.
32. Carlo-Stella C, Zinzani PL, Janakiram M, et al. Planned interim analysis of a phase 2 study of loncastuximab tesirine plus ibrutinib in patients with advanced diffuse large B-cell lymphoma (LOTIS-3). Blood. 2021; 138 (Suppl 1): 54.
33. Linhares Y, Gandhi MD, Chung M, Adeleye J, Ungar D, Hamandani M. Safety and antitumor activity study evaluating loncastuximab tesirine and rituximab versus immunochemotherapy in diffuse large B‐cell lymphoma. Blood. 2020; 136 (Suppl 1): 9–10.
34. Hamadani M, Radford J, Carlo‐Stella C, et al. Final results of a phase 1 study of loncastuximab tesirine in relapsed/refractory Bcell non‐Hodgkin lymphoma. Blood. 2021; 137 (19): 2634–2645.
35. Chavez JC, Bachmeier C, Kharfan-Dabaja MA. CAR T-cell therapy for B-cell lymphomas: clinical trial results of available products. Ther Adv Hematol. 2019; 10 : 2040620719841581. doi: 10.1177/2040620719841581.
36. Abramson JS. Anti-CD19 CAR T-cell therapy for B-cell non-Hodgkin lymphoma. Transfus Med Rev. 2020; 34 (1): 29–33.
37. Locke FL, Ghobadi A, Jacobson CA, et al. Long‐term safety and activity of axicabtagene ciloleucel in refractory large B‐cell lymphoma (ZUMA‐1): a single‐arm, multicentre, phase 1–2 trial. Lancet Oncol. 2019; 20 (1): 31–42.
38. Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B‐cell lymphoma. N Engl J Med. 2019; 380 (1): 45–56.
39. Abramson JS, Palomba ML, Gordon LI, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B‐cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet. 2020; 396 (10254): 839–852.
40. Westin JR, Kersten MJ, Salles G, et al. Efficacy and safety of CD19‐directed CAR‐T cell therapies in patients with relapsed/refractory aggressive B‐cell lymphomas: observations from the JULIET, ZUMA‐1, and TRANSCEND trials. Am J Hematol. 2021; 96 (10): 1295–1312.
41. Westin JR, Oluwole OO, Kersten MJ, et al. Survival with axicabtagene ciloleucel in large B-cell lymphoma. N Engl J Med. 2023; 389 (2): 148–157.
42. Bishop MR, Dickinson M, Purtill D, et al. Second-line tisagenlecleucel or standard care in aggressive B-cell lymphoma. N Engl J Med. 2022; 386 (7): 629–639.
43. Kamdar M, Solomon SR, Arnason J, et al. TRANSFORM Investigators. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma (TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet. 2022; 399 (10343): 2294–2308.
44. Gordon LI, Liu FF, Braverman J, et al. Lisocabtagene maraleucel for second-line relapsed or refractory large B-cell lymphoma: patient-reported outcomes from the PILOT study. Haematologica. Published online August 31, 2023. doi: 10.3324/haematol.2023.283162.
45. Brooks TR, Caimi PF. A paradox of choice: Sequencing therapy in relapsed/refractory diffuse large B-cell lymphoma. Blood Rev. Published online October 28, 2023. doi: 10.1016/ j.blre.2023.101140.
46. Sauter CS, Matasar MJ, Meikle J, et al. Prognostic value of FDG-PET prior to autologous stem cell transplantation for relapsed and refractory diffuse large B-cell lymphoma. Blood. 2015; 125 (16): 2579–2581.
47. Shah NN, Ahn KW, Litovich C, et al. Is autologous transplant in relapsed DLBCL patients achieving only a PET+ PR appropriate in the CAR T-cell era? Blood. 2021; 137 (10): 1416–1423.
48. Caimi PF, Auberle C, Goparaju K, Baidoun F, Cashen AF, Hill BT. Outcomes of DLBCL patients achieving complete remission after R-ICE Chemoimmunotherapy. Blood. 2022; 140 (Suppl 1): 381–383.
49. Červená kniha. Léčebné postupy v hematologii 2023 – Česká hematologická společnost ČLS JEP (hematology.cz).
50. Qualls D, Buege MJ, Dao P, et al. Tafasitamab and lenalidomide in relapsed/refractory large B cell lymphoma (R/R LBCL): real world outcomes in a multicenter retrospective study. Blood. 2022; 140 (Suppl 1): 787–789.
51. Hamadani M, Liao L, Wilson L, Howarth A, Flores C, Chen L. Real-world outcomes in relapsed/refractory DLBCL patients who received polatuzumab vedotin PLUS bendamustine and rituximab or tafasitamab plus lenalidomide by line of therapy. Blood. 2022; 140 (Suppl 1): 8058–8060.
52. Smith SD, Lopedote P, Samara Y, et al. Polatuzumab vedotin for relapsed/refractory aggressive B-cell lymphoma: a multicenter post-marketing analysis. Clin Lymphoma Myeloma Leuk. 2021; 21 (3): 170–175.
53. Vodicka P, Benesova K, Janikova A, et al. Polatuzumab vedotin plus bendamustine and rituximab in patients with relapsed/refractory diffuse large B-cell lymphoma in the real world. Eur J Haematol. 2022; 109 (2): 162–165.
54. Schuster SJ, Maziarz RT, Rusch ES, et al. Grading and management of cytokine release syndrome in patients treated with tisagenlecleucel in the JULIET trial. Blood Adv. 2020; 4 (7): 1432–1439.
55. Tang K, Nastoupil LJ. Real-world experiences of CAR T-cell therapy for large B-cell lymphoma: how similar are they to the prospective studies? J Immunother Precis Oncol. 2021; 4 (3): 150–159.
56. Riedell PA, Hwang WT, Nastoupil LJ, et al. Patterns of use, outcomes, and resource utilization among recipients of commercial axicabtagene ciloleucel and tisagenlecleucel for relapsed/refractory aggressive B cell lymphomas. Transplant Cell Ther. 2022; 28 (10): 669–676.
57. Iacoboni G, Villacampa G, Martinez-Cibrian N, et al. Real-world evidence of tisagenlecleucel for the treatment of relapsed or refractory large B-cell lymphoma. Cancer Med. 2021; 10 (10): 3214–3223.
58. Caimi PF, Hamadani M, Carlo-Stella C, et al. CD19 expression by IHC alone is not a predictor of response to Loncastuximab Tesirine: results from the LOTIS-2 clinical trial and quantitative systems pharmacology Modeling. Blood. 2022; 140 (Suppl 1): 9548–9550.
59. Fitzgerald KN, Quesada AE, von Keudell G, et al. CD19 epitope masking by tafasitamab leads to delays in subsequent use of CD19 CAR T-cell therapy in two patients with aggressive mature B-cell lymphomas. Leuk Lymphoma. 2022; 63 (3): 751–754.
60. Spiegel JY, Dahiya S, Jain MD, et al. Outcomes of patients with large B-cell lymphoma progressing after axicabtagene ciloleucel therapy. Blood. 2021; 137 (13): 1832–1835.
61. Thapa B, Caimi PF, Ardeshna KM, et al. CD19 antibody-drug conjugate therapy in DLBCL does not preclude subsequent responses to CD19-directed CAR T-cell therapy [published correction appears in Blood Adv. 2020; 4 (19): 4606]. Blood Adv. 2020; 4 (16): 3850–3852.
62. Sakemura R, Horvei P, Manriquez-Roman C, et al. The impact of prior treatment with a CD19 targeting monoclonal antibody on subsequent treatment with CD19 targeting CART cell therapy in preclinical models. Blood. 2021; 138 (Suppl 1): 2412.
63. Dickinson MJ, Carlo-Stella C, Morschhauser F, et al. Glofitamab for relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med. 2022; 387 (24): 2220–2231.
64. Thieblemont C, Phillips T, Ghesquieres H, et al. Epcoritamab, a novel, subcutaneous CD3xCD20 bispecific T-cell-engaging antibody, in relapsed or refractory large B-cell lymphoma: dose expansion in a phase I/II trial. J Clin Oncol. 2023; 41 (12): 2238–2247.
65. Bannerji R, Arnason JE, Advani RH, et al. Odronextamab, a human CD20×CD3 bispecific antibody in patients with CD20-positive B-cell malignancies (ELM-1): results from the relapsed or refractory non-Hodgkin lymphoma cohort in a single-arm, multicentre, phase 1 trial. Lancet Haematol. 2022; 9 (5): e327–e339. doi: 10.1016/S2352-3026 (22) 00072-2.
66. Budde LE, Assouline S, Sehn LH, et al. Single-agent mosunetuzumab shows durable complete responses in patients with relapsed or refractory B-cell lymphomas: phase I dose-escalation study. J Clin Oncol. 2022; 40 (5): 481–491.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
VP – příprava rukopisuVH – léčba pacienta, revize, korekce rukopisuLH, PF – příprava obrazových podkladů a revize textuTP – revize, korekce, závěrečná kontrola rukopisuPODĚKOVÁNÍ
Autoři děkují MUDr. Lence Henzlové, Ph.D, za přípravu obrazových podkladů vyšetření PET/CT a MUDr. Patriku Flodrovi, Ph.D., za přípravu fotodokumentace histologických preparátů.
GRANTOVÁ PODPORA
Podpořeno granty MZ ČR – RVO (FNOl, 00098 892) a IGA_LF_2023_005.
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 4. 1. 2024.
Přijato po recenzi dne: 24. 1. 2024.prof. MUDr. Vít Procházka, Ph.D.
Hemato-onkologická klinika
LF UP a FN Olomouc
Zdravotníků 248/7
779 00 Olomouc
e-mail: vit.prochazka@fnol.czŠtítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2024 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Terapie zacílená proti antigenu CD19 u difuzního velkobuněčného B-lymfomu
- Deskriptivní epidemiologie vybraných hematoonkologických onemocnění v České republice
- Editorial
- Protilátka anti-Kpb v těhotenství
- Mnohočetný myelom s primárním multifokálním extramedulárním postižením a raritní cytogenetickou změnou
- Umělá inteligence v cytomorfologii kostní dřeně: Morphogo a Scopio
- 16. Střešovický transfuzní den „Krví přenosné infekce – staré i nové hrozby“
- Certifikovaný kurz „Walking Blood Bank“
- Cena České hematologické společnosti ČLS JEP za nejlepší publikaci v oboru hematologie v roce 2023.
- Prof. MUDr. Jaroslav Čermák, CSc. – jubilující
- Jubileum profesora Romana Hájka
- Monoklonální gamapatie klinického významu a další nemoci
- Ibrutinib s venetoklaxem s fixní délkou podávání v první linii léčby CLL – pětiletá data ze studií CAPTIVATE a GLOW
- Možnosti léčby pacientů s AML s nepříznivým rizikem v roce 2024
- Současné možnosti použití ivosidenibu v terapii akutní myeloidní leukemie
- Nový inhibitor BTK píše novou kapitolu léčby CLL
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapie zacílená proti antigenu CD19 u difuzního velkobuněčného B-lymfomu
- Deskriptivní epidemiologie vybraných hematoonkologických onemocnění v České republice
- Umělá inteligence v cytomorfologii kostní dřeně: Morphogo a Scopio
- Mnohočetný myelom s primárním multifokálním extramedulárním postižením a raritní cytogenetickou změnou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



