-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Koincidence lymfomu tračníku a biliárního ileu – kazuistika
Coincidence of colonic lymphoma and gallstone ileus – case report
Introduction:
Primary colonic lymphoma is a very rare malignant disease of the gastrointestinal tract, accounting for 1−4% of all malignant diseases in this location. It is classified in the group of extranodal lymphomas; its long-term asymptomatic progression makes it different from common colorectal carcinomas making its diagnosis very difficult, more often accidental. Gallstone ileus is quite an uncommon complication of cholecystolithiasis diagnosed with difficulty. Up to 50% of cases are diagnosed during surgery. The obturated location depends on the size of the stone, location of the conjunction between the biliary and gastrointestinal tracts, and also on any preexisting stenosis due to another unknown pathology.Case report:
We present a case of an 86-year-old man treated for acute diverticulitis with typical clinical symptoms. Following further examination (colonoscopy, computed tomography) revealed a tumour-like infiltration in the sigmoid colon wall and a voluminous polyp was suspected according to the colonoscopy. Computed tomography described an obstruction by a biliary stone tumbling through the cholecystocolonic fistula. Subsequent biopsy supported the suspected malignant etiology. The patient underwent resection of the sigmoid colon sec. Hartmann; an infiltration was found in the subhepatic space, which corresponded to the described fistulisation between the biliary tract and the colon. A large 40 mm gallstone was found in the resected sigmoid colon over the stenosis and the bowel wall showed diffuse thickening with several polyps; final histopathological assessment confirmed malignant lymphoma of the plasmocytoma type. No serious complications occurred in the postoperative period; after healing, the patient was transferred to hematooncology care.Conclusion:
The article describes the presence of two rare diseases – colonic lymphoma and gallstone ileus. Clearly, without the biliary stone obstruction in the preexisting tumorous stenosis in the sigmoid colon, the malignant hematooncology disease would not have been diagnosed.Key words:
primary colonic lymphoma – gallstone ileus – complication of the cholecystolithiasis – extranodal lymphoma – acute diverticulitis
Autoři: M. Černá 1; V. Opatrný 1; J. Nosek 1; J. Geiger 1; V. Třeška 1; L. Boudová 2; V. Buriánek 3
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 9, s. 377-382.
Kategorie: Kazuistika
Souhrn
Úvod:
Primární lymfom tračníku je velmi vzácné onemocnění gastrointestinálního traktu, představuje 1−4 % všech zhoubných onemocnění v této lokalitě. Patří do skupiny extranodálních lymfomů a na rozdíl od kolorektálního karcinomu probíhá dlouho asymptomaticky, což činí jeho diagnostiku velmi obtížnou, často náhodnou. Biliární ileus je vzácnou komplikací cholecystolithiázy, jeho diagnostika nebývá jednoduchá a až v 50 % je diagnostikován peroperačně. Místo obstrukce závisí na velikosti konkrementu, lokalizaci komunikace biliárního stromu s gastrointestinálním traktem a svůj podíl může mít rovněž preexistující stenóza v důsledku jiného patologického procesu.Kazuistika:
Předmětem sdělení je případ 86letého muže, který byl léčen konzervativně pro klinické příznaky akutní divertikulitidy. Dalším vyšetřováním (kolonoskopie, počítačová tomografie) bylo vysloveno podezření na nádorovou stenózu v oblasti esovité kličky tračníku, dle kolonoskopie s podezřením na objemný polyp, CT obraz svědčil pro obstrukci objemným biliárním konkrementem vycestovaným cholecystokolickou píštělí. Podezření z nádorové infiltrace podpořila i odebraná biopsie. Pacient podstoupil resekci sigmatu dle Hartmanna, nález infiltrátu v podjaterní krajině odpovídal popisované komunikaci biliárního stromu s tračníkem. V resekátu byl nad stenózou nalezen objemný 40mm biliární konkrement, stěna střeva byla difuzně ztluštělá s několika polypy a definitivní histopatologické zpracování potvrdilo diagnózu maligního lymfomu tračníku typu plazmocytomu. Pacient stonal bez vážných komplikací a po zhojení byl předán do péče hematoonkologa.Závěr:
Předkládaná práce demonstruje současný výskyt dvou vzácných onemocnění – lymfom tračníku a biliární ileus. Je dokladem toho, že nebýt obstrukce biliárním konkrementem v oblasti dosud bezpříznakové tumurózní stenózy v oblasti esovité kličky tračníku, zcela jistě by zhoubné hematologické onemocnění nebylo diagnostikováno.Klíčová slova:
primární lymfom tračníku – biliární ileus – komplikace cholecystolitiázy – extranodální lymfom – akutní divertikulitidaÚvod
Maligní onemocnění tlustého střeva stojí v České republice na předních příčkách mezi zhoubnými onemocněními vůbec, jednoznačně nejběžnější je adenokarcinom.
Primární lymfom tračníku (PLT) je podstatně vzácnější typ maligního onemocnění v této lokalitě, představuje 1−4 % všech zhoubných novotvarů. Tvoří samostatnou skupinu extranodálních lymfomů, jenž jsou proti lymfomům nodálním často řešitelné lokoregionálně. Představuje 12 % všech non-Hodgkinských lymfomů a pouze v 1/3 postihuje střevo, ve 2/3 bývá lokalizován v žaludku. Předoperační stanovení diagnózy je velmi obtížné, PLT nemá vlastní specifické příznaky odlišující ho od jiných maligních či benigních onemocnění a postrádá celkové i laboratorní příznaky. Díky odlišnému biologickému chování a růstu bývá často dlouho asymptomatický a ani symptomatické formy neodhalí přesnou diagnózu bez histopatologického vyšetření [1].
Obdobně ani biliární ileus není zcela běžnou příčinou náhlé příhody břišní (NPB), není naštěstí ani častou komplikací cholecystolithiázy. Stanovení diagnózy předoperačně není jednoduché, více než v polovině případů je stanovena během operace. Jako klíč k diagnóze slouží soubor nepřímých příznaků, tzv. Rieglerova trias. Přesto, není-li plně vyjádřena a jsou-li přítomny známky střevní neprůchodnosti, je nezbytná laparotomie. Místo obstrukce závisí jak na velikosti konkrementu, tak místě vzniklé komunikace gastrointestinálního traktu (GIT) se žlučovým stromem, svůj podíl může mít rovněž preexistující onemocnění způsobující změnu anatomických poměrů v GIT. Drobnokaménková lithiáza nemusí být při absenci jiných zažívacích obtíží rozpoznána, může na ni upozornit až náhodný odchod per vias naturales. Na druhé straně, i při komunikaci s tračníkem může nevelký konkrement způsobit obstrukci ve stenotickém úseku na podkladě pozánětlivého jizvení či tumorózní stenózy.
Kazuistika
86letý pacient byl přijat na Chirurgickou kliniku pro 4 dny trvající, mírně progredující bolesti břicha v levém dolním kvadrantu. Při vstupním fyzikálním vyšetření byla zjištěna hmatná, palpačně citlivá válcovitá rezistence táhnoucí se z levého mezogastria do levého podbřišku, bez známek peritoneálního dráždění, bez překážkové peristaltiky, v dosahu prstu s normálním nálezem per rektum. Nález byl velmi podezřelý z akutní divertikulitidy, což podpořil i sonografický nález popisující zánětlivé změny na přechodu sestupného a esovitého tračníku v terénu divertikulózy (Obr. 1). V laboratoři byla patrna izolovaně elevace CRP na 124 mg/l, bez leukocytózy (9,30x109/l), s hladinou hemoglobinu 107 g/l a mírnými projevy malnutrice (celková bílkovina 57 g/l, albumin 34,6 g/l). Vyšetření moči vyloučilo uroinfekci.
Obr. 1. Sonografický obraz zesílení střevní stěny s divertiklem Fig. 1: Thickened bowel wall with a diverticulum (sonography finding) 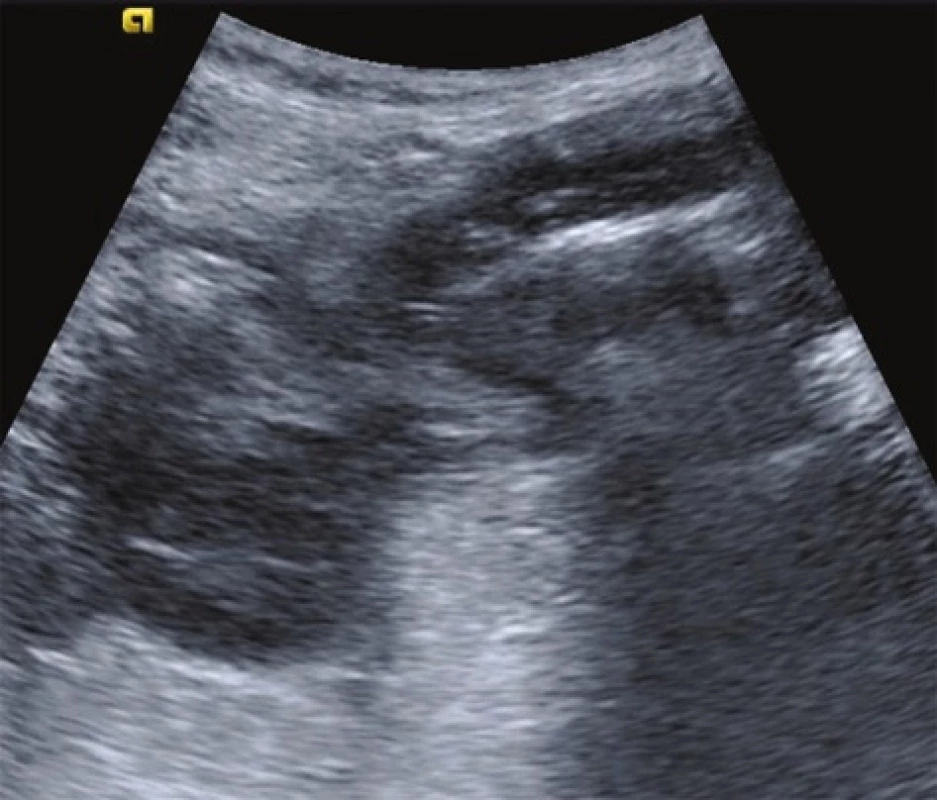
Anamnesticky pacient udával chronický sklon k zácpě a již před 11 lety při kolonoskopickém vyšetření pro enterorhagii mu byla diagnostikována divertikulární choroba tračníku. Hlavními interními a léčenými diagnózami byly kardiovaskulární choroby, pro sick sinus syndrom mu byl implantován trvalý kardiostimulátor, podstoupil kardiochirurgickou operaci s plastikou mitrální chlopně pro těžký stupeň insuficience, revaskularizační výkon pro stenózu ramus interventricularis anterior, při srdeční arytmii trvale na antiagregační léčbě, antihypertenzní a hypolipidemické léčbě. V osobní anamnéze dosud bez onkologického onemocnění. Rodinná anamnéza byla zatížena pouze kardiovaskulárními nemocemi, onkologicky byla zcela negativní.
U prezentovaného pacienta byla zahájena konzervativní léčba akutní divertikulitidy (metronidazol, ciprofloxacin). V průběhu 4–5 dní došlo subjektivně k plnému odeznění obtíží, laboratorně k poklesu CRP na 54 g/l, přesto však přetrvával pohmatový nález, ale nebyl již doprovázen bolestivou reakcí a nečinil poruchy pasáže. Vedlejším laboratorním nálezem byla subklinická anemizace. K verifikaci palpačního nálezu byl nemocný odeslán k tomografickému (CT) a kolonoskopickému vyšetření. CT vyšetření přineslo překvapivý nález v orální části colon sigmoideum, kde byla difuzně zesílená střevní stěna na 15–20 mm podezřelá z tumorózní infiltrace s obstrukcí lumen konkrementem velikosti 50x30 mm (Obr. 2), v podjaterní krajině intimní vztah mezi žlučníkem, duodenem a hepatální flexurou a přítomností plynu ve žlučníku. Nález byl uzavřen jako subileózní stav při tumorózní infiltraci střevní stěny v oblasti colon sigmoideum s obstrukcí objemným biliárním konkrementem. Vzhledem k velikosti konkrementu byl předpoklad komunikace cestou cholecystokolické píštěle (Obr. 3). Provedené endoskopické vyšetření prokázalo změny ve vzdálenosti 30 cm od anu, kde byl popisován pendulující objemný útvar krytý fibrinem, otok sliznice s četnými divertikly a odebraná biopsie byla velmi suspektní z lymfomu tračníku.
Obr. 2. CT obraz – tumorózní stenóza colon sigmoideum s obstrukcí biliárním konkrementem Fig. 2: Tumour-like stenosis of the sigmoid colon with gallstone obstruction (computed tomography finding) 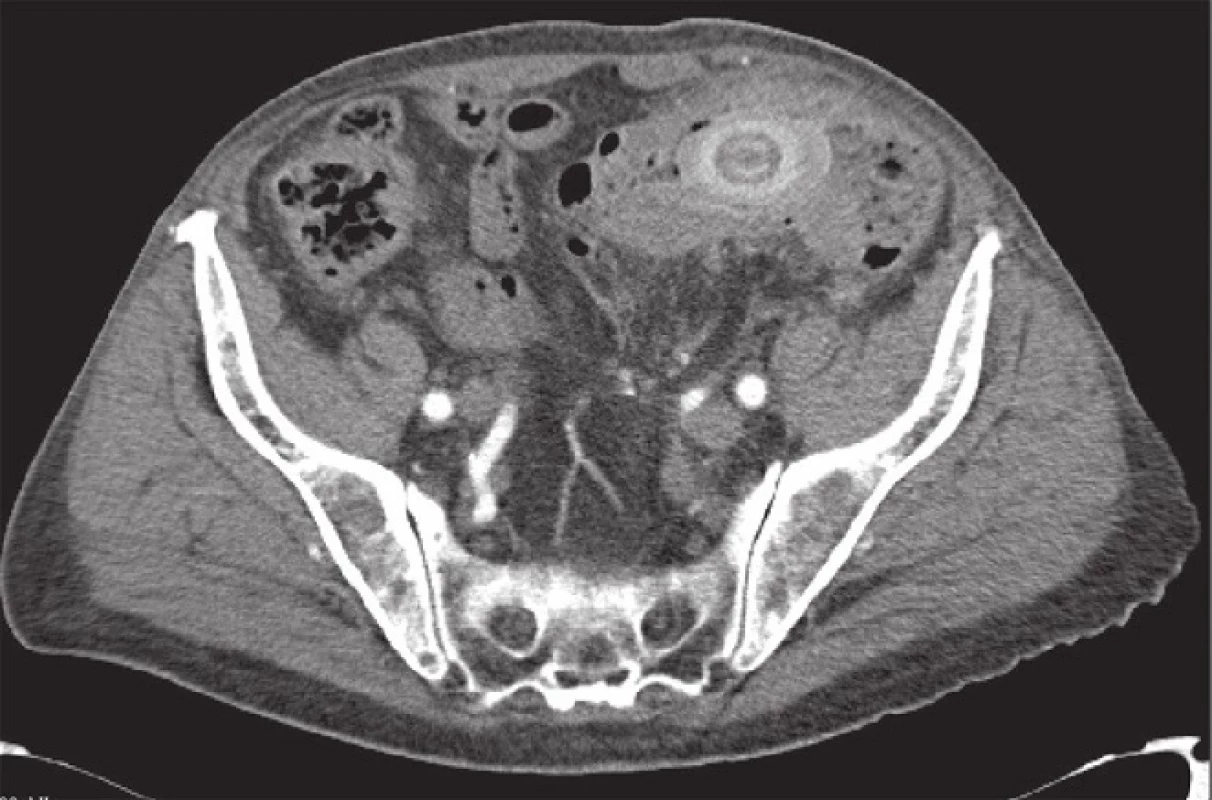
Obr. 3. CT obraz – cholecystokolická píštěl Fig. 3: Cholecystocolonic fistula (computed tomography finding) 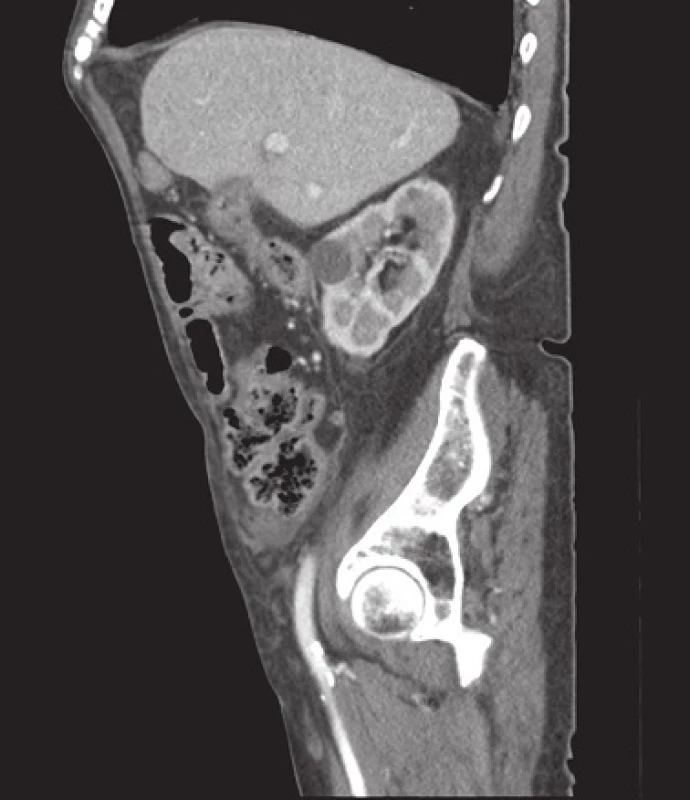
Po interní předoperační přípravě včetně úpravy vnitřního prostředí, nutričních parametrů a doplnění krevních derivátů byl nemocný indikován k laparotomii a pokusu o resekci postižené části střeva.
Při laparotomii bylo nalezeno objemné tumorózní ztluštění tračníku na vrcholu esovité kličky velikosti 10x10 cm, laterálně fixované do retroperitonea. Další explorací byly nalezeny četné klidné divertikly jejuna se širokými bazemi, divertikly levé poloviny tračníku a nepřehledná podjaterní oblast v pevných adhezích. Byla provedena resekce sigmatu dle Hartmanna (Obr. 4). Na rozstřiženém preparátu střeva byl ve shodě s CT popisem nalezen objemný biliární konkrement velikosti 40x30x20 mm (Obr. 5). Ve stěně střeva byly četné klidné divertikly, ale hlavním nálezem byly 3 přisedlé polypy v průměrech 13, 22 a 25 mm vytvářející trs, který splýval a vytvářel růžovobílou masu o celkových rozměrech 30x35x50 mm infiltrující do přilehlé tukové tkáně a ložiskově dosahoval k peritoneálnímu povrchu. Patolog po imunohistochemickém zpracování preparátu nález uzavřel jako maligní lymfom typu plazmocytomu (Obr. 6).
Obr. 4. Resekát colon sigmoideum Fig. 4: Resected sigmoid colon 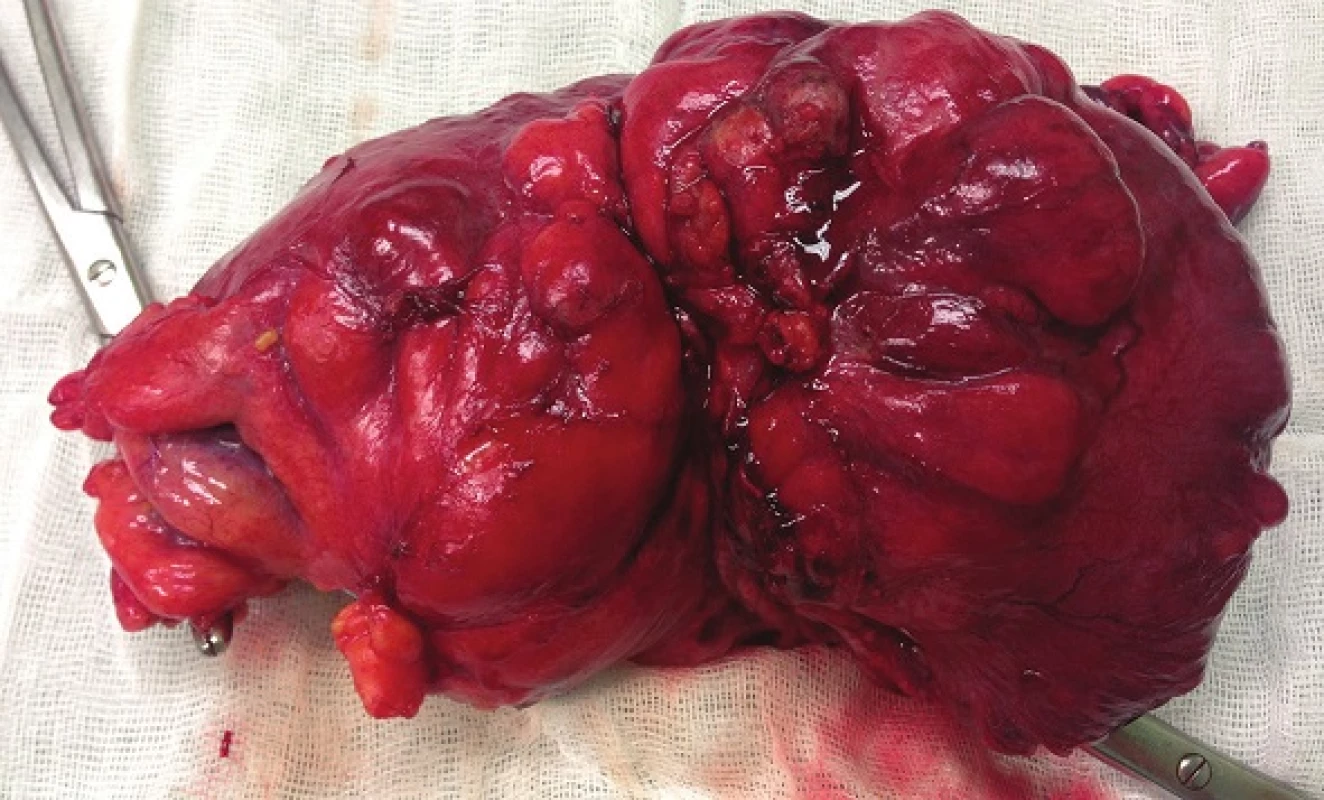
Obr. 5. Rozstřižený resekát colon sigmoideum s tumorózním ztluštěním stěny, biliární konkrement obturující lumen Fig. 5: Resected sigmoid colon with tumorous infiltration of the wall; obstructive gallstone in the lumen 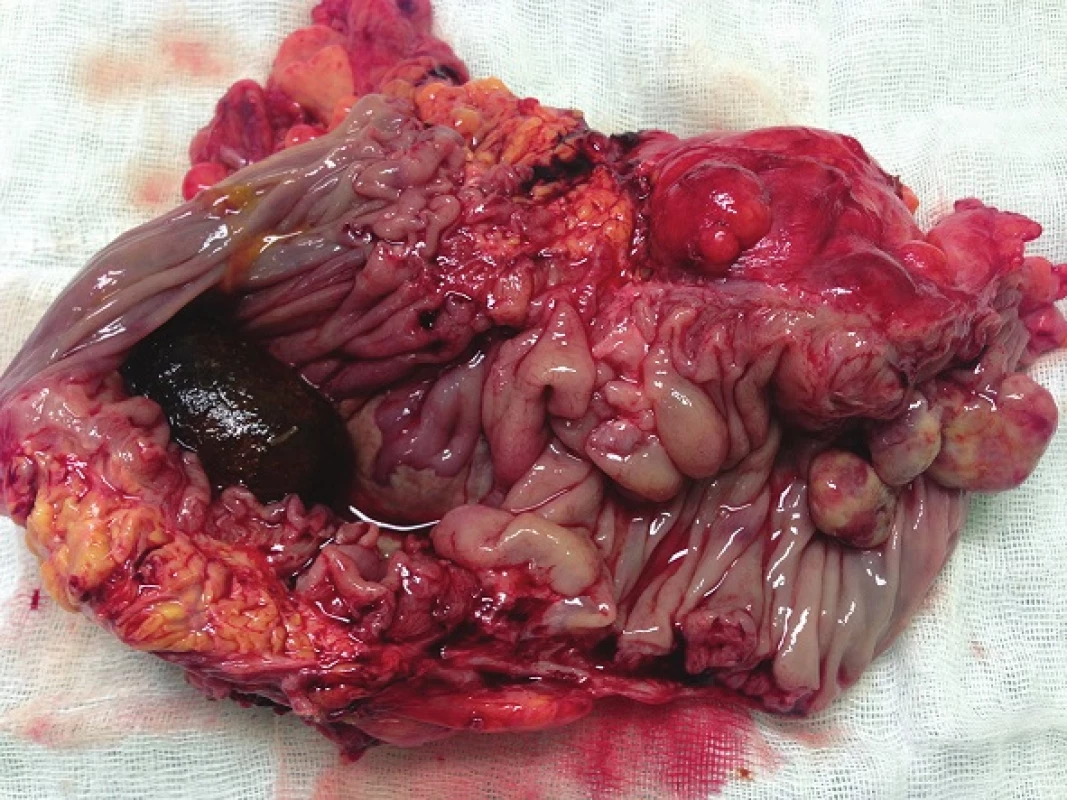
Obr. 6. Histopatologický obraz maligního lymfomu tračníku typu plasmocytomu Fig. 6: Histopathological finding of malignant lymphoma of the plasmocytoma type 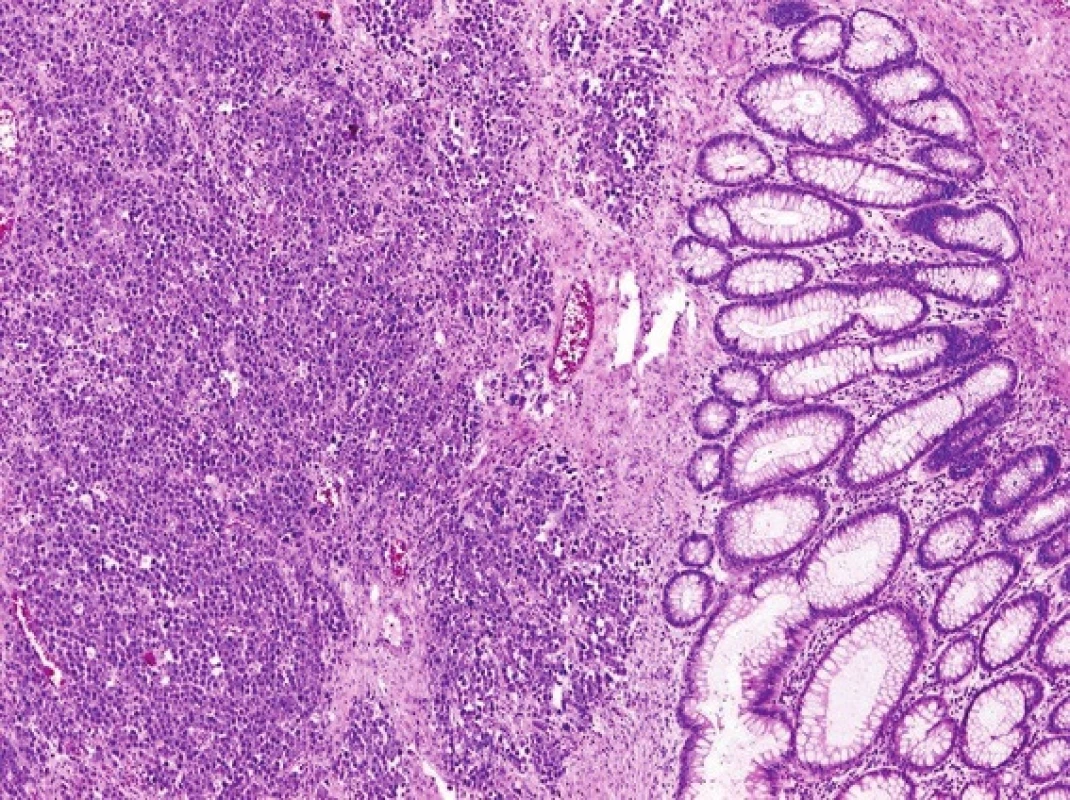
Pooperační průběh byl bez vážnějších komplikací a pacient byl 9. pooperační den propuštěn do ambulantní péče a s ohledem na histologický nález byl předán do péče hematoonkologa.
Diskuze
Primární lymfom gastrointestinálního traktu (PGIL) lze definovat jako chorobu, která spadá do početné rodiny hematologických malignit, jež je predominantně ohraničena na zažívací trakt, vzniká bez předchozí periferní lymfadenopatie a projevuje se příznaky svědčícími pro onemocnění GIT [2]. Udává se, že přibližně 40 % lymfomů je lokalizováno extranodálně, přičemž nejčastěji bývá postižen GIT, z hlediska lokalizace v 50−60 % žaludek, 20−30 % tenké střevo a 15−20 % kolorektální oblast. Lymfom lokalizovaný v oblasti kolorektální představuje 1,4 % všech non-Hodgkinských lymfomů a pouze 0,2 % všech zhoubných novotvarů v této lokalitě. Pravděpodobnost vzniku PGIL se zvyšuje s věkem, největší podíl nemocných je mezi 50. až 70. rokem věku a riziko výrazně zvyšuje imunosupresivní léčba zejména po orgánových transplantacích či idiopatických střevních zánětech [3].
Na rozdíl od nejčastěji se vyskytujícího adenokarcinomu tračníku je PLT až v 50 % bezpříznakový, tzn. nejsou přítomny příznaky onemocnění GIT ani známky systémového onemocnění. Již v roce 1961 Dawson et al. definoval kritéria PGIL, zahrnující nepřítomnost klinicky zjistitelné lymfadenopatie, nepřítomnost mediastinální lymfadenopatie na skiagramu hrudníku, normální krevní obraz i biopsii z kostní dřeně, nepřítomnost patologického nálezu v játrech a slezině. V současné době je pro potvrzení PGIL požadováno CT vylučující mediastinální i retroperitoneální lymfadenopatii, splenomegalii a jejich ložiskové postižení [4]. Symptomatičtí pacienti mají často nespecifické příznaky, nejčastěji dlouhodobější nevýrazné bolesti břicha, hubnutí, postupně anemizují. Mnohdy prvním klinickým příznakem bývá hmatná rezistence, přesto až polovina těchto nemocných nemá žádné subjektivní příznaky nemoci [5]. Naopak typické příznaky spojené s adenokarcinomem charakteru obstrukce či perforace jsou velmi vzácné, nejspíše z toho důvodu, že střevo postižené lymfomem si dlouhou dobu zachovává svou ohebnost při absenci desmoplastické reakce.
Z hlediska histologických typů nejčastěji postihuje GIT difuzní velkobuněčný B-lymfom, rychle proliferující, s agresivním chováním. Druhým nejčastějším je MALT (mucosa-associated lymphoid tissue-associated lymphoma) vycházející z B-buněk lymfatické tkáně sliznice. Jejich typickou lokalizací je žaludek, kde vznikají v důsledku chronického zánětu jako reakce na přítomnost Helicobacter pylori, kde pouze eradikace infekce může být úspěšnou léčebnou modalitou. MALT v oblasti kolorektální není spojován s infekční etiologií, proto i chování a léčba v této lokalizaci jsou odlišné. Z dalších již vzácnějších typů lymfomů se lze v oblasti GIT setkat s lymfomem vycházejícím z buněk pláště (MCL – mantle cell lymphoma), Burkittovým či folikulárním lymfomem, raritní jsou T-buněčné lymfomy a Hodgkinský lymfom postihující GIT častěji sekundárně [6].
PLT bývá lokalizován nejběžněji v pravé polovině tračníku, až v 70 % v oblasti hepatální flexury a pouze v jedné čtvrtině postihuje levou polovinu tračníku a rektosigmoideum. Pro diagnostiku má největší výtěžnost počítačová tomografie (CT), resp. pozitronová emisní tomografie (PET), které přinášejí cenné informace ohledně lokalizace, délky a hloubky postižení střeva, jeho extraluminálním šíření včetně posouzení lymfatických uzlin. PET má své nezastupitelné místo v monitoraci efektu systémové léčby a následné dispenzarizaci. Na základě radiodiagnostického nálezu lze hovořit o formě lokalizované (postižení střeva se spádovými lymfatickými uzlinami) či difuzní (postižení vzdálených lymfatických uzlin či dalších extranodálních orgánů) [7]. Pro stanovení diagnózy je samozřejmostí kolonoskopické vyšetření s obligátním odběrem biopsie. Makroskopický obraz zahrnuje celou řadu změn od mukózních polypů přes difúzní nodulární infiltraci stěny až po ulcerace, které svým vzhledem napodobují idiopatické střevní záněty či polypy rozličné etiologie [8].
Na léčbu primárního lymfomu tračníku není v literatuře jednotný náhled. Vzhledem k malému počtu pacientů chybí studie na větších souborech, neexistuje proto jednotný konsenzus léčebné strategie. Jedna skupina autorů přistupuje k lymfomu tračníku jako k systémovému onemocnění a domnívá se, že standardní léčbou by měla být chemoterapie a chirurgická léčba ponechána jako rezerva při komplikacích charakteru perforace, obstrukce nebo krvácení. Argumentují tím, že zásadní význam pro zlepšení prognózy je co nejčasnější zahájení systémové léčby. Zatímco druhá skupina autorů věří, že chirurgická resekce postižené části střeva zajistí lepší lokální kontrolu nemoci a následována systémovou léčbou poskytuje celkově lepší přežití v porovnání se samotnou systémovou léčbou [9,10]. Obě skupiny se shodují, že jednoznačnou výhodou chirurgické léčby je přesné stanovení histologického typu lymfomu, což je východiskem pro volbu systémové léčby a snížení rizika perforace při podávané chemoterapii vyskytující se ve více než 30 % zejména u tumorů postihujících celou tloušťku stěny. Korejská studie hodnotící retrospektivně bezpříznakové přežití pacientů s lokalizovaným PLT léčené resekcí a chemoterapií, resp. pouze chemoterapií dokládá jednoznačně lepší přežití ve skupině léčených lokální i systémovou léčbou s relapsem 15,3 %, resp. 36,8 % při pouhé systémové léčbě [11]. Studie Aviles et al. se zabývá srovnáním přežití při zajištění chirurgickou i systémovou léčbou, resp. pouze chirurgickou, kdy 10leté období přežívá 83 %, resp. 74 % [12]. Obecně lze tedy říci, že při volbě léčebného algoritmu je nutné přihlédnout ke stádiu nádorového postižení, histologickému typu a jeho senzitivitě k chemoterapii, charakteru obtíží nemocného, zhodnocení celkového stavu a operačního rizika a v neposlední řadě preferenci nemocného. Za nezpochybnitelnou indikaci k resekčnímu výkonu je nutné považovat střevní neprůchodnost, krvácení, fistulizaci či perforaci. Na základě prací zahrnujících menší soubory se lze přiklonit k resekčnímu výkonu u lokalizovaných forem, naopak formy generalizované lze spíše doporučit k systémové léčbě a chirurgickou terapii ponechat jako rezervu pro řešení komplikací. Co do rozsahu chirurgického výkonu je doporučována resekce střeva se spádovými lymfatickými uzlinami řídící se stejnými pravidly jako při léčbě adenokarcinomu. Vychází z toho, že pouze 14−24 % pacientů s PLT nemá zasaženy lymfatické uzliny, zatímco u 62−86 % jsou prokázány patologické uzliny. Požadavek radikality odpadá při akutním chirurgickém řešení komplikací při systémové léčbě. Přesto je obecně PLT onemocnění zatížené vysokým rizikem rekurence, do 5 let v rozmezí 33−75 % [13].
Biliární ileus je poměrně vzácná komplikace cholecystolithiázy a představuje 1−4 % všech střevních obstrukcí s vyšší prevalencí v ženské části populace v poměru 3,5−6 : 1. Udává se, že ve věku nad 65 let tvoří až 25 % střevních neprůchodností. Nejčastějším místem komunikace žlučového stromu s GIT bývá vzhledem k anatomickým poměrům duodenum (60−86 %), následované tračníkem a žaludkem [14]. Za hlavní příčinu vzniku je považována cholecystitida, často recidivující s pericholecystitidou vedoucí ke vzniku pevných adhezí žlučníku s okolními orgány a v důsledku eroze tlakem žlučového kamene na stěnu žlučníku dochází k postupnému proležení do příslušného orgánu. Druhou teorií týkající se pouze žaludku a duodena je vředová choroba, kdy penetrací peptického vředu je vytvořena komunikace se žlučovým stromem. Až 90 % pacientů s cholecysto-gastrointestinální píštělí má v anamnéze Mirizziho syndrom [15]. Raritou je biliární ileus popisovaný jako následek endoskopické retrográdní cholangiopankreatikografie (ERCP), při níž následkem papilosfinkterotomie dojde k uvolnění a vycestování konkrementu do GIT [16]. Potíže činí v 90 % kameny velikosti větší než 20 mm. V 50−75 % dochází k obstrukci v oblasti terminálního ilea a ileocékálního přechodu, ve 20−40 % v oblasti jejuna a proximálního ilea, v 10 % v žaludku a duodenu. K obstrukci tračníku dochází vzhledem k šířce lumen prakticky pouze při preexistující patologii, zejména pozánětlivých strikturách různé etiologie, tumorózních stenózách, které dosud byly zcela asymptomatické [17].
Stanovení přesné diagnózy jako příčiny obstrukčního ileu je velmi obtížné, resp. je založené na souboru nepřímých příznaků svědčících pro biliární ileus. Jedná se o tzv. Rieglerovu trias zahrnující ektopický konkrement, aerobilii a dilataci střevních kliček nad překážkou [18]. Specifickou nosologickou jednotkou je v této souvislosti popisovaná obstrukce na přechodu žaludku a duodena konkrementem zaklíněným v oblasti pyloru či bulbu duodena, klinicky nesoucí známky vysokého ileu, označována jako Bouveretův syndrom. Jeho příčinou je vředová choroba komplikována penetrací vředu do biliárního stromu. Nejlepší diagnostickou metodou je CT, které jednoznačně potvrdí diagnózu biliárního ileu, určí polohu konkrementu, poskytne cenné informace o přehlednosti podjaterní krajiny a eliminuje prolongaci správné léčby v důsledku diferenciálně diagnostických rozvah [19].
Léčba biliárního ileu je v zásadě chirurgická. Nabízejí se 3 možnosti léčby – prostá extrakce konkrementu; extrakce konkrementu a cholecystektomie ve druhé době (two-stage) a extrakce konkrementu a cholecystektomie v jedné době (one-stage). Při volbě léčebné strategie je nutné zhodnotit zejména celkový zdravotní stav nemocného a lokální nález v podjaterní krajině při laparotomii. V zásadě platí, že čím vyšší věk pacienta, více komorbidit a vyšší operační riziko, tím jednodušší operační výkon volíme. Přeneseno do praxe, nezbytným výkonem je odstranění konkrementu z příslušné části GIT, nejčastěji cestou enterotomie. Standardní operační přístup je laparotomický, nicméně jsou publikovány kazuistické práce popisující úspěšnou extrakci konkrementu laparoskopicky, resp. laparoskopicky asistovaně [20]. K resekčním výkonům přistupujeme pouze v případech narušení vitality střeva, perforaci či významných stenózách a nemožnosti vybavení konkrementu ze střevního lumen. Teoreticky lze jednodobé operace připustit u pacientů v dobré kondici, kde lze předpokládat dobrou tendenci k hojení (riziko insuficience sutury při zrušení a přešití píštěle), a je-li oblast podjaterní krajiny natolik přehledná, aby bylo provedení cholecystektomie bezpečné a nedošlo k iatrogennímu poranění žlučových cest. Výhodou jednodobé operace je prevence recidivy biliárního ileu, akutní cholecystitidy, vzniku karcinomu žlučníku v důsledku chronických změn a snížení rizika akutní cholangoitidy. Praktická zkušenost je ale opačná, při laparotomii ve většině případů nalézáme „nerozpreparovatelnou“ podjaterní oblast a biliární ileus je řešen pouze extrakcí konkrementu. Literární zdroje udávají, že ve více než v 50 % dochází ke spontánnímu uzávěru píštěle. Co se týká dvoudobých operací, nejčastěji k cholecystektomii přistupujeme až tehdy, objeví-li se nové komplikace cholecystolitiázy, zejména cholecystitida či recidiva biliárního ileu. Elektivní operace nadále asymptomatických jedinců vyššího věku představují vysokou operační zátěž a výrazně zvyšují jejich morbiditu i mortalitu [21,22]. Ve světovém písemnictví existují práce předkládající využití endoskopických přístupů k extrakci konkrementu ze žaludku či duodena, resp. tračníku cestou ezofagogastroduodenoskopie, resp. kolonoskopie [23].
Závěr
Předkládaná práce je praktickou ukázkou synchronního nálezu vzácného maligního onemocnění tračníku, poukazuje na odlišnosti klinických projevů, vlastností a chování od klasického kolorektálního karcinomu, díky nimž může zůstat dlouho neodhalené, resp. diagnóza je stanovena v pokročilejším stádiu.
U našeho pacienta nepochybně přispěla ke klinické manifestaci přítomnost biliárního konkrementu způsobující zánětlivou reakci stěny tračníku imitující akutní divertikulitidu. V opačném případě by pravděpodobně diagnóza lymfomu tračníku zůstala neodhalena, poněvadž pro hematologickou malignitu ani jiné gastrointestinální onemocnění pacient neměl žádné klinické ani laboratorní příznaky.
Seznam zkratek:
CT - počítačová tomografie
ERCP - endoskopická retrográdní cholangiopankreatikografie
GIT - gastrointestinální trakt
NPB - náhlá příhoda břišní
PET - počítačová emisní tomografie
PGIL - primární lymfom gastrointestinálního traktu
PLT - primární lymfom tračníku
Práce byla podpořena Výzkumným záměrem Univerzity Karlovy v Praze P36.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Monika Černá
Chirurgická klinika FN a LF UK v Plzni
alej Svobody 80
304 60 Plzeň
e-mail: monika-cerna@centrum.cz
Zdroje
1. Tomíška M, Vášová I. Současná terapie primárních lymfomů gastrointestinálního traktu. Klin Farmakol Farm 2004;18 : 153−9.
2. Quayle FJ, Lowney JK. Colorectal lymphoma. Clin Colon Rectal Surg 2006;19 : 49–53.
3. Ghimire P, Wu G, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol 2011;17 : 697−707.
4. Dawson IM, Cornes JS, Morson BC. Primary malignant lymphoid tumours of the intestinal tract. Report of 37 cases with a study of factors influencing prognosis. Br J Surg 1961;49 : 80–9.
5. Zighelboim J, Larson MV. Primary colonic lymphoma. Clinical presentation, histopathologic features, and outcome with combination chemotherapy. J Clin Gastroenterol. 1994;18 : 291–7.
6. Janíková A, Zambo I, Baumeisterová A, et al. Lymfomy gastrointestinálního traktu – klinicko-patologický přehled. Transfuze Hematol dnes 2013;19 : 140−51.
7. Rohren EM, Turkington TG, Coleman RE. Clinical applications of PET in oncology. Radiology 2004;231 : 305–32.
8. Štefánek J, Morávková P, Žák P, et al. Atypický obraz infiltrace tračníku lymfomem u pacienta s chronickou lymfatickou leukémií. Gastroent Hepatol 2015;69 : 141−5.
9. Morrison VA. Evolution of R-CHOP therapy for older patients with diffuse large B-cell lymphoma. Expert Rev Anticancer Ther 2008;8 : 1651–8.
10. Gonzalez QH, Heslin MJ, Dávila-Cervantes A, et al. Primary colonic lymphoma. Am Surg 2008;74 : 214–6.
11. Kim SJ, Kang HJ, Kim JS, et al. Comparison of treatment strategies for patients with intestinal diffuse large B-cell lymphoma: Surgical resection followed by chemotherapy versus chemotherapy alone. Blood 2011;117 : 1958−65.
12. Avilés A, Neri N, Huerta-Guzmán J. Large bowel lymphoma: an analysis of prognostic factors and therapy in 53 patients. J Surg Oncol 2002;80 : 111–5.
13. Lai YL, Lin JK, Liang WY, et al. Surgical resection combined with chemotherapy can help achieve better outcomes in patients with primary colonic lymphoma. J Surg Oncol 2011;104 : 265−8.
14. Loizides S, Reese GE. Gallstone ileus. Internal Medicine Journal 2011;41 : 705–6.
15. Beltran MA, Csendes A, Cruces KS. The relationship of Mirizzi syndrome and cholecystoenteric fistula: validation of a modified classification. World J Surg 2008;32 : 2237.
16. Despland M, Clavien PA, Mentha G, et al. Gallstone ileus and bowel perforation after endoscopic sphincterotomy. Am J Gastroenterol 1992;87 : 886.
17. Ayantunde AA, Agrawal A. Gallstone ileus: diagnosis and management. World J Surg 2007;31 : 1292.
18. Clavien PA, Richon J, Burgan S, et al. Gallstone ileus. British Journal of Surgery 1999;77 : 737–42.
19. Kishi K, Yamada K, Sugiyama T. Gastric outlet obstruction caused by a large gallstone in the duodenum (Bouveret‘s syndrome). Clin Gastroenterol Hepatol 2008;6 : 11.
20. Zygomalas A, Karamanakos S, Kehagias I. Totally laparoscopic management of gallstone ileus – technical report and review of the literature. J Laparoendosc Adv Surg Tech A. 2012;22 : 265–8.
21. Hoch J, Kubáčková K. Lymfom rekta – diagnóza k operaci? Rozhl Chir 2009;88 : 317−9.
22. Tan YM, Wong WK, Ooi LL. A comparison of two surgical strategies for the emergency treatment of gallstone ileus. Singapore Med J 2004;45 : 69.
23. Kim YG, Byeon JS, Lee SK, et al. Gallstone ileus successfully treated with endoscopic fragmentation by using double-balloon endoskopy. Gastrointestinal Endosopy 2011;74 : 228–30.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Česká chirurgie 2016Článek Volby do ČCHS ČLS JEP 2016
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2016 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Znalost vlastních komplikací − trnitá cesta ke zlepšování výsledků léčby
- Primární zhoubné nádory tenkého střeva
- Krvácení po pankreatektomii (PPH), prevalence, diagnostika a řešení
- Kvalita života po extenzivních pánevních operacích
- Cirkumskriptní a difuzní peritonitis: závažné komplikace po operacích bariatrické a metabolické chirurgie, specifika při jejich diagnostice a terapii
- Za doc. MUDr. Milanem Krajíčkem, DrSc.
- Synchronní kolorektální karcinom a nehodgkinský lymfom – popis dvou případů
- Corpus alienum − migrující cizí těleso
- Koincidence lymfomu tračníku a biliárního ileu – kazuistika
- Česká chirurgie 2016
- Volby do ČCHS ČLS JEP 2016
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Primární zhoubné nádory tenkého střeva
- Corpus alienum − migrující cizí těleso
- Cirkumskriptní a difuzní peritonitis: závažné komplikace po operacích bariatrické a metabolické chirurgie, specifika při jejich diagnostice a terapii
- Synchronní kolorektální karcinom a nehodgkinský lymfom – popis dvou případů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



