-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné podmínky přípravy a použití biologických kožních krytů pro léčbu popálenin v České republice
Autoři: P. Měřička 1; L. Klein 2,3; H. Straková 1
Působiště autorů: Tkáňová ústředna Fakultní nemocnice Hradec Králové, vedoucí lékař: MUDr. P. Měřička, Ph. D. 1; Chirurgická klinika UK v Praze Lékařské fakulty v Hradci Králové a Fakultní nemocnice Hradec Králové přednosta: Prof. MUDr. A. Ferko, CSc. 2; Katedra válečné chirurgie Fakulty vojenského zdravotnictví Univerzity obrany Hradec Králové vedoucí: Doc. MUDr. J. Páral, Ph. D. 3
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 5, s. 279-282.
Kategorie: Postgraduální vzdělávání
Úvod
Biologické náhrady kožního krytu mohou být použity jako náhrada celé kůže nebo jako stimulace hojení rány při parciální ztrátě kůže. Přitom lze použít tyto kryty:
Dermoepidermální autoštěpy, dermoepidermální aloštěpy, dermoepidermální xenoštěpy, chorioamniové štěpy, kultivované kožní kryty a kompozitní štěpy. Trvalé uzavření rány vždy vyžaduje použití autoštěpu nebo kultivovaného kožního krytu. Vitální dermoepidermální aloštěpy jsou typicky používány ve formě dočasné kožní náhrady, která se po přihojení na nekrektomovanou plochu chirurgicky odstraní a nahradí autoštěpem v intervalu 14 až 21 dnů. Dermoepidermální aloštěpy, chorioamniové štěpy a dermoepidermální xenoštěpy se používají též jako biologický obvaz u rozsáhlých popálenin II. stupně do doby spontánní epitelizace. Xenoštěpy byly hojně používány i jako dočasný kryt nekrektomované plochy do provedení autotransplantace. V tomto případě se štěpy nenechávaly přihojit a vyměňovaly se v pravidelných 3denních intervalech. Jejich nespornou výhodou byly nelimitované zdroje, což umožňovalo, jak jsme sami prokázali po železničním neštěstí v Baškirii v červnu 1989, i jejich použití za mimořádných okolností [1,2,3].
V dalším textu probereme podmínky odběru a konzervace jednotlivých zmíněných druhů krytů především s ohledem na splnění požadavků nové legislativy Evropských společenství a harmonizovaných právních norem České republiky (ČR). Tyto normy na jedné straně nepochybně posílily bezpečnost použití těchto krytů a práva dárců, na druhé straně výrazně omezily jejich nabídku a okruh jejich poskytovatelů ve srovnání se situací před jejich přijetím v roce 2004. V tomto textu se omezíme na popis dopadu těchto změn na praxi plastického, resp. popáleninového chirurga. Zájemce o bližší seznámení s problematikou nové legislativy včetně procesu licencování tkáňových bank odkazujeme na naše dříve publikované práce [4,5].
1. Alogenní dermoepidermální štěpy
Použití vitálních dermoepidermálních alotransplantátů je stále považováno za zlatý standard pro dočasné krytí excidované popálené plochy (Obr. 1), pokud není možné okamžitě provést autotransplantaci [6]. Na tyto kryty se v plné míře vztahují nové směrnice Evropských společenství č. 23/2004/ES, 17/2006/ES a 86/2006/ES a harmonizované národní normy, zákon č. 296/2008 Sb. (zákon o lidských tkáních a buňkách) a vyhláška MZdČR č. 422/2008/Sb. [5]. Každá tkáňová banka, která tyto kryty poskytuje, musí mít platné povolení Státního ústavu pro kontrolu léčiv (SÚKL) pro opatřování, zpracování, popř. distribuci kožní tkáně. Seznam držitelů těchto povolení je veřejně dostupný na webových stránkách SÚKL [7].
Obr. 1. Rejekce epidermis u alogenního dermoepidermálního štěpu excidovaného po 14 dnech po transplantaci <i>Foto: MUDr. Z. Kerekes, CSc.</i> 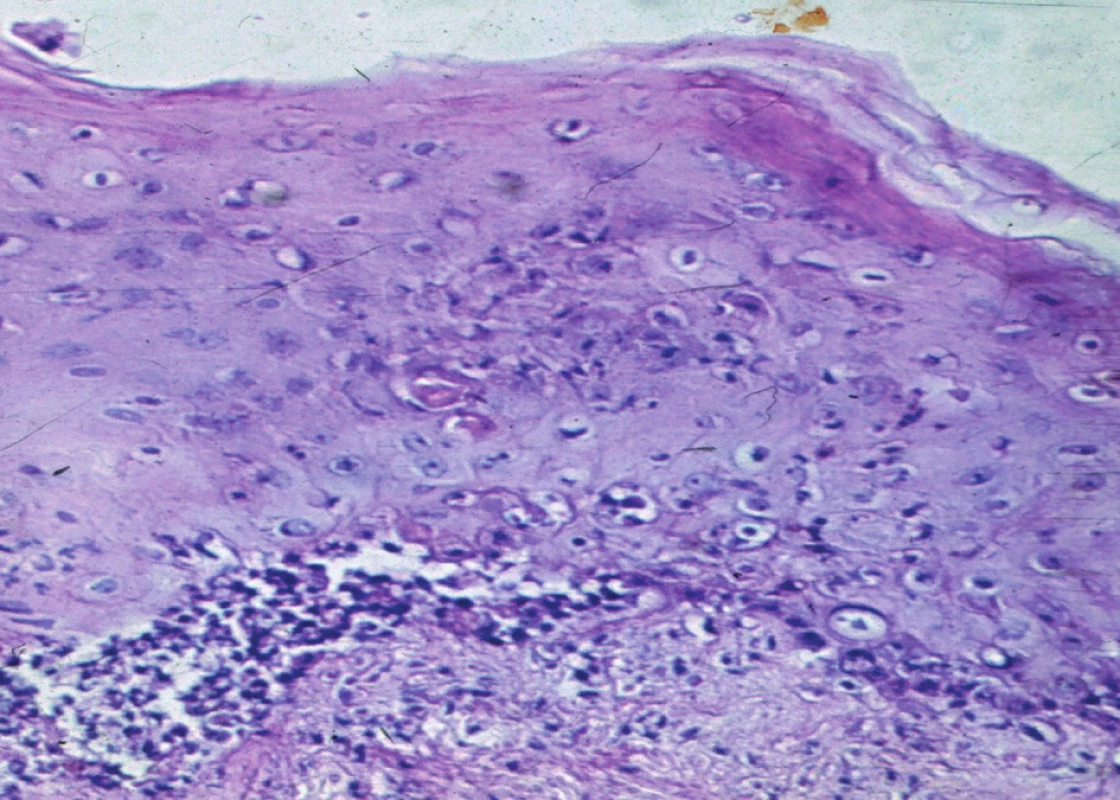
Odběr kožní tkáně od žijícího dárce probíhá vždy s jeho informovaným souhlasem, popř. se souhlasem zákonného zástupce. U zemřelých dárců je v souladu s transplantačním zákonem (zákon č. 276/2002 Sb.) souhlas předpokládán. Musí však být prověřeno, zda potenciální dárce není zapsán v Národním registru osob odmítajících odběr a osoby blízké musejí být informovány o úmyslu odběr provést. Pro splnění všech těchto povinností je ideální, je-li v příslušné nemocnici etablován dárcovský program tkání a orgánů, jak popisujeme v kapitole o odběru tkání v rámci multiorgánového odběru v nedávno vydané kolektivní česko-slovenské monografii Odběry orgánů k transplantacím/Odbery orgánov na transplantácie [8]. Plastický chirurg zajišťuje v tomto systému pouze ryze technickou stránku odběru, která se neliší od odběru dermoepidermální tkáně při běžné operaci. S odebranou tkání zachází přesně podle vnitřních předpisů příslušného tkáňového zařízení, se kterým spolupracuje.
2. Alogenní chorioamniové a amniové štěpy
Alogenní chorioamniové štěpy, resp. amniové, jsou široce používány jako náhrada kožního krytu v zemích, kde přístup k zemřelým dárcům je velmi obtížný až nemožný, tj. např. v zemích Blízkého a Středního východu [9]. Jako výhodná alternativa se ale uplatňovaly nebo stále uplatňují i v zemích střední Evropy, Českou republiku nevyjímaje [10,11]. Zejména velmi tenké amnion je vhodným krytem pro krytí popálenin ve zvláště citlivých lokalizacích (obličej, oční víčka apod.). Platí pro ně stejná pravidla jako pro dermoepidermální štěpy od žijících dárců, seznam držitelů povolení pro jejich přípravu je veřejně dostupný na stránkách SÚKL [7].
3. Xenogenní dermoepidermální štěpy
Vzhledem k častému nedostatku alotransplantátů bylo v ČR donedávna použití vitálních xenotransplantátů považováno za optimální řešení. V celosvětovém měřítku byla nejčastěji používána prasečí kůže [6,12,13], je však popsáno i použití kůže hovězí, ovčí, psí nebo dokonce kůže tropických žab [6]. Použití hovězí a zejména ovčí kůže v současné době považujeme za rizikové vzhledem k možnosti přenosu spongiformní encefalopatie (scrapie u ovcí, resp. nemoc šílených krav), stejně jako použití kůže psí, kde je nebezpečí přenosu vztekliny. Naproti tomu poněkud exotické použití kůže studenokrevných je z hlediska bezpečnosti bezproblémové. Prase domácí sice není uvedeno na seznamu rizikových zvířecích druhů, v literatuře je však široce diskutována problematika tzv. endogenních prasečích retrovirů [4]. V některých zemích Evropské unie (EU), např. v Bulharsku, je použití vitálních xenotransplantátů dosud možné ve stejném režimu jako u alogenních štěpů, podobně jako tomu bylo v minulosti v ČR (Obr. 2). V současné době je v ČR vitální xenotransplantát klasifikován jako léčivo [4], což činí jejich přípravu ve standardně vybavené tkáňové bance velmi obtížnou vzhledem k povinnosti striktního oddělení odběru a zpracování alogenních a xenogenních tkání. Xenogenní kůži je však možno použít ve formě zdravotnického prostředku – sterilizovaného avitálního štěpu. Příkladem je Xe-Derma® (14,15), která je v současné době v ČR k dispozici, nebo v minulosti dostupný Suiderm®, vyvinutý v Biovetě Terezín ve druhé polovině 80. let minulého století. Společnou nevýhodou těchto krytů je ovšem absence epidermální vrstvy.
Obr. 2. Odběr xenogenního dermoepidermálního štěpu bateriovým elektrodermatomem (autor vpravo) <i>Foto: E. Vídeňská</i> 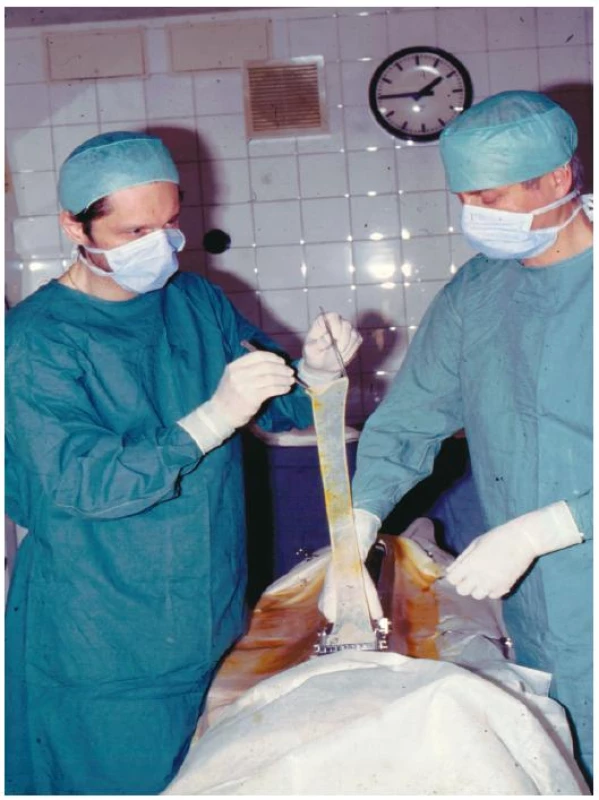
4. Kultivované kožní kryty
Alternativu léčby rozsáhlých popálenin klasickými tkáňovými štěpy představuje autotransplantace kultivovaných epidermálních keratinocytů [16]. Epiteliální blány pocházející ze sekundárních kultur jsou k dispozici obvykle během 21 dnů po odběru malého vzorku kožní tkáně. Technika kultivace umožňuje expanzi až 1000krát, tzn. z odběru vzorku o velikosti 4x4 cm je možno vypěstovat až 16 000 cm2 kultivovaného krytu, což je postačující pro pokrytí celého povrchu průměrného dospělého jedince [6]. Nevýhodou použití keratinocytů ve formě blány u hlubokých popálenin je tendence k jizvení z důvodu absence dermální vrstvy a fragilita epidermis a tvorba puchýřů jako důsledek vytvoření plochého dermo-epidermálního spojení, resp. pozdní vytváření dermálních papil [17]. Sami jsme tento jev pozorovali u případu použití keratinocytů u Lyellova syndromu, kde se vytvořily hluboké kožní defekty [18]. Přihojení keratinocytů může být zlepšeno kombinací s tenkým dermálním štěpem metodikou podle Cuona nebo kombinací se speciálními arteficiálními náhradami, např. na bázi esteru kyseliny hyaluronové [19,20] (Obr. 3).
Obr. 3. Přikládání kultury autologních epidermálních keratinocytů na nosiči z esteru kyseliny hyaluronové (Laserskin, Fidia Advanced Biopolymers, Abano Therme, Itálie) na chronický kožní defekt dolní končetiny <i>Foto: Doc. MUDr. L. Klein, CSc.</i> 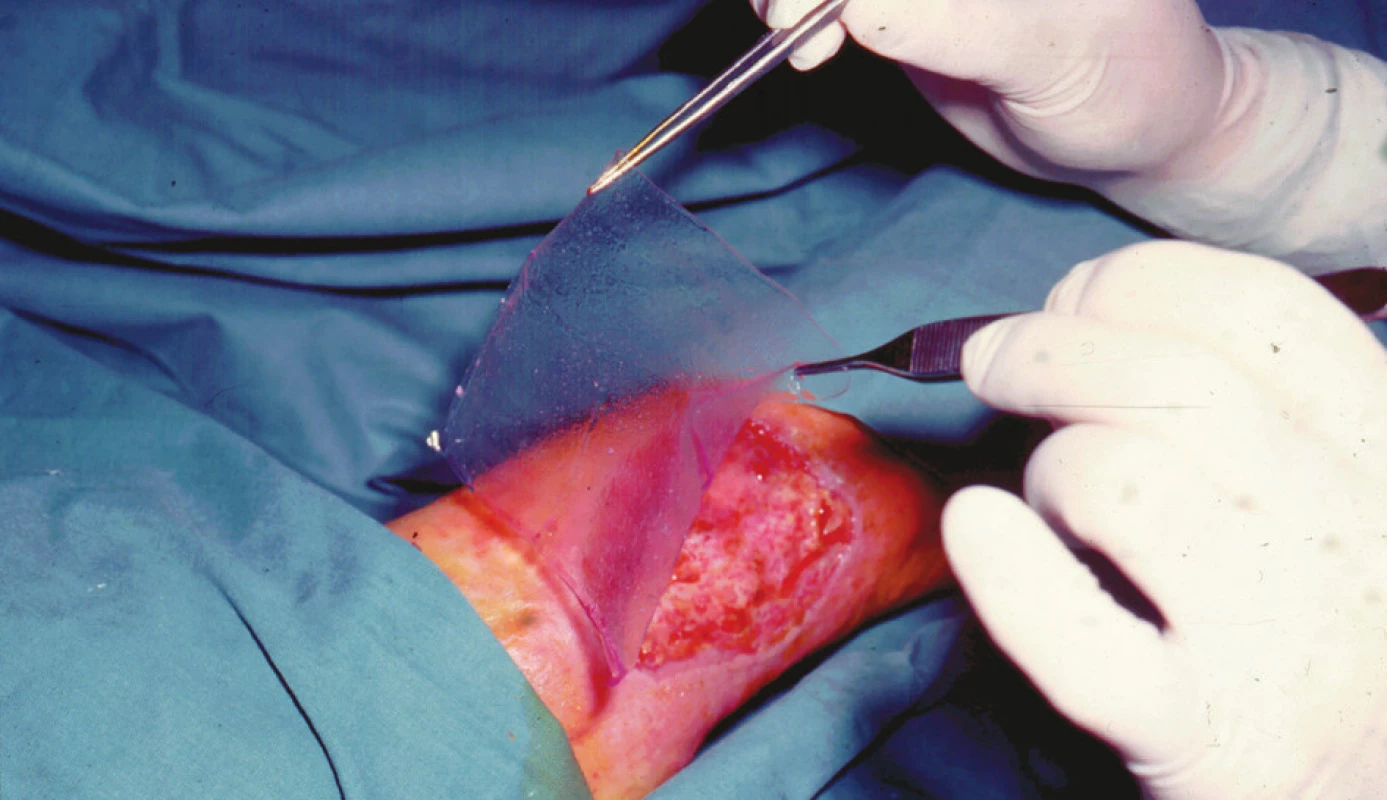
Až do konce roku 2008 bylo v ČR možno kultivované kožní kryty získávat z tkáňových bank, které je měly na seznamu biologického materiálu hrazeného zdravotnickými pojišťovnami na neziskovém principu a bez daně z přidané hodnoty. V současné době to již není možné, neboť podle Nařízení Evropského parlamentu a Rady z roku 2007 platného od 1. 1. 2009 se tyto kryty řadí mezi léčivé přípravky pro moderní terapii, a plně se na ně tudíž vztahuje zákon o léčivech. Navíc není u těchto přípravků možná registrace na národní úrovni, ale pouze centrálně u Evropské lékové agentury v Londýně. Do konce roku 2012 bylo ještě možné tyto přípravky používat v rámci specifických léčebných programů schválených MZdČR. Od 1. 1. 2013 je toto však možné výhradně v rámci klinického hodnocení, tzn., že léčbu nelze hradit z prostředků zdravotního pojištění. Již od 1. 1.2009 musí mít výrobce těchto přípravků povolení k výrobě hodnocených léčivých přípravků od SÚKL a certifikát správné výrobní praxe platný pro celou EU. Seznam držitelů těchto povolení, jakož i držitelů povolení ke klinickému hodnocení, je veřejně dostupný na webových stránkách SÚKL [7]. V některých zemích, např. na Slovensku, se ve vztahu k použití těchto krytů uplatňuje tzv. nemocniční výjimka, která je i v ČR nyní uzákoněna novelou zákona o léčivech z 19.2.2013. Podmínkou udělení této výjimky je ovšem minimálně průkaz bezpečnosti a snášenlivosti přípravku v rámci klinického hodnocení.
5. Technologie konzervace kožní tkáně
Přehled metod konzervace kožní tkáně publikoval již před 47 lety Perry [21], později byly přehledné články publikovány Baxterem [22], Kearnym [23], McCauleym [24] i námi [25]. První práce popisují různé modifikace použití vlhké komůrky nebo konzervace v různých kapalných médiích a skladování při teplotě +4 °C do 14 dnů, případně i méně, 7–8 dnů [23]. Principy moderní kryokonzervace kožní tkáně vypracovali May a DeClement [26]. Odebraná tkáň natažená na umělý nosič se v plastickém vaku na jedno použití zmrazí buď řízeně v programovatelném zmrazovači a uloží do par kapalného dusíku, nebo neřízeně vložením do mechanického zmrazovacího zařízení o teplotě - 80 °C, obvykle jištěného kapalným dusíkem, kde se též skladuje. Jako kryoprotektivum se používá dimetylsulfoxid v 10% nebo glycerol v 15% koncentraci. Moderní skladovací kontejnery umožňují skladovat tkáně výhradně v parách takovým způsobem, že kontakt vaku s konzervovanou tkání s kapalným dusíkem je zcela vyloučen. Průkopníky kryokonzervace kožní tkáně v bývalém Československu byli Böhm a Dvořák [27]. Na rozdíl od minulosti, kdy se k balení tkáně používaly často i improvizované prostředky [27] nebo obaly určené např. pro sterilizaci (28), jsou dnes běžně dostupné certifikované obaly určené pro kryokonzervaci kůže, které plně odolávají teplotám kapalného dusíku.
Kromě vitálních alotransplantátů jsou v EU všeobecně dostupné i avitální štěpy konzervované v koncentrovaném glycerolu metodikou Euroskin Bank, Beverwijk, Holandsko [29].
Závěr
Přizpůsobení legislativy České republiky požadavkům směrnic Evropských společenství regulujících zdravotnické prostředky biologického původu, tkáně a buňky lidského původu určené ke klinickému použití a léčivé přípravky vyrobené expanzí lidských buněk in vitro, zásadně změnilo podmínky přípravy a použití biologických kožních krytů ve srovnání se situací před rokem 2004. Alogenní minimálně manipulované kožní štěpy je nutno získávat pouze z licencovaných tkáňových bank, avitální xenogenní tkáně jsou dostupné ve formě komerčně vyráběného zdravotnického prostředku. Kryty z pomnožených autologních epidermálních keratinocytů nebo jejich kombinace s biologickými nebo umělými nosiči mají charakter léčivých přípravků pro moderní terapii a jsou v současné době použitelné pouze v rámci schválených klinických studií.
MUDr. Pavel Měřička, Ph.D.
Tkáňová ústředna Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: pavel.mericka@fnhk.cz
Zdroje
1. Měřička P, Klein L, Preiss J, Ettlerová E. The Role of a Tissue Bank in Disaster Planning. In: Maselis M, Gunn SWA (ed.). Proceedings of the Second International Conference on Burns and Fire Disasters: Perspectives 2000 Palermo, Kluwer Academic Publishers;1. vydání 1995 : 75–83.
2. Klein L, Měřička P. Příprava a využití biologických krytů v léčbě popálených z pohledu válečné chirurgie a medicíny katastrof. Hradec Králové, Vojenská lékařská akademie J. E. Purkyně 2000 : 83.
3. Měřička P, Hošek F. The importance of stored supplies of biological skin covers in territorial management of mass burn casualties. Acta Chir Plast 2002;44,3 : 90–96.
4. Měřička P. Current trends in safety assurance for tissue grafts used in burn treatment. Acta Chir Plast 2006;48 : 51–58.
5. Měřička P, Navrátil P, Špatenka J. Legislativa dárcovství a odběru tkání v České republice. In: Baláž P, Janek J, Adamec M. Odběry orgánů k transplantaci/Odbery orgánov na transplantácie. Praha, Karolinum 2011 : 223–239.
6. Hansbrough JF. Wound Coverage with Biological Dressings and Cultured Skin Substitutes. Austin, R.G. Landes Company, Second Printing 1993 : 152.
7. Seznam držitelů povolení SÚKL. Dostupný na www.sukl.cz.
8. Měřička P, Špatenka J, Navrátil P. Organizace a chirurgická technika odběru tkání v rámci multiorgánového odběru. In: Baláž P, Janek J, Adamec M. Odběry orgánů k transplantaci/Odbery orgánov na transplantácie. Praha, Karolinum 2011 : 240–251.
9. Haberal M, Oner Z, Bayractar U, Bilgin N. The use of silver nitrate incorporated amniotic membrane as a temporary dressing. Burns 1987;13 : 159–163.
10. Klen R, Skalská H. A comparison of dermoepidermal and chorioamniotic grafts in the treatment of burns. Acta Chir Plast 1976; 18 : 225–232.
11. Koller J, Panáková E. Experience in the use of fetal membranes for the treatment of burns and other skin defects. In: Phillips GO, Strong DM, von Versen R, Nather A. (eds): Advances in Tissue Banking, vol. 2. Singapore, New Jersey, London, Hong Kong, World Scientific 1998 : 353–359.
12. Moserová J, Houšková E. The Healing and Treatment of Skin Defects. Basel, Munchen, Paris, London, New York, New Delhi, Singapore, Tokyo, Sydney, Karger 1989 : 163.
13. Königová R, Bláha J, a kol. Komplexní léčba popáleninového traumatu. Praha, Karolinum, 1. vydání 2010 : 430.
14. Zajíček R, Matoušková E, Brož L, Kubok R, Waldauf P, Königová R. New biological temporary skin cover Xe-Derma® in the treatment of superficial scald burns in children. Burns 2011; 37 : 333–337.
15. Zajíček R, Pafčuga I, Šuca H, et al. Hojení široce síťovaných autotransplantátů pomocí autologních epidermálních buněk a bezbuněčné xenodermis Xe-Derma®. Hojení ran 2012;6 : 12–18.
16. Gallico GG, OęConnor NE, Compton CC, Kehinde O, Green H. Permanent coverage of large burn wounds with autologous cultured human epithelium. N Engl J Med 1984;311,7 : 448–451.
17. Compton CC, Gill JM, Bradford DA, Regauer S, Gallico GG, OęConnor NE. Skin regenerated from cultured epithelial autografts on full-thickness burn wounds from 6 days to 5 years after grafting. A light, electron microscopic and immunohistochemical study. Lab Invest 1989;60 : 600–612.
18. Klein L, Měřička P, Straková H, Jebavý L, Nožičková M, Bláha M, Talábová Z, Hošek F. Biological covers in treatment of two cases of the Lyellęs syndrome. Ann Transplant 1997;2 : 45–48.
19. Cuono CB, Langdon R, Birchall N, Barttlbort S, McGuire J. Composite autologous, allogeneic skin replacement: Development and clinical application. Plast Reconstr Surg 1987;80 : 626–635.
20. Donati L. Development and clinical application of keratinocytes cultured on hyaluronic ester membrane in burned patients. In: Maselis M, Gunn SWA (eds.). The management of burns and fire disasters: Perspectives 2000. Dordrecht, Boston, London, Kluwer Academic Publishers 1995 : 357–361.
21. Perry VP. A review of skin preservation. Cryobiology 1966;192–230.
22. Baxter C, Aggarwal S, Dilller KR. Cryopreservation of Skin – A review. Transplant. Proc Suppl 1985;XVII:112–120.
23. Kearney J. Banking of skin grafts and biological dressings. In: J.A.D. Settle (ed.): Principles and Practice of Burns Management. New York, Edinburg, London, Madrid, Melbourne, San Francisco, Tokyo, Churchill Livingstone 1996 : 1103–1108.
24. Mc Cauley RL. The skin bank. In: Herndon DN. Total Burn Care. London, Philadelphia, Toronto, Sydney, Tokyo,W.B.Saunders, Co. Ltd. 1996 : 159–163.
25. Měřička P, Klein L, Straková H, Šubrtová D. Biological Skin Cover: Banking and Application. In: Phillips GO, Strong DM, von Versen R, Nather A (eds). Advances in Tissue Banking (Vol. 2). Singapore, New Jersey, London, Hong Kong, World Scientific Publishing Co. 1998 : 323–341.
26. May SR, DeClement FA. Skin Banking, Part III. Cadaveric allograft skin viability. J Burn Care Rehab 1981;2 : 128–141.
27. Praus R, Böhm F, Dvořák R. Skin Cryopreservation I. Incorporation of radioactive sulphate as a criterion of pigskin graft viability after freezing to -196°C in the presence of cryoprotectants. Cryobiology 1980;17 : 130–134.
28. Měřička P, Straková H, Čermák P, Štěpánová V, Hradecký Z, Drahošová M. New Safety Assurance for Biological Skin Covers. Acta Chir Plast 2002;44 : 23–29.
29. Stark GB, Kaiser HW. Cologne Burn Centre experience with glycerol preserved allogeneic skin. Part II: Combination with autologous cultured keratinocytes. Burns 1994;20 : 34–38.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Intenzivní péče v chirurgiiČlánek Elektrotrauma
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Intenzivní péče v chirurgii
- Vakuová drenáž jako varianta terapie infektu cévní infrainguinální protetické rekonstrukce – zkušenosti z našeho pracoviště a shrnutí problematiky
- Vliv dehiscence anastomózy na onkologické výsledky u resekčních výkonů pro karcinom rekta
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Artrodéza ramene zevním fixatérem v léčbě chronických zánětlivých komplikací zlomenin proximálního humeru
- Zemřel profesor Jindřich Šebor
- Břišní aktinomykóza – 3 kazuistiky a přehled literatury
- Významné životní jubileum profesora Jana Schütznera
- Několik poznámek k současným principům léčby termických úrazů
- Chirurgické výkony v léčbě popáleninového traumatu
- Možnosti náhrady kože v 21. storočí
- Současné podmínky přípravy a použití biologických kožních krytů pro léčbu popálenin v České republice
- Kožní náhrada Integra® v klinické praxi
- Elektrotrauma
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgické výkony v léčbě popáleninového traumatu
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Elektrotrauma
- Kožní náhrada Integra® v klinické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



