-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transplantace plic
Lung Transplantation
Lung transplantation is an effective life-saving therapy for the treatment of a variety of end-stage lung diseases. However, the application of lung transplantation is hindered by multiple factors such as the shortage of organ donors, early graft failure, infection, and chronic graft dysfunction.
A novel strategy for donor lung preservation - ex-vivo lung perfusion (EVLP) – that keeps the organ at physiological protective conditions, has shown great promise to increase lung utilization by reassessing, treating, and repairing injured donor lungs prior to transplantation.
Infections are a major cause of early morbidity and mortality after lung transplantation. Because of the potential association of infections such as respiratory viral infections and gram-negative bacterial infections with bronchiolitis obliterans syndrome, prompt attention to these pathogens is critical. Despite marked improvements in early survival, long-term outcome after lung transplantation is still threatened by bronchiolitis obliterans syndrome. The program of lung transplantation in Czech Republic was started in University Hospital Motol in Prague in 1997. Nowadays in Czech Republic is performed about 20 transplants every year with results comparable to other advanced centers. Until September 2011, 175 transplants were carried out in Czech Republic.Key words:
lung transplant – indication – technique – complications
Autoři: R. Lischke
; J. Šimonek; J. Pozniak; J. Schützner; P. Pafko
Působiště autorů: III. chirurgická klinika 1. LF UK a FN Motol, přednosta: doc. MUDr. Robert Lischke, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 11, s. 612-620.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Transplantace plic je efektivní život zachraňující léčebná metoda pro pacienty v konečném stadiu některých plicních onemocnění. Provedení plicní transplantace je ovlivněno řadou faktorů jako je nedostatek vhodných dárců orgánů, časné selhání štěpu, infekce a chronická dysfunkce štěpu. Novou strategii pro udržení a přehodnocení dárcovské plíce představuje metoda ex-vivo plicní perfuze (EVLP), kdy je odebraný orgán uchováván ve fyziologických podmínkách ex-vivo, a může být opakovaně vyšetřován a dokonce léčen před vlastní transplantací. Tato metoda je do budoucnosti velmi slibná pro větší utilizaci jinak neakceptovatelných orgánů. Infekce je hlavní příčina časné morbidity a mortality po plicní transplantaci. Kvůli potencujícímu se vlivu infekce respiračními viry a gram negativními bakteriemi pro rozvoj bronchiolitis obliterans syndromu je časná pozornost věnovaná těmto patogenům kruciální. Navzdory značným pokrokům v krátkodobém přežívání pacientů, dlouhodobé přežívání je stále významně ovlivněno syndromem obstrukční bronchiolitidy. Program transplantace plic v České republice byl zahájen ve FN Motol v Praze v roce 1997. Nyní se v ČR provádí kolem 20 transplantací ročně s výsledky srovnatelnými s ostatními vyspělými centry. Do září 2011 bylo v České republice provedeno 175 transplantací.
Klíčová slova:
transplantace plic – indikace – technika – komplikaceHISTORIE
První transplantaci plic provedl v USA James Hardy v roce 1963, pacient však zemřel po 18 dnech. Hardy prokázal možnost technicky úspěšného provedení transplantace plic a i celosvětově vyvolal zájem o tuto metodu.
Skutečný úspěch a rozvoj této by metody byl umožněn až objevem cyklosporinu A (Jean Borel), který se stal základním kamenem imunosupresivní léčby a zahájil tak začátkem osmdesátých let úspěšnou éru orgánových transplantací.
Blok srdce a plic byl poprvé úspěšně transplantován ve Stanfordu v roce 1981, následovala první jednostranná transplantace plic v roce 1983 u padesátiosmiletého muže s idiopatickou plicní fibrózou a první úspěšná oboustranná transplantace en-bloc v roce 1986 pro sekundární emfyzém. Oba tyto výkony byly provedeny v Torontu pod vedením J. D. Coopera. En-bloc oboustranné transplantace však byly zatíženy neadekvátním počtem komplikací hojení tracheální anastomózy, a proto tato metoda byla nahrazena technikou bilaterální sekvenční transplantace plic.
Dnes je transplantace plic etablovanou klinickou metodou a limitem většího počtu výkonu je pouze nedostatek vhodných dárců. Jako možné řešení byla v posledních letech v University of Southern California vypracována a zavedena metoda transplantace plicních laloků od živých dárců, která bývá užívána téměř výhradně u dětí s cystickou fibrózou, kdy dva příbuzní poskytnou dva plicní laloky. Pro příjemce je riziko takového postupu srovnatelné s transplantací od kadaverózního dárce a operační rizika lobektomie pro dárce jsou v rukou zkušeného chirurga velmi malá.
Další možností jak řešit nedostatečnou nabídku je transplantace plic od dárců s nebijícím srdcem (non-heart-beating donors – NHBD). První úspěšnou transplantaci provedli Stig Steen a kolektiv v roce 2001 v Lundu ve Švédsku. Tato transplantace od dárce s nebijícím srdcem byla vyvrcholením dlouholetého úsilí o vypracování metodiky odběru, konzervace a posouzení funkčních kvalit štěpu.
Velká pozornost se věnuje využití marginálních dárců a agresivní péči o dárce ve snaze získat co nejvíce vhodných orgánů, protože právě nedostatek vhodných dárců a chronická rejekce jsou v současné době hlavními limity větší úspěšnosti plicních transplantací.
Poslední převratnou novinkou je „Ex vivo perfuze a rekondice“ štěpu s nedostatečnou funkcí, kdy v případě nedostatečné funkce plic je tento štěp standardně odebrán a ex vivo dále ventilován a perfundován. Během tohoto období je možno ovlivnit funkci štěpu ex vivo různými terapeutickými zásahy a v případě obnovení funkce je tento štěp implantován.
Program transplantace plic v České republice byl zahájen pod vedením prof. MUDr. Pavla Pafka, DrSc., ve FN Motol v Praze v roce 1997. Tento program je nejúspěšnější ze všech „východoevropských“ programů. Nyní se v ČR provádí kolem 20 transplantací ročně s výsledky srovnatelnými s ostatními vyspělými centry. Do září 2011 bylo v České republice provedeno 175 transplantací.
INDIKAČNÍ A KONTRAINDIKAČNÍ KRITÉRIA K ZAŘAZENÍ PACIENTA DO TRANSPLANTAČNÍHO PROGRAMU
K transplantaci plic jsou indikováni pacienti v konečném stadiu plicního onemocnění, u kterých riziko blízkého úmrtí převyšuje rizika samotné transplantace. Navíc však jejich celkový zdravotní stav nesmí ohrozit dlouhodobý úspěch a přežití po náročné operaci.
K transplantaci plic jsou indikováni pacienti splňující kritéria:
- Konečné stadium chronického onemocnění plic s vyčerpanými konzervativními léčebnými možnostmi.
- Očekávaná doba přežití je snížená, nicméně je vyšší než předpokládaná doba strávená čekáním na vhodný orgán na čekací listině (12–18 měsíců).
- Chybějící kvalita života, závislost na kyslíku, zvyšující se imobilita.
Absolutní kontraindikace
- Malignita v posledních 2 letech s výjimkou kožního skvamózního karcinomu a bazaliomu, k transplantaci mohou být indikováni pacienti po pěti letech bez známky relapsu maligního onemocnění po jeho radikální léčbě.
- Neléčitelné selhání dalšího významného orgánového systému. Ischemická choroba srdeční neřešitelná perkutánní intervencí či bypassem, nebo spojená s významně sníženou ejekční frakcí levé komory.
- Neléčitelná systémová infekce (např. hepatitida B, C, HIV).
- Významná hrudní či páteřní deformita.
- Nespolupráce při užívání léčby či při docházení na ambulantní kontroly.
- Neléčitelné psychiatrické onemocnění či psychologické poruchy znemožňující dodržování léčby.
- Absence sociálního zázemí.
- Kouření, alkoholismus, drogová závislost v průběhu posledních šesti měsíců.
Relativní kontraindikace
- Potřeba invazivní ventilace.
- Porucha renálních funkcí – creatinin clearence < 50mg/ml/min.
- Psychosociální nestabilita.
- Relativní kontraindikace je třeba posoudit v transplantačním centru.
ONEMOCNĚNÍ INDIKOVANÁ K TRASPLANTACI PLIC
CHOPN, Emfyzém při α-1-antitrypsin deficienci
Zařazení do transplantačního (tx) programu
- BODE index nad 5.
Indikace k transplantaci
- BODE index 7–10 či alespoň 1 z následujících bodů:
- Hospitalizace pro exacerbaci spojená s akutní hyperkapnií v anamnéze (pCO2 nad 50 mmHg).
- Plicní hypertenze či cor pulmonale či oboje i přes oxygenoterapii.
- FEV1 pod 20 %, DLCO pod 20 %, homogenní distribuce emfyzému.
Cystická fibróza, bronchiektázie.
Zařazení do tx programu
- FEV1 pod 30 % normy či rychlý pokles FEV1.
- Zvyšující se frekvence exacerbací vyžadující antibiotickou terapii.
- Neustupující či recidivující pneumotorax.
- Recidivující hemoptýza nekontrolovaná embolizací bronch. tepen.
Indikace k tx
- Oxygenodependentní respirační selhání.
- Hyperkapnie.
- Plicní hypertenze.
Idiopatická plicní fibróza (UIP) a nespecifická intersticiální pneumonie (NSIP)
Zařazení do tx programu
- Histologická či radiologická diagnóza UIP bez ohledu na vitální kapacitu.
- Histologická evidence NSIP.
Indikace k tx
- Histologická či radiologická diagnóza UIP a cokoliv z následujícího:
- DLCO pod 39 % normy.
- Pokles FEV1 o 10 % či více v průběhu posledních 6 měsíců sledování.
- Pokles saturace pulzním oxymetrem při 6MWT pod 88 %.
- Voštinovitá přestavba při HRCT.
- Histologická diagnóza NSIP a cokoliv z následujícího:
- DLCO pod 35 % normy.
- Pokles FEV1 o 10 % či více či pokles DLCO o 15 % a více v průběhu posledních 6 měsíců sledování.
Plicní arteriální hypertenze, chronická tromboembolická plicní hypertenze
Zařazení do tx programu
- NYHA funkční třída III nebo IV, bez ohledu na probíhající terapii.
- Rapidní progrese onemocnění.
Indikace k tx
- Perzistující funkční třída NYHA III. nebo IV. při maximální léčbě.
- Nízká ušlá vzdálenost při 6 MWT (pod 350 m).
- Selhání léčby intravenózním epoprostenolem či ekvivalentem.
- CI (cardiac index) menší než 2l /min/m2
- Tlak v pravé síni nad 15 mmHg.
Sarkoidóza
Zařazení do tx programu
- NYHA funkční třída III. nebo IV.
Indikace k tx
- Snížení tolerance fyzické námahy (NYHA III. či IV) a cokoliv z následujícího:
- Klidová hypoxemie.
- Plicní hypertenze.
- Zvýšený tlak v pravé síni nad 15 mmHg.
Lymfangioleiomyomatóza
Zařazení do tx programu
- NYHA funkční třída III. nebo IV.
Indikace k tx
- Těžké snížení plicních funkcí a tolerance fyzické námahy (např. VO2max pod 50 % normy).
- Klidová hypoxemie.
Granulomatóza z Langerhansových buněk (Histiocytóza X)
Zařazení do tx programu
- NYHA funkční třída III. nebo IV.
Indikace k tx
- Těžké snížení plicních funkcí a tolerance fyzické námahy.
- Klidová hypoxemie.
Plicní fibróza spojená se systémovým onemocněním (sklerodermie, revmatiodní artritida, onemocnění pojivové tkáně…)
- Nutné posuzovat individuálně, pacienta lze zařadit do programu v případě stabilizovaného neaktivního onemocnění, při prokázané aktivní vaskulitidě by neměl být pacient doporučen k tx.
ČEKACÍ LISTINA
Během čekací doby na transplantaci plic jsou pacienti většinou dále v péči ošetřujících lékařů. Pacient by měl být zařazen do rehabilitačního programu, jehož cílem je pacienta co nejlépe připravit k plánované operaci, posilovat svalstvo (cílený aerobní zátěžový trénink) a zlepšit jeho nutriční stav. Každé tři měsíce se konají pravidelné kontroly v transplantačním centru, kdy se hodnotí rychlost progrese základního onemocnění a aktualizuje se předtransplantační vyšetření a to zejména opakované vyšetření sputa. Morální a etické dilema pro transplantační tým vzniká u pacientů, kteří byly zařazení na čekací listinu v době, kdy např. pacienti s cystickou fibrózou byli kolonizováni bakteriálními kmeny citlivými na antibiotika in vitro a během čekací periody se vyvinula kompletní rezistence nebo se objevila jiná kontraindikace. Kritický nedostatek vhodných orgánů k transplantaci a stoupající tlak na provádění transplantací u pacientů s reálnou šancí na přežití vedou k vyřazení těchto pacientů z čekacích listin.
DÁRCE A ODBĚR PLIC
Při multiorgánovém odběru od dárce s bijícím srdcem je možný odběr plic pouze v 15–20 % případů. Důvodem je častá plicní infekce, která je u většiny intubovaných a dlouhodobě ventilovaných pacientů přítomna a která použití plic k transplantaci kontraindikuje. Dalším důvodem je značná vulnerabilita plicního parenchymu k řadě nepříznivých faktorů nastupujících po smrti mozku (neurogenní plicní edém) a v průběhu intenzivní péče, samozřejmě včetně iatrogenního poškození. Další komplikací, která znemožňuje odběr plíce jinak vhodné plíce, jsou poranění hrudníku, především u polytraumatizovaných zemřelých.
Z obecného hlediska je k transplantaci plic vhodná plíce se zachovalou funkcí, velikostí odpovídající hrudníku příjemce, kompatibilní v systému AB0.
Vhodným dárcem plic je tedy pacient, u kterého byla prokázána smrt mozku, který splňuje všechna obecná kritéria pro multiorgánový odběr a následující specifická kritéria pro odběr plic:
- Věk pod 60 let.
- AB0 kompatibilita.
- RTG plic bez patologického nálezu.
- RTG plic – snímek ze vzdálenosti 1 metru, který umožní porovnání velikosti plic dárce a příjemce (tzv. size matching).
Na RTG snímku jsou posuzovány 2 rozměry:
- Horizontální velikost plic – měřena v úrovni vrcholů bránice.
- Vertikální velikost plic – měřena od vrcholu plíce k vrcholu bránice v medioklavikulární čáře.
Obr. 1. Měření horizontálního a vertikálního rozměru plíce na RTG snímku a obvod hrudníku v rovině prsních bradavek a dolní apertury hrudní k posouzení velikosti plic Fig. 1. Measurement of horizontal and vertical lung sizes on x-ray. The chest circumference at the breast nipples level and at the level of the lower thoracic aperture for the lung size assessment 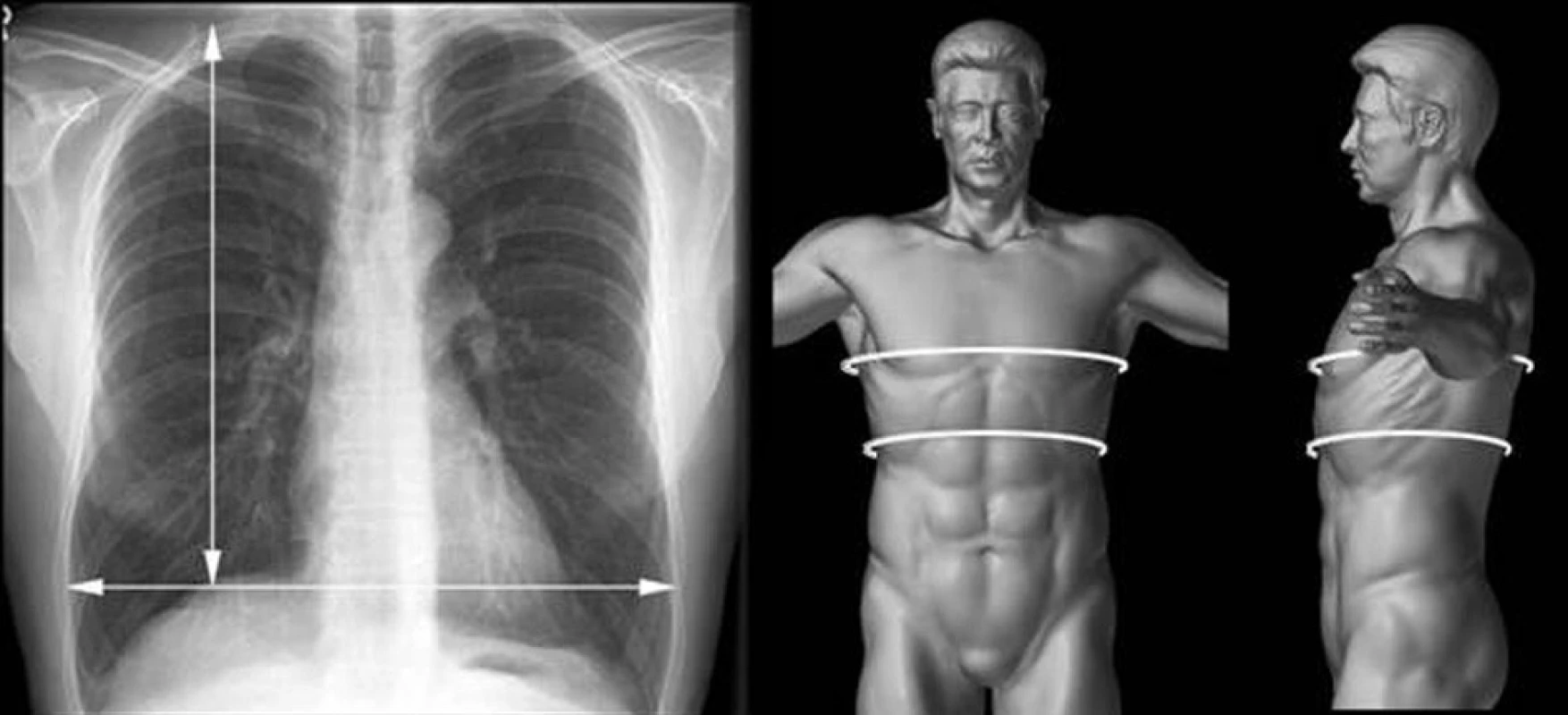
Ostatní potřebné údaje:
- Výška a hmotnost dárce (co nejpřesněji).
- Anamnéza bez plicních onemocnění, dlouhodobého kouření, hrudního traumatu, aspirace (anamnézu je však třeba posuzovat přísně individuálně).
- Kultivace sputa při dlouhodobé ventilaci.
Další péče o dárce a požadované hodnoty:
- Oxygenace: paO2 > 100 mmHg při FiO2 0.4 a PEEP 5,0 cm H2O resp. paO2 > 300 mmHg při krátkodobé ventilaci FiO2 1.0.
- Optimální dechový režim při PEEP 5,0 cm H2O a minimální frakci kyslíku, s dechovými objemy 10–15 ml/kg.
- Přijatelná plicní compliance – vrchol inspiračního tlaku < 30 cm H2O při dechovém objemu 15 ml/kg.
- Malá bronchiální sekrece.
- Centrální žilní tlak < 10 cm H2O, plicní kapilární tlak v zaklínění < 12 mmHg.
- Restrikce i.v. aplikovaných tekutin pro nebezpečí rozvoje plicního edému.
- Elevace horní poloviny těla.
Finální posouzení těsně před odběrem plíce:
- RTG plic – nadále beze změn.
- Oxygenace nezměněna.
- Bronchoskopické vyšetření k vyloučení aspirace a purulentní sekrece.
- Vizuální a manuální posouzení plicního parenchymu, pleurální dutiny a případných srůstů v pleurální dutině.
Vlastní odběr plic je koordinován a prováděn ve spolupráci s týmem odebírajícím srdce. Cílem dobře provedeného odběru a prezervace plic je uchovat jejich morfologickou a funkční integritu. Současné metody umožňují prodloužit studenou ischemii plic až na 6 až 8 hodin. Po otevření perikardu a pleurálních dutin a definitivním makroskopickém a palpačním vyšetření obou orgánů je provedena preparace velkých cév, je aplikován systémově heparin a bolus 0,05 mg epoprostenolu (Flolan, Glaxo Wellcome), který vyvolá vazodilataci plicních cév a umožní tak lepší perfuzi konzervačním roztokem.
Obr. 2. Oddělení plic přerušením terče levé síně a uzavřením a přerušením levého hlavního bronchu (snímek pořízený při odběru) Fig. 2. Lung detachment through intersection of the left atrial disc and closure and intersection of the left main bronchus (the picture taken at the time of collection) 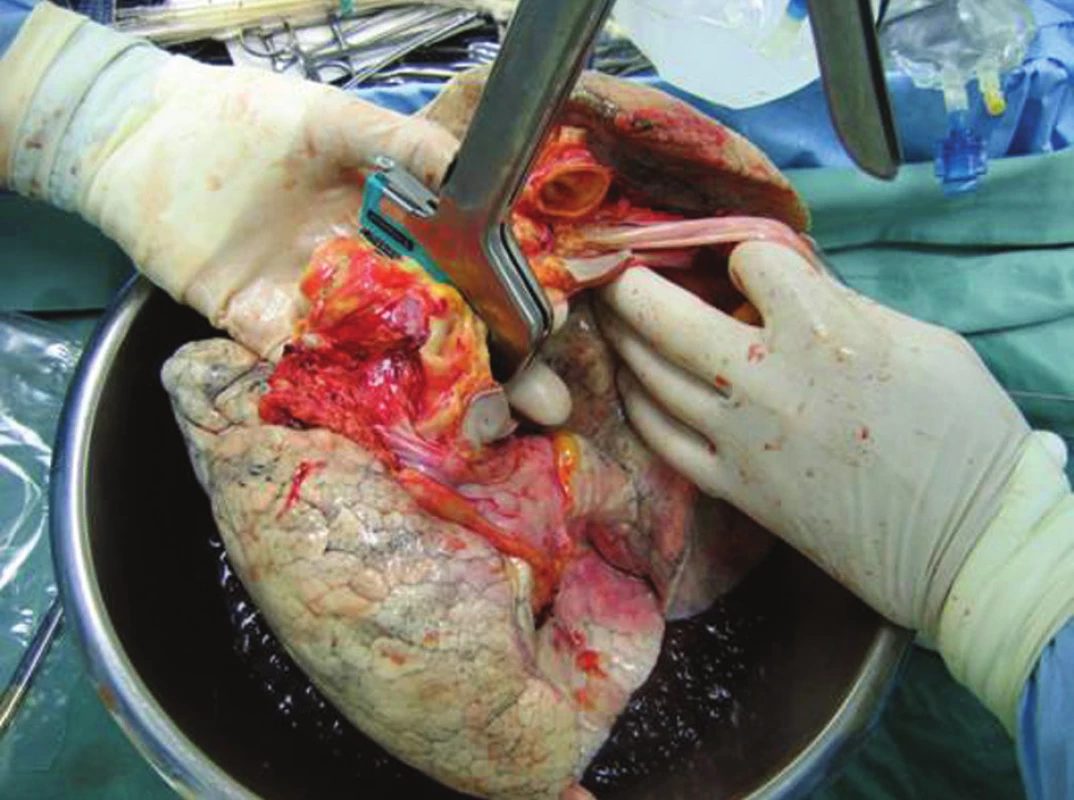
Po kanylaci aorty a plicní tepny je ligována horní dutá žíla, dolní dutá žíla je přerušena, levé ouško je otevřeno k odtoku perfuzního roztoku a aorta je uzavřena svorkou. Blok obou plic je perfundován 4 °C studeným, modifikovaným roztokem Perfadex v množství asi 50–60 ml/kg při pokračující ventilaci. Srdce je zároveň retrográdně perfundováno kořenem aorty kardioplegickým roztokem. Srdce a plíce jsou místně chlazeny ihned po naložení svorky na aortu ledovou tříští. Po ukončení perfuze obou orgánu následuje odběr srdce tak, že při přerušení plicních žil musí být zachován terč stěny levé síně s ústím všech 4 plicních a žil a plicní tepna je přerušena ve své bifurkaci. Po odběru srdce je izolován blok plic a průdušnice je přerušena staplerem v inspiriu s inspiračním tlakem do 30 cm H2O. Dále jsou plíce odděleny tak, že se rozdělí terč levé síně, bifurkace plicní tepny a levý hlavní bronchus. Plíce jsou transportovány v perfuzním roztoku Perfadex a v igelitovém pytli, v dalších dvou pytlech je studený fyziologický roztok. Takto zabalené plíce jsou uloženy do chladícího boxu s ledem a připraveny k transportu. Kvalita prezervace odebraných plic k transplantaci je rozhodujícím faktorem pro časnou funkci štěpu a rozvoj reperfuzního edému. Ale ischemicko-reperfuzní poškození zůstává stále vážným problémem. Odběr plic je nejčastěji součástí multiorgánového odběru, ale ve výjimečných případech může být proveden i izolovaně, nejsou-li ostatní orgány k odběru akceptovány.
OPERACE
Dnes se zdá, že problém technického provedení transplantace plic je vyřešen. Provádí se dva typy výkonu: Jednostranná transplantace plic a bilaterální sekvenční transplantace plic.
Obr. 3. Technika transplantace plic Fig. 3. Lung tansplantation technique 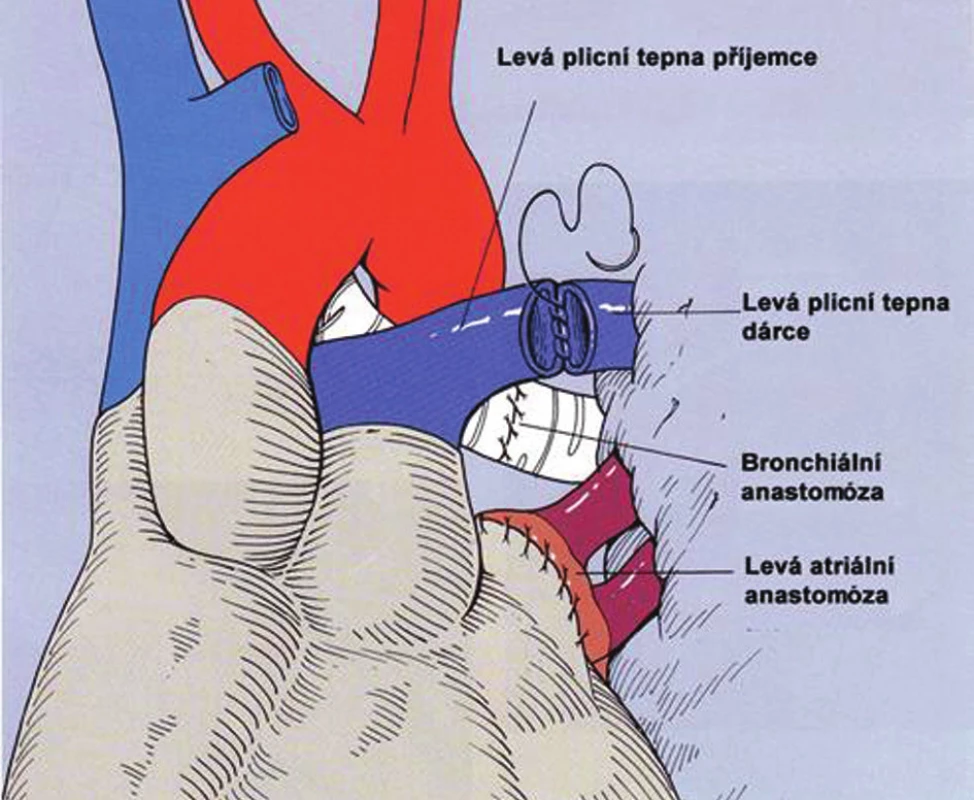
Jednostranná transplantace plic
Přístupem je standardní posterolaterální torakotomie. Při ventilaci kontralaterální plíce je zahájena preparace plicního hilu. Jestliže dojde k irreverzibilní hypoxemii je třeba uzavřít svorkou plicní tepnu a zrušit tak shunt kolabovanou a neventilovanou plící. Pokud hypoxemie přetrvává nebo dojde k rozvoji oběhově nestability je indikován přechod na mimotělní oběh, který je vždy připraven „standby“. U pacientů s plicní hypertenzí, dojde po uzavření plicní tepny k dalšímu zhoršení, často až ke kardiální dekompenzaci a snížení hodnoty cardiac index (CI). U pacientů s restriktivním onemocněním, bývá nutno pokračovat v mimotělním oběhu, jestliže pokles CI je větší než 1,0–1,5 l/min/m2. Po dokončení preparace v plicním hilu, při šetření frenického, bloudivého a vlevo zvratného nervu, je dokončena explantace nativní plíce a je provedena implantace plíce dárcovské. Jsou provedeny tři anastomózy v tomto pořadí: bronchiální, anastomóza levé síně a konečně anastomóza plicní tepny.
Bronchiální anastomóza je zatížena největším počtem komplikací a dříve byla Achillovou patou celé operace. Bronchiální cévní zásobení dárcovské plíce je přerušeno a dárcovský bronchus je tak závislý pouze na retrográdním průtoku z plicního cévního systému.
Původně standardním postupem byla anastomóza koncem ke konci s omentopexí („omental wraping“) a v omezených případech byla prováděna přímá revaskularizace bronchiální tepny. Bylo ovšem prokázáno, že hojení bronchiální spojky může být dobré bez jakéhokoli krytí a bez revaskularizace, která výkon neúměrně komplikuje a její efekt je sporný. Dnes je nejpoužívanější tzv. spojka koncem ke konci pokračujícím stehem.
Bilaterální sekvenční transplantace plic
Technika oboustranné transplantace se od svého zavedení výrazně změnila. Původní „double-lung“ byla prováděna vždy při mimotělním oběhu. Přístupem byla podélná sternotomie a dárcovské plíce byly implantovány en bloc s tracheální anastomózou. V roce 1989 byla zavedena technika bilaterální sekvenční transplantace a stala se standardní metodou. Přístupem je transverzální bilaterální torakotomie transsternální tzv. „clamshell incision“ a plíce jsou implantovány odděleně a postupně. Bronchiální anastomózy jsou zatíženy výrazně menším počtem komplikací než tracheální spojky. Bilaterální operace je provedena postupně jako jednostranná levo - a pravostranná transplantace.
Po otevření pleurálních dutin jsou obě plíce připraveny k pneumonektomii. Nejprve je odstraněna plíce s horší funkcí. Problémy s hypoxií a oběhovou nestabilitou jsou řešeny stejným způsobem jako při jednostranné transplantaci – přechodem na mimotělní oběh. Následuje implantace jedné plíce a po její reperfuzi je zahájena ventilace čerstvě implantovaného štěpu a pokračuje se s explantací a implantací druhé plíce. Mimotělní oběh je vždy použit při transplantaci pro plicní cévní onemocnění, v ostatních případech je indikován jen ve 20–30 % případů. Během bilaterální sekvenční transplantace se vyskytují tři momenty, které mohou vyvolat nutnost použití mimotělního oběhu: uzavření plicní tepny při implantaci první plíce, po reperfuzi prvního štěpu nebo při uzavření plicní tepny před implantací druhé plíce.
Po dokončení implantace plíce na obou stranách a po úspěšné reperfuzi jsou do každé pleurální dutiny zavedeny dva hrudní drény a torakotomie je uzavřena v anatomických vrstvách. Následuje bronchoskopické vyšetření dýchacích cest. Anestezie je ukončena a pacient je transportován na jednotku intenzivní péče.
Další operační postupy
Se stoupajícími zkušenostmi jsou zaváděny některé nové operační postupy, jejichž účelem je minimalizace operačního traumatu a maximální využití nabídnutých orgánů.
Při bilaterální transplantaci může být transverzální torakotomie nahrazena dvěmi anterolaterálními torakotomiemi bez přerušení sterna, jehož pooperační nestabilita může být pooperačním období klinickým problémem.
Další možností je transplantace pouze plicních laloků. Malému příjemci je totiž možno implantovat jen část plíce většího dárce. Nejčastěji je implantován dolní levý a dolní pravý lalok.
Další alternativou je metoda split-lung, při které je levý dolní lalok dárce implantován příjemci vlevo a levý horní lalok je rotován o 180° a implantován příjemci vpravo.
V posledních letech byla vypracována a zavedena metoda transplantace plicních laloků od živých dárců, která bývá užívána téměř výhradně u dětí s mukoviscidózou, kdy dva příbuzní poskytnou dva plicní laloky. Pro příjemce je riziko takového postupu srovnatelné s transplantací od kadaverózního dárce a operační rizika lobektomie pro dárce v rukou zkušeného chirurga jsou velmi malá.
Rovněž se místo mimotělního oběhu začíná uplatňovat extrakorporální membránová oxygenace (ECMO), jejíž hlavní výhody patří minimálně invazivní přístup, odpadá nutnost podání heparinu a je možné v extrakorporální oxygenaci pokračovat i pooperačně a ovlivňovat tak míru průtoku plicní tepnou a omezovat výskyt a stupeň reperfuzního edému.
Obr. 4. Technika transplantace plic, stav před implantací Fig. 4. Lung tansplantation technique, the condition prior to the procedure 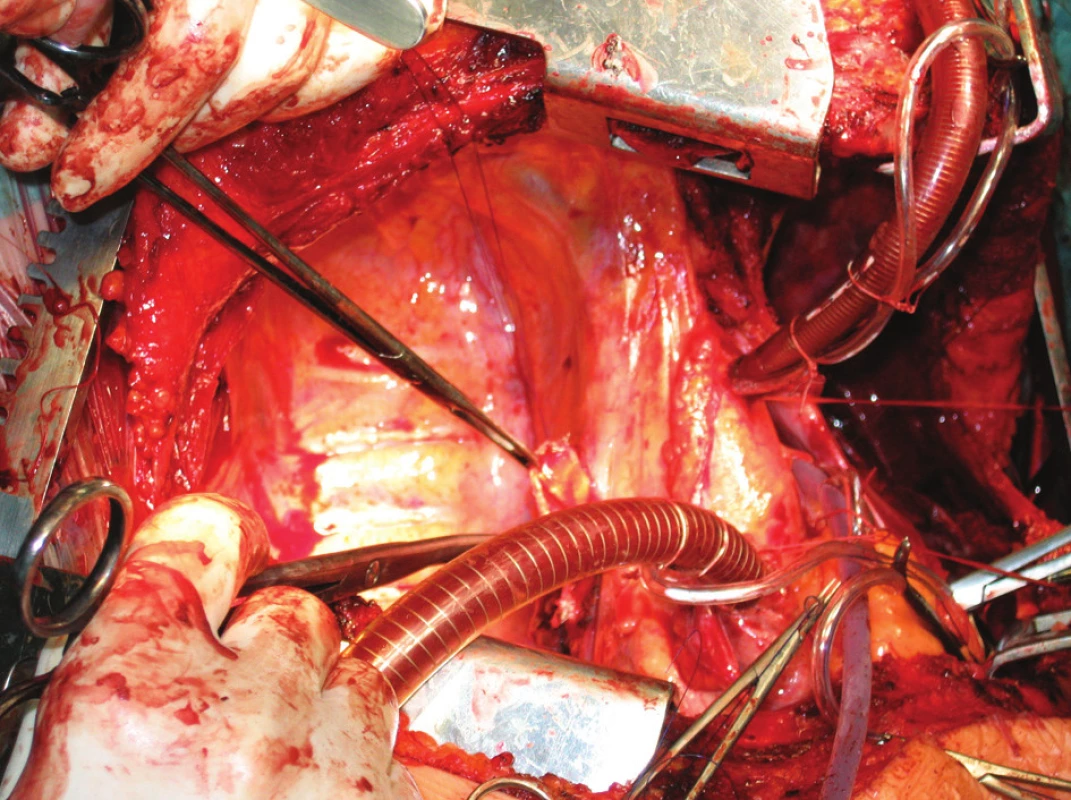
Obr. 5. Technika transplantace plic, stav po implantací Fig. 5.Lung tansplantation technique, the condition after the procedure 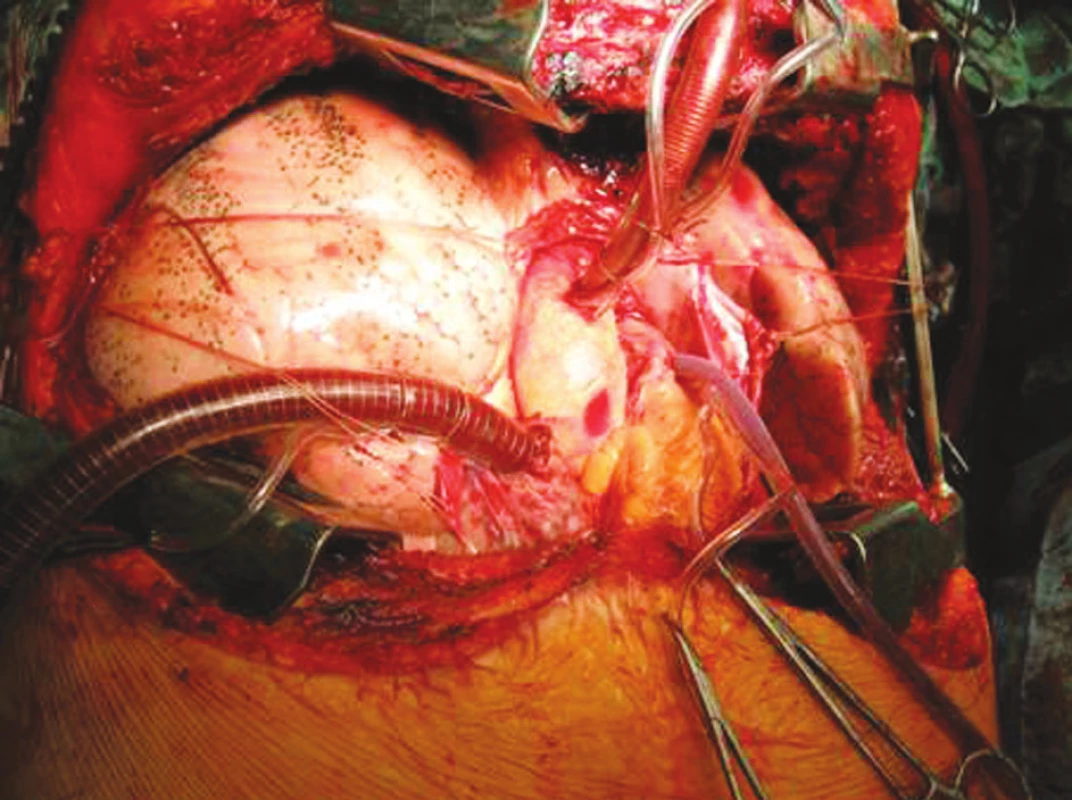
POOPERAČNÍ PÉČE
Intenzivní péče o pacienty po transplantaci je velice komplikovaná a komplexní. Po operaci je pacient hospitalizován na jednotkách intenzivní péče a kompletně monitorován. Dvakrát denně se provádí RTG plic, kompletní laboratorní screening, vyšetření hladiny imunosupresiv, kreatinin clearence, denně vyšetření hemokultury, týdně sérologická vyšetření na přítomnost virové a mykotické infekce.
Používá se standardní typ umělé plicní ventilace. Při těžké dysfunkci štěpu může být výhodná nezávislá ventilace jednotlivých plicních křídel, ale ve většině případů nutná není. Pozitivní přetlak na konci výdechu je standardní součástí ventilačního programu.
Při ideálním průběhu není výjimkou extubace pacienta za několik hodin po výkonu, kdy je zcela obnovena funkce transplantovaných plic.
U pacientů po transplantaci pro primární plicní hypertenzi (PPH) je taktika odlišná. Během prvních dnů je hemodynamika a oxygenace velmi nestabilní. Proto je pacient tlumen, relaxován a ventilován 24–48 hodin po operaci nebo více. Odvykání od ventilátoru se uskuteční jen velmi pomalu a opatrně.
AMBULANTNÍ PÉČE
Pacienti po transplantaci plic jsou po ukončení hospitalizace ambulantně sledováni v transplantačním centru. Smyslem těchto kontrol je včas rozpoznat a léčit:
- plicní komplikace – rejekce a infekce,
- mimoplicní komplikace, které jsou nejčastěji spojeny s chronickou imunosupresivní léčbou.
K ambulantním kontrolám, které se uskutečňují každé 4–8 týdnů, patří tato vyšetření:
- vyšetření plicních funkcí (spirometrie) a vyšetření krevních plynů,
- kompletní laboratorní screening,
- RTG plic,
- diagnostika CMV,
- vyšetření sputa,
- stanovení hladiny cyklosporinu A nebo tacrolimu,
- v pravidelných odstupech jsou provedena clearence kreatininu, kostní denzitometrie a CT hrudníku.
K mimoplicním komplikacím způsobeným imunosupresivní terapií patří chronická renální insuficience, hypertenze, osteoporóza, diabetes mellitus, hyperplazie gingivy, hirsutismus, alopecie, potransplantační lymfom, kožní a nekožní malignomy. Léčba těchto komplikací se uskutečňuje v rámci interdisciplinární spolupráce. Z hlediska dlouhodobého sledování představuje spirometrie nejdůležitější vyšetření.
IMUNOSUPRESIVNÍ TERAPIE U PACIENTŮ PO TRANSPLANTACI PLIC
Zásadním omezením dlouhodobého přežívání je problém chronické rejekce štěpu, která je morfologicky vyjádřena jako obliterujíci bronchiolitida, u které zatím zcela chybí terapeutické konsekvence.
Jako dvě hlavní příčiny úmrtí po transplantaci plic jsou uváděny právě obliterující bronchiolitida a infekce. Obě tyto komplikace jsou známkou neadekvátní imunosupresivní terapie, a proto je zřejmé, že mají-li se střednědobé a dlouhodobé výsledky zlepšit, je třeba v prvé řadě optimalizovat její strategii.
Zásadním momentem pro úspěšné klinické provedení transplantace plic byl objev cyklosporinu A (CSA). Transplantace plic, prováděná ještě před érou CSA, neustále ztroskotávala a to zejména proto, že imunosuprese docilovaná kombinací vysokých dávek steroidů a azathioprinu měla za následek výrazné komplikace hojení bronchiální anastomózy a nepostačovala ke kontrole akutní rejekce.
Imunosupresivní strategie po transplantaci plic se týkají indukční terapie, udržovací imunosuprese a léčby akutní a chronické rejekce.
V posledních letech byly se ve stejných počtech provedeny transplantace plic jak bez indukční terapie anebo s touto terapií – podáváním antilymfocytárních protilátek nebo monoklonálních protilátek vůči interleukin-2 receptoru.
Pacientům po transplantaci plic je převážně indikován udržovací režim s trojkombinací léčiv, zahrnující kalcineurinový inhibitor, inhibitor buněčného cyklu a steroidy. V posledních několika letech se rýsuje zřetelný trend používat inhibitor kalcineurinu tacrolimus (Tac) místo CSA jako součást udržovacího imunosupresivního režimu. V roce 1999 se jeden rok po transplantaci asi 70 % pacientům s plicními štěpy podával CSA, zatímco 26 % nemocných užívalo Tac. V roce 2007 užívalo CSA 1 rok a 5 let po transplantaci 27 % a 34 % příjemců plicních štěpů, Tac 73 a 64 % pacientů. Tento vývoj se opírá o studie prokazující menší výskyt akutních rejekcí a obliterující bronchiolitidy. Ve skupinách s Tac byl počet epizod akutní rejekce připadajících na jednoho pacienta nižší a absence recidiv akutní rejekce signifikantně častější.
V posledních letech se do imunosupresivních schémat začal zařazovat rovněž rapamycin. Inhibice fibroproliferativních procesů mechanismem účinku rapamycinu, který by mohl být perspektivní z hlediska ovlivnění obliterující bronchiolitidy, je pravděpodobně příčinou vysokého počtu komplikací hojení bronchiální anastomózy u pacientů, u kterých byl bezprostředně po transplantaci rapamycin nasazen. Užití rapamycinu tedy není doporučeno v časném pooperačním období, ale až po kompletním zhojení bronchiální anastomózy.
Dalším zásadním problémem komplikujícím potransplantační průběh jsou komplikace spojené s dlouhodobým užíváním imunosupresiv.
Jelikož plíce jsou vysoce imunogenní orgán, musí být imunosupresivní terapie velice agresivní, což vede k řadě nežádoucích účinků, které jsou příčinou zvýšené morbidity a mortality.
KOMPLIKACE
Časná dysfunkce štěpu
Časná dysfunkce štěpu není neobvyklá během prvních posttransplantačních dnů. Klinický obraz je charakterizován špatnou plicní funkcí, omezenou oxygenací a plicními infiltráty na RTG. Závažnost stavu může oscilovat od lehkého poškození až po ARDS. Dochází ke zvýšené vaskulární permeabilitě, která je způsobena prezervací a ischemicko-reperfuzním poškozením. Stejný klinický obraz může způsobit obstrukce plicních cév, kterou je možno vyloučit transoezofageální echokardiografií. Dále je třeba vyloučit hyperakutní rejekci, která je však při negativním nálezu cytotoxických protilátek před operací do pátého pooperačního dne nepravděpodobná, a CMV pneumonii, která se vyskytuje jen velmi výjimečně v prvních dvou týdnech. Pokud je však diagnóza nejistá, je třeba provést transbronchiální biopsii a bronchoalveolární laváž.
Léčba je stejná jako při jiném plicním poškození, používá se rovněž inhalace NO a extrakorporální membránová oxygenace. Časná dysfunkce štěpu může být fatální v 16 % případů a patří mezi nejčastější příčiny úmrtí v prvních třech měsících.
Komplikace v dýchacích cestách
Dehiscence bronchiální anastomózy představovala nejvážnější chirurgický problém a spolu se stenózou a bronchomalacií je stále obávanou komplikací. Tyto komplikace se vyskytují v 10–20 % případů, ale s nimi spojená mortalita je velmi nízká. Podstatnými vlivy na hojení bronchiální spojky jsou technika šití anastomózy, peroperační aplikace kortikosteroidů, prezervace plic, doba studené ischemie, rejekce a infekce. Komplikace se mohou projevit kašlem, dyspnoí, dušením, spirometrické známky obstrukce. Klíčovou diagnostickou metodou je bronchoskopie, rovněž CT vyšetření může pomoci stanovit správnou diagnózu. Léčba závisí na lokalizaci, délce a rozsahu stenózy, přítomnosti granulační tkáně nebo bronchomalacie. Často je nutno implantovant stent, stenózu možno dilatovat, granulační tkáň odstranit laserem. Reoperace ve většině případů není doporučena, jsou však popsány pozdní sleeve resekce stenotického úseku bronchu.
Rejekce
Rejekce je specifická imunitní odpověď na přítomnost štěpu, která je normálním projevem obranné reakce hostitele na přítomnost cizích antigenů. Jedná se o nejvýznamnější komplikaci omezující střední a dlouhodobé přežití. Incidence akutní rejekce je při užití nejmodernějších imunosupresivních režimů stále vysoká a jelikož je jen výjimečně fatální, je považována jako základní rizikový faktor pro rozvoj rejekce chronické. Chronická rejekce nebo obliterující bronchiolitida se vyskytují ve většině souborů v 35–50 %. Velmi tak ovlivňuje tak špatnou dlouhodobou prognózu. Obecně se rozlišuje hyperakutní, akutní a chronická rejekce.
Hyperakutní rejekce
Hyperakutní rejekce je způsobena přítomností cytotoxických protilátek, které se rychle váží na cévní endotel dárcovského orgánu, aktivují komplement a způsobují cévní trombózu. Pokud jsou tyto protilátky přítomny, jsou důsledkem dřívějšímu vystavení organismu alloantigenům při podání transfuze, v těhotenství nebo předchozích transplantacích. Hyperakutní rejekce je nyní téměř eliminována předoperačním screeningem na tyto protilátky, vyšetření séra příjemce proti standardnímu buněčnému panelu (panel reactive antibodies, PRA), ale zůstává zásadní překážkou pro xenotransplantace.
Akutní rejekce
Akutní rejekce se může objevit kdykoli po transplantaci, nejčastěji se však vyskytuje v prvním roce. Rejekce nízkého stupně může proběhnout asymptomaticky, příznaky jsou nespecifické a zahrnují kašel, dušnost, subfebrilie, poslechový nález, plicní infiltrát, pleurální výpotek a zhoršenou oxygenaci a funkci plic. Během prvních týdnů je vysoká senzitivita RTG vyšetření a postupně tato senzitivita klesá. V časné pooperační době je možno stanovit diagnózu pouze klinickým a RTG vyšetřením při vyloučení ostatních možných komplikací. Při nejasnostech je indikována transbronchiální biopsie a histologické vyšetření plicní tkáně. V pozdním pooperačním období je hlavním symptomem zhoršení funkčních parametrů, průkazná je opět TBB, která je vyhodnocena podle ISHLT (International Society for Heart and Lung Transplantation) ve stupních A0-A4, kdy A4 charakterizuje nejtěžší stupeň rejekce. Výtěžnost je závislá na kvalitě a množství odebraného materiálu a zkušenostech patologa. Senzitivita TBB je 61–94 % a specifita od 90 do 100 %.
Standardní léčbou akutní rejekce je aplikace vysokých dávek kortikosteroidů. Tři dny pacient dostává methylprednisolon v dávce 15 mg/kg/den a dále 1 mg/kg/den s poklesem během 2–3 týdnů na udržovací dávku. Ve většině případů časné akutní rejekce je tento postup účinný, ale při pozdějších atakách se již nemusí dostavit adekvátní odpověď a tyto ataky jsou pak předchůdcem obliterující bronchiolitidy. K potvrzení efektu léčby je indikována TBB. Rekurentní a refrakterní rejekce není velmi častá, ale při jejím výskytu musí být léčba agresivní pro riziko následného rozvoje obliterující bronchiolitidy. Strategie proto zahrnuje léčbu OKT3 nebo antithymocytárním globulinem, změnu cyklosporinu na tacrolimus, inhalace cyklosporinu a extrakorporální fotochemoterapii (fotoferézu).
Chronická rejekce
Chronická rejekce je histologicky definována jako obliterující bronchiolitida a klinicky se projevuje jako obstrukce dýchacích cest. Histologický průkaz není pro stanovení této klinické diagnózy, která se nazývá bronchiolitis obliterans syndrom (BOS), nutná, ale je třeba vyloučit jiné příčiny obstrukce dýchacích cest. K rozvoji BOS může dojít již 3 měsíce po transplantaci, ale nejčastěji je diagnostikována mezi 16.–20. měsícem. Začátek může být akutní a může imitovat respirační infekci nebo se může projevit progresivním poklesem plicních funkcí. Diagnóza je stanovena bronchoskopicky a spirometricky. Jelikož histologický obraz není rozhodující, je pomocí TBB třeba vyloučit jiné příčiny poklesu plicních funkcí jako akutní rejekce, infekce či komplikace v dýchacích cestách. Spirometrická kriteria pro diagnostiku a staging BOS byla standardizována. Jednotlivé stupně pokročilosti jsou založena na hodnocení aktuální FEV1 ve vztahu k hodnotě nejlepších tří dosažených hodnot FEV1 po transplantaci.
Staging BOS
Léčba není známa, imunosuprese je zvyšována na únosné maximum, aplikace inhalačních kortikoidů. Chronická rejekce postupně progreduje až k rozvoji dušnosti a imobility pacienta a je nečastější příčinou pozdního úmrtí a limituje tak dlouhodobého přežívání. Řešením může být retransplantace.
Tab. 1. Stupně bronchiolitis obliterans syndromu Tab. 1. Grades of the bronchiolitis obliterans syndrome 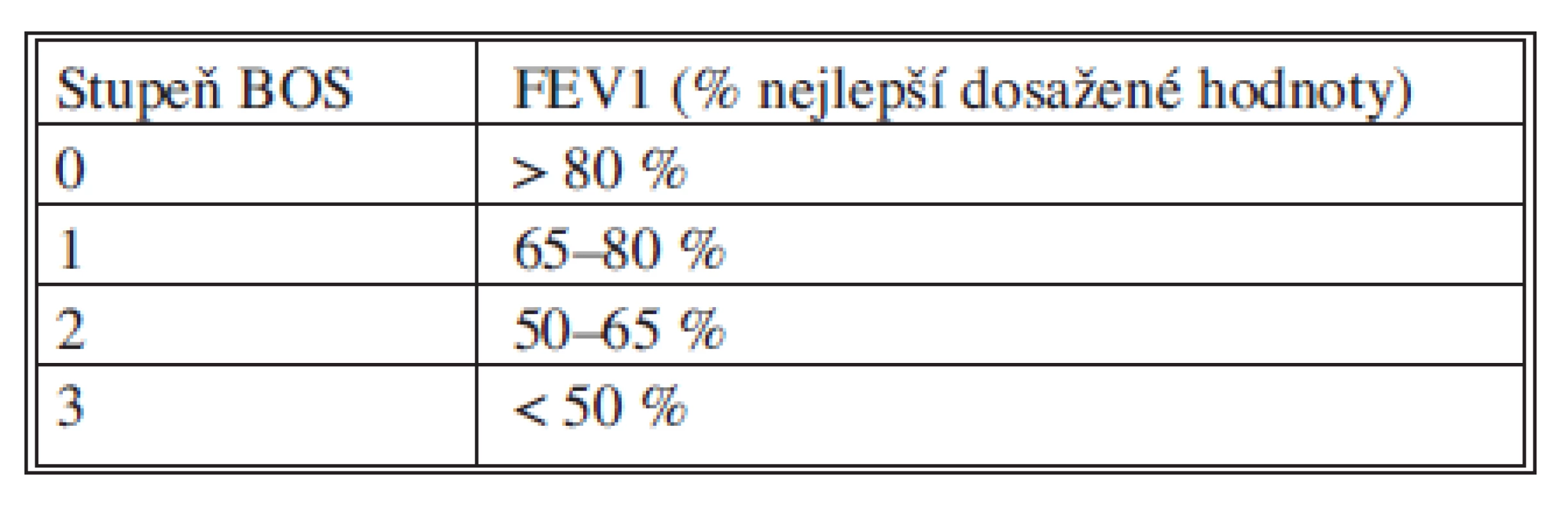
Infekce
Infekční komplikace představují nejčastější příčinu časné a pozdní morbidity a mortality. Infekce je nejčastěji lokalizována v transplantované plíci. Spektrum patogenů zahrnuje bakterie, viry, mykózy a protozoa. Infekce může být zanesena dárcovským orgánem, zdroj může být v proximálních dýchacích cestách, v sinusech či v nativní plíci při jednostranné transplantaci nebo může být získána po operaci. Imunosupresivní léčba, denervace plíce, oslabený kašlací reflex, zhoršená mukociliární clearence a porušená lymfatická drenáž představují predispoziční faktory pro vznik infekce.
Nejčastější infekční komplikace je bakteriální pneumonie, která se vyskytuje asi u 10 % příjemců v prvním týdnu po transplantaci. Diagnóza je stanovena dle běžných kritérií, rozhodující význam má bronchoalveolární laváž (BAL), která umožní kultivaci vyvolávajícího agens a adekvátní antibiotickou terapii.
Cytomegalovirus způsobuje řadu infekčních komplikací u imunosuprimovaných pacientů. Po transplantaci plic se nejčastěji vyskytuje CMV pneumonie. K jejímu rozvoji většinou nedochází před druhým týdnem po výkonu. Diagnóza je stanovena klinicky, serologicky a kultivačně. Po zavedení profylaktického podávání gancicloviru a po jeho zavedení spolu s CMV-hyperimunním imunoglobulinem do léčby výrazně klesla morbidita a mortalita způsobená infekcí tímto virem. CMV infekce je jedním s predisponujících faktorů v rozvoji obliterující bronchiolitidy.
Izolace Candidy a Aspegilla nejsou neobvyklé, jejich disseminace a lokálně invazivní infekce jsou rovněž častým zdrojem morbidity a mortality. Proto je medikamentózní profylaxe zařazena do všech terapeutických potransplantačních schématů. Problémem je nefrotoxicita používaných preparátů a jejich interakce s cyklosporinem a tacrolimem. Osvědčila se proto inhalace Amphotericinu B.
Infekce Pneumocystis carinii byla dříve velmi častá, ale postupně byl tento problém téměř eliminován profylaktickým doživotním podáváním cotrimoxazolu nebo inhalací Pentamidinu.
RETRANSPLANTACE
Nejčastější indikací k retransplantaci je časné selhání štěpu, neřešitelné komplikace v dýchacích cestách a chronická rejekce. Výsledky jsou horší ve srovnání s primárními transplantacemi: 65 % pacientů přežívá jeden měsíc a 45 % jeden rok ačkoli mezi příjemci, kteří přežili prvních 90 dní, 65 % přežívá 3 roky po retransplantaci. Nejpodstatnějším předpokladem pro přežití je to, že pacient zůstává pouze v ambulantní péči a splňuje indikace a kontraindikace jako před primární transplantací.
ZÁVĚR
Transplantace plic dnes představuje etablovanou klinickou metodu určenou pro pacienty v terminální fází respiračního selhání u onemocnění plicního parenchymu či kardiálního selhání u primární a sekundární plicní hypertenze. Optimální jednoroční přežívání přesahuje 75 %, pětileté 55 %.
Limitem většího počtu transplantací a s tím spojené vysoké mortality na čekacích listinách je nedostatek vhodných dárců a funkčních štěpů.
Novou strategii pro udržení a přehodnocení dárcovské plíce představuje metoda ex-vivo plicní perfuze (EVLP), kdy je odebraný orgán uchováván ve fyziologických podmínkách ex-vivo, a může být opakovaně vyšetřován a dokonce léčen před vlastní transplantací. V České republice byla zahájena příprava programu ex vivo perfuze a rekondice plic, která by po jejím zavedení do klinické praxe měla výrazně snížit mortalitu na čekací listině.
Limitem lepšího přežívání je vysoká incidence infekčních komplikací, které jsou důsledkem vysoké intenzity imunosupresivní terapie, která je nutná pro vysoké riziko rejekce, častou kolonizaci příjemců rezistentními bakteriálními kmeny a trvalé expozice štěpu patogenům zevního prostřední. Zásadním omezením dlouhodobého přežívání je problém chronické rejekce štěpu – rozvoj bronchiolitis obliterans syndromu, kde zatím zcela chybí terapeutické konsekvence.
Doc. MUDr. Robert Lischke, Ph.D.
Růžová 5
110 00 Praha 1
e-mail: robert.lischke@fnmotol.cz
Zdroje
1. Hardy, J. D. The first lung transplant in man (1963) and the first heart transplant in man (1964). Transplant. Proc., 1999, Feb-Mar; 31 (1-2): 25–29.
2. Borel, J. F. History of the discovery of cyclosporin and of its early pharmacological development. Wien Klin. Wochenschr., 2002, Jun 28; 114 (12): 433–437.
3. Cooper, J. D. The history of surgical procedures for emphysema. Ann. Thorac. Surg., 1997, Feb; 63(2): 312–319.
4. Steen, S., Liao, Q., Wierup, P. N., Bolys, R., Pierre, L., Sjoberg, T. Transplantation of lungs from non-heart-beating donors after functional assessment ex vivo. Ann. Thorac. Surg., 2003, Jul; 76 (1): 244–252; discussion 252.
5. Steen, S., Ingemansson, R., Eriksson, L., Pierre, L., Algotsson, L., Wierup, P., Liao, Q., Eyjolfsson, A., Gustafsson, R., Sjöberg, T. First human transplantation of anonacceptable donor lung after reconditioning ex vivo. Ann. Thorac. Surg., 2007, Jun; 83 (6): 2191–2194.
6. Orens, J. P. International Guidelines for the Selection of Lung Transplant Candidates: 2006 Update-A Consensus Report From the Pulmonary Scientific Council of the International Society for Heart and Lung Transplantation. J. Heart Lung Transplant., 2006, Jul; 25 (7): 745–755.
7. Celli, B. R., Cote, C. G., Marin, J. M., Casanova, C., Montes de Oca, M., Mendez, R. A., Pinto Plata, V., Cabral, H. J. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N. Engl. J. Med., 2004, Mar 4; 350 (10): 1005–1012.
8. Aigner, C., Wisser, W., Taghavi, S., et al. Institutional experience with extracorporeal membrane oxygenation in lung transplantation. Eur. J. Cardiothorac. Surg., 2007, Mar; 31 (3): 468–473.
9. Lau, C. L., Patterson, G. A., Palmer, S. M. Critical care aspects of lung transplantation. J. Intensive Care Med., 2004, Mar-Apr; 19 (2): 83–104.
10. Snell, G. I., Westall, G. P. Immunosuppression for lung transplantation: evidence to date. Drugs, 2007; 67 (11): 1531–1539.
11. Groetzner, J., Kur, F., Spelsberg, F., et al. Munich Lung Transplant Group. Airway anastomosis complications in de novo lung transplantation with sirolimus-based immunosuppression. J. Heart Lung Transplant., 2004, May; 23 (5): 632–638.
12. Hernandez, R. L., Gil, P. U., Gallo, C. G., et al. Rapamycin in lung transplantation. Transplant. Proc., 2005, Nov; 37 (9): 3999–4000.
13. Oto, T., Levvey, B. J., Snell, G. I. Potential refinements of the International Society for Heart and Lung Transplantation primary graft dysfunction grading system. J. Heart Lung Transplant., 2007, May; 26 (5): 431–436.
14. Lischke, R., Sarahrudi, K., Neuhauser, P., et al. Bronchial anastomoses after lung transplantation: results with single running suture technique. Chirurg, 2001, Sep; 72 (9): 1048–1053.
15. Glanville, A. R. The role of bronchoscopic surveillance monitoring in the care of lung transplant recipients. Semin. Respir. Crit. Care Med., 2006, Oct; 27 (5): 480–491.
16. Estenne, M., Hertz, M. Bronchiolitis obliterans after human lung transplantation. Am. J. Respir. Crit. Care Med., 2002; 166 : 440–444.
17. Aigner, C., Jaksch, P., Taghavi, S., et al. Pulmonary retransplantation: is it worth the effort? A long-term analysis of 46 cases. J. Heart Lung Transplant., 2008, Jan; 27 (1): 60–65.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Budoucnost hrudní chirurgie v České republice
- Akutní mediastinitida
- Transplantace plic
- Využitie epiteliálnych buniek príjemcu pri allotransplantácii trachey v experimente – prvé výsledky
- Je něco nového v léčbě spontánního pneumotoraxu?
- Je oprávněné provedení pneumonektomie v léčbě plicních metastáz?
- Spontánní pneumomediastinum – kazuistika
- Principy ošetření poranění hrudní stěny
- Penetrující poranění hrudníku a břicha: diagnostický a léčebný postup
- Perforace jícnu
- Četnost metatastického postižení mediastinálních uzlin během plicní metastasektomie
- Perforace pravé komory srdeční úlomkem žebra po tupém úrazu hrudníku
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní mediastinitida
- Transplantace plic
- Perforace jícnu
- Je něco nového v léčbě spontánního pneumotoraxu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



