-
Články
- Vzdělávání
- Časopisy
Top články
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využitie epiteliálnych buniek príjemcu pri allotransplantácii trachey v experimente – prvé výsledky
Experimental Use of the Recipient’s Epithelial Cells in Tracheal Allotransplantation – Initial Outcomes
The management of long tracheal lesions requires development of tracheal implants, which would enable resection combined with anastomosis. The authors’ scientific study is based on tracheal allotransplantation on an animal model (sheep), using tracheal epithelial cells of the recipient. The project covers preparation of the graft, so that all components of the major histocompatibility complex (MHC), which participate in graft rejection, are removed.
Histological examination of the allograft with cultivated epithelial cells showed its good healing with revasculatization and with no signs of graft rejection.Key words:
surgery – trachea – allotransplantation
Autoři: J. Belák 1; M. Kudláč 1; V. Ledecký 1; J. Rosocha 2; R. Tkáčová 3; Z. Ševčíková 5; I. Čavarga 4; A. Somoš 4
Působiště autorů: II. chirurgická klinika, UPJŠ, LF, Košice, Slovenská republika, prednosta: doc. MUDr. J. Belák, PhD. 1; Klinika malých zvierat, Univerzita veterinárskeho lekárstva a farmácie, Košice, Slovenská republika, prednosta: doc. MVDr. A. Trbolová, PhD. 2; Združená tkanivová banka, UPJŠ, LF, Košice, Slovenská republika, prednosta: MVDr. J. Rosocha, CSc. 3; Klinika pneumológie a ftizeológie, UPJŠ, LF, Košice, Slovenská republika, prednosta: prof. MUDr. R. Tkáčová, DrSc. 4; Ústav patologickej anatómie, Univerzita veterinárskeho lekárstva a farmácie, Košice, Slovenská republika, vedúci ústavu: prof. MVDr. M. Levkut, DrSc. 5
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 11, s. 621-624.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Potreba riešenia dlhých lézií trachey vedú k vyvíjaniu tracheálnych náhrad, ktoré by umožnili resekciu a anastomózu. Podstatou vedeckého projektu autorov je allotransplantácia trachey na zvieracom modeli (ovca) s využitím tracheálnych epitélii od príjemcu. Súčasťou projektu je príprava štepu tak, aby boli odstránené komponenty veľkého histokompatibilného antigenného komplexu, ktoré hrajú úlohu v rejekcii štepu.
Histologické vyšetrenie allotransplantátu s kultivovanými epiteliálnymi bunkami ukázalo jeho dobré hojenie aj s vyvíjajúcou sa revaskularizáciou, bez známok rejekcie štepu.Kľúčové slová:
chirurgia – trachea – allotransplantáciaÚVOD
S rozvojom anesteziológie a intenzívnej medicíny stále pribúda počet pacientov, ktorých sa podarí po dlhodobej umelej pľúcnej ventilácii zachrániť a vrátiť do života. U časti pacientov sa však po čase môžu vyskytnúť komplikácie ako následok dlhodobej ventilácie a trachestómie. Väčšina tracheálnych lézii môže byť v súčasnosti bezpečne resekovaná a primárne rekonštruovaná. Základnými limitami resekcie a rekonštrukcie sú: polovica dĺžky trachey dospelého a pravdepodobne jedna tretina dĺžky trachey u malých detí. Limity závisia od veku, telesnej stavby, anatomických pomerov, patológie a od prvotného liečebného zásahu [1, 2, 3]. Dlhšie lézie trachey, ktoré nie je možné resekovať a rekonštruovať, sú zvyčajne riešené implantáciou T-kanyly alebo stentu, niekedy permanentnou tracheostómiou. Potreba riešenia dlhých lézii trachey vedie k vyvíjaniu tracheálnych náhrad, ktoré by umožnili resekciu, a primárnu anastomózu. Jednou z možnosti ako to dosiahnúť je tracheálna transplantácia.
Podstatou nášho vedeckého projektu je allotransplantácia trachey na zvieracom modeli (ovca) s využitím tracheálnych epitélii od príjemcu. Súčasťou projektu je príprava štepu tak, aby boli odstránené komponenty veľkého histokompatibilného antigenného komplexu, ktoré hrajú úlohu v rejekcii štepu.
MATERIÁL A METÓDA
Projekt prebieha bez imunosupresie a bez využitia nepriamej vaskularizácie. V experimente je využitá ovca, plemeno Merino, dvojročná samica.
Príprava tracheálneho alloštepu:
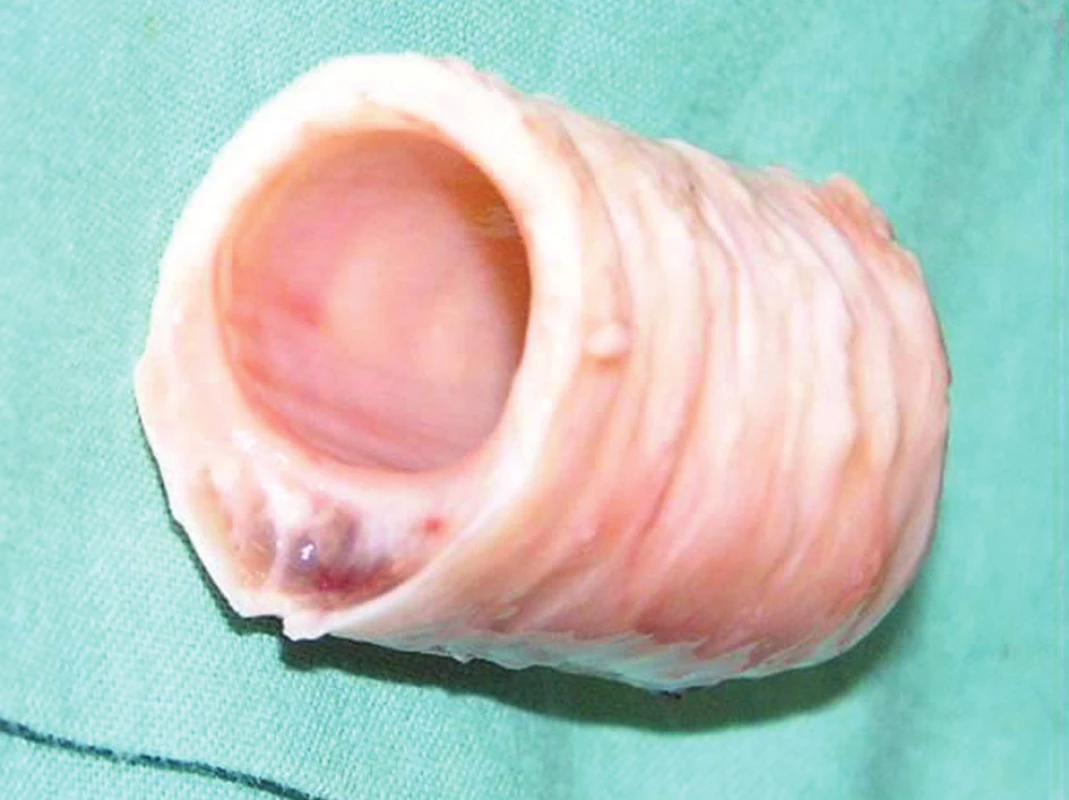
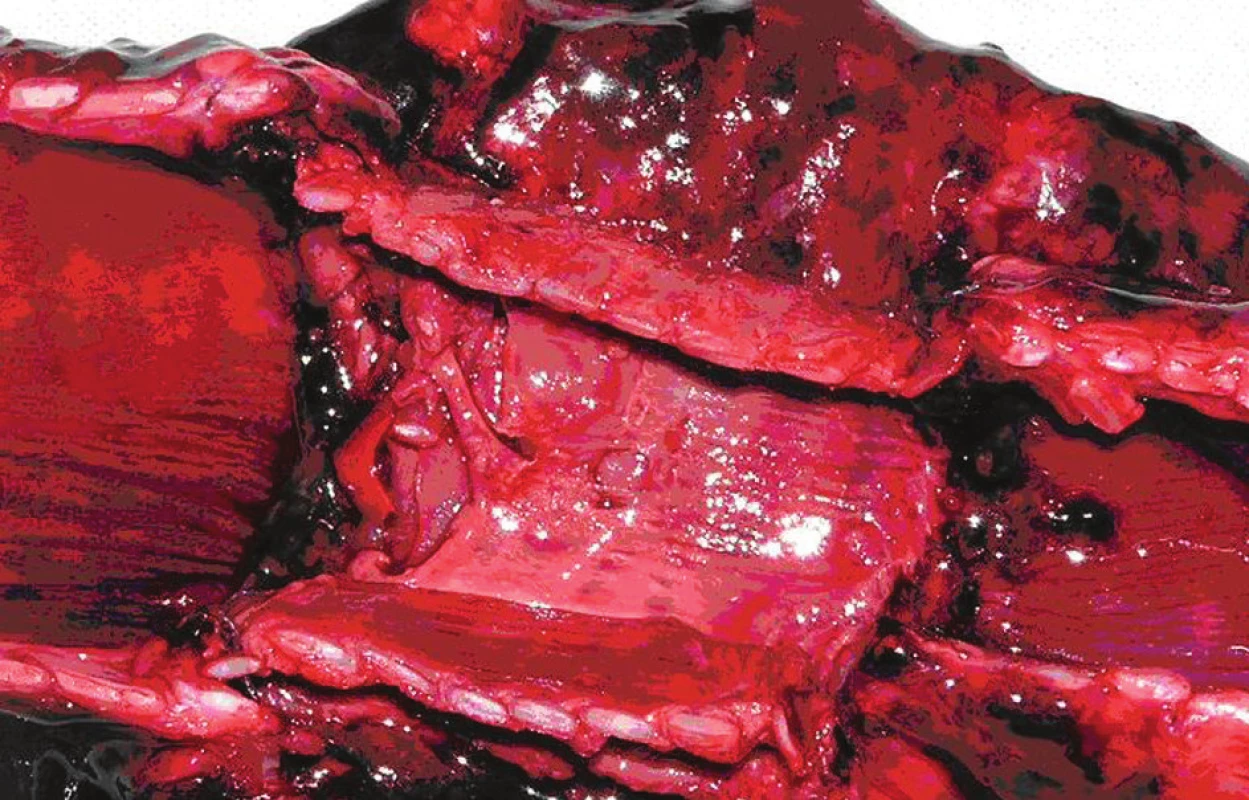
Zmrazovanie tracheálneho tkaniva. Sterilne odobratá časť trachey ovce (8–10 prstencov) bola očistená od priliehajúcich tkanív na povrchu a skalpelom bola skarifikovaná sliznica v jej lúmene (Obr. 1). Trachea bola tri krát premytá v médiu Dulbecco’s Modified Eagle Medium (DMEM; Biochrom AG, Berlin, Germany) s 2,5% hmotnostné množstvá na 1 mililiter obsahom roztoku penicilínu, streptomycínu a amfotericínu B (Antibiotic antimycotic solution, Gibco BRL), zmrazená a skladovaná v 50 ml skúmavke (Falcon, Becton Dickinson Labware) v médiu M199 (Gibco BRL) s 10 % obsahom dimethylsulfoxidu (DMSO CryoSure, Wak Chemie Medical, GMBH) pri -80 °C.
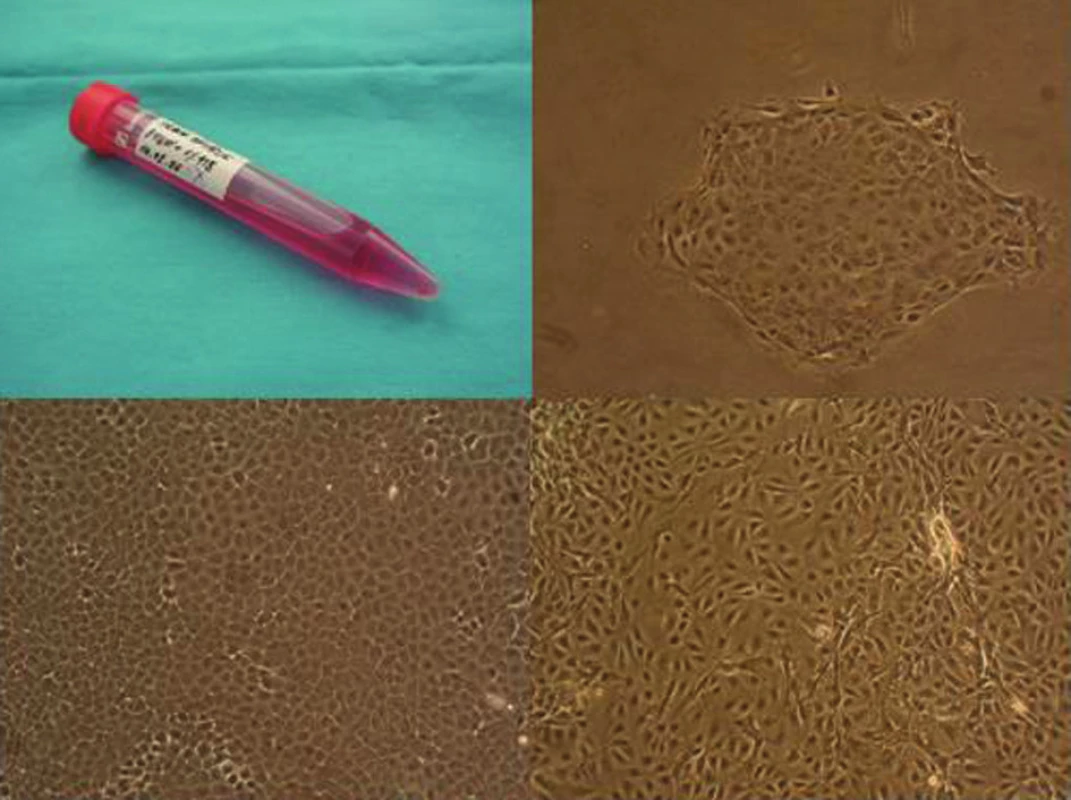
Izolácia a in vitro kultivácia tracheálnych epiteliálnych buniek. Endoskopicky excidované kúsky tracheálnej sliznice ovce boli vložené do skúmaviek s 2 ml odberového média (DMEM) s 1% obsahom roztoku penicilínu, streptomycínu a amfotericínu B a ihneď po doručení do laboratória centrifugované 10 minút pri 1500 RPM a 4 °C. Supernatant bol odsatý a ku každému kúsku tkaniva (veľkosť približne 0,2 mm) boli pridané 2 ml 0,1% roztoku kolagenázy typu II (Gibco, BRL). Po 15 minútovom pôsobení enzýmu pri 37 °C (v termostate) bol enzým spolu s odlúčenými bunkami odsatý a prenesený do média DMEM s 10% FCS. K zostávajúcemu kúsku tkaniva boli znovu pridané 2 ml roztoku kolagenázy typ II. Postup bol zopakovaný štyrikrát. Počas enzymatickej disociácie tkaniva boli získané bunky uskladnené v chladničke a po ukončení enzymatického spracovania centrifugované 10 minút pri 1500 RPM a 4 °C, následne resupendované v médiu DMEM-F12 s 10% obsahom FCS, 1% obsahom ITS a 1% obsahom roztoku penicilínu, streptomycínu a amfotericínu B a kultivované pri 37 °C v 5% CO2 atmosfére. Čerstvé kompletné kultivačné médium bolo vymieňané každé 2 až 3 dni (Obr. 2).
Bunky použité na resurfáciu tracheálneho lúmenu boli pasážované jeden až dva razy s použitím 0, 25% roztoku trypsínu-EDTA.
Spracovanie a príprava trachey pred transplantáciou
Tkanivo bolo rýchlo rozmrazené pri 37 °C, trikrát premyté v médiu DMEM s prídavkom 200 μg/ml gentamycínu (Gentamicin, Lek), vložené do 50ml skúmavky následne doplnenej médiom M199 s 5% obsahom roztoku penicilínu, streptomycínu a amfotericínu B a temperované v termostate pri 37 °C cez noc. Na druhý deň bol lúmen trachey osadený in vitro kultivovanými tracheálnymi epiteliálnymi bunkami. Bunky boli od kultivačného povrchu fľaše enzymaticky oddelené 0,25% roztokom trypsínu – EDTA (Gibco, BRL). Získané bunky boli trikrát premyté v médiu DMEM (centrifugácia 1 500 RPM, 7 minút pri 4 °C), resuspendované v 1 ml kompletného kultivačného média (DMEM-F12, 10% fetálneho bovinného séra, FCS; 1% Insulin-Transferin-Selenium-A, ITS; 1% Antibiotic antimycotic solution, Gibco, BRL) a po odstránení média M199 zo skúmavky s tracheou boli nanesené do lúmenu trachey. Skúmavka bola umiestnená horizontálne a každých 15 minút pootočená v jednom smere o 90°. Po troch hodinách bola skúmavka naplnená kompletným kultivačným médiom. Tracheálne epiteliálne bunky osadené v lúmene trachey boli kultivované až do doby transplantácie (24 hodín) v termostate pri 37 °C (Obr. 3).
Tracheálna allotransplantácia
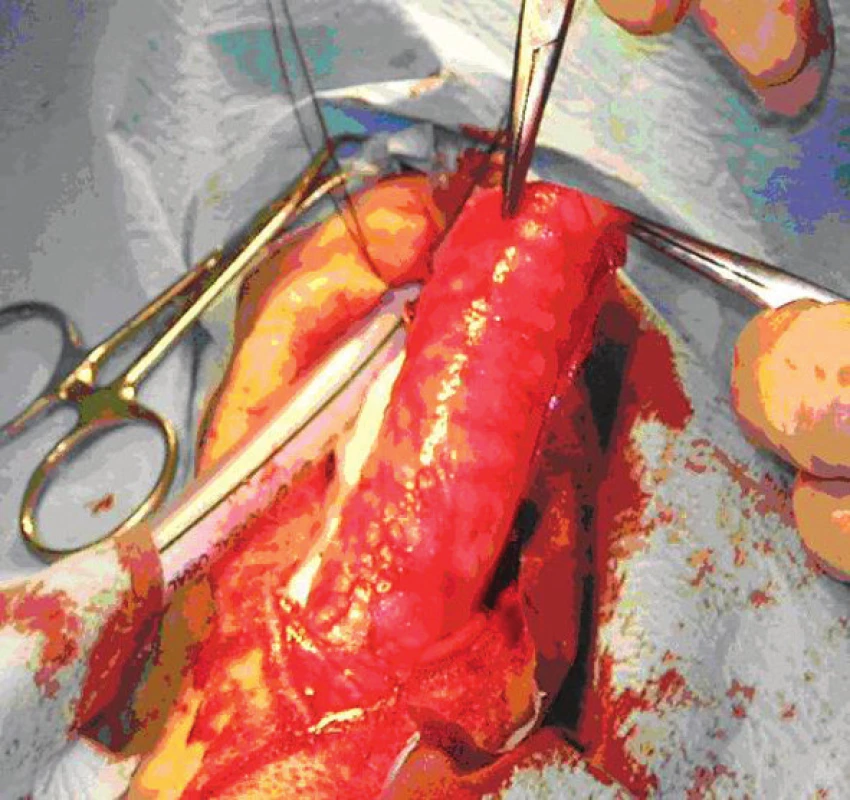
U zvieraťa 12 hodín pred transplantáciou bol zabránený prístupu ku krmivu a 6 hodín pred transplantáciou bol obmedzený prísun tekutín pred celkovou anestéziou. Antibiotická clona vykonaná 24 hod pred operačným zákrokom intramuskulárnou aplikáciou penicilín/streptomycín (1 ml/10kg; Penstrepten inj a.u.v). Intramuskulárna premedikacia: atropín (0,05 mg/kg; Atropin Biotoka inj); butorfanol (0,1 mg/kg; Butomidor inj a.u.v); acepromazín (0,05 mg/kg; Placivet inj a.u.v) pred úvodom do celkovej anestézie. Intravenózna aplikácia propofolu (4 mg/kg) do vena cephalica brachialis, 10 minút po premedikácií pacienta. Po uľahnutí pacienta vykonané zabezpečenie priechodnosti dýchacích ciest pomocou laryngeálnej masky LMA ProSeal™ (PLMA) s následnou kontrolou tesnosti masky. Laryngeálna maska je napojená na Bainov dýchací okruch a pacient je saturovaný O2 s prietokom 0,5 l/min. Segment trachey z krčného úseku, o dĺžke 10 prstencov, bol resekovaný a je ďalej pripravovaný ako štep pre ďalšiu transplantáciu. Na toto miesto bol vložený pripravený alloštep o dĺžke 8 prstencov a následne urobená end to end anastomóza, najprv na proximalnom a potom na distalnom okraji štepu, jednotlivými stehmi, uzlenými navonok 4-0 Vicrylom plus (Obr. 4). Pooperačne počas 4 dní intramuskulárna aplikácia antibiotík penicilín/streptomycín (1 ml/10 kg; Penstrepten inj a.u.v) a nesteroidných antiflogistík flumexín-meglumin (2,2 mg/kg; Finadine inj a.u.v. Vybratie stehov na 10 deň po operačnom zákroku. V súčasnosti sú urobené 2 allotransplantácie bez využitia nepriamej vaskularizácie lalokom omenta.
Histologické vyšetrenie
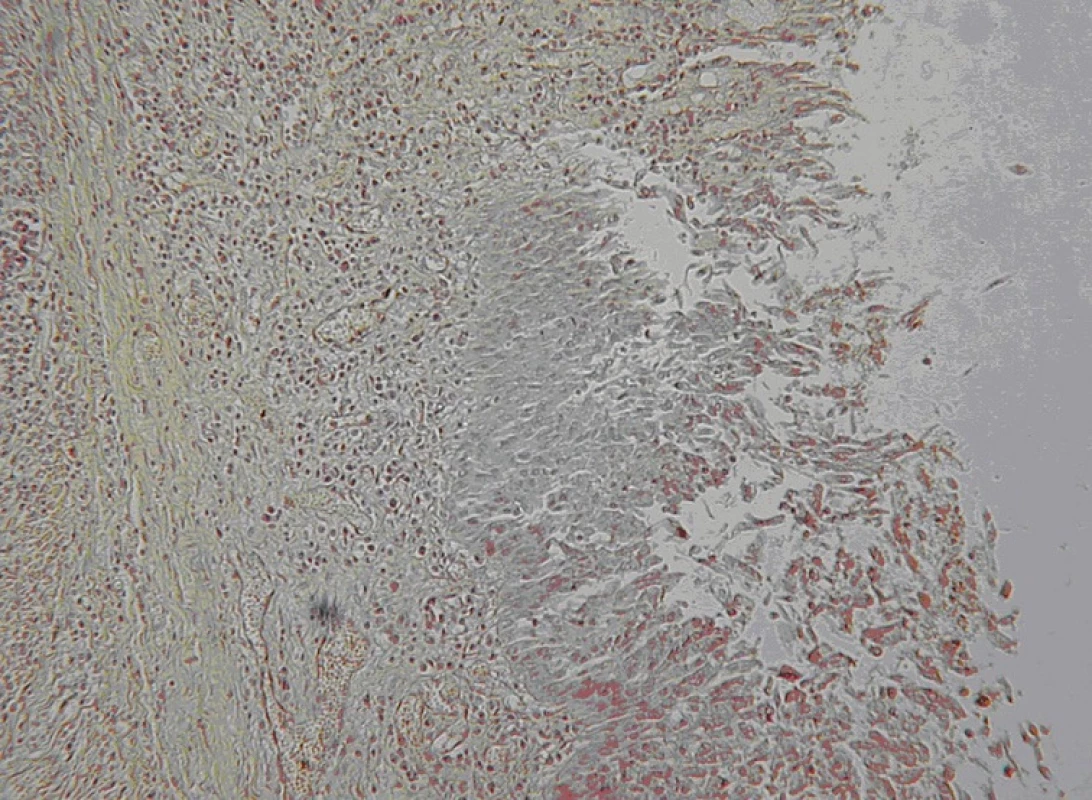
Vzorky histopatologického vyšetrenia boli fixované v 10% formaline, vložené do parafínu a farbené hematoxylín eozínom. Histopatologické vyšetrenie ukázalo: 1. krvácanie a zápalovú infiltráciu lymfocytmi a neutrofilmi v mieste materiálu použitého na sutúru; 2. prítomnosť transplantovaných epiteliálnych buniek v lúmene štepu, v mieste chýbania epiteliálnych buniek je prítomné fibrózne tkanivo; 3. v lamina propria sú prítomné hemorágie a formujúce sa granulačné tkanivo; 4. ostrovčeky nekrózy novej sliznice; 5. nekróza chruky nebola prítomná.
VÝSLEDKY
Prvé výsledky
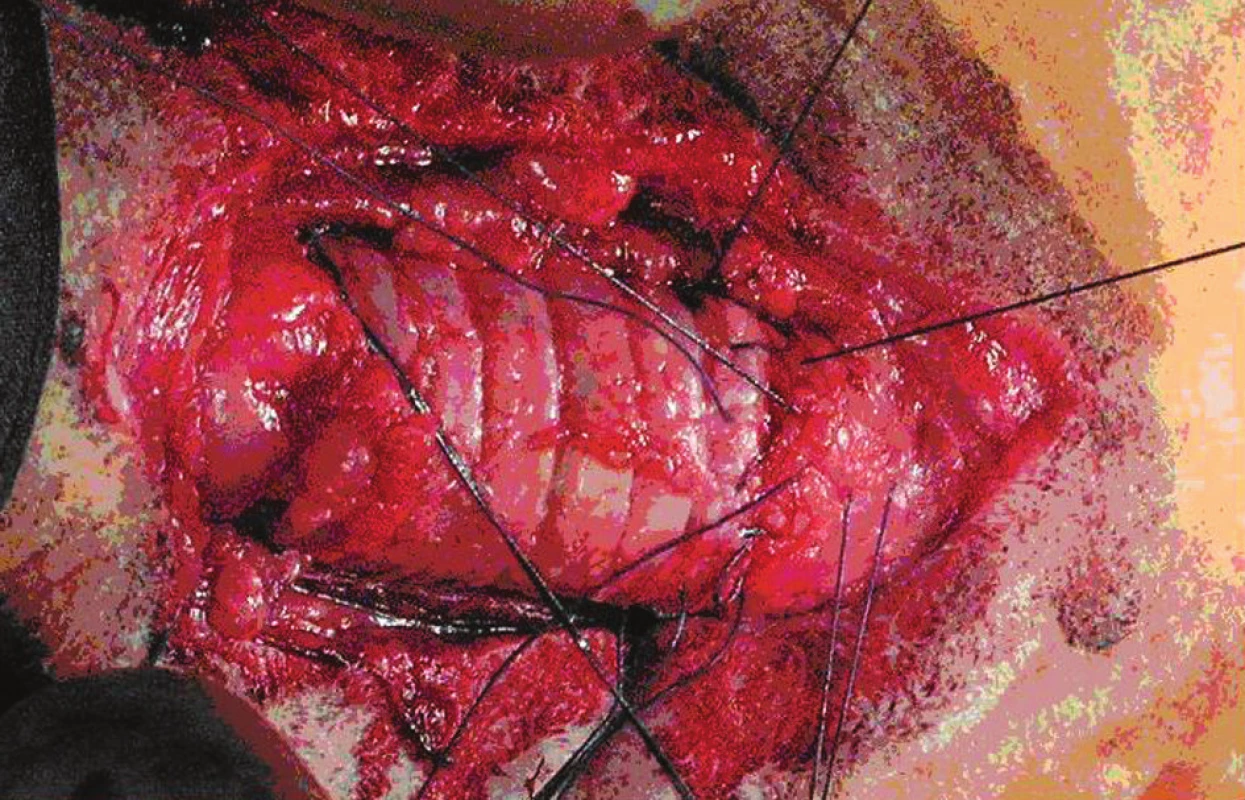
U obidvoch zvierat bol bezprostredný pooperačný priebeh bez komplikácii. Na 10. pooperačný deň bola realizovaná tracheoskopická kontrola štepu. Lúmen trachey bol u obidvoch zvierat voľne priechodný, sliznica štepu ružovobelavej farby s ostrovčekmi mapovitého tvaru ružovočervenej farby, anastomózy voľne priechodné. Prvé zviera bolo utratené na 15. pooperačný deň, druhé prežíva 30 dní (Obr. 5). Tkanivo trachey, ktoré bolo transplantované bolo histologický vyšetrené. Transplantovaný epitel bol nájdený vo vzorkách z blízkosti proximálnej a distálnej anastomózy (Obr. 6). V ostatných častiach bol nahradený proliferujúcim spojivovým tkanivom v lamina propria mucoae. Prítomnosť granulačného tkaniva pod nepoškodeným transplantovaným epitelom ukázala na dobre sa vyvíjajúcu reparatívnu schopnosť trachey. Zápalová reakcia bola lokalizovaná iba v mieste šijacieho materiálu v mieste sutúry. Bolo sledované dobré hojenie štepu a jeho revaskularizácia. Známky rejekcie štepu neboli zistené.
DISKUSIA
Aj keď v súčasnosti väčšina tracheálnych lézií môže byť bezpečne resekovaná a primárne rekonštruovaná, je tu skupina pacientov, ktorá je trvalo odkázaná na stent alebo tracheostómiu. Potreba riešenia dlhých lézií trachey vedú k vyvíjaniu tracheálnych náhrad, ktoré by umožnili resekciu a anastomózu.
V experimente bolo vyskúšaných množstvo cudzorodých materiálov, z ktorých boli konštruované solidné a porézne protézy, v ojedinelých prípadoch boli tieto náhrady vyskúšané aj v klinickej praxi [4, 5]. Pri využití poréznych protéz často dochádzalo k jazvovateniu a vzniku stenóz.
V literatúre je množstvo prác, ktoré sa v experimente venujú tracheálnym transplantáciam. Postupne boli riešené problémy ošetrenia a fixácie štepu [6, 7, 8, 9]. Ďalšou otázkou, ktorá bola riešená, bola otázka rejekcie štepu a potreby imunosupresívnej liečby. Došlo sa k záverom, že pri odstránení veľkého histokompatibilného antigenného komplexu trachey, ktorý predstavuje epitélie a zmiešané žľazy, nie potrebná pooperačná imunosupresívna liečba [10, 11, 12]. Ďalším problémom, ktorý bol riešený, je vaskularizácia štepu [13, 14, 15, 16]. Výhodným sa zdá byť využitie stopky omenta, ktorou sa obalí transplantát [17].
Náš projekt vychádza zo skúsenosti vyššie uvedených autorov. Novým prvkom je využitie tracheálnych epitélii, ktoré sú kultivované a vložené do pripraveného štepu príjemcu, čo by mohlo zlepšiť hojenie štepu. Prvé výsledky sú dobré, o výsledku celého projektu budeme informovať po jeho ukončení.
ZÁVER
Histologické vyšetrenie allotransplantátu s kultivovanými epiteliálnymi bunkami ukázalo jeho dobré hojenie aj s vyvíjajúcou sa revaskularizáciou, bez známok rejekcie štepu.
Doc. MUDr. Jozef Belák, PhD.
Lomonosovova 30
040 01 Košice
Slovenská republika
e-mail: jozef.belak@upjs.sk
Obrázky byly reprodukovány z nestandardních podkladů
Zdroje
1. Fiala, P., Cernohorsky, S., Patek, J., Zatloukal, P. Trachealresektion bei Narbenstenosen. Zentralbl. Chir., 2002; 127 : 933–938.
2. Grillo, H. C., Donahue, D. M., Mathisen, D. J., Wain, J. C., Wright, C. D. Postintubation tracheal stenosis. Treatment and result. J. Thorac. Cardiovasc. Surg., 1995; 109 : 486–493.
3. Harustiak, S., Majer, I., Benej, R., Pereszlenyi, A., Bohucky, S., Jurakova, O., Dzuberova, I., Kajanovicova, V. Stenóza trachey a jej liečba. Bratisl. Lek. Listy, 1999, 100 : 291–295.
4. Pinera, J. G., Martinez, A. P., Macian, A. M., Olmo, D. G. An experimental model for the prevention of postanastomotic tracheal stenosis. J. Thorac. Cardiovasc. Surg., 1997; 114 : 76–83.
5. Tsukada, H., Osada, H. Experimental study of a new tracheal prosthesis: pored Dacron tube. J. Thorac. Cardiovasc. Surg., 2004; 127 : 877–884.
6. Aoki, T., Yamato, Y., Tsichida, M., Souma, T., Yoshiya, K., Watanabe, T., Hayashi, J. Successful tracheal transplantation using cryopreserved allografts in a rat model. Eur. J. Cardiothorac. Surg., 1999; 16 : 169–173.
7. Kushibe, K., Nezu, K., Nishizaki, K., Takahama, M., Taniguchi, S. Tracheal allotransplantation maintaining cartilage viability with long-term cryopreserved allografts. Ann. Thorac. Surg., 2001; 71 : 1666–1669.
8. Macchiarini, P., Mazmanian, G. M., De Montpreville, V. T., Dulment, E. M., Chapelier, A. R., Dartevelle, P. G. Maximal preservation time of tracheal allografts. Ann. Thorac. Surg., 1995; 60 : 1597–1604.
9. Nakanishi, R., Hashimoto, M., Umesue, M., Kohno, H., Yasumoto, K. Maximal period of cryopreservation with the bicell biofreezing vessel for rat tracheal isografts. J. Thorac. Cardiovasc. Surg., 1999; 117 : 1070–1076.
10. Dodge-Kathami, A., Niessen, H. W. M., Baidoshvili, A., van Gulik, T. M., Klein, M. G., Eijsman, L., De Mol, B. A. J. M. Topical vascular endothelial growth factor in rabit tracheal surgery: comparative effect on healing using various reconstruction materials and intraluminal stents. Eur. J. Cardiothorac. Surg., 2003; 23 : 6–14.
11. Liu, Y., Nakamura, T., Yamamoto, Y., Matsumoto, K., Sekine, T., Ueda, H., Shimizu, Y. Immunosupressant-free allotransplantation of the trachea: the antigenicity of tracheal grafts can be reduced by removing the epithelium and mixed glands from graft by detergent treatment. J. Thorac. Cardiovasc. Surg., 2000; 120 : 108–114.
12. Stoelben, E., Harpering, H., Haberstroh, J., Di Fillipo, A., Wellens, E. Heterotopic transplantation of cryopreserved tracheae in a rat model. Eur. J. Cardiothorac. Surg., 2003; 23 : 15–20.
13. Jadczuk, E. High doses of hydrocortisone improved tracheal autograft revascularization. Eur. J. Cardiothorac. Surg., 1998; 14 : 615–620.
14. Levashev, Y. N., Akopov, A. L., Mosin, I. V. The possibilities of greater omentum usage in thoracic surgery. Eur. J. Cardiothorac. Surg., 1999; 15 : 465–468.
15. Li, J., Xu, P., Chen, H., Yang, Z., Zang, Q. Improvement of tracheal autograft survival with transplantation into the greater omentum. Ann. Thorac. Surg., 1995; 60 : 1592–1596.
16. Moriyama, H., Sasajima, T., Hirata, S., Yamazaki, K., Yatuyanagi, E., Kubo, Y. Revascularization of canine cryopreserved tracheal allografts. Ann. Thorac. Surg., 2000; 69 : 1701–1706..
17. Delaere, P. R., Liu, Z. Y., Hermans, R., Sciot, R., Feestra, L. Experimental tracheal allograft revascularization and transplantation. J. Thorac. Cardiovasc. Surg., 1995; 110 : 728–737.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 11- S doc. Martinem Vyhnálkem o Friedreichově ataxii v éře inovativní léčby – od symptomatické péče k ovlivnění průběhu nemoci a reálnému zlepšení kvality života
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Vliv pH-pufrovací technologie na snížení výskytu peristomálních komplikací a bolesti
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Budoucnost hrudní chirurgie v České republice
- Akutní mediastinitida
- Transplantace plic
- Využitie epiteliálnych buniek príjemcu pri allotransplantácii trachey v experimente – prvé výsledky
- Je něco nového v léčbě spontánního pneumotoraxu?
- Je oprávněné provedení pneumonektomie v léčbě plicních metastáz?
- Spontánní pneumomediastinum – kazuistika
- Principy ošetření poranění hrudní stěny
- Penetrující poranění hrudníku a břicha: diagnostický a léčebný postup
- Perforace jícnu
- Četnost metatastického postižení mediastinálních uzlin během plicní metastasektomie
- Perforace pravé komory srdeční úlomkem žebra po tupém úrazu hrudníku
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní mediastinitida
- Transplantace plic
- Perforace jícnu
- Je něco nového v léčbě spontánního pneumotoraxu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání