-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
Plasmatic Levels of Proinflammatory Cytokines in Abdominal Aortic Aneurysms
Introduction:
Inflammation within the abdominal aortic wall is generally considered a very significant ethiopathogenic factor in the development of abdominal aortic aneurysms. Proinflammatory cytokines are important mediators of inflammation within the abdominal aortic wall.Aim:
The aim of the study was to research, whether plasmatic levels of certain proinflammatory cytikens, which can commonly be evaluated (TNFα, IL-1, -2, -6 a -8), play a significant role in the development of AAA.Method:
The prospective non - randomized study included 345 patients with AAAs. The patients were assigned to 5 subgroups based on their symptoms and AAA diameters. The first subgroup included patients with symptomatic AAAs, including AAA ruptures (N = 69), the second subgroup included subjects with asymptomatic AAAs (N = 276) with AAA diameters up to 5 cm (N = 72), the third subgroup included 5 cm (N = 72), the fourth included 5–8 cm (N = 192) and the fifth subgroup included subjects with AAA diameters of more than 8 cm (N = 81). The mean age of patients was 74.1 ± 7.8 years (56–84 y.o.a.). The male to female ratio was 5 : 1. The control group included 30 healthy volunteer subjects of similar age and male to female rates, who had no clinical signs of arterial disorders. Plasmatic levels of cytokines were evaluated from venous blood samples using ELISA (Bender, Austria) testing. Statistical assessment of the results was performed using ANOVA and Wilcoxon tests with Spearman’s correlation. P values< 0.05 were considered significant.Results:
Plasmatic concentrations of proinflammatory cytokines were found to be statistically significantly higher in patients with AAAs compared to those in healthy volunteers. Plasmatic IL8 levels were significantly decreasing proportionally to decreasing AAA diameters (p < 0.05). TNFα levels were found to be significantly low in symptomatic patients with AAA ruptures (p < 0.05).Conclusion:
The study confirmed the significance of proinflammatory cytokines levels monitoring in AAA patients. The authors showed that, for instance IL8 activity and to a certain extent TNFα activity, is the highest in small and developing AAAs. These findings would be significant for customized medication therapy aimed at blocking the effects of these factors on the inflammatory process within the AAA wall.Key words:
abdominal aortic aneurysm – proinflammatory cytokines
Autoři: V. Třeška 1; O. Topolčan 2; J. Kočová 3; J. Moláček 1; K. Houdek 1; Z. Tonar 3; J. Vrzalová 2; Inka Třešková 1
; V. Křížková 3; L. Boudová 3
Působiště autorů: Chirurgická klinika Lékařské fakulty a Fakultní nemocnice v Plzni, přednosta: prof. MUDr. Vladislav Třeška, DrSc. 1; Oddělení imunochemické diagnostiky Lékařské fakulty a Fakultní nemocnice v Plzni, přednosta: prof. MUDr. Ondřej Topolčan, CSc. 2; Ústav histologie a embryologie Lékařské fakulty UK v Plzni, přednostka: doc. MUDr. Jitka Kočová, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 1, s. 37-41.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Role zánětu ve stěně abdominální aorty při vzniku její výdutě (AAA) je obecně považována za velmi důležitý etiopatogenetický faktor. Prozánětlivé cytokiny jsou důležitými mediátory zánětu ve stěně AAA.Cíl práce:
Cílem práce bylo zjistit, zda plazmatické hladiny některých běžně stanovitelných prozánětlivých cytokinů (TNFα, IL-1, -2, -6 a -8) mají význam pro vývoj AAA.Metoda:
V prospektivní nerandomizované studii bylo vyšetřeno 345 nemocných s AAA. Nemocní byli rozděleni do 5 skupin podle symptomatologie a průměru AAA. První skupinu tvořili nemocní se symptomatickými AAA včetně ruptur (N = 69), druhou pak nemocní s asymptomatickými AAA (N = 276) s průměrem do 5 cm (N = 72), třetí skupinu s AAA 5 cm (N = 72) a čtvrtou s AAA 5–8 cm (N = 192) a pátou s průměrem AAA nad 8 cm (N = 81). Průměrný věk nemocných byl 74,1 ± 7,8 roku (56–84 let). Poměr mužů a žen byl 5 : 1. Kontrolní skupina byla tvořena 30 zdravými dobrovolníky přibližného věkového složení a zastoupení pohlaví bez klinicky manifestních projevů tepenného onemocnění. Plazmatické hladiny cytokinů byly stanoveny v žilní krvi metodou ELISA (Bender, Rakousko). Statistické zpracování výsledků bylo provedeno pomocí ANOVA a Wilcoxonova testu se Spearmanovou korelací. Za statisticky významný rozdíl jsme považovali p < 0,05.Výsledky:
Plazmatické koncentrace prozánětlivých cytokinů byly statisticky významně vyšší u nemocných s AAA v porovnání se zdravými jedinci. Plazmatické hladiny IL-8 významně klesaly s průměrem AAA (p < 0,05). Hladiny TNFα pak byly významně nízké u nemocných symptomatických a s rupturou AAA (p < 0,05).Závěr:
Naše studie prokázala význam sledování plazmatických hladin prozánětlivých cytokinů u nemocných s AAA. Ukazuje se, že např. aktivita IL-8 a do jisté míry i TNFα bude nejvyšší u malých a vyvíjejících se AAA. To by mělo nepochybný význam pro cílenou medikamentózní léčbu zaměřenou na blokování účinku těchto faktorů v procesu zánětu ve stěně AAA.Klíčová slova:
aneuryzma abdominální aorty – prozánětlivé cytokinyÚVOD
AAA je definováno jako rozšíření subrenálního úseku břišní aorty o 50 % (nebo 1,5x) jejího lumen v porovnání se suprarenálním průměrem aorty. Jedná se o závažné onemocnění, jehož výskyt v populaci trvale stoupá. Postihuje více než 10 % populace s nejvyšším výskytem u mužů mezi 65–75 lety, kde jeho prevalence je 1,4 %, ale bude pravděpodobně ještě vyšší, protože řada nemocných, kteří zemřou a nejsou pitváni, má nediagnostikované AAA. Více jsou tímto onemocněním postiženi muži v poměru 5 : 1 k ženám. V USA způsobuje ročně více jak 150 000 hospitalizací, více než 40 000 otevřených nebo endovaskulárních výkonů a přibližně 15 000 úmrtí. Ruptura AAA zaujímá u mužů starších 55 let desáté místo v příčinách smrti.
Etiopatogeneze AAA je komplexní proces, na kterém se podílí celá řada endogenních i exogenních faktorů. Vedle genetické dispozice a věku nemocných je to hypertenze, kouření se 4x větší prevalencí než u nekuřáků a u již vzniklého AAA pak s jeho podstatně větším růstem. K dalším rizikovým faktorům patří mužské pohlaví, chronická obstrukční choroba plicní, genetická dispozice s výskytem 15–19 % u přímých potomků mužského pohlaví [1, 2].
Při vzniku AAA hraje významnou roli několik faktorů, mezi které patří především rozvoj zánětu spojeným s proteolýzou ve stěně abdominální aorty a hemodynamické faktory zvyšující napětí aortální stěny. Z hlediska role zánětu je z dosavadních včetně našich vlastních studií známo, že ve stěně AAA probíhají velmi aktivní metabolické pochody, kterých se účastní celá řada endogenních faktorů, které mohou být uvolňovány do krve.Takovými endogenními faktory jsou i tzv. prozánětlivé cytokiny, molekuly polypeptidové povahy, které jsou produkovány makrofágy, neutrofily, T - a B-lymfocyty, ale také destičkami v nástěném trombu AAA, buňkami hladkého svalu medie a fibroblasty v tunica adventicia. Ve stěně AAA je jejich aktivita jakýmsi odrazem zánětlivých dějů vedoucích k degradaci extracelulární matrix a podpoře neovaskularizace.
Cílem naší studie bylo zjistit, do jaké míry dochází k uvolňování těchto cytokinů do krve nemocného s AAA a zda plazmatické hladiny prozánětlivých cytokinů korelují s velikostí a symptomatologií AAA. Jako plazmatické markery vývoje AAA jsme vybrali cytokiny, které jsou přímo zastoupeny v metabolických procesech ve stěně AAA. Jednalo se o tumor necrosis factor α (TNFα), interleukin 1b, 2, 6 a 8 (IL-1, L-1b, -2, -6, -8).
MATERIÁL A METODA
V prospektivní nerandomizované studii jsme vyšetřili celkem 345 nemocných s AAA, kteří v době sledování netrpěli žádným onemocněním, které by ovlivnilo hladiny sledovaných protizánětlivých cytokinů v plazmě. Nemocní byli rozděleni do skupin podle symptomatologie a průměru AAA. První skupina nemocných měla symptomatická AAA včetně ruptur (N = 69), druhá pak symptomatická AAA (N = 276). Třetí skupinu tvořili nemocní s AAA < 5 cm (N = 72), čtvrtou skupinu nemocní s průměrem AAA mezi 5–8 cm (N = 192) a pátou nemocní s AAA > 8 cm (N = 81). Průměrný věk nemocných byl 74,1 ± 7,8 roku (56–84 let). Poměr mužů a žen byl 4 : 1. V době vyšetření netrpěl žádný nemocný zánětlivou chorobou, nebo manifestní malignitou, které by mohly ovlivnit plazmatické hladiny sledovaných cytokinů. Kontrolní skupina byla tvořena 30 zdravými dobrovolníky přibližného věkového složení a zastoupení pohlaví bez klinicky manifestních projevů aterosklerózy, kteří byli přijati k programové operaci tříselné nebo pupeční kýly. Všichni jedinci zastoupení ve studii byli seznámeni se záměry studie a vyjádřili dobrovolný souhlas se zařazením do studie.
Velikost AAA byla hodnocena podle největšího předozadního nebo příčného průměru AAA měřeného sonograficky dvěma zkušenými sonografisty a pomocí výpočetní tomografie (CT). Symptomatologie byla určena rupturou AAA, nebo hrozící rupturou při náhle vzniklých bolestech břicha v oblasti AAA a zad.
Plazmatické hladiny cytokinů jsme stanovovali ze vzorků žilní krve (na lačno mezi 6–7 hodinou ranní) odebíraných za standardních podmínek z kubitální žíly bez užití turniketu. U každého jedince jsme nabírali vždy dva vzorky po sobě, abychom vyloučili chybu danou jedním náběrem. Výslednou hodnotu jsme určili z průměru těchto dvou vzorků. Odebraná žilní krev byla ihned centrifugována, zmražena na -70 °C v tekutém dusíku. Hladiny cytokinů byly stanoveny ELISA metodou (souprava firmy Bender, Rakousko).
Výsledky byl stanoveny svými průměry a směrodatnou odchylkou (± SD). Statistické zpracování výsledků bylo provedeno pomocí ANOVA a Wilcoxonova testu se Spearmanovou korelací. Za statisticky významný rozdíl jsme považovali p < 0,05.
VÝSLEDKY
Plazmatické hladiny cytokinů u kontrolní skupiny nemocných a nemocných s AAA jsou uvedeny v tabulce 1. Je patrné, že hladiny všech cytokinů u nemocných s AAA významně převyšovaly (s výjimkou IL-8) hladiny u zdravých jedinců.
Tab. 1. Plazmatické hladiny cytokinů u nemocných s AAA (N = 345) a kontrolní skupiny (N = 30) Tab. 1. Plasmatic levels of cytokines in patients with AAAs (N = 345) and in the control group subjects (N = 30) 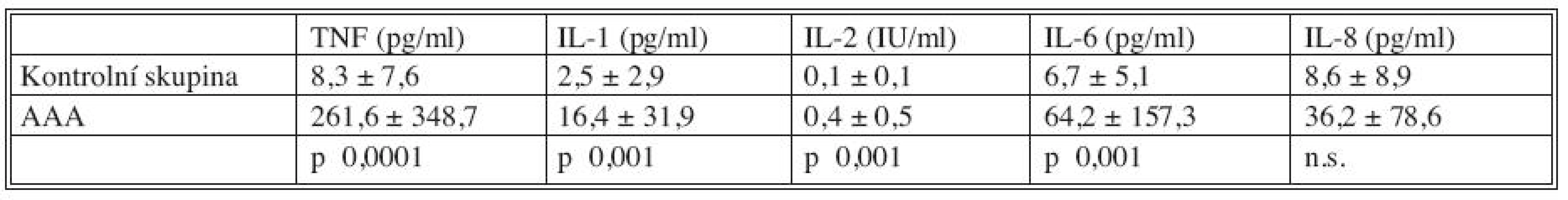
Pokud jsme porovnali plazmatické hladiny cytokinů podle velikosti AAA (Tab. 2) bylo zřejmé, že při rostoucím průměru AAA dochází k významnému poklesu plazmatických hladin IL-8. U ostatních cytokinů nebyla korelace jejich hladin s průměrem AAA významná.
Tab. 2. Korelace plazmatických hladin cytokinů s průměrem AAA Tab. 2. Correlation between the cytokines plasmatic levels and the AAA diametres 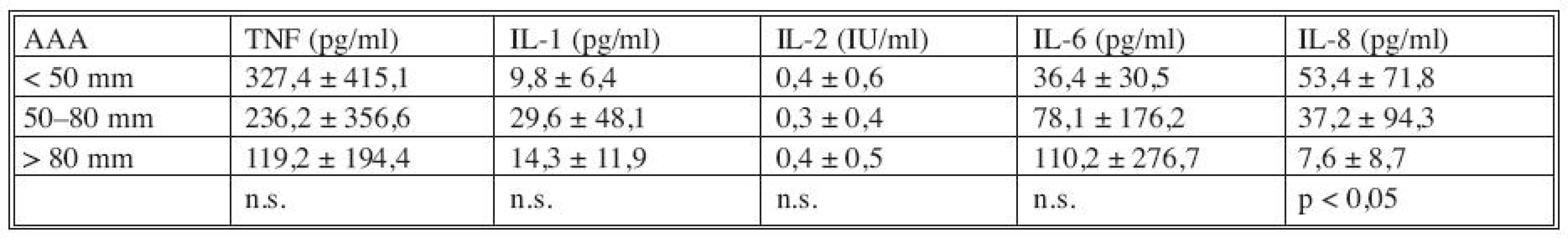
U asymptomatických nemocných významně převyšovaly plazmatické hladiny TNFα hladiny stejného faktoru u nemocných s pozitivní symptomatologií či rupturou AAA (p < 0,05). Hladiny ostatních faktorů nebyly signifikantní v korelaci se symptomatologií AAA (Tab. 3).
Tab. 3. Korelace plazmatických hladin cytokinů se symptomatologií AAA (aAAA=asymptomatické AAA, s+rAAA= symptomatické, rupturované AAA) Tab. 3. Correlation between the cytokines plasmatic levels and the AAA symptomatology (aAAA=asymptomatic AAA, s+rAAA= symptomatic, ruptured AAA) 
DISKUSE
V současné době je jednou z často diskutovaných otázek v klinické praxi léčba a prevence závažných komplikací u nemocných s AAA. Jednoznačnou indikací k chirurgické, nebo endovaskulární léčbě jsou ruptury AAA, dále AAA symptomatická a asymptomatická AAA o průměru větším 50 mm. Otázkou zůstává, jak léčit nemocné s asymptomatickými AAA o průměru < 50 mm. Jinými slovy, zda resekční nebo endovaskulární léčba dokáže nemocným nabídnout významný profit co do kvality života, nebo komplikace plynoucí z výše uvedené léčby převažují komplikace dané přirozeným vývojem AAA. Současně na základě dosavadních znalostí v etiopatogenezi AAA se začíná využívat u malých (< 50 mm v průměru) AAA léčby medikamentózní zaměřené především na zánětlivé procesy ve stěně AAA s cílem tyto procesy zpomalit, nebo zcela zastavit. Je proto cílem mnoha experimentálních a klinických studií pokusit se najít takové exogenní a endogenní faktory, které mají bezprostřední význam pro vznik a vývoj AAA. Snahou studií je využití těchto markerů k lepšímu posouzení závažnosti AAA ve smyslu hrozící ruptury a indikovat tím včasný endovaskulární nebo resekční výkon na straně jedné, na straně druhé pak využití těchto markerů pro prevenci komplikací AAA pomocí cílené medikamentózní terapie, která by měla vést ke zpomalení nebo úplnému zastavení růstu malého AAA. Cílem naší pilotní studie bylo zhodnotit pomocí plazmatických hladin prozánětlivých cytokinů aktivitu zánětlivého procesu v organizmu nemocného s AAA v různém stupni vývoje podle jeho průměru a symptomatologie.
Výběr námi sledovaných markerů nebyl náhodný. Vybírali jsme faktory, které jsou v literatuře nejčastěji diskutovány (a často s protichůdnými výsledky) z hlediska zánětlivé etiopatogeneze ve stěně AAA [3, 4, 5]. Touto pilotní studií jsme rovněž sledovali určité vytipování faktorů, které mohou ukazovat na jistý směr v etiopatogenezi zánětu při vývoji AAA.V současné době na našem pracovišti probíhá již detailní studie metabolismu AAA, kde sledujeme plazmatické a tkáňové hladiny cytokinů a dalších biologicky aktivních látek současně s jejich genovou expresí.
V současné době je nepochybné, že v procesu vzniku a vývoje AAA hraje jednu z hlavních rolí zánět ve stěně subrenální aorty, jehož důsledkem dochází k destrukci extracelulární matrix s následnou ztrátou pružnosti a pevnosti aortální stěny [6, 7]. Histopatologické změny ve stěně AAA jsou důsledkem vzájemných interakcí mezi buňkami hladkého svalu medie (SMC), fibroblastů, tedy mezenchymálními buňkami a buňkami zánětu (T a B lymfocyty, makrofágy). Jak mezenchymální, tak zejména zánětlivé buňky produkují řadu metaloproteináz (MMP 1, 2, 3, 9), které následně destruují elastin, kolagen a další stavební komponenty matrix stěny aorty. Rozpadové produkty elastinu pak stimulují neutrofilní leukocyty k další produkci MMP, na které se podílí rovněž plasmín, jehož množství je ovlivňováno činností mononukleárních buněk, které produkují aktivátor plazminogenu [8, 9, 10].
Vzájemné buněčné interakce a následné patofyziologické reakce jsou řízeny pomocí informačních molekul polypeptidové povahy – cytokinů [11, 12, 13, 14]. Jejich role ve stěně břišní aorty při vzniku aneuryzmatu je nezastupitelná. V metabolických pochodech mají stimulační, jindy naopak regresivní vliv. K hlavním cytokinům, které se podílejí na procesu vzniku AAA, patří především TNFα, IL-1, -2, -6 a -8 [15, 16, 17]. Stěna AAA je charakterizována vysokou metabolickou aktivitou v porovnání k aortě zdravé i ateroskleroticky změněné u nemocných s ischemickou chorobou dolních končetin.
TNFα se uplatňuje v procesu neovaskularizace v oblasti tunica adventitia, kde se podílí na aktivaci endotelové membrány společně s adhezními molekulami, což vede k prostupu endotelu zánětlivými buňkami, které migrují do tunica media aortální stěny. V oblasti tunica media pak dochází činností těchto buněk, která je stimulována kromě jiných faktorů i TNFα, k destrukci mezibuněčné matrix. TNFα je rovněž přímým inhibitorem syntézy kolagenu v aortální stěně. Naopak podporuje produkci MMP 1 v SMC a podílí se tak na štěpení elastinu a kolagenu ve stěně aorty. Hlavním zdrojem TNFα (kachektinu) jsou makrofágy, granulocyty, aktivované lymfocyty, fibroblasty a SMC.
Zdrojem IL-1, který aktivuje endotel k expresi adhezních molekul s následnou vazbou zánětlivých buněk na endotel a jejich migrací do subendoteliálních prostor, jsou aktivované makrofágy, endotel a fibroblasty. Umožňuje migraci monocytů do stěny aorty a jejich přeměnu v makrofágy, které stimuluje k tvorbě TNFα. IL-1 aktivuje fibroblasty k tvorbě MMP a následné degradaci aortální matrix. IL-1 ve stěně AAA významně ovlivňuje funkce SMC, které stimuluje jednak k migraci a jednak má význam pro inhibici jejich kontrakce. Zda je tento účinek důležitý ve vývoji AAA je zatím otázkou. Tento interleukin významně stimuluje sekreci IL-6 v SMC, který v AAA působí chemotakticky pro B-lymfocyty, v nichž podporuje produkci imunoglobulinů, a tak pravděpodobně navozuje autoimunní pochody ve stěně AAA [18, 19].
IL-2 ovlivňuje imunitní pochody v organismu stimulací T - a B-lymfocytů. Uplatňuje se při tvorbě protilátek v autoimunních procesech, jejichž role je velmi pravděpodobná při vzniku AAA. IL-6 je produkován makrofágy, T-lymfocyty, fibroblasty a endoteliálními buňkami. Působí stimulaci a diferenciaci T - i B-lymfocytů, které následně produkují MMP ve stěně aorty. Jeho produkce je zvyšována v monocytech za přítomnosti D dimeru, který vzniká v oblasti trombu na stěně AAA. IL-8 je chemotaktickým faktorem pro neutrofily a lymfocyty. Působí na uvolnění adhezních molekul a zvyšuje tak adhezivitu neutrofilů na endotel a jejich pronikání do aortální stěny. Přímo stimuluje produkci elastáz v neutrofilech, čímž nepřímo podporuje degradaci elastinu a vznik aneuryzmatické dilatace aorty.
Obecnou charakteristikou zánětlivých pochodů, které se odehrávají při různých patologických stavech v různých oblastech organismu, je přítomnost zánětlivých faktorů nejen v zánětlivém ložisku, ale i v krvi nemocného jedince, kde nepřímo charakterizují tíži zánětu. I naše studie proto vycházela z plazmatických hladin prozánětlivých cytokinů u nemocných s AAA, kteří netrpěli žádnou jinou přidruženou chorobou, která by hladiny sledovaných cytokinů mohla ovlivnit.
V naší pilotní studii jsme zjistili, že plazmatické hladiny námi sledovaných cytokinů jsou u nemocných s AAA velmi významně zvýšeny. Toto naše pozorování je v souladu s pozorováními jiných autorů, kteří prokázali, že hladina IL-8 ve stěně abdominálního aneuryzmatu je podstatně vyšší než ve zdravé aortě. Dawson [21] ve své práci prokazuje , že hladina IL-6 má vztah i k riziku kardiovaskulárních komplikací u osob s AAA. Pokud jsme se však detailně zabývali rozborem vztahu plazmatických hladin sledovaných cytokinů k velikosti a klinické symptomatologii AAA nejsou naše pozorování již tak zcela jednoznačná. V naší studii jsme nalezli signifikantní vztah mezi plazmatickými hladinami IL-6 a velikostí AAA, což podporuje i výsledky Karlsona [22], Lindemana [23] a Dawsona [24]. Cheuk [25] pak nalezl signifikantní rozdíl mezi symptomatologií a sekrecí IL-6 u nemocných s AAA. My jsme však tuto korelaci nenalezli. Zajímavý byl nález významně nízkých plazmatických hladin TNFα u nemocných se symptomatickým, nebo rupturovaným AAA v porovnání s vysokými hladinami tohoto faktoru u asymptomatických nemocných v naší studii. Pravděpodobně bude tento faktor zastoupen především v procesu vzniku a vývoje AAA, kde se dá očekávat vysoká metabolická prozánětlivá aktivita. Dokazují to i výsledky hladin TNFα u našich nemocných podle velikosti AAA, i když ve statistickém hodnocení nebyly v konečném kontextu významné. TNFα se obecně připisuje klíčová role v patogenezi AAA a to především aktivací metaloproteináz a remodelačním procesu AAA. Xiong a spol [26] na zvířecím modelu jednoznačně prokázal, že blokování aktivity TNFα ve stěně AAA má pozitivní význam pro ovlivnění rozvoje AAA. Otázku vztahu cytokinů a dalších markerů k růstu a velikosti aneuryzmatu cituje ve své práci rovněž Flondell-Sité [27], ale nedochází k jednoznačným závěrům ve vztahu cytosinů a růstu AAA. Zajímavé jsou v poslední době některé experimentální práce. Zhang [28] ve svém experimentu na zvířatech nalezl možnost ovlivnění sérových hladin IL-1, -6 a -8 a tak i expresi adhezivních molekul v cévní stěně pomocí medikamentů vyvinutých na bázi epoxyeicosatrienoické kyseliny.
ZÁVĚR
Jsme si vědomi, že naše studie má své nedostatky zejména v tom, že nezohledňuje hladiny sledovaných cytokinů ve stěně AAA. Nicméně v souladu s dalšími klinickými a experimentálními studiemi naše studie ukázala jistý směr v zaměření dalšího výzkumu sledování role zánětlivých faktorů na vznik a vývoj AAA. Důležité pak je, že v současné době lze vyvíjet léky, které jsou cíleně zaměřené proti specifickým faktorům zánětu ve stěně AAA a mohly by tak účinně omezit jeho růst a vznik letální komplikace, jakým je ruptura AAA.
Řešeno s podporou Výzkumného projektu Evropské Unie – FAD No 200647 a Výzkumného úkolu MZ ČR MSM 0021620819.
Prof. MUDr. Vladislav Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e-mail: treska@fnplzen.cz
Zdroje
1. Chaikof, E. L., Brewster, D. C, Dalman, R. L., Makaroun, M. S., Illig, K. A., Sicard, G. A., Timaran, C. H., Upchurch, G. R., Veith, F. J. The care of patiens with abdominal aortic aneurysma: the Society for Vascular Surgery practice guidelines. J. Vasc. Surg., 2009; 50 (4Suppl): S2–49.
2. Nordon, I. M., Hinchliffe, R. J., Holt, P. J., Loftus, I. M., Thompson, M. M. Review of current theories for abdominal aortic aneurysma pathogenesis. Vascular, 2009; 17(5): 253–263.
3. Reeps, C., Pelisek, J., Seidl, S., Schuster, T., Zimmermann, A., Kuehnl, A., Eckstein, H. H. Inflammatory infiltrates and neovessels are relevant sources of MMPs in abdominal aortic aneurysm wall. Pathobiology, 2009; 76(5): 243–252.
4. Treska,V., Kocova, J., Topolcan, O., Boudova, L. Inflammation in the wall of abdominal aneurysm and its role for symptomatology of aneurysm. Cytokines, Cellular and Molecular Therapy Journal, 2002; 7(3): 91–97.
5. Tonar, Z., Nemecek, S., Holota, R., Kocova, J., Treska, V., Molacek, J., Kohoutek, T., Hadravska, S. Microscopic image analysis of elastin network in samples of normal, atherosclerotic and aneurysmatic abdominal aorta and its biomechanical implications. J. Appl. Biomed., 2003; 1 (3): 149–160.
6. Golledge, J., Tsao, P. S., Dalman, R. L., Norman, P. E. Circulating markers of abdominal aortic aneurysm presence and progression. Circulation, 2008; 118(23): 2382–2392.
7. Ailawadi, G, Eliason, J. L., Upchurch, G. R. Jr. Current concepts in the pathogenesis of abdominal aortic aneurysm. J. Vasc. Surg., 2003; 38(3): 584–588.
8. Annambhotla, S., Bourgeois, S., Wang, X., Lin, P. H., Yao, Q., Chen, C. Recent advances in molecular mechanisms of abdominal aortic aneurysm formation. World J. Surg., 2008; 32(6): 976–986.
9. Gottsäter, A., Flondell-Site, D., Kölbel, T., Lindblad, B. Associations betweenstatin treatment and markers of inflammation, vasoconstriction, and coagulation in patients with abdominal aortic aneurysm. Vasc. Endovascular Surg., 2009; 42(6): 567–573.
10. Golledge, A. L., Walker, P., Norman, P. E., Golledge, J. A systematic review of studies examining inflammation associated cytokines in human abdominal aortic aneurysm samples. Dis. Markers, 2009; 26(4): 181–188.
11. Golledge, J., Clancy, P., Jones, G. T., Cooper, M., Palmer, L. J., van Rij, A. M., Norman, P. E. Possible association between genetic polymorphisms in transforming growth factor beta receptors, serum transforming growth factor beta1 concentration and abdominal aortic aneurysm. Br. J. Surg., 2009; 96(6): 628–632.
12. Treska, V., Topolcan, O., Wenham, P. W., Pecenm, L., Kocova, J. Cytokine metabolism in aneurysms of the abdominal aorta. Rozhl. Chir., 1998; 77(5): 225–229.
13. Borges, L. F., Touat, Z., Leclercq, A., Zen, A. A., Jondeau, G., Franc, B., Philippe, M., Meilhac, O., Gutierrez, P. S., Michel, J. B. Tissue diffusion and retention of metalloproteinases in ascending aortic aneurysma and dissections. Hum. Pathol., 2009; 40(3): 306–313.
14. Hamano, K., Li, T. S., Takahashi, M., Kobayashi, T., Shirasawa, B., Ito, H., Zempo, N. Enhanced tumor necrosis factor - alpha expression in small sized abdominal aortic aneurysms. World J. Surg., 2003; 27(4): 476–480.
15. Dawson, J., Cockerill, G., Choke, E., Loftus, I., Thompson, M. M. Circulating cytokines in patients with abdominal aortic aneurysms. Ann. N Y Acad. Sci., 2006; 1085 : 324–326.
16. Guo, D. C., Papke, C. L., He, R., Milewicz, D. M. Pathogenesis of thoracic and abdominal aortic aneurysms. Ann. N Y Acad. Sci., 2006; 1085 : 339–352.
17. Rizas, K. D., Ippagunta, N., Tilsom, M. D. Immune cells and molecular mediators in the pathogenesis of the abdominal aortic aneurysm. Cardiol. Rev., 2009; 17(5): 201–210.
18. Houard, X., Touat, Z., Ollivier, V., Louedec, L., Philippe, M., Sebbag, U., Meilhac, O., Rossignol, P., Michel, J. B. Mediators of neutrophil recruitment in human abdominal aortic aneurysms. Cardiovasc. Res., 2009; 82(3): 532–541.
19. Wallinder, J., Bergqvist, D,. Henriksson, A. E. Proinflammatory and anti-inflammatory cytokine balance in patients with abdominal aortic aneurysm and the impact of aneurysm size. Vasc. Endovascular Surg., 2009; 43(3): 258–261.
20. Middleton, R. K., Lloyd, G. M., Bown, M. J., Cooper, N. J., London, N. J., Sayers, R. D. The pro-inflammatory and chemotactic cytokine microenvironment of the abdominal aortic aneurysm wall: a protein array study. Eur. J. Vasc. Endovasc. Surg., 2009; 37(1): 46–55.
21. Dawson, J., Cockerill, G., Choke, E., Loftus, I., Thompson, M. M. Aortic aneurysms as a source of circulating interleukin-6. Ann. N Y Acad. Sci., 2006; 1085 : 320–323.
22. Karlsson, L., Bergqvist, D., Lindback, J., Parsson, H. Expansion of small-diameter abdominal aortic aneurysms is not reflected by the release of inflammatory mediators IL-6, MMP-9 and CRP in plasma. Eur. J. Vasc. Endovasc. Surg., 2009; 37(4): 420–424.
23. Lindeman, J. H., Abdul-Hussien, H., Schaapherder, A. F., Van Bockel, J. H., von der Thüsen, J. H., Roelen, D. L., Kleemann, R. Enhanced expression and activation of pro-inflammatory transcription factors distinguish aneurysmal from atherosclerotic aorta: IL-6 - and IL-8-dominated inflammatory responses prevail in the human aneurysm. Clin Sci (Lond). 2008; 114(11): 687–697.
24. Dawson, J. A., Choke, E., Cockerill, G. W., Loftus, I. M., Thompson, M. M. The long-term effects of open and endovascular aneurysm repair on circulating interleukin-6. Eur. J. Vasc. Endovasc. Surg., 2009; 37(1): 43–45.
25. Cheuk, B. L., Cheng, S. W. Differential secretion of prostaglandin E(2), thromboxane A(2) and interleukin-6 in intact and ruptured abdominal aortic aneurysms. Int. J. Mol. Med., 2007; 20(3): 391–395.
26. Xiong, W., MacTaggart, J., Knispel, R., Worth, J., Persidsky, Y., Baxter, B. T. Blocking TNF-alpha attenuates aneurysm formation in a murine model. J. Immunol., 2009; 183(4): 2741–2746.
27. Flondell-Sité, D., Lindblad, B., Kolbel, T., Gottsater, A. Cytokines and systemic biomarkers are related to the size of abdominal aortic aneurysms. Cytokine, 2009; 46(2): 211–215.
28. Zhang, L. N., Vincelette, J., Cheng, Y., Mehra, U., Chen, D., Anandan, S. K., Gless, R, Webb, H. K., Wang, Y. X. Inhibition of soluble epoxide hydrolase atenuated atherosclerosis, abdominal aortic aneurysm formativ, and dyslipidemia. Arterioscler. Thromb. Vasc. Biol., 2009; 29(9): 1265–1270.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
- Ischemická kolitída po operáciách pre AAA
- Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
- Roboticky asistované cévní rekonstrukce aorto-ilické oblasti
- Vliv infrainguinálních bypassů na dlouhodobou průchodnost pánevních intervencí – význam hybridních výkonů
- Žilní interponát při řešení krvácení z distální anastomózy pedálního bypassu
- Peroperační intraarteriální trombolýza v terapii akutní končetinové ischemie
- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Simultánní karotická endarterektomie a koronární revaskularizace: indikace a výsledky
- Jednoduchá metoda odstranění infikované cévní protézy
- Dva mylné mýty flebologické chirurgie 20. století
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



