-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
Cytostatic Hyperthermic Isolated Limb Perfusion (HILP) in VFN (General Faculty Hospital in Prague)
Hyperthermic isolated limb perfusion (HILP) is a standardized method of treatment in selected patiens with in-transient locoregional recurence/methastasis of melanoma or, some other soft tissue tumors (incl. sarcoma etc.) Authors present history and current status of this treatment modality in General University Hospital in Prague. During one year period (7/2009–6/2010) 10 patients were indicated for this procedure. We performed 13 procedures (3x redo), 11 in lower extremity and 2 in upper extremity. There was no serious complication in this cohort of patiens. Multidisciplinar approach is indicated in melanoma patiens care.
Key words:
regional hypertermic perfusion – melanoma – in-transit metastases – melphalan – TNF
Autoři: M. Špaček; P. Mitáš; L. Lacina 1; I. Krajsová 1; G. Hodková; M. Salmay; R. Špunda; L. Brlicová; J. Lindner
Působiště autorů: II. chirurgická klinika, kardiovaskulární chirurgie, 1. LF UK a VFN v Praze ; Dermatovenerologická klinika, 1. LF UK a VFN v Praze 1
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 1, s. 62-66.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Cytostatická hypertermická perfuze izolované končetiny (HILP) je standardní léčebnou metodou pro část pacientů s lokální recidivou melanomu na dolní či horní končetině, u nemocných s lokálně neresekovatelným nádorem. Metoda se používá též u některých dalších typů nádorů. Autoři sdělení popisují historii a současné aspekty použití této metody ve Všeobecné fakultní nemocnici v Praze.Soubor pacientů a metody:
V období 1 roku (7/2009–6/2010) jsme na našem pracovišti provedli celkem 13 cytostatických hypertermických perfuzí izolované končetiny (HILP – hypertermic isolatedl limb perfusion) u 10 nemocných. U 9 nemocných se jednalo o perfuzi dolní končetiny (ve dvou případech opakovanou) a jedenkrát jsme provedli HILP horní končetiny (opakovanou). V 9 případech jsme k výkonu indikovali nemocné s lokální recidivou melanomu, charakteristika primárního onemocnění podle klasifikace MD Anderson byla: III – IV. V jednom případě jsme operovali nemocnou s lokální recidivou spinocelulárního karcinomu postihující dolní končetinu.Výsledky:
V krátkodobém horizontu jsme nezaznamenali vážnější komplikace spojené s vlastní procedurou. U jedné nemocné došlo k hojení rány v třísle per secundam intentionem. Pooperační otok/erytém byl přítomen u většiny nemocných, ale postižení nepřekračovalo stupeň 2–3 podle Wieberdinkovy klasifikace. Kompletní léčebné odpovědi bylo v rámci krátkodobého sledování dosaženo u 5 nemocných, částečné u 4 nemocných, u poslední ošetřené pacientky nelze zatím relevantně klinickou odpověď hodnotit.Závěr:
Hypertermická izolovaná perfuze končetin je bezpečná metoda léčby v indikovaných případech. Kompletní léčebná odpověď, která byla dosažena u 5 nemocných, je, ve shodě s literárními údaji, pozitivní prognostický indikátor dlouhodobého přežití. Z onkologického hlediska jsou dosažené výsledky nadějné, i když doba sledování, která by umožnila komplexní hodnocení kohorty pacientů, je zatím příliš krátká. Pro poskytování maximální léčby pomocí této metody je třeba v dohledné době zavedení kombinace Melphalan + TNF alfa v ČR.Klíčová slova:
regionální hypertermická perfuze – melanom – tranzitní metastázy – melphalan – TNFÚVOD
Cytostatická hypertermická perfuze izolované končetiny (HILP) je metodou volby u nemocných s lokálně neresekovatelným melanomem [1] a u nemocných s lokální recidivou tumoru bez průkazu vzdálených metastáz. Historicky byla nejprve používána perfuze normotermní – rok 1958 (Creech a Krementz) – z důvodu obav ze spazmu cév při hypertermii. První hypertermická perfuze končetiny byla provedena roku 1969 [2]. Díky izolaci oběhu perfundované končetiny lze tímto postupem dosáhnout více než dvacetinásobné tkáňové koncentrace cytostatika ve srovnání s maximální dosažitelnou koncentrací při systémovém podání [18]. Použití jednotlivých typů cytostatik a jejich kombinace přináší další zlepšení léčebných výsledků. V rámci VFN se touto technikou zabývali v 60. letech prof. Lichtenberg a v druhé polovině 80. let dr. Bříza a kolektiv [3, 4].
Tumory vhodné pro léčbu pomocí HILP
Jak bylo uvedeno, léčba pomocí HILP se týká v převážné většině definované skupiny nemocných maligním melanomem. Při užití kombinované cytostatické léčby (Melphalan + TNF alfa), která byla zahájena devadesátých letech minulého století, bylo dosaženo podstatné zlepšení výsledků též u neresekovatelných sarkomů měkkých tkání. V případě maligního melanomu byla užita MD Anderson klasifikace místo běžnější TNM klasifikace pro lepší porovnatelnost výsledků s literárně známými daty (Tab. 1).
Tab. 1. Klasifikace stadií podle MD Anderson Tab. 1. Classification of stages according to MD Anderson 
Indikace k operaci
Rekurence maligního melanomu na horní či dolní končetině je obvykle léčena lokálním chirurgickým výkonem, eventuálně v kombinaci s další onkologickou léčbou. Pokud počet, lokalizace nebo velikost primární, či metastatických lézí nedovoluje tento typ léčby, označujeme nádor jako lokálně neresekabilní a v této situaci může být nemocný indikován k hypertermické izolované perfuzi končetiny s vysokou dávkou cytostatika. Intranzitní metastázy se vyskytují u 5–8 % nemocných s vysoce rizikovým typem melanomu. Jejich léčba představuje určitou výzvu. Možnost jednoduché chirurgické excize může být též limitována velikostí, četností a stavem po předešlých léčebných procedurách, jako např. radioterapii. Další možné způsoby léčby, jako radioterapie, chemoterapie a/nebo imunoterapie mají u maligního melanomu omezenou účinnost [8–10]. Lze tedy shrnout, že maximální profit z léčby pomocí HILP mají nemocní s rekurencí onemocnění, přítomností intranzitních metastáz melanomu, a dále s neresekovatelnými sarkomy měkkých tkání. Obecnou podmínkou je citlivost nádoru vůči Melphalanu, což rozšiřuje v některých případech indikační interval i na méně časté typy končetinových nádorů.
Používaná cytostatika
Léčebné odpovědi dosahujeme kombinací lokální hypertermie (kombinace podložky a izolované mimotělní cirkulace) a vysoké koncentrace cytostatika. Standardně užívaným cytostatikem je Melphalan (Alkeran). Kompletní léčebné odpovědi při užití Melphalanu dosahujeme u 54 % nemocných [16]. Řada autorů doporučuje jeho kombinaci s Tumor Necrosis Faktorem alfa (TNF alfa), který však není t.č. do České republiky dovážen, ale jeho užití je pro tuto skupinu nemocných otázkou snad blízké budoucnosti. Po zavedení TNF alfa do klinické praxe v roce 1992 byly publikovány soubory dosahující kompletní léčebné odpovědi až 73 % [17, 18]. Synergie spojenou s profitem nemocných při kombinaci uvedených látek v perfuzátu popisuje např. E. Noorda et al. [7]. Mechanismem působení je zvýšení prostupnosti cévního zásobení tumoru pomocí TNF alfa, kde se poté může v plné šíři uplatnit účinek Melphalanu. To je výhodou zejména u nemocných, kteří trpí nádorem ve formě nodulů, resprektive rozsáhlejších nádorových mas. Jiní autoři popisují dosažení kompletní odpovědi ve 45 % ve skupině HILP (Melphalan) ve srovnání s 59 % ve skupině HILP (Melphalan+ TNF), kdy ve druhé skupině bylo tohoto stavu dosaženo o 1 měsíc dříve (2 vs. 3 měsíce) Avšak četnost rekurence a medián recurence – free survival končetiny byl v obou skupinách stejný. Byť v některých studiích statisticky nevýznamná, avšak zřejmá, je tendence k lepší léčebné odpovědi u nemocných léčených kombinací melphalanu v kombinaci s TNF alfa. Další, v průběhu devadesátých let minulého století, podrobně studovanou kombinací chemoterapeutik byl Melphalan + TNF alfa + interferon-gamma. Jedná se zejména o Multicenter European phase 2 trial [11–13], která tento trend potvrdila. V této studii byli nemocní rozděleni do dvou skupin. První byla léčená pomocí melphalan + TNF alfa (M+T) a druhá pomocí melphalan + TNF alfa + interferon gamma (M+T+I). Výsledky v těchto skupinách byly porovnány s výsledky v historické skupině nemocných léčených pouze HILP s použitím Melphalanu a potvrdily výsledky předešlých studií.
Prognostické faktory pro tumor response a limb-recurence free surfoval
Podle literárních údajů významným faktorem pro dosažení kompletní léčebné odpovědi a též recurrence-free survival končetiny, je stadium IIIA podle MD Andersona. Pokročilejší stadia onemocnění před HILP znamenají horší prognózu stran těchto sledovaných parametrů. Stran prognózy celkového přežití nemocných jsou významnými parametry dosažení kompletní léčebné odpovědi a též velikost tumoru do 3 cm [7].
Léčba rekurence perzistující po HILP
Způsob léčby nemocných v případě rekurence léze indikujeme individuálně. Možností je excize, radioterapie a lokální hypertermie, další izolovaná hypertermická perfuze končetiny (ev. doplněná excizí lézí), chemoterapie, imunoterapie a v extremních případech zvážení amputace končetiny.
Toxicita a morbidita, komplikace
Hodnocení odpovědi organismu ve smyslu toxického poškození vychází z práce Wieberdinka et al. [6] – viz tabulka 2. Z hlediska středně a dlouhodobého hodnotíme komplikace ve smyslu žilní trombózy, infekce v ráně/hojení per secundam intentionem. Edém, neuropatie, atrofie svalstva a obecně malfunkce končetiny jsou parametry sledování dlouhodobé morbidity (Tab. 2).
Tab. 2. Wieberdinkova klasifikace akutní regionální toxicity Tab. 2. Wieberdink classification of acute regional toxicity 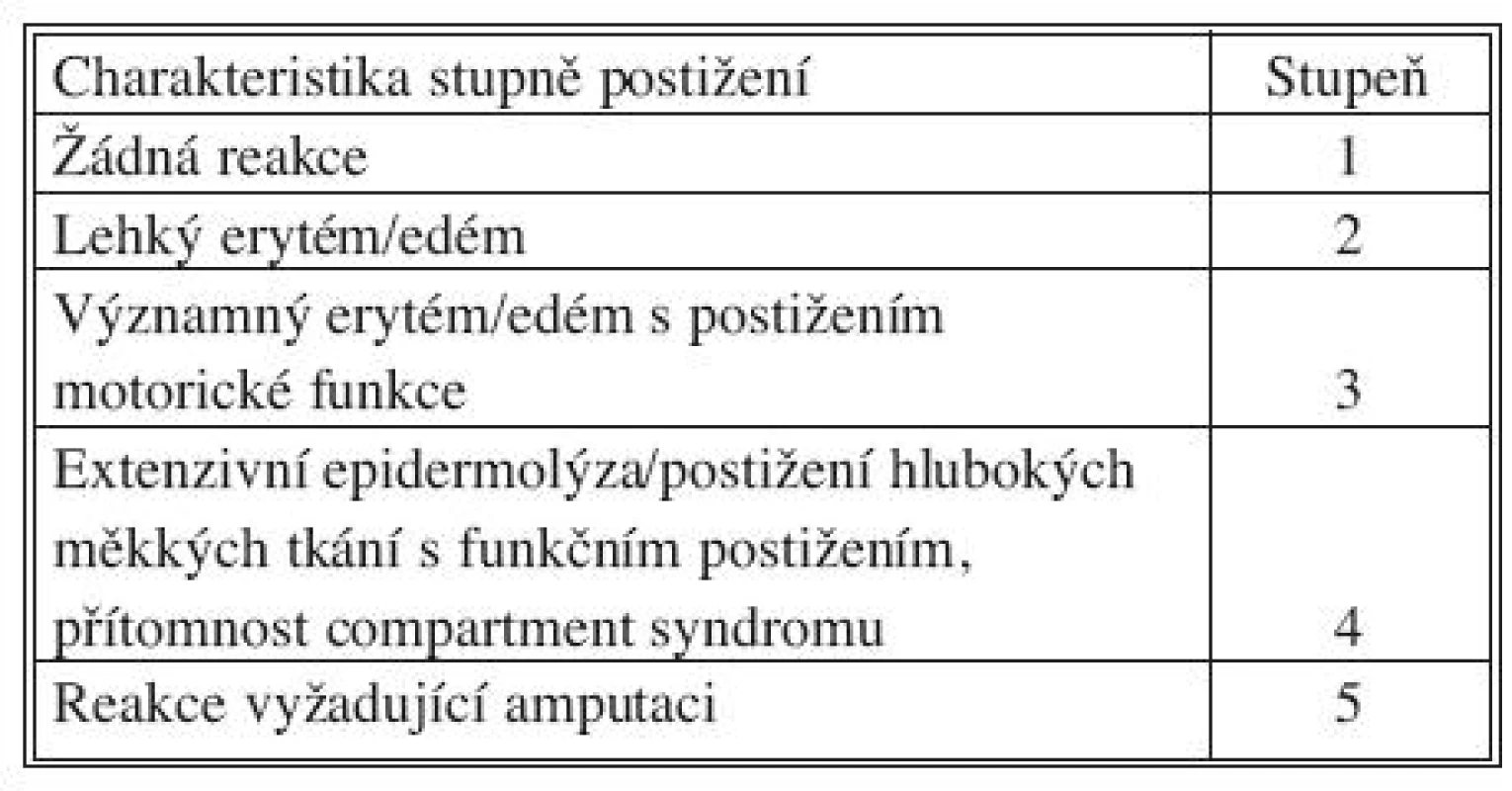
MATERIÁL A METODA
Technika HILP
Samotné technické provedení operace spočívá v preparaci cév dané lokality a následné kanylaci pro zajištění mimotělního oběhu. Možná místa kanylace závisí na lokalizaci tumoru ev. metastáz a cílové oblasti perfuze. U tumorů lokalizovaných od poloviny stehna distálně volíme jako místa kanylace femorální cévy. U tumorů, které zasahují horní část stehna až do oblasti tříselného vazu, je třeba kanylovat ilické cévy. V tomto případě důsledně volíme šetrný extraperitoneální přístup. Izolaci kolaterálního oběhu je třeba v takovém případě uskutečnit za použití dočasné zevní fixace k upevnění Esmarchových škrtidel. Pokud je proces lokalizován na nohu, je možno ke kanylaci použít popliteální cévy a to z přístupu dorzálního v podkolenní štěrbině, nebo mediálního – v oblasti těsně nad kolenní štěrbinou. Obdobně místa kanylace cév horní končetiny vycházení z lokalizace tumoru. Zde nejčastěji kanylujeme brachiální ev. axilární cévy z krátké, kosmeticky příznivé kožní incize (Obr. 1).
Obr. 1. Kanylace femorálních cév pro zahájení mimotělního oběhu. Centrálně jsou cévy uzavřeny pomocí svorek Fig. 1. Canylation of femoral vessels after initiation of extracorporeal circulation. Centrally, the vessels are closed using vascular clips 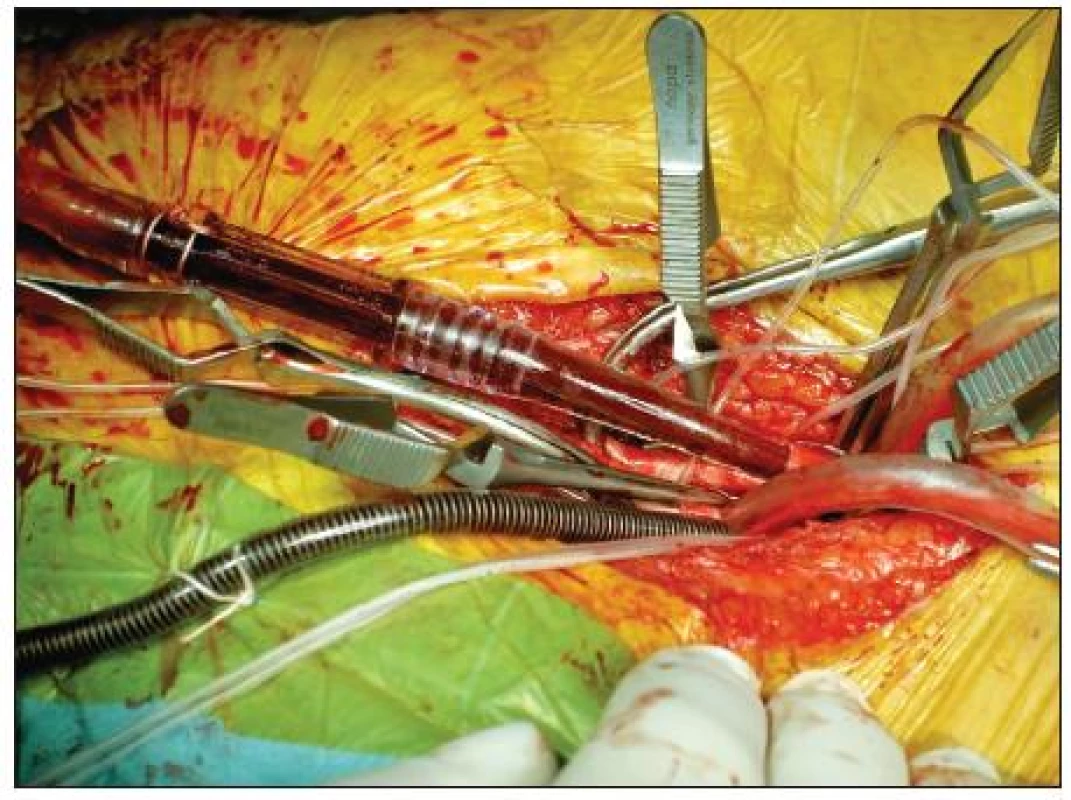
Nejčastějším přístupem pro perfuzi dolní končetiny jsou femorální cévy. Kožní incize je asi 8 cm dlouhá. V třísle preparujeme bifurkaci femorální tepny a žíly, včetně odstupujících drobných větví, pro možnost jejich uzávěru během vlastní perfuze tak, aby byla periferie končetiny maximálním možným způsobem izolována a nedocházelo k úniku hypertermického perfuzátu, resp. cytostatika. Kanylace příslušných tepen a žil se provádí z příčné tomie cév, průměr kanyl jako nejvyšší možný podle průměru cév tak, abychom zajistili dostatečný průtok v mimotělním oběhu. Součástí přístroje pro mimotělní oběh je oxygenátor zajištující výměnu plynů v krevním roztoku tak, aby ischemie končetiny po dobu perfuze byla co nejnižší. Izolace kolaterál se provádí naložením a adekvátním utažením dvou esmarchových škrtidel proximálně od perfundované oblasti. Výměník tepla zajištuje potřebné ohřátí roztoku tak, aby cílová teplota tkání dosahovala 39–40 °C. Monitorace cílové teploty je průběžně zajištěna senzory svalového a podkožního teploměru. Lokální hypertermii napomáhá uložení končetiny do sterilní vodní podložky. Standardní doba ohřevu končetiny je asi 30 minut. Po dosažení cílové teploty tání je do perfuzátu přidán roztok cytostatika (Melphalan/Alkeran) v množství, které závisí na objemu končetiny. Poločas rozpadu cytostatika je krátký, proto jeho příprava je zahájena současně se zahájením perfuze. Od rekonstituce injekčního roztoku do dokončení infuzního podání by totiž neměla uplynout doba delší než 1,5 hodiny. Platí, že jeho stabilita a rychlost degradace se rychle zvyšuje se stoupající teplotou. Hlavním faktorem určujícím poločas u lidí je spíše spontánní degradace než enzymová metabolizace. Doba perfuze s cytostatikem je asi 90–100 minut, a to za dodržení dosažené teploty. Na závěr je do arteriální linky přidáno 2–3 l izotonického roztoku k vymytí perfuzátu. Tento je likvidován podle zásad práce s biologickým materiálem a cytostatiky (Obr. 2). Pokud by určitá ztráta krve, která je dána likvidací izolovaného perfuzátu končetiny, znamenala výrazný pokles v hodnotě krevního obrazu, jsou pro nemocného připraveny 2 transfuzní jednotky erymasy. Jejich podání je ale spíše výjimečné. Možnost monitorace úniku perfuzátu s cytostatikem během výkonu existuje za použití metod nukleární medicíny. Metabolické změny v perfundované končetině (Graf 1) nevedly ke vzniku compartment syndromu u žádného z pacientů. Tato skutečnost je ve shodě s výsledky predikce rozvoje compartment syndromu po reperfuzi ischemické končetiny na základě biochemického monitoringu, kdy dostatečnou oxygenaci tkání zajišťuje zařazení oxygenátoru do systému mimotělního oběhu i při sníženém hematokritu vlastního perfuzátu.
Obr. 2. Přístroj pro mimotělní oběh (miniaturní oxygenátor i hadicový set, vak na uskladnění a likvidaci perfuzátu) Fig. 2. Extracorporeal circulation apparatus (miniature oxygenator and a set o tubes, a sac for storage and disposal of the perfusate) 
Graf 1. Hodnoty laktatemie v systémové cirkulaci a v izolovaném mimotělním oběhu (MO) perfundované končetiny v průběhu HILP (před MO, po ohřátí končetiny – podání infuze cytostatika a dále po 30 a 60 min. perfuze s cytostatikem, a po obnovení krevního průtoku v končetině na konci výkonu) Graph 1. Lactate levels in systemic circulation and in isolated extracorporeal circulation(MO) of the perfused limb during HILP (prior to extracorporeal circulation(MO), after the limb warming – administration of cytostatic infusion, then regional cytostatic perfusion at 30 minutes and 60 minutes, and after the limb perfusion recovery at the end of the procedure) 
Vlastní výkon provádíme po dohodě s nemocným v šetrné celkové anestezii, která je pro nemocného vzhledem k délce výkonu výhodnější. Standardní protokol operace zahrnuje zavedení epidurálního katétru k podávání analgezie, zejména však pro pooperační období a též vzhledem k možným pooperačním komplikacím. Po operaci je nemocný 24 hod. monitorován na jednotce intenzivní péče. Další pobyt na standardním oddělení závisí na individuální rychlosti časné rekonvalescence a výskytu eventuálních lokálních komplikací, v průměru nepřesahuje 3 dny.
VÝSLEDKY
V krátkodobém horizontu jsme nezaznamenali vážnější komplikace spojené s vlastní procedurou. U jedné nemocné došlo k hojení rány v třísle per secundam intentionem. Pooperační otok/erytém byl přítomen u většiny nemocných, ale postižení nepřekračovalo stupeň 2–3 podle Wieberdinkovy klasifikace. Kompletní léčebné odpovědi bylo v rámci krátkodobého sledování dosaženo u 5 nemocných, částečné u 4 nemocných, u poslední ošetřené pacientky nelze zatím relevantně klinickou odpověď hodnotit (Tab. 3).
Tab. 3. Výsledky – charakteristika souboru Tab. 3. Results – the study group characteristics 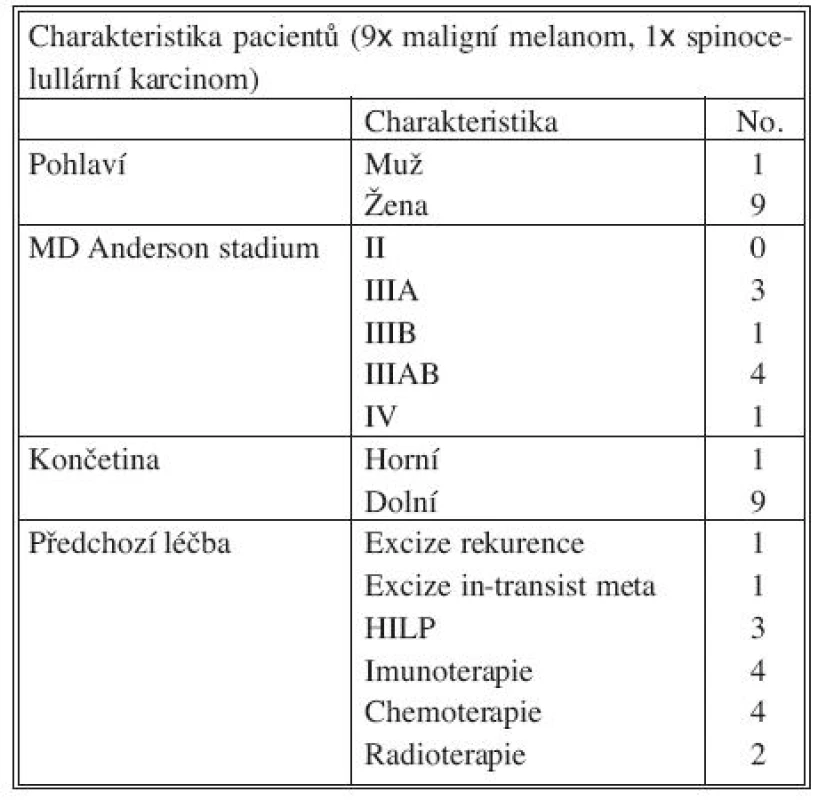
Očekávaný přínos pro nemocné. Udávané pětileté přežití pro nemocné léčené HILP ve stadiu II MD Anderson je 57–80 %, ve stadiu IIIA disease 35–70%, ve stadiu IIIAB onemocnění 23–40%, a pro stadium IV 8–10% [11–15].
ZÁVĚR
Hypertermická izolovaná perfuze končetin je přínosem pro nemocné jako paliativní léčebná metoda zejména v případech lokálně extenzivního nálezu. Většině nemocných přináší úplnou nebo částečnou léčebnou odpověď, prodlouží interval nové rekurence onemocnění. V podskupině nemocných s méně agresivním chováním tumoru je léčba též spojena s delším disease-free survival. Dosažení úplné léčebné odpovědi je pozitivní predátor dlouhodobého přežití. Pro poskytování maximální léčby pomocí této metody je třeba v dohledné době zavedení kombinace Melphalan + TNF alfa v ČR. Tato kombinace přináší úplnou léčebnou odpověď až u 73 % vs. 54 % nemocných při samostatném použitím Melphalanu. Úkolem tohoto sdělení není hodnocení krátkodobých výsledků u relativně malého souboru nemocných, ale podrobnější seznámení odborné veřejnosti s indikací a technikou provedení operačního výkonu. Vzhledem k relativně malému počtu nemocných indikovaných k operaci je vhodné, aby se léčba centralizovala v rámci ČR do několika málo pracovišť, tak jak je tomu v současné době (Centrum kardiovaskulární a transplantační chirurgie v Brně, II. Chirurgická klinika kardiovaskulární chirurgie v Praze).
Poděkování patří MUDr. Jiřímu Slavíkovi z Centra kardiovaskulární a transplantační chirurgie v Brně, za laskavou pomoc a asistenci u prvních perfuzí.
S podporou grantu IGA MZ ČR NS 9787-3.
MUDr. Miroslav Špaček
II. chirurgická klinika VFN a 1. LF UK
U Nemocnice 2
128 08 Praha 2
e-mail: mirekspacek@seznam.cz
Zdroje
1. Noorda, E., Vrouenraets, B., Nieweg, O., et al. Isolated limb perfusion for unresectable melanoma of the extremities. Arch. Surg., 2004 : 139 : 1237–1242.
2. Krementz, E. T. Regional perfusion. Cancer, 57, 1986 : 416–432.
3. Lichtenberg, J. Izolovaná perfuze cytostatiky v léčbě zhoubných nádorů končetin. Prakt. Lék., 42, 1962, p. 781–783.
4. Bříza, J., Lichtenberg, J., Teršíp, K., Tošovský, J. Naše zkušenosti s izolovanou regionální hypertermií perfuzí cytostatiky u končetinových nádorů. Rozhl. Chir., 68, 1989, No. 2, p. 113–116.
5. Grunhagen, D., van Etten, B., Brunstein, F., et al. Efficacy of repeat isolated limb perfusion with tumor necrosis factor alpha and melphalan for multiple in-transit metastases in patiens with prior isolated limb perfusion silure. Ann. Surg. Oncol., 12(8): 609–615.
6. Wieberdink, J., et al. Dosimetry in isolation perfusion of the limbs by assesment of perfused tissue volume and grading of toxic tissue reaction. Eur. J. Cancer Clin. Oncol., 1982 : 18 : 905–910.
7. Noorda, E. M., et al. Isolated limb perfusion for unresectable melanoma of the extremities. Arch. Surg., 2004 : 139 : 1237–1242.
8. Overgaard, J., Gonzalez, G. D., et al. European society for hypertermic oncology. Randomised trial for hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. Lancet, 1995 : 345 : 540–543.
9. Eton, O., Legha, S. S., et al. Sequential biochemotherapy versus chemotherapy for metastatic melanoma: results from phase III randomized trial. J. Clin. Oncol., 2002 : 20 : 2045–2052.
10. Keiholz, U., Conradt, C., Legha, S. S., et al. Results of interleukin-2-based treatment in advanced melanoma: a case record-based analysis of 631 patients. J. Clin. Oncol., 1998 : 16 : 2921–2929.
11. Koops, H. S. Is isolated limb perfusion of metastatic malignant melanoma of the extremity worthwhile. Eur. J. Cancer, 1996; 32 : 1633–1640.
12. Krementz, E. T., Carter, R. D., Sutherland, C. M., et al. Regional chemotherapy for melanoma: a 36 year experience. Ann. Surg., 1994; 220 : 520–535.
13. Krementz, E. T., Sutherland, C. M., Muchmore, J. H. Isolated hyperthermia chemotherapy perfusion for limb melanoma. Surg. Clin. North Am., 1996; 76 : 1313–1330.
14. Klasse, J. M., Kroon, B. B. R., van Geel, A. N., et al. Limb recurrence-free interval and survival in patients with recurrent melanoma of the extremities treated with normothermic isolated perfusion. J. Am. Coll. Surg., 1994; 178 : 564–572.
15. Grunhagen, D. J., Brunstein, F., Graveland, W. J., et al. One hundred consecutive isolated limb perfusions with TNF-alpha and melphalan in melanoma patients with multiple in-transit metastases. Ann. Surg., 2004; 240 : 939–948.
16. Creech, D. G., Krementz, E. T., Ryan, R. F., Winblad, J. N. Chemotherapy of cancer: regionalperfusion utilising an extracorporeal circuit. Ann. Surg., 1958; 148 : 616–632.
17. Fraker, D., Alexander, H., Ross, M., et al. A phase III trial of isolated limb perfusion for extremity melanoma comparing melphalan alone versus melphalan plus tumor necrosis factor (TNF) plus interferon gamma [abstract]. Ann. Surg. Oncol., 2002; 9: S8.
18. Rossi, C. R., Foletto, M., Pilati, P., Mocellin, S., Lise, M. Isolated limb perfusion in locally advanced cutaneous melanoma. Semin. Oncol., 2002; 29 : 400–409.
19. Benckhuijsen, C., Kroon, B. B., van Geel, A. N., Wieberdink, J. Regional perfusion treatment with melphalan for melanoma in a limb: an evaluation of drug kinetics. Eur. J. Surg. Oncol., 1988; 14 : 157–163.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
- Ischemická kolitída po operáciách pre AAA
- Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
- Roboticky asistované cévní rekonstrukce aorto-ilické oblasti
- Vliv infrainguinálních bypassů na dlouhodobou průchodnost pánevních intervencí – význam hybridních výkonů
- Žilní interponát při řešení krvácení z distální anastomózy pedálního bypassu
- Peroperační intraarteriální trombolýza v terapii akutní končetinové ischemie
- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Simultánní karotická endarterektomie a koronární revaskularizace: indikace a výsledky
- Jednoduchá metoda odstranění infikované cévní protézy
- Dva mylné mýty flebologické chirurgie 20. století
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



