-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRadikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Radical Operation of Infected Aortofemoral Prosthesis using Fresh Arterial Allograft: Our Mid-term Experience
Introduction:
The mid-term experience with the use of the fresh arterial allografts in the treatment of aortic or aortofemoral prosthetic infection is presented.Material and methods:
Between 2001–2010 24 patients (23 with the infected graft in aortic or aortofemoral position and one with a mycotic aneurysm of the aortic bifurcation) were operated with the use of the fresh arterial allograft. Male/female ratio was 15/9, average age 65.8 (36–81) years. The gastrointestinal comorbidities dominated this cohort. The total of 70 previous vascular operations (1–9; m. 2.9/patient) were performed with the median of 5.8 years between the first and the last procedure. Seven patients had sepsis (29.2%), aortoeneteric fistula occurred in three. Various technical modifications of the aortobifemoral (13), aortounifemoral (8) bypass, aortic and aortoiliac replacement (3) were performed including the sequential distal reconstructions. The arterial allograft was used within 8–48 hours following harvest (the median cold ischemic time of 20 hours) and all patients were given cyclosporine A perioperatively.Results:
In-hospital mortality was 20.8% (5/24), twice caused by postoperative hemorrhage from either the aortic anastomosis or the graft necrosis. The remaining deaths were not related to the allograft itself. Two limbs, preoperatively ischemic, were amputated (8.3%). The median follow-up is 4.6 years (3 m.–8 yrs.). The three-years survival was 68.4% and the known causes of death had no relation to the allograft. The late occlusion of the graft limb occurred twice, stenoses within its course twice and three femoral anastomotic stenoses were disclosed. All were treated either surgically or by PTA/stent and the redo procedures’ rate has thus reached 20.5% in the mid-term follow-up interval. One graft has shown a slight diffuse dilatation since requiring but follow-up.Conclusions:
Under the conditions of the ABO compatibility tolerance and ongoing postimplantation immunosuppression the shortly ischemic arterial graft helds its anatomic structure and function and within the hostile setting of the previous infection represents a valuable alternative of the surgical treatment of the vascular prosthetic infection in the aortofemoral position or of the mycotic aneurysm.Key words:
vascular prosthetic infection – arterial allograft – immunosuppression
Autoři: P. Šebesta; P. Štádler; P. Šedivý; P. Zdráhal; K. El Samman; V. Jindrák *; Martin Syrůček **
Působiště autorů: Oddělení cévní chirurgie, Nemocnice Na Homolce, primář doc. MUDr. P. Štádler, Ph. D. ; Oddělení mikrobiologie, Nemocnice Na Homolce, primář MUDr. V. Jindrák *; Oddělení patologie, Nemocnice Na Homolce, primář MUDr. M. Syrůček **
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 1, s. 4-13.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Autoři předkládají střednědobé zkušenosti pracoviště s použitím čerstvých arteriálních allograftů v řešení infekce cévní protézy v aortální či aortofemorální pozici.Materiál a metodika:
V letech 2001–2010 jsme operovali celkem 24 nemocných (23 s infektem cévní protézy v aortální, resp. aortofemorální pozici a 1x s metastatickou nepravou výdutí bifurkace AA) za použití čerstvého tepenného alloštěpu. Poměr M/Ž byl 15/9, průměrný věk souboru 65,8 (36–81) let. Z přidružených chorob dominovala této sestavě chronická onemocnění GIT. Nemocní prodělali před výkonem celkem 70 cévních operací (1–9; m. 2,9/pac.), medián mezi první a poslední operací byl 5,8 roku. Sedm nemocných bylo v sepsi (29,2 %), 3 měli aortoenterickou píštěl. Proveden 13x aortobifemorální bypass, 8x aortounifemorální bypass a 3x aortální, resp. aortobiiliacká náhrada v rozličných technických modifikacích včetně sekvenčních distálních rekonstrukcí. Tepenný allograft byl použit do 8–48 hodin po odběru (medián studené ischemie 20 hodin) a nemocným již perioperačně nasazen cyklosporin A.Výsledky:
Hospitalizační mortalita byla 20,8 % (5/24), ve dvou případech zapříčiněná pooperačním krvácením z napojení alloštěpu či při jeho nekróze. Další úmrtí nesouvisela přímo s implantátem. Amputovali jsme dvě končetiny (8,3 %), ischemické již před operací. Medián sledování nemocných je 4,6 roku (3 m.–8 r.). Přežití do 3 let bylo 68,4 % a příčiny úmrtí nesouvisely v dohledaných případech se stavem allograftu. K pozdnímu uzávěru raménka došlo 2x, zúžení v průběhu štěpu jsme zaznamenali 2x a stenózy v distálních napojeních 3x. Stav byl vyřešen reoperací či intervenčně a četnost servisních výkonů tak dosáhla 20,5 % ve střednědobém sledování. Jeden allograft je sledován pro mírnou dilataci.Závěr:
Krátce konzervovaný tepenný allograft si, za podmínek respektování ABO kompatibility a trvalé postimplantační imunosupresivní léčby zachovává svou anatomickou strukturu i funkci a v hostilním prostředí předchozího infektu představuje cennou alternativu chirurgické léčby infekce cévní protézy v aortofemorální pozici či mykotického aneuryzmatu.Klíčová slova:
infekce cévní protézy – tepenný allograft – imunosupreseÚVOD
Bakteriální infekce postihující cévní protézy (dále CP) je nejobávanější komplikací jejich použití v cévně-chirurgické praxi. Ačkoli procento klinické manifestace je poměrně nízké, celkový počet nemocných je vzhledem k množství implantátů nezanedbatelný a představuje zásadní odborný a mnohdy i organizační problém. Infikovaná CP v aortální pozici pak svými specifickými komplikacemi (krvácení, sepse, aortoenterická píštěl (dále AEP) ohrožuje nemocného quo ad vitam. Možnosti úspěšného léčení takovéto katastrofy jsou i v dnešní době dosti omezené a žádná ze současných klinických metod nepřináší jednoznačně výhodnější řešení.
V poslední dekádě dáváme na našem pracovišti u těchto nemocných přednost radikální explantaci infikovaného materiálu a anatomické náhradě čerstvým tepenným allograftem (dále TAG) získaným během orgánového odběru z kadaverózního dárce.
MATERIÁL A METODA
Soubor nemocných
Na oddělení cévní chirurgie Nemocnice Na Homolce jsme za bezmála devítileté období (11/2001–6/2010) hospitalizovali a operovali 23 nemocných s infekcí CP v aortální či aortofemorální pozici. Další nemocný prodělal bakteriální destrukci břišní aorty v důsledku metastatického osídlení při akutní endokarditidě. Muži převažovali nad ženami v poměru 15 : 9, průměrný věk souboru byl 65,8 roku (36–81); ženy byly v průměru o 4 roky starší (64,3 vs. 68,4).
Všichni nemocní měli kombinaci několika přidružených chorob (Tab. 1), přičemž u 23 pacientů šlo o komorbidity postihující gastrointestinální a urogenitální systém (95,8 %; Tab. 2). Z rizikových faktorů rozvoje aterosklerózy převažovala hypertenze a kuřáctví, diabetiků bylo pět. Jedenáct nemocných s infekčními fokusy bylo v předchorobí opakovaně vystaveno vysokému riziku bakteriémie a minimálně dva další byli potenciálně imunosuprimováni (Tab. 3).
Tab. 1. Přidružená onemocnění: kardiovaskulární a pulmonální Tab. 1. Associated disorders: cardiovascular and pulmonary 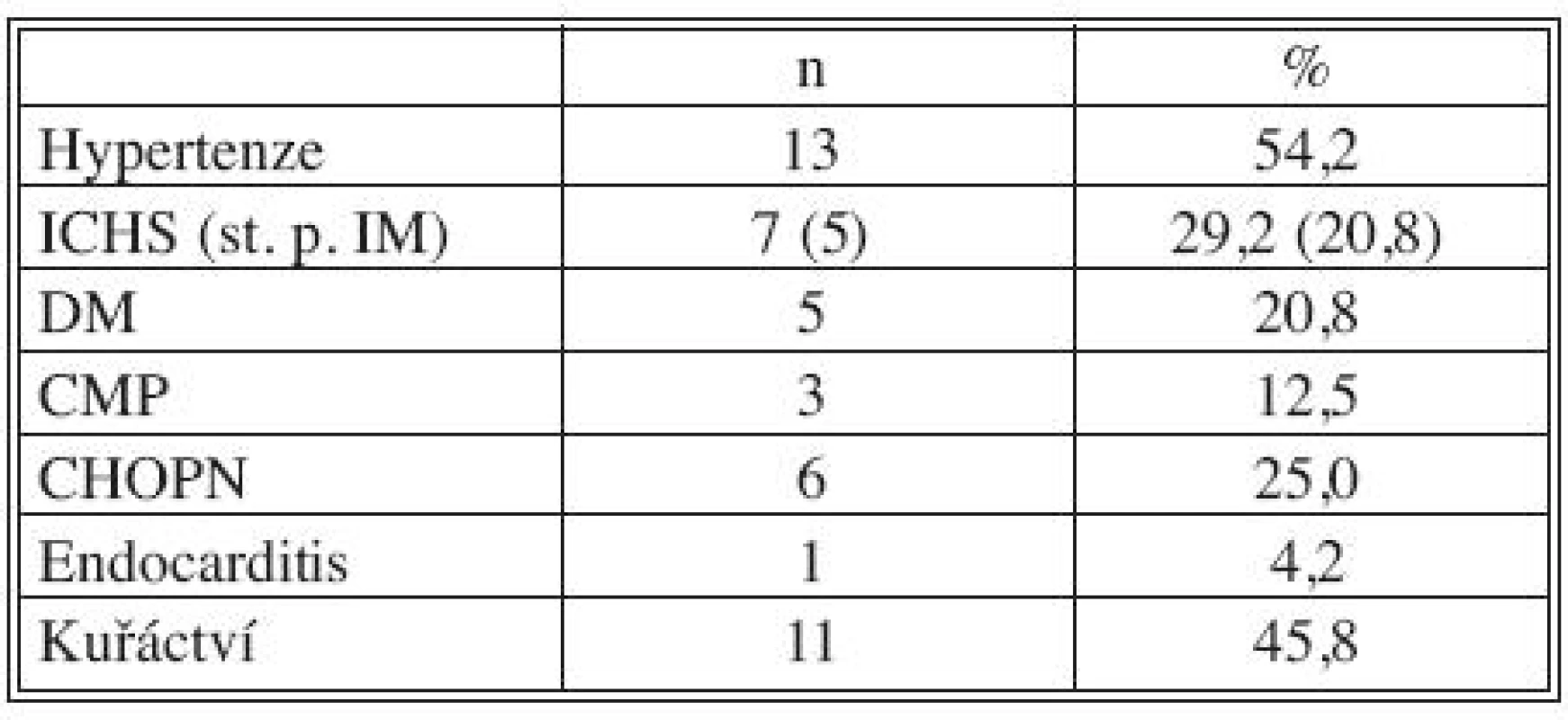
Legenda: ICHS, IM – ischemická choroba srdeční, infarkt myokardu DM – diabetes mellitus CMP – cévní mozková příhoda CHOPN – chronická obstrukční plicní nemoc Tab. 2. Přidružená onemocnění: GIT a urogenitální systém Tab. 2. Associated disorders: GIT and urogenital system 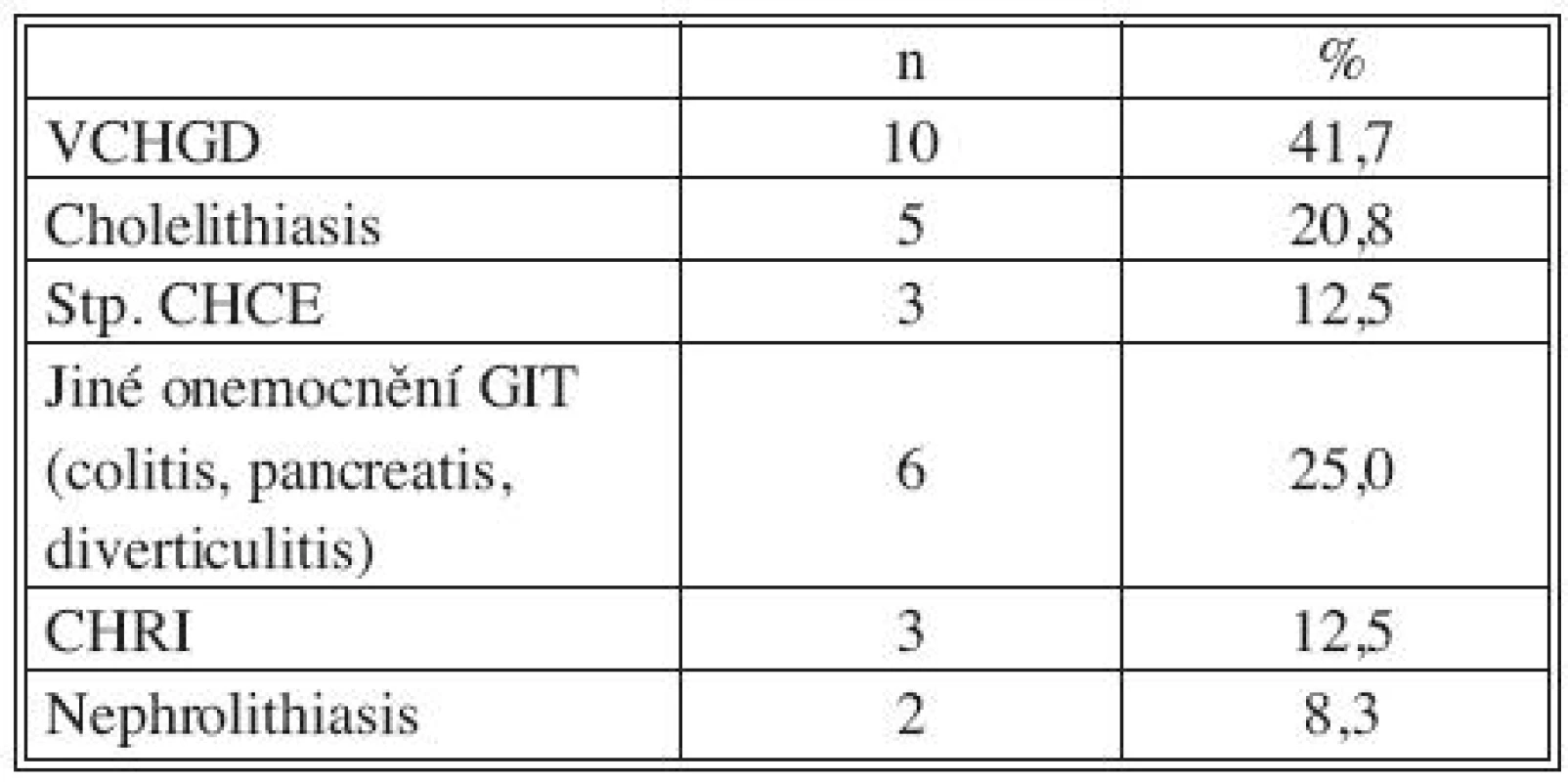
Legenda: VCHGD – vředová choroba gastroduodena CHCE – cholecystektomie GIT – gastrointestinální trakt CHRI – chronická renální insuficience Tab. 3. Přidružená onemocnění: riziko imunosuprese a bakteriemie Tab. 3. Associated disorders: risks of immunosuppression and bacteremia 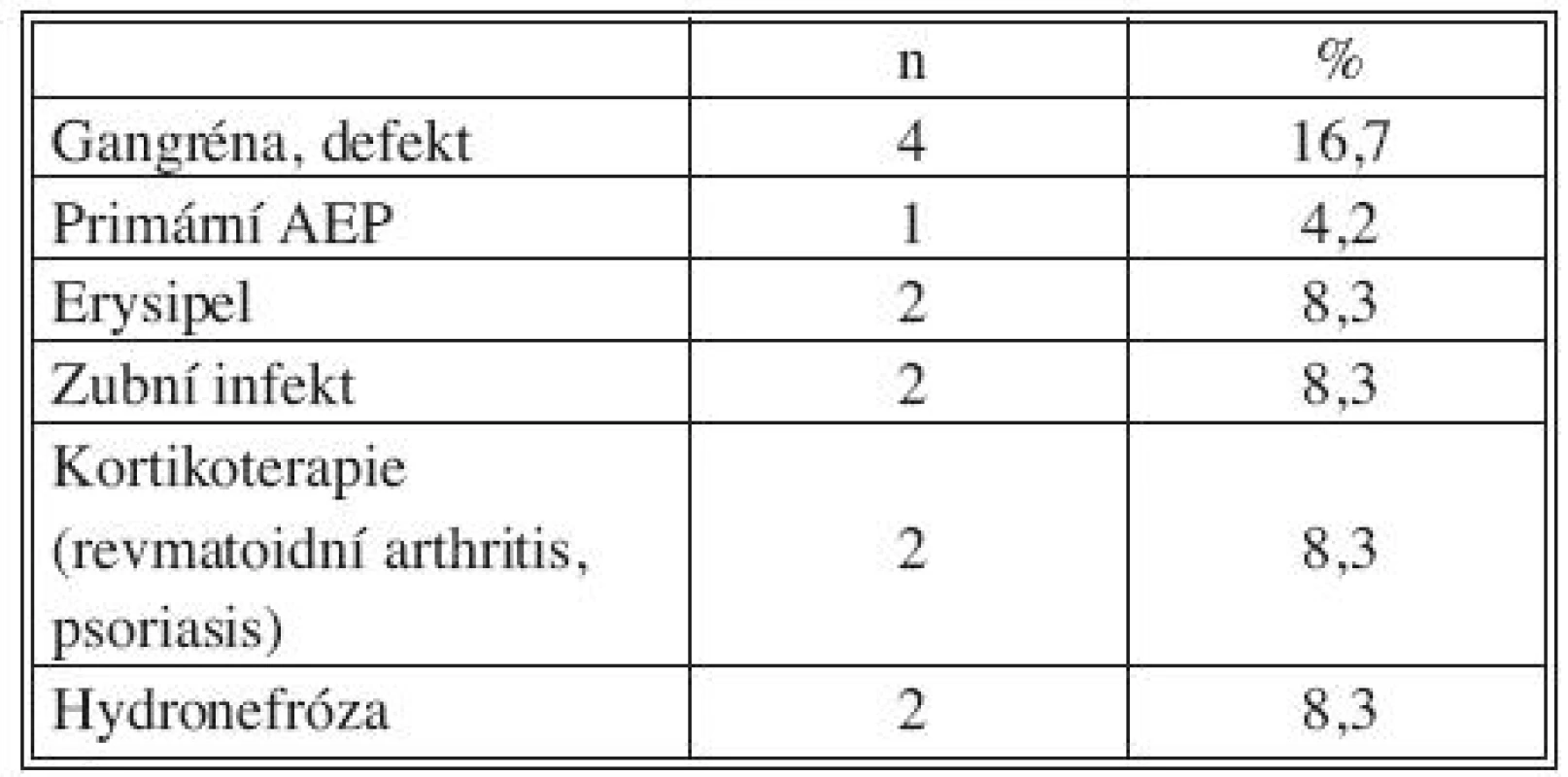
Legenda: AEP – aortoenterická píštěl Předchozí operace
Těchto 24 nemocných prodělalo v období před přijetím celkem 70 cévních operací (průměr 2,9/pacienta, rozmezí 1–9 operací). Primárním výkonem byl nejčastěji aortobifemorální bypass (dále ABF) (14) a jednostranný aortofemorální bypass (dále AUF) (6). Dva nemocní měli náhradu břišní aorty pro aneurysma abdominální aorty (dále AAA). Jedna pacientka byla akutně operována pro primární AEP při ruptuře AAA.
Následným reoperacím vévodily resekce a náhrady nepravých aneuryzmat distálních anastomóz s novou protetickou rekonstrukcí, dále trombektomie, revize s laváží, excize s eventuální myoplastikou a extraanatomické rekonstrukce.
Medián časového intervalu mezi primoimplantací cévní protézy a prvním průkazným projevem její infekce byl 3,2 roku (1–19), časový medián mezi prvotním výkonem a konečnou excizí cévní protézy s implantací TAG čítal průměrně 5,8 roku (1–19).
Příznaky
Celkové příznaky sepse se projevily u 7 nemocných (akutní 2, chronické 5). Tři ze sedmi septických nemocných měli AEP (Obr. 1), jeden infekt protetické náhrady AAA a jeden mykotické aneuryzma bifurkace aorty při bakteriální endokarditidě (Obr. 2). U 22 pacientů jsme zaznamenali celkem 42 ohraničených a často kombinovaných projevů infekce CP. Jejich přehled uvádí tabulka 4.
Obr. 1. Sekundární aortoduodenální píštěl Fig. 1. Secondary aortoduodenal fistula 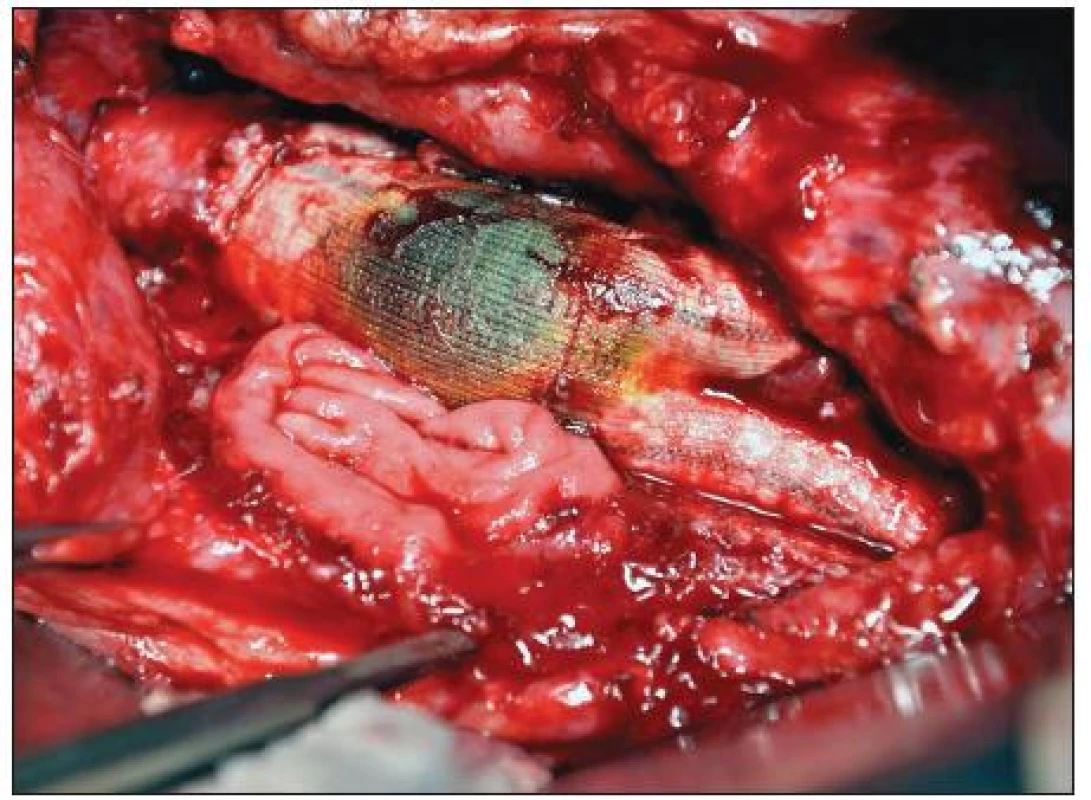
Obr. 2. Mykotické aneuryzma bifurkace aorty s přesahem na a. iliaca comm. l. sin. a s jejím tromboembolickým uzávěrem Fig. 2. Mycotic aneurysm of the aortic bifurcation extending to the left common iliac artery with its thromboembolic occlusion 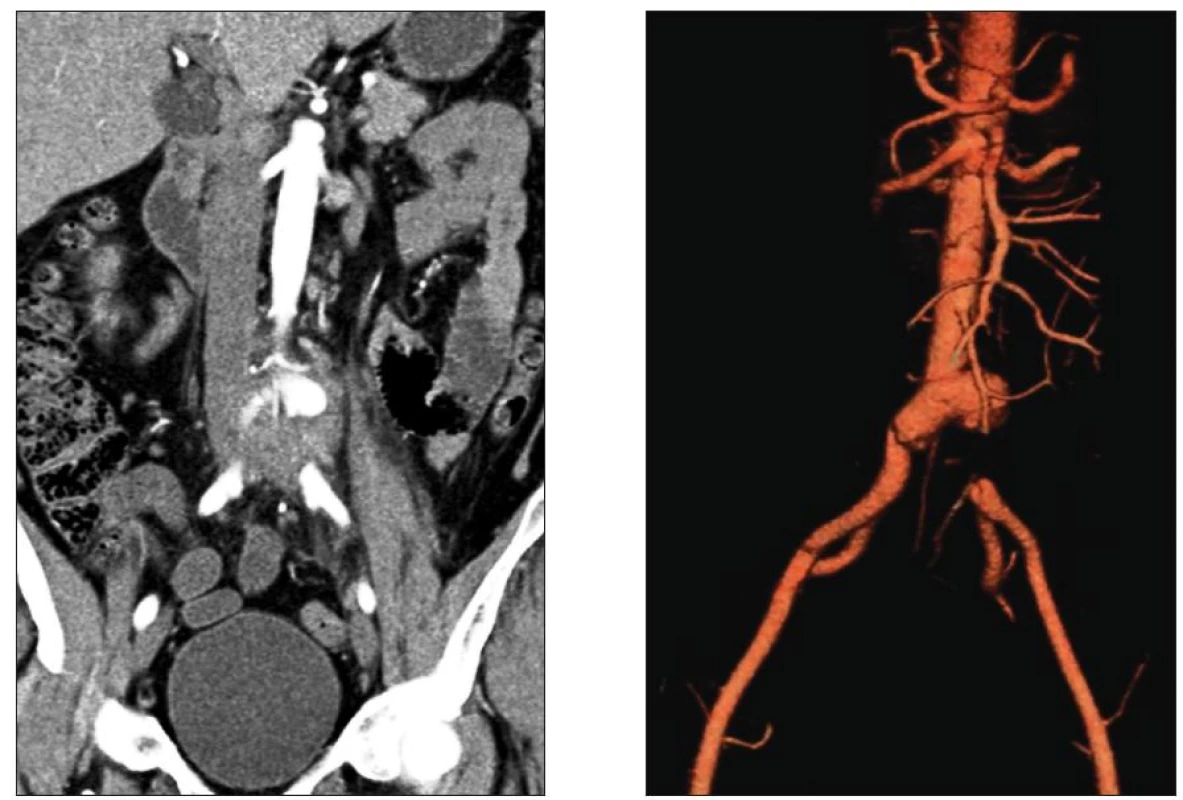
Tab. 4. Lokální septické projevy Tab. 4. Local septic signs 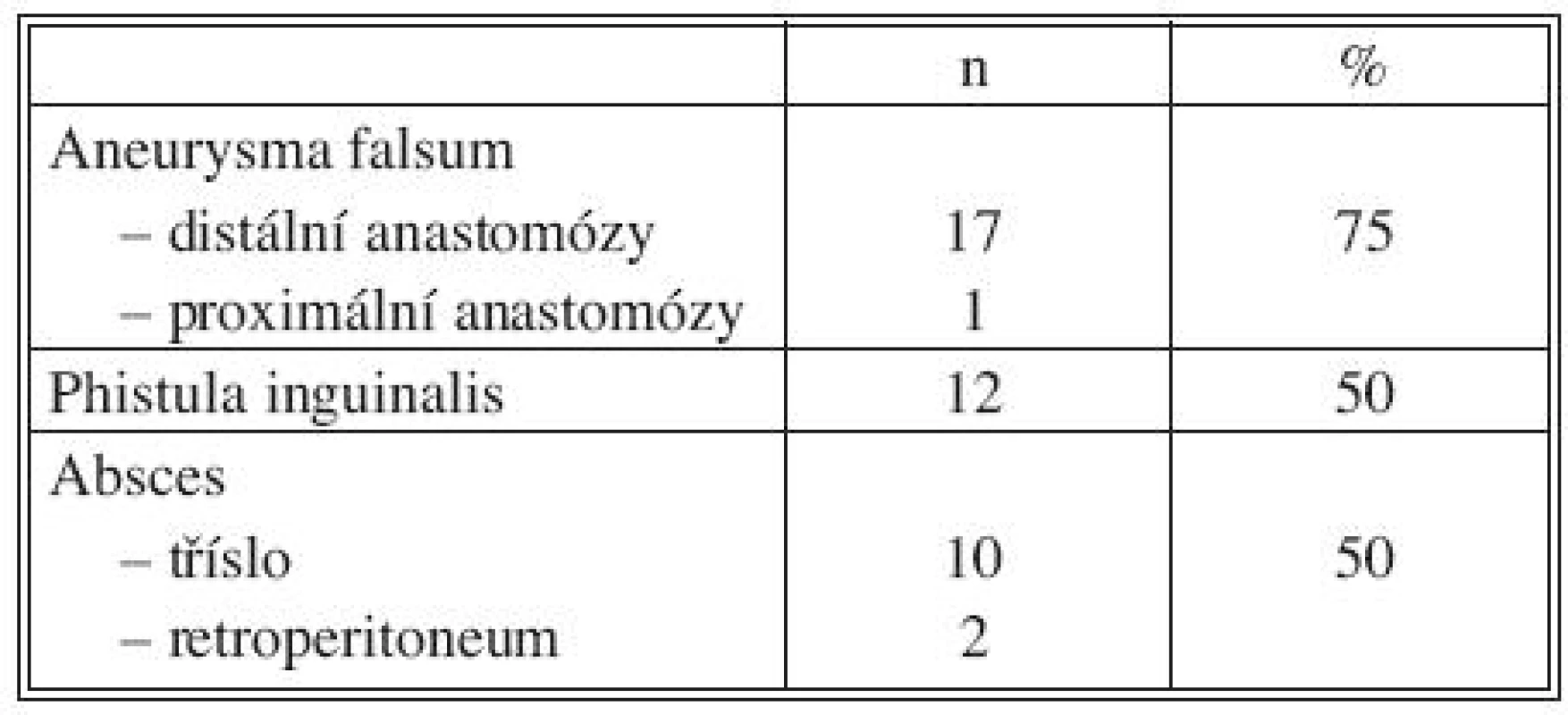
Diagnostika
Klinická diagnóza byla, s ohledem na zjištění rozsahu a lokalizace protetického infektu ověřována zobrazovacími metodami (pozitronová emisní tomografie /PET/, výpočetní tomografie /CT/ a případně kombinací obou). PET/CT provedeno u 17, samotné CT u 6 nemocných (Obr. 3). Fibroskopie horního GIT byla indikována 3x.
Obr. 3. CT vs. FDG-PET/CT obraz infekce oboustranného aortofemorálního bypassu Fig. 3. CT vs. FDG-PET/CT pattern of the infected aortobifemoral bypass graft 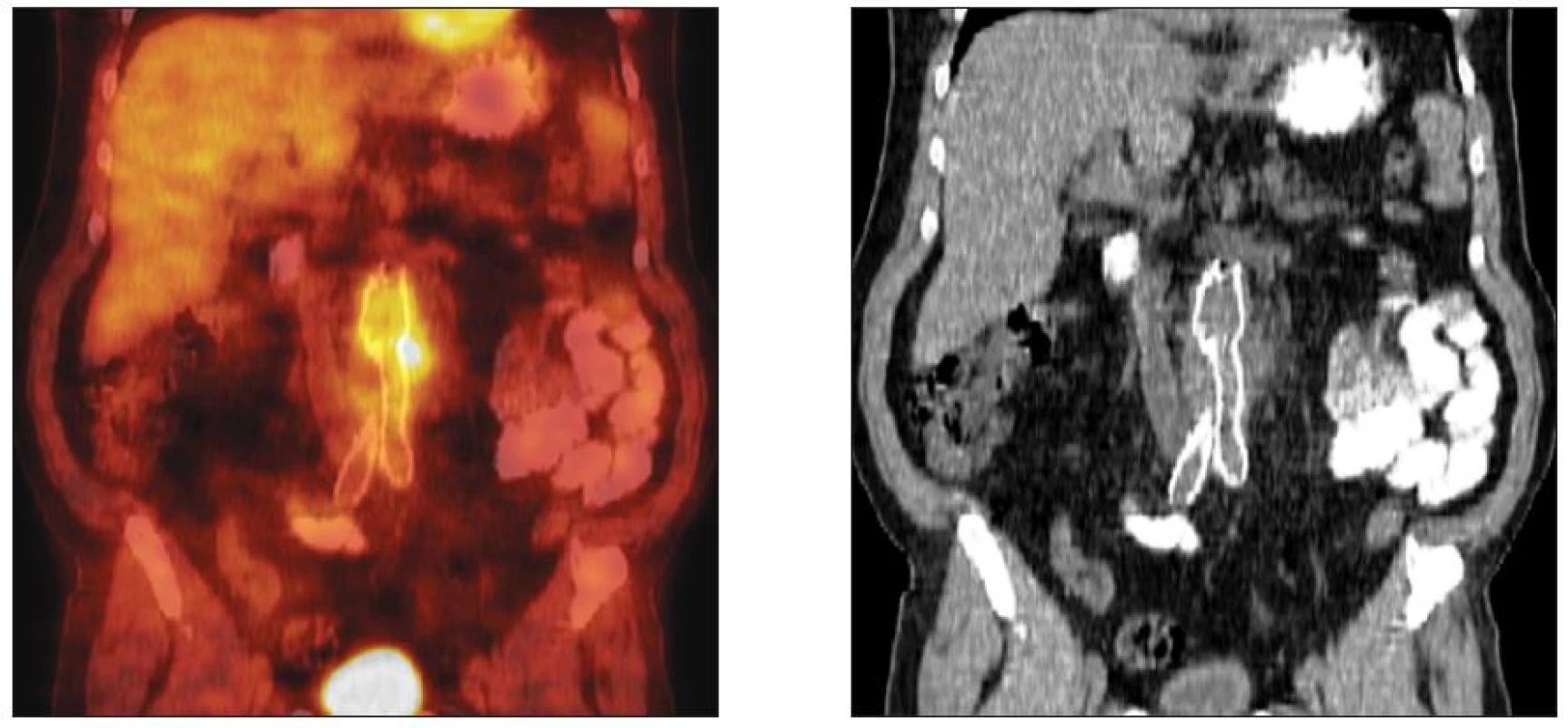
Laboratorní diagnostika spočívala v hodnocení nespecifických biochemických markerů zánětu (FW, leukocytóza, CRP), ale především se opírala o podrobné a opakované vyšetření mikrobiální kultivace (předoperační ranné stěry, hemokultury) včetně diagnostiky genetické.
Převažovaly monokultury (10x), kombinace původců byla zaznamenána 8x a 6x nebyl původce určen.
Mikrobiologické nálezy jsou přehledně uvedeny v tabulce 5.
Tab. 5. Mikrobiologické nálezy, vztah ke klinice a průběhu Tab. 5. Microbiological findings, correlation with clinical condition and the disease course 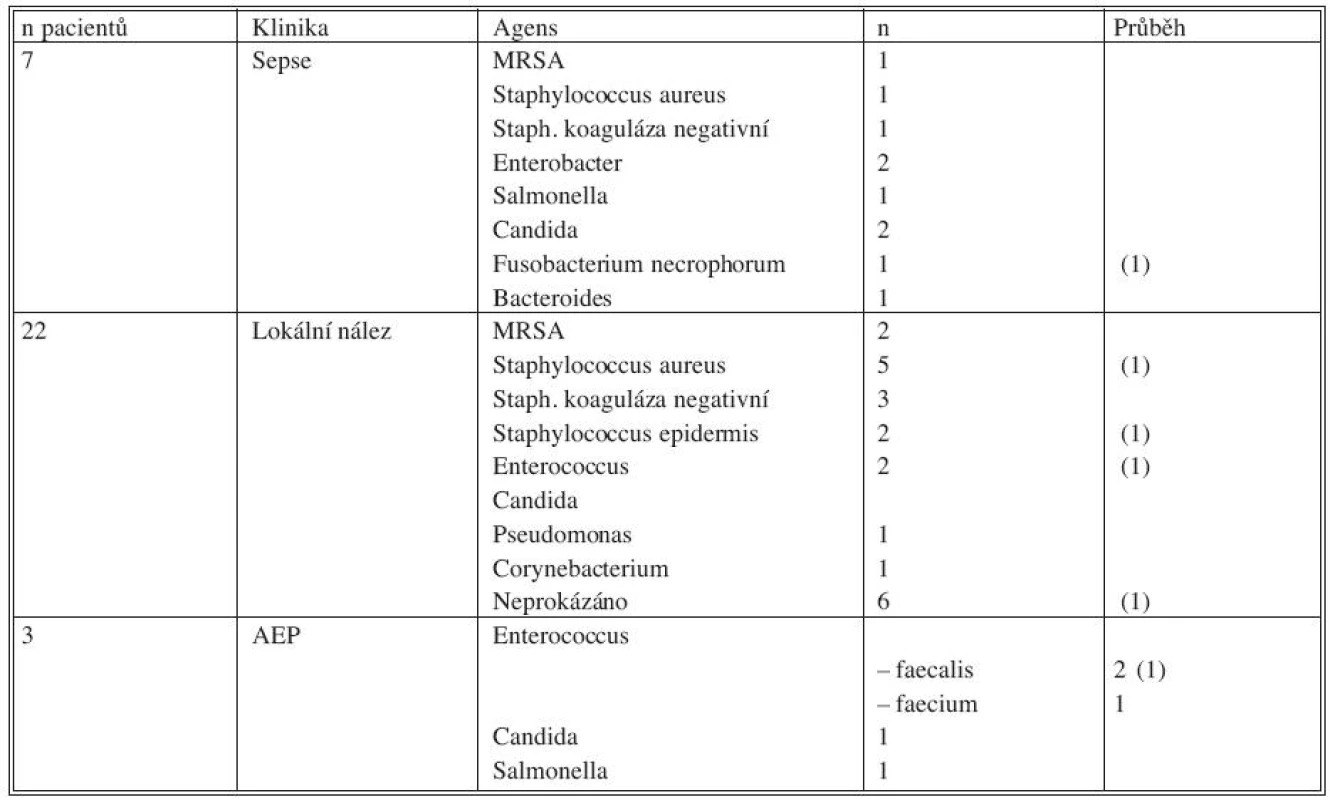
Legenda: (1) – úmrtí během hospitalizace AEP – aortoenterická píštěl MRSA – methicilin resistentní Staphylococcus aureus Indikace a princip operace
Operaci jsme indikovali u nemocných s klinickým či laboratorním průkazem infekce cévní protézy (či aortální stěny) a a) u nemocných zpravidla již vícekrát paliativně a bez trvalého úspěchu operovaných pro takový infekt, b) u nemocných ohrožených na životě septickým stavem a rizikem život ohrožujícího krvácení.
Principem výkonu bylo ve všech případech úplné odstranění infikovaného materiálu (cévní protézy, arteriální infikované stěny) s nezbytným débridement a sanací terénu. Arteriální substituce bylo posléze dosaženo anatomickým uložením čerstvého tepenného allotransplantátu, získaného během (multi)orgánového odběru od kadaverózního dárce.
Alloštěp: výběr, uložení a příprava
Aortoarteriální štěp je odebrán po skončení orgánového odběru pracovníky odběrového týmu a řídí se objednaným požadavkem cévního chirurga. Dodržujeme ABO kompatibilitu. Pro náš soubor jsme použili 22 štěpů zahrnujících subrenální břišní aortu, její bifurkaci a iliakofemorální úseky, ve dvou případech i s femoropopliteálními tepennými segmenty. Dvakrát byl použit štěp z hrudní aorty.
Po odběru a proplachu roztokem UW byla tepna uložena do konzervačního roztoku (Custodiol 1000 ml, gentamycin 240 mg, amfotericin 100 mg) a po dobu studené ischemie skladována při 4 °C. Doba studené ischemie kolísala mezi 8 a 48 hodinami (medián 20 hodin).
TAG je před implantací dvakrát kontrolován: prvně po doručení a následně v úvodu operace, kdy jsou definitivně provedeny potřebné úpravy (excize přebytečné okolní tkáně, ligatury a opichy tepenných větví atd.). Z důvodů snížení rizika pokračující infekce dáváme přednost monofilnímu materiálu.
Předoperační příprava příjemce TAG
Nemocní čekají na dárcovskou tepnu zpravidla delší dobu (viz níže) a tato skutečnost zpravidla umožňuje déledobou přípravu. Septičtí nemocní jsou léčeni a připravováni na jednotce intenzivní či intermediární péče, je zajištěna parenterální a podle možností i enterální nutrice, po opakovaných konsultacích s mikrobiologem zajištěna cílená antibiotická léčba apod. Pacienti s lokálnimi projevy infektu jsou k výkonu připravováni na standardním lůžku a případně čekají v podmínkách domácího či ambulantního ošetřování (v našem souboru 2/24).
Medián časového intervalu mezi požadavkem na TAG a jeho získáním byl v našem souboru 21 dnů (6–64).
Den před výkonem zahajujeme imunosupresivní léčbu cyklosporinem A (Sandimmun Neoral, Novartis ČR) v dávce 50–100 mg/24 h.
V den operace jsme 9x sondovali jeden či oba uretery s ponecháním pigtail katétru.
Operujeme v chráněném koagulu a antibiotika podáváme podle specifické citlivosti, v případě negativních perioperačních stěrů pak podle momentálně platných pravidel profylaktického režimu.
Typy a varianty operací
V našem souboru jsme, po exstirpaci infikovaného protetického materiálu, provedli 13x ABF bypass, 8x AUF bypass a 2x aortoaortální náhradu. U jednoho nemocného jsme nahradili resekovanou aortální bifurkaci aortoiliackým TAG. V jednom případě ABF bypassu byl použit tubulární TAG a druhé raménko vytvořeno z autologní v. saphena magna (VSM). Dvakrát šlo o sekvenční rekonstrukci (po odstranění infikované aortofemorální a femoropopliteální protetické náhrady). Nedostatečně dlouhý bifurkační TAG jsme byli nuceni ve 4 případech nastavovat, ať s použitím větví a. iliaca interna štěpu, spirálně sešité autologní VSM či endarterektomovaného úseku uzavřené a. femoralis superficialis příjemce.
Proximální aortální anastomóza byla našita 16x koncem ke straně (ETS) – 1x na subdiafragmatický úsek aorty – a 8x koncem ke konci (ETE). V případě inkongruence průměrů TAG a aorty příjemce jsme při ETE napojení provedli dilatační plastiku hrdla transplantátu ve vlastní modifikaci (Obr. 4).
Obr. 4. Dilatační plastika hrdla TAG s pomocí synarterializace odstupů společných pánevních tepen a nastřižením společného ústí Fig. 4. Dilating arterioplasty of the TAG using synarterialization of the common iliac arteries and partial incision of the common trunk 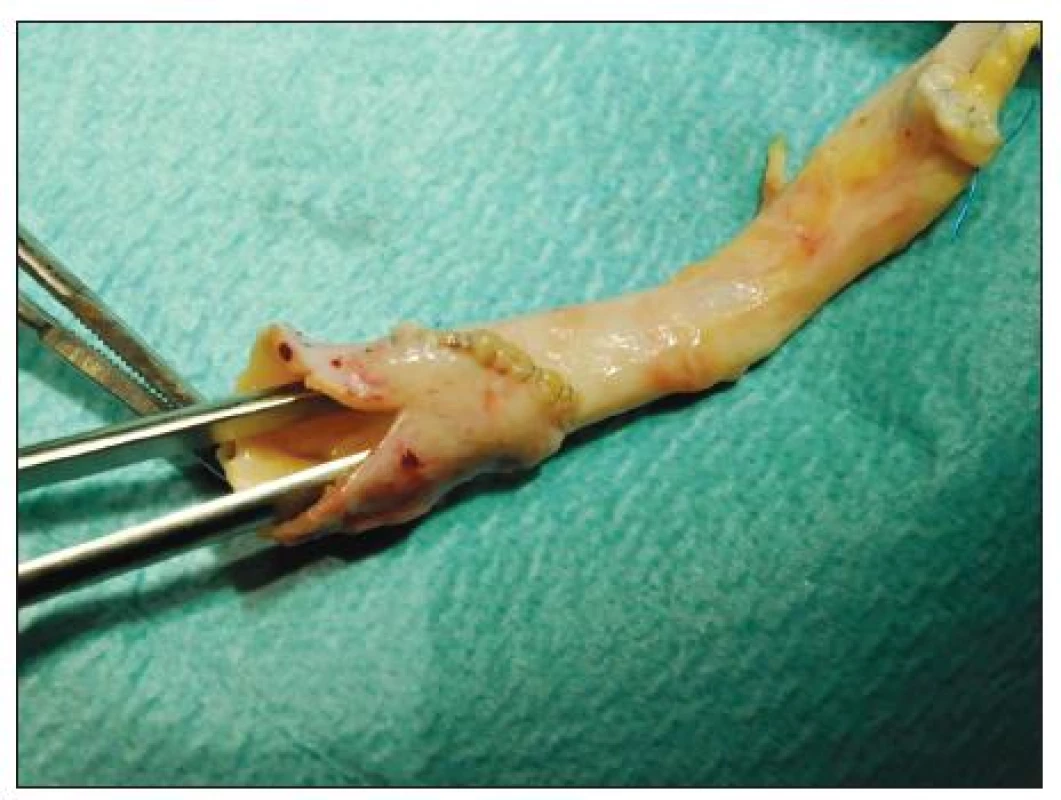
Distálních anastomóz bylo celkem 40 (34x a. femoralis, 2x bifurkace aorty, 2x a. iliaca communis, 2x a. poplitea), v běžných technických variantách cévního spojení. Jedenkrát jsme rekonstruovali pravou podpažní tepnu po odstranění axilofemorálního bypassu pomocí záplaty z TAG.
U tří nemocných s enterální píštělí byla komunikace zvyklým způsobem uzavřena.
Technické poznámky
Operační přístup je, v našem souboru s jedinou výjimkou, transperitoneální, střední laparotomií. Prvotním cílem je zajištění aorty nad původní centrální anastomózou, teprve pak přistupujeme k preparaci infikovaného implantátu, pravidelně uloženého v zánětlivém plastronu. Současně exponujeme distální napojení a přilehlé tepenné úseky. Vyhýbáme se zbytečné disekci a bereme v úvahu možnost endoluminální tepenné okluze. Po podání heparinu a naložení aortální svorky excidujeme CP, původní šicí materiál i okolní nekrotickou a granulační tkáň a materiál odesíláme k mikrobiologické analýze. Zpětné krvácení často kontrolujeme Foleyovou cévkou či Fogartyho katetrem. Z důvodů operace v infekčním terénu nepoužíváme rekuperační odsávání. V případě aortoenterické/duodenální/ píštěle mobilizujeme v nezbytném rozsahu střevo a komunikaci zavíráme jedno - či dvouvrstevnou technikou. Provádíme débridement a výplach kanálu ramének původní protézy. Před našitím TAG dostává nemocný další dávku imunosupresiva. Upravený TAG zpravidla obracíme dorzální stranou ventrálně (kontrola případného krvácení z ústí lumbálních tepen) a po našití proximálního napojení štěp zvolna plníme tepennou krví. Před protažením ramének preformovanými kanály důsledně kontrolujeme a ošetřujeme případné zdroje krvácení. V případě bifurkačního TAG zahajujeme průtok štěpem po našití prvního distálního napojení, abychom zkrátili čas aortální svorky. Po skončení rekonstruční fáze tepenné operace kontrolujeme všechny anastomózy, stav a průběh štěpu a podáváme protamin. V případě omezené možnosti krytí TAG v reoperovaném retroperitoneu připravujeme lalok předstěry a štěp kryjeme omentoplastikou (v našem souboru 6x; vždy v případě AEP; Obr. 5), podle mikrobiálního nálezu někdy do lože TAG ukládáme plátky gentamycinové pěny (Garamycin, EUSA Pharma, UK). Po kontrole stavu prokrvení střeva a repozici útrob usazujeme transpyloricky jejunální sondu a výkon končíme standardním uzávěrem operační rány. V případě distálních anastomóz v tříslech ukládáme podél ramének TAG sací drény a ponecháváme zpravidla 48 hodin.
Obr. 5. TAG in situ; překryt omentoplastikou Fig. 5. TAG in situ; covered by omentoplasty 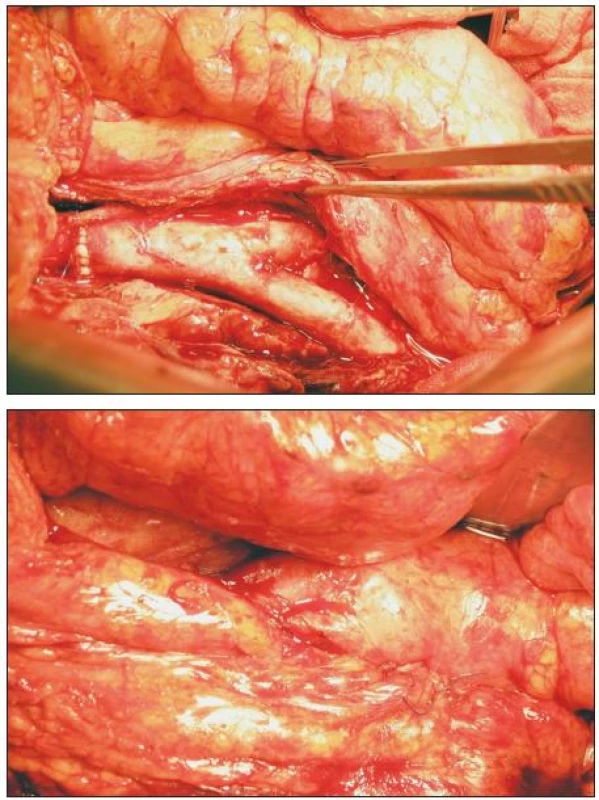
Pooperační ošetřování
Všichni operovaní byli po výkonu ošetřováni na oddílenské jednotce intenzivní péče. Způsob ošetřování se zásadně nelišil od algoritmu běžného pro léčbu a sledování nemocných po aortálních operacích, s výjimkou pokračující imunosupresivní a cílené antibiotické terapie (zpravidla v trvání 4–6 týdnů).
Nemocní dostávají standardně antiagregancia v běžné dávce, jeden nemocný byl warfarinizován.
Pooperační sledování
Nemocné ambulantně kontrolujeme 6 týdnů, 3, 6 a 12 měsíců po výkonu a dále většinou v ročních intervalech. Klinické vyšetření doplňujeme sonografickými, případně CT-angiografickými vyšetřeními cílenými na stav TAG a rekonstruovaného řečiště. Kontrolujeme biochemické parametry včetně hodnot sérových hladin cyklosporinu A (50–150 mg/l). Medián sledování pacientů souboru je 4,6 roku (3 měsíce – 8 let).
VÝSLEDKY
A/ Morbidita
1. Peroperační komplikace
Při reoperaci v nepřehledném terénu jsme dvakrát poranili ureter, jednou ileální kličku. Zranění byla včas rozpoznána a ošetřena, bez nepříznivého dopadu na další průběh. Jednou poranil chirurg duodenum a následná dehiscence sutury byla pravděpodobně v přímé souvislosti se vznikem pozdějšího fatálního krvácení (viz níže). Jeden nemocný byl během výkonu úspěšně kardiopulmonálně resuscitován.
Výkon trval v průměru 4,30 hod. (3–6,30), příčná svorka na aortě 55 minut (45–110).
Průměrná krevní ztráta byla 2750 ml (1000–6500).
2. Časné pooperační komplikace (do 30 dnů)
a) celkové
Z chirurgických komplikací jsme zaznamenali dvě fatální krvácivé příhody. U dalšího nemocného se rozvinula gangréna colon, ošetřená pátý den Hartmannovou operací. Jeden nemocný prodělal ataku akutní cholangoitidy a u jiného byla provedena epicystostomie pro chronickou močovou retenci. Kardiopulmonální komplikace provázely výkon u 4 nemocných: jeden nemocný prodělal akutní netransmurální perioperační IM, druhý pacient podlehl 13. den srdečnímu selhání. U tří pacientů se objevily přechodné poruchy rytmu typu tachyarytmií a byly vyřešeny medikamentózní verzí. Dva pacienti prodělali pooperační zánět plic. Přechodné zhoršení renálních funkcí jsme zaznamenali ve třech případech a 1x nevratné v rámci syndromu multiorgánového selhání.
Třetina operovaných (8 nemocných) trpěla v časném pooperačním období epizodami psychomotorického neklidu, zmatenosti až amence.
b) místní
U jednoho nemocného došlo 15. den po výkonu k uzávěru raménka TAG a stav byl úspěšně vyřešen trombektomií. U dalšího pacienta jsme první pooperační den provedli embolektomii bércového tepenného řečiště. Oba nemocní se zhojili. U dalšího pacienta se uzavřela sekvenční aortofemoropopliteální rekonstrukce dvěma TAG při nově vzniklém uzávěru břišní aorty (Lericheův syndrom) a stav si vynutil vysokou amputaci.
Časně jsme amputovali 2x, jednou ve výše uvedeném případě, podruhé v přednoží pro chronickou gangrénu při průchodném štěpu.
3. Pozdní pooperační komplikace (nad 30 dnů)
a) celkové
Nemocný s cholangoitidou podstoupil biliární drenáž. Další nemocný byl dva měsíce po výkonu cholecystektomován pro litiázu a empyém. Jiná nemocná prodělala rok po výkonu nefrektomii pro opakovanou hematurii při AV malformaci a neúspěšných endovaskulárních pokusech o její embolizaci. Jeden pacient prodělal ileofemorální flebotrombózu a byl následně warfarinizován s dobrým výsledkem. U dvou nemocných vznikla do jednoho roku incizionální herniace (1x po střední laparotomii, 1x po lumbotomii z urologické indikace).
Nemocný po perioperačním IM prodělal 5 let po operaci chirurgickou revaskularizaci myokardu.
b) místní
K pozdnímu uzávěru raménka bifurkačního TAG došlo 2x (po 6 měsících a 5 letech). V prvém případě si stav končetiny vynutil amputaci ve stehně, v případě druhém byl uzávěr úspěšně vyřešen protetickým zkříženým („crossover“) bypassem. Obdobně jsme ošetřili i obliteraci druhostranného nativního pánevního řečiště 2 roky po jednostranném AUF bypassu alloštěpem.
Stenózy ve femorálních napojeních jsme zaznamenali 3x (po 9 a 21 měsíci) a stav vyřešili reoperací (autologní žilní plastikou či synarterializací). Zúžení v průběhu TAG bylo prokázáno ve dvou případech (po 4 a 14 měsících ) a ošetřeno endovaskulárně implantací stentu.
Jednoho nemocného sledujeme pro mírnou dilataci TAG diagnostikovanou rok po implantaci.
Celkem, ať časně či odloženě, jsme provedli dvě vysoké amputace (8,3 %), přičemž v obou případech šlo o kriticky ischemické končetiny již před cévní operací.
Započítáme-li větvené a sekvenční TAG jako párové transplantáty, získáme celkový počet 39 alloštěpů. Uzávěr štěpu (ať časný či pozdní) se vyskytl 5x (5/39 = 12,8 %), stenózy 4x (4/39 = 10,3 %) a dilatace náhrady 1x (1/39 = 2,6 %). Souhrnný výskyt komplikací přímo vázaných na implantovaný TAG je tedy 10/39 (= 25,6 %), resp. 8/39 (= 20,5 %) odečteme-li reoperace dvou stenóz ve femorálních anastomózách, které nebyly podmíněny pouze patologickými změnami v TAG.
B/ Mortalita
1. Časná
Z 24 nemocných jsme ztratili 5 (hospitalizační/30denní mortalita 20,83 %).
Dva operovaní vykrváceli; jeden nemocný při operační revizi 3. den po výkonu pro infekt původní protetické náhrady AAA v gramnegativní sepsi, druhý po revizi 10. den pro peritonitidu a hematemézu vzniklou dehiscencí sutury duodena. V obou případech byl TAG částečně autolyzován a aortální anastomóza rozrušena. Další nemocný podlehl progredujícímu srdečnímu selhání 13. pooperační den. Dva týdny po výkonu (a 9. den po Hartmannově operaci) zemřel čtvrtý pacient pod obrazem sepse. Pátého nemocného jsme ztratili 20. pooperační den na následky multiorgánového selhání.
2. Pozdní
Z 19 přeživších nemocných zemřelo do tří let po výkonu 6 (střednědobé přežití 68,42 %). Příčiny smrti známe ve 4 případech, u 2 se nám je nepodařilo dohledat. Ve známých případech však causa mortis zjevně nesouvisela se stavem implantovaného TAG.
Příčiny smrti jsou přehledně uvedeny v tabulce 6.
Tab. 6a. Causae mortis: časné Tab. 6a. Causae mortis: early 
Legenda: MOS – multiorgánové selhání Tab. 6b. Causae mortis: pozdní Tab. 6b. Causae mortis: late 
Legenda: IM – infarkt myokardu TEN – tromboembolická nemoc DISKUSE
Rekonstrukční aortální operace za použití CP jsou zatíženy poměrně stabilním procentem infekce implantátu, kolísajícím mezi 1–2 % [1]. Toto riziko nelze z více důvodů zcela eliminovat. Nemocní bývají multimorbidní a jejich celkový stav spolu s místními projevy pokročilé ischemie (defekty kožního krytu, gangrény) podmiňuje snížené možnosti jejich imunitní odpovědi. Při operaci – a zejména při disekci ve Scarpově trojúhelníku – dochází k expozici potenciálně infikovaných mízních cest. Hlavní fyzikální charakteristikou CP je porozita a schopnost přijímat krevní a pojivové elementy a vhojit se do okolní tkáně jako jakási pevná osnova nově vznikajícího tepenného konduitu. Takový materiál je ideální osnovou i pro mikrobiální osídlení.
Nejde-li o extrémně virulentní kmeny a masivní peroperační akvizici, která je patrně výjimečná, infekt CP se klinicky projeví až s odstupem měsíců či spíše let. Příznaky a nálezy jsou častěji lokální a v případě aortofemorálních rekonstrukcí obvykle začínají rannými projevy právě v oblasti někdejších tříselných expozic a distálních anastomóz na femorální tepny. Objevuje se infiltrát, zarudnutí, nepravé anastomotické aneuryzma, případně se provalí píštěl. Celkové příznaky (neprospívání, „malaise“, subfebrilie, případně až obraz sepse) bývají známkou již pokročilého infektu postihujícího celý implantát a svědčí buď o virulentní infekci nebo, přidruží-li se případně i projevy krvácení do GIT, o možnosti komunikace CP se střevem (AEP). Analýza diagnostických zobrazovacích a laboratorních metod není předmětem tohoto sdělení a zabývali jsme se jimi jinde [2].
Sami jsme nezaznamenali zřetelný souběh mezi bakteriální virulencí a pooperačním průběhem: septičtí nemocní měli ovšem horší prognózu. Překvapením pro nás bylo vysoké procento GIT komorbidit v sestavě; jsme si však vědomi, že retrospektivní analýza poměrně malého souboru neumožňuje z této skutečnosti vyvozovat žádné validní závěry.
Z výše řečeného je zjevné, že infekt CP implantované do aortální, resp. aortofemorální pozice představuje pro nemocného vysoké riziko. V počátečních stadiích infekce je sice možné uspět s parciální resekcí např. distálního úseku raménka protézy, ale toto řešení vede jen zřídka k trvalejšímu úspěchu. Pokud je nemocného celkový stav únosný, pouze radikální odstranění celé náhrady může situaci definitivně vyřešit. Mortalita takového výkonu je ovšem poměrně vysoká a uvádí se mezi 15–60 % [3].
U protetických bypassů na dolních končetinách je infekt CP často provázen chronickým uzávěrem náhrady a odstranění implantátu nemusí být nutně provázeno novou rekonstrukcí přítoku. U vysokoprůtočných náhrad aortofemorálního úseku je současná okluze vzácnější a cévní chirurg je tudíž nucen nalézt, po odstranění infikované CP, způsob rekonstrukce arteriální perfuze jedné či obou dolních končetin a pánve.
Možnosti jsou následující:
- a) Odstranění CP a rekonstrukce původního arteriálního řečiště (endarterektomie, uzávěr s použitím autologní žilní záplaty apod.) bez použití nového protetického materiálu. Tento způsob je vděčnou, ale většinou teoretickou variantou vzhledem ke stupni a rozsahu sklerotických změn dlouhodobě přemostěných původních tepen. Je použitelný u chybně indikovaných operací, přemosťujících např. izolovaná zúžení pánevních tepen, kde lze výjimečně postupovat i endovaskulárně,
-
b) Odstranění CP, subrenální uzávěr aortálního
pahýlu a extraanatomická nová protetická rekonstrukce, tj. axillobifemorální bypass. Metoda sdružuje nevýhody
extraanatomického bypassu s rizikem reinfektu, amputace
a vykrvácení z dehiscence aortální sutury [1, 4].
Přesto je považována za metodu volby u nemocných s prokázanou AEP, - c) Odstranění CP, débridement lože protézy a nový protetický bypass s použitím protézy s tzv. antimikrobiální úpravou (sole stříbra, antibiotika). Jde o neradikální řešení s možným krátkodobým, ale sporným dlouhodobým úspěchem, rezervovaným pro případy infektu s nejnižší či spornou virulencí [5],
- d) Odstranění CP a rekonstrukce pomocí cévních implantátů pacientu vlastních. VSM bývá použitelná jen výjimečně, při chronickém uzávěru povrchní stehenní tepny lze uvažovat o jejím odběru a desobliteraci. Častější je odběr vena femoralis superficialis, většinou oboustranný. Metoda ovšem prodlužuje výkon, štěp je tenkostěnný a neelastický a chronická žilní nedostatečnost není po výkonu vzácností. Příznivé zkušenosti s operací v naší literatuře referuje Staffa [6],
- e) Odstranění CP a rekonstrukce arteriálním kadaverosním štěpem, ať čerstvým nebo kryoprezervovaným.
O metodě pojednává i naše sdělení a další diskuse bude omezena na tuto problematiku.
Chirurgická historie použití tepenných allograftů se odvíjí po typické sinusoidě: po experimentálních a klinických počátcích přichází, s érou nástupu cévních protéz, útlum [7]. S potřebou řešení mj. infekčních komplikací protetických implantátů a s rozvojem orgánových transplantací stoupá i křivka zájmu o biologické tepenné náhrady pro jejich relativní antimikrobiální odolnost a anatomickou kompatibilitu s rekonstruovaným řečištěm. Tyto předpoklady byly v klinice opakovaně potvrzeny, včetně našich iniciálních zkušeností [8].
Z praktického hlediska chce chirurg znát odpověď na tři základní otázky:
- a) Jsou klinické výsledky těchto operací v současné době přijatelné?
- b) Pakliže ano, mám použít čerstvý či kryoprezervovaný štěp?
- c) Je nezbytné zatížit nemocného imunosupresivní léčbou?
Ad a) Výchozí nepříznivá situace infektu CP v aortální pozici zpravidla vyžaduje operační léčbu i za cenu vysokého procedurálního rizika. Užití allograftu zkracuje čas výkonu a snižuje operační trauma a ve srovnání s extraanatomickým řešením má nižší riziko vykrvácení, uzávěru rekonstrukce a amputace [9]. Na rezistenci TAG vůči infekci lze nicméně spoléhat pouze u méně virulentních kmenů; v případě kontaminace operačního pole střevním obsahem není TAG doporučován [10]. Sami jsme ze tří nemocných s AEP ztratili jednoho, ale bez projevů destrukce tepenného štěpu. Ta se objevila ve dvou jiných případech, 1x s poraněním duodena a 1x při sepsi s neobvyklým původcem (Fusobacterium necrophorum, Bacteroides).
Tři nemocní s MRSA infektem CP se zhojili. Naše perioperační mortalita je shodná s výsledky největší publikované sestavy (NNH 20,8 %, Pitié-SalpetriŹre 20,1 % [10]). Čtyři významné klinické zprávy z posledních tří let zahrnující použití kryoprezervovaných TAG celkem u 96 nemocných s infekcí aortální CP včetně AEP a mykotických aneurysmat uvádějí mortalitu 0–21 %; v jednom případě postup doporučují za metodu volby [11, 12, 13, 14].
Ad b) Vzhledem k omezenému počtu dárců a jejich nahodilému výskytu na jedné straně a vysoké poptávce po TAG na straně druhé je v našich podmínkách dostupnější čerstvý štěp. Čerstvý TAG je i více „user-friendly“ a podrží si fyzikální vlastnosti nativní arterie [15]. Nevýhodou ve srovnání s kryoprezervovanou tepnou je vyšší riziko virového přenosu, vyšší imunologická nálož a snad i nižší protiinfekční odolnost [16, 17]. Poslední tvrzení zpochybnili Saito et al. a Camiade et al., kteří v experimentu s čerstvým TAG prokázali relativní antibakteriální rezistenci štěpu vůči stafylokokům včetně MRSA; prvně jmenovaní popsali její biochemický mechanismus [18, 19]. Převažující klinická preference konzervovaného TAG je podepřena rozsáhlým souborem179 nemocných Kieffera et al., kteří pozorovali rupturu štěpu po náhradě infikovaných aortálních náhrad pouze u čerstvých TAG [10]. Zkušenost ostatních nebyla vždy shodná [20, 21]. V italské Collaborative Vascular Homograft Group nenalezli rozdíl mezi čerstvými a kryoprezervovanými TAG ve smyslu na štěp vázané mortality či četnosti uzávěrů [22]. Ovlivnění imunogenicity TAG kryoprezervací je rovněž diskutabilní [23, 24, 25]. Pracovníci IKEM opakovaně referují příznivé zkušenosti s čerstvými i kryoprezervovanými TAG [15, 26]. Spolehlivé srovnání většiny literárních údajů však znemožňují rozdíly v metodách konzervace štěpů [27].
Ad c) Medicína založená na důkazech nedává ani na tuto otázku jednoznačnou odpověď. Čerstvý TAG není neživá stromální kostra a má silný imunogenetický potenciál vázaný zejména na antigeny endotelií a buněk hladkého svalu [9, 28]. Pozdní degenerace TAG je podmíněná především komplexní imunologickou odpovědí a moderní imunosupresiva mohou tyto procesy příznivě ovlivnit [15, 26]. Vysazení imunosupresiva vyústí v destrukci intimy [29]. Selhání distálních končetinových bypassů provedených pomocí TAG bývají spojena s absencí imunosupresivní léčby či ignorováním základních histokompatibilních charakteristik [30, 31]. Prager et al. udávají dobré výsledky při použití čerstvých TAG při opačném přístupu [9]. Tepny svalového typu jsou více imunogenní ve srovnání s elastickými [10] a aortální TAG jsou v tomto ohledu snad zvýhodněny. Nutnost přistoupit k příjemci čerstvého i kryoprezervovaného TAG jako k příjemci jiného parenchymatózního transplantátu potvrzují i další literární údaje [32, 33]. Nemocný po proběhlé orgánové transplantaci – a tudíž důsledně imunosuprimovaný – je v tomto ohledu i optimálním příjemcem alloarteriálního štěpu, jak jsme se sami přesvědčili [34].
Na výše položené otázky neumíme jednoznačně odpovědět. Domníváme se však, že:
- Určitá diskriminace čerstvých TAG může souviset s nesprávným zacházením. Včasné použití TAG (za námi propagovaných pravidel do 48–72 hodin běžného hypotermního skladování) zachová tepennou strukturu (Obr. 6a). Tato klinická zkušenost je podepřena experimentem [35].
- TAG si svou biologickou aktivitu udržuje dlouho a měl by být považován za pravý transplantát spíše než za mechanickou tkáňovou náhradu. Základní imunogenetická shoda mezi dárcem a příjemcem je důležitým předpokladem úspěchu tepenné transplantace.
- Trvalá imunosupresivní léčba má příznivý vliv na dlouhodobé přežití TAG a na prevenci těžkých degenerativních změn transplantátu, jak ukázala i naše zkušenost (Obr. 6b).
Obr. 6a. Čerstvý TAG před implantací. Fyziologická struktura stěny tepny (hematoxylin-eosin, 200x) Fig. 6a. Fresh TAG before implantation. Physiological structure of the arterial wall (hematoxylin-eosin, 200x) 
Obr. 6b. TAG 5 let po implantaci. Výrazná intimální fibróza se zachováním svalových vrstev. Obrovskobuněčný granulom kolem cizorodého materiálu (hematoxylin-eosin, 100x) Fig. 6b. TAG 5 years following implantation. Significant intimal fibrosis with preservation of the muscular layers. Giantcell granuloma surrounding foreign material (hematoxylin-eosin, 100x) 
Souhrnně řečeno, vnímání TAG jako každého jiného parenchymatózního orgánu určeného k transplantaci může podle našeho názoru a zkušenosti zlepšit déledobé výsledky operací.
ZÁVĚR
Za definovaných podmínek může použití TAG znamenat cennou variantu řešení svízelného klinického problému a infekce cévní protézy v aortofemorální pozici takovou situaci určitě představuje. Nepotvrdili jsme přímou korelaci mezi závažností bakteriologické situace a osudem allograftu a tepenné štěpy většinou obstály i v podmínkách virulentní infekce. Výsledek léčby byl spíše ovlivněn celkovým stavem nemocných před výkonem než konkrétním mikrobiálním původcem. Naše poměrně příznivé střednědobé zkušenosti s užitím čerstvých tepenných alloštěpů a výsledky srovnatelné se zkušenostmi autorů preferujících kryoprezervované transplantáty podporují koncept zkrácení ischemických časů při přípravě TAG spolu s požadavkem trvalé a kontrolované postimplantační imunosupresivní léčby.
Studie byla vypracována s podporou grantu IGA MZ ČR NS 10587-3 „Význam 18-FDG PET/CT v diagnostice infekce cévní protézy”
Doc. MUDr. Pavel Šebesta, CSc.
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
Zdroje
1. O‘Hara, P. J., Hertzer, N. R., Beven, E. G., Krajewski, L. P. Surgical management of infected abdominal aortic grafts: review of a 25-year experience. J. Vasc. Surg., 1986; 3 : 725–731.
2. Špaček, M., Bělohlávek, O., Votrubová, J., et al. Diagnostics of „non-acute“ vascular prosthesis infection using 18-F-FDG PET/CT: our experience with 96 prostheses. Eur. J. Nucl. Med. Mol. Imaging, 2009; 36(5): 850–858.
3. Young, R. M., Cherry, K. J. Jr., Davis, P. M., et al. The results of in situ prosthetic replacement for infected aortic grafts. Am. J. Surg., 1999; 178(2): 136–140.
4. Yeager, R. A., Taylor, L. M. Jr, Moneta, G. L., et al. Improved results with conventional management of infrarenal aortic infection. J. Vasc. Surg., 1999; 30 : 76–83.
5. Koshiko, S., Sasajima, T., Muraki, S., et al. Limitations in the use of rifampicin-gelatin grafts against virulent organisms. J. Vasc. Surg., 2002; 35 : 779–785.
6. Staffa, R., Kříž, Z., Vlachovský, R., et al. Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy. Rozhl. Chir., 2010; 89(1): 39–44.
7. Szilagyi, D. E., Rodriguez, F. J., Smith, R. F., Elliott, J. P. Late fate of arterial allografts. Observations 6 to 15 years after implantation. Arch. Surg., 1970; 101 : 721–733.
8. Štádler, P., Šebesta, P., Klika, T., et al. Alografty v cévní chirurgii. Rozhl. Chir., 2005; 84(7): 350–355.
9. Prager, M., Holzenbein, T., Aslim, E., et al. Fresh arterial homograft transplantation: a novel concept for critical limb ischaemia. Eur. J. Vasc. Endovasc. Surg., 2002; 24 : 314–321.
10. Kieffer, E., Gomes, D., Chiche, L., et al. Allograft replacement for infrarenal aortic graft infection: early and late rsults in 179 patients. J. Vasc. Surg., 2004; 39 : 1009–1017.
11. Zhou, W., Lin, P. H., Bush, R. L., et al. In situ reconstruction with cryopreserved arterial allografts for management of mycotic aneurysms or aortic prosthetic graft infections: a multi-institutional experience. Tex. Heart Inst. J., 2006; 33(1): 14–18.
12. Brown, K. E., Heyer, K., Rodriguez, H., et al. Arterial reconstruction with cryopreserved human allografts in the setting of infection: A single-center experience with midterm follow-up. J. Vasc. Surg., 2009; 49(3): 660–666.
13. Vardanian, A. J., Chau, A., Quinones-Baldrich, W., Lawrence, P. E. Arterial allograft allows in-line reconstruction of prosthetic graft infection with low recurrence rate and mortality. Am. Surg., 2009; 75(10): 1000–1003.
14. Esperón, A., Kamaid, E., Diamant, M., et al. Uruguayan experience with cryopreserved arterial homografts. Transplant. Proc., 2009; 41(8): 3500–3504.
15. Adamec, M., Tosenovsky, P., Janousek, L. Simultaneous surgical repair of abdominal aortic aneurysm using fresh arterial allograft and renal transplantation. Eur. J. Vasc. Endovasc. Surg., 2001; 21 : 467–468.
16. Mirelli, M., Buzzi, M., Pasquinelli, G., et al. Fresh and cryopreserved arterial homografts: immunological and clinical results. Transplant. Proc., 2005; 37 : 2688–2691.
17. Litzler, P. Y., Thomas, P., Danielou, E., et al. Bacterial resistance of refrigerated and cryopreserved aortic allografts in an experimental virulent infection model. J. Vasc. Surg., 2009; 29 : 1090–1096.
18. Saito, A., Motomura, N., Kakimi, M., et al. Vascular allografts are resistant to methicillin-resistant Staphylococcus aureus through indoleamine 2,3-dioxygenase in a murine model. J. Thorac. Cardiovasc. Surg., 2008; 136(1): 156–167.
19. Camiade, C., Goldschmidt, P., Koskas, F. et al. Optimization of the resistance of arterial allografts to infection: comparative study with synthetic prostheses. Ann. Vasc. Surg., 2001; 15 : 186–196.
20. Locati, P., Novali, C., Socrate, A. M., et al. The use of arterial allografts in aortic graft infections. A three years experience on eighteen patients. J. Cardiovasc. Surg., 1998; 39 : 735–741.
21. Noel, A. A., Gloviczki, P., Cherry, K. J., et al. Abdominal aortic reconstruction in infected fields: early results of the United States cryopreserved aortic allograft registry. J. Vasc. Surg., 2002; 35 : 847–852.
22. Chiesa, R., Astore, D., Piccolo, G., et al. Fresh and cryopreserved arterial homografts in the treatment of prosthetic graft infections: experience of the Italian collaborative vascular homograft group. Ann. Vasc. Surg., 1998; 12 : 457–462.
23. Marois, Y., Wagner, E., Paris, E., et al. Comparison of healing in fresh and preserved arterial allografts in the dog. Ann. Vasc. Surg., 1999; 13 : 130–140.
24. Moriyama, S., Utoh, J., Sun, L. B., et al. Antigenicity of cryopreserved arterial allografts: comparison with fresh and glutaraldehyde treated grafts. Am. Soc. Artif. Intern. Organs J., 2001; 47 : 202–205.
25. Gabriel, M., Kostrzewa, A., Sobieska, M. Immunologic reaction following cryopreserved aortic allograft replacement for major vascular infection. Transplant. Proc., 2002; 34 : 713–714.
26. Matia, I., Adamec, M., Varga, M., et al. Aortoiliac reconstruction with allograft and kidney transplantation as a one-stage procedure: long term results. Eur. J. Vasc. Endovasc. Surg., 2008; 35 : 353–357.
27. Fahner, P., Idu, M. M., van Gulik, T. M., Legemate, D. A. Systematic review of preservation methods and clinical outcome of infrainguinal vascular allografts. J. Vasc. Surg., 2006; 44 : 518–524.
28. Mirelli, M., Stella, A., Faggioli, G. L., et al. Immune rsponse following fresh arterial homograft replacement for aortoiliac graft infection. Eur. J. Vasc. Endovasc. Surg., 1999; 18 : 424–429.
29. Azuma, N., Sasajima, T., Kubo, Y. Immunosuppression with FK506 in rat arterial allografts:fate of allogeneic endothelial cells. J. Vasc. Surg., 1999; 29(4): 694–702.
30. Albertini, J. N., Barral, X., Branchereau, A., et al. Long-term results of arterial allograft below-knee bypass grafts for limb salvage: a retrospective multicenter study. J. Vasc. Surg., 2000; 31 : 426–435.
31. Magne, J. L., Farrah, I., Roux, J. J., et al. Below-knee bypass using fresh arterial allografts for limb salvage: early results. Ann. Vasc. Surg., 1997; 11 : 237–241.
32. Matia, I., Adamec, M., Janousek, L., et al. Fresh arterial grafts and conduits for vascular reconstructions in transplanted patients. Eur. J. Vasc. Endovasc. Surg., 2006; 32 : 549–556.
33. Dinis da Gama, D., Sarmiento, C., Vieira, T., do Carmo, G. The use of arterial allografts for vascular reconstruction in patients receiving immunosuppression for organ transplantation. J. Vasc. Surg., 1994; 20 : 271–278.
34. Šebesta, P., Štádler, P., Šedivý, P., Bartík, K. The seven-yearęsecondary patency of a fresh arterial allograft in the femorocrural position in a heart transplant recipient: a case report. Ann. Vasc. Surg., 2010, Epub. 6/2010; v tisku.
35. Štádler, P., Slížová, D., Krs, O., et al. Microscopic study of vascular allografts. Cor. Vasa, 2005; 47(1): 10–13.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
- Ischemická kolitída po operáciách pre AAA
- Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
- Roboticky asistované cévní rekonstrukce aorto-ilické oblasti
- Vliv infrainguinálních bypassů na dlouhodobou průchodnost pánevních intervencí – význam hybridních výkonů
- Žilní interponát při řešení krvácení z distální anastomózy pedálního bypassu
- Peroperační intraarteriální trombolýza v terapii akutní končetinové ischemie
- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Simultánní karotická endarterektomie a koronární revaskularizace: indikace a výsledky
- Jednoduchá metoda odstranění infikované cévní protézy
- Dva mylné mýty flebologické chirurgie 20. století
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



