-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní radioterapie v komplexní léčbě sarkomů měkkých tkání a kostí u dospělých – aktuální přehled a vlastní zkušenosti
Modern Radiotherapy in the Complex Management of Soft Tissue and Bone Sarcomas in Adults – Current Overview and the Author‘s Experience
Soft tissue sarcomas and primary bone tumours constitute very heterogenic group. Gold treatment standard is surgery in most of them. Nowadays the combination surgery with radiotherapy is preferred, because thanks new radiotherapeutic technology is possible to apply very high dose of radiation which necessary for local control of these tumours.
The goal of our article is to describe new possibilities of radiotherapy, including neoadjuvant and adjuvant setting, intraoperative radiotherapy, interstitial brachytherapy and the combination with surgery.
But very important is multidisciplinary cooperation to until recently in prognostic bad group of patients, concentration these patients to centers with modern technique and clinical experience with treatment of soft tissue sarcomas and bone tumours.Key words:
soft tissue sarcomas – primary bone tumours – neoadjuvant radiotherapy – adjuvant radiotherapy – intraoperative radiotherapy – intertitial brachytherapy
Autoři: R. Soumarová 1; Z. Lovasová 1; S. Czudek 2; M. Škrovina 2; L. Adamčík 2; M. Straka 2
Působiště autorů: Oddělení radioterapie a onkologie, Komplexní onkologické centrum Nový Jičín primář: doc. MUDr. Renata Soumarová, Ph. D. 1; Chirurgické oddělení nemocnice Nový Jičín, Komplexní onkologické centrum Nový Jičín primář: MUDr. Stanislav Czudek, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 7, s. 387-393.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Sarkomy měkkých tkání a primární nádory kostí tvoří velmi heterogenní skupinu. Zlatým léčebným standardem u velké většiny z nich je chirurgický výkon. V současné době se však stále více uplatňuje kombinace resekčního výkonu s radioterapií, která díky nových technologiím umožní i aplikaci relativně vysokých dávek záření nutných pro léčbu právě těchto nádorů. Cílem sdělení je podat ucelený přehled o nejnovějších možnostech léčby zářením ve formě neoadjuvantní a adjuvantní zevní radioterapie, intraoperačního ozáření, intersticiální brachyterapie a kombinace s chirurgickým výkonem.
Pro dosažení optimálních výsledků u skupiny donedávna velmi prognosticky špatné skupiny nemocných je ovšem nutná multidisciplinární spolupráce a koncentrace pacientů do center, které mají technické možnosti a praktické zkušenosti s léčbou sarkomů měkkých tkání a kostí.Klíčová slova:
sarkomy měkkých tkání – primární kostní nádory – neoadjuvantní radioterapie – intraoperační radioterapie – intersticiální brachyterapie – adjuvantní radioterapieÚVOD
Sarkomy měkkých tkání (soft tissue sarcomas – STS) tvoří pouze necelá 2 % všech nádorů. Jedná se o velmi heterogenní skupinu nádorů, které mají původ v mezenchymální tkáni. Existuje více než 50 histologických subtypů, z nichž mnohé jsou spojeny se specifickými klinickými projevy, prognostickými faktory a léčebnými postupy. Nejčastější se vyskytuje maligní fibrózní histiocytom a liposarkom. Sarkomy vzácně vychází i z trávicího ústrojí. Tuto skupinu v současné době nazýváme gastrointestinální stromální tumory a jejich léčba je zcela odlišná od výše uvedených a nebude dále v tomto článku pojednávána. Nejtypičtější lokalizací STS jsou končetiny (50 %), oblast retroperitonea, trupu a hlavy a krku. Většina lézí je asymptomatických, příznaky se většinou objevují až po útlaku okolních struktur. Často tak, zejména v břišní dutině, mohou narůst i do obrovských rozměrů. Sarkomy měkkých tkání jsou jedinými solidními nádory, u nichž o stadiu rozhoduje také stupeň diferenciace. Histopatologický grading koreluje s intervalem bez známek onemocnění i celkovou dobou přežití. Pro určení histologického typu by měl být stanoven grading podle uznaných kritérií včetně buněčnosti, buněčné pleiomorfie, mitotické aktivity a nekrózy. Mitotická aktivita a přítomnost či absence nekróz je signifikantně spojena s délkou doby do vzniku vzdálených metastáz. Mezi negativní prognostické faktory patří velikost tumoru nad 10 cm, uložení nádoru v hlubších strukturách, lokalizace v oblasti retroperitonea, mužské pohlaví, vyšší věk, vyšší grading, nekróza, cévní invaze.
Primární kostní nádory jsou vzácné, tvoří asi jen 0,2 % všech nádorů. Mezi nejběžnější histologické typy patří osteosarkom (35 %), chondrosarkom (30 %) a Ewingův sarkom (16 %) (NCCN, verze 1.2009).
Zvláštním typem sarkomů jsou desmoidy – benigní nádory pojivové tkáně s lokálně agresivním chováním, které rostou z hlubokých pojivových tkání šlach, fascií, aponeuróz. V anglo-americké literatuře se nazývají agresivní fibromatózou [1]. Tvoří méně než 3 % sarkomů měkkých tkání a asi 0,03 % všech nádorů. Zlatým standardem je kompletní chirurgické odstranění, avšak téměř v 50 % vzniká recidiva. Vzhledem k často pomalému růstu a v některých případech ke spontánní stabilizaci je nutné zvažovat sporný přínos případných mutilujících chirurgických výkonů (např. extenzivní resekce kliček tenkého střeva). Nejvyšší procento lokálních relapsů mají extraabdominální tumory, asi ve dvou třetinách po kompletním chirurgickém odstranění. Po Rl resekci radioterapie signifikantně snižuje procento recidiv [2]. Radioterapie je též indikována po R0 resekci s volnými okraji méně než 2 cm. Doporučovaná dávka je 50-60 Gy, není však prokázán přínos RT s dávkou vyšší než 60 Gy [3].
VLASTNÍ ZKUŠENOSTI
Problematikou léčby sarkomů se v našem centru v interdisciplinárním týmu zabýváme od roku 2004. Dosud jsme léčili téměř sto nemocných s diagnózou sarkomu měkkých tkání a kostí a desmoidů. U každého nemocného jde o vysoce individuální záležitost z hlediska klasifikace a klinického obrazu nádoru a tím i léčby, takže počty nemocných v jednotlivých podskupinách jsou zatím malé a je brzy na podrobnější hodnocení výsledků. Vzhledem k celkovému počtu nádorů sarkomů měkkých tkání však je soubor relativně početný. Celý soubor trvale sledujeme, první výsledky sarkomů měkkých končetin léčených intersticiální brachyterapií budou publikovány. Metodu intersticiální brachyterapie s použitím high dose rate afterloadingu jsme zahájili již v roce 2004. Použili jsem ji u 10 pacientů. Od roku 2006 jsme zavedli u nás dosud nepoužívanou novou léčebnou metodu intraoperační radioterapie (IORT) a tu jsme použili u 3 nemocných se sarkomem retroperitonea.
LÉČEBNÉ MOŽNOSTI
Léčba sarkomů měkkých tkání a kostí se v posledních desetiletích dramaticky změnila. Současný management zahrnuje multidisciplinární přístup kombinující chirurgický výkon, radioterapii i agresivní chemoterapii podle histologického typu a stadia onemocnění. Léčebný protokol závisí na velikosti a umístění nádoru, jeho vztahu k neurovaskulárním strukturám nebo vnitřním orgánům, věku pacienta a jeho celkovém stavu, na zkušenosti týmu a v neposlední řadě i na přání pacienta. Ve většině případů u negeneralizovaného onemocnění je základní léčebnou modalitou resekční výkon a zejména u končetinových sarkomů výkon zachovávající končetinu (limb sparing surgery) [4–7]. Chirurgie se však uplatňuje i v případě resekce solitární metastázy.
Radioterapie v kombinaci s chirurgickým výkonem vede ke snížení pravděpodobnosti lokální recidivy a tím vzniku diseminace onemocnění [8]. Její vliv na celkové přežití se však nepodařilo prokázat [9].
Sarkomy měkkých tkání a kostí tvoří, jak již bylo uvedeno, velmi heterogenní skupinu. O většině z nich je známo, že patří mezi tzv. radiorezistentní nádory, čili tumory ne dobře reagující na aplikované ionizující záření. Nutno však říct, že tento pohled se mění. Důvodem je možnost aplikace relativně vysokých dávek záření díky novým moderním technologiím a kombinace s dalšími léčebnými modalitami. V kombinaci s chirurgickým výkonem může být rádioterapie indikována jako neoadjuvantní (předoperační), intraoperační nebo adjuvantní (pooperační), v závislosti na rozsahu onemocnění, typu resekce či účinnosti chemoterapie. U neoperabilního onemocnění může mít rádioterapie i velmi dobrý paliativní efekt.
Neoadjuvantní (předoperační) a adjuvantní (pooperační) radioterapie
Studie organizovaná National Cancer Institute (NCI) srovnávala celkové přežití u pacientů se sarkomy měkkých tkání končetin léčených buď amputací, nebo končetinu zachovávajícím výkonem s adjuvantní radioterapií. Výsledky obou léčebných postupů byly srovnatelné [10]. Adjuvantní radioterapie je v současné době indikována u sarkomů měkkých tkání větších než 5 cm, klasifikace pT2a-b a vždy v případě resekčních okrajů menších než 10 mm [11]. Je také vhodná u kostních nádorů s pozitivními či úzkými resekčními okraji nebo nádorů špatně odpovídajících na chemoterapii. Vliv adjuvantní radioterapie na lokální kontrolu onemocnění po konzervativním chirurgickém výkonu pro STS prokázaly dvě prospektivní randomizované studie [12, 13]. Radioterapie na jedné straně významně zlepšuje lokální kontrolu onemocnění, ale na straně druhé může způsobovat pozdní změny omezující funkci končetin, zejména ve smyslu podkožní fibrózy, edému, osteoradionekrózy, ztuhlosti kloubů. Další dvě studie hodnotily toxicitu před a pooperační radioterapie u sarkomů měkkých tkání končetin [14, 15]. Ke vzniku vážnějších pozdních komplikací více přispívala pooperační radioterapie, avšak lokální kontrola byla v obou ramenech stejná.
V případě pozitivních nebo nejistých okrajů po resekci by měla být podle některých autorů zvažována reresekce [16]. To ovšem může v některých případech znamenat amputaci. Vliv pozitivity či negativity chirurgických okrajů na lokální kontrolu sarkomů měkkých tkání hodnotila nedávno publikovaná studie, která analyzovala skupinu 150 pacientů po absolvování resekce a pooperační radioterapie [17]. Analýza neprokázala statisticky signifikantní vliv pozitivních okrajů na lokální kontrolu onemocnění či na celkové přežití při provedení adjuvantní radioterapie. Autoři proto uzavírají, že reresekce v případě pozitivních okrajů, pokud je indikována radioterapie, není bezpodmínečně nutná. Není ovšem pochyb, že by měla být primárně plánována kompletní resekce s negativními okraji. V případě, že by dosažení negativních okrajů znamenalo špatné funkční výsledky (např. v případě těsné blízkosti neurovaskulárních svazků) je možnou alternativou resekce a pooperační radioterapie. Podobné závěry přinesla i velká retrospektivní skandinávská studie vyhodnocující efekt adjuvantní radioterapie u více než tisíce pacientů [18].
Cílový objem u adjuvantní RT pro STS tvoří lůžko tumoru, nejlépe označené peroperačně klipy, s bezpečnostním lemem. Vzhledem k tomu, že většina STS nemetastazuje do lymfatických uzlin, nejsou součástí cílového objemu regionální lymfatické uzliny. Na přímou otázku, zda je indikováno i ozáření lymfatických uzlin odpověděla studie z MD Andersonu u skupiny 150 pacientů se synoviálním sarkomem. Závěrem práce bylo doporučení, lymfatické uzliny elektivně neozařovat [19].
Kostní nádory vyžadují resekci doplněnou radioterapií a chemoterapií. Nicméně řada z nich, zejména v oblasti pánve, sakra a osového skeletuje velmi obtížně resekovatelná s negativními okraji. Lokální kontrola zde ve srovnání s končetinovými sarkomy kostí bývá relativně nízká. Současná role radioterapie však stále není zcela jasná a existuje relativně málo publikovaných dat [20, 21, 22]. Dávka záření potřebná k dosažení lokální kontroly onemocnění je nejméně 65 Gy, což je velmi obtížné dosáhnout v blízkosti míchy nebo střevních kliček. Velká retrospektivní analýza shrnující 15leté zkušenosti z jednoho pracoviště s léčbou Ewingova sarkomu pánve, doporučuje též kombinaci chirurgie a RT [23].
Neoadjuvantní radioterapie je vhodná zejména u velkých hluboko uložených sarkomů měkkých tkání nebo u nádorů kostí před resekci obratlů či u sarkomů pánve. Je možné použít též předoperační radioterapii u osteosarkomů v případě plánovaného končetinu šetřícího výkonu, kde pomáhá zvýšit šanci na dobrou lokální kontrolu onemocnění. Součástí protokolu je i podání chemoterapie [24]. Určitou možností je též kombinace předoperační radioterapie v relativně nízké dávce (20 Gy) s maximálně možnou resekci a pooperační radioterapií. Předoperační radioterapie by zde měla sterilizovat onemocnění a zabránit zejména vzniku implantačních metastáz v jizvě. Též při tomto způsobuje sníženo riziko pozdních komplikací i nehojení rány [25].
Primární radioterapie
Samostatnou radioterapii lze použít pouze u neresekabilního onemocnění. Právě zde je nutné zvažovat všechny moderní metody radioterapie, které pomohou zvýšit dávku a zlepšit tak dlouhodobé výsledky bez zvýšení komplikací léčby [23]. Radioterapie jako primární léčba je tedy vhodná u medicínsky inoperabilních pacientů, u axiálních Ewingových sarkomů nebo tam, kde by chirurgie znamenala velké funkční omezení [26], u kostních sarkomů postihujících horní část kosti křížové [27], bázi lební nebo u těch, které rostou do ethmoidálních a sfenoidálních sinů [28]. Účinnost a efektivita definitivní radioterapie musí být vyvážena následky případného chirurgického výkonu.
K regresi tumoru, zmírnění bolestí a např. zastavení krvácení, a tím i dosažení paliativního efektu, může být dosaženo i u velmi radiorezistentních tumorů.
Dávky radioterapie
Dávka radioterapie se u různých typů sarkomů liší. Relativně nízké dávky se používají u Ewingova sarkomu [29], vysoké např. u rhabdomyosarkomu. Vyšší dávky (průměrně 66 Gy a více) vyžadují též chondrosarkomy a osteogenní sarkomy.
Myxoidní liposarkom je obzvláště citlivý na RT. Studie prokázaly regresi tumoru a vysokou lokální kontrolu onemocnění již po dávce 50–60 Gy [30]. Doporučované dávky pro předoperační RT u liposarkomů jsou 50 Gy [31] a v pooperačním podání 60 Gy, v případě pozitivních okrajů 64–68 Gy nejlépe s použitím techniky postupného zmenšování polí [32]. U neresekabilních nádorů měkkých tkání je pro lokální kontrolu onemocnění nutná dávka záření kolem 68 Gy. Při další eskalaci dávky má již asi čtvrtina pacientů pozdní komplikace [33].
TECHNIKA RADIOTERAPIE
Nejčastěji používanou technikou radioterapie je zevní radioterapie fotonovými svazky, aleje možná kombinace zevní radioterapie s brachyterapií, ozáření těžkými částicemi či intraoperační radioterapie elektronovým svazkem či tzv. ortovoltáží. Stále častěji se používají metody konformní radioterapie (3D CRT) (Obr. 1) nebo technika intenzitně modulovaného svazku (IMRT) [34]. Technika IMRT je zvláště vhodná pro nádory v blízkosti míchy (Obr. 2). Je vysoce konformní a umožní aplikaci vyšších dávek záření bez překročení toleranční dávky míchy (45 Gy). Pro aplikaci vysokých dávek záření v blízkosti senzitivnějších struktur jsou vhodné i např. protonové svazky. Mezi nádory vhodné pro ozařování tímto způsobem mohou patřit nádory baze lební či krčních obratlů [35]. Vysoké dávky záření v oblasti lůžka tumoru umožní též kombinace zevní RT s brachyterapií, pomocí které je možné dosáhnout lokální kontroly onemocnění v 80–90 % případů [36, 37]. K výhodám intersticiální brachyterapie patří možnost aplikace vyšší dávky záření v cílovém objemu, šetření okolních zdravých tkání, přesné posouzení lůžka tumoru, ozáření dobře oxygenovaných buněk před nástupem jizevnatých změn, kratší léčba. Vodiče pro brachyterapie jsou pooperačně zavedeny do lůžka nádoru (Obr. 3). Léčba intersticiální brachyterapií může být zahájena v relativně krátkém časovém odstupu od operace na rozdíl od zevní radioterapie, která může být zahájena až po zahojení resekční rány, tzn. za 2–3 týdny. Důvodem pro kombinaci zevní radioterapie s brachyterapií je velikost ozařovaného objemu. Brachyterapie nezaručuje v tomto případě dávkovou homogenitu a zevní radioterapie kompenzuje toto nerovnoměrné rozložení dávky. Dalším důvodem pro kombinaci brachyterapie se zevní radioterapií je zpravidla nutnost ozáření celého svalového kompartmentu a jizvy po resekčním výkonu [38].
Obr. 1. Technika 3D konformní RT u sarkomu tibie dolní končetiny Fig. 1. Conformal RT 3D technique in tibial sarcoma 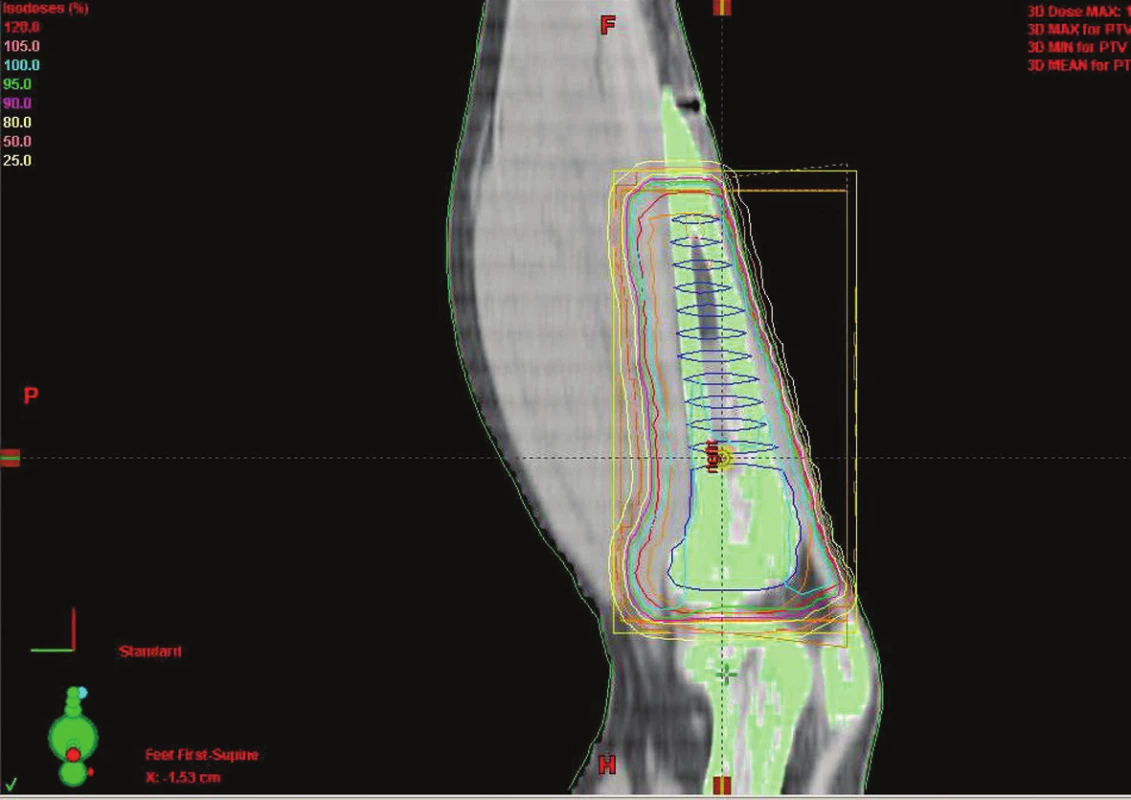
Obr. 2. IMRT technika na oblast lůžka sarkomu umístěného v těsné blízkosti míchy a ledvin – barevně je označena izodóza označující oblast 45 Gy (toleranční dávka míchy) Fig. 2. IMRT technique at the sarcoma bed located close to the spinal cord and kidneys– the isodose marking the 45 Gy region (the spinal cord tolerance dose) is highlighted in colour 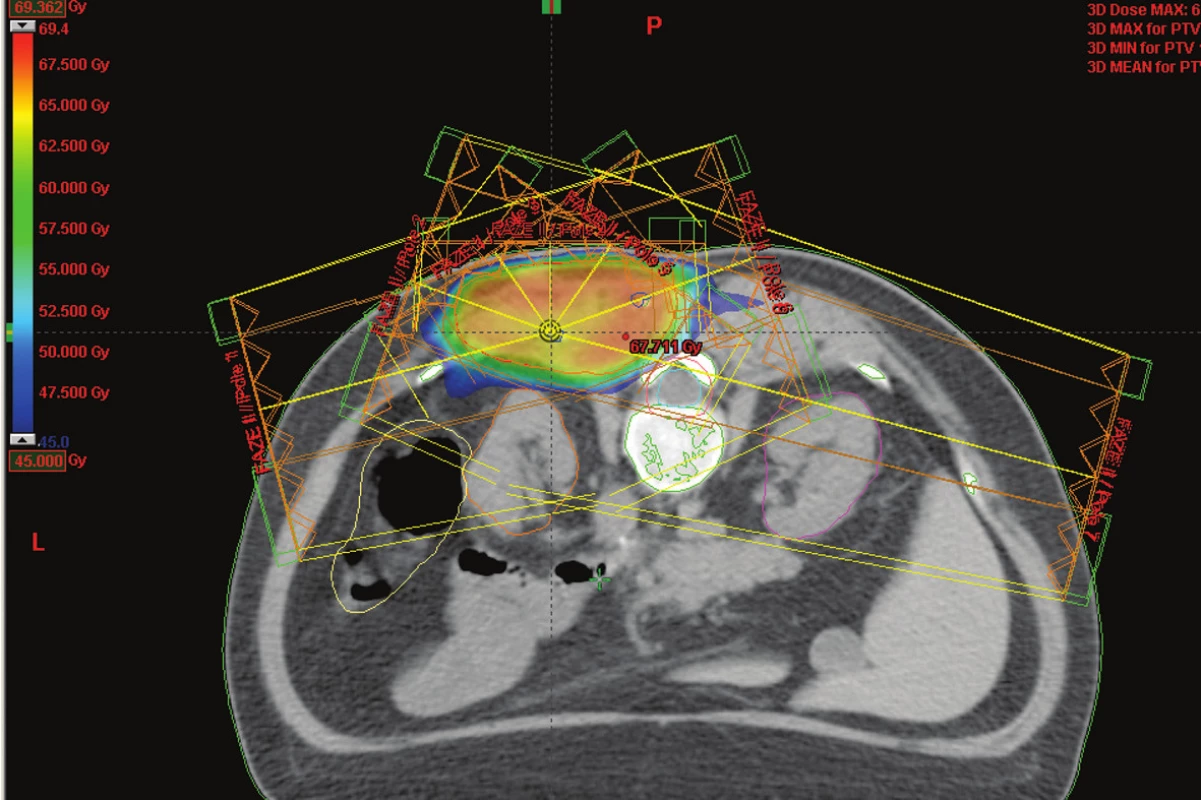
Obr. 3. Interticiální brachyterapie a) lůžko po odstranění nádoru b) zavedení plastikových vodičů pro intersticiální brachyterapii a sutura rány Fig. 3. Interstitial brachytherapy a) the bed following removal of the tumor b) introduction of plastic applicators for interstitial brachytherapy and the wound suturing 
U recidivujícího onemocnění je indikována maximálně možná resekce s následnou brachyterapií s nebo bez zevní radioterapie [39]. Po předchozí radiaci je brachyterapie optimální metodou [40].
Snaha o končetinu záchovný výkon se objevuje i u kostních nádorů končetin. Zde je možné také použít v kombinaci s chirurgickým výkonem intraoperační radioterapii vysokou jednorázovou dávkou [41].
Intraoperační radioterapie (IORT) elektronovým svazkem je technika vhodná zejména pro retroperitoneální sarkomy [42]. Tyto nádory často narostou v břišní dutině do obrovských rozměrů (Obr. 4). Kompletní chirurgická resekce zde zůstává hlavní léčebnou modalitou, ale lokální kontrola je často špatná, selhání je popisováno v 45 % až 86 % [43, 44]. Adjuvantní radioterapie u sarkomů retroperitonea je nutná pro zajištění lokální kontroly a zlepšení přežití. Srovnání před a pooperační RT se zabývala studie z Floridy [45]. Jejím závěrem byla preference předoperační radioterapie, která umožní zlepšení resekability a lokální kontroly s menším rizikem komplikací než při použití pooperační RT.
Obr. 4. Obrovský sarkom retroperitonea Fig. 4. Large retroperitoneal sarcoma 
Samostatná zevní radioterapii vzhledem k blízkosti radiosenzitivních struktur zejména kliček tenkého střeva, míchy či ledvin, je ovšem limitovaná. Intraoperační radioterapie (IORT) využívá aplikaci svazku ionizujícího záření do operačního pole během chirurgické revize (Obr. 5). Na oblast tumoru nebo jeho lůžka je aplikována vysoká jednorázová dávka záření (10–30 Gy), přičemž zdravé tkáně jsou z ozařovaného objemu dočasně mechanicky odsunuty. Zlepšení lokální kontroly onemocnění při použití kombinace zevní RT a IORT ve srovnání se samostatnou zevní RT prokázaly randomizované studie [46, 47]. Tyto studie prokázaly též nižší stupeň akutních i pozdních gastrointestinálních komplikací. Nicméně počet pacientů zde randomizovaných byl relativně nízký. Právě kombinace zevní RT, chirurgie a IORT s elektronovým svazkem je jednou z možností ke zlepšení lokální kontroly u sarkomů retroperitonea (Tab. 1) [47–51].
Obr. 3. Intraoperační radioterapie sarkomu retroperitonea s použitím elektronového svazku lineárního urychlovače – umístění tubusu pro IORT do břišní dutiny Fig. 5. Intraoperative radiotherapy of the retroperitoneal sarkoma using an electron beam linear accelerator– positioning of the tubus for abdominal IORT 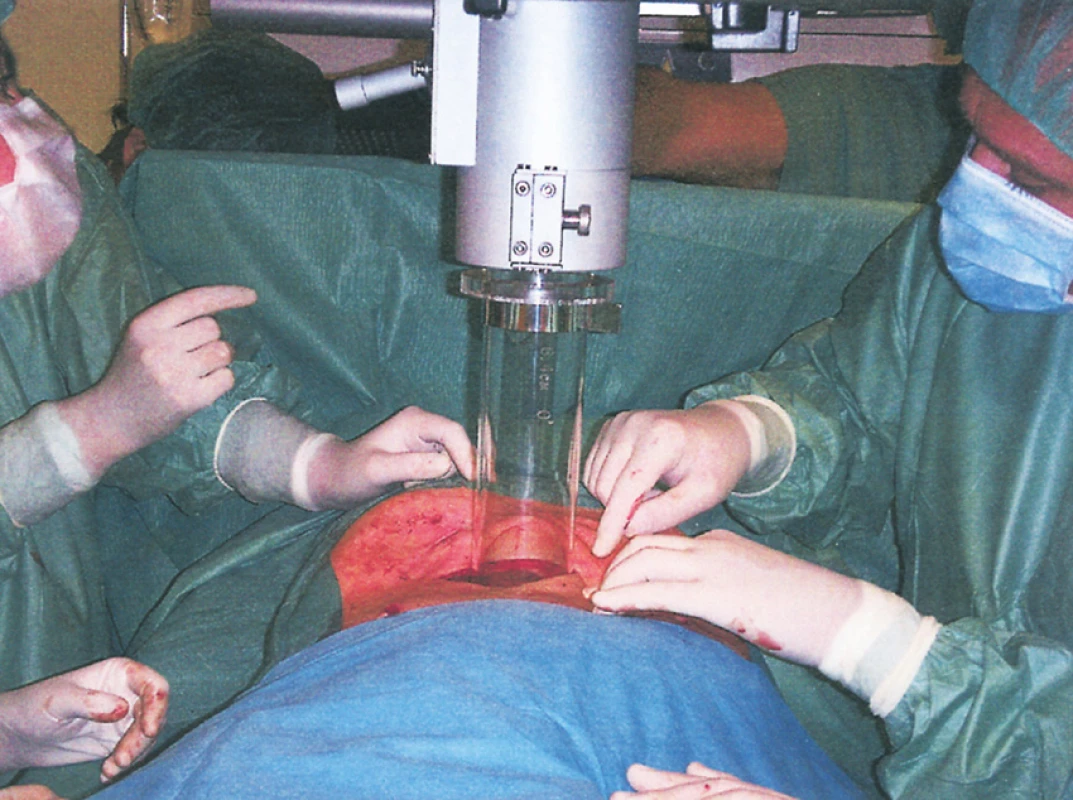
Tab. 1. Studie s použitím intraoperační radioterapie u sarkomu retroperitonea Tab. 1. Intraoperative radiotherapy study in retroperitoneal sarcoma 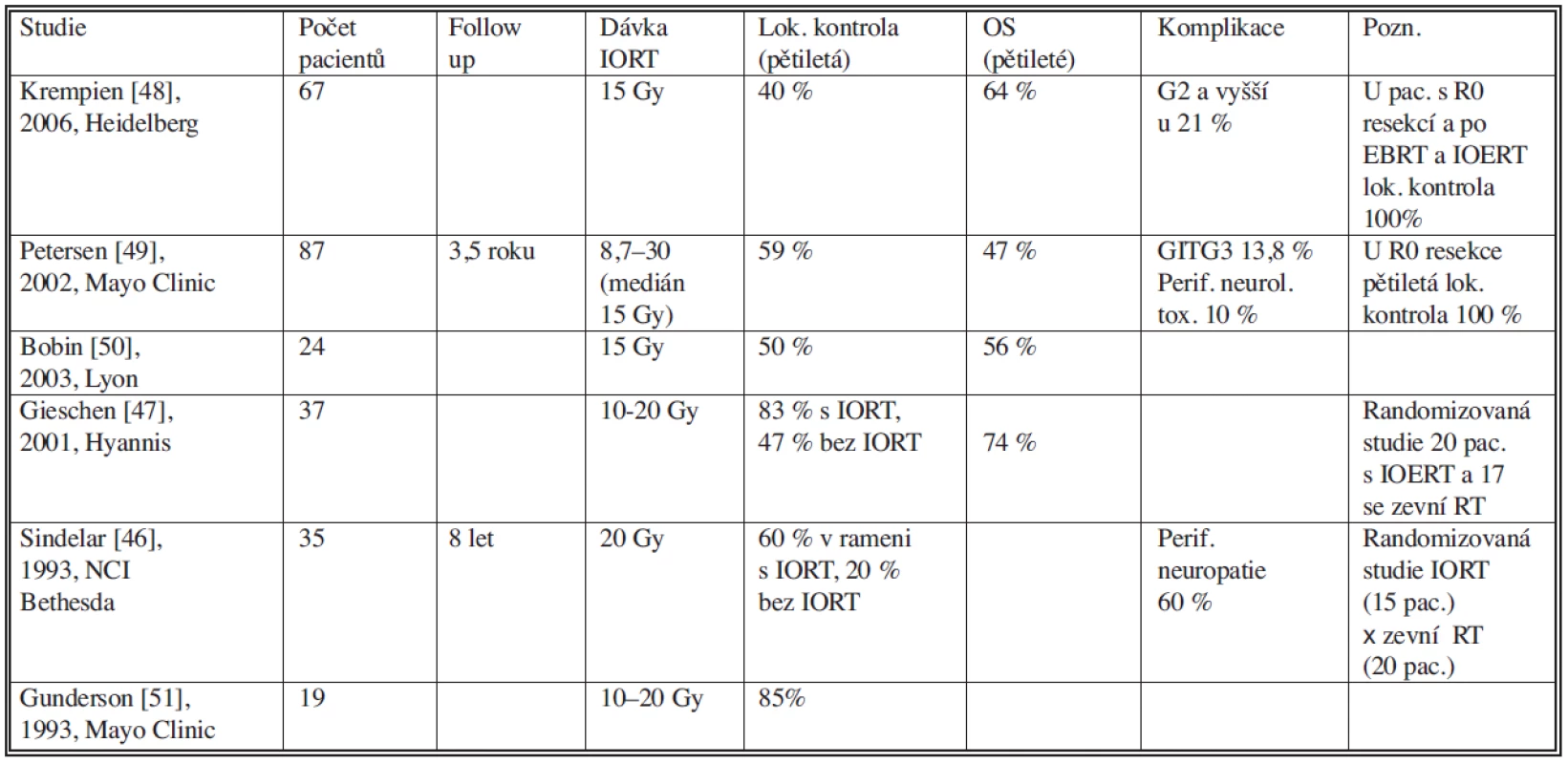
U neresekabilních sarkomů STS i u chondrosarkomů se zkouší nové metody radioterapie, včetně využití částicového záření, uhlíkové ionty, neutrony apod. [52, 53, 54]. Ewingův sarkom i osteosarkom v oblasti končetin může být indikací pro experimentální metodu extrakorporálního ozáření postižené kosti vysokou jednorázovou dávkou (50 Gy) a reimplantace ozářené kosti zpět. Smyslem tohoto postupuje zachování končetiny a dosažení dobré lokální kontroly onemocnění. Lokální recidivy a sekundárně indukované tumory zatím nebyly popsány [55, 56].
ZÁVĚR
Sarkomy měkkých tkání a nádory kostí tvoří skupinu nádorů převážně s lokálně agresivním chováním a často s tendencí k tvorbě vzdálených metastáz. Moderní chirurgické postupy v kombinaci s radioterapií umožní použití záchovných operací, které pacienty méně mutilují, ale mají stejné léčebné výsledky. Moderní technologie v radioterapii umožní aplikace podstatně vyšších dávek záření než tomu bylo v době nedávno minulé. Proto zařazení radioterapie do léčebných postupů sarkomů kostí a měkkých tkání jednoznačně patří. Je ovšem nutné využívat všech možností včetně techniky konformní zevní radioterapie, IMRT, brachyterapie či intraoperační radioterapie. Optimální stanovení léčebného postupu může výrazně zlepšit výsledky i kvalitu života těchto pacientů. Právě proto by se léčba těchto onemocnění měla koncentrovat do center, které mají multidisciplinární týmy zaměřené na tuto problematiku a které jsou vybaveny kvalitní radioterapeutickou technikou. Informací je o nich stále málo, bylo by proto vhodné i založení registrů.
Doc. MUDr. Renata Soumarová, Ph.D.
Komplexní onkologické centrum J. G. Mendela
Purkyňova 2138/16
741 01 Nový Jičín
e-mail: renata.soumarova@radioterapie. cz
Zdroje
1. Kiel, K. D., Suit, H. D. Radiation therapy in the treatment of aggressive fibromatoses (desmoid tumors). Cancer, 1984; 54 : 2051–2055.
2. Micke, O., Seegenschmiedt, M. H. Radiation therapy for aggressive fibromatosis (desmoid tumors): results of a national Patterns of Care Study. Int. J. Radiat. Oncol. Biol. Phys., 2005 Mar 1; 61(3): 882–891.
3. Ballo, M. T., Zagars, G. K., Pollack, A. Radiation therapy in the management of desmoid tumors. Int. J. Radiat. Oncol. Biol. Phys., 1998; 42 : 1007–1014.
4. Sugarbaker, P. H. Surgical techniques for extremity soft tissue sarcomas. In: Raaf JH, ed. Soft Tissue Sarcomas: Diagnosis and Treatment. St. Louis, Mo: Mosby; 1993.
5. Heslin, M. J., Woodruff, J., Brennan, M. F. Prognostic significance of a positive microscopic margin in high-risk extremity soft tissue sarcoma: implications for management. J. Clin. Oncol., 1996; 14 : 473–478.
6. Grobmyer, S. R., Brennan, M. F. Predictive variables detailing the recurrence rate of soft tissue sarcomas. Curr. Opin. Oncol., 2003; 15 : 319–326.
7. O’Sullivan, B., Wylie, J., Catton, C. The local management of soft tissue sarcomas. Semin. Radiat. Oncol., 1999; 9 : 328–348.
8. Suit, H. D., Spiro, I. Role of radiation in the management of adult patients with sarcoma of soft tissue. Semin. Surg. Oncol., 1994; 10 : 347–356.
9. Yang, J. C., Chang, A. E., Baker, A. R., et al. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcomas of the extremity. J. Clin. Oncol., 1998, 6(1), 197–203.
10. Rosenberg, S. A., Temper, J., Glatstein, E., et al. The treatment of soft-tissue sarcomas of the extremities: prospective randomized evaluations of (1) limb-sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann. Surg., 1982; 196 : 305–315.
11. McKee, M. D., Liu, D. F., Brooks, J. J., et al. The prognostic signifikance of margin width for extremity and trunk sarcoma. J. Surg. Oncol., 2004; 85 : 68–76.
12. Yang, J. C., Chang, A. E., Baker, A. R., et al. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcomas of the extremity. J. Clin. Oncol., 1998; 16 : 197–203.
13. Pisters, P. W., Harrison, L. B., Leung, D. H., et al. Long-term results of a prospective randomized trial of adjuvant brachytherapy in soft tissue sarcoma. J. Clin. Oncol., 1996; 14 : 859–868.
14. O’Sullivan, B., Davis, A. M., Turcotte, R., et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: A randomized trial. Lancet, 2002, 29; 359 : 2235–2241
15. Davis, A. M., O’Sullivan, B., Turcotte, R., et al. Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft tissue sarcoma. Radiother. Oncol., 2005; 75 : 48–53.
16. Zagars, G. K., Ballo, M. T., Pisters, P. W., et al. Surgical margins and reresection in the management of patients with soft tissue sarcoma using conservative surgery and radiation therapy. Cancer, 2003; 97 : 2544–2553.
17. Kim, Y. B., Shin, K. H., Seong, J., et al. Clinical significance of margin status in postoperative radiotherapy for extremity and truncal soft-tissue sarcoma. Int. J. Radiat. Oncol. Biol. Phys., 2007, 70(1): 139–144.
18. Jebsen, N. L., Trovik, C. S., Bauer, H. C., et al. Radiotherapy to improve local control regardless of surgical margin and malignancy grade in extremity and trunk wall soft tissue sarcoma: a Scandinavian sarcoma group study. Int. J. Radiat. Oncol. Biol. Phys., 2008 Jul 15; 71(4): 1196–203.
19. Guadagnolo, B. A., Zagars, G. K., Ballo, M. T., et al. Long-term outcomes for synovial sarcoma treated with conservation surgery and radiotherapy. Int. J. Radiat. Oncol. Biol. Phys., 2007; 69(4): 1173–1180.
20. Park, L., DeLaney, T. F., Liebsch, N. J., et al. Sacral chordomas: Impact of high-dose proton/photon-beam radiation therapy combined with or without surgery for primary versus recurrent tumor. Int. J. Radiat. Oncol. Biol. Phys., 2006; 65 : 1514–1521.
21. Hug, E. B., Fitzek, M. M., Liebsch, et al. Locally challenging osteo and chondrogenic tumors of the axial skeleton: Results of combined proton and photon radiation therapy using threedimensional treatment planning. Int. J. Radiat. Oncol. Biol. Phys., 1995; 31 : 467–476.
22. DeLaney, T. F., Park, L., Goldberg, S. I., et al. Radiotherapy for local control of osteosarcoma. Int. J. Radiat. Oncol. Biol. Phys., 2005; 61 : 492–498.
23. Indelicato, D. J., Keole, S. R., Shahlaee, A. H., et al. Impact of local management on long-term outcomes in Ewing tumors of the pelvis and sacral bones: the University of Florida experience. Int. J. Radiat. Oncol. Biol. Phys., 2008 Sep l; 72(l): 41–48.
24. Dincbas, F. O., Koca, S., Mandel, N. M., et al. The role of preoperative radiotherapy in nonmetastatic high-grade osteosarcoma of the extremities for limb-sparing surgery. Int. J. Radiat. Oncol. Biol. Phys., 2005 Jul l; 62(3): 820–828.
25. Wagner, T. D., Kobayashi, W., Dean, S., et al. Combination Short-Course Preoperative Irradiation, Surgical Resection, and Reduced-Field High-Dose Postoperative Irradiation in the Treatment of Tumors Involving the Bone. Int. J. Radiat. Oncol. Biol. Phys., 2009, 73(l): 259–266.
26. Sailer, S. L. The role of radiation therapy in localized Ewing‘s sarcoma. Semin. Radiat. Oncol., 1997, 7 : 225–235.
27. Hug, E. B., Fitzek, M. M., Liebsch, N. J., et al. Locally challenging osteo - and chondrogenic tumor soft the axial skeleton: results of combined proton and photon radiation therapy using three-dimensional treatment planning. Int. J. Radiat. Oncol. Biol. Phys., 1995, 31 : 467–476.
28. Munzenrider, J. E., Liebsch, N. J. Proton therapy for tumors of the skuli base. Sthranlenther Onkol., 1999, 175(suppl 2): 57–63.
29. Krasin, M. J., Rodriguez-Galindo, C., Billups, C. A., et al. Definitive irradiation in multidisciplinary management of localized Ewing sarcina family of tumors in pediatrie patiens: outcome and prognostic factors. Int. J. Radiat. Oncol. Biol. Phys., 2004, 60(3): 830–838.
30. Pitson, G., Robinson, P., Wilke, D., et al. Radiation response: An additional unique signature of myxoid liposarcoma. Int. J. Radiat. Oncol. Biol. Phys., 2004; 60 : 522–526.
31. Bossi, A., De Wever, I., Van Limbergen, E., Vanstraelen, B. Intensity modulated radiation-therapy for preoperative posterior abdominal wall irradiation of retroperitoneal liposarcomas. Int. J. Radiat. Oncol. Biol. Phys., 2007 Jan l; 67(l): 164–170.
32. Guadagnolo, B. A., Zagars, G. K., Ballo, M. T., et al. Excellent local kontrol rates and distinctive patterns of failure in myxoid liposarcoma treated with conservation surgery and radiotherapy. Int. J. Radiat. Oncol. Biol. Phys., 2008 Mar l; 70(3): 760–765.
33. Kepka, L., DeLaney, T. F., Suit, H. D., Goldberg, S. I. Results of radiation therapy for unresected soft-tissue sarcomas. Int. J. Radiat. Oncol. Biol. Phys., 2005, 63, 3, 852–859.
34. Alektiar, K. M., Hong, L., Brennan, M. F., et al. Intensity modulated radiation therapy for primary soft tissue sarcoma of the extremity: preliminary results. Int. J. Radiat. Oncol. Biol. Phys., 2007; 68 : 458–464.
35. Munzenrider, J. E., Liebsch, N. J. Proton therapy for tumors of the skuli base. Strahlenther Onkol., 1999; 174(suppl 2): 57–63.
36. Lindberg, R. D., Martin, R. G., Romsdhal, M. M., et al. Conservative surgery and postoperative radiotherapy is the treatment of soft tissue sarcoma in adults. AJR, 1975, 123 : 123–129.
37. Chaudhary, A. J., Laskar, S., Badhwar, R. Interstitial brachy-therapy in soft tissue sarcomas. Strahlenther Onkol., 1998, 174 : 522–528.
38. Calais, G. Role of radiotherapy in soft tissue sarcoma. Cancer Radiother., 1(5): 457–461, 1997.
39. Nori, D., Shupak, K., Shiu, M. H., Brennan, M. F. Role of brachytherapy in recurrent extremity sarcoma in patients treated with prior surgery and irradiation. Int. J. Radiat. Oncol. Biol. Phys., 1991; 20 : 1229–1233.
40. Moureau-Zabotto, L., Thomas, L., Bui, B. N., et al. Management of soft tissue sarcomas (STS) in first isolated local recurrence: a retrospective study of 83 cases. Radiother. Oncol., 2004 Dec; 73(3): 313–319.
41. Oya, N., Kokubo, M., Mizowaki, T., et al. Definitive intraoperative very high-dose radiotherapy for localized osteosarcoma in the extremities. Int. J. Radiat. Oncol. Biol. Phys., 2001 Sep l; 51(l): 87–93.
42. Petersen, I. A., Haddock, M. G., Donohue, J. H., et al. Use of intraoperative electron beam radiotherapy in the management of retroperitoneal soft tissue sarcoma. Int. J. Radiat. Oncol. Biol. Phys., 2002; 52(2): 469–475.
43. Heslin, M. J., Lewis, J. J., Nadler, E., et al. Prognostic factors associated with long-term survival for retroperitoneal sarcoma: Implications for management. J. Clin. Oncol., 1998; 15 : 2832–2839.
44. Dalton, R. R., Donohue, J. H., Mucha, P., et al. Management of retroperitoneal sarcomas. Surgery, 1989; 106 : 725–733.
45. Zlotecki, R. A., Katz, T. S., Morris, C. G., Lind, D. S., Hochwald, S. N. Adjuvant radiation therapy for resectable retroperitoneal soft tissue sarcoma: the University of Florida experience. Am. J. Clin. Oncol., 2005 Jun; 28(3): 310–316.
46. Sindelar, W. F., Kinsella, T. J., Chen, P. W., et al. Intraoperative radiotherapy in retroperitoneal sarcomas. Arch. Surg., 1993; 128 : 402–410.
47. Gieschen, H. L., Spiro, I. J., Suit, H. D., et al. Long-term results of intraoperative electron beam radiotherapy for primary and recurrent retroperitoneal soft tissue sarcoma. Int. J. Radiat. Oncol. Biol. Phys., 2001 May l; 50(l): 127–131.
48. Krempien, R., Roeder, F., Oertel, S., et al. Intraoperative electron-beam therapy for primary and recurrent retroperitoneal soft-tissue sarcoma. Int. J. Radiat. Oncol. Biol. Phys., 2006 Jul l; 65(3): 773–779.
49. Petersen, I. A., Haddock, M. G., Donohue, J. H., et al. Use of intraoperative electron beam radiotherapy in the management of retroperitoneal soft tissue sarcomas. Int. J. Radiat. Oncol. Biol. Phys., 2002 Feb l; 52(2): 469–475.
50. Bobin, J. Y., Al-Lawati, T., Granero, L. E., et al. Surgical management of retroperitoneal sarcomas associated with external and intraoperative electron beam radiotherapy. Eur. J. Surg. Oncol., 2003 Oct; 29(8): 676–681.
51. Gunderson, L. L., Nagorney, D. M., McIlrath, D. C., et al. External beam and intraoperative electron irradiation for locally advanced soft tissue sarcomas. Int. J. Radiat. Oncol. Biol. Phys., 1993 Mar 15; 25(4): 647–656.
52. Imai, R., Kamada, T., Tsuji, H., et al. Carbon ion radiotherapy for unresectable sacral chordomas. Clin. Cancer Res., 2004 Sep l; 10(17): 5741–5746.
53. Breteau, N., Demasure, M., Favre, A., et al. Fast neutron therapy for inoperable or recurrent sacrococcygeal chordomas. Bull Cancer Radiother., 1996; 83 Suppl: 142 s.
54. Gelderblom, H., Hogendoorn, P. C., Dijkstra, S. D., et al. The clinical approach towards chondrosarcoma. Oncologist., 2008 Mar; 13(3): 320–329.
55. Anacak, Y., Sabah, D., Demirci, S., Kamer, S. Intraoperative extracorporeal irradiation and re-implantation of involved bone for the treatment of musculoskeletal tumors. J. Exp. Clin. Cancer. Res., 2007 Dec; 26(4): 571–574.
56. Davidson, A. W., Hong, A., McCarthy, S. W., Stalley, P. D. En-bloc resection, extracorporeal irradiation, and re-implantation in limb salvage for bony malignancies. J. Bone Joint Surg. Br., 2005 Jun; 87(6): 851–857.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Jaké jsou současné úkoly intenzivní péče v chirurgii?
- Infekce náhrad abdominální aorty
- Perioperační metabolická péče u diabetického pacienta – doporučení
- Antibiotická profylaxe v urologii
- Levostranné resekce pankreatu: indikace, chirurgická technika a komplikace
- Experimentální terapie nádoru pomocí intratumorózní aplikace dendritických buněk
- Minimalizace krevních ztrát v jaterní chirurgii
- Úloha klasickej chirurgie pri liečbe náhlych príhod brušných u onkologických pacientov
- Nekrotizující infekční komplikace u syndromu diabetické nohy a jejich řešení
- Moderní radioterapie v komplexní léčbě sarkomů měkkých tkání a kostí u dospělých – aktuální přehled a vlastní zkušenosti
- Komplikace IPOM plastiky – naše zkušenosti
- Septický šok u pacienta s Fourniérovou gangrénou s fatálním koncem
- Komplikace periproktálního abscesu – Fourniérova gangréna nebo nekrotizující fasciitida? Kazuistika
- Nutriční intervence v chirurgii
- The Occurrence of Gallbladder Carcinoma in Yemeni Patients Undergoing Cholecystectomy in Two Hospitals
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Septický šok u pacienta s Fourniérovou gangrénou s fatálním koncem
- Komplikace IPOM plastiky – naše zkušenosti
- Komplikace periproktálního abscesu – Fourniérova gangréna nebo nekrotizující fasciitida? Kazuistika
- Antibiotická profylaxe v urologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





