-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
DASATINIB A JEHO POSTAVENÍ V LÉČBĚ CHRONICKÉ MYELOIDNÍ LEUKÉMIE
Dasatinib and chronic myeloid leukemia
BCR-ABL, a constitutively active tyrosine kinase, causes chronic myeloid leukaemia (CML). Rational development of drugs targeting BCR-ABL has significantly improved the treatment of CML. Imatinib (a BCR-ABL tyrosine kinase inhibitor) produces haematological and cytogenetic remissions across all phases of CML and is the present standard of care. However, imatinib resistance occurs in a significant proportion of patients and mechanisms of resistance include BCR-ABL mutations and activation of alternate oncogenic pathways. Dasatinib is a novel, potent, multi-targeted oral kinase inhibitor. Preclinical and clinical investigations demonstrate that dasatinib effectively overcomes imatinib resistance and has further improved the treatment of CML.
Key words:
chronic myeloid leukemia – dasatinib – imatinib – transplantation
Autoři: M. Doubek; D. Žáčková; J. Vorlíček; J. Mayer
Působiště autorů: Interní hematologická klinika LF MU a FN Brno
Vyšlo v časopise: Reviz. posud. Lék., 10, 2007, č. 2, s. 60-64
Kategorie: Zprávy
Souhrn
K rozvoji chronické myeloidní leukémie (CML) vede patologická BCR-ABL tyrozinkináza. Vývoj léků, které blokují BCR-ABL tyrozinkinázu, vedl k významnému zlepšení prognózy pacientů s CML. Inhibitor BCR-ABL imatinib vede k hematologickým a cytogenetickým remisím u pacientů s CML a stal se v současnosti lékem volby u CML. Nicméně je zde skupina nemocných s CML, kteří jsou na imatinib rezistentní nebo lék netolerují. Rezistence na imatinib bývá způsobena mutacemi BCR-ABL nebo aktivací alternativních onkogenních drah v leukemických buňkách. Dasatinib je nový a velmi účinný tyrozinkinázový inhibitor. Preklinická a klinická data ukazují, že dasatinib může být účinný u pacientů s CML, u nichž není imatinib účinný, čímž zlepšuje prognózu nemocných s CML.
Klíčová slova:
chronická myeloidní leukémie – dasatinib – imatinib – transplantaceÚvod
Chronická myeloidní leukémie (CML) je myeloproliferativní choroba vycházející pravděpodobně z pluripotentní kmenové buňky, u níž dominuje proliferace myeloidní řady. Pro tuto diagnózu je typická a diagnostická přítomnost cytogenetické odchylky, která se nazývá podle místa objevu filadelfský chromozom (Ph1 chromozom). Ph1 chromozom je výsledkem translokace (9;22) a v místě fúze chromozomu 9 a chromozomu 22 vzniká chimerický gen BCR-ABL [28].
CML je nejčastěji diagnostikována v chronické fázi, která se projevuje především neutrofilní leukocytózou a splenomegalií. V průběhu nemoci ale dochází k postupné dediferenciaci maligních buněk. Prohlubuje se jejich autonomie, což vede k akceleraci nemoci až blastickému zvratu, jenž připomíná velmi agresivní akutní leukémie. Nemoc v tomto stadiu špatně reaguje na většinu léčebných postupů. Chronická fáze trvá průměrně 3–4 roky. Vzhledem k výrazné variabilitě nemoci však jsou nemocní, u nichž chronická fáze trvá jen několik měsíců nebo na druhou stranu i 10 let [28].
Ročně je v Česku diagnostikováno asi 140 nových případů CML. Jde o chorobu převážně středního a vyššího věku.
Dosavadní léčba chronické myeloidní leukémie
Léčba CML se od počátku 21. století dramaticky proměnila. Do široké klinické praxe se dostal tyrozinkinázový inhibitor imatinib (dříve STI571), lék, který blokuje funkci proteinu, jenž je produktem fúzního genu BCR - -ABL [15]. Léčba imatinibem významně snížila počet nemocných s CML, u nichž je indikována alogenní transplantace krvetvorby. Podle studie IRIS (International Randomized Study of Interferon and STI571), provedené na 1106 nemocných s nově diagnostikovanou CML v chronické fázi a srovnávající imatinib s interferonem alfa a cytarabinem v nízkých dávkách, dokáže imatinib v monoterapii u pacientů s CML navodit kompletní cytogenetickou remisi (úplné vymizení fúzního genu BCR-ABL při cytogenetickém vyšetření kostní dřeně) u 76,2 % nemocných po 18 měsících léčby. Podle této studie dále během 18 měsíců užívání imatinibu nedojde k progresi onemocnění u 96,7 % pacientů [33]. Jak dokazují poslední analýzy studie IRIS, zásadní význam má dosažení co nejlepší léčebné odpovědi [9, 10, 15–17, 19, 20]. Ve studii IRIS byl chimerický gen BCR-ABL kvantifikován jako poměr BCR - -ABL/BCR. Hodnotil se pokles této hodnoty, přičemž pokles na desetinu byl hodnocen jako snížení o jeden log. Při dosažení kompletní cytogenetické odpovědi bylo redukce BCR-ABL/BCR nejméně o 3 log dosaženo u 57 % nemocných léčených imatinibem, ale jen u 24 % nemocných na kombinované terapii s interferonem a cytarabinem. Vzhledem k tomu, že u pacientů na kombinované terapii se kompletní cytogenetické odpovědi dosahovalo méně často, byly výsledky této redukce BCR-ABL/BCR pro všechny nemocné daleko rozdílnější: 39 % pro imatinib a 2 % pro kombinovanou terapii. Pro nemocné, kteří dosáhli po 18 měsících terapie kompletní cytogenetické odpovědi a redukce BCR-ABL/BCR alespoň o 3 log, byla pravděpodobnost přežití bez progrese CML po 60 měsících 100%. Nemocní, kteří sice dosáhli kompletní cytogenetické remise, ale ne tak hluboké redukce BCR-ABL/BCR, měli pravděpodobnost přežití bez progrese 98% a pacienti bez kompletní cytogenetické remise jen 87%.
O účinnosti imatinibu v léčbě CML bylo několikrát referováno i v české odborné literatuře [11–14, 28, 29].
I přes vysokou účinnost imatinibu u CML však existuje skupina nemocných, u nichž je lék neúčinný, kteří jsou na imatinib rezistentní nebo lék netolerují. Jde často o nemocné v pokročilých stadiích nemoci. Právě tito nemocní by mohli profitovat z léčby novými inhibitory BCR-ABL a dalších kináz, k nimž patří dasatinib [1, 2, 10, 21, 22].
Rezistence na imatinib je komplexní fenomén. Existuje primární rezistence neboli refrakterita a sekundární rezistence (relaps), které se vyvinou po předchozí léčebné odpovědi. Rezistence může být dále rozdělena na hematologickou, cytogenetickou a molekulární [20].
U různých linií rezistentních buněk nebo na zvířecích modelech byly popsány různé mechanismy jejího vzniku:
- mutace v kinázové doméně BCR-ABL,
- větší exprese BCR-ABL proteinu pro amplifikaci BCR-ABL genu,
- zvýšená exprese MDR1 (multidrug resistance gene) a zvýšený export imatinibu z buněk,
- zvýšené koncentrace AAG v plazmě (a-1-acid glycoprotein, bílkovina, která může vázat imatinib),
- vyšší exprese proteinů tepelného šoku stabilizujících BCR-ABL,
- aktivace BCR-ABL nezávislých signálních drah, např. příslušníky rodiny Src kináz [6].
Pravděpodobně nejvýznamnějším mechanismem vzniku rezistence je mutace v kinázové doméně BCR--ABL (mutace v P smyčce, mutace T315, mutace M351, mutace v A smyčce a další). Možnosti vyšetřování rezistence na imatinib u nás shrnuli nedávno Naušová et al. [30]. V poslední době se ale hodně hovoří i o aktivaci na BCR-ABL nezávislých signálních drah, např. o rodině Src kináz. Tyto kinázy mají asi rozhodující vliv v pozdějších stadiích choroby, fungují „nad“ a „pod“ drahami BCR-ABL a jsou na BCR-ABL nezávislé.
Druhou možností, jak v současnosti účinně léčit CML, je provést alogenní transplantaci krvetvorných buněk. Alogenní transplantace krvetvorných buněk je stále, i přes obrovský pokrok, který byl v léčbě CML v posledních letech zaznamenán, považována za hlavní metodu, kterou lze CML vyléčit. Současné stanovisko k indikacím transplantací u pacientů s CML není jednoznačné. Na toto téma existuje řada prací a rámcových doporučení [18, 36]. V úvahu se bere rizikovost nemocného z hlediska základní choroby, transplantace, dostupnosti dárce a často také reakce na úvodní terapii imatinibem. Hlavním argumentem proti alogenním transplantacím u pacientů s CML je toxicita přípravného režimu a komplikace provázející transplantace, k nimž patří infekční komplikace a nemoc štěpu proti hostiteli. Na tyto komplikace může zemřít přibližně 1/3 nemocných po alogenní transplantaci. Část těchto komplikací je možné eliminovat použitím tzv. nemyeloablativního přípravného režimu nebo přípravného režimu s redukovanou intenzitou. Mortalita spojená s těmito režimy je minimální, přičemž efekt štěpu proti leukémii (GvL, graft-versus-leukemia), hlavní princip transplantace, zůstává zachován [7, 23, 24, 29].
Na téma nákladů na terapii imatinibem nebo na transplantační léčbu bylo provedeno několik analýz. Skrepnek a Ballard [39] provedli teoretické srovnání ceny terapie imatinibem a transplantací krvetvorných buněk od nepříbuzného dárce pro první 2 roky léčby. Za této situace vyšel imatinib ve srovnání s transplantací finančně výhodněji. Autoři však zdůrazňují, že se jedná pouze o první 2 roky. V dalších letech cena transplantační terapie klesá. Kumulace vysokých nákladů v časném období po transplantaci je logický a zřejmě všeobecný fenomén. Podobná data byla také publikována pro transplantace pro CML a nepříbuzné dárce. Ve studii, kterou publikovali Lee et al. [25], byly potransplantační náklady vysoké do 18 měsíce po transplantaci, poté klesaly a plató se objevilo kolem 3. roku. Pacienti, kteří do 6 měsíců po transplantaci zemřeli, byli podstatně dražší než ti, kteří toto období přežili. Podle naší analýzy je transplantační léčba v prvním roce o něco dražší než hypotetická léčba stejného pacienta imatinibem [23, 24, 28, 29].
Dasatinib
Studium nejrůznějších tyrozinkinázových inhibitorů začalo v 90. letech 20. století [26]. Imatinib, derivát fenylaminopyrimidinu, tak nebyl ani zdaleka první poznaný inhibitor.
Dasatinib, původně označovaný BMS-354825, dostal svůj generický název po pracovníkovi laboratoří společnosti Bristol-Myers-Squibb, který se podílel na jeho objevu a jehož jméno je Jagabandhu Das [5]. Tento lék zaznamenal raketový vzestup. Od podání preparátu prvnímu pacientovi k jeho registraci ve Spojených státech a Evropě uplynuly pouhé 3 roky. Prvnímu pacientovi byl dasatinib podán v roce 2003. O rok později už byly na sjezdu Americké hematologické společnosti zveřejněny výsledky studie fáze I, za další rok studie fáze II. Registrační řízení proběhlo ve Spojených státech a Evropě koncem roku 2006 a v současné době už lze lék podávat mimo klinické studie i českým nemocným.
Dasatinib (BMS-354825) je látka jiné struktury než imatinib, která je velmi účinná v léčbě CML i jiných hematologických malignit. Také o tomto léku už padla zmínka v české medicínské literatuře[8, 14].
Dasatinib inhibuje Src kinázy, o jejichž roli v progresi CML jsme se již zmínili. Vzhledem ke strukturální podobě Src kináz a ABL kinázy se dasatinib také váže na BCR-ABL. Patří tedy mezi duální Src/ABL kinázové inhibitory. Kromě těchto dvou kináz ještě ovlivňuje c-kit, Ephrin receptor kinázu a PDGF-ß. Dasatinib inhibuje BCR-ABL in vitro 325krát silněji než imatinib a 16krát silněji než nilotinib, další z tyrozinkinázových inhibitorů [33]. Dasatinib se podstatně odlišuje od imatinibu také tím, že se může vázat na BCR-ABL i v aktivní konformaci [37, 38]. Jiná vazba dasatinibu na BCR-ABL, než je tomu u imatinibu, umožňuje deaktivovat i mnohé mutantní formy BCR-ABL, na něž imatinib nepůsobí. Dasatinib navíc není ovlivněn činností MDR1. Hlavní přínos dasatinibu oproti imatinibu by tedy měl spočívat právě v možnosti ovlivnit mutantní formy BCR-ABL a v blokování Src kináz. Z in vitro testů vyplynulo, že jedinou mutací, která je rezistentní na účinky dasatinibu, je T315I [33].
Dasatinib se po perorálním požití váže z 96 % na plazmatické proteiny. Lék je významně distribuován do extravaskulárního prostoru. Metabolizuje se v játrech cestou enzymu CYP3A4 a z 85 % se vylučuje žlučí a ze 4 % ledvinami. Jeho poločas v plazmě kolísá od 1,3 do 5 hodin.
Doporučená dávka dasatinibu je 70 mg dvakrát denně, podávaná perorálně, s jídlem nebo bez jídla [19, 20]. V případě, že léčba dasatinibem nepřináší navození remise onemocnění a nemocní nemají závažné nežádoucí účinky léku, je možné denní dávku zvýšit až na 200 mg.
Dasatinib by měl být podáván dlouhodobě, pokud ho nemocný toleruje a nedochází k progresi onemocnění.
Dosud poznané nežádoucí efekty léčby dasatinibem se částečně podobají vedlejším efektům u imatinibu, nicméně některé jsou výraznější. Z nežádoucích účinků si zaslouží největší pozornost tři: myelosuprese, retence tekutin s pohrudničními výpotky a kardiotoxicita.
Myelosuprese je při léčbě dasatinibem velmi častá, zejména u nemocných s pokročilým onemocněním.
Pleurální výpotky jsou překvapivě poměrně častým nežádoucím účinkem dasatinibu. Podle posledních zpráv se vyskytují u 7–30 % nemocných léčených tímto preparátem. Pleurální výpotky stupně 3 a 4 postihují 4 % nemocných. Fluidothorax při léčbě dasatinibem je pravděpodobně způsoben tím, že některé z kináz, jež lék blokuje, se nachází ve vyšší míře v pohrudnici. Léčbou pleurálních výpotků způsobených dasatinibem je vysazení léku a aplikace diuretik a steroidů [35].
Dasatinib může u některých nemocných prodloužit QT interval na EKG. Lék by neměl být nasazován nemocným, kteří mají hodnotu QTc přesahující 450 ms. Během léčby dasatinibem by měly být důsledně kontrolovány plazmatické hladiny iontů.
Obecně platí, že lék by měl být vysazen vždy při toxicitě stupně 3 a 4.
Jedinými absolutními kontraindikacemi nasazení dasatinibu jsou hypersenzitivita na tento lék a těhotenství. Větší pozornost by měla být věnována nemocným s poruchami funkce jater (hodnoty ALT a AST přesahující dvojnásobek normy). Lék by také neměl být podáván pacientům, kteří užívají léky inhibující enzym CYP3A4, k nimž patří ketokonazol, itrakonazol, erytromycin, klaritromycin, astemizol, terfenadin nebo cisaprid. Některé léky, jako např. dexametazon nebo karbamazepim, naopak odbourávání dasatinibu urychlují. Omeprazol, blokárory histaminu-2 a antacida snižují resorpci léku [7, 8].
Účinnost dasatinibu u chronické myeloidní leukémie
Základní indikací dasatinibu v současné době je CML a Ph1+ akutní lymfoblastická leukémie rezistentní k předchozí terapii nebo u nemocných, kteří léčbu první volby netolerují.
Dasatinib byl již testován v řadě studií fáze I a II. Výsledky některých z nich byly publikovány in extenso, jiné zatím jen ve formě abstrakt. Základním cílem těchto studií bylo hodnocení účinnosti a tolerance dasatinibu u pokročilých fází CML a hledání optimálního dávkování léku.
U pacientů v chronické fázi CML bylo s dasatinibem provedeno už několik studií.
Výsledky první z nich (fáze I) publikoval Talpaz et al. [40]. Podle této studie navodil dasatinib kompletní hematologickou remisi u 37 ze 40 nemocných v chronické fázi CML, kteří netolerovali nebo byli rezistentní k imatinibu. Velké cytogenetické remise dosáhlo 18 ze 40 nemocných a kompletní 14 ze 40 pacientů. U 186 imatinibem předléčených pacientů v chronické fázi CML rezistentních na imatinib nebo netolerujících tento lék byla provedena otevřená jednoramenná multicentrická studie s dasatinibem v dávce 70 mg 2krát denně. Tato studie byla označena START-C. Střední doba podávání dasatinibu byla 8,3 měsíce. Za tuto dobu dosáhlo hematologické remise 97 % pacientů netolerujících imatinib a 87 % pacientů rezistentních na imatinib. Kompletní cytogenetickou remisi dosáhlo 64 % netolerujících a 28 % rezistentních na imatinib [1, 2] – tabulka 1. Další studií fáze II s dasatinibem, která ještě probíhá, je studie CA180-034 [19]. Tato studie porovnávala dasatinib u pacientů s CML, kteří netolerovali nebo byli rezistentní na imatinib. Dávka dasatinibu byla 100 mg a 140 mg v jedné nebo dvou denních dávkách. Do studie bylo randomizováno 670 nemocných. Po 3 měsících terapie byl počet celkových hematologických odpovědí 80 % a velkých cytogenetických remisí 37 %. Tato studie naznačuje, že lépe je dasatinib tolerován při podání 1krát denně. První výsledky otevřené randomizované nekomparativní multicentrické studie CA180-017 START-R (Src/ABL tyrosin kinase inhibition activity: research trials of dasatinib), prováděné u pacientů s CML v chronické fázi, kteří jsou rezistentní na standardní dávku imatinibu, a srovnávající u těchto nemocných dasatinib s vyšší dávkou imatinibu, zatím na souboru 150 randomizovaných pacientů ukazují lepší hematologickou odpověď (92 vs 82 %) i velkou cytogenetickou odpověď (48 vs 33 %) po dasatinibu [37, 38].
V případě akcelerované fáze CML u pacientů rezistentních nebo intolerantních na imatinib je účinnost dasatinibu následující: lék podle Guilhota et al. [16, 17] může navodit 39 % kompletních hematologických remisí, 31 % velkých cytogenetických remisí a 22 % kompletních cytogenetických remisí. Studie neprokázala účinnost léku u pacientů s mutací BCR-ABL T315I. Základní výsledky analýzy Guilhota et al. uvádí tabulka 1. Podle výsledků studie fáze II, studie START-A, které byly předneseny v roce 2006 na sjezdu Americké hematologické společnosti, navozuje dasatinib 45 % kompletních hematologických remisí, 39 % velkých cytogenetických remisí a 32 % kompletních cytogenetických remisí [3, 4].
Koncem roku 2006 byly zveřejněny detailní výsledky studie týkající se léčby dasatinibem u pacientů s CML v blastické krizi [4]. Tato studie provedená na 116 nemocných s lymfoblastickým nebo myeloblastickým zvratem CML (rezistentních nebo intolerantních k imatinibu) ukázala, že dasatinib v monoterapii je schopen navodit kompletní hematologickou remisi u 26 % nemocných jak s lymfoblastickým, tak myelo-blastickým zvratem CML. U pacientů s lymfoblastickým zvratem CML bylo dosaženo více kompletních cytogenetických remisí než u pacientů se zvratem myeloblastickým (43 vs 27 %), nicméně doba přežití nemocných bez progrese byla významně delší u pacientů se zvratem myeloblastickým. Výsledky studie jsou shrnuty v tabulce 1. Studie fáze II, START-B, týkající se pacientů v blastické krizi CML a uveřejněná na sjezdu Americké hematologické společnosti v roce 2006, ukázala, že dasatinib může navodit 34 % velkých hematologických remisí, 38 % velkých cytogenetických a 31 % kompletních cytogenetických remisí [27]. Dasatinibu v pokročilých stadiích CML (akcelerace a blastické zvraty) se týká i studie CA180-035, jejíž výsledky zatím hovoří o tom, že lék u těchto nemocných může navodit 35 % velkých hematologických remisí, 33 % velkých cytogenetických a 23 % kompletních cytogenetických remisí [21, 22].
Účinnost dasatinibu u pacientů v jednotlivých fázích CML představuje tabulka 1.
Tab. 1. Účinnost dasatinibu v jednotlivých fázích chronické myeloidní leukemie (CML)* 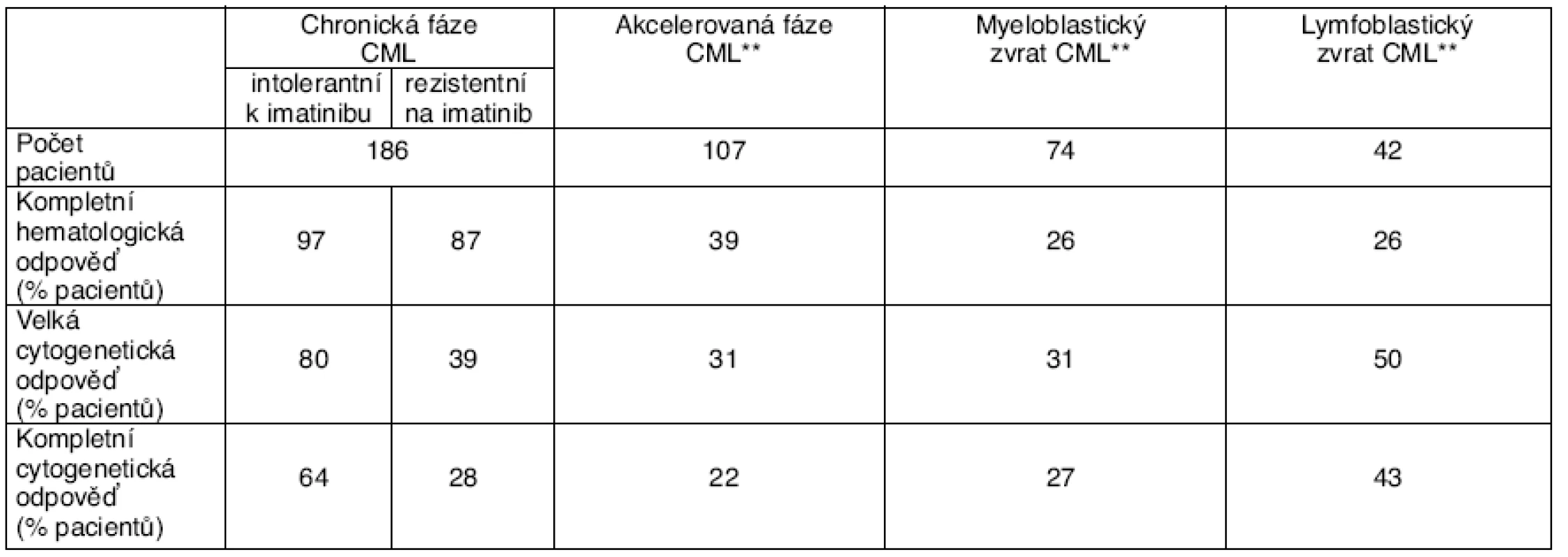
*Jde o výsledky studií na pacientech intolerantních nebo rezistentních na imatinib. **minimální doba sledování 8 měsíců Dasatinib není účinný jen v léčbě chronické myeloidní leukémie, ale také u pacientů s Ph1+ akutní lymfoblastickou leukémií. Ukazuje se, že proniká i do mozkomíšního moku, což může zlepšit vyhlídky nemocných s postižením centrálního nervového systému u CML nebo Ph1+ akutní lymfoblastické leukémie.
Jakou podle současných poznatků volit léčbu u jednotlivých fází chronické myeloidní leukémie?
Optimální léčba CML se stále hledá. Stručně lze popsat současnou léčbu CML následovně:
- Chronická fáze CML – lékem volby je imatinib. U pacientů s vysokým rizikem, kteří mají HLA shodného sourozence, je možné stále uvažovat i o alogenní transplantaci krvetvorných buněk. V případě, že imatinib ve standardním dávkování nenavodí žádnou cytogenetickou remisi nemoci (po 6 měsících užívání), je indikováno navýšení dávky imatinibu. Selže-li i toto navýšení, pak je indikována terapie dasatinibem či jiným tyrozinkinázovým inhibitorem (zatím v klinických studiích) nebo alogenní transplantace krvetvorných buněk od příbuzného nebo nepříbuzného dárce, je-li tento dárce k dispozici a nemocný nemá kontraindikace transplantace [32].
- U pacientů diagnostikovaných v akceleraci onemocnění nebo blastickém zvratu se musí vždy na prvním místě uvažovat o alogenní transplantaci krvetvorných buněk. Do provedení transplantace by měli být nemocní léčení imatinibem ve vyšších dávkách nebo imatinibem s chemoterapií k navození chronické fáze nemoci. Při selhání imatinibu je indikován dasatinib nebo zařazení pacienta do klinické studie, je-li taková k dispozici [33].
Závěr
Dasatinib je účinný lék v terapii CML i u pacientů, u nichž selhal imatinib. V současnosti je podávání dasatinibu indikována právě u nemocných rezistentních na imatinib nebo netolerujících imatinib.
Adresa pro korespondenci:
Doc. MUDr. Michael Doubek, Ph.D.
Interní hematoonkologická klinika LF MU a FN
Jihlavská 20
62500 Brno
Zdroje
1. Baccarani, M., Kantarjian, H., Apperley, J. et al. Dasatinib (SPRYCEL®) induces durable cytogenetic responses in patients with CP-CML with resistance or intolerance to imatinib: updated results of the CA180-013 START-C phase II study. Blood, 2006, 108, abstract 164.
2. Baccarani, M., Saglio, G., Goldman, J. et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood, 2006, 108, p. 1809–1820.
3. Cortes, J., Kim, D. W., Guilhot, F. et al. Dasatinib (SPRYCEL®) in Patients with Chronic Myelogenous Leukemia in Accelerated Phase that is Imatinib-resistant or -intolerant: Updated Results of the CA180-005 ‘START-A’ Phase II Study. Blood, 2006, 108, abstrakt 2160.
4. Cortes, J., Rousselot, P., Dong-Wook, K. et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in blast crisis. Blood, 2006, Blood First Edition Paper, prepublished online, DOI 10.1182/blood-2006-09-046888.
5. Das, J., Chen, P., Norris, D. et al. 2-aminothiazole as a novel kinase inhibitor template. Structure-activity relationship studies toward the discovery of N-(2-chloro-6-methylphenyl)-2-[6-[4-(2-hydroxyphenyl)-1-piperazinyl)]-2-methyl-4-pyrimidinylamino)]-1,3-thiazole-5-carboxamide (dasatinib, BMS-354825) as a potent pan-Src kinase inhibitor. J. Med. Chem., 2006, 49, p. 6819–6832.
6. Deininger, M., Buchdunger, E., Druker, B. J. The development of imatinib as a therapeutic agent for chronic myeloid leukemia. Blood, 2005, 105, p. 2640–2653.
7. Doubek, M., Vítek, A., Mayer, J. Reduced-intensity allografting for chronic myeloid leukemia in the first chronic phase. Haematologica, 2004, 89, 1, ELT03.
8. Doubek, M., Žáčková, D., Mayer, J. Dasatinib. Remedia, 2007, 17, s. 59–63.
9. Druker, B. J., Guilhot, F., O’Brien, S. G. et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N. Engl. J. Med., 2006, 355, p. 2408–2417.
10. Druker, B. J., Sawyers, C. L., Kantarjian, H. et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lym-phoblastic leukemia with the Philadelphia chromosome. N. Engl. J. Med., 2001, 344, p. 1038–1042.
11. Faber, E. Dasatinib. Farmakoterapie, 2006, 2, s. 135–137.
12. Faber, E. Imatinib. Farmakoterapie, 2005, 1, s. 233–238.
13. Faber, E. Imatinib (Glivec®) v léčbě nemocných s akcelerovanou fází chronické myeloidní leukemie – první zkušenosti. Trendy v medicíně, 2002, 4, s. 3–7.
14. Faber, E., Indák, K. Dasatinib. Farmakoterapie, 2007, 3, s. 135-140.
15. Goldman, J. M., Melo, J. V. Chronic myeloid leukemia – advances in biology and new approaches to treatment. N. Engl. J. Med., 2003, 349, s. 1451–1464.
16. Guilhot, F., Apperley, J., Kim, D. W. et al. Dasatinib induces significant hematologic and cytogenetic responses in patients with imatinib-resistant or –intolerant chronic myeloid leukemia in accelerated phase. Blood, 2006, Blood First Edition Paper, prepublished online, DOI 10.1182/blood - -2006-09-046839.
17. Guilhot, F., Roy, L., Guilhot, J. et al. Retrospective comparison of imatinib versus interferon plus cytarabine for chronic myelogenous leukemia patients in chronic phase. Blood, 2005, 106, abstrakt 165.
18. Hehlmann, R. Current CML therapy: progress and dilemma. Leukemia, 2003, 17, p. 1010–1012.
19. Hochhaus, A., Kim, D. W., Rousselot, P. et al. Dasatinib (SPRYCEL®) 50mg or 70mg BID Versus 100mg or 140mg QD in Patients with Chronic Myeloid Leukemia in Chronic Phase (CML-CP) Resistant or Intolerant to Imatinib: Results of the CA180-034 Study. Blood, 2006, 108, abstrakt 166.
20. Hochhaus, A., La Rosée, P. Imatinib therapy in chronic myelogenous leukemia: strategies to avoid and overcome resistance. Leukemia, 2004, 18, p. 1313–1321.
21. Kantarjian, H. M., Cortes, J., O’Brien, S. et al. Imatinib mesylate (STI 571) therapy for Philadelphia chromosome – positive chronic myelogenous leukemia in blast phase. Blood, 2002, 99, p. 3547–3553.
22. Kantarjian, H., Ottmann, O., Pasquini, R. et al. Dasatinib (SPRYCEL®) 140 mg QD vs 70 mg BID in Advanced Phase CML (ABP-CML) or Ph(+) ALL Resistant or Intolerant to Imatinib – Results of the CA180-035 Study. Blood, 2006, 108, abstrakt 746.
23. Krejčí, M., Doubek, M., Brychtová, Y. et al. Is nonmyeloablative transplant sufficient to cure chronic myeloid leukemia? Haematologica, 2005, 90, Suppl. 2, abstrakt 0526.
24. Krejčí, M., Mayer, J., Doubek, M. et al. Clinical outcomes and direct hospital costs of reduced-intensity allogeneic transplantation in chronic myeloid leukemia. Bone Marrow Transplant., 2006, 38, p. 483–491.
25. Lee, S. J., Anasseti, C., Kuntz, K. M. et al. The cost and cost-effectiveness of unrelated donor bone marrow transplantation for chronic phase chronic myelogenous leukemia. Blood, 1998, 92, p. 4047–4052.
26. Levitzki, A., Gazit, A. Tyrosine kinase inhibition: an approach to drug development. Science, 1995, 267, p. 1782–1788.
27. Martinelli, G., Hochhaus, A., Coutre, S. et al. Dasatinib (SPRYCEL®) Efficacy and Safety in Patients With Chronic Myelogenous Leukemia in Lymphoid or Myeloid Blast Phase with Imatinib Resistance or Intolerance. Blood, 2006, 108, abstrakt 745.
28. Mayer, J. Chronická myeloidní leukemie jako model moderní necytostatické léčby maligních chorob. Od Virchowa po STI 571. Vnitřní Lék., 2002, 48, s. 45–49.
29. Mayer, J., Krahulová, M., Kořístek, Z. et al. Alogenní transplantace periferních kmenových buněk po nemyeloablativním režimu. První zkušenosti. Čas. Lék. čes., 1999, 138, s. 624–627.
30. Naušová, J., Priwitzerová, M., Jarošová, M. et al. Chronická myeloidní leukemie – rezistence na imatinib mesylát (Glivec) – přehled literatury a vlastní zkušenosti. Čas. Lék. čes., 2006, 145, s. 377–382.
31. O’Brien, S. G., Guilhot, F., Larson, R. A. et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N. Engl. J. Med., 2003, 348, p. 994–1004.
32. O’Brien, S., Radich, J. P. (Eds.). NCCN Clinical Practice Guidelines in Oncology. Cronic Myelogenous Leukemia. In 2. 2007. National Comprehensive Cancer Network. www.nccn.org.
33. O’Hare, T., Walters, D. K., Stoftregen, E. P. et al. In vitro activity of Bcr-Abl inhibitors AMN107 and BMS-354825 against clinically relevant imatinib-resistant Abl kinase domain mutants. Cancer Res., 2005, 65, p. 4500–4505.
34. Or, R., Shapira, M. Y., Resnick, I. et al. Nonmyeloablative allogeneic stem cell transplantation for the treatment of chronic myeloid leukemia in first chronic phase. Blood, 2003, 101, p. 441–445.
35. Quintas-Cardema, A., Kantarjian, H. M., Munden, R. et al. Pleural Effusion in Patients (pts) with Chronic Myelogenous Leukemia (CML) Treated with Dasatinib after Imatinib Failure. Blood, 2006, 108, abstrakt 2164.
36. Radich, J. P., Olavarria, E., Apperley, J. F. Allogeneic hematopoietic stem cell transplantation for chronic myeloid leukemia. Hematol. Oncol. Clin. N. Am., 2004, 18, p. 685–702.
37. Shah, N., Pasquini, R., Rousselot, P. et al. Dasatinib (Sprycel) vs. escalated dose of imatinib in patients with chronic phase chronic myeloid leukemia resistant to imatinib: results of the CA180-017 START-R randomized study. Blood, 2006, 108, abstrakt 167.
38. Shah, N. P., Tran, C., Lee, F. Y. et al. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science, 2004, 305, p. 399–401.
39. Skrepnek, G. H., Ballard, E. E. Cost-efficacy of imatinib versus allogeneic bone marrow transplantation with matched unrelated donor in the treatment of chronic myelogenous leukemia: a decision-analytic approach. Pharmaco-therapy, 2005, 25, p. 325–334.
40. Talpaz, M., Shah, N. P., Kantarjian, H. et al. Dasatinib in imatinib-resistant philadelphia chromosome-positive leukemias. N. Engl. J. Med., 2006, 354, p. 2531–2541.
Štítky
Posudkové lékařství Pracovní lékařství
Článek vyšel v časopiseRevizní a posudkové lékařství
Nejčtenější tento týden
2007 Číslo 2- Úhrada léčivých přípravků podle § 16: Jak přesně postupovat?
- Vedolizumab v klinické praxi: pro koho, kdy a jak
- Vedolizumab v léčbě středně těžké až těžké aktivní Crohnovy nemoci
- Vedolizumab je vhodný i pro déletrvající léčbu pacientů s IBD
- Nové možnosti v terapii zánětlivých střevních onemocnění
-
Všechny články tohoto čísla
- FUNKČNÍ DIAGNOSTIKA V REHABILITACI PRO ÚČELY ZAMĚSTNANOSTI
- SOCIÁLNÍ PÉČE VE ZDRAVOTNICKÝCH ZAŘÍZENÍCH
- MALIGNÍ NÁDORY HLAVY A KRKU – POSUDKOVÁ PROBLEMATIKA
- TĚHOTENSTVÍ – NEMOC ČI FYZIOLOGICKÝ STAV?
- EKVITA VE ZDRAVÍ A ZDRAVOTNICKÝCH SLUŽBÁCH
- PERSPEKTIVA POSUDKOVÉHO A REVIZNÍHO LÉKAŘSTVÍ
- DASATINIB A JEHO POSTAVENÍ V LÉČBĚ CHRONICKÉ MYELOIDNÍ LEUKÉMIE
- Revizní a posudkové lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- EKVITA VE ZDRAVÍ A ZDRAVOTNICKÝCH SLUŽBÁCH
- TĚHOTENSTVÍ – NEMOC ČI FYZIOLOGICKÝ STAV?
- MALIGNÍ NÁDORY HLAVY A KRKU – POSUDKOVÁ PROBLEMATIKA
- SOCIÁLNÍ PÉČE VE ZDRAVOTNICKÝCH ZAŘÍZENÍCH
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



