-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Optické endoskopické metody v diagnostice nádorů hlavy a krku
Optical endoscopic methods in the diagnostics of head and neck tumours
Endoscopic optical imaging methods have been developed with the aim of early detection of lesions suspected from precancerous or malignant changes. In ENT area, it is primarily used in oral cavity, oropharynx, hypopharynx and larynx. They can be divided into two basic groups. Horizontal methods visualize the mucosal surface (autofluorescence, photodynamic diagnosis, narrow band imaging, magnifying and contact endoscopy) and vertical methods – showing the different layers of the mucosa (optical coherence tomography and confocal endomicroscopy). In the ENT area, the mostly used method is narrow band imaging (NBI).
Keywords:
optical imaging methods – narrow band imaging – autofluorescence – confocal endomicroscopy – optical coherence to-mography
Autoři: Jana Šatanková 1,2
; Anna Švejdová 1
; L. Zeinerová 1; Viktor Chrobok 1,2
Působiště autorů: Fakultní nemocnice Hradec Králové, Klinika otorinolaryngologie a chirurgie hlavy a krku, Přednosta: prof. MUDr. Viktor Chrobok, CSc., Ph. D. 1; Univerzita Karlova, Lékařská fakulta v Hradci Králové, Děkan: prof. MUDr. Jiří Manďák, Ph. D. 2
Vyšlo v časopise: Prakt. Lék. 2021; 101(2): 97-102
Kategorie: Přehledy
Souhrn
Endoskopické optické zobrazovací metody byly vyvinuty s cílem časné detekce slizničních lézí suspektních z prekancerózních nebo maligních změn. V ORL oblasti je to především oblast dutiny ústní, orofaryngu, hypofaryngu a hrtanu. Zobrazovací metody se dělí do dvou základních skupin. Horizontální metody vizualizují povrch sliznice (autofluorescence, fotodynamická diagnostika, narrow band imaging, zvětšovací a kontaktní endoskopie) a vertikální metody zobrazují různé vrstvy sliznice (optická koherentní tomografie a konfokální endomikroskopie). V ORL oblasti je nejvíce používaná metoda narrow band imaging (NBI).
Klíčová slova:
optické zobrazovací metody – narrow band imaging – autofluorescence – konfokální endomikroskopie – optická koherentní tomografie
ÚVOD
Pacienti s nádory horních dýchacích a polykacích cest (UADT – upper aerodigestive tumors) jsou rutinně vyšetřováni endoskopicky pomocí konvenčního bílého světla (WLE – white light endoscopy), což je nejběžnější metoda jak hodnotit povrchové šíření dlaždicobuněčného karcinomu (1). V časných stadiích jsou tumory UADT často nerozlišitelné od normální tkáně a velmi těžce detekovatelné pomocí konvenční WLE, proto není většinou možná časná detekce tumoru. Vzhledem k minimálním slizničním změnám je těžké diferencovat hranici mezi normálním a patologickým nálezem s cílem odebrání reprezentativní a správné biopsie. Diagnostika pozdních stadií nemoci znamená pro pacienta horší prognózu a rozsáhlejší chirurgickou či onkologickou léčbu, která přináší i značnou mutilaci pacienta. Časný záchyt malignit je jedním z nejdůležitějších faktorů úspěšnosti léčby (2). Proto je snaha vyvíjet nové diagnostické, pokud možno neinvazivní metody pro hodnocení prekancerózních a časných neoplastických změn. Zavedení endoskopických technik s vysokým rozlišením vedlo k lepší vizualizaci vaskulárních a epiteliálních struktur a jejich patologických změn a tím k přesnější a časnější diagnostice. Konvenčním bílým světlem jsou zobrazeny pouze makroskopicky zřetelné, většinou již pokročilé léze. Optické endoskopické metody jsou schopné zobrazit i léze velikosti několika milimetrů, neviditelné pomocí bílého světla. Přestože „zlatým“ standardem pro diagnostiku suspektní nádorové léze zůstává histopatologické vyšetření, metody tzv. „biologické“ endoskopie přispívají k redukci množství zbytečných biopsií a minimalizují počet falešně negativních výsledků (3). V současnosti je k dispozici větší množství endoskopických metod, ale dosud neexistuje jediná „ideální“ metoda. Některé z nich, např. chromoendoskopie s barvením sliznic Lugolovým roztokem mají limitace použití v oblasti respiračního traktu vzhledem k vysokému riziku aspirace. Při výběru hraje roli více faktorů – použití pro celou populaci nebo v rámci screeningu vysoce rizikových pacientů, v ambulantních podmínkách při primárním záchytu onkologického onemocnění nebo v rámci sledování pacientů po chirurgické/kombinované léčbě, případně pro použití na operačním sále s cílem detekovat hranice suspektní léze (4).
Endoskopické metody jsou schopné detekovat tzv. intraepiteliální papilární kapilární kličky (IPCL – intra-epithelial papillary capillary loops), což jsou cévní změny, které vznikají sekundárně v důsledku epiteliálního kancerogenního stimulu (5). Charakteristika a uspořádání povrchových cév je dynamická a podléhá změnám v průběhu přechodu od prekancerózních až k maligním změnám. Při rozvoji epiteliálních karcinomů dochází na začátku k prodlužování a rozšiřování existujících kapilár, následně transformací prekancerózních lézí do maligních stadií se vytvářejí cévy bez pravidelné organizace kapilár a v plně rozvinutých stadiích nádorového onemocnění dochází k úplné ztrátě mikroarchitektoniky cévní pleteně. Alterace cévního uspořádání se stává více zřetelná v oblasti těžkých high-grade dysplastických změn ve srovnání s low-grade dysplazií (3).
Optické endoskopické metody dělíme do dvou skupin (tab. 1). V ORL oblasti se více uplatňují horizontální metody, které zobrazují povrch sliznice a penetrují minimálně do hloubky vyšetřované tkáně. Patří mezi ně autofluorescence, fotodynamická diagnostika, zvětšovací a kontaktní endoskopie, narrow band imaging (6). Mezi vertikální metody, které zohledňují hloubku invaze, a zobrazují tak různé vrstvy sliznice, patří konfokální endomikroskopie a optická koherentní tomografie. Vertikální metody se v ORL používají pouze v experimentálním režimu (6).
Tab. 1. Rozdělení optických endoskopických zobrazovacích metod 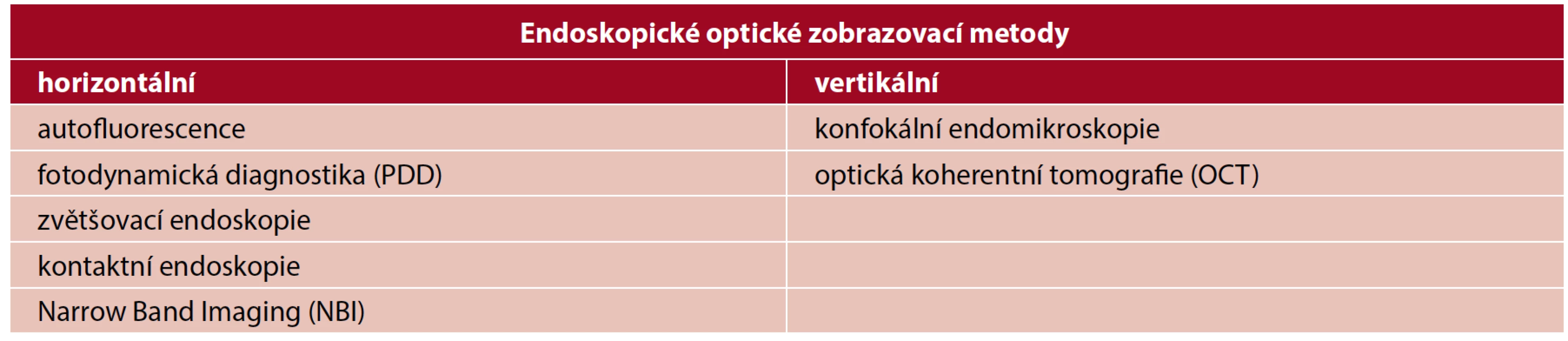
VERTIKÁLNÍ OPTICKÉ ENDOSKOPICKÉ METODY
Konfokální endomikroskopie
Metoda byla primárně vyvinuta pro gastroenterology. Umožňuje vyšetření sliznice ve třech rozměrech in vivo a vyšetření pod zvětšením s eliminací světla mimo ohnisko, zároveň poskytuje detailní histopatologický obraz i hlubších podslizničních vrstev s vysokým rozlišením při dostatečném zvětšení zobrazit histologické detaily nad bazální membránou (7). V současné době jsou k dispozici miniaturizované sondy konfokálního endomikroskopu, které lze vsunout pracovním kanálem flexibilního endoskopu (7). Konfokální endomikroskop velice rychle skenuje tkáň ve stejné hloubce (ohniskové rovině), zaznamenává obrazy z mnoha sousedních ohniskových bodů a vytváří dvourozměrný obraz, změnou ohniska pak ze série fokálních rovin vytváří 3D obraz bez ztráty rozlišení a v reálném čase. Hodnocení získané 3D struktury in vivo je nazváno „virtuální biopsie“ (8). K zobrazení buněčných jader se využívá lokální aplikace acriflavin – hydrochlorid a intravenózně podaný fluorescein. Metoda našla využití ve vyšetřování Barretova jícnu, ulcerózní kolitidy a v diagnostice neoplazií gastrointestinálního traktu (9–11). Limitací použití v ORL oblasti, speciálně v oblasti hrtanu, je nedostatečná penetrace světla celou tloušťkou epitelu až k bazální membráně, a nelze tak jasně odlišit high-grade dysplazie od časného stadia invazivního karcinomu (12).
Optická koherentní tomografie (OCT)
Jde o neinvazivní topografickou zobrazovací a diagnostickou metodu, která v extrémně vysoké kvalitě mikrometrového rozlišení umožňuje zobrazení mikrostruktury biologických tkání (tenké vrstvy kůže a sliznice, sítnice oka, zubu, ale i sliznice hlasivek) v transverzálním průřezu (13, 14). Umožňuje zobrazení patologie tkáně in situ v reálném čase, bez potřeby excize tkáně. Fyzikální princip OCT je analogický s ultrazvukem (6) s tím rozdílem, že OCT pro snímání biologických tkání nepoužívá akustické vlny, ale záření blízké infračervenému spektru, které je schopno proniknout výrazně hlouběji (1 až 3 mm). Mikroarchitektura biologických tkání je zobrazena pomocí měření časového opoždění odrazu a intenzity zpět odraženého a pohlceného optického signálu. Technologie umožňuje zobrazení s vysokým rozlišením 1,5–15 µm (13). Díky dosahovanému vysokému tkáňovému rozlišení lze metodu použít v laryngologii k peroperačnímu určení rozsahu slizničního postižení a rovněž k určení hloubky invaze léze do jednotlivých vrstev sliznice. Limitací metody je hodnocení granulační tkáně a neschopnost dostatečně zobrazit detaily buněk ke zhodnocení stupně dysplazie (14, 15). Metoda je dosud v ORL oblasti užívána spíše v experimentálním režimu.
HORIZONTÁLNÍ OPTICKÉ ENDOSKOPICKÉ METODY
Autofluorescence
Využívá rozdílu různých koncentrací fluoreskujících biomolekul, jako jsou elastin, kolagen a nikotinamidadenindinukleotid (NADH), v normální tkáni a neoplastické lézi. Ve sliznici hrtanu se běžně nacházejí porfyriny, elastin, kolagen a NADH. Tyto molekuly mají schopnost fotoluminiscenčního záření, tzv. autofluorescence, a jsou nazývány fluorofory. Biologicky odlišné tkáně se zvýrazňují při osvitu modrého světla o vlnové délce 400–475 nm. Vzhledem k tomu, že koncentrace fluoroforů je rozdílná ve zdravé sliznici a ve sliznici nádorově změněné, dochází v případě nádorových změn k patrnému útlumu autofluorescence (6). Zdravá sliznice je zobrazována jasně zeleně a patologická sliznice pak modrofialově (16). V otorinolaryngologii byla využívána v oblasti laryngu i dutiny ústní a orofaryngu. K diagnostice tumorů hrtanu autofluorescenci prvně použili Harries et al. (17). Je využívána jak v ambulantním režimu, tak v průběhu direktních laryngoskopií v celkové anestezii. Umožňuje lepší detekci drobných lézí, které nemusejí být patrné v konvenčním bílém světle, dále multifokální léze, větší rozsah a metachronní tumory (18). Negativem je poměrně nízká specificita v důsledku většího počtu falešně pozitivních výsledků. Naopak falešná negativita je způsobena např. při hodnocení kořene jazyka, patrových tonzil nebo nekrotické tkáně, kde bakteriální flóra s produkcí různých fluoroforů interferuje s výsledkem vyšetření (18).
Fotodynamická diagnostika (PDD)
Detekuje emitované fluorescenční světlo. Rozdílem ve srovnání s autofluorescencí je, že sliznice vyšetřované oblasti je předem ošetřena lokální aplikací kyseliny 5-aminolevulové (ALA), která vyvolává fluorescenci nádorových buněk (19). ALA sama o sobě není fluorofor, ale účastní se syntézy hemu. Dvě molekuly ALA kondenzují za vzniku porfobilinogenu, který je dále metabolizován na fluorofor-protoporfyrin IX (PTP). Po začlenění železa vzniká hem, který již fluoroforem není. Nádorové buňky jsou více propustné pro ALA a zpomalují proměnu na hem. Výsledkem aplikace ALA na nádorovou sliznici je oranžovo-červená fluorescence po ozáření UV světlem. Zdravá sliznice vyzařuje standardní zelenou autofluorescenci. Využití v laryngologii je limitováno obtížnou přípravou pacienta, kdy se ALA aplikuje ve formě inhalace, a vyšetření je pak prováděno s dvouhodinovým odstupem. Metoda není rutinně v praxi využívána (6).
Zvětšovací endoskopie
Slouží k dokonalému zobrazení IPCL, umožňuje dosáhnout až 150násobného zvětšení (14). Optimální obraz lze dosáhnout použitím HDTV s vysokým rozlišením – více než 1 milion obrazových bodů (20) nebo s ultravysokým rozlišením 4K – více než 8 milionů obrazových bodů. Zvětšovací endoskopy spolu s HDTV nebo 4K zobrazením umožňují určit malignitu s vysokou pravděpodobností ještě před stanovením histologické diagnózy („optická biopsie“) (20). Sliznici lze pozorovat ze vzdálenosti několika milimetrů. Pro gastroenterologii jsou k dispozici zvětšovací flexibilní endoskopy vybavené zoomovacím systémem (21). Jejich rozměry nedovolují použití při transnazálním vyšetření v ORL oblasti. Proto se provádí pouze pomocí rigidních optik, v ambulantním režimu je limitována pouze na dutinu ústní a orofarynx. Vyšetření hrtanu a hypofaryngu musí být prováděno v celkové anestezii, kdy je rigidní endoskop zaváděn tubusem direktního laryngoskopu. Při kombinaci zvětšovací endoskopie a NBI je možné dosáhnout vysokého zvětšení, které umožňuje detailněji pozorovat změny vaskularizace sliznice a přesněji odlišit benigní změny od maligních (6).
Kontaktní endoskopie
Je jednou z metod, které umožňují rozlišení na buněčné úrovni. Využívá speciální rigidní endoskopy, které jsou v přímém kontaktu se slizničním povrchem, který je pozorován pod 60–150 násobným zvětšením. Při použití endoskopické kamery a 24palcového monitoru je zvětšení až 1100násobné (22). K zobrazení nukleových kyselin je lokálně aplikována methylenová modř, buněčné jádro je zbarveno tmavě modře v kontrastu se světlou cytoplazmou (22). Nádorové buňky mají vysokou mitotickou aktivitu, proto jsou methylenovou modří výrazně zbarveny. Rovněž tak krevní cévy jsou modří odbarveny, proto je nádorová neoangiogeneze při endoskopii dobře detekovatelná. V současné době jsou kontaktní endoskopy v ORL oblasti používány v kombinaci s NBI systémem a hlavním cílem není pozorování buněčných atypií, ale podrobné zobrazování cévních struktur (23). Dle stupně mikrovaskularizace je možné odlišit léze charakteru hyperplazie, dysplazie, karcinom in situ nebo invazivního karcinomu. Prvotní využití bylo v gynekologii (sliznice děložního čípku), v otorinolaryngologii především v oblasti dutiny ústní a orofaryngu, ale i hypofaryngu, laryngu, dutině nosní a nosohltanu (24, 25).
Narrow Band Imaging
Metoda využívající charakteristiky spektra filtrovaného světla ke zlepšení kontrastu mezi epitelem a slizničními cévami (2). NBI systém se skládá ze světelného zdroje, kamerové jednotky, videoendoskopu nebo endoskopické kamerové hlavy a speciálního obrazového procesoru. Světelný zdroj obsahuje sadu filtrů, které propouštějí pouze specifické vlnové délky – modré (415 nm) a zelené světlo (540 nm). Modré světlo odpovídá absorpčnímu spektru hemoglobinu, penetruje pouze do povrchových vrstev sliznice a tím lépe zobrazuje kapiláry – intraepiteliální papilární kapilární kličky (IPCL). Zelené světlo (540 nm) penetruje do hlubších vrstev a zvýrazňuje podslizniční cévní pleteně (4). V definitivním obraze je mikrovaskularizace sliznice zobrazena hnědě a podslizniční cévy azurově. Dochází tak k podstatnému zvýšení kontrastu mezi cévami a okolní tkání a vzhledem k tomu mohou být rozpoznány i velmi diskrétní změny v mikrovaskulární architektonice (4). Normální kapiláry jsou dobře větvené kličky, zatímco suspektní prekancerózní léze nebo malignita se projeví ohraničeným okrskem změněných kapilár v podobě hnědých teček - brown dots (obr. 1). Poprvé byla metoda aplikována v Japonsku v rámci dispenzarizace pacientů léčených pro karcinom jícnu, kde byla zaznamenána vysoká diagnostická hodnota v detekci synchronních nebo metachronních tumorů, zvláště v oblasti orofaryngu a hypofaryngu (1). Dle dosud publikovaných prací má NBI endoskopie především místo v předoperační diagnostice suspektních prekancerózních a nádorových lézí, dále peroperačně s cílem detekce resekčních okrajů za účelem provádění cílených biopsií a případné identifikace synchronních (duplicitních) nádorů a nakonec i v rámci dispenzarizace pacientů po chirurgické, onkologické nebo kombinované léčbě (4) (tab. 2).
Obr. 1. Dlaždicobuněčný karcinom orofaryngu (kořene jazyka) vlevo v NBI (IPCL Vb typu dle Ni) 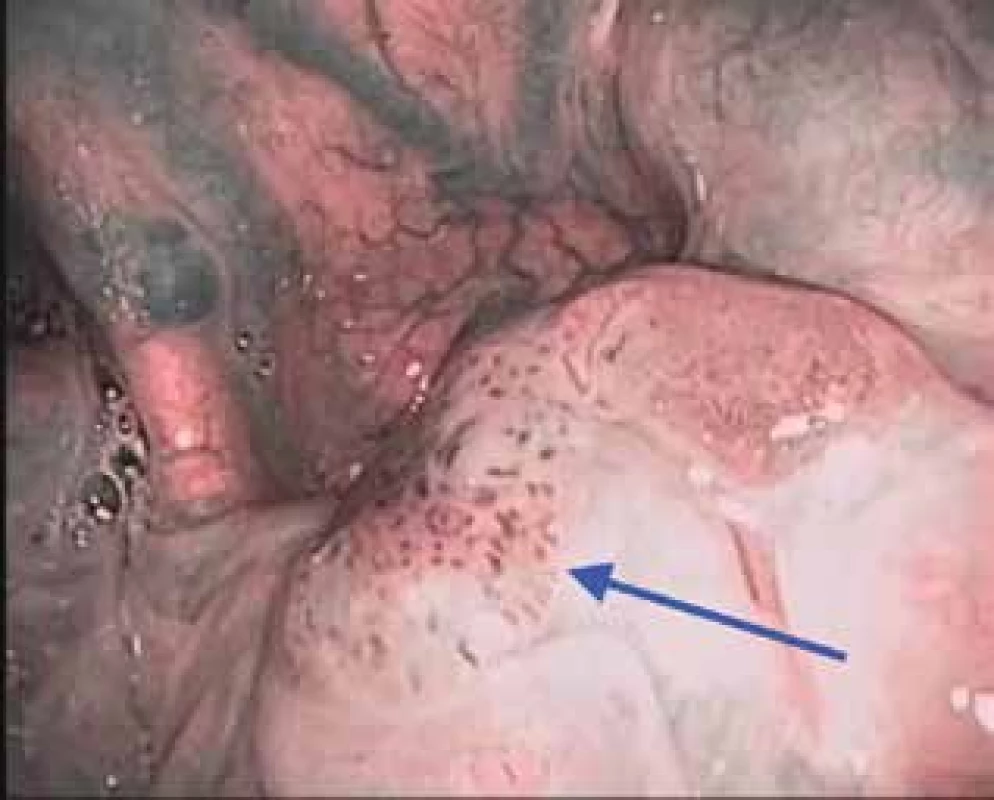
Tab. 2. Možnosti využití NBI endoskopie 
Pro účely NBI jsou v otorinolaryngologii využívané flexibilní endoskopy v ambulantním režimu nebo rigidní videoendoskopické systémy především na operačním sále. V literatuře se udává poměrně vysoká senzitivita i specificita NBI endoskopie u pacientů s karcinomem hlavy a krku (91,3–100 %, resp. 91,6 až 98 %) (4). Jedná se o neinvazivní, bezpečnou a rychlou vyšetřovací metodu, která by měla být součástí diagnostických algoritmů suspektních nádorových lézí orofaryngu (obr. 1), hypofaryngu (obr. 2) a hrtanu (obr. 3).
Obr. 2. Dlaždicobuněčný karcinom hypofaryngu vlevo se šířením na aryepiglotickou řasu vlevo v NBI (IPCL Vc typu dle Ni) 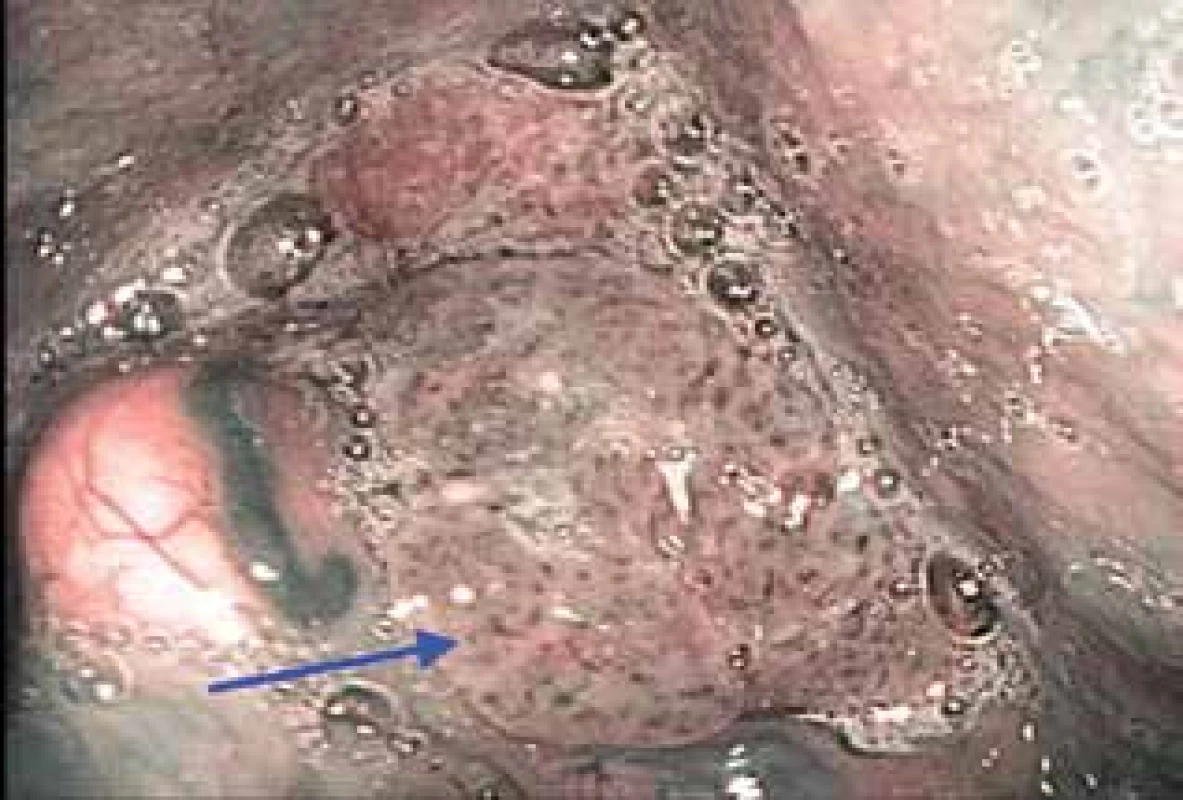
Obr. 3. Patologická vaskularizace v NBI (IPCL Va typu dle Ni) v oblasti přední komisury při leukoplakii hlasivek (značeno modrým kruhem) 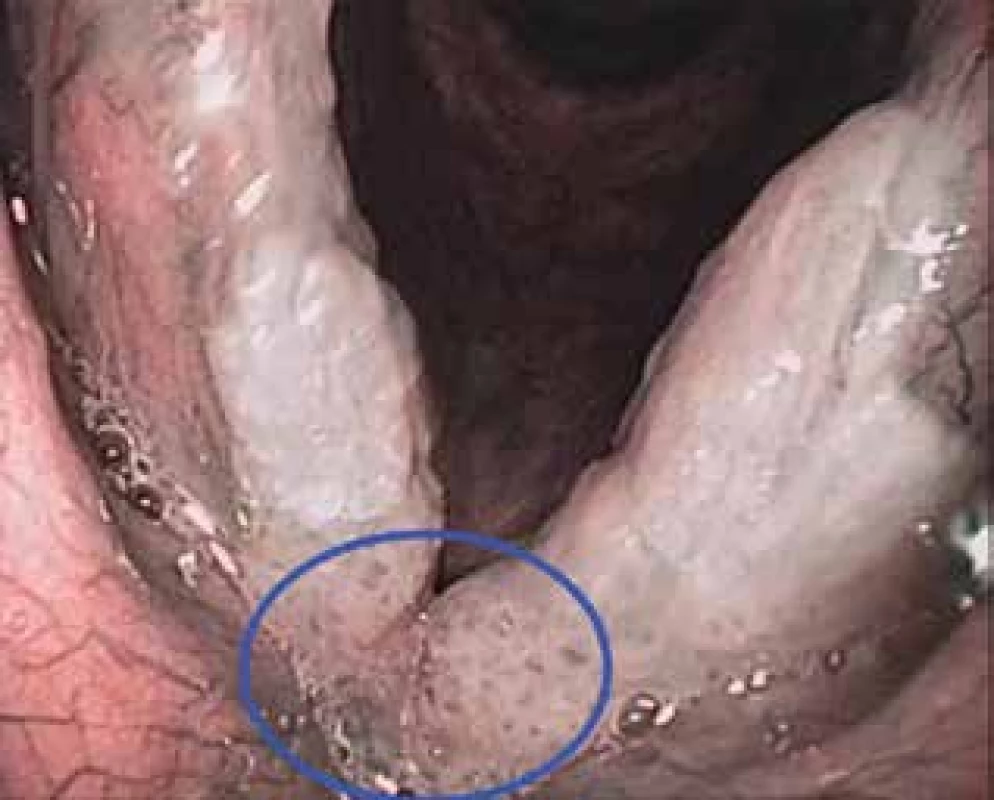
Existují různé klasifikace IPCL změn pro oblast horního aerodigestivního traktu, nejpoužívanější je klasifikace dle Ni (2011). Je současně první klasifikací epiteliální vaskularizace pro hodnocení patologických změn v oblasti hrtanu (26). Charakter změn IPCL v NBI endoskopickém obraze je rozdělen do pěti typů od fyziologického vzhledu (typ I) až po nádorové změny (typ V) (tab. 3).
Tab. 3. Klasifikace intraepiteliálních papilárních kapilárních kliček (Ni et al., 2011) (1) 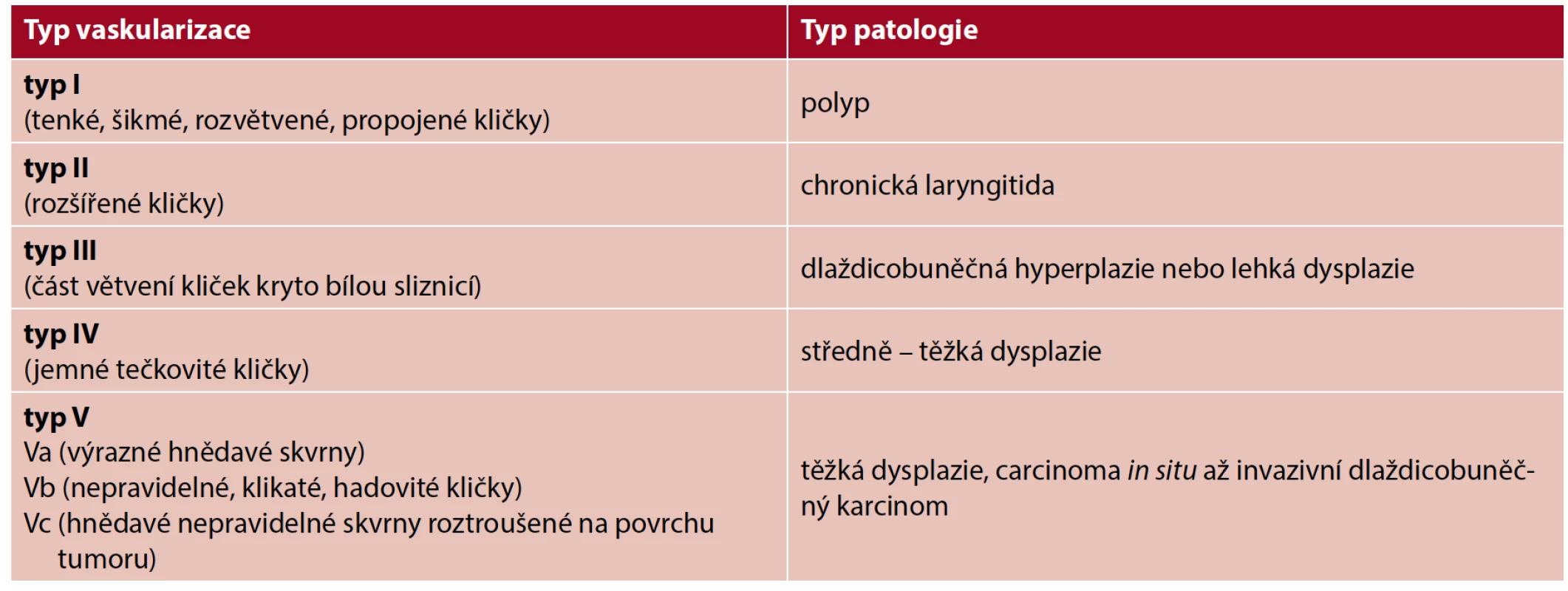
LIMITY NBI ENDOSKOPIE
Obraz v NBI nelze validně posoudit v případě hyperkeratózy nebo leukoplakie, při stáze slin a přítomnosti vazkých hlenů (2, 27). Falešně negativní výsledek může být v případě podslizničních tumorů. Naopak, falešně pozitivní výsledek může představovat nález chronické laryngitidy, změny po radioterapii nebo recidivující respirační papilomatóza (RRP). U RRP NBI dokáže detekovat ložiska papilomů neviditelných v bílém světle (20) (obr. 4).
Obr. 4. Vícečetné léze papilomů v oblasti obou vestibulárních řas hrtanu v NBI (IPCL IV. typu dle Ni, značeno modrými šipkami) 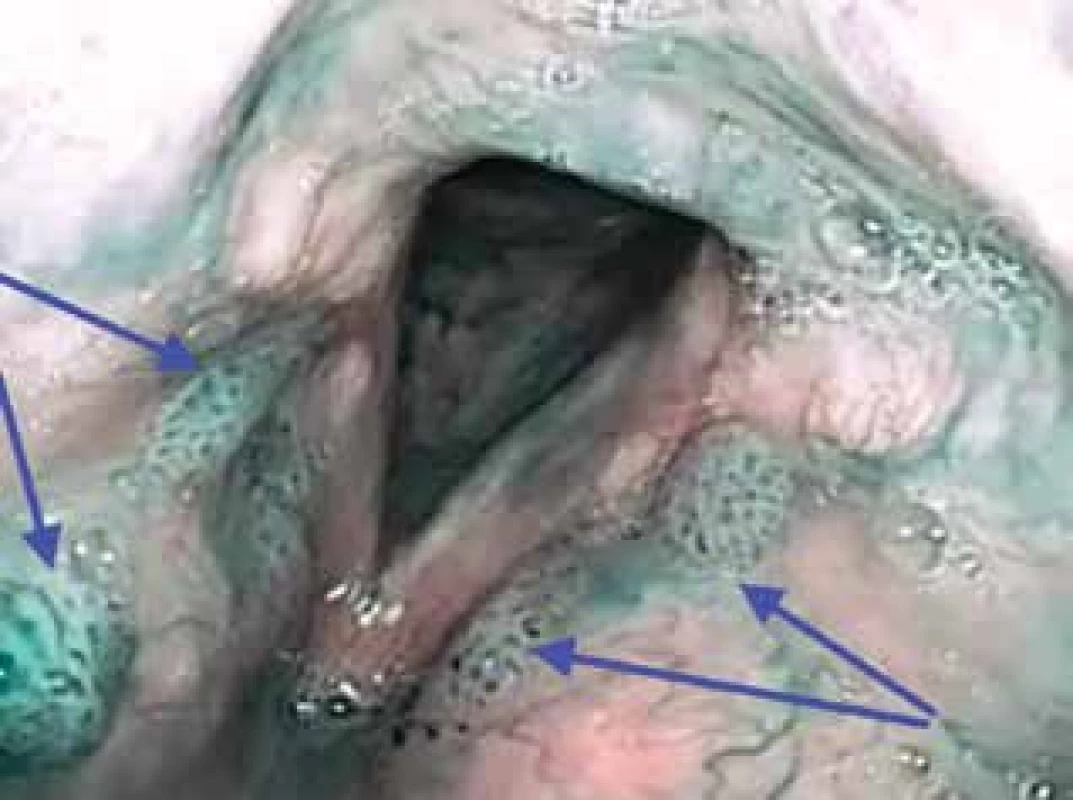
ZÁVĚR
Všechny uvedené optické endoskopické metody přispívají ke zlepšení tzv. předhistologické diagnostiky slizničních lézí. Nejvhodnější by bylo používat kombinaci horizontálních a vertikálních metod. Limitací však je časová a finanční náročnost. V diagnostice slizničních nádorů hlavy a krku se používají především horizontální metody. Nejdostupnější z nich je narrow band imaging, která je neinvazivní, pacientem dobře tolerovaná a ve srovnání s jinými metodami i časově nenáročná. Vzhledem ke svým pozitivům by měla být součástí diagnostického algoritmu v předhistologickém vyšetřování, pro zlepšení výtěžnosti vyšetření ideálně v kombinaci se zvětšovací nebo kontaktní endoskopií.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Jana Šatanková
Klinika otorinolaryngologie a chirurgie hlavy a krku FN
Sokolská 581, 500 05 Hradec Králové
e-mail: jana.satankova@fnhk.cz
Zdroje
- Sano Y, Kobayashi M, Hamamoto Y, et al. New diagnostic method based on color imaging using narrowband imaging (NBI) endoscopy system for gastrointestinal tract. Gastrointest Endosc 2001; 53(5): AB125.
- Lukeš P, Zábrodský M, Lukešová E, a kol. Narrow Band Imaging (NBI) – endoskopická metoda pro diagnostiku karcinomů hlavy a krku. Otorinolaryng a Foniat (Prague) 2013; 62(4): 173–179.
- Piazza C, Del Bon F, Peretti G, et al. „Biologic endoscopy“: optimization of upper aerodigestive tract cancer evaluation. Curr Opin Otolaryngol Head Neck Surg 2011; 19(2): 67–76.
- Piazza C, Del Bon F, Peretti G, et al. Narrow band imaging in endoscopic evaluation of the larynx. Curr Opin Otolaryngol Head Neck Surg 2012; 20(6): 472–476.
- Lin YC, Wang WH, Lee KF. Value of narrow band imaging endoscopy in early mucosal head and neck cancer. Head Neck 2012; 34(11): 1574–1579.
- Lukeš P, Lukešová E, Zábrodský M, a kol. Endoskopické optické zobrazovací metody v diagnostice nádorů hrtanu. Čas. Lék. čes. 2017; 156(4): 192–196.
- Volgger V, Girschick S, Ihrler S, et al. Evaluation of confocal laser endomicroscopy as an aid to differentiate primary flat lesions of the larynx. A prospective clinical study. Head Neck 2016; 38(Suppl 1): E1695–E1704.
- Kiesslich R, Burg J, Vieth M, et al. Confocal laser endoscopy for diagnosing intraepithelial neoplasias and colorectal cancer in vivo. Gastroenterology 2004; 127(3): 706–713.
- Goetz M, Kiesslich R. Confocal endomicroscopy: in vivo diagnosis of neoplastic lesions of the gastrointestinal tract. Anticancer Res 2008; 28(1B): 353–360.
- Hurlstone DP, Baraza W, Brown S, et al. In vivo real-time confocal laser scanning endomicroscopic colonoscopy for the detection and characterization of colorectal neoplasia. Br J Surg 2008; 95(5): 636–645.
- Kobayashi M, Neumann H, Hino S, et al. Influence of reviewers’ clinical backgrounds on interpretation of confocal laser endomicroscopy findings. Endoscopy 2016; 48(6): 521–529.
- Hughes OR, Stone N, Kraft M, et al. Optical and molecular techniques to identify tumor margine within the larynx. Head Neck 2010; 32(11): 1544–1553.
- Tearney G, Brezinski M, Bouma S, et al. In vivo endoscopic optical biopsy with optical coherence tomography. Science 1997; 276(5321): 2037–2039.
- Wong BJ, Jackson RP, Guo S, et al. In vivo optical coherence tomography of the human larynx: normative and benign pathology in 82 patients. Laryngoscope 2005; 115(11): 1904–1911.
- Kraft M, Luerssen K, Lubatschowski H, et al. Technique of optical coherence tomography of the larynx during microlaryngoscopy. Laryngoscope 2007; 117(5): 950–952.
- Arens C, Dreyer T, Glanz H, et al. Indirect autofluorescence laryngoscopy in the diagnosis of laryngeal cancer and its precursor lesions. Eur Arch Otorhinolaryngol 2004; 261(2): 71–76.
- Harries ML, Lam S, MacAulay C, et al. Diagnostic imaging of the larynx: autofluorescence of laryngeal tumors using the helium – cadmium laser. J Laryngol Otol 1995; 109(2): 108–110.
- Arens C, Reussner D, Woenkhaus J, et al. Indirect fluorescence laryngoscopy in the diagnosis of precancerous and cancerous laryngeal lesions. Eur Arch Otorhinolaryngol 2007; 264(6): 621–626.
- Abels C, Fritsch C, Bolsen K, et al. Photodynamic therapy with 5-aminolaevulinic acid – induced porphyrins of an amelanotic melanoma in vivo. J Photochem Photobiol B 1997; 40(1): 76–83.
- Lukes P, Zabrodsky M, Lukesova E, et al. The role of NBI HDTV Magnifying endoscopy in the prehistologic diagnosis of laryngeal papillomatosis and spinocellular cancer. Biomed Res Int 2014; 2014 : 285486.
- Inoue H, Kaga M, Ikeda H, et al. Magnification endoscopy in esophageal squamous cell carcinoma: a review of the intrapapillary capillary loop classification. Ann Gastroenterol 2015; 28(1): 41–48.
- Andrea M, Dias O, Santos A. Contact endoscopy during microlaryngeal surgery: a new technique for endoscopic examination of the larynx. Ann Otol Rhinol Laryngol 1995; 104(5): 333–339.
- Arens C, Voigt-Zimmermann S. Contact endoscopy of the vocal folds in combination with narrow band imaging (compact endoscopy). Laryngorhinootol 2015; 94(3): 150–152.
- Puxeddu R, Sionis S, Gerosa C, et al. Enhanced contact endoscopy for the detection of neoangiogenesis in tumors of larynx and hypopharynx. Laryngoscope 2015; 125(7): 1600–1606.
- Warnecke A, Averbeck T, Leinung M, et al. Contact endoscopy for the evaluation of the pharyngeal and laryngeal mucosa. Laryngoscope 2010; 120(2): 253–258.
- Ni XG, He S, Xu ZG, et al. Endoscopic diagnosis of laryngeal cancer and precancerous lesions by narrow band imaging. J Laryngol Otol 2011; 125(3): 288–296.
- Staníková L, Šatanková J, Kučová H, et al. The role of narrow-band imaging (NBI) endoscopy in optical biopsy of vocal cord leukoplakia. Eur Arch Otorhinolaryngol 2017; 274(1): 355–359.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Profesionální onemocnění hlášená v České republice v roce 2020
- Znalosti sester o dezinfekci vybraných předmětů a ploch při poskytování zdravotních služeb
- Algoritmus diferenciální diagnostiky urologických symptomů v primární péči
- Zlatá medaile České lékařské společnosti J. E. Purkyně prof. MUDr. Zdeňku Mračkovi
- Historie infekčních nemoci – nekončící příběh
- Pacient vegan: nutriční specifika rostlinné stravy
- Hepatotoxický potenciál výživových a dietetických suplementov
- Optické endoskopické metody v diagnostice nádorů hlavy a krku
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pacient vegan: nutriční specifika rostlinné stravy
- Historie infekčních nemoci – nekončící příběh
- Hepatotoxický potenciál výživových a dietetických suplementov
- Znalosti sester o dezinfekci vybraných předmětů a ploch při poskytování zdravotních služeb
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



