-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nastal čas uplatnění personalizované medicíny v psychiatrii?
Has the time come for more personalised medicine in psychiatry?
In psychiatry, personalised medicine in terms of treatment tailored to the individual patient can currently only be based on the knowledge of the mode of action of psychotropic drugs, their pharmacokinetics, and on predictive tests, e.g., QEEG methods. The use of molecular biology, genomics, and proteomics in psychiatry still lags behind other medical fields.
Key words:
personalised medicine, psychiatry, psychopharmacology.
Autoři: C. Höschl
Působiště autorů: Ředitel: prof. MUDr. Cyril Höschl, DrSc., FRCPsych. ; Psychiatrické centrum, Praha
Vyšlo v časopise: Prakt. Lék. 2010; 90(8): 502-505
Kategorie: Aktuality/zprávy/recenze
Souhrn
Personalizovaná medicína ve smyslu individuální léčby „šité na míru“ může v současné době v psychiatrii vycházet ze znalostí mechanismu účinku psychofarmak, farmakokinetiky a rozvoje prediktivních testů, např. pomocí QEEG. Využití molekulární biologie, genomiky a proteomiky v psychiatrii zaostává za ostatními obory medicíny a klinická psychiatrie k němu dosud nedospěla.
Klíčová slova:
personalizovaná medicína, psychiatrie, psychofarmakologie.Úvod
Personalizovaná medicína je podle jedné z definic (http://www.pwc. com/personalizedmedicine) model medicíny, jenž zdůrazňuje systematické užití informace o jednotlivém pacientovi k výběru a optimalizaci preventivní péče a léčby toho kterého jednotlivce. Personalizovaná medicína může být široce definována jako „produkt“ a služby, které přímo či nepřímo využívají genomiku a proteomiku a kapitalizují na trendech k pohodlí a konzumerismu, aby umožnily individuální přístup (šití na míru) v preventivní a léčebné péči. Personalizovaná medicína se často definuje jako „správná léčba správnému jedinci ve správný čas“.
Tento přístup v psychiatrii začíná už znalostí mechanismu účinku psychofarmak a využitím těchto znalostí, jakož i zkušeností, s jejich vedlejšími a nežádoucími účinky k individualizaci léčby. Například u antipsychotik víme, že jejich hlavním mechanismem účinku je kompetitivní antagonismus na dopaminových D2 receptorech. Ty se v mozku vyskytují ve čtyřech drahách, nepočítáme-li corpus callosum:
- v dráze mezokortikální,
- nigrostriatální,
- mezolimbické, a
- tuberoinfundibulární.
Je-li mezokortikální dráha hypoaktivní, vede to v klinickém obrazu k výskytu negativních příznaků (emoční oploštění, myšlenkové ochuzení, sociální stažení), abulii a kognitivnímu deficitu.
Je-li příliš antagonizována dráha nigrostriatální, vede to k rozvoji extrapyramidových příznaků.
Je-li naopak hyperaktivní dráha mezolimbická, vede to k rozvoji příznaků pozitivních (bludy, halucinace, neklid) a její potlačení k jejich korekci. To je to, čeho chceme antipsychotiky, například u schizofrenie, dosáhnout.
Naopak tuberoinfundibulární dráha normálně tonicky inhibuje sekreci prolaktinu a při její inhibici antidopaminergním působením antipsychotik dochází k elevaci prolaktinu se všemi klinickými důsledky (poruchy menstruace, galaktorea, poruchy libida).
Antipsychotika tedy vykonávají svým mechanismem účinku na jednotlivých úrovních mozku odlišné změny, jejichž relativní proporce je dána mj. různou vulnerabilitou jednotlivce k těmto změnám, danou převážně geneticky. Řada nežádoucích účinků, jako extrapyramidové poruchy, jsou již na úrovni vývoje psychofarmak dále korigovány – v tomto případě anticholinergním působením, což vede sice k omezení extrapyramidové symptomatiky, ale za cenu dalšího rozšíření spektra vedlejších účinků o příznaky anticholinergní, jako je:
- sucho v ústech,
- poruchy akomodace,
- retence moči,
- poruchy motility zažívacího traktu, aj.
K tomu u antipsychotik se širším receptorovým profilem přistupují vedlejší účinky dané jejich působením např. antihistaminovým (H1), jako je sedace a přibývání hmotnosti, antiadrenergním (α1), jako jsou ortostatické hypotenze a kolapsy, aj. Navíc se mohou objevit nežádoucí účinky jako je alergie, popř. fotosenzitivita. Při znalosti proporce výskytu těchto účinků jich lze někdy využívat právě k individualizované léčbě. Tak např. nárůst hmotnosti, který je více vyjádřen u některých antipsychotik (olanzapin, klozapin) než u jiných (aripiprazol), lze využít při rozhodování o antipsychotické léčbě u leptosomních, popř. kachektických, respektive obézních pacientů. Je přitom žádoucí brát v úvahu také další tělesné aspekty a rizikové faktory, jako je sklon k rozvoji metabolického syndromu, diabetes mellitus II. typu, k arytmiím apod.
Personalizovaná antipsychotická a antidepresivní léčba
Jemnější rozhodovací kritéria na základě současných znalostí lze uplatňovat při „šití na míru“ antipsychotické léčby s ohledem na profil psychopatologie, ať již příznaků v oblasti kognitivní, emoční, anebo neurologických. Ideální antipsychotikum by mělo správně zvyšovat dopaminergní aktivitu v prefrontální kůře, popř. stimulovat tamtéž D1 receptory, což by vedlo ke zlepšení kognitivních funkcí a k odstranění negativních a afektivních příznaků. Naopak blokáda D2 receptorů v nc. accumbens a ve striatu potlačuje pozitivní příznaky, jako jsou bludy a halucinace. Antagonismus na serotoninových 2A receptorech přispívá k příznivému ovlivnění negativních příznaků a afektivity a vykazuje neurotrofní účinky. Agonismus na adrenergních α2 receptorech může přispívat k potlačení pozitivních příznaků podobně jako mírný agonismus na glutamátergních NMDA a AMPA receptorech. Facilitace cholinergního působení v kůře vede ke zlepšení kognitivních funkcí.
Celkově příznivé účinky má zvýšená exprese růstových faktorů a hudbou blízké budoucnosti může být i ovlivnění genové exprese a jiné genové manipulace s využitím genetického inženýrství. Dovedeme si představit, že personalizovaná medicína by mohla využít kombinace těchto zásahů.
Jestli tedy výše uvedené otočíme, můžeme shrnout, že
- antidopaminergní (D2) působení je příznivé na pozitivní příznaky, ale nepříznivé na rozvoj extrapyramidové symptomatiky a hyperprolaktinémie,
- antagonismus na 5HT2A receptorech příznivě ovlivňuje negativní příznaky a extrapyramidové příznaky,
- agonismus na 5HT1A receptorech příznivě ovlivňuje depresivní, úzkostné a možná i negativní příznaky,
- antagonismus na 5HT2C příznivě působí na depresi a úzkost,
- antagonismus na 5HT1D rovněž,
- anticholinergní působení (M1) naproti tomu zhoršuje kognitivní funkce a paměť a působí anticholinergní příznaky jako sucho v puse, poruchy vidění, zácpu a retenci moči, ¨
- antihistaminové (H1) působení vede k sedaci a nárůstu hmotnosti,
- antiadrenergní (α1) působení vede k hypotenzi a sexuálním dysfunkcím,
- blokáda re-uptake noradrenalinu působí příznivě na depresi a pozornost, a
- blokáda re-uptake serotoninu příznivě ovlivňuje depresi a úzkost.
Hrubá relativní proporce v afinitách k těmto receptorům a mechanismům u jednotlivých antipsychotik je uvedena v tabulce 1.
Tab. 1. Relativní receptorové afinity hlavních antipsychotik 2. generace 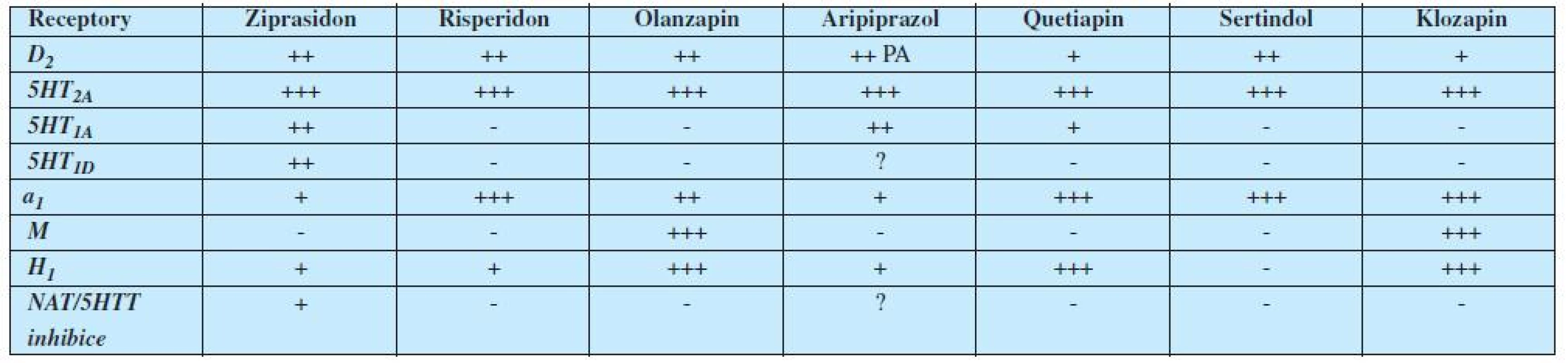
Legenda: PA = parciální agonista; T= transportér; D = dopamin; NA= noradrenalin; 5HT = serotonin; M= muskarin; H = histamin V tabulce 1 jsou uvedena pouze moderní antipsychotika II. generace. Vycházíme-li ale též ze znalosti mechanismu účinku klasických neuroleptik (antipsychotika I. generace – 1), pak můžeme na základě uvedeného sestavit mapu téměř všech hlavních nežádoucích účinků antipsychotik (tabulka 2). (2, 3).
Tab. 2. Nežádoucí účinky antipsychotik 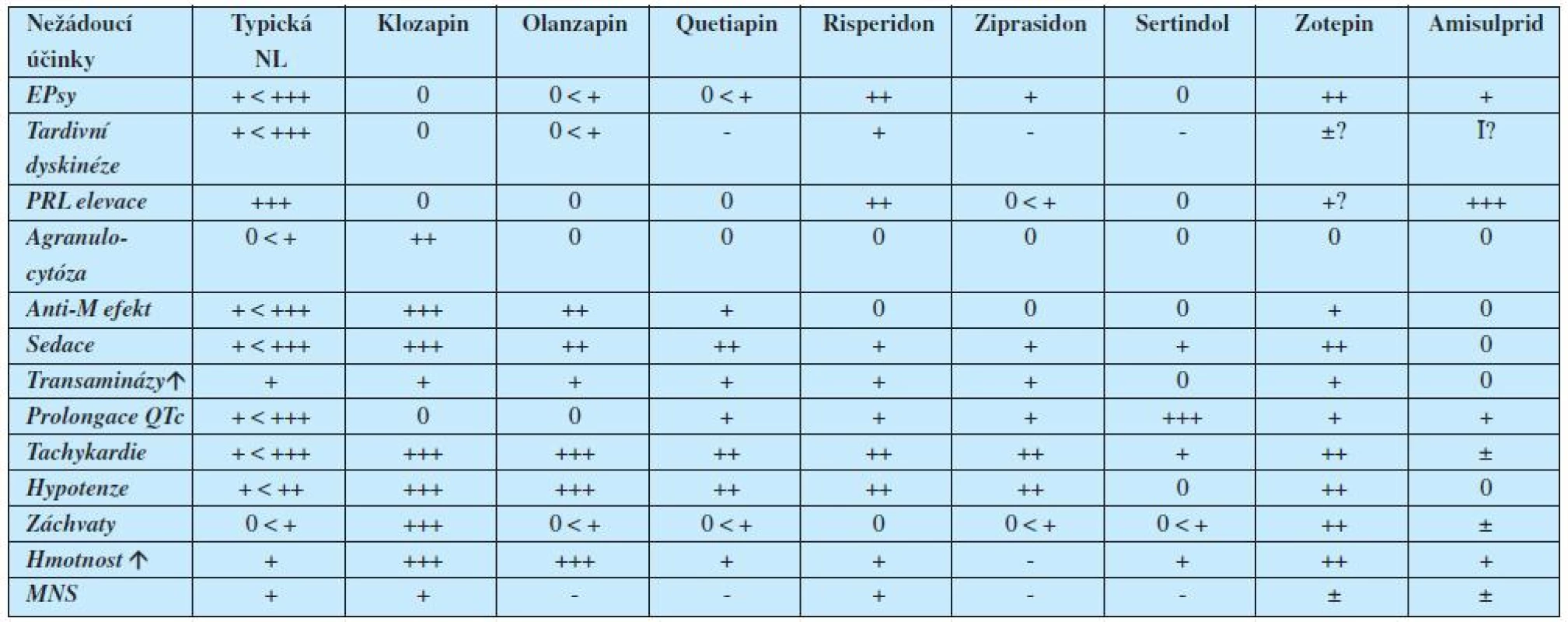
Legenda: NL =neuroleptika; EPsy = extrapyramidový syndrom; PRL = prolaktin; M = muskarinový receptor; MNS = maligní neuroleptický syndrom; Už první pohled na tabulku upozorňuje, že klasická antipsychotika se nehodí pro staré lidi, zejména vinou svého anticholinergního, sedativního a kardiogenního působení, vůči němuž jsou pacienti ve vyšších věkových skupinách vulnerabilnější. Klozapin a olanzapin by se zase pokud možno neměly dávat pacientům obézním a těm, u nichž je vysoké riziko rozvoje diabetes mellitus. Amisulprid není zase vhodný u žen rizikových pro karcinom mammy či tam, kde je na závadu gynekomastie.
Tabulka 3 zase ukazuje, co můžeme očekávat, když převádíme pacienta z jednoho antipsychotika na druhé. Výsledný efekt je důsledkem náhlé změny z receptorového profilu předchozího antipsychotika na receptorový profil antipsychotika následujícího (4).
Tab. 3. Klinické projevy přechodu z jednoho antipsychotika na druhé (tzv. switch). 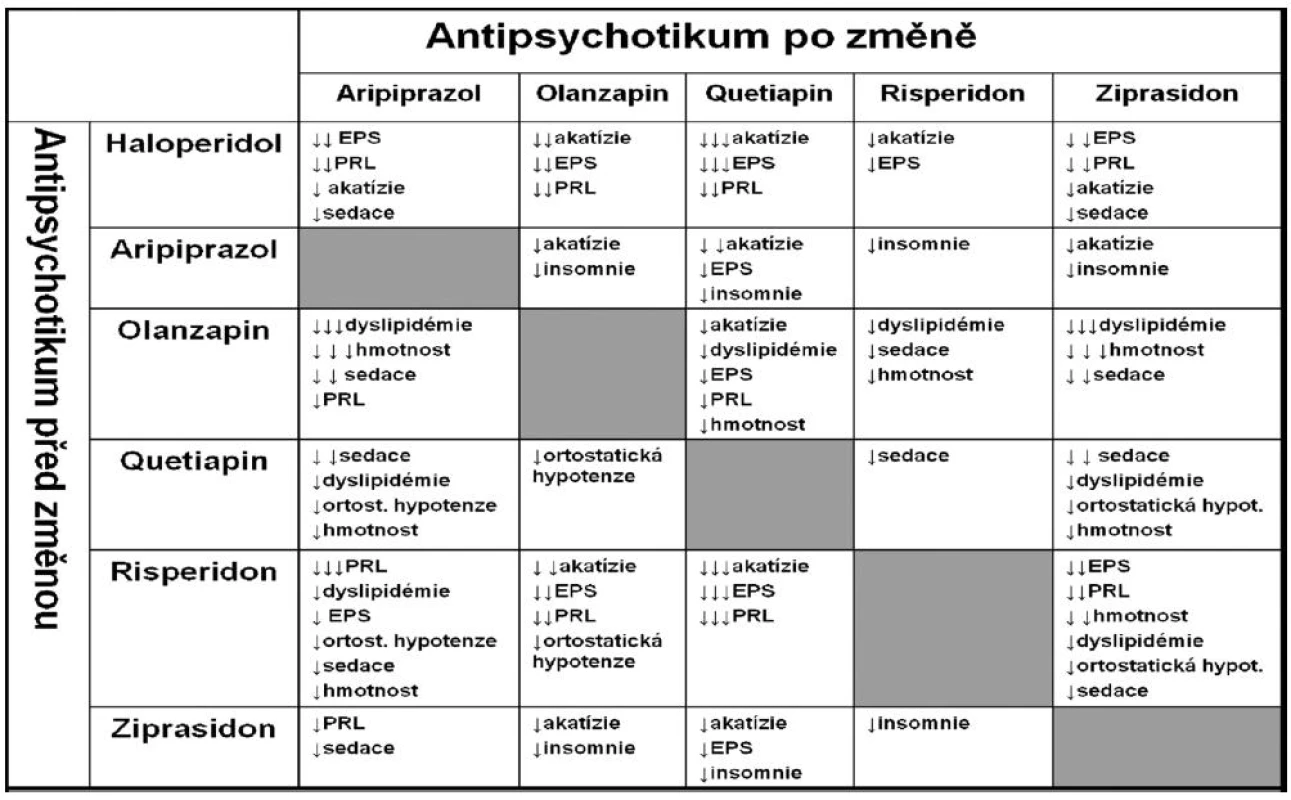
Legenda: PRL = prolaktin; (Upraveno podle Weidena, 2007). Velice důležitou roli při léčbě antipsychotiky hrají úvahy farmakogenetické, zaměřené na polymorfismus cytochromového systému P450 a z toho vyplývající rychlost odbourávání a lékové interakce. Hrubý nárys interakcí v oblasti psychofarmak ukazuje tabulka 4.
Tab. 4. Farmakogenetické úvahy při léčbě antipsychotiky: P450 a lékové interakce 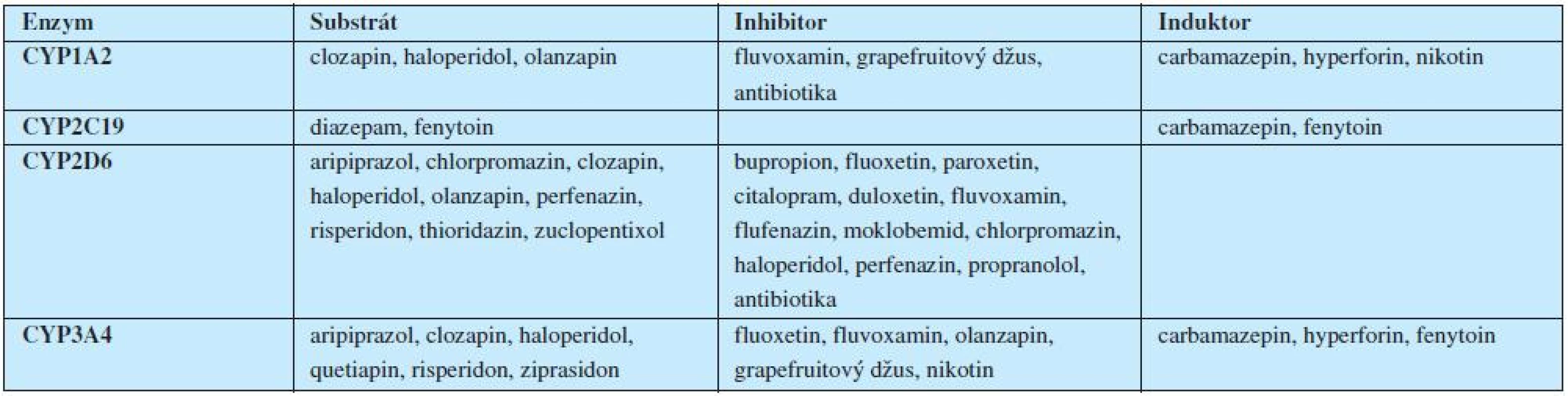
Úplně jinou oblastí individualizace psychofarmakologické léčby je predikce účinku antidepresiv s využitím kvalitativní elektroencefalografie, tzv. QEEG kordance (5). QEEG kordance je parametr, který je vypočítán z hodnot „nálože“ kvantitativního EEG s využitím rychlé Fourierovy transformace a který integruje absolutní a relativní hodnoty výkonnostního spektra. Kordance zřejmě souvisí s regionální mozkovou perfuzí a konkrétně v případě theta vln v prefrontálních svodech s regionální mozkovou perfuzí v oblasti předního cingula (Cg25), jehož aktivita koreluje s klinickými změnami projevů deprese. Je to údaj, jenž poskytuje informaci interpretovatelnou v kontextu pozitronové emisní tomografie (PET) a SPECT neurozobrazovacích studií deprese. V pracích, jež jsme publikovali, jsme opakovaně ukázali, že senzitivita a specificita, respektive pozitivní a negativní predikční hodnota QEEG kordance pro predikci terapeutické odezvy na určité antidepresivum u určitého pacienta již v prvním týdnu podání se pohybuje mezi 70–100 %, což je v porovnání se všemi laboratorními a neurofyziologickými metodami překvapivě slušný „výkon“.
Budoucnost personalizované léčby
Využití genomiky a proteomiky v psychiatrii je zatím, v porovnání s některými jinými obory medicíny, o něco pozadu. Nicméně otázku v názvu tohoto článku, zda nastal čas k uplatnění personalizované medicíny v psychiatrii, si již dnes můžeme zařadit do kontextu celé medicíny. V něm se zdá, že odpověď na ni bude velmi ovlivněna několika faktory.
Prvním je vliv farmaceutického průmyslu.
Zdá se totiž, že personalizovaná, a tedy mnohem specifičtější, medicína bude ve svých důsledcích dražší, neboť místo aby rozšiřovala indikační spektrum jednoho produktu farmaceutického průmyslu, tak bude toto spektrum zužovat. Zúžením cílové populace se invence, výroba a distribuce nových psychofarmak dále prodraží.
Dalším faktorem je zájem „diagnostického průmyslu“,
kterému se v podobě genomiky a testování s jejím využitím otevírá široké pole působení, jež ovšem také nebude bez nákladů.
Třetím faktorem bude tedy ochota pojišťoven tento trend podporovat.
Budou na to mít?
Dalším faktorem bude vzdělání, přístup a motivace lékařů,
neboť rozhodovací proces nebude ovlivněn ani tak epidemiologickými statistikami jako spíše „šitím na míru“; nepůjde tedy o „guideliny“ a diagnózy, ale spíše o kazuistiky.
V neposlední řadě to budou především pacienti,
kteří pod vlivem nové osvěty budou těmi, kdo rozvoj personalizované medicíny svými požadavky buď urychlí, nebo naopak zpomalí.
Prof. MUDr. Cyril Höschl, DrSc., FRCPsych.
Psychiatrické centrum Praha
Ústavní 91
181 03 Praha 8
E-mail: hoschl@pcp.lf3.cuni.cz
Zdroje
1. Höschl, C. First-generation antipsychotics. In: Stolerman I.P. (ed.), Encyclopaedia of Psychopharmacology. Berlin-Heidelberg: Springer-Verlag, 2010.
2. Burns, M.J. The pharmacology and toxicology of atypical antipsychotic agents. J. Toxicol. Clin. Toxicol. 2001, 39(1), p. 1-14.
3. Horáček, J. a kol. Psychotické stavy v klinické praxi. Praha: Amepra, 2003.
4. Weiden, P.J. Switching antipsychotics as a treatment strategy for antipsychotic-induced weight gain and dyslipidemia. J. Clin. Psychiatry 2007, 68, Suppl 4, p. 34-39.
5. Bareš, M., Brunovský, M., Kopeček, M et al. Changes in QEEG prefrontal cordance as a predictor of response to antidepressants in patients with treatment resistant depressive disorder: A pilot study. J. Psych. Res. 2007, 41(3-4), p. 319-325.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2010 Číslo 8- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
-
Evoluce a evoluční teorie pro lékaře
VIII. Evoluce lidského mozku - Zinek a jeho vztah k nádorům prostaty
-
Jak lze úspěšně sledovat odbornou kvalitu zdravotní péče
Příklad dobré praxe z Dánska - Rodinný pečující o osobu postiženou demencí
- Pohybové aktivity jako součást prevence kardiovaskulárních onemocnění v ordinaci praktického lékaře
- Výskyt symptomů a rizikových faktorů syndromu obstrukční spánkové apnoe u pacientů vyšetřených pro srdeční arytmie pomocí Holterovy monitorace EKG
- Biomonitoring – význam a použití pro hodnocení expozice populace chemickým (toxickým) látkám z prostředí
- Arytmie u osôb s metabolickým syndrómom a kritickou končatinovou ischémiou
- Prevence relapsu při léčbě návykových nemocí
- Spontánní intrakraniální hypotenze
- Karcinom pankreatu: Molekulární biologie a časná diagnostika
-
Miniportréty slavných českých lékařů
Profesor Pavel Jedlička – neurolog - Zaklepat to na dřevo
-
XXI. kongres
České lékařské společnosti J.E. Purkyně
Personalizovaná medicína - Nastal čas uplatnění personalizované medicíny v psychiatrii?
- Roche a IBM spolupracují na vývoji technologie sekvenování DNA
- Nový předtěhotenský test a snižuje náklady na zdravotní péči
- JUBILEA
-
Evoluce a evoluční teorie pro lékaře
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Spontánní intrakraniální hypotenze
- Zinek a jeho vztah k nádorům prostaty
- Biomonitoring – význam a použití pro hodnocení expozice populace chemickým (toxickým) látkám z prostředí
-
Miniportréty slavných českých lékařů
Profesor Pavel Jedlička – neurolog
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



