-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Skvamocelulárny karcinóm rekta u mladej ženy
Squamous cell rectal cancer in a young woman
Background: Rectal squamous cell carcinoma (RSCC) belongs to rare gastrointestinal malignancies. There are no consensus recommendations for the treatment of non-metastatic RSCC, which can cause problems when considering optimal therapy.
Purpose: The objective of this report is to point out that RSCC is a rare disease which needs to be distinguished from anal squamous cell cancer (ASCC) and the treatment of which differs from that of rectal adenocarcinoma.
Case report: We discuss the diagnosis and therapy of a patient with non-metastatic RSCC. A forty-two-year-old woman with a history of diarrhea and rectal bleeding was diagnosed for RSCC with locoregional lymphadenopathy, stage T3N1MO. Protective sigmostomy was performed for stenotizing tumor; then the patient underwent chemoradiotherapy with the effect of complete response in MR scans. Subsequently, the patient underwent rectal resection according to Dixon with histological confirmation of complete tumor regression and without detection of residual tumor in the rectum.
Conclusion: It can be sometimes difficult to distinguish primary RSCC from ASCC. Nowadays, there is no standardized staging system for RSCC, and it causes problems in comparative studies as well as in the determination of treatment protocols. The backbone of RSCC treatment is chemoradiotherapy.
Keywords:
squamous cell – rectal cancer – radiotherapy – Chemotherapy – tumor staging
Autoři: Novisedláková Mária 1; Danihel Udovít ml. 2; Oravský Milan 2; Kukučka Martin 2; Schnorrer Milan 2
Působiště autorů: Oddelenie klinickej onkológie, UNsP Milosrdní Bratia, Bratislava, Slovenská republika 1; III. chirurgická klinika LF UK a UNsP Milosrdní Bratia, Bratislava, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2021; 34(1): 62-68
Kategorie: Kazuistika
doi: https://doi.org/10.48095/ccko202162Souhrn
Východiská: Skvamocelulárny karcinóm rekta (rectal squamous cell carcinoma – RSCC) patrí medzi zriedkavé malignity gastrointestinálneho traktu. Neexistujú žiadne konsenzuálne odporúčania pre liečbu nemetastatického RSCC, čo môže spôsobovať problémy pri zvažovaní optimálnej terapie.
Cieľ: Cieľom tejto práce je poukázať na to, že RSCC je raritné ochorenie, ktoré je potrebné odlíšiť od skvamocelulárneho karcinómu anu (ASCC), a liečba ktorého sa líši od liečby adenokarcinómu rekta.
Kazuistika: V tomto článku diskutujeme diagnózu a liečbu pacientky s nemetastatickým RSCC. Štyridsaťdvaročnej pacientke s anamnézou hnačiek a proktorágie bol diagnostikovaný RSCC s lokoregionálnou lymfadenopatiou, štádium T3N1MO. Vzhľadom na stenotizujúci tumor bola realizovaná protektívna sigmostómia, pacientka absolvovala chemorádioterapiu, s kompletnou odpoveďou po liečbe verifikovanou MR vyšetrením. Následne pacientka absolvovala resekciu rekta podľa Dixona s histologickým potvrdením kompletnej regresie tumoru bez detekcie zvyškov tumoróznej masy v oblasti rekta.
Záver: Primárny RSCC môže byť niekedy ťažké odlíšiť od ASCC. V súčasnosti nie je štandardizovaný stagingový systém pre RSCC, čo spôsobuje ťažkosti v komparatívnych štúdiach a pri stanovení systematizovaných liečebných protokolov. Základom liečby RSCC je chemorádioterapia.
Klíčová slova:
skvamocelulárny – karcinom rekta – rádioterapia – chemoterapia – štádium nádoru
Úvod
Skvamocelulárny karcinóm rekta (rectal squamous cell carcinoma – RSCC) patrí medzi zriedkavé malignity gastrointestinálneho traktu (GIT) [1]. Skvamocelulárny karcinóm GIT-u sa najčastejšie vyskytuje v pažeráku alebo análnom kanále, štúdie ukazujú < 1% incidenciu v rekte [2,3].
Adenokarcinómy tvoria 95–97 % všetkých malígnych tumorov kolorekta, zostávajúcich 3–5 % patrí medzi raritné tumory. Raritné tumory hrubého čreva môžeme rozdeliť do dvoch skupín: 1. tumory s incidenciou 0,1–2 %: karcinoidy (neuroendokrinné tumory) 1,8 %, primárne lymfómy 0,1–1%, GIST-y 0,9 %, melanómy 0,5–1 % a SCC > 0,1 % (okrem anu); 2. tumory s incidenciou < 0,1%: teratómy, plazmocytóm, schwannómy a metastatické tumory. Ročné percentuálne zmeny v incidencii každého raritného tumoru stúpajú počas 10 rokov s výnimkou SCC [3–5]. Prvýkrát skvamocelulárny karcinóm hrubého čreva popísali Schmidtmann et al v r. 1919 a to v céku [6]; to isté ochorenie v rekte popísal v r. 1933 Reiford [18]. RSCC sa najčastejšie vyskytuje v 6. dekáde života, a častejšie u žien [4].
V r. 1979 Williams et al navrhli kritéria, ktoré sú bežne akceptované pre diagnózu primárneho RSCC:
- musia byť vylúčené metastázy z iných miest;
- fistula so skvamocelulárnou výstelkou nesmie zahŕňať afektované črevo;
- musí byť vylúčený skvamocelulárny karcinóm anu (anal squamous cell carcinoma – ASCC) anu [7,8].
Etiológia kolorektálneho SCC je stále nejasná; avšak kľúčovú úlohu môže zohrávať chronický zápal (infekčný alebo autoimunitný). Niektorí popisujú spojenie medzi SCC a zápalovým ochorením hrubého čreva, HPV infekciou, parazitárnou infekciou, predchádzajúcou radiáciou a imunosupresiou (AIDS) [7,9,10].
Analýza Surveillance, Epidemiology, and End Results (SEER) ukázala, že SCC majú priaznivú prognózu porovnateľnú s adenokarcinómami rekta [2,11]. Kým malé neinvazívne tumory rekta môžu byť riešené iba chirurgicky, pokročilejšie rektálne tumory majú benefit z ďalšej intervencie, zahrňujúc chemoterapiu a/alebo rádioterapiu [2,12].
V súčasnosti neexistujú žiadne konsenzuálne odporúčania pre liečbu nemetastatického RSCC, čo môže spôsobiť problémy pri rozhodovaní sa o optimálnej terapii, ktorá sa môže líšiť od liečby adenokarcinómu rekta [2,13].
Takisto nie je úplne jednoznačné, či stagingový systém pre RSCC by mal byť založený na veľkosti, ako pre ASCC, alebo na hĺbke invázie, ak pre rektálny adenokarcinóm.
Primárny RSCC môže byť niekedy ťažké odlíšiť od ASCC.
Štandardom starostlivosti u lokoregionálnych ASCC je kombinovaná chemorádioterapia bez plánovanej chirurgie [2,14].
Otázne je, či by pacienti s lokálne pokročilým RSCC mali po chemorádioterapii podstúpiť aj definitívny operačný zákrok.
Kazuistika
Štyridsaťdvaročná pacientka bez komorbidít so 6-mesačnou anamnézou hnačiek a krvácania z konečníka absolvovala kolonoskopické vyšetrenie s nálezom cirkulárneho tumoru rektosigmy stenotizujúceho lumen, histologicky bol potvrdený skvamocelulárny karcinóm (SCC) rektosigmy, G2, Ki67 40 %. Doplnené bolo stagingové CT vyšetrenie so záverom: tumor rektosigmy s lokoregionálnou lymfadenopatiou, bez nálezu vzdialených metastáz; a magnetická rezonancia malej panvy (MR MP) k presnému lokálnemu stagingu s objektivizáciou cirkulárneho stenotizujúceho tumoru rekta postihujúceho strednú a čiastočne hornú tretinu, s nálezom metastaticky zmenenej mezorektálnej lymfatickej uzliny, s tesným kontaktom línie mezorektálnej fascie, bez evidentných známok infiltrácie tumoru do okolitých orgánov, s tesným vzťahom tumoru medzi zadnou kontúrou zadnej vaginálnej klenby až cervixu maternice. Doplnené onkogynekologické vyšetrenie prerastanie tumoru do krčka maternice vylúčilo. Laboratórne OM Ca 72-4, SCCA, CEA a CA 19-9 boli v norme.
Definitívny diagnostický záver u pacientky bol: SCC strednej a hornej tretiny rekta, stenotizujúci, s lokoregionálnou lymfadenopatiou, štádium T3N1MO, štádium IIIA (TNM – ASCC), štádium IIIB (AJCC – rectum). Vzhľadom na stenotizujúci tumor bola u pacientky pred zahájením liečby realizovaná protektívna sigmostómia. Následne pacientka absolvovala externú rádioterapiu na oblasť malej panvy 25×1,8 Gy, v TD 45,0 Gy + boost s konkomitantnou chemoterapiou Mitomycin C 10 mg/m2 D1, D29 + kapecitabín 825 mg/m2 2× denne v dni rádioterapie. Šesť týždňov po ukončení chemorádioterapie absolvovala kontrolnú MR MP, ktorá bola bez znakov viability nádorového postihnutia a ktorá potvrdila kompletnú regresiu tumoru rekta po chemorádioterapii. CT vyšetrenie bolo bez vzdialených metastáz. Nasledoval pohovor s pacientkou o ďalšom terapeutickom postupe, bola poučená o možnostiach, to znamená, že na základe histologického typu nádoru nie je nevyhnutný definitívny chirurgický výkon, môže byť observovaná a sigmostómia môže byť zanorená, eventuálne môže absolvovať definitívny operačný zákrok s resekciou tumoru, vzhľadom na výšku procesu by sa u pacientky zachovala kontinencia. Pacientka sa rozhodla pre definitívny operačný zákrok. Realizovaná bola operácia podľa Dixona, výsledok pooperačného histologického vyšetrenia potvrdil kompletnú regresiu tumoru bez detekcie zvyškov tumoróznej masy z oblasti rekta, v kompletne spracovanom perikolickom tuku bolo zachytených 49 lymfatických uzlín bez nálezu metastázy: tumor regression grading systems (TRG): TRG 0 (žiadne viabilné nádorové bunky). Staging: ypT0NXMX L0V0R0Pn0.
V súčasnosti je pacientka observovaná 40 mesiacov bez známok recidívy malígneho ochorenia pri kolonoskopii, ako aj v zobrazovacích vyšetreniach. MR MP pred a po chemorádioterapii je na obr. 1.
Obr. 1. Magnetická rezonancia malej panvy pred a po chemorádioterapii. 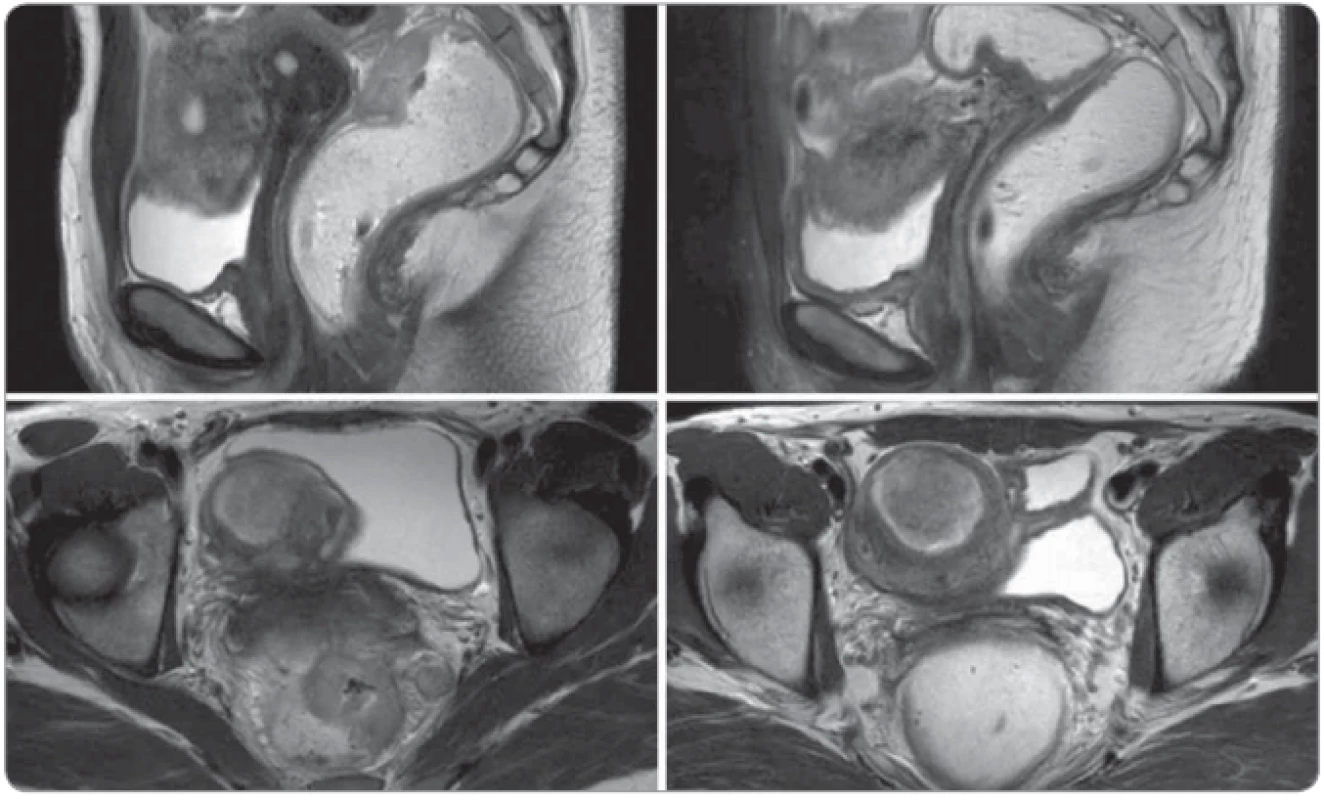
Diskusia
Skvamocelulárne karcinómy rekta (RSCC) sú raritné, je nejasné ako stupeň odpovede na chemorádioterapiu zlepšuje výsledky ich liečby. Kulaylat et al v retrospektívnej štúdii porovnávali štádiovo špecifické prežívanie pre skvamocelulárny karcinóm anu (ASCC) a RSCC na základe terapeutického prístupu. Zistili, že RSCC sú spojené so signifikantne horším prežívaním ako ASCC v klinických štádiach I a II ochorenia. RSCC môžu byť menej radiosenzitívne ako ASCC, čo predpokladajú na základe vyššej incidencie záchrannej (salvage) chirugie, ktorá ale, zdá sa, signifikantne nezlepšuje celkové prežívanie [15].
Leeds et al v komentári k tejto štúdii vyzdvihli, že použili jeden z najrozsiahlejších zdrojov dostupných dát, aby popísali patologické odlišnosti týchto dvoch entít. Autori tiež citovali, že nedostatočnosť Williamsových kritérií zhoršuje schopnosť rozlíšiť proximálny invazívny ASCC od primárneho RSCC [16]. Táto strata rozlíšenia môže limitovať konzervatívne tvrdenia týkajúce sa radiosenzitivity a potencionálne rozdielnych úloh chirurgie [16].
Goffredo et al sa v populačnej štúdii, v ktorej analyzovali údaje zo SEER databázy u pacientov diagnostikovaných v rokoch 1988–2013, snažil určiť optimálny manažment, prognostické faktory a stagingový systém pre RSCC. Vychádzal z toho, že nie je známe, či stagingový systém pre RSCC by mal byť založený na veľkosti, ako pre ASCC, alebo na hĺbke invázie, ako pre adenokarcinóm rekta. Limitom štúdie bol nedostatok údajov o chemoterapii a lokalizácii pozitívnych lymfatických uzlín. Záverom tejto štúdie bolo, že pridanie lokálnej excízie alebo radikálneho chirurgického výkonu k liečbe založenej na rádioterapii, nie je spojené so zlepšením celkového prežívania [17]. Preto v optimálnom manažmente RSCC by mala byť primárne zvažovaná rádioterapia. Ukázala tiež, že stagingový systém American Joint Committee on Cancer (AJCC) – anus, 7th edition, založený na veľkosti (ako pre ASCC), sa zdá byť presnejší v predikovaní prognózy ako stagingový systém AJCC – rectum založený na hĺbke invázie ako pre rektálny adenokarcinóm [17].
Guerra et al v systematickom prehľade spracoval dáta týkajúce sa pacientov s primárnym RSCC z dostupných relevantných článkov, prehľadov a prípadových štúdií v rokoch 1946–2015, v ktorom okrem iného analyzoval aj spôsob akým boli pacienti liečení (tab. 1, 2) [1].
Tab. 1. Konvenčná liečba primárneho skvamocelulárneho rektálneho karcinómu. Upravené podľa [1]. ![Konvenčná liečba primárneho skvamocelulárneho rektálneho karcinómu. Upravené podľa [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6d6e9ded481200eb7ca432a1416943ab.png)
1 nezahrnuté do analýzy ako odmietnutá liečba, 2 nezahrnuté do analýzy, pretože nebol zaznamenaný žiadny relevantný údaj ANED – nažive, žiadny dôkaz ochorenia (alive, no evidence of disease), APR – abdominoperineálna resekcia, AR – predná resekcia (anterior resection), CTx – chemoterapia, CRTx – chemorádioterapia, H – podľa Hartamnna, LR – lokálna rekurencia, M – metastazy, NR – nezaznamenané (not recorded), PP – perineálna proktektómia, PR – zadná resekcia (posterior resection), RTx – rádioterapia, S – odvádzajúca stómia, TAE – transanálna excízia, TPC – totálna proktokolektómia (total proctocolectomy) Tab. 1 – pokračovanie. Konvenčná liečba primárneho skvamocelulárneho rektálneho karcinómu. Upravené podľa [1]. ![Tab. 1 – pokračovanie. Konvenčná liečba primárneho skvamocelulárneho rektálneho karcinómu. Upravené podľa [1].](https://pl-master.mdcdn.cz/media/image_pdf/4222077aa10376d8e4b50c58915b8979.png?version=1613734541)
1 nezahrnuté do analýzy ako odmietnutá liečba, 2 nezahrnuté do analýzy, pretože nebol zaznamenaný žiadny relevantný údaj ANED – nažive, žiadny dôkaz ochorenia (alive, no evidence of disease), APR – abdominoperineálna resekcia, AR – predná resekcia (anterior resection), CTx – chemoterapia, CRTx – chemorádioterapia, H – podľa Hartamnna, LR – lokálna rekurencia, M – metastazy, NR – nezaznamenané (not recorded), PP – perineálna proktektómia, PR – zadná resekcia (posterior resection), RTx – rádioterapia, S – odvádzajúca stómia, TAE – transanálna excízia, TPC – totálna proktokolektómia (total proctocolectomy) Tab. 2. Chemorádioterapia ako primárna liečba skvamocelulárneho rektálneho karcinómu. Upravené podľa [1]. ![Chemorádioterapia ako primárna liečba skvamocelulárneho rektálneho karcinómu. Upravené podľa [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/58df11c024ce55b4d2511333d38305d9.png)
1 nezahrnuté do analýzy, pretože nebol zaznamenaný žiadny relevantný údaj
ANED – nažive, žiadny dôkaz ochorenia (alive, no evidence of disease), APR – abdominoperineálna resekcia, AR – predná resekcia (anterior resection), CR – kompletná odpoveď (complete response), CTx – chemoterapia, CTx iná – 5FU (n = 3), 5FU/cisplatina (n = 26), kapecitabin/cisplatina (n = 3), kapecitabin (n = 1), raltitrexed/oxaliplatina (n = 2), S1 (n = 3), CRTx – chemorádioterapia, Gy – Gray, H – podľa Hartamnna, LR – lokálna rekurencia, M – metastazy, NR – nezaznamenané (not recorded), Path CR – patolologická kompletná odpoveď (pathological complete response), PE – pelvická exenterácia (pelvic exenteration), PP – perineálna proktektómia, PR – zadná resekcia (posterior resection), RTx – rádioterapia, S – odvádzajúca stómia, TAE – transanálna excízia, TPC – totálna proktokolektómia (total proctocolectomy)Dutta et al hodnotili dáta z National Cancer Database u pacientov s RSCC diagnostikovaných v rokoch 2004–2014, zahrňujúc cT1-4, cN0-2, cM0 tumory (kohorta A, n = 2 296). Subskupinová analýza bola uskutočnená u lokálne pokročilých tumorov (cT1-T2,N+ alebo cT3, akékoľvek N; subkohorta B, n = 883), liečených chemorádioterapiou (n = 706), alebo tromi modalitami (n = 177) zahrňujúcimi chemoterapiu, rádioterapiu a chirurgiu. Hodnotili stupeň kompletnej patologickej odpovede po neoadjuvantnej liečbe, a celkové prežívanie po 5 a 10 rokoch. Desaťročné prežívanie pre štádium I ochorenia bolo 71,3 a 57,8 %, pre štádium II 57,0 a 38,9 % a pre štádium III 57,8 a 41,5 %. Vyššia cT kategória bola spojená s horším prežívaním. U lokálne pokročilých tumorov (subkohorta B), nebol signifikantný rozdiel v prežívaní medzi chemorádioterapiou alebo liečbou všetkými tromi modalitami [2].
Záver
Skvamocelulárny karcinóm rekta patrí medzi zriedkavé malignity gastrointestinálneho traktu.
Neexistujú žiadne konsenzuálne odporúčania pre liečbu nemetastatického RSCC, čo môže spôsobiť problémy pri zvažovaní optimálnej terapie, ktorá sa môže líšiť od liečby adenokarcinómu rekta [2,13]. V súčasnosti nie je štandardizovaný stagingový systém pre RSCC, čo spôsobuje ťažkosti v komparatívnych štúdiach a pri stanovení systematizovaných liečebných protokolov [17]. Základom liečby RSCC je chemorádioterapia. Pridanie lokálnej excízie alebo radikálneho chirurgického výkonu, k liečbe založenej na rádioterapii, nie je spojené so zlepšením celkového prežívania [17].
Sú potrebné ďalšie štúdie k stanoveniu optimálneho terapeutického postupu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Mária Novisedláková
Oddelenie klinickej onkológie
UNsP Milosrdní Bratia
Námestie SNP 1
814 65 Bratislava
Slovenská Republika
e-mail: maria.novisedlakova@gmail.com
Obdŕžané/Submitted: 6. 4. 2020
Prijaté/Accepted: 16. 6. 2020
Zdroje
1. Guerra GR, Kong CH, Warrier SK et al. Primary squamous cell carcinoma of the rectum: An update and implications for treatment. World J Gastrointest Surg 2016; 8 (3): 252–265. doi: 10.4240/wjgs.v8.i3.252.
2. Dutta SW, Alonso CE, Waddle MR et al. Squamous cell carcinoma of the rectum: Practice trends and patient survival. Cancer Med 2018; 7 (12): 6093–6103. doi: 10.1002/cam4.1893.
3. Kang H, O’Connell JB, Leonardi MJ et al. Rare tumors of the colon and rectum: a national review. Int J Colorectal Dis 2007; 22 (2): 183–189. doi: 10.1007/s00384-006 - 0145-2.
4. Stanojević G, Kripokapič Z. Rare tumors of the colon and rectum. Colorectal cancer – surgery, diagnostics and treatment 2014 : 254–267. doi: 10.5772/56937.
5. Gordon Ph. Malignant neoplasms of the colon. In: Gordon Ph, Nivatvongs S (eds). Principles and practice of the surgery for the colon rectum and anus. New York: CRC Press 2007 : 489–645.
6. Schmidtmann M. Zur Kenntnis seltner Krebsformen. Virchow Arch (A) 1919; 226 : 100–118.
7. Kiyani A, Coyle WJ, Bao F. A rare case of primary rectal squamous cell carcinoma diagnosed by endoscopic ultrasound. J Gastrointest Oncol 2017; 8 (4): 56–59. doi: 10.21037/jgo.2017.06.04.
8. Williams GT, Blackshaw AJ, Morson BC. Squamous carcinoma of the colorectum and its genesis. J Pathol 1979; 129 (3): 139–147. doi: 10.1002/path.1711290306.
9. Zirkin RM, Mccord DL. Squamous cell carcinoma of the rectum: report of a case complicating chronic ulcerative colitis. Dis Colon Rectum 1963; 6 : 370–373. doi: 10.1007/BF02618400.
10. Nahas CS, Shia J, Joseph R et al. Squamous-cell carcinoma of the rectum: a rare but curable tumor. Dis Colon Rectum 2007; 50 : 1393–1400. doi: 10.1007/s10350-007-0256-z.
11. Chiu MS, Verma V, Bennion NR et al. Comparison of outcomes between rectal squamous cell carcinoma and adenocarcinoma. Cancer Med 2016; 5 (12): 3394–3402. doi: 10.1002/cam4.927.
12. Glimelius B, Tiret E, Cervantes A et al. Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and followup. Ann Oncol 2013; 24 (suppl 6): vi81–vi88. doi: 10.1093/annonc/mdt240.
13. National Comprehensive Cancer Network. Rectal cancer (version 1.2018). [online]. Available from: https: //www.nccn.org/professionals/physician_gls/pdf/ rectal.pdf.
14. Nigro ND, Seydel HG, Considine B et al. Combined preoperative radiation and chemotherapy for squamous cell carcinoma of the anal canal. Cancer 1983; 51 (10): 1826–1829. doi: 10.1002/1097-0142 (19830515) 51 : 10<1826:: aid-cncr2820511012>3.0.co; 2 - l.
15. Kulaylat AS, Hollenbeak CS, Stewart DB Sr. Squamous cancers of the rectum demonstrate poorer survival and increased need for salvage surgery compared with squamous cancers of the anus. Dis Colon Rectum 2017; 60 (9): 922–927. doi: 10.1097/DCR.0000000000000 881.
16. Leeds IL, Griffin JF, Fang SH. Distinguishing anal squamous cell carcinoma and rectal squamous cell carcinoma in secondary data sets. Dis Colon Rectum 2018; 61 (3): e19. doi: 10.1097/DCR.0000000000001015.
17. Goffredo P, Robinson TJ, Frakes JM. Comparison of anal versus rectal staging in the prognostication of rectal squamous cell carcinoma: a population-based analysis. Dis Colon Rectum 2019; 62 (3): 302–308. doi: 10.1097/DCR.0000000000001205.
18. Raiford T. Epithelioma of the lower rectum and anus. Surg Gynaecol Obstet 1933; 57 : 21–35. doi: 10.1080/00325481.1950.11693937.
19. Catell RB, Williams AG. Epidermoid carcinoma of the anus and rectum. Arch Surg 1943; 46 (3): 336–349. doi: 10.1001/archsurg.1943.01220090031003.
20. LeBlanc LJ, Buie LA, Dockerty MB. Squamous-cell epithelioma of the rectum. Ann Surg 1950; 131 (3): 392–399. doi: 10.1097/00000658-195003000-00010.
21. O’Brien JP, Meehan DJ. Squamous cell carcinoma of the rectum. Ann Surg 1951; 133 (2): 283–285.
22. Kron SD, Wurzel HA, Chodoff RJ. Squamous cell carcinoma of the rectum. Gastroenterology 1951; 17 : 194–197.
23. Dixon CF, Dockerty MB, Powelson MH. Squamous cell carcinoma of the midrectum: report of case. Proc Staff Meet Mayo Clin 1954; 29 (15): 420–423.
24. Burns FJ. Squamous cell carcinoma of the rectum. Mo Med 1955; 52 (1): 31.
25. Wiener MF, Polayes SH, Yidi R. Squamous carcinoma with schistosomiasis of the colon. Am J Gastroenterol 1962; 37 : 48–54.
26. Hohm WH, Jackman RJ. Squamous cell carcinoma of the rectum complicating ulcerative colitis: report of two cases. Mayo Clin Proc 1964; 39 : 249–251.
27. Angelchik JP, Epstein J. Squamous cell carcinoma of the upper rectum. Ariz Med 1967; 24 (1): 19–21.
28. Cabrera A, Pickren JW. Squamous metaplasia and squamous-cell carcinoma of the rectosigmoid. Dis Colon Rectum 1967; 10 (4): 288–297. doi: 10.1007/BF02617 142.
29. Minkowitz S. Primary squamous cell carcinoma of the rectosigmoid portion of the colon. Arch Pathol 1967; 84 (1): 77–80.
30. Higton DI. Squamous cell carcinoma of rectum. Proc R Soc Med 1970; 63 (8): 754.
31. Comer TP, Beahrs OH, Dockerty MB. Primary squamous cell carcinoma and adenocanthoma of the colon. Cancer 1971; 28 : 1111–1117.
32. Vezeridis MP, Herrera LO, Lopez GE et al. Squamous-cell carcinoma of the colon and rectum. Dis Colon Rectum 1983; 26 (3): 188–191. doi: 10.1007/BF02560169.
33. Lafreniere R, Ketcham AS. Primary squamous carcinoma of the rectum. Report of a case and review of the literature. Dis Colon Rectum 1985; 28 (12): 967–972. doi: 10.1007/BF02554319.
34. Pigott JP, Williams GB. Primary squamous cell carcinoma of the colorectum: case report and literature review of a rare entity. J Surg Oncol 1987; 35 (2): 117–119. doi: 10.1002/jso.2930350211.
35. Woods WG. Squamous cell carcinoma of the rectum arising in an area of squamous metaplasia. Eur J Surg Oncol 1987; 13 (5): 455–458.
36. Prener A, Nielsen K. Primary squamous cell carcinoma of the rectum in Denmark. APMIS 1988; 96 (9): 839–844. doi: 10.1111/j.1699-0463.1988.tb00951.x.
37. Schneider TA, Birkett DH, Vernava AM. Primary adenosquamous and squamous cell carcinoma of the colon and rectum. Int J Colorectal Dis 1992; 7 (3): 144–147. doi: 10.1007/BF00360355.
38. Fazzi U, Anderson JR. Squamous carcinoma of the rectum. Br J Clin Pract 1994; 48 (2): 106–107. doi: 10.4240/wjgs.v8.i3.252.
39. Copur S, Ledakis P, Novinski D et al. Squamous cell carcinoma of the colon with an elevated serum squamous cell carcinoma antigen responding to combination chemotherapy. Clin Colorectal Cancer 2001; 1 (1): 55–58. doi: 10.3816/CCC.2001.n.006.
40. Frizelle FA, Hobday KS, Batts KP et al. Adenosquamous and squamous carcinoma of the colon and upper rectum: a clinical and histopathologic study. Dis Colon Rectum 2001; 44 (3): 341–346. doi: 10.1007/BF02234730.
41. Sotlar K, Köveker G, Aepinus C et al. Human papillomavirus type 16-associated primary squamous cell carcinoma of the rectum. Gastroenterology 2001; 120 (4): 988–994. doi: 10.1053/gast.2001.22523.
42. Gelas T, Peyrat P, Francois Y et al. Primary squamous-cell carcinoma of the rectum: report of six cases and review of the literature. Dis Colon Rectum 2002; 45 (11): 1535–1540. doi: 10.1007/s10350-004-6462-z.
43. Anagnostopoulos G, Sakorafas GH, Kostopoulos P et al. Squamous cell carcinoma of the rectum: a case report and review of the literature. Eur J Cancer Care (Engl) 2005; 14 (1): 70–74. doi: 10.1111/j.1365-2354.2005.00523.x.
44. Fahim F, Al-Salamah SM, Alam MK et al. Squamous cell carcinoma of colon and rectum. Saudi Med J 2006; 27 (6): 874–877.
45. Lam AK, Ho YH. Primary squamous cell carcinoma of the rectum in a patient on immunosuppressive therapy. Pathology 2006; 38 (1): 74–76. doi: 10.1080/00313020500467113.
46. Cheng H, Sitrin MD, Satchidanand SK et al. Colonic squamous cell carcinoma in ulcerative colitis: report of a case and review of the literature. Can J Gastroenterol 2007; 21 (1): 47–50. doi: 10.1155/2007/904081.
47. Kong CS, Welton ML, Longacre TA. Role of human papillomavirus in squamous cell metaplasia-dysplasia-carcinoma of the rectum. Am J Surg Pathol 2007; 31 (6): 919–925. doi: 10.1097/01.pas.0000213441.86030.fc.
48. Leung KK, Heitzman J, Madan A. Squamous cell carcinoma of the rectum 21 years after radiotherapy for cervical carcinoma. Saudi J Gastroenterol 2009; 15 (3): 196–198. doi: 10.4103/1319-3767.54745.
49. Dzeletovic I, Pasha S, Leighton JA. Human papillomavirus-related rectal squamous cell carcinoma in a patient with ulcerative colitis diagnosed on narrow-band imaging. Clin Gastroenterol Hepatol 2010; 8 (5): e47–e48. doi: 10.1016/j.cgh.2009.10.019.
50. Sameer AS, Syeed N, Chowdri NA et al. Squamous cell carcinoma of rectum presenting in a man: a case report. J Med Case Rep 2010; 4 : 392. doi: 10.1186/1752-1947-4-392.
51. Wang ML, Heriot A, Leong T et al. Chemoradiotherapy in the management of primary squamous-cell carcinoma of the rectum. Colorectal Dis 2011; 13 (3): 296–301. doi: 10.1111/j.1463-1318.2009.02154.x.
52. Sanal SM, Sivrikoz ON, Karapolat I et al. Complete clinical response in squamous cell carcinoma of the rectum with liver metastases. J Clin Oncol 2011; 29 (33): e806–e808. doi: 10.1200/JCO.2011.36.7292.
53. Yeh J, Hastings J, Rao A et al. Squamous cell carcinoma of the rectum: a single institution experience. Tech Coloproctol 2012; 16 (5): 349–354. doi: 10.1007/s10151-012-0848-z.
54. Faidzal O, Azmi MN, Kalavathi R. Primary squamous cell carcinoma of the rectum: a case report. IMJM 2013; 12 : 87. doi: 10.3402/jchimp.v6.31708.
55. Wang JF, Wang ZX, Xu XX et al. Primary rectal squamous cell carcinoma treated with surgery and radiotherapy. World J Gastroenterol 2014; 20 (14): 4106–4109. doi: 10.3748/wjg.v20.i14.4106.
56. Scaringi S, Bisogni D, Messerini L et al. Squamous cell carcinoma of the middle rectum: report of a case and literature overview. Int J Surg Case Rep 2015; 7C: 127–129. doi: 10.1016/j.ijscr.2014.10.097.
57. Ozuner G, Aytac E, Gorgun E et al. Colorectal squamous cell carcinoma: a rare tumor with poor prognosis. Int J Colorectal Dis 2015; 30 (1): 127–130. doi: 10.1007/s00384-014-2058-9.
58. Péron J, Bylicki O, Laude C et al. Nonoperative management of squamous-cell carcinoma of the rectum. Dis Colon Rectum 2015; 58 (1): 60–64. doi: 10.1097/DCR.000 0000000000218.
59. Schneider TA, Birkett DH, Vernava AM. Primary adenosquamous and squamous cell carcinoma of the colon and rectum. Int J Colorectal Dis 1992; 7 (3): 144–147. doi: 10.1007/BF00360355.
60. Kulaylat MN, Doerr R, Butler B et al. Squamous cell carcinoma complicating idiopathic inflammatory bowel disease. J Surg Oncol 1995; 59 (1): 48–55. doi: 10.1002/jso.2930590113.
61. Martinez-Gonzalez MD, Takahashi T, Leon-Rodriguez E et al. Case report of primary squamous carcinoma of the rectum. Rev Invest Clin 1996; 48 (6): 453–456.
62. Theodosopoulos TK, Marinis AD, Dafnios NA et al. Aggressive treatment of metastatic squamous cell carcinoma of the rectum to the liver: a case report and a brief review of the literature. World J Surg Oncol 2006; 4 : 49. doi: 10.1186/1477-7819-4-49.
63. Pikarsky AJ, Belin B, Efron J et al. Squamous cell carcinoma of the rectum in ulcerative colitis: case report and review of the literature. Int J Colorectal Dis 2007; 22 (4): 445–447. doi: 10.1007/s00384-006-0110-0.
64. Clark J, Cleator S, Goldin R et al. Treatment of primary rectal squamous cell carcinoma by primary chemoradiotherapy: should surgery still be considered a standard of care. Eur J Cancer 2008; 44 (16): 2340–2343. doi: 10.1016/j.ejca.2008.07.004.
65. Matsuda A, Takahashi K, Yamaguchi T et al. HPV infection in an HIV-positive patient with primary squamous cell carcinoma of rectum. Int J Clin Oncol 2009; 14 (6): 551–554. doi: 10.1007/s10147-009-0890-7.
66. Brammer RD, Taniere P, Radley S. Metachronous squamous-cell carcinoma of the colon and treatment of rectal squamous carcinoma with chemoradiotherapy. Colorectal Dis 2009; 11 (2): 219–220. doi: 10.1111/j.1463-1318.2008.01577.x.
67. Rasheed S, Yap T, Zia A et al. Chemo-radiotherapy: an alternative to surgery for squamous cell carcinoma of the rectum-report of six patients and literature review. Colorectal Dis 2009; 11 (2): 191–197. doi: 10.1111/j.1463-1318.2008.01560.x.
68. Al Hallak MN, Hage-Nassar G, Mouchli A. Primary submucosal squamous cell carcinoma of the rectum diagnosed by endoscopic ultrasound: case report and literature review. Case Rep Gastroenterol 2010; 4 (2): 243–249. doi: 10.1159/000319013.
69. Tronconi MC, Carnaghi C, Bignardi M et al. Rectal squamous cell carcinoma treated with chemoradiotherapy: report of six cases. Int J Colorectal Dis 2010; 25 (12): 1435–1439. doi: 10.1007/s00384-010-0988-4.
70. Iannacone E, Dionisi F, Musio D et al. Chemoradiation as definitive treatment for primary squamous cell cancer of the rectum. World J Radiol 2010; 2 (8): 329–333. doi: 10.4329/wjr.v2.i8.329.
71. Jeong BG, Kim DY, Kim SY. Concurrent chemoradiotherapy for squamous cell carcinoma of the rectum. Hepatogastroenterology 2013; 60 (123): 512–516. doi: 10.5754/hge11293.
72. Kassir R, Baccot S, Bouarioua N et al. Squamous cell carcinoma of middle rectum: literature review. Int J Surg Case Rep 2014; 5 (2): 86–90. doi: 10.1016/j.ijscr.2013.12. 011.
73. Ferreira AO, Loureiro AL, Marques V et al. Primary squamous cell carcinoma of the most distal rectum: a dilemma in origin and management. BMJ Case Rep 2014; 2014: bcr2013201156. doi: 10.1136/bcr-2013-201 156.
74. Choi H, Lee HW, Ann HW et al. A case of rectal squamous cell carcinoma with metachronous diffuse large B cell lymphoma in an HIV-infected patient. Infect Chemother 2014; 46 (4): 257–260. doi: 10.3947/ic.2014.46.4.257.
75. Musio D, De Felice F, Manfrida S et al. Squamous cell carcinoma of the rectum: the treatment paradigm. Eur J Surg Oncol 2015; 41 (8): 1054–1058. doi: 10.1016/j.ejso.2015.03.239.
76. Funahashi K, Nemoto T, Koike J et al. Chemoradiation therapy with S-1 for primary squamous cell carcinoma of the rectum: report of three cases. Surgical Case Reports 2015; 1 (1): 1–7. doi: 10.1186/s40792-015-0025-5.
77. Seshadri RA, Pancholi M, Jayanand SB et al. Squamous cell carcinoma of the rectum: is chemoradiation sufficient. J Cancer Res Ther 2015; 11 (3): 664. doi: 10.4103/0973-1482.143350.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tiskuČlánek Zemřela Mgr. Jana Drexlerová
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Rehabilitácia pri rakovine prsníka
- Vznik a význam sekvenčních variant mikroRNA v kancerogenezi
- Zárodečné mutace v genech RAD51C a RAD51D a dědičná predispozice ke vzniku karcinomu ovaria
- Patnáct let Národního onkologického programu České republiky a jeho vliv na výsledky u solidních nádorů dospělých v přehledu a číslech
- Droplet digitálna PCR ako nový diagnostický nástroj
- Odkládání návštěvy lékaře při podezření na karcinom prsu u žen v České republice
- Patologická odpoveď a klinické výsledky při léčbě operabilního triple negativního karcinomu prsu cisplatinou přidanou k standardní neoadjuvantní chemoterapii
- Pretrvávajúca elevácia alfa-fetoproteínu u pacienta po liečbe nádoru semenníka
- Pembrolizumab v 1. linii terapie generalizovaného spinocelulárního karcinomu jícnu
- Skvamocelulárny karcinóm rekta u mladej ženy
- Léčba kastračně rezistentního karcinomu prostaty enzalutamidem trvající 4 roky
- Selhání adjuvantní léčby maligního melanomu – a co dál?
- Aktuality z odborného tisku
- Král Z, Adam Z et al. Histiocytární neoplazie a další vybrané velmi vzácné krevní nemoci.
- Zemřela Mgr. Jana Drexlerová
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rehabilitácia pri rakovine prsníka
- Zárodečné mutace v genech RAD51C a RAD51D a dědičná predispozice ke vzniku karcinomu ovaria
- Droplet digitálna PCR ako nový diagnostický nástroj
- Skvamocelulárny karcinóm rekta u mladej ženy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



